由于化石燃料的枯竭和对环境问题的关注,生物乙醇和生物丁醇等生物燃料越来越受到关注。作为车用替代燃料,丁醇比乙醇更具有前途,其优点主要包括较低的挥发性、较高的能量含量、较低的腐蚀性以及与汽油柴油等较好的相容性,因此可以不用对现有的发动机结构做出大的改动[1-5]。使用产溶剂梭菌通过工业化规模生产丁醇传统的丙酮-丁醇-乙醇 (acetone-butanol-ethanol, ABE) 发酵工艺可以追溯到19世纪40年代[6-7]。生物丁醇的产业化在技术上还存在瓶颈,原因是其成本较高,不能形成如生物乙醇一样的市场竞争力。目前国内的生物丁醇的生产主要以玉米等粮食作为原料,当前这些原料已被国家政策限制使用,而且原料的成本较高。产溶剂梭菌的ABE发酵其丙酮、丁醇、乙醇的质量比例为3∶6∶1,其中丁醇和乙醇可以作为燃料,而丙酮由于沸点低会对管道和橡胶有腐蚀作用,不适合燃料使用,后期需要进行精馏分离而增加生产成本[8-9]。此外,丁醇具有毒性,产溶剂梭菌不能耐受超过2%的丁醇产量,这大大限制了最终的丁醇产量(<20 g/L) [10-11]。并且,由于丁醇毒性的抑制,发酵终止时产生大量酪醇,难以满足环保需求。此外,产溶剂梭菌是严格厌氧的,因此在操作过程中通常需要昂贵的还原剂和氮气来维持厌氧环境[12-14]。为了提高生物丁醇生产的经济性,研究者们已经探索了各种遗传修饰策略,例如消除副产物形成、负责丁醇合成的关键基因的过度表达等[15]。然而,产溶剂梭菌复杂的调控系统增加了遗传修饰的难度[16]。
最近,一些非产溶剂的微生物,包括模式微生物,如大肠杆菌和酿酒酵母等,以及其他非模式微生物,如短乳杆菌和热解糖高温厌氧菌等,已被探索用于生产生物丁醇[14,17-18]。不同于产溶剂梭菌,这些非产溶剂的微生物作为丁醇生产的宿主展示出一些极具前景的优势,包括对溶剂毒性耐受性强、培养条件简单和基因改造工具成熟[19]。为了更好地了解使用非产溶剂微生物作为宿主生产丁醇的最新技术,这篇综述将全面总结和比较不同微生物宿主的优势。此外,还讨论了利用非产溶剂微生物生产丁醇的最新进展,并提供了一些提高丁醇生产效率的策略。
1 代谢工程改造模式微生物生产丁醇
1.1 大肠杆菌生物合成丁醇
大肠杆菌由于其易于培养和操作、遗传背景清晰等优点,是生物合成化学品的优良底盘菌株,目前已被广泛用于生化产品和生物燃料生产[20-21]。
通常,可以将两种代谢途径引入大肠杆菌用于丁醇生产,包括辅酶A(coenzyme A,CoA) 依赖性途径和氨基酸生物合成途径。氨基酸生物合成途径是一种已经经过充分研究的途径,可以合成更高级别的醇。大肠杆菌可以利用苏氨酸通过氨基酸生物合成途径生产2-酮丁酸,然后将其脱羧为丁醇(图1)[22-23]。该途径可以使用天然氨基酸中间体作为生产丁醇的前体,避免代谢有毒中间体引起的疾病。然而,该途径也会产生大量副产物,例如丙醇,导致丁醇收率降低。因此,在具有氨基酸生物合成途径的重组大肠杆菌中也应消除副产物形成途径。
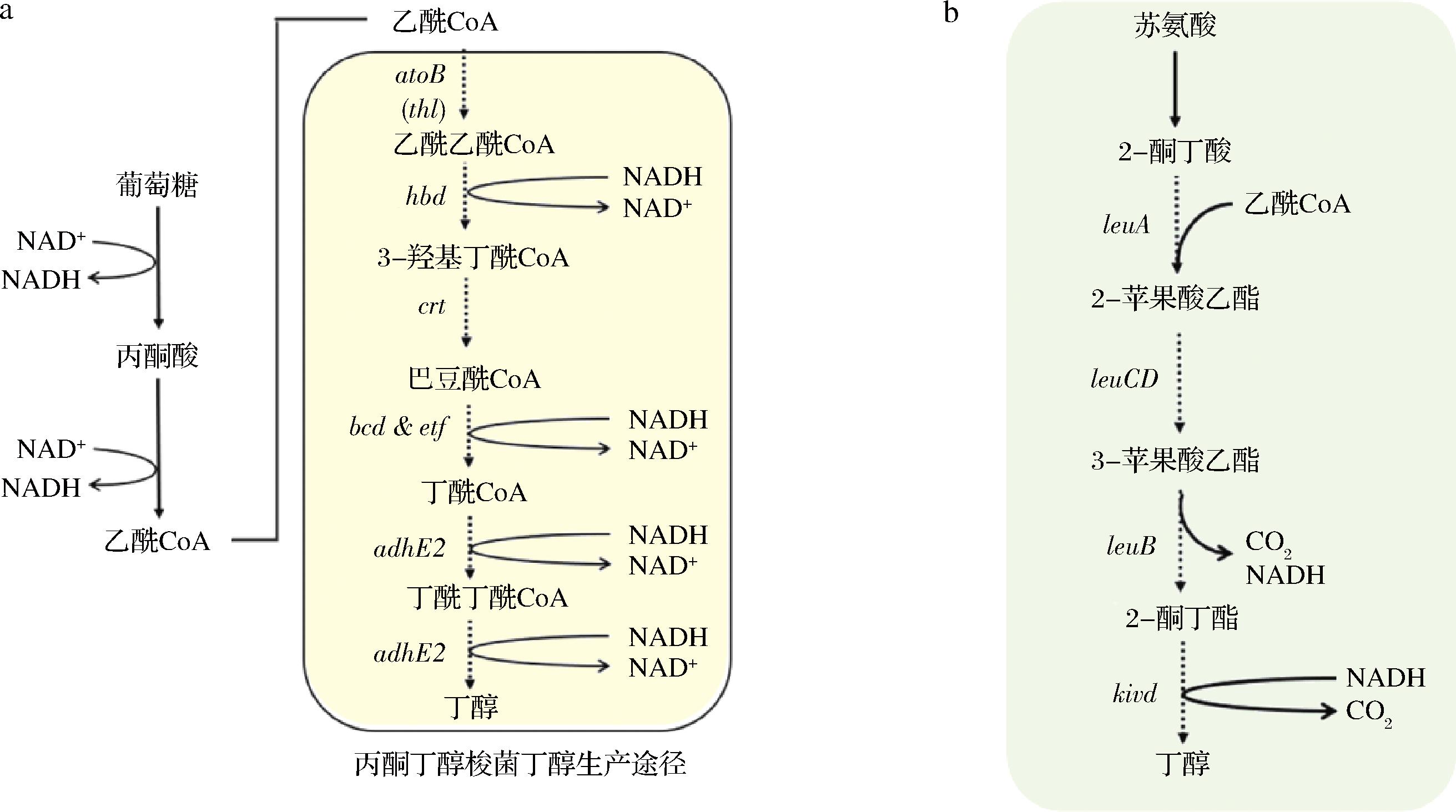
a-CoA依赖途径;b-合成的2-酮酸途径
图1 大肠杆菌用于葡萄糖生产丁醇的代谢途径
Fig.1 Metabolic pathway of Escherichia coli for butanol production from glucose
注:工程涉及丁醇合成模块的引入用虚线表示;atoB:乙酰辅酶A乙酰转移酶、thl-硫解酶、hbd-3-羟基丁酰-CoA、crt-巴豆酶、bcd-丁酰-CoA脱氢酶、etf-电子转移黄素蛋白、adhE2-醛-醇脱氢酶、leuA-α-异丙基苹果酸合酶、leuCD-异丙基苹果酸异构酶、leuB-β-异丙基苹果酸脱氢酶、kivd-酮异戊酸脱羧酶(下同)。
CoA依赖性途径是大肠杆菌中丁醇生产的第二种常用途径,其存在于天然产溶剂梭菌中[21]。CoA依赖性途径主要由乙酰乙酰CoA、硫解酶(thlA)、醛/醇脱氢酶(adhE)和bcs操纵子组成。通过糖酵解途径获得的乙酰CoA被硫解酶作用生成乙酰乙酰CoA,再经过还原、脱水再还原生成丁酰CoA,最终在醛/醇脱氢酶的催化下生成丁醇。来自糖丁酸梭菌的整个外源性CoA依赖性途径可被引入大肠杆菌,然而,重组大肠杆菌只能产生 67 mg/L 的丁醇。为了进一步提高最终丁醇产量,thlA 可以被来自大肠杆菌的乙酰CoA乙酰转移酶 (atoB) 取代。同时可以消除副产物形成基因,包括乳酸脱氢酶 (ldh)、adhE1 和富马酸还原酶 (frd)。发酵条件优化后,最终丁醇产量可提高至584 mg/L[24]。在类似构建原理的指导下,来自丙酮丁醇梭菌的CoA依赖性途径也被尝试引入大肠杆菌。令人惊讶的是,最终可以获得18.3 g/L的丁醇产量。通过使用重组大肠杆菌,丁醇产量的显著增加表明源自不同菌株的CoA 依赖性途径对于最终的丁醇滴度是必不可少的。为了进一步提高丁醇产量,可以敲除异柠檬酸裂解酶 (aceA) 以减少乙醛酸和乙酸的积累。最后,丁醇收率从0.30 g/g增加到0.37 g/g,几乎达到了最大理论丁醇收率(0.41 g/g)[25]。对于大肠杆菌,如何提高最终丁醇产量可能是下一步重点。众所周知,亲脂性丁醇会溶解细胞膜,而丁醇的毒性会显著影响最终的丁醇生产效率。因此,未来的研究应更多地关注重组大肠杆菌对丁醇耐受性的提高。
为了进一步减少底物成本,其他各种廉价碳资源(如木质纤维素、甘油等)也被用于生物丁醇生产。例如,木质纤维素是一种丰富的可再生资源,主要由纤维素和半纤维素组成,其主要水解为葡萄糖和木糖用于后续微生物发酵。大肠杆菌可以很好地利用葡萄糖,但不能利用木糖。为了实现有效的木糖利用和丁醇生产,ABDELAAL等[26]选择大肠杆菌SSK42作为亲本菌株,将其设计为从木糖生产乙醇,通过遗传构建丙酮酸脱氢酶操纵子启动子,负责副产物产生的基因也被删除,丁醇合成途径(乙酰乙酰CoA还原途径)也通过CRISPR/Cas9 技术整合到大肠杆菌SSK42的基因组中,重组大肠杆菌最终能从木糖中产生 4.32 g/L 的丁醇[26]。此外,当葡萄糖和木糖同时作为碳源时,基因工程大肠杆菌由于碳分解代谢抑制 (carbon catabolic repression, CCR) 无法同时利用它们。为了减少CCR效应,SAINI等 [27]构建了一个通过底物交叉饲喂的微生物共培养体系,该体系由特定的葡萄糖利用菌株和特定的木糖利用菌株组成。该微生物共培养体系可同时有效利用葡萄糖和木糖,最终生产5.2 g/L丁醇,丁醇生产率可达到 0.17 g/(L·h),理论收率为63%。甘油是生物柴油加工过程中的副产物,其产量约占生物柴油质量的10%,因其低廉的价格和可用性也备受关注[28]。然而,自然进化的大肠杆菌在葡萄糖存在的情况下无法利用甘油。大肠杆菌中的甘油代谢通常包括两种途径:第一个由甘油激酶 (glpK) 和甘油3-磷酸脱氢酶 (glpD) 组成。然而,由于glpD 的表达受到其他优选碳源的抑制,因此该途径不能在含葡萄糖的培养基中利用甘油;另一种途径由甘油脱氢酶 (gldA) 和二羟基丙酮激酶 (dhaKLM) 组成。将这种甘油利用途径引入大肠杆菌BuT-14后,可以从葡萄糖和甘油共底物中生产5.0 g/L丁醇。为了进一步增加最终的丁醇产量,消除了丙酮酸甲酸裂解酶 (pflB) 以增加NADH水平。重组菌株最终可以生产6.2 g/L丁醇,转化率和生产率分别为76.5%和0.17 g/(L·h)[22]。此外,还可以设计微生物共培养体系以实现葡萄糖和甘油的同时利用。例如,可以通过删除大肠杆菌菌株BuT-14 中的甘油促进基因 (glpF) 来构建利用葡萄糖的菌株,而利用甘油的菌株可以通过删除大肠杆菌BuT-14G中的葡萄糖激酶基因(glk) 来构建。这种微生物共培养体系可以生产6.2 g/L丁醇,丁醇生产率为 0.15 g/(L·h)[22]。
众所周知,丁酸是ABE发酵过程中的重要中间体,可以被进一步转化为丁醇。因此,补充丁酸可以正向调节细菌生长和丁醇合成[29]。例如,在培养基中加入 10 g/L丁酸钠后,重组大肠杆菌可以产生6.2 g/L丁醇,相比于对照增加了44%。此外,丁酸盐的补充还可以将丁醇摩尔转化率提高到92% [20]。除了额外补充这些昂贵的丁酸盐,另一种方法是通过将产丁酸和产丁醇的细菌组合构建微生物群落。例如,可以设计大肠杆菌二元共培养系统,其中具有产生丁酸能力的代谢工程大肠杆菌可以与产生丁醇的大肠杆菌共培养。在产生丁酸的大肠杆菌的代谢构建方面,atoDA、phaA(β-酮硫解酶基因)、hbd、crt和ter可以引入大肠杆菌。而就产生丁醇的大肠杆菌的代谢构建而言,来自梭菌的atoDA和adhE2可以被引入大肠杆菌。发酵条件优化后,该微生物共培养体系生产了5.5 g/L丁醇,理论产量为69%[20]。众所周知,微生物共培养体系需要保持在动态平衡过程中才能高效生产目标产物。因此,构建动态代谢模型以指导进一步的系统优化有助于提高最终丁醇的生产效率。
1.2 酪丁酸梭菌生物合成丁醇
酪丁酸梭菌是一种革兰氏阳性、杆状、产孢子和专性厌氧细菌,主要产物为丁酸、乙酸、CO2和H2。与产溶剂梭菌不同,丙酮合成的本地消除将有助于重组酪丁酸梭菌的高丁醇产率。此外,重组酪丁酸梭菌中的丁醇生物合成途径不会影响细胞的孢子形成和自溶,这将提高最终丁醇的生产效率。因此,酪丁酸梭菌可能是另一种有前途的丁醇生产工业宿主。
由于其固有的丁酸合成能力,重组酪丁酸梭菌可以通过简单地引入adhE2来实现丁醇生产。然而,重组酪丁酸梭菌仅产生了1.1 g/L丁醇。通过删除乙酸激酶 (ack) 和磷酸转丁酸酶 (ptb) 基因进一步控制酪丁酸梭菌中的碳流分布,以葡萄糖为碳源生产了10.0 g/L丁醇,丁醇收率为0.27 g/g(图2)[30]。特别是当ack被敲除时,C4/C2产率高达10.6(mol/mol)。其他代谢途径也可以引入酪丁酸梭菌生产丁醇(图2),其中CoA转移酶基因(ctfAB) 可以过表达,负责催化乙酸/丁酸和乙酰乙酰CoA反应生成乙酰/丁酰-CoA和乙酰乙酸。在酪丁酸梭菌(Δack,adhE2)中过表达ctfAB后,乙酸和丁酸可以回收用于溶剂生产,丁醇生产能力可以进一步提高。最后,随着乙酸和丁酸的减少,丁醇产量达到12.3~13.4 g/L,这是目前非溶剂生产菌株的最高丁醇产量[31]。

图2 通过代谢工程改造酪丁酸梭菌从蔗糖、葡萄糖和果糖生产ABE的代谢途径
Fig.2 The metabolic pathway for ABE production from sucrose, glucose and fructose by metabolic engineering C.tyrobutyricum
注:scrA-蔗糖特异性PTS、scrB-蔗糖6-磷酸水解酶或蔗糖酶、scrK-果糖激酶、pta-磷酸转乙酰酶、ack-乙酸激酶、thl-硫解酶、hbd-β-羟基丁酰-CoA脱氢酶、crt-巴豆酸酶、bcd-丁酰CoA脱氢酶、etf-电子转移黄素蛋白、ptb-磷酸转丁酰酶、buk-丁酸激酶、ctf-丁酰辅酶A/乙酸辅酶 A转移酶、adh-醇脱氢酶、adhE2-醛醇脱氢酶。
为了进一步降低生产成本,大量廉价碳资源也被开发利用生产丁醇。与大肠杆菌类似,CCR也存在于酪丁酸梭菌中。为了减轻CCR并提高木糖利用能力,编码木糖质子同向转运蛋白(xylT)、木糖异构酶(xylA)和木酮糖激酶(xylB)的3个基因可以在酪丁酸梭菌(Δack、adhE2)中共表达。在重组菌株生长的对数期观察到类似的葡萄糖和木糖消耗率,分别为1.03和1.05 g/(L·h)。最后,以大豆壳水解物为底物的丁醇产量可提高至15.7 g/L,丁醇收率为0.24 g/g,丁醇生产率为 0.29 g/(L·h)[32]。在华南和巴西,甘蔗汁和糖蜜是丰富且廉价的底物[33]。然而,由于蔗糖代谢基因的缺乏,酪丁酸梭菌不能利用蔗糖。ZHANG等[33]将3个与蔗糖分解代谢相关的基因(scrA、scrB和scrK)和一个丁醇转化基因adhE从丙酮丁酸梭菌中引入酪丁酸梭菌。重组菌株最终可以同时利用蔗糖和葡萄糖,蔗糖消耗率可达0.79 g/(L·h),甚至高于0.54 g/(L·h)的葡萄糖消耗率。此外,在丁醇比为0.94的情况下,基因工程化的酪丁酸梭菌可以从甘蔗汁中生产14.8~18.8 g/L丁醇[34]。这些结果表明,酪丁酸梭菌是从广泛的廉价底物生产丁醇的一种潜在底盘,包括木质纤维素水解物、甘蔗汁等。
adhE2催化的丁醇合成通常受到NADH有效性的限制,导致丁醇滴度、收率和生产率低。为了减轻这种限制,通常在培养基中加入甲基紫精,它是一种人工电子载体,用于从铁氧还蛋白中转移电子。在删除ack和过表达 adhE2后,补充500 μmol/L 甲基紫精有助于将最终丁醇产量提高到14.5 g/L,相比于对照提高了40%。H2、乙酸和丁酸的产率均显著降低80%~90%以上。代谢通量分析表明,补充甲基紫精后,NADH的利用能力也有所提高[35]。
1.3 酿酒酵母生物合成丁醇
酿酒酵母是一种兼性厌氧酵母,主要代谢产物是乙醇 [29,36]。与细菌宿主相比,酿酒酵母能适应更恶劣的培养条件,包括高浓度溶剂、低pH条件等[37-39]。研究者们已经探索了酿酒酵母生产丁醇的3种代谢途径(图3)[34,40]。与大肠杆菌不同,当源自产溶剂梭菌的异源丁醇合成途径被引入酿酒酵母时,只有2.5 mg/L丁醇是由代谢工程酿酒酵母产生的[34]。即使经过进一步的基因改造,包括增加细胞质中乙酰CoA的基因表达水平(醛脱氢酶、乙酰CoA合成酶、乙醇脱氢酶),重组酿酒酵母的丁醇产量仅提高到16.3 mg/L,远低于使用重组大肠杆菌的产量[40]。这暗示着原核细菌的代谢途径可能与酵母不相容。
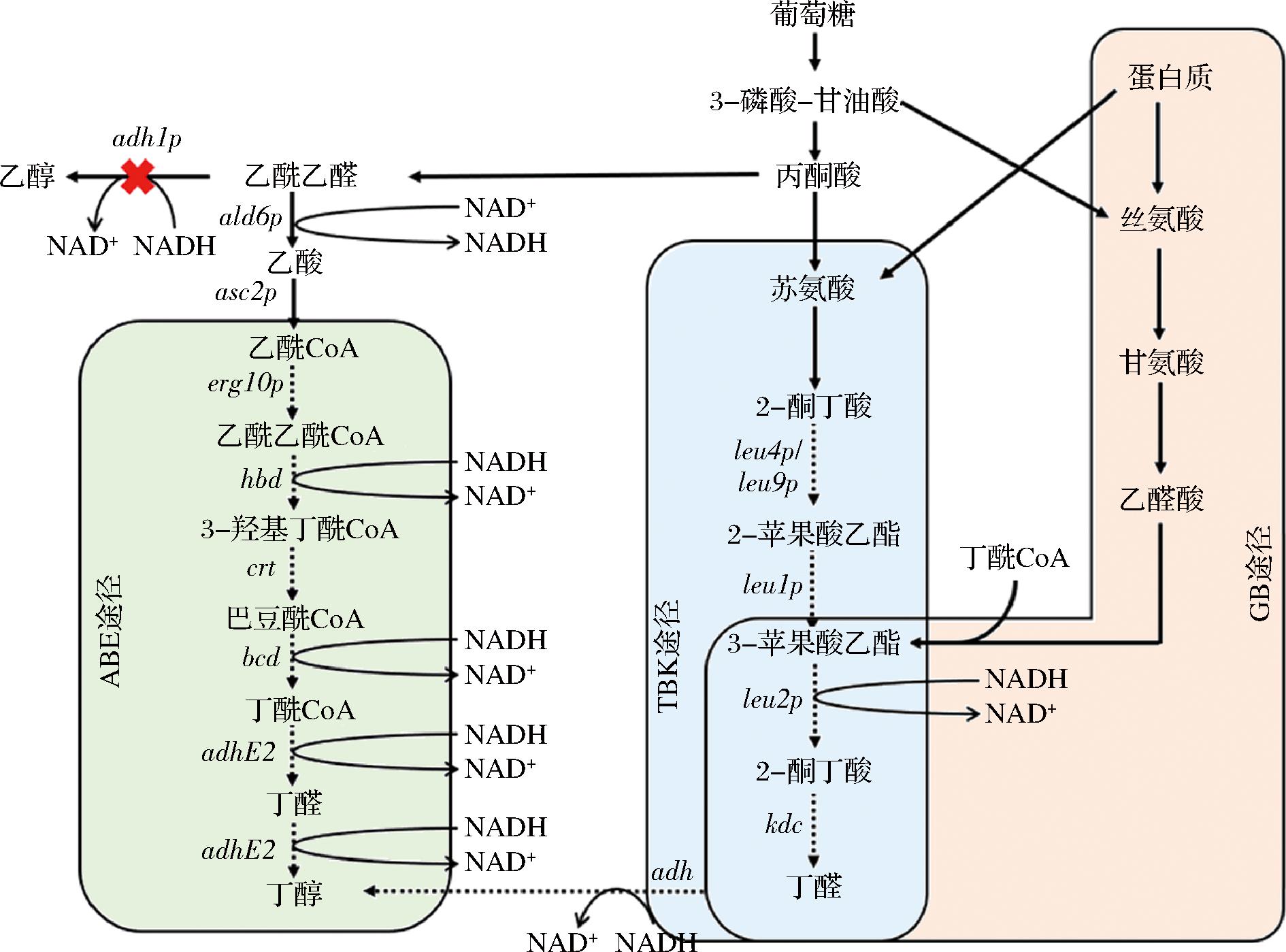
图3 酿酒酵母生产丁醇的内源性和外源性代谢途径
Fig.3 Endogenous and exogenous metabolic pathways for butanol production in S.cerevisiae
注:hbd-3-羟基丁酰-CoA脱氢酶、crt-巴豆酸酶、bcd-丁酰-CoA 脱氢酶、adhE2-醇脱氢酶、erg10p-硫解酶、ald6p-醛脱氢酶和acs2p-乙酰辅酶A合成酶,leu1p-异丙基苹果酸异构酶,leu2p-β-异丙基苹果酸脱氢酶,leu4p/leu9p-α-异丙基苹果酸合酶;红色叉表示酵母adh1p基因的敲除。
可用于酿酒酵母生产丁醇的另一种丁醇合成途径是苏氨酸基酮酸途径(threonine-based ketoacid,TBK)(图3)。编码醇脱氢酶的adh1的缺失会激活酿酒酵母中的TBK途径[41]。TBK途径起源于线粒体中的苏氨酸分解代谢,它采用亮氨酸生物合成途径中的酶来合成丁醛。然后可以通过醇脱氢酶的催化将丁醛还原为丁醇。删除adh1不仅有助于增加丁醇产量,还可以提高内源性丁醇产量。因此,一些旨在提高丁醇产量的基因改造也将促进内源丁醇的生产[42]。通过内源和外源丁醇合成途径的联合引入,重组酿酒酵母最终可以生产120 mg/L丁醇 [43-44]。
第三种途径是甘氨酸-丁醇(glycine-butanol,GB) 途径,其中甘氨酸主要用作氮源 [45]。为了实现酿酒酵母生产丁醇,可以将来自枯草芽孢杆菌的甘氨酸氧化酶 (goxb) 基因导入酿酒酵母,这可以促进甘氨酸转化为乙醛酸。然后乙醛酸通过 α-酮戊二酸催化成丁醇(图3)[45]。在酵母中,内源性甘氨酸通常由丝氨酸成,丝氨酸是糖酵解的中间体之一。例如,添加甘氨酸可以将重组酿酒酵母的丁醇产量从40 mg/L显著增加到120 mg/L。
目前,外源途径仍是丁醇生产的主要途径,但是原核与真核细胞代谢途径不相容导致其产量较低。内源性途径TBK途径和GB途径的丁醇产量也较低。虽然adh1缺失会激活内源性丁醇生产,但丁醇生产仍保持在低水平。因此,鉴定TBK途径中的限速酶可能是进一步提高丁醇产量的关键。在GB途径中,外部补充甘氨酸和酮戊二酸将有助于提高最终丁醇产量。与外源甘氨酸相比,加入α-酮戊二酸后丁醇产量超过2.4 g/L [43]。
2 代谢工程改造非模式微生物生产丁醇
2.1 短乳杆菌生物合成丁醇
短乳杆菌由于丁醇耐受性高(3%,体积分数,下同),因此具有醇生产的潜力。短乳杆菌可以本地表达参与丁醇合成的thl和adhE2基因,从而从葡萄糖中产生 300 mg/L的丁醇。为了增加最终丁醇产量,可将梭菌丁醛和丁醇脱氢酶引入短乳杆菌。然而,用于将乙酰CoA转化为丁醇的梭菌基因的组装只有在短乳杆菌宿主中乙醛和乙醇脱氢酶基因失活后才会有效。此外,ldh的完全失活以及丙酮酸脱氢酶 (pdh) 的激活也可能是必不可少的,因为这会将丙酮酸重定向到乙酰CoA并增加细胞内NADH库。乙酰CoA到乙酰乙酰CoA的代谢重新定向取决于thl和aldh活性的比率以及它们各自对乙酰CoA的亲和力[46]。因此,增加丁醇合成途径的酶活性可以进一步帮助提高丁醇生产。
2.2 恶臭假单胞菌和枯草芽孢杆菌生物合成丁醇
恶臭假单胞菌和枯草芽孢杆菌都是天然的耐溶剂菌株。枯草芽孢杆菌在使用高浓度丁醇(2%~5%)的适应性进化后表现出良好的丁醇耐受性。例如,恶臭假单胞菌和枯草芽孢杆菌在含有5%~6%的培养基中生长良好,而产溶剂梭菌只能耐受1%~2%的丁醇。然而,丁醇会被恶臭假单胞菌代谢成其他产物。因此,重组恶臭假单胞菌通常维持在低水平丁醇产量。例如,NIELSEN等[47]在恶臭假单胞菌表达了来源于梭状芽孢杆菌thl、hbd、crt、bcd、etfAB、ctfAB和adhE;然而,重组恶臭假单胞菌只产生了122 mg/L的丁醇。重组枯草芽孢杆菌也得到了类似的结果,枯草芽孢杆菌表达thl、hbd、crt、bcd、etfAB和adhE2基因表达后仅产生24 mg/L的丁醇。
2.3 热解糖高温厌氧菌生物合成丁醇
热解糖高温厌氧菌是一种厌氧、革兰氏阳性和嗜热微生物,主要代谢产物包括乙醇、乙酸、丁酸、乳酸、CO2和H2[48]。此外,它具有广泛的底物利用谱,包括木聚糖、甘露聚糖、淀粉等。值得注意的是,在生物技术过程中,嗜热微生物比嗜温微生物显示出更大的潜力,其优点包括降低污染风险、更高的反应速率以及更低的加热和冷却成本。例如,BHANDIWAD等[49]将来自嗜热厌氧杆菌和丙酮丁醇梭菌的thl、hbd、crt、bcd、etfAB和adhE的优化基因引入热解糖高温厌氧菌,重组热解糖高温厌氧菌可从10 g/L木糖生产0.85 g/L丁醇。当副产物乳酸生产途径被敲除后,丁醇产量可提高到1.05 g/L [50]。但丁醇产量仍处于低水平,这可能是由于外源表达酶在高温条件下的活性降低。虽然嗜热厌氧杆菌属作为丁醇生产底盘显示出巨大的潜力,但是,热稳定酶的有限资源阻碍了它们的进一步发展。
3 结论和未来前景
与由产溶剂梭菌进行的典型ABE发酵过程不同,将丁醇合成途径单一引入这些非溶剂生产菌株通常会产生较少的副产物。由于其明确的遗传背景,一些不需要的副产品也可以很容易地消除,这些通常有助于提高丁醇收率。因此,通过这些非溶剂生产菌株提高最终丁醇产量将是未来研究的重点。如上所述,最终的丁醇生产也会显著影响分离成本。根据经济分析,如果最终丁醇产量提高到18 g/L以上,接下来的丁醇分离成本将降低一半。综上所述,以上详细的非溶剂生产菌株根据其目前的丁醇生产能力可分为3类(图4):
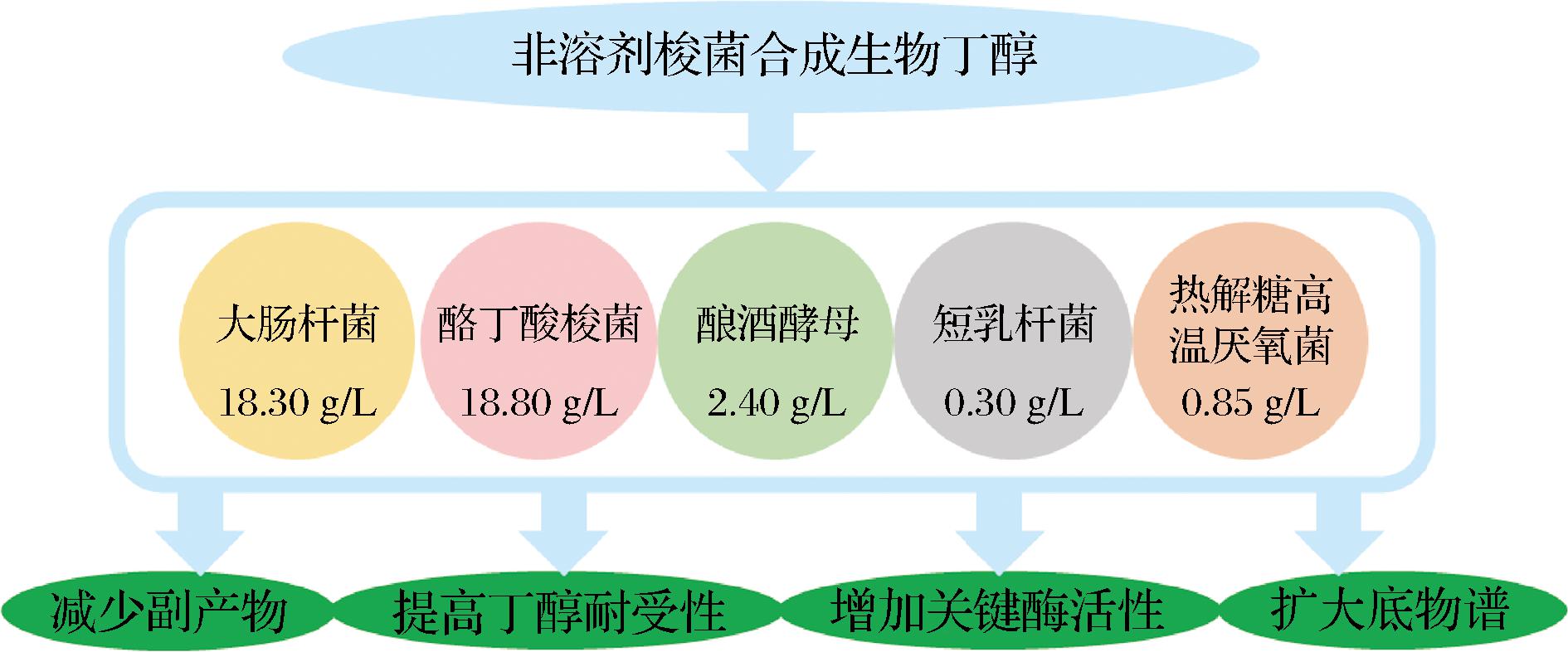
图4 非溶剂梭菌合成生物丁醇的主要挑战
Fig.4 Major challenges for butanol production by non-solvent strains
a)高水平的丁醇生产菌株:据报道,重组大肠杆菌和酪丁酸梭菌可生产超过18 g/L的丁醇,高于大多数报道的野生型产溶剂梭菌菌株(10~15 g/L)。由于其明确的遗传背景和成熟的遗传工具,它们不仅可以在丁醇生产效价和产量方面表现良好,而且可以使用多种底物,例如基因修饰后可以利用木质纤维素水解物。然而,高浓度的丁醇仍然显著影响细胞生长。因此,未来的研究应更加关注重组菌株对丁醇的耐受性。简而言之,这两种模型微生物可能是进一步扩大丁醇生产的更有希望的候选者。
b) 中等水平的丁醇生产菌株:与细菌宿主相比,酿酒酵母更健壮,对有机溶剂显示出较高的耐受性。因此,酿酒酵母可能是一种本地有前途的丁醇生产宿主。然而,重组酿酒酵母仅产生2.4 g/L 的丁醇。尽管可以在酿酒酵母中引入几种丁醇合成途径来生产丁醇,但某些酶的表达水平可能较低,这会影响最终的丁醇产量。因此在未来的研究中需要探索酿酒酵母丁醇合成途径中的关键限速步骤。
c)低水平的丁醇生产菌株:目前,短乳杆菌和热解糖高温厌氧菌的重组体只能生产不到1 g/L的丁醇。这些微生物不太可能用于丁醇的工业生产。对于具有良好丁醇耐受性(>2%)的短乳杆菌,丁醇合成途径中相关酶的过度表达可能会增加丁醇产量。而对于热解糖高温厌氧菌来说,表达耐高温的关键酶可能是提高丁醇产量的首选。
目前来说,CoA依赖性途径是代谢工程策略生产生物丁醇效率最高的途径,其天然存在于产溶剂梭菌中。大肠杆菌由于其遗传操作工具成熟,是代谢工程改造生产丁醇的最有宿主之一,并且将优化的CoA依赖性途径引入大肠杆菌中,与溶剂梭菌天然存在的ABE途径相比,可有效减少产物。酪丁酸梭菌天然存在丁酰丁酰CoA合成途径,因为只需引入醇脱氢酶即可实现丁醇的生产,并且其产物丁酸乙酸可通过回补途径进一步生成丁醇,因此其也是代谢工程改造生产丁醇的优秀底盘细胞。虽然目前酿酒酵母、短乳杆菌等丁醇产量很低,但这些微生物各自具有不同的优势,比如利用廉价底物的能力强,或对丁醇的耐受性高等。相信随着合成生物学的进一步发展,这些宿主生物合成丁醇的能力将不断增强。
综上所述,丁醇耐受性的提高和关键酶活性的增加将是通过使用这些非溶剂生产菌来提高丁醇生产的下一个重点。然而,由于许多复杂的膜蛋白参与丁醇耐受性,因此具体鉴定一种或几种负责改善丁醇耐受性的蛋白质是不同的。目前,随机诱变仍然是提高产溶剂梭菌最终丁醇耐受性的有效方法。菌株代谢工程与适应性或随机诱变的结合也是提高这些非溶剂生产菌株最终丁醇产量的有效方法。通过进一步的遗传和蛋白质组学分析,还可以鉴定出一些关键基因和蛋白质,这可能有助于指导高丁醇生产者的代谢构建。
[1] DU G Q, CHE J, WU Y D, et al.Disruption of hydrogenase gene for enhancing butanol selectivity and production in Clostridium acetobutylicum[J].Biochemical Engineering Journal, 2021, 171:108014.
[2] WU Y D, WANG Z Z, XIN X, et al.Synergetic engineering of central carbon, energy, and redox metabolisms for high butanol production and productivity by Clostridium acetobutylicum[J].Industrial &Engineering Chemistry Research, 2020, 59(39):17137-17146.
[3] HERGUETA C, BOGARRA M, TSOLAKIS A, et al.Butanol-gasoline blend and exhaust gas recirculation, impact on GDI engine emissions[J].Fuel, 2017, 208:662-672.
[4] GAO Y, ZHANG M M, ZHOU X, et al.Effects of carbon ion beam irradiation on butanol tolerance and production of Clostridium acetobutylicum[J].Frontiers in Microbiology, 2020, 11:602774.
[5] XIN F X, DONG W L, JIANG Y J, et al.Recent advances on conversion and co-production of acetone-butanol-ethanol into high value-added bioproducts[J].Critical Reviews in Biotechnology, 2018, 38(4):529-540.
[6] JONES D T, WOODS D R.Acetone-butanol fermentation revisited[J].Microbiological Reviews, 1986, 50(4):484-524.
[7] BORAH A J, ROY K, GOYAL A, et al.Mechanistic investigations in biobutanol synthesis via ultrasound-assisted ABE fermentation using mixed feedstock of invasive weeds[J].Bioresource Technology, 2019, 272:389-397.
[8] 赵新河, 贺壮壮, 赵玉斌, 等.玉米浆发酵产生物丁醇的氨基酸代谢动力学模拟[J].农业工程学报, 2020, 36(18):263-274.ZHAO X H, HE Z Z, ZHAO Y B, et al.Kinetic simulation of amino acid metabolism of butanol produced from the fermentation of corn steep liquor[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(18):263-274.
[9] TSVETANOVA F, PETROVA P, PETROV K.Microbial production of 1-butanol-recent advances and future prospects (review)[J].Journal of Chemical Technology and Metallurgy, 2018, 53(4):683-696.[10] TSAI T Y, LO Y C, DONG C D, et al.Biobutanol production from lignocellulosic biomass using immobilized Clostridium acetobutylicum[J].Applied Energy, 2020, 277:115531.
[11] DAI Z J, ZHU Y, DONG H J, et al.Enforcing ATP hydrolysis enhanced anaerobic glycolysis and promoted solvent production in Clostridium acetobutylicum[J].Microbial Cell Factories, 2021, 20(1):149.
[12] DARKWAH K, NOKES S E, SEAY J R, et al.Mechanistic simulation of batch acetone-butanol-ethanol (ABE) fermentation with in situ gas stripping using Aspen Plus[J].Bioprocess and Biosystems Engineering, 2018, 41(9):1283-1294.
[13] SHANMUGAM S, SUN C R, ZENG X M, et al.High-efficient production of biobutanol by a novel Clostridium sp.strain WST with uncontrolled pH strategy[J].Bioresource Technology, 2018, 256:543-547.
[14] WANG P X, CHEN Y M, WANG Y F, et al.Towards comprehensive lignocellulosic biomass utilization for bioenergy production:Efficient biobutanol production from acetic acid pretreated switchgrass with Clostridium saccharoperbutylacetonicum N1-4[J].Applied Energy, 2019, 236:551-559.
[15] WANG P X, FENG J, GUO L, et al.Engineering Clostridium saccharoperbutylacetonicum for high level isopropanol-butanol-ethanol (IBE) production from acetic acid pretreated switchgrass using the CRISPR-Cas9 system[J].ACS Sustainable Chemistry &Engineering, 2019, 7(21):18153-18164.
[16] WAYNE CHEW K, YING YAP J, SABARIAH DIN S, et al.Developments in fermentative butanol production as an alternative biofuel source[J].Journal of Energy Resources Technology, 2018, 140(4):040801.
[17] KANNO M, TAMAKI H, MITANI Y, et al.pH-induced change in cell susceptibility to butanol in a high butanol-tolerant bacterium, Enterococcus faecalis strain CM4A[J].Biotechnology for Biofuels, 2015, 8:69.
[18] POEHLEIN A, SOLANO J D M, FLITSCH S K, et al.Microbial solvent formation revisited by comparative genome analysis[J].Biotechnology for Biofuels, 2017, 10:58.
[19] FISCHER C R, KLEIN-MARCUSCHAMER D, STEPHANOPOULOS G.Selection and optimization of microbial hosts for biofuels production[J].Metabolic Engineering, 2008, 10(6):295-304.
[20] SAINI M, WANG Z W, CHIANG C J, et al.Metabolic engineering of Escherichia coli for production of n-butanol from crude glycerol[J].Biotechnology for Biofuels, 2017, 10:173.
[21] FERREIRA S, PEREIRA R, WAHL S A, et al.Metabolic engineering strategies for butanol production in Escherichia coli[J].Biotechnology and Bioengineering, 2020, 117(8):2571-2587.
[22] SAINI M, LIN L J, CHIANG C J, et al.Effective production of n-butanol in Escherichia coli utilizing the glucose-glycerol mixture[J].Journal of the Taiwan Institute of Chemical Engineers, 2017, 81:134-139.
[23] ATSUMI S, HANAI T, LIAO J C.Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels[J].Nature, 2008, 451(7174):86-89.
[24] YE W H, LI J, HAN R Z, et al.Engineering coenzyme A-dependent pathway from Clostridium saccharobutylicum in Escherichia coli for butanol production[J].Bioresource Technology, 2017, 235:140-148.
[25] NITTA K, LAVI A W A, PONTRELLI S, et al.Metabolome analysis revealed the knockout of glyoxylate shunt as an effective strategy for improvement of 1-butanol production in transgenic Escherichia coli[J].Journal of Bioscience and Bioengineering, 2019, 127(3):301-308.
A W A, PONTRELLI S, et al.Metabolome analysis revealed the knockout of glyoxylate shunt as an effective strategy for improvement of 1-butanol production in transgenic Escherichia coli[J].Journal of Bioscience and Bioengineering, 2019, 127(3):301-308.
[26] ABDELAAL A S, JAWED K, YAZDANI S S.CRISPR/Cas9-mediated engineering of Escherichia coli for n-butanol production from xylose in defined medium[J].Journal of Industrial Microbiology &Biotechnology, 2019, 46(7):965-975.
[27] SAINI M, LIN L J, CHIANG C J, et al.Synthetic consortium of Escherichia coli for n-butanol production by fermentation of the glucose-xylose mixture[J].Journal of Agricultural and Food Chemistry, 2017, 65(46):10040-10047.
[28] AYOUB M, ABDULLAH A Z.Critical review on the current scenario and significance of crude glycerol resulting from biodiesel industry towards more sustainable renewable energy industry[J].Renewable and Sustainable Energy Reviews, 2012, 16(5):2671-2686.
[29] SENGUPTA S, DEB M, NATH R, et al.Optimization of ethanol production using nitrosative stress exposed S.cerevisiae[J].Cell Biochemistry and Biophysics, 2020, 78(1):101-110.
[30] YU M R, ZHANG Y L, TANG I C, et al.Metabolic engineering of Clostridium tyrobutyricum for n-butanol production[J].Metabolic Engineering, 2011, 13(4):373-382.
[31] YU L, ZHAO J B, XU M M, et al.Metabolic engineering of Clostridium tyrobutyricum for n-butanol production:Effects of CoA transferase[J].Applied Microbiology and Biotechnology, 2015, 99(11):4917-4930.
[32] YU L, XU M M, TANG I C, et al.Metabolic engineering of Clostridium tyrobutyricum for n-butanol production through co-utilization of glucose and xylose[J].Biotechnology and Bioengineering, 2015, 112(10):2134-2141.
[33] ZHANG J Z, YU L, XU M M, et al.Metabolic engineering of Clostridium tyrobutyricum for n-butanol production from sugarcane juice[J].Applied Microbiology and Biotechnology, 2017, 101(10):4327-4337.
[34] STEEN E J, CHAN R, PRASAD N, et al.Metabolic engineering of Saccharomyces cerevisiae for the production of n-butanol[J].Microbial Cell Factories, 2008, 7:36.
[35] DU Y M, JIANG W Y, YU M R, et al.Metabolic process engineering of Clostridium tyrobutyricum Δack-adhE2 for enhanced n-butanol production from glucose:Effects of methyl viologen on NADH availability, flux distribution, and fermentation kinetics[J].Biotechnology and Bioengineering, 2015, 112(4):705-715.
[36] WANG Y, LI X Z, BLASCHEK H P.Effects of supplementary butyrate on butanol production and the metabolic switch in Clostridium beijerinckii NCIMB 8052:Genome-wide transcriptional analysis with RNA-Seq[J].Biotechnology for Biofuels, 2013, 6(1):138.
[37] HAKKAART X, LIU Y Y, HULST M, et al.Physiological responses of Saccharomyces cerevisiae to industrially relevant conditions:Slow growth, low pH, and high CO2 levels[J].Biotechnology and Bioengineering, 2020, 117(3):721-735.
[38] LIAN J Z, MISHRA S, ZHAO H M.Recent advances in metabolic engineering of Saccharomyces cerevisiae:New tools and their applications[J].Metabolic Engineering, 2018, 50:85-108.
[39] PEREIRA R, MOHAMED E T, RADI M S, et al.Elucidating aromatic acid tolerance at low pH in Saccharomyces cerevisiae using adaptive laboratory evolution[J].Proceedings of the National Academy of Sciences of the United States of America, 2020, 117(45):27954-27961.
[40] VAN ROSSUM H M, KOZAK B U, PRONK J T, et al.Engineering cytosolic acetyl-coenzyme A supply in Saccharomyces cerevisiae:Pathway stoichiometry, free-energy conservation and redox-cofactor balancing[J].Metabolic Engineering, 2016, 36:99-115.
[41] SI T, LUO Y Z, XIAO H, et al.Utilizing an endogenous pathway for 1-butanol production in Saccharomyces cerevisiae[J].Metabolic Engineering, 2014, 22:60-68.
[42] SHI S B, SI T, LIU Z H, et al.Metabolic engineering of a synergistic pathway for n-butanol production in Saccharomyces cerevisiae[J].Scientific Reports, 2016, 6:25675.
[43] SWIDAH R, OGUNLABI O, GRANT C M, et al.N-Butanol production in S.cerevisiae:Co-ordinate use of endogenous and exogenous pathways[J].Applied Microbiology and Biotechnology, 2018, 102(22):9857-9866.
[44] SWIDAH R, WANG H, REID P J, et al.Butanol production in S.cerevisiae via a synthetic ABE pathway is enhanced by specific metabolic engineering and butanol resistance[J].Biotechnology for Biofuels, 2015, 8:97.
[45] BRANDUARDI P, LONGO V, BERTERAME N M, et al.A novel pathway to produce butanol and isobutanol in Saccharomyces cerevisiae[J].Biotechnology for Biofuels, 2013, 6(1):68.
[46] BEREZINA O V, ZAKHAROVA N V, BRANDT A, et al.Reconstructing the clostridial n-butanol metabolic pathway in Lactobacillus brevis[J].Applied Microbiology and Biotechnology, 2010, 87(2):635-646.
[47] NIELSEN D R, LEONARD E, YOON S H, et al.Engineering alternative butanol production platforms in heterologous bacteria[J].Metabolic Engineering, 2009, 11(4-5):262-273.
[48] WANG M Y, ZHAO Q, LI L, et al.Contributing factors in the improvement of cellulosic H2 production in Clostridium thermocellum/Thermoanaerobacterium co-cultures[J].Applied Microbiology and Biotechnology, 2016, 100(19):8607-8620.
[49] BHANDIWAD A, SHAW A J, GUSS A, et al.Metabolic engineering of Thermoanaerobacterium saccharolyticum for n-butanol production[J].Metabolic Engineering, 2014, 21:17-25.
[50] THORGERSEN M P, LIPSCOMB G L, SCHUT G J, et al.Deletion of acetyl-CoA synthetases I and II increases production of 3-hydroxypropionate by the metabolically-engineered hyperthermophile Pyrococcus furiosus[J].Metabolic Engineering, 2014, 22:83-88.