近年来,由于动物源性食品的过度消费引发的公共卫生和环境问题,和全球人口持续增长引发的粮食安全及可持续性问题,富含植物蛋白的食品原料逐渐受到人们的青睐。绿叶中含有高达40%~50%的蛋白(干重计),具有不同的结构和功能,包括脂蛋白(膜)、结构蛋白、光活性色素结合蛋白和酶。值得关注的是,叶蛋白中一种含量较高的双功能多聚植物代谢酶—核酮糖-1,5-二磷酸羧化酶/加氧酶 (ribulose-1,5-bisphosphate carboxylase/oxygenase,RuBisCO),作为叶片光合碳同化中的关键酶,其存在于从原核生物到真核生物的大多数自养生物中,是地球上较丰富的蛋白质。与粮农组织/世卫组织所要求的必需氨基酸数量相比,RuBisCO的化学评分为98分,是极好的必需氨基酸补体[1]。RuBisCO中的限制性氨基酸是含硫氨基酸(如蛋氨酸和半胱氨酸),但赖氨酸和苏氨酸含量较为丰富,可以与谷物蛋白形成互补[2]。目前,叶蛋白的提取和纯化工艺仍然有待改进,主要是因为其富含叶绿素、多酚、糖类等物质导致一些方法的提取成本高、效率低,工艺复杂,品质不佳。在理化特性方面,由于RuBisCO在食品pH值下良好的溶解性(pH值 6~8),使其具有与蛋清蛋白相似的发泡能力;高于蛋清蛋白的乳化能力;在低浓度和低温下可形成凝胶的特性[3]。所以,RuBisCO可以用于改善食物的品质和口感,成为食品和饮料的配料或在减肥餐中充当肉类取代物。同时,RuBisCO较高的营养价值和功能特性也使其成为生物活性肽的丰富来源。本文通过综述RuBisCO的来源、结构、提取方法、理化特性、营养与功能,为促进其作为一种未充分利用的、可持续的人类营养蛋白质提供理论基础。
1 RuBisCO的来源与含量
绿叶中总蛋白质含量在1.2%~8.2%(平均约3.5%,鲜重计),是丰富的可食用蛋白来源。绿叶中约80%的蛋白质位于叶绿体中,其中50%以上的蛋白质可溶于基质,另一半是类囊体膜的一部分。另外约20%的蛋白质大多位于细胞质中,少量存在于细胞核中(1%~2%)或线粒体中(小于5%)中。不溶性蛋白质主要由形成光合复合物的蛋白质与脂质及色素组成,还包括附着在细胞壁上与多糖结合的蛋白。可溶性蛋白部分主要是RuBisCO。总体上,在叶蛋白中发现了约250~300种不同的蛋白质和多肽。
RuBisCO的含量和质量与植物物种、种植条件、植物生长阶段等因素密切相关[4]。植物物种根据碳固定途径分为C3、C4和CAM。其中,C3植物包括稻、麦、棉、油、茶等大部分农作物以及除红杉外的重要木本科植物,RuBisCO占C3植物总可溶性蛋白的25%~59%,且密集地分布在叶绿体基质中(质量浓度高达300 mg/mL)。高粱、甘蔗、玉米、苋菜等为C4植物,RuBisCO占C4植物总可溶性蛋白8%~23%[5],且仅存在于维管束细胞中。部分C3及C4植物的总可溶性蛋白见表1。
表1 植物叶蛋白来源与含量
Table 1 Source and content of plant leaf protein
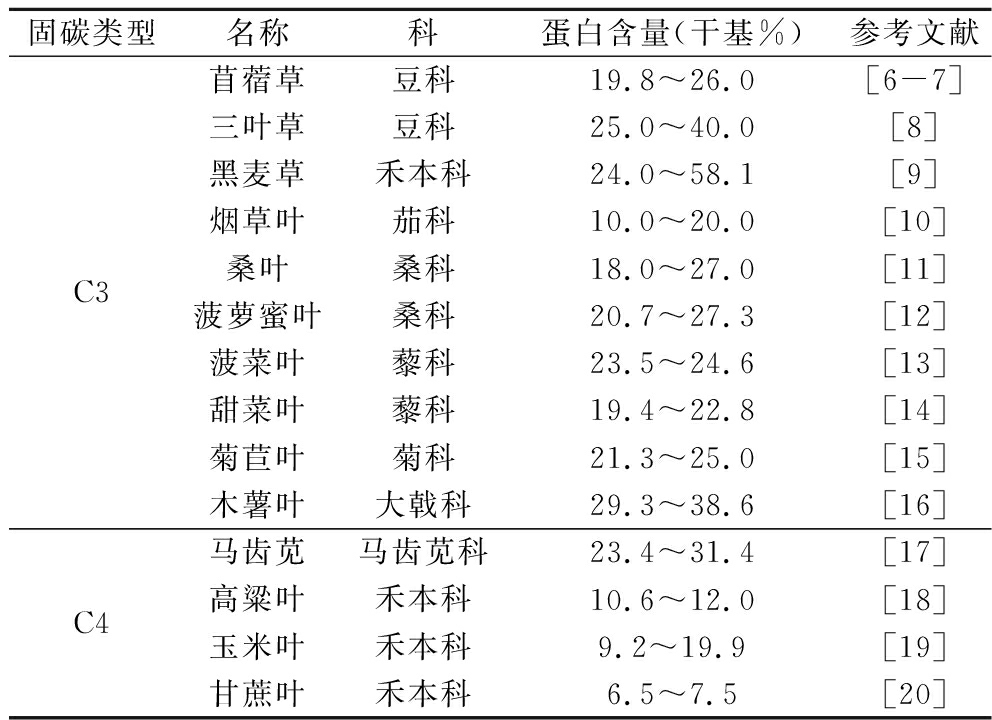
固碳类型名称科蛋白含量(干基%)参考文献C3苜蓿草豆科19.8~26.0[6-7]三叶草豆科25.0~40.0[8]黑麦草禾本科24.0~58.1[9]烟草叶茄科10.0~20.0[10]桑叶桑科18.0~27.0[11]菠萝蜜叶桑科20.7~27.3[12]菠菜叶藜科23.5~24.6[13]甜菜叶藜科19.4~22.8[14]菊苣叶菊科21.3~25.0[15]木薯叶大戟科29.3~38.6[16]C4马齿苋马齿苋科23.4~31.4[17]高粱叶禾本科10.6~12.0[18]玉米叶禾本科9.2~19.9[19]甘蔗叶禾本科6.5~7.5[20]
据研究,光照强度、含氮量、植物株龄及叶片位置决定了叶片中的蛋白质浓度。充足的光照和早期施氮能够增加植物叶片中RuBisCO的浓度。然而,由于同化产物的增加,使用氨或硝酸盐施肥会降低植物叶片中真蛋白/粗蛋白的比例[21]。植物在不同的生长阶段,由于内源性蛋白酶的作用,其叶片可溶性蛋白质含量也在不断变化。一般在叶片完全展开时RuBisCO含量最高,在衰老过程中降至最低水平[22]。在对番茄叶(C3植物)的研究中发现,叶片中蛋白质含量的总体水平随着株龄的增加而下降,且叶片位置对蛋白质含量的影响要高于株龄,高位置叶片的蛋白质含量高于低位置叶片的蛋白质含量。同时,植物较低位置的叶片比植物较高位置的叶片含有更多的多肽和游离氨基酸,较少的完整的蛋白质,较少的多酚类化合物,所以在提取的过程中导致较高的蛋白提取率,这些规律对植物叶蛋白具有普适性[22]。所以,在进行蛋白提取中应该充分的考虑这些因素以提高最终蛋白的品质和得率。
2 RuBisCO的结构与组成
RuBisCO是一种双功能的多聚植物代谢酶,目前报道的分子质量为500 ~590 kDa,催化光合作用中CO2固定的第一步和光呼吸过程中的碳氧化这两个竞争性的反应。它以4种形式(I、II、III和IV)存在于原核生物到真核生物的多数自养生物中[23]。在C3植物中,该酶通过催化1,5-二磷酸核酮糖(ribulose-1,5-bisphosphate,RuBP) 的羧化,启动光合作用中的卡尔文循环,将生物圈中的CO2转化为有机化合物,产生两个分子的3-磷酸甘油酸。在C4植物中是由磷酸烯醇式丙酮酸(phosphoenolpyruvic acid,PEP)羧化酶催化初始固碳反应,RuBisCO不参与固碳[24]。虽然RuBisCO对CO2的亲和力有利于其固碳催化活性,但是它对分子氧的亲和导致了光呼吸,使CO2固定的催化活性降低了50%。因此,RuBisCO通常被认为是一种低效酶,它被认为可能在体内作为代谢物缓冲液发挥作用,具有隔离和释放参与光合反应的各种磷酸糖的能力[22]。
I型RuBisCO广泛存在于陆生植物和绿藻中,叶绿体DNA编码和合成大的RuBisCO亚基 (55 kDa),而细胞核DNA编码小RuBisCO亚基(15 kDa),并由细胞质核糖体合成。这两个亚基在翻译处理后,小亚基被添加到叶绿体中伴侣组装的大亚基的核心中。对于烟草叶蛋白RuBisCO四元结构的Eisenberg-Baker模型指出,全酶结构由8个大亚基和8个小亚基组成,呈422对称,酶分子的形状近似于一个空心球体或圆柱体,估计尺寸为11.4 nm×13.7 nm×10.0 nm(图1)。II型RuBisCO存在于一些原核生物和鞭毛虫中,包括紫色非硫细菌和化学自养细菌,仅由一个大亚基组成的二聚体,它对CO2的特异性低于形式I,物种间没有明显的结构细分[22, 25]。III型RuBisCO存在于一些古细菌中。IV型RuBisCO被认为是RuBisCO相似的蛋白,在一级序列和三级结构水平上与RuBisCO相关,但不具有催化羧化和氧合的作用。非I型的RuBisCO分子的整体形状出现非球体[22, 25]。

a-RuBisCO四级结构的艾森伯格-贝克模型;b-RuBisCO全酶结构;c-还原条件下SDS-PAGE电泳凝胶
图1 RuBisCO的结构
Fig.1 The structure of RuBisCO
注:b由8个大亚基(深蓝色、浅蓝色)和8个小亚基(红色、橙色)组成,在两个相邻的大亚基之间形成的活性位点(黄色);c中左道为Marker蛋白分子质量标记,右道为RuBisCO (源自甜菜叶)。
在氨基酸组成方面,RuBisCO含有20种氨基酸,可作为苏氨酸、缬氨酸、异亮氨酸和亮氨酸等必需氨基酸的良好来源。在不同来源的叶蛋白中,必需氨基酸占总蛋白的46%~53%。另外,RuBisCO中天冬氨酸和谷氨酸残基与碱性组氨酸、精氨酸和赖氨酸的比值为1.25∶1.0,所以蛋白质呈轻度酸性[26]。使用 UniProtKB Align数据库研究从菠菜(Spinacia oleracea)、苜蓿(Medigaco sativa ) 和向日葵( Helianthus annuus) 中提取的RuBisCO,它们的大亚基的多肽链分别含有 473、472 和 483 个氨基酸残基,显示为 89.5%序列同源性和434个相同的位置,而小亚基则含有约123个氨基酸残基,序列同源性为70%~75%[27]。对于RuBisCO二级结构的研究发现,α-螺旋结构的含量为30%左右,β-结构的含量为50%左右,无规卷曲含量为20%左右;且大亚基富含β-结构,而小亚基富含α-螺旋结构。蛋白质的二级结构的比例与蛋白质的消化性存在必然的联系,特别是α-螺旋结构和β-结构[28]。二硫键和次级相互作用是连接蛋白质促成其复杂结构的重要作用力,RuBisCO含有90个巯基,约23个二硫键形成分子内—S—S—键;RuBisCO还具有较高的平均疏水性(1 275 kJ/mol氨基酸残基),仅次于酪蛋白(1 298 kJ/mol)[22]。
对RuBisCO结构解聚和聚合行为进一步研究发现,在3~4 mol/L的尿素条件下,维持蛋白质三级结构的作用力(氢键和疏水相互作用)会被破坏,小亚基会与大亚基分离,而在>5 mol/L的尿素的条件下,蛋白质二级结构被严重破坏,大亚基会解离为单体,这两个过程均为不可逆的变性。pH条件也会诱导亚基的解聚和聚合,在pH>11或者pH<2时,大小亚基发生不可逆的分离[29]。RuBisCO的解聚和聚合的有效调控有助于扩展其在其他领域的应用范围,然而目前仍然没有能实现其自组装的方法。
3 RuBisCO的提取与纯化工艺
植物叶蛋白通常被包裹在细胞壁内,使用胶体磨、均质机、小型压机或螺旋压榨机可对细胞进行机械式裂解,快速的破坏植物基质释放叶蛋白。在破壁过程中为了防止多酚和多酚氧化酶与蛋白质混合产生褐色的醌蛋白,通常在裂解前加入多酚氧化酶抑制剂来防止褐变,建议使用量小于1 g/L。同时,可以使用聚乙烯基聚吡咯烷酮(polyvinylpyrrolidone,PVPP)与多酚的结合,从而减小多酚与蛋白的结合[30]。通常叶汁天然pH值接近RuBisCO的等电点4.0~5.5,因此RuBisCO在叶片破碎后即趋向于沉淀状态,优选的提取缓冲液的pH值应>6[31],采用的缓冲液体系包括磷酸盐体系、Tris-HCl缓冲液体系。另外,也可以通过酸、碱加热法提取,但是提高pH值会加大对叶绿体的破坏,增加其他化合物的溶解(如多酚)。在破壁阶段,超声波、微波、酶处理等辅助手段可以加强对细胞的破坏,促进RuBisCO的溶出[32]。
蛋白提取之后通过酸沉法(盐酸、醋酸、柠檬酸、自然发酵)、盐析法[(NH4)2SO4、NaCl]、醇沉法或者超滤浓缩法得到一定纯度的粗蛋白。相比而言,超滤浓缩法得到的蛋白被证明具有良好的功能特性,且经济高效[10]。为得到更高质量的成品,可以进一步进行脱色、脱多酚等纯化处理。目前使用的脱色方法有机溶剂处理法、双氧水脱色法、吸附法和超临界CO2流体萃取技术。有机溶剂处理法可在低温下通过相似相溶原理在不破坏蛋白质的前提下实现脱色,但消耗的有机溶剂量较大[33]。H2O2通过破坏色素分子中生色基的共轭双键来脱色,其氧化能力在碱性条件下更强但稳定性较差。吸附法常用活性炭、硅藻土、树脂,最终脱色效果与温度、时间、脱色剂用量、溶液pH值有关[34-35]。对于树脂,DA201-C型大孔吸附树脂对苜蓿叶蛋白肽进行纯化,可提高46.95%的叶蛋白肽含量,降低81.88%的糖含量以及70.97%的盐和其他杂质含量[36];非离子交联芳香族聚合物AmberliteTM XAD 16树脂,能去除2/3的多酚物质,叶绿素保留量小于0.1%;Amberlite IRA900Cl也被发现能去除92%~95%的酚类,同时保留较多的肽组分[22]。另外,FAVATI等[37]利用超临界CO2流体对苜蓿叶蛋白中的胡萝卜素及叶黄素进行萃取,30 MPa以上的压力可除去90%的胡萝卜素。凝胶色谱法也被用于脱盐、脱多酚类物质,分离高纯度的RuBisCO,常用Q-sepharose FF 柱和Sephadex G75柱。然而,这些纯化方法在一定程度上会造成蛋白的损失,导致最终蛋白得率降低,且成本较高。干燥技术是获得终产品的最后一步,对最终蛋白的品质具有一定影响。传统的干燥方式有冷冻干燥、喷雾干燥、真空干燥和微波干燥。冷冻干燥对蛋白的破坏作用最小,得到的样品结构疏松,溶解度较大。但冷冻干燥成本较高,目前常用喷雾干燥。一些植物叶蛋白提取和纯化的实例见表2。
表2 RuBisCO提取和纯化典型实例
Table 2 Example of extraction and purification of RuBisCO

样品提取与纯化方法工艺参数得率/纯度参考文献苜蓿叶直接加热法料液比1∶2.5,90 ℃,3 min33.1%/62.3%[38]碱化加热法料液比1∶2,70 ℃,5 min,pH 1058.2%/63.76%[39]酸化加热法0.1 mol/L HCl调pH值到4.0,80° C,20 min,静置2 h26.20%/51.56%[40]微生物发酵法1 g发酵剂加到100 mL提取物中,35 ℃孵化12 h29.86%/57.19%[40]复合酶法料液比1∶40、纤维素酶(1.0×105 U/g)、果胶酶(1.0×105 U/g) 7∶3,酶用量8%,89 min,36 ℃54.78%/-[41]碱溶酸沉法料液比为 1∶7, 碱溶pH 10, 50 min,酸沉 pH 4.057.87%/87.38%[42]超滤+阴离子交换树脂pH 9.5,质量浓度30 g/L,分子截留量为10 kDa,4.49 m/s,40 ℃、离子交换Amberlite IRA900Cl61.0%/-[43]阴离子交换树脂+凝胶柱pH 8,用0.45 μm过滤,Q-sepharose FF柱处理后,使用Sephadex G75柱脱盐-/95%[44]枸杞叶酶法+酸沉料液比1∶9, 纤维素酶(酶活力 15 U/mL)加酶量30 U/g、120 min、35 ℃,酸沉pH 3.513.79%/-[45]
注:料液比均为g∶mL
综上,目前需要开发一种经济并高效的提取和纯化工艺,该工艺可以扩展到分离用于食品级应用的大量蛋白质,并理想地保留蛋白质的功能和营养。对于工艺控制要点,首先第一步是对原材料的选择,如本文第一部分提到的选择蛋白质含量高及其可提取性大的叶子作为原材料(季节因素、株龄及叶片位置因素);第二,减少不良反应的发生,包括脂质和多酚氧化或蛋白质水解。这些都有可能对蛋白质提取物的营养价值、感官特性和功能特性产生负面影响,蛋白质-醌复合物的形成不但会影响色泽,还会形成苦味;第三,可以考虑附加值子产品的开发,例如榨汁步骤后获得的纤维部分。
4 RuBisCO的理化特性
4.1 溶解度
RuBisCO的极性氨基酸残基位于蛋白质表面,非极性疏水侧链埋藏在分子内部的蛋白质,其三维结构高度符合油滴模型,具有较高的水溶性(表3)。pH值、温度、离子强度、二价阳离子的存在、蛋白质浓度和分离蛋白质的植物物种等因素都会影响蛋白质溶解度[46]。PREVOT-D’ALVISE等[47]观察到紫花苜蓿的RuBisCO溶解度受pH值影响很大,pH值为3时苜蓿RuBisCO溶解度为20%;pH值为10时溶解度为90%,继续升高pH值时溶解度可以达到100%。SHEEN等[48]通过比较烟草RuBisCO与大豆分离蛋白的溶解度,发现除了在pH值为6.0时,烟草RuBisCO的溶解度都高于大豆分离蛋白。来自不同植物物种的RuBisCO溶解度特性的差异归因于其小亚基的氨基酸组成的变化[22]。
表3 RuBisCO与商业蛋白理化特性的比较
Table 3 Comparison of physicochemical properties between RuBisCO and commercial proteins
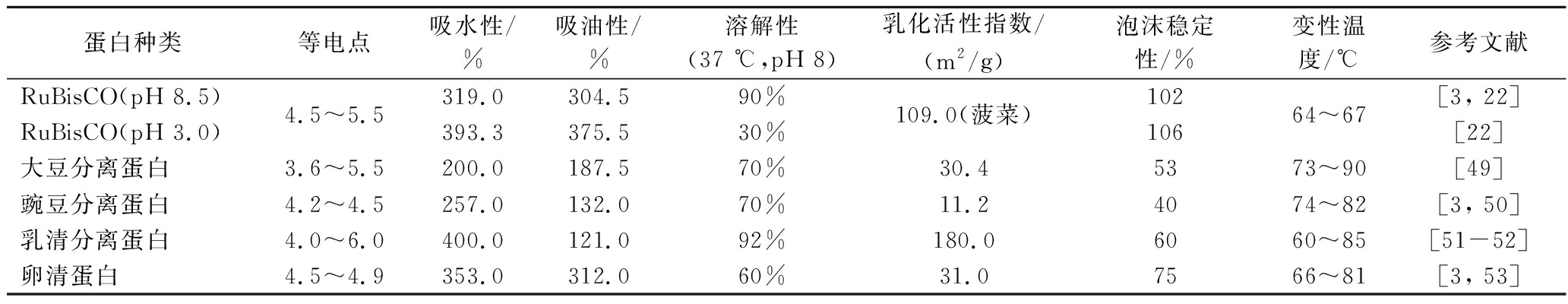
蛋白种类等电点吸水性/%吸油性/%溶解性(37 ℃,pH 8)乳化活性指数/(m2 /g)泡沫稳定性/%变性温度/℃参考文献RuBisCO(pH 8.5)RuBisCO(pH 3.0)4.5~5.5319.0304.590%393.3375.530%109.0(菠菜)10210664~67[3, 22][22]大豆分离蛋白3.6~5.5200.0187.570%30.45373~90[49]豌豆分离蛋白4.2~4.5257.0132.070%11.24074~82[3, 50]乳清分离蛋白4.0~6.0400.0121.092%180.06060~85[51-52]卵清蛋白4.5~4.9353.0312.060%31.07566~81[3, 53]
4.2 乳化性
乳化性是指蛋白质在各种食品基质中形成和稳定乳液的能力,疏水性、分子柔韧性和纯化步骤是影响蛋白质乳化性的主要因素。RuBisCO的乳化能力和乳化稳定性较强(表3),据LAMSAL等[54]报道,RuBisCO的乳化能力和乳化活性低于牛血清白蛋白,但高于蛋清蛋白。另外,与酸沉淀法制备的浓缩物相比,超滤法得到的苜蓿叶蛋白浓缩物乳化能力更强,这可能是因为超滤蛋白质样品中天然形式蛋白质的含量高于酸沉淀样品。HOJILLA-EVANGELISTA等[6]还发现苜蓿叶蛋白乳化性能随着pH值的增加而增加,这可能与蛋白质去折叠以及在碱性pH条件下油水界面增加有关。研究还证明,乳剂的表观黏度随着蛋白质和/或玉米油浓度的增加而增加,且由4%~6% pH 3.0 的RuBisCO和40%玉米油制成的乳液具有均匀的稠度和坚固的质地,类似于布丁,相比之下pH 8.0表观黏度则显著降低[22]。
4.3 起泡性
在泡沫形成过程中,蛋白质必须快速吸附到空气泡表面,使空气一水界面的张力降低。苜蓿RuBisCO的泡沫膨胀和泡沫稳定性超过卵清蛋白[6](表3)。HOJILLA-EVANGELISTA等[6]用紫花苜蓿RuBisCO浓缩物置于不同的pH条件,观察到在pH 7.0或10.0时,泡沫非常不稳定并在1.5 h内消失;而在pH 4.5下制备的泡沫随着时间的延长非常稳定,并在2 h内保持大约相同的体积,且用pH 3.0 的RuBisCO制备的泡沫比蛋清蛋白、乳清蛋白和大豆蛋白更稳定。值得一提的是,DUCROCQ等[55]在面团中加入0~33%的菊苣RuBisCO,发现其在面团水合和混合过程中能够形成弱键和共价键,在加热的过程中保持面团的弹性,且相比于小麦蛋白和豌豆蛋白,RuBisCO可形成相对细小的面筋蛋白网络,不会形成微观可见的聚集结构(图2),这说明了RuBisCO作为食品配方中小麦面筋替代品的适宜性。
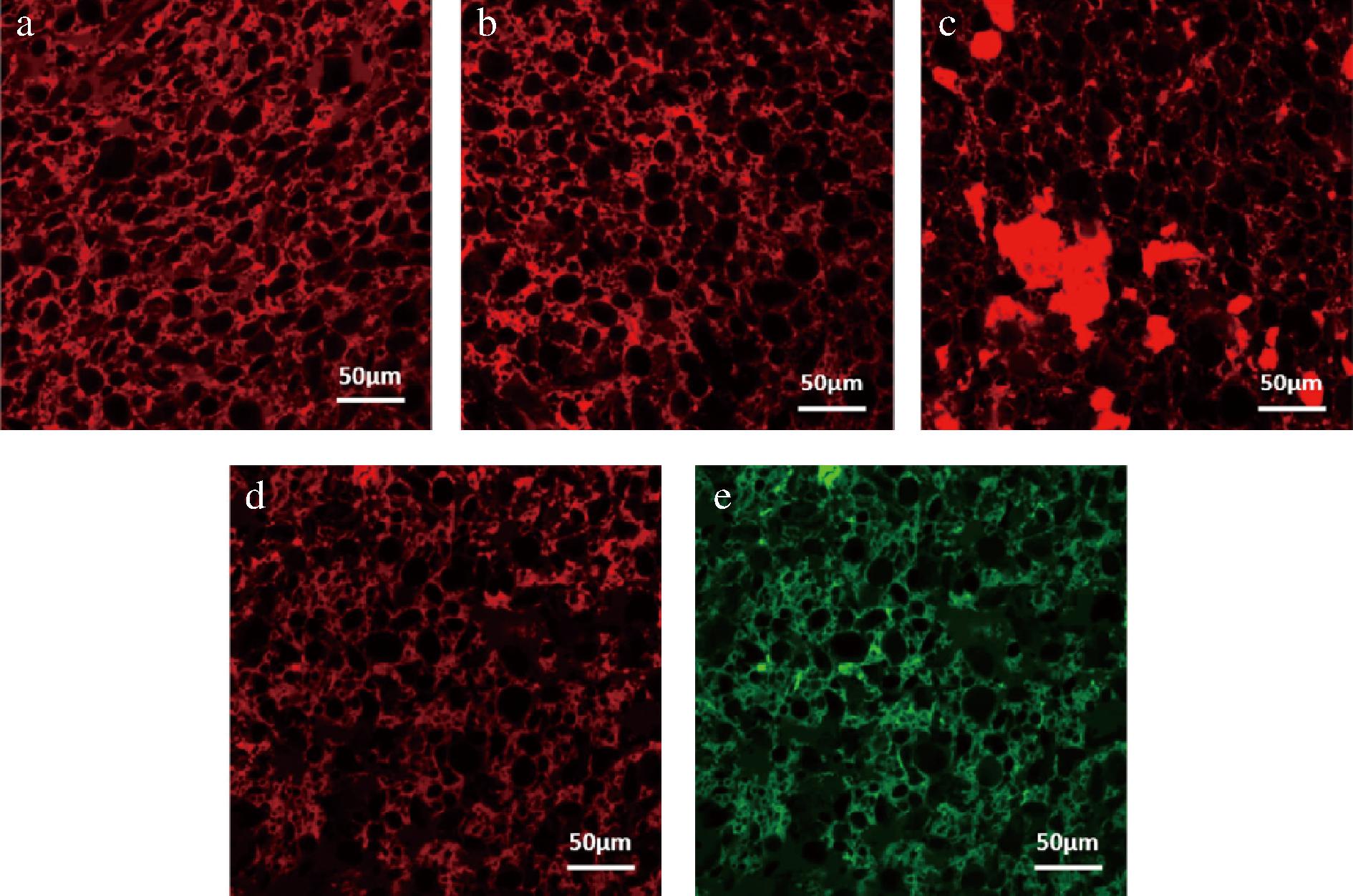
a-对照小麦面团;b-富含29.6%谷蛋白的面团;c-富含33%豌豆蛋白的面团;d1,d2-富含31.9% RuBisCO的面团
图2 RuBisCO添加的面团的微观结构
Fig.2 Microstructure of dough added by RuBisCO
4.4 凝胶性
蛋白质的凝胶性是其分子聚集的现象,可以形成具有弹性的蛋白质网络结构。如表3所示,RuBisCO与动物蛋白和传统植物蛋白相比显示出较低的变性温度,低变性温度使RuBisCO在加热条件下只需较低浓度就能够快速形成凝胶。据研究,RuBisCO的临界凝胶浓度<2.5%,并且储能模量G′及凝胶化电位较高,易形成较弱的和具有脆性的凝胶网络[44]。在甜菜叶RuBisCO的研究中发现,在浓度为50 g/kg时形成了自支撑凝胶,而乳清蛋白和大豆蛋白则需要更高的浓度[56]。ZHOU等[3]使用10%的RuBisCO溶液在pH值为8的条件下成功制作出植物基蛋清类似物,它的凝胶比蛋清更脆、更不耐嚼(图3)。另有研究指出,10% RuBisCO储能模量(G′)为104 kPa,远高于蛋清蛋白和乳清蛋白[57]。蛋白质构象变化是蛋白质分子聚集的先决条件,最终的凝胶强度主要由冷却过程中形成的氢键和疏水相互作用决定,高温、短时间挤压或谷氨酰胺转胺酶处理可以部分改善蛋白质的凝胶特性。值得一提的是,脆性和感知味觉强度之间具有相关性,脆性凝胶往往会分解成许多小碎片,导致碎片与口腔组织之间的接触面积更大,风味化合物受体(如盐、糖和肽)与味道的相互作用率更高[57]。
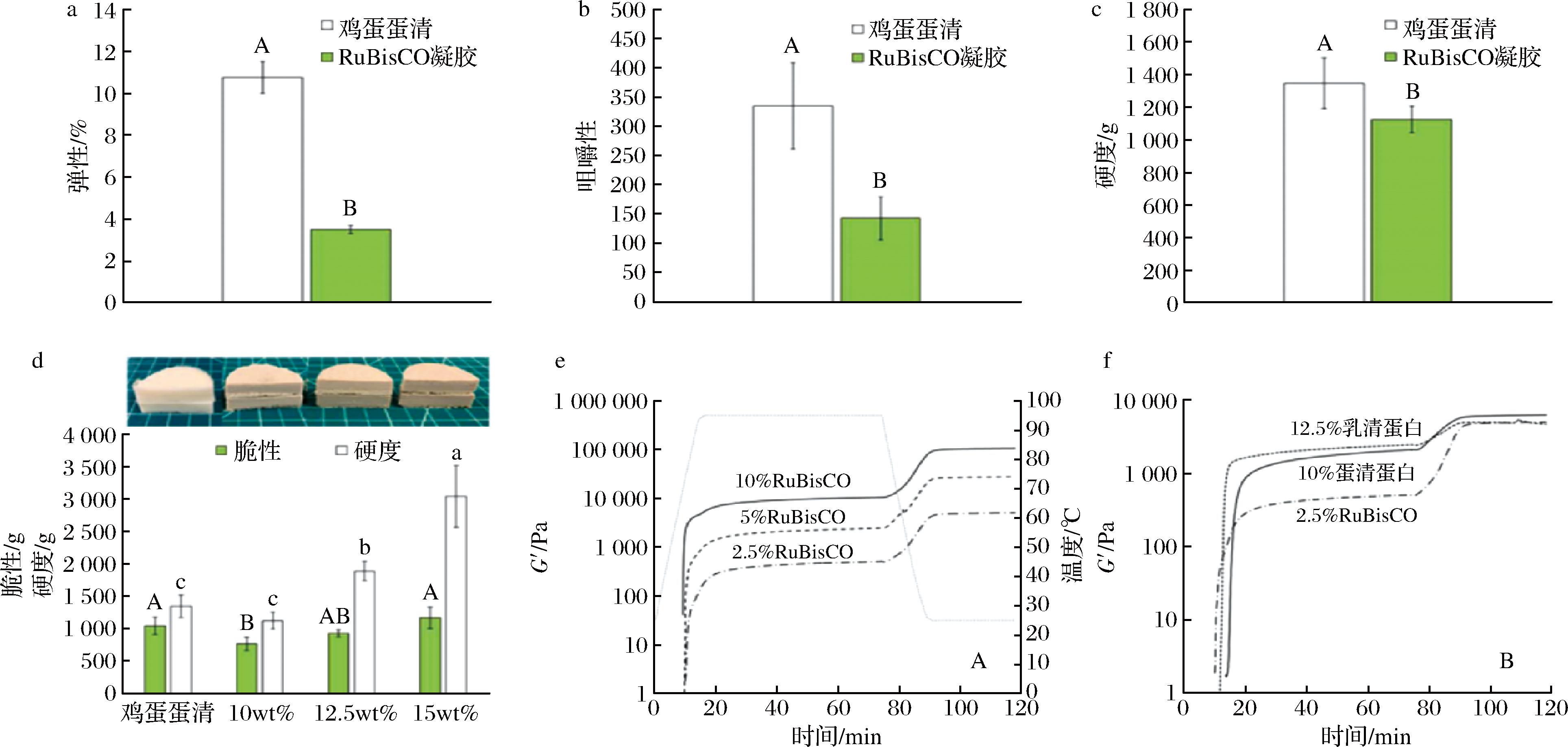
a-弹性;b-咀嚼性;c-硬度;d-不同浓度RuBisCO (pH=8)的脆性和硬度;e-RuBisCO凝胶的储能模量;f-RuBisCO凝胶与其他蛋白储能模量的对比
图3 RuBisCO的凝胶特性[3, 44]
Fig.3 Gel characteristics of RuBisCO[3, 44]
4.5 营养与功能特性
RuBisCO的质量、维生素、矿物质浓度以及脂肪酸组成与植物种子不同。豆科植物种子通常缺乏蛋氨酸,谷物种子通常缺乏赖氨酸,而RuBisCO符合粮农组织规定的一种类似于动物性食品的完整蛋白的标准。从烟草叶中纯化的RuBisCO (PER 3.0) 的营养价值 (蛋白质效率比, PER) 略优于酪蛋白 (PER 2.8)[2]。同时,RuBisCO作为叶蛋白的提取物是维生素的良好来源,如β-胡萝卜素(维生素原a)、B6、B12、维生素E和维生素K,以及铁、钙和镁。所以,RuBisCO营养价值的利用有利于改善人类饮食结构。RuBisCO还具有良好的消化性,在体内可被蛋白水解瘤胃细菌迅速降解。BARBEAU[58]利用绵羊瘤胃液进行体外实验发现水解率下降的程度为:酪蛋白>RuBisCO>牛血清白蛋白。FU等[59]表明菠菜RuBisCO在体外被胃蛋白酶消化会在30 s内迅速降解,且不会引发小鼠免疫反应,且大亚基的溶解和降解比小亚基更快。
对于RuBisCO的功能特性,已知RuBisCO的大、小亚基中的多肽具有12和13种不同的健康相关生物活性(如ACE抑制剂、DPP4抑制剂、免疫调节、刺激、抗氧化、激活泛素介导的蛋白水解、抗血栓、抗遗忘)[60]。其中,最主要的是在外源蛋白酶的作用下释放二肽基肽酶(dipeptidyl peptidase-4,DPP)-IV活性的肽,且半胱氨酸蛋白酶比丝氨酸和天冬氨酸蛋白酶释放更多的DPPIV抑制肽;其次较多的ACE抑制特性肽。来源于菠菜的RuBisCO的IC50值分别为56、120 μg /mL,对自发性高血压大鼠(spontaneously hypertensive rats,SHR)有降压作用[61]。另外,研究发现RuBisCO的小亚基可产生具有抑菌和促分泌特性的生物活性肽[62]。目前已发现的生物活性肽及功能见表4[63]。
表4 RuBisCO生物活性肽
Table 4 RuBisCO bioactive peptide

应用来源肽序列/条件功能生物活性肽菠菜叶苜蓿叶藻类Met-Arg-Trp Tyr-Pro-Leu-Asp-LeuTyr-Pro-Leu-Asp-Leu-PheIle-Ala-Tyr-Lys-Pro-Ala-GlyVal-Trp Val-Trp-Ile-SerMet-Arg-Trp-Arg-AspLeu-Arg-Ile-Pro-Val-Ala Ile-Ala-TyrIle-Ala-Tyr-Lys-Pro,Lys-Pro-Met-Asp-AsnAsn-Arg-Asn-Ala-CysLeu-Arg-Asp-Asp-PheTyr-Pro-Ile-Asp-Leu-Phe抗焦虑症抗焦虑症增强记忆降压降压、改善血管内皮功能和心功能抗菌和降压活性抗神经性疼痛
5 结论
本文综述了RuBisCO的来源、结构、提取方法、理化特性及营养与功能特性,展示了其作为一种具有丰富来源的蛋白质部分或者全部代替动物蛋白和传统植物蛋白,并用以缓解大量的动物蛋白摄入带来的环境问题和健康问题的潜力。RuBisCO资源的有效利用对于发掘植物资源和农业科研优势,促进国内植物叶蛋白的工业化与标准化及最终改善人类的饮食结构具有重要的意义。然而,目前对于RuBisCO产品开发的研究仍然比较少,这可能是受到提取成本及产品质量的限制。在未来的研究中,一方面要开发操作简单、成本低,有效的分离和纯化方法,且将源自RuBisCO的生物活性肽的健康益处在人类受试者中得到进一步证实。另一方面,研究者应充分探究利用现有RuBisCO结构的独特性,实现其自组装,开发其在其他领域,如医学和材料学方面的应用前景。
[1] HAYER-HARTL M, HARTL F U.Chaperone machineries of RuBisCO-the most abundant enzyme[J].Trends in Biochemical Sciences, 2020, 45(9):748-763.
[2] VON CAEMMERER S.RuBisCO carboxylase/oxygenase:From the enzyme to the globe:A gas exchange perspective[J].Journal of Plant Physiology, 2020, 252:153240.
[3] ZHOU H L, VU G, MCCLEMENTS D J.Formulation and characterization of plant-based egg white analogs using RuBisCO protein[J].Food Chemistry, 2022, 397:133808.
[4] PÉREZ-VILA S, FENELON M A, O’MAHONY J A, et al.Extraction of plant protein from green leaves:Biomass composition and processing considerations[J].Food Hydrocolloids, 2022, 133:107902.
[5] KU M S B, SCHMITT M R, EDWARDS G E.Quantitative determination of RuBP carboxylase-oxygenase protein in leaves of several C3 and C4 plants[J].Journal of Experimental Botany, 1979, 30(1):89-98.
[6] HOJILLA-EVANGELISTA M P, SELLING G W, HATFIELD R, et al.Extraction, composition, and functional properties of dried alfalfa (Medicago sativa L.) leaf protein[J].Journal of the Science of Food and Agriculture, 2017, 97(3):882-888.
[7] WU Z L, SHU T, ZHANG M W, et al.Foam fractionation for effective recovery of leaf protein from alfalfa (Medicago sativa L.) [J].Separation Science and Technology, 2020, 55(7):1388-1397.[8] MCCREE K J.Maintenance requirements of white clover at high and low growth Rates1[J].Crop Science, 1982, 22(2):345-351.
[9] MØLLER A H, HAMMERSHØJ M, DOS PASSOS N H M, et al.Biorefinery of green Biomass─How to extract and evaluate high quality leaf protein for food?[J].Journal of Agricultural and Food Chemistry, 2021, 69(48):14341-14357.
[10] SHI W Y, LI H B, ZENG X H, et al.The extraction of tobacco protein from discarded tobacco leaf by hollow fiber membrane integrated process[J].Innovative Food Science &Emerging Technologies, 2019, 58:102245.
[11] CAI M, MU L, WANG Z L, et al.Assessment of mulberry leaf as a potential feed supplement for animal feeding in P.R.China[J].Asian-Australasian Journal of Animal Sciences, 2019, 32(8):1145-1152.
[12] CALDER N-CHIU C, CALDER
N-CHIU C, CALDER N-SANTOYO M, HERMAN-LARA E, et al.Jackfruit (Artocarpus heterophyllus Lam) leaf as a new source to obtain protein hydrolysates:Physicochemical characterization, techno-functional properties and antioxidant capacity[J].Food Hydrocolloids, 2021, 112:106319.
N-SANTOYO M, HERMAN-LARA E, et al.Jackfruit (Artocarpus heterophyllus Lam) leaf as a new source to obtain protein hydrolysates:Physicochemical characterization, techno-functional properties and antioxidant capacity[J].Food Hydrocolloids, 2021, 112:106319.
[13] ISLAM M M, AKTHER S M, SUJON S A, et al.Effects of vermicompost and PK on growth and protein content of spinach (Spinacia oleracia L.) [J].Bangladesh Journal of Botany, 2020, 49:141-146.
[14] AKYÜZ A, ERSUS S.Optimization of enzyme assisted extraction of protein from the sugar beet (Beta vulgaris L.) leaves for alternative plant protein concentrate production [J].Food Chemistry, 2021, 335:127673.
[15] PEROVI J,
J,  APONJAC V T, KOJI
APONJAC V T, KOJI J, et al.Chicory (Cichorium intybus L.) as a food ingredient- Nutritional composition, bioactivity, safety, and health claims:A review[J].Food Chemistry, 2021, 336:127676.
J, et al.Chicory (Cichorium intybus L.) as a food ingredient- Nutritional composition, bioactivity, safety, and health claims:A review[J].Food Chemistry, 2021, 336:127676.
[16] YEOH H H, CHEW M Y.Protein content and amino acid composition of cassava leaf[J].Phytochemistry, 1976, 15(11):1597-1599.
[17] ABEROUMAND A.Nutritional evaluation of edible Portulaca oleracia as plant food[J].Food Analytical Methods, 2009, 2(3):204-207.
[18] TAYLOR J, ZHANG K, WANG D.Industrial and Nonfood Applications [M]//TAYLOR J R N, DUODU K G.Sorghum and Millets (Second Edition).Saint Paul, Minnesota:AACC International Press,2019:393-420.
[19] RAHMAN S, VANCE G F, MUNN L C.Salinity induced effects on the nutrient status of soil, corn leaves and kernels[J].Communications in Soil Science and Plant Analysis, 1993, 24(17-18):2251-2269.
[20] BASSI D, MENOSSI M, MATTIELLO L.Nitrogen supply influences photosynthesis establishment along the sugarcane leaf[J].Scientific Reports, 2018, 8(1):2327.
[21] MANGAN J L.2.1 the nitrogenous constituents of fresh forages[J].BSAP Occasional Publication, 1982, 6:25-40.
[22] YU Y F, KLEUTER M, TAGHIAN DINANI S, et al.The role of plant age and leaf position on protein extraction and phenolic compounds removal from tomato (Solanum lycopersicum) leaves using food-grade solvents[J].Food Chemistry, 2023, 406:135072.
[23] KIM H, PARK J, LIM S, et al.Cryo-EM structures of GroEL:ES2 with RuBisCO visualize molecular contacts of encapsulated substrates in a double-cage chaperonin[J].iScience, 2022, 25(1):103704.
[24] GALMÉS J, CAP -BAUÇ
-BAUÇ S, NIINEMETS Ü, et al.Potential improvement of photosynthetic CO2 assimilation in crops by exploiting the natural variation in the temperature response of RuBisCO catalytic traits[J].Current Opinion in Plant Biology, 2019, 49:60-67.
S, NIINEMETS Ü, et al.Potential improvement of photosynthetic CO2 assimilation in crops by exploiting the natural variation in the temperature response of RuBisCO catalytic traits[J].Current Opinion in Plant Biology, 2019, 49:60-67.
[25] SPREITZER R J.Questions about the complexity of chloroplast ribulose-1, 5-bisphosphate carboxylase/oxygenase[J].Photosynthesis Research, 1999, 60(1):29-42.
[26] ANDERSSON I, BACKLUND A.Structure and function of rubisco[J].Plant Physiology and Biochemistry, 2008, 46(3):275-291.
[27] SPREITZER R J.Genetic dissection of rubisco structure and function[J].Annual Review of Plant Physiology and Plant Molecular Biology, 1993, 44(1):411-434.
[28] DU X J, SUN Y Y, PAN D D, et al.Change of the structure and the digestibility of myofibrillar proteins in Nanjing dry-cured duck during processing[J].Journal of the Science of Food and Agriculture, 2018, 98(8):3140-3147.
[29] GREENFIELD N J.Using circular dichroism spectra to estimate protein secondary structure[J].Nature Protocols, 2006, 1(6):2876-2890.
[30] AMER B, JUUL L, MØLLER A H, et al.Improved solubility of proteins from white and red clover- inhibition of redox enzymes [J].International Journal of Food Science &Technology, 2021, 56(1):302-311.
[31] EDWARDS R H, MILLER R E, DE FREMERY D, et al.Pilot plant production of an edible white fraction leaf protein concentrate from alfalfa[J].Journal of Agricultural and Food Chemistry, 1975, 23(4):620-626.
[32] XU Y, LI Y T, BAO T, et al.A recyclable protein resource derived from cauliflower by-products:Potential biological activities of protein hydrolysates[J].Food Chemistry, 2017, 221:114-122.
[33] DU J, SHI J C, OBADI M, et al.Decolorization of commercial zein via protein precipitation involving organic solvents at low temperatures[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2020, 596:124738.
[34] 金伟丽, 郑国栋, 黎冬明.硅藻土对米渣蛋白脱色工艺的研究[J].粮食与油脂, 2016, 29(3):50-52.JIN W L, ZHENG G D, LI D M.Study on the diatomite decoloration process of rice residue protein[J].Cereals &Oils, 2016, 29(3):50-52.
[35] 王松, 李成辉, 王洪彩, 等.大豆肽的硅藻土脱色工艺优化[J].中国油脂, 2020, 45(6):41-44.WANG S, LI C H, WANG H C, et al.Optimization of bleaching of soybean peptide by diatomite[J].China Oils and Fats, 2020, 45(6):41-44.
[36] 许英一, 吴红艳, 王宇, 等.大孔树脂纯化苜蓿叶蛋白肽的工艺优化[J].食品与机械, 2019, 35(5):167-171.XU Y Y, WU H Y, WANG Y, et al.Optimization on purification technology of alfalfa leaf protein peptide bymacroporous adsoption resin[J].Food &Machinery, 2019, 35(5):167-171.
[37] MA G X, YANG W J, FANG Y, et al.Antioxidant and cytotoxicites of Pleurotus eryngii residue polysaccharides obtained by ultrafiltration[J].LWT, 2016, 73:108-116.
[38] 吴万灵, 韩鲁佳, 王唯涌.苜蓿叶蛋白提取工艺参数优化试验研究[J].中国农业大学学报, 2006, 11(5):65-69.WU W L, HAN L J, WANG W Y.Experimental study on parameter optimization of extraction process of leaf protein from alfalfa[J].Journal of China Agricultural University, 2006, 11(5):65-69.
[39] 李道娥, 刘向阳, 韩鲁佳, 等.加热法提取叶蛋白的工艺研究[J].农业工程学报, 1998, 14(1):238-242.LI D E, LIU X Y, HAN L J, et al.Study on the technology of extracting leaf protein by heating[J].Transactions of the Chinese Society of Agricultural Engineering, 1998, 14(1):238-242.
[40] PANDEY V N, SRIVASTAVA A K.A simple, low energy requiring method of coagulating leaf proteins for food use[J].Plant Foods for Human Nutrition, 1993, 43(3):241-245.
[41] 辛小丽. 紫花苜蓿叶蛋白的提取及其功能特性的改善研究[D].西宁:青海师范大学, 2020.XIN X L.Extraction of alfalfa leaf protein and improvement of its functional properties[D].Xining:Qinghai Normal University, 2020.
[42] 谢正军. 苜蓿叶蛋白和酶法制备抗氧化肽的研究[D].无锡:江南大学, 2009.XIE Z J.Study on the alfalfa leaf protein and preparation of antioxidant peptides by enzymic hydrolyzing[D].Wuxi:Jiangnan University, 2009.
[43] D’ALVISE N, LESUEUR- L A M B E R T C, FERTIN B, et al.Removal of polyphenols and recovery of proteins from alfalfa white protein concentrate by ultrafiltration and adsorbent resin separations[J].Separation Science and Technology, 2000, 35(15):2453-2472.
[44] MARTIN A H, NIEUWLAND M, DE JONG G A H.Characterization of heat-set gels from RuBisCO in comparison to those from other proteins[J].Journal of Agricultural and Food Chemistry, 2014, 62(44):10783-10791.
[45] 李明. 枸杞叶蛋白提取及应用研究[D].武汉:武汉轻工大学, 2020.LI M.Study on the extraction and application of Lycium barbarum leaf protein[D].Wuhan:Wuhan Polytechnic University, 2020.
[46] YOUSEFI N, ABBASI S.Food proteins:Solubility &thermal stability improvement techniques[J].Food Chemistry Advances, 2022, 1:100090.
[47] PREVOT-D’ALVISE N, LESUEUR-LAMBERT C, FERTIN-BAZUS A, et al.Continuous enzymatic solubilization of alfalfa proteins in an ultrafiltration reactor[J].Enzyme and Microbial Technology, 2004, 34(5):380-391.
[48] SHEEN S J, SHEEN V L.Functional properties of fraction 1 protein from tobacco leaf[J].Journal of Agricultural and Food Chemistry, 1985, 33(1):79-83.
[49] 莫耽, 黄行健, 段雅庆, 等.辐照对大豆分离蛋白功能特性影响[J].食品科学, 2011, 32(1):52-55.MO D, HUANG X J, DUAN Y Q, et al.Effect of irradiation on functional properties of soybean protein isolate[J].Food Science, 2011, 32(1):52-55.
[50] TAHERIAN A R, MONDOR M, LAMARCHE F.Enhancing nutritional values and functional properties of yellow pea protein via membrane processing [J].Peas:Cultivation, Varieties and Nutritional Uses, 2012:1-48.
[51] 郭本恒, 骆承庠.乳清蛋白变性的测定方法[J].中国乳品工业, 1994, 22(5):221-224.GUO B H, LUO C X.Method for determination of denaturation of whey protein[J].China Dairy Industry, 1994, 22(5):221-224.
[52] PELEGRINE D H G, GASPARETTO C A.Whey proteins solubility as function of temperature and pH[J].LWT- Food Science and Technology, 2005, 38(1):77-80.
[53] SHARMA H P, MADAN A, JOSHI D C.Clarifying Agents [M]//MELTON L, SHAHIDI F, VARELIS P.Encyclopedia of Food Chemistry.Oxford;Academic Press,2019:53-60.
[54] LAMSAL B P, KOEGEL R G, GUNASEKARAN S.Some physicochemical and functional properties of alfalfa soluble leaf proteins[J].LWT- Food Science and Technology, 2007, 40(9):1520-1526.
[55] DUCROCQ M, BOIRE A, ANTON M, et al.Rubisco:A promising plant protein to enrich wheat-based food without impairing dough viscoelasticity and protein polymerisation[J].Food Hydrocolloids, 2020, 109:106101.
[56] MARTIN A H, CASTELLANI O, DE JONG G A, et al.Comparison of the functional properties of RuBisCO protein isolate extracted from sugar beet leaves with commercial whey protein and soy protein isolates[J].Journal of the Science of Food and Agriculture, 2019, 99(4):1568-1576.
[57] SPOTTI M J, TARHAN Ö, SCHAFFTER S, et al.Whey protein gelation induced by enzymatic hydrolysis and heat treatment:Comparison of creep and recovery behavior[J].Food Hydrocolloids, 2017, 63:696-704.
[58] BARBEAU W E.Functional properties of leaf proteins:Criteria required in food applications[J].Italian Journal of Food Science, 1990, 2(4):213-225.
[59] FU T J, ABBOTT U R, HATZOS C.Digestibility of food allergens and nonallergenic proteins in simulated gastric fluid and simulated intestinal fluid: A comparative study[J].Journal of Agricultural and Food Chemistry, 2002, 50(24):7154-7160.
[60] KANDEMIR-CAVAS C, PÉREZ-SANCHEZ H, MERT-OZUPEK N, et al.In silico analysis of bioactive peptides in invasive sea grass Halophila stipulacea[J].Cells, 2019, 8(6):557.
[61] SAITO Y, WANEZAKI K, KAWATO A, et al.Antihypertensive effects of peptide in sake and its by-products on spontaneously hypertensive rats[J].Bioscience, Biotechnology, and Biochemistry, 1994, 58(5):812-816.
[62] KOBBI S, BALTI R, BOUGATEF A, et al.Antibacterial activity of novel peptides isolated from protein hydrolysates of RuBisCO purified from green juice alfalfa[J].Journal of Functional Foods, 2015, 18:703-713.
[63] STEFANO E D, AGYEI D, NJOKU E N, et al.Plant RuBisCO:An underutilized protein for food applications[J].Journal of the American Oil Chemists’ Society, 2018,95:1063-1074.