近年来,随着消费者健康意识的增强,天然、营养、新鲜、原味鲜榨果汁已经成了新的消费趋势。天然混浊汁(如苹果汁、柑橘汁、西瓜汁、菠萝汁等)因其具有最少加工、营养丰富、口味纯正的优势,备受消费者青睐。滋味和香气是果汁品质的关键指标之一,其中滋味物质,即混浊汁体系中的非挥发性成分,有果胶、蛋白、多酚、糖、有机酸及其盐溶液等,而果汁香气有贡献的化合物多达上百种,主要包括醇类、酯类、醛类、酚类和萜烯类物质[1]。虽然气味印象是食物感知的第一步,但在食物被食用或饮用时的口服阶段气味感知仍在继续进行,这也表明香气物质对果汁品质评价是极为重要的。其中,香气从食物中的释放主要受两个因素调控:(1)分配因素,用来描述香气化合物在静态体系中与基质成分的亲和作用,如空气-水相分配系数、油-水分配系数;(2)质量传递(动态因素),用来描述食物中非挥发性成分通过物化相互作用、直接或间接的化学反应来影响香气化合物的释放。由此可见,果汁中香气化合物的释放程度可能受到香气化合物本身性质及基质组分的相互作用的影响[2-3]。
果胶作为最重要的云状颗粒组分,它不仅影响果汁稳定性和口感,还可以通过物理截留方式抑制香气化合物的动态变化,或通过各种相互作用力影响果汁中香气化合物的保留和释放[4]。但由于果汁体系的复杂性以及果胶和香气化合物自身结构和性质的特异性,非常难以全面而准确的了解果汁体系中果胶和香气化合物间相互作用的本质和规律。果胶对香气化合物释放的影响主要取决于果胶和香气物质自身的性质如果胶酯化度、摩尔质量和香气物质的溶解性、极性等。除此之外,果汁体系中的其他基质成分也会影响果胶和芳香物质间的结合作用,如糖、盐和矿物质离子等。PAN等[5]研究了糖浓度对芒果汁中香气物质释放的影响,发现低浓度糖通过产生盐析效应来降低疏水香气化合物溶解度,进而提升芳香化合物的释放效果,而高浓度糖则会增大溶液黏度进而保留大部分香气物质。此外,香气化合物在一些环境因素的影响下和果胶的结合作用会受到不同程度的影响,温度、盐、pH值的变化通过改变香气化合物的溶解性导致果汁风味呈现不同的释放模式。由此可见,如何通过利用果汁中天然组分间物理、化学交互作用来提高饮料的风味和稳定性显得尤为重要。目前对果汁中云状颗粒组分与香气成分的提取、分析及生理活性的研究已经取得了很大的进展,而关于混浊汁基质成分与香气物质间结合作用的本质及规律却鲜有报道。因此,了解香气化合物与果胶间的研究方法、相互作用机制和影响因素有助于调控果汁中风味物质的释放和保留,满足消费需求和市场需求。
本文综述了果胶的组成和结构,以及果胶与香气物质间相互作用的测定方法和机制,并探讨了影响果胶-香气化合物结合的主要因素,可为提高和稳定果汁的香气提供理论参考。
1 果胶的组成和结构
水果是果胶的主要来源,90%以上的商业果胶来自于水果的副产品。据资料显示,柑橘果皮中含有20%~30%的果胶,苹果渣含有15%~18%的果胶[6-7]。果胶是一类广泛存在于陆生植物细胞壁中的支链阴离子多糖,其相对分子质量介于50~300 kDa,具有改善肠道、抗肿瘤、抗氧化等多种生理功能[8]。如图1所示,果胶作为多糖聚合物,其主链由D-半乳糖醛酸以α-1,4-糖苷键连接组成,侧链隔一定距离与主链相连,除此之外,侧链上还含有半乳糖和阿拉伯糖等中性糖分子。果胶按结构不同可分为同型半乳糖醛酸聚糖、I型鼠李半乳糖醛酸聚糖和II型鼠李半乳糖醛酸聚糖[9]。果胶的分子结构与其功能活性有着密切关系,而这些结构特性(如酯化度、甲氧基分布程度、溶解度和流变性等)对果胶与果汁中其他物质的相互作用(如与香气的结合或与钙离子的交联作用)均有影响[10]。果胶甲基酯化区域良好的疏水特性可结合更多具有疏水特性的香气物质[11]。果蔬基质中主要有3种不同的果胶组分,分别是水溶性果胶(water solubilized pectin fraction,WSF)、螯合剂可溶性果胶(chelator solubilized pectin fraction,CSF)和碳酸钠可溶性果胶(sodium carbonate solubilized pectin fraction,NSF),这3种果胶不仅在不同溶液中的增溶性不同,其结构和性质也有很大差异[12]。WSF是通过非共价键和非离子键与细胞壁松散结合的果胶聚合物,CSF主要由离子交联的果胶组成,而NSF主要通过共价酯键与细胞壁多糖结合[13]。因此,WSF具有较小的尺寸和较高的水溶性,其性质是影响果汁体系黏度的重要因素,而CSF和NSF通常是高摩尔质量、强疏水性和低酯化度,主要与果汁体系的稳定性和香气释放有关[14]。
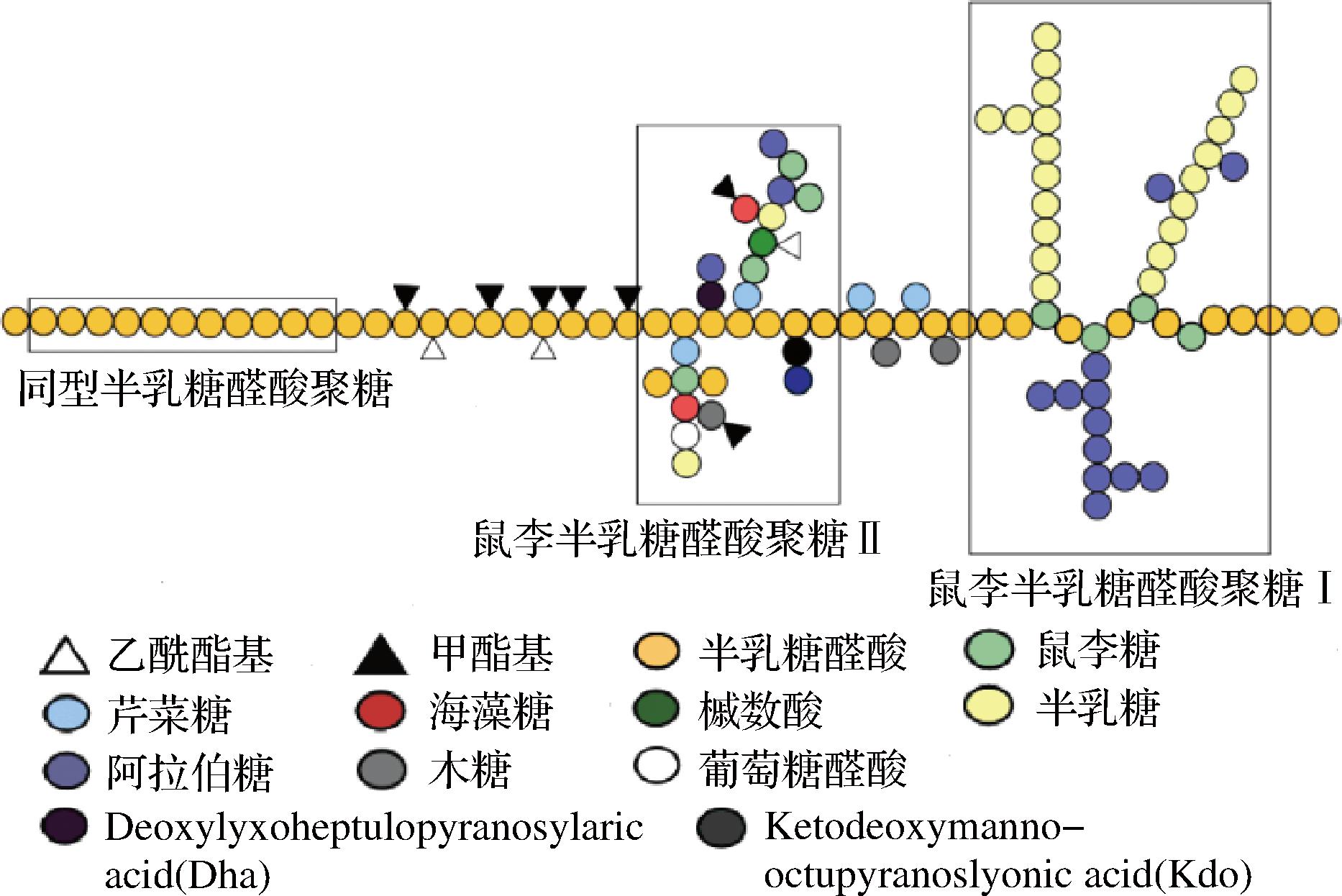
图1 果胶组分和结构[15]
Fig.1 Composition and structure of pectin[15]
2 果胶与香气化合物相互作用的研究方法
基于果胶组分和分子结构的多重差异,以及果汁体系的复杂性,增加了解析果胶与香气化合物间相互作用的难度。根据分析原理,可将果胶与香气化合物相互作用的研究方法分为直接法和间接法[16-22]。其中,直接法是依据果胶分子结构变化的谱学分析方法,通过分析添加香气前后果胶分子的结构变化,进而确定果胶与香气配体间的结合位置、主要作用力,判断果胶与香气物质间的结合作用程度。间接法是利用不同键破坏剂对果胶与风味物质相互作用键的影响,通过检测添加化学试剂前后风味物质与果胶混合溶液的顶空浓度,进一步确定果胶与不同类型风味化合物的相互作用力。
2.1 直接法
随着新检测技术方法的发现,关于非挥发性大分子物质与小分子间的相互作用研究层出不穷,其分析方法不断更迭,分析的准确性和科学性亦被不断推进。光谱学分析技术广泛用于揭示分子水平上挥发性物质与非挥发性物质之间的相互作用机制,常用技术主要包括紫外-可见吸收光谱、荧光淬灭光谱和傅里叶红外光谱等技术。此外,核磁共振(nuclear magnetic resonance, NMR)技术、独立梯度模型分析、分子动力学模型和热力学分析也可以用于评估果胶-香气复合物的形成。通过测定果胶-香气物质配合物的平衡常数(K)、吉布斯自由能(ΔGo)、焓变(ΔHo)、熵变(ΔSo)、结合常数(Ka)和结合位点数(n)等热力学参数来表征果胶与香气物质间的作用力类型和结合程度[23]。化学反应的平衡常数(K)和标准吉布斯自由能(ΔGo)均用于反映2种物质间结合能力的强弱或化学反应进行的程度,以此来量化相互作用力的大小。而化学反应的焓变(ΔHo)和熵变(ΔSo)可用于判断物质间的主要作用力类型和驱动力类型[24]。当ΔHo>0,ΔSo>0时,物质间的反应以疏水相互作用为主;当ΔHo<0,ΔSo>0时,静电作用在反应中起主要作用,ΔH<0和ΔSo<0时,氢键和范德华力在结合过程中的作用最显著[25]。
2.1.1 紫外-可见吸收光谱
紫外-可见吸收光谱是研究多糖与小分子之间相互作用的一种简单而有效地方法,联合紫外-可见吸收光谱和荧光淬灭光谱发现果胶使得苯乙醇在250~260 nm间的紫外吸收峰强度增大[26],可能是由于果胶的加入使得苯乙醇周围官能团的构象和微环境发生了变化。随着果胶浓度的增大,苯乙醇的最大吸收峰发生轻微的红移(从253 nm到258 nm),这表明果胶分子进一步诱导分子内效应,减小π-π*电子跃迁能隙,增加电子跃迁概率,最终导致苯乙醇的紫外-可见吸收光谱增宽。张瑜[24]利用紫外-可见吸收光谱,基于模拟体系分析了多糖与5种酯类物质间的相互作用机制,通过测定果胶与酯类混合溶液吸收光谱发现,混合溶液的最大吸收光度值不等于该吸收波长果胶与酯类单独的吸光度之和,该试验现象不符合朗伯比尔定律的加和性质,表明有新的复合物生成。进一步测定反应过程中的平衡常数(K)、吉布斯自由能(ΔGo)、焓变(ΔHo)、熵变(ΔSo),结果显示氢键是果胶与丁酸乙酯、乳酸乙酯和丁二酸二乙酯可逆结合的主要驱动力;而疏水相互作用在果胶与乙酸乙酯、乙酸异戊酯的结合中起主导作用。
2.1.2 荧光猝灭光谱
荧光猝灭光谱是表征生物分子间相互作用的重要技术,荧光猝灭是指猝灭分子由于激发态反应、分子重排、能量转移和基态复合物形成等各种分子相互作用导致荧光团荧光强度降低的现象[27]。根据相互作用的不同,荧光猝灭可分为动态猝灭和静态猝灭。其中,由碰撞所致的猝灭称为动态猝灭,而静态猝灭则是生成基态络合物引发的猝灭[28]。猝灭机制的判断需利用Stem-Volmer方程对荧光数据进行分析并计算其猝灭速率常数(KSV),若KSV值与温度变化趋势相反,则说明果胶与香气是静态猝灭,并生成了果胶-香气复合物。若KSV值与温度变化趋势一致,则说明果胶与香气间仅发生了碰撞,属于动态猝灭[29]。根据苯乙醇-果胶复合物的双对数图、位点结合模型和Stem-Volmer方程计算出配合物的结合位点数n值为1.15,可以推断果胶与苯乙醇的荧光基团之间存在一个结合位点。进一步分析计算发现,苯乙醇-果胶配合物的动态散射碰撞率常数(Kq)显著高于生物大分子与猝灭剂碰撞可达的最大速率常数[2×1010 L/(mol·S)],则说明苯乙醇与果胶的结合过程中仅存在静态猝灭[26]。
2.1.3 NMR
NMR已被广泛用于表征非挥发性物质与配体小分子之间的低亲和力相互作用,借助NMR各种参数如化学位移、线宽和驰豫时间来评估分子间或分子内的相互作用[21],根据这一特性可测定果蔬汁中基质组分与相关香气物质间的结合位点和结合模式。LI等[26]利用NMR技术测定分析番茄汁中果胶与苯乙醇的相互作用,结果显示苯乙醇与果胶结合后,其化学位移发生显著变化,且果胶中半乳糖醛酸的甲氧基相关质子信号显著降低,可能是由于果胶的半乳糖醛酸羧基残基与苯乙醇的羟基之间形成了氢键,进而放大了苯乙醇的去屏蔽作用,导致苯乙醇的质子信号向低频偏移,这也说明苯乙醇与果胶具有较好的结合亲和力。此外,FAURIE等[30]结合NMR技术、动态光散射和分子动力学模型检测三元配合物(糖、多酚和果胶)间的相互作用,通过分析判断唾液蛋白、多酚和多糖结合过程中的1H化学位移变化、NMR峰面积变化和复合物构象及大小等参数,发现糖类能通过减弱酚类物质与唾液蛋白的作用强度而间接地减弱葡萄酒中涩味的感知。因此,NMR技术在测定各种参数的基础上能在原子水平上深入了解多个物质之间的分子相互作用,并评估控制这种复杂相互作用的动力学参数。
2.1.4 分子对接
分子对接是指通过计算机软件,建立不同分子动力学模型下生物大分子-配体复合物的可能构象,进而揭示反应过程中的结合位点、结合位点处配体构象和相互作用力类型的新技术[22]。对于分子对接的研究起源于1894年FISCHER[31]提出的“锁钥模型”理论,即受体和配体间通过几何互补和能量匹配来完成结合作用。1958年,KOSHLAND[32]提出的“诱导契合”理论将受体和配体定义为柔性结构,不仅解释了一些受体和配体结合后构象明显改变的现象,也为分子对接提供了理论参考。分子对接技术在药物研发过程中常被用来筛选设计可以与靶点结合先导药物,如抗癌症药物筛选、酶抑制剂筛选和病毒药物筛选[33]等,此技术能显著提高药物筛选设计的成功率。除此之外,分子对接还能用于解释大分子受体与小分子配体间的互作机制,对结合反应的结论进行理论上的验证和补充。根据紫外-可见吸收光谱分析发现,糠醛、β-二氢紫罗兰酮、香叶醇均可以通过疏水作用力与索马甜相互作用,且通过热力学与分子对接结果进一步说明3种香气物质与索马甜分子相互作用的驱动力主要是疏水作用、氢键和静电相互作用,其具体的结合位点如图2所示[34]。

a-糠醛;b-β-二氢紫罗兰酮;c-香叶醇
图2 三种香气物质与索马甜的结合位点及二维相互作用图[34]
Fig.2 Binding site and 2D interaction diagram of thaumatin with three aromatic substances[34]
2.2 间接法
化学试剂破坏化学键的方法常被用来研究热诱导形成的蛋白凝胶网络结构涉及的相互作用力以及生物大分子间的相互作用力[35-41]。除此之外,该方法还可以通过在果胶-香气混合溶液中加入特定化学试剂来修饰或阻碍化学键的形成,分析其风味物质结合量的变化,进而评估果胶与风味化合物结合涉及的相互作用力及贡献度。若风味化合物的释放量增高,则此作用力对其结合贡献很大;若果胶与风味物质的结合不受影响,则此作用力对其结合没有贡献。而果胶与香气物质间的相互作用可能是与果胶带电基团结合的离子效应;也可能是氢键和疏水相互作用,针对非共价相互作用的化学物质有尿素、丙二醇、盐酸胍、Na2SO4和三氯乙酸钠[42]。常见的5种化学试剂分别破坏或增强的化学键如表1所示[43]。UTSUMI等[36]研究了各种试剂对凝胶形成和硬度的影响,发现球蛋白凝胶的硬度随丙二醇浓度的增加而增加,当体积分数高于10%时趋于平稳,而氢键和静电相互作用在弹性凝胶的形成中起重要作用。这与TANFORD[44]的研究结果一致,即丙二醇会减少疏水性的贡献,但会通过降低介电常数来增强氢键和静电相互作用。此外,URUAKPA等[40]证实高浓度的尿酸可以通过改变水的结构和增加疏水氨基酸侧链的溶解度来减弱氢键和疏水相互作用。沈雨思等[43]研究了苹果果胶与特征风味物质的相互作用机制,选取尿素、丙二醇、盐酸胍、Na2SO4和三氯乙酸钠等5种化学试剂作用于果胶-香气混合液,运用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)联合GC-MS检测试剂处理前后果胶与风味化合物结合量的变化,结果表明5种化学试剂均对苹果果胶产生了明显的破坏作用。其中,氢键和疏水相互作用在果胶与5种风味物质结合过程中起主导作用,且2-甲基丁基乙酸酯和乙酸己酯与果胶结合时,氢键和离子/静电相互作用的贡献可能大于或等于疏水相互作用。
表1 各种试剂对果胶与风味物质相互作用/键的影响[43]
Table 1 Effect of various reagents on the interactions/bonds between pectins and flavours[43]

试剂类型氢键疏水相互作用离子效应/静电相互作用尿素减弱减弱-丙二醇增强减弱增强盐酸胍抑制减弱抑制Na2SO4-增强-三氯乙酸钠-破坏多糖结构低浓度下与静电相互作用有关
注:-表示无影响。
研究果胶与小分子化合物相互作用的方法很多,本文基于分析原理归纳为直接法和间接法。直接法如紫外-可见吸收光谱、荧光猝灭光谱、NMR等技术在分子水平研究果胶与香气化合物的结合模式,通过研究果胶与风味物质间相互作用的亲和力、结合位点数以及结合热力学参数(焓变、熵变和吉布斯自由能)来阐明活性结合位点和结合作用类型[42]。该方法对样品需求量小,且操作方便快捷,检测精度高,但对检测设备要求高。间接法通过添加化学键破坏剂后,采用SPME联合GC-MS技术测定果胶与不同类型风味化合物结合量的变化,解析果胶与不同类型风味化合物结合涉及的相互作用力及贡献度。该方法仅测定不同类型风味化合物与果胶相互作用方式的结合参数,检测指标单一,设备要求相对不高,检测精度易受化学试剂类型、添加量等因素影响,且难以深入研究果胶与风味化合物的互作机制以及结合的热力学参数。
3 果胶与香气物质的作用机制
随着果胶与香气物质互作研究方法的创新和多种新方法的有机结合,为探明果胶与香气物质的作用机制提供了源动力。果胶和风味物质作为果汁体系中的重要组分,二者发生反应直接或间接造成风味损失或品质劣变,最终影响果汁商品属性,因此,解析果胶与香气物质的互作机制为保持果汁原有风味、提升品质、延长货架期提供了可行条件。
3.1 非共价键合作用
早期认为果胶可能会影响食物基质的风味释放,TERTA等[45]和BAINES等[46]提出果胶主要通过非共价键合和物理吸附2种方式实现对芳香物质的吸附保留。其中,果胶与芳香性化合物间的非共价作用主要是由氢键、疏水相互作用、微区截留和离子相互作用等介导的,这些方式常用于提高疏水性芳香化合物的保留率进而实现香气在果汁中缓慢释放[47]。此外,水胶体类型对挥发性化合物的分配系数有显著差异,由于静态条件下决定顶空浓度的是热力学因素,而不是传质因素,因此不同质地凝胶之间的差异可能源于挥发物-基质间的相互作用。进一步探究发现,果胶可以在食物基质中形成分子间氢键而导致更非极性的环境,这一特性促进了芳香性化合物通过疏水相互作用与果胶的结合[48]。根据紫外-可见光谱、荧光发射光谱和动态光散射分析,范德华力、氢键、疏水和静电相互作用在苯乙醇-果胶配合物的形成中起主导作用[28]。食品中常见的4种风味化合物(2-乙酰吡啶、2-乙酰基噻吩、2,3-二乙基吡嗪和2-辛酮)与低酯化果胶间的相互作用研究发现[47],杂环风味化合物在中性介质中不被酯化度低于50%的果胶吸附,而在酸性介质中通过氢键被吸附,这些氢键由风味化合物的芳香环和果胶羧基上的氢原子构成,但2-辛酮在中性介质中通过范德华力被低酯化果胶吸附,在酸性介质中通过疏水相互作用被吸附。因此,果胶与挥发性化合物的相互作用显著影响了其在食品中的释放和保留,但果胶与不同香气物质间相互作用的方式不同,这取决于果胶的结构特性和芳香性化合物的类型及性质。
3.2 物理吸附作用
果胶对风味的影响是复杂的,除了利用范德华力、氢键、静电和疏水相互作用等非共价键作用来直接捕获风味化合物外,还可以通过增稠或形成凝胶网状结构的物理吸附方式来减少挥发性风味物质的扩散,进而起到物理稳定作用,这种相互作用模式对于高浓度的风味化合物更为重要[49]。果胶具有形成凝胶的能力,可以影响香气释放的数量和强度,网状结构是连接果胶力学性能和香气释放的桥梁。同样,高顶空浓度的香气化合物在较软的凝胶中被检测到,这可能是由于在较松散的凝胶结构中,芳香化合物更容易与果胶链的疏水部分相互作用[50]。LUNDFREN等[51]的研究也论证了这一观点,当香气成分的浓度固定时,感知到的香气强度取决于果胶强度,果胶越牢固,香气强度越弱。此外,果胶流变性参数与香气化合物顶空浓度的相关性表明,相位角与香气顶空浓度呈正相关,即凝胶样品的香气顶空浓度低于黏性溶液,多半乳糖醛酸链的纠缠可能是导致凝胶中风味迁移率降低的原因,从而减少挥发性物质向气相的释放[46]。在增稠体系中,复杂交错的网状结构抑制了小分子从凝胶体系内部到表面的运输。由图3可知,苯乙醇的加入诱导果胶溶液中形成大颗粒,且果胶的平均粒径随着苯乙醇浓度的增加而显著增大,这可能是果胶形成了复杂交错的聚合物网络,通过物理方式捕获挥发性化合物。果胶的分子质量和物理状态都会影响风味的保留,果胶结晶产生的交联效应导致聚合物与风味物质间的结合位点减少,使风味化合物被强行从果胶基质的网络结构中挤出到表面,最终导致风味化合物的保留减少[47]。此外,果胶结构的重排和凝胶化都会显著影响芳香化合物的包埋、迁移和扩散[52]。由此可见,果胶的交联网络结构在食品的风味释放中起着至关重要的作用。
图3 果胶残基与苯乙醇之间的相互作用[26]
Fig.3 Description of interactions between pectin residues and phenylethyl alcohol[26]
4 果胶与香气化合物相互作用的影响因素
探析果胶与香气互作机制主要受制于其研究方法,而果胶与香气互作机制研究方法的突破依赖于对果胶自身结构特性及其影响因素的准确分析和科学评估,这也是推动其研究方法以及探明互作机制的根本。果汁中香气释放的程度和效率受诸多因素影响,主要取决于芳香化合物的挥发性,这属于热力学范畴,同时也取决于香气化合物在不同相之间的传质阻力,这属于动力学范畴[53]。当处于热力学平衡时,芳香化合物在气相中的浓度取决于它们的分配系数,而分配系数不仅与香气化合物的物理性质有关,还受果胶结构特性的影响。此外,基质中其他成分(如蛋白质和多酚等)和环境因素(如温度和pH)也会对果胶和香气物质互作产生一定影响。
4.1 果胶结构特性
果胶的酯化度、分子质量、化学官能团、分子结构和空间构象都能影响芳香化合物在液体基质中的释放。近年来,果胶对芳香性化合物释放的影响已经被广泛研究。果胶酯化度能反映果胶分子中羧基酯化的半乳糖醛酸单体占全部半乳糖醛酸单体的比重。根据酯化程度不同可将天然果胶分为高甲氧基果胶(酯化度>50%)和低甲氧基果胶(酯化度<50%)两类[54]。酯化度通过影响果胶分子的疏水性和溶解度进而影响与香气物质的结合作用。低酯化的CSF和NSF很容易在酸性果汁体系中相互结合建立凝胶网络,因此离心处理后的橙汁中萜烯类化合物与果胶组分(CSF和NSF)呈强正相关[12]。而在去酯化的低甲氧基果胶中,许多去酯化区域出现半乳糖醛酸残基,氢键位点的数量增加,这可以增加果胶分子之间的氢键,导致凝胶强度增加,果胶与香气化合物的结合中断。因此,相较其他果胶凝胶,低甲氧基果胶可释放更多的香气化合物[55]。GUICHARD等[56]报道了果胶酯化度对草莓果酱香气释放的影响,发现高甲氧基果胶导致典型的果酱香气强度发生改变,但低甲氧基果胶对香气释放没有显著影响。这与HANSSON等[57]研究结果一致,高甲氧基果胶会显著降低香气化合物的顶空浓度,因为凝胶结构增强了对它们的包埋吸附作用。KIM等[11]考察了果胶分子特性(酯化程度、分子质量和酰胺化程度)对凝胶体系中顶空浓度和香气感知强度的影响,发现果胶在酯化度较高、分子质量较低时对风味的感知强度最高。而感官结构分析表明,果胶凝胶感知风味的强度与其硬度呈显著负相关。果胶的酰胺化则会减少香气化合物的释放,由于酰胺基团区域疏水性增加,形成更多的氢键和疏水区域,导致更多疏水性芳香化合物的保留[58]。这说明果胶特性会严重影响食品中香气的感知。
4.2 香气物质的物化性质
在水果中,香气是一个非常复杂的品质参数,对香气贡献最大的挥发性化合物通常由其化学结构、疏水性和挥发性等特性决定。在大多数情况下,芳香化合物的化学结构和理化特性对其释放行为有显著影响。BYLAITE等[59]研究了不同化学类别、不同结构性质的芳香化合物对香气-果胶结合的影响,含甲基的醛类和酮类比直链醛类和酮类更具挥发性,而在所有挥发物中柠檬烯的保留率最高,这可能与其疏水性有关。此外,在果胶和明胶两种凝胶体系中,随着香气化合物酯链长度的增加(异戊酸乙酯C-7、己酸乙酯C-8、乙酸苄酯C-9、乙酸苯丙酯C-10),其空气-凝胶分配系数减小[48]。REINERS等[60]利用亲和色谱法研究了不同结构特性的酯类对香气释放的影响,发现香气结合系数随酯链中碳原子数(即疏水性)的增加而增加。这些结果表明,疏水性更强的风味化合物对凝胶基质具有更高的亲和力,这可能是由于果胶凝胶对风味化合物的结合/捕获作用。由此可见,疏水性、分子质量和挥发性等物化性质通过影响风味物质与果胶间的亲和力,从而使不同种类的香气物质表现出不同的释放模式。由于萜烯的水溶性较差,容易被果胶胶束的疏水部分和“蛋盒”模型捕获,离心后在橙汁果肉中积累。但由于分子间的氢键取代了结合水,一些游离水在离心后从凝胶网络中释放到上清液中,这一现象导致上清液中存在较多的水溶性醇[12]。此外,碳链结构在香气-果胶相互作用中起重要作用,酮类和醛类由于碳链结构上含有羰基而成为极性分子,其电荷密度高于酯类,这使得羰基上的氧可以充当氢键受体。因此,酯类和醛类在果胶模拟体系中的保留率高于酯类[61]。由此可见,香气-果胶相互作用的程度高度依赖于相关香气化合物的化学结构和理化性质。
4.3 果汁中其他基质成分
近年来,大量研究表明果汁中非挥发性成分多酚、蛋白除了可以与香气物质直接作用外,还可以与果胶相互作用进而影响其香气物质释放及呈香特点,直接或间接的影响香气品质。根据结合方式的不同,多酚主要通过π-π堆积和疏水相互作用实现对芳香物质的吸附保留[62]。而蛋白质-香气化合物的结合方式主要包括共价键合、非共价键合和传质效应[63-64]。果汁中的非挥发性成分果胶、多酚、蛋白质都是空间构象复杂的生物大分子,分子间存在着共价作用力和非共价相互作用力,前者主要是通过酶促、碳二亚胺交联等方法产生,后者则包括疏水相互作用、氢键和范德华力等[65],对果汁体系的稳定性和香气释放有着重要影响。基质中大分子之间的相互作用改变了香气化合物的性质和可用结合位点的数量,从而显著影响香气释放。这与BENJAMIN等[66]研究结果一致,蛋白质与多糖的相互作用可导致界面处蛋白质结构的展开,暴露出更多疏水性基团,这些基团可为脂溶性风味物质的结合提供额外的位点。当果胶吸附在蛋白质上时,可能会发生构象变化,从而改变挥发性化合物的亲和力。香气的滞留不仅仅依赖于芳香化合物与果胶间的相互作用,而是果汁中复杂网络结构的捕获作用或其他基质组分的协同作用。
4.4 其他外界因素
果汁中香气化合物的释放除了受到芳香物质和样品基质的影响,外界环境因素(如温度、pH)也对香气化合物的释放起着重要作用。众所周知,pH值在影响多糖和蛋白质所携带的带电基团的电离程度方面具有至关重要的作用,pH值主要通过影响果胶分子间的络合和凝聚来影响果胶对芳香物质的结合作用[67]。在中性pH下,大多数果胶会与水相分离,导致疏水保留率低于预期。在低pH条件下,果胶中含有更多的质子化羧基,易形成局部凝聚的胶束结构,从而捕获非极性芳香化合物。而当pH=3时t-2己烯醛的释放速率从2 075 ng/(L·min)减缓至1 300 ng/(L·min)[68],这可能是因为在低pH下(pH 2.0~3.5),H+抑制果胶链上的羧基水解导致链上携带的负电荷减少,果胶分子链间氢键的相互作用增强,分子间排斥力减小,有利于三维网络结构的形成和稳定[69]。
温度主要通过改变芳香化合物的基质-空气分配系数及基质黏度来影响果汁中的香气释放,这2种变化也有主次之分。通过快速提高温度,基质的流变行为及其对风味释放的影响似乎不如食品内部的传热及其对香气化合物分配的影响重要[68]。温度对挥发性物质的总体影响由分配系数和亨利定律方程来解释,随着温度的升高,挥发性化合物的空气/水分配系数增大,因此挥发性化合物的顶空浓度增加,其风味增强[70]。当温度>30 ℃时,果胶短链间可形成氢键,发生疏水相互作用,从而引起链的聚集和结区的扩大来实现对芳香物质的吸附保留作用[66]。由此可见,温度对果汁体系的风味感知起着重要的作用。
5 展望
风味作为衡量果汁品质的重要指标,如何有效地平衡、保留和提高果汁香气是果汁加工领域面临的一项重大挑战。果胶作为果汁中重要的基质成分,不仅影响果汁稳定性和口感,还可以通过物理截留方式抑制香气化合物的动态变化,或通过各种相互作用力影响果汁中香气化合物的保留和释放。果胶、淀粉等多糖通常被用作有效的载体用于封装风味化合物,为了实现风味化合物的有效封装和可制释放,涂层和涂层材料性质的研究非常必要[51]。阐明食品成分的风味结合行为,可有的放矢地开发具有所需风味的产品。
随着科技日新月异的发展,果胶与香气物质互作机制的研究方法和技术从微观尺度不断创新并突破认知。早期利用化学键破坏剂来评估果胶与风味化合物结合涉及的相互作用力及贡献度,而色谱、光谱、质谱和波谱等技术发展可进一步测定果胶-香气复合物的结合常数、结合位点数和吉布斯自由能等热力学参数,达到有效分析。但果胶与香气物质相互作用的研究仍存在一定局限性,如果胶与香气的相互作用停留在基础研究方面,针对果汁加工引起的果胶结构和物化特性变化以及添加食品配料对果胶与香气化合物结合作用影响等方面的研究鲜有报道。因此,精准剖析果汁从加工到食用过程中的风味变化,有利于实现风味品质的稳态化调控。此外,果胶-风味物质相互作用的研究一般是在单一组分或已知多组分的模拟体系中完成,由于果汁体系的复杂性,这未能真实反映果胶与香气物质互作对果汁风味释放的影响。因此,在未知多组分食品基质的复杂体系中研究果胶或其他云状颗粒组分与风味化合物的相互作用是未来果汁香气的难点和重点。
基于果胶和风味化合物在食品领域的重要性,特别是在果汁加工中的特殊品质属性,本文对果胶的基本组成结构、果胶与香气化合物结合作用的测定方法、互作机制和影响因素进行了阐述,系统比较了紫外-可见吸收光谱、荧光猝灭光谱、NMR、分子对接和化学试剂破坏化学键法等技术在果胶-香气化合物结合作用中的应用;概括了果胶与香气化合物之间的结合作用方式(包括非共价键合和物理吸附作用),并从多角度阐述了果胶结构特性、香气物化特性、其他基质成分和环境等因素对果胶与香气物质互作效应的影响,以期解析果胶与果汁风味的互作机制,优化实现香气品质的稳态化调控和可控释放。在今后的研究中可通过使用甜味剂或脂肪替代品等对产品配方进行修改,改变所涉及的相互作用的性质来改变风味感知,助力于推动果汁新产品开发和风味提升。
[1] 范刚, 乔宇, 姚晓琳, 等.柑橘加工制品中香气物质的研究进展[J].中国农业科学, 2009, 42(12):4324-4332.FAN G, QIAO Y, YAO X L, et al.Advances in research of aroma compounds of citrus processing products[J].Scientia Agricultura Sinica, 2009, 42(12):4324-4332.
[2] VOILLEY A, ETIÉVANT P.Flavour in Food[M].Cambridge:Woodhead Publishing Limited, 2006.
[3] DE ROOS K B.How lipids influence food flavor[J].Food Technology, 1997, 51(1):60-62.
[4] SAIFULLAH M, SHISHIR M R I, FERDOWSI R, et al.Micro and nano encapsulation, retention and controlled release of flavor and aroma compounds:A critical review[J].Trends in Food Science &Technology, 2019, 86:230-251.
[5] PAN X, WU J H, ZHANG W T, et al.Effects of sugar matrices on the release of key aroma compounds in fresh and high hydrostatic pressure processed Tainong mango juices[J].Food Chemistry, 2021, 338:128117.
[6] CUI J F, ZHAO C Y, FENG L P, et al.Pectins from fruits:Relationships between extraction methods, structural characteristics, and functional properties[J].Trends in Food Science &Technology, 2021, 110:39-54.
[7] 朱晓红, 于颖.从苹果渣中提取果胶工艺条件的研究[J].粮油加工, 2010(6):136-138.ZHU X H, YU Y.Study on technological conditions of extracting pectin from apple pomace[J].Cereals and Oils Processing, 2010(6):136-138.
[8] RAHMANI Z, KHODAIYAN F, KAZEMI M, et al.Optimization of microwave-assisted extraction and structural characterization of pectin from sweet lemon peel[J].International Journal of Biological Macromolecules, 2020, 147:1107-1115.
[9] MAO G Z, WU D M, WEI C Y, et al.Reconsidering conventional and innovative methods for pectin extraction from fruit and vegetable waste:Targeting rhamnogalacturonan I[J].Trends in Food Science &Technology, 2019, 94:65-78.[10] 陈西, 柳晓丹, 张同童, 等.橙汁混浊稳定性的研究进展[J].食品工业科技, 2017, 38(8):384-389.CHEN X, LIU X D, ZHANG T T, et al.Research progress on cloud stability of orange juice[J].Science and Technology of Food Industry, 2017, 38(8):384-389.
[11] KIM Y, KIM Y S, YOO S H, et al.Molecular differences of low methoxy pectins induced by pectin methyl esterase I:Effects on texture, release and perception of aroma in gel systems[J].Food Chemistry, 2010, 123(2):451-455.
[12] LI M B, ZHANG W Z, ZHANG M Q, et al.Effect of centrifugal pre-treatment on flavor change of cloudy orange juice:Interaction between pectin and aroma release[J].Food Chemistry, 2022, 374:131705.
[13] NJOROGE D M, KINYANJUI P K, CHIGWEDERE C M, et al.Mechanistic insight into common bean pectic polysaccharide changes during storage, soaking and thermal treatment in relation to the hard-to-cook defect[J].Food Research International, 2016, 81:39-49.
[14] CYBULSKA J, ZDUNEK A, KOZIO A.The self-assembled network and physiological degradation of pectins in carrot cell walls[J].Food Hydrocolloids, 2015, 43:41-50.
A.The self-assembled network and physiological degradation of pectins in carrot cell walls[J].Food Hydrocolloids, 2015, 43:41-50.
[15] 刘嘉宁. 高压均质对胡萝卜汁物化特性和类胡萝卜素生物有效性的影响[D].沈阳:沈阳农业大学, 2018.LIU J N.Effects of high pressure homogenization on physico-chemical properties and carotenoid bioaccessibility of carrot juice[D].Shenyang:Shenyang Agricultural University, 2018.
[16] CHUNG S, VILLOTA R.Binding of alcohols by soy protein in aqueous solutions[J].Journal of Food Science, 1989, 54(6):1604-1606.
[17] ZHOU Q X, LEE S Y, CADWALLADER K R.Inverse gas chromatographic evaluation of the influence of soy protein on the binding of selected butter flavor compounds in a wheat soda cracker system[J].Journal of Agricultural and Food Chemistry, 2006, 54(15):5516-5520.
[18] DAMODARAN S, KINSELLA J E.Interaction of carbonyls with soy protein:Thermodynamic effects[J].Journal of Agricultural and Food Chemistry, 1981, 29(6):1249-1253.
[19] QI P X, XIAO Y P, WICKHAM E D.Changes in physical, chemical and functional properties of whey protein isolate (WPI) and sugar beet pectin (SBP) conjugates formed by controlled dry-heating[J].Food Hydrocolloids, 2017, 69:86-96.
[20] SIVA S, LI C Z, CUI H Y, et al.Encompassment of isoeugenol in 2-hydroxypropyl-β-cyclodextrin using ultrasonication:Characterization, antioxidant and antibacterial activities[J].Journal of Molecular Liquids, 2019, 296:111777.
[21] ZHAO Q Z, TIAN H, CHEN L, et al.Interactions between soluble soybean polysaccharide and starch during the gelatinization and retrogradation:Effects of selected starch varieties[J].Food Hydrocolloids, 2021, 118:106765.
[22] GAO Q, ZHANG B, QIU L Z, et al.Ordered structure of starch inclusion complex with C10 aroma molecules[J].Food Hydrocolloids, 2020, 108:105969.
[23] 王茗, 李红霞.蛋白质与配体相互作用机制研究方法进展[J].广州化工, 2022, 50(11):18-20;42.WANG M, LI H X.Research progress on methods for mechanism of protein ligand[J].Guangzhou Chemical Industry, 2022, 50(11):18-20;42.
[24] 张瑜. 非挥发性成分多酚、多肽及多糖对葡萄酒中五种酯类香气物质的影响[D].兰州:甘肃农业大学, 2022.ZHANG Y.Effects of nonvolatile components polyphenols, polypeptides and polysaccharides on five esters in wine[D].Lanzhou:Gansu Agricultural University, 2022.
[25] JU P, FAN H, LIU T, et al.Probing the interaction of flower-like CdSe nanostructure particles targeted to bovine serum albumin using spectroscopic techniques[J].Journal of Luminescence, 2011, 131(8):1724-1730.
[26] LI X J, ZENG X Q, XI Y, et al.Effects of non-covalent interactions between pectin and volatile compounds on the flavor release of tomato paste[J].Food Hydrocolloids, 2022, 133:107886.
[27] ZENG X Q, DU Z J, SHENG Z T, et al.Characterization of the interactions between banana condensed tannins and biologically important metal ions (Cu2+, Zn2+ and Fe2+)[J].Food Research International, 2019, 123:518-528.
[28] ZENG X Q, DU Z J, DING X M, et al.Preparation, characterization and in vitro hypoglycemic activity of banana condensed tannin-inulin conjugate[J].Food &Function, 2020, 11(9):7973-7986.
[29] SHEN H, ZHAO M M, SUN W Z.Effect of pH on the interaction of porcine myofibrillar proteins with pyrazine compounds[J].Food Chemistry, 2019, 287:93-99.
[30] FAURIE B, DUFOURC E J, LAGUERRE M, et al.Monitoring the interactions of a ternary complex using NMR spectroscopy:The case of sugars, polyphenols, and proteins[J].Analytical Chemistry, 2016, 88(24):12470-12478.
[31] FISCHER E.Einfluss der Configuration auf die Wirkung der Enzyme[J].Berichte Der Deutschen Chemischen Gesellschaft, 1894, 27(3):2985-2993.
[32] KOSHLAND D E.Application of a theory of enzyme specificity to protein synthesis[J].Proceedings of the National Academy of Sciences of the United States of America, 1958, 44(2):98-104.
[33] ZAHER N H, MOSTAFA M I, ALTAHER A Y.Design, synthesis and molecular docking of novel triazole derivatives as potential CoV helicase inhibitors[J].Acta Pharmaceutica, 2020, 70(2):145-159.
[34] XIAO Z, JIANG X, NIU Y. Study on the interaction of sweet protein (thaumatin) with key aroma compounds in passion fruit juice using electronic nose, ultraviolet spectrum, thermodynamics, and molecular docking[J]. Food Science &Technology, 2022, 162: 113463.
[35] IMESON A P, LEDWARD D A, MITCHELL J R.On the nature of the interaction between some anionic polysaccharides and proteins[J].Journal of the Science of Food and Agriculture, 1977, 28(8):661-668.
[36] UTSUMI S, KINSELLA J E.Forces involved in soy protein gelation:Effects of various reagents on the formation, hardness and solubility of heat-induced gels made from 7S, 11S, and soy isolate[J].Journal of Food Science, 1985, 50(5):1278-1282.
[37] ARNTFIELD S D, MURRAY E D, ISMOND M A H.Role of disulfide bonds in determining the rheological and microstructural properties of heat-induced protein networks from ovalbumin and vicilin[J].Journal of Agricultural and Food Chemistry, 1991, 39(8):1378-1385.
[38] SUN X D, ARNTFIELD S D.Molecular forces involved in heat-induced pea protein gelation:Effects of various reagents on the rheological properties of salt-extracted pea protein gels[J].Food Hydrocolloids, 2012, 28(2):325-332.
[39] URUAKPA F O, ARNTFIELD S D.Structural thermostability of commercial canola protein-hydrocolloid mixtures[J].LWT-Food Science and Technology, 2006, 39(2):124-134.
[40] URUAKPA F O, ARNTFIELD S D.Network formation of canola protein-κ-carrageenan mixtures as affected by salts, urea and dithiothreitol[J].LWT-Food Science and Technology, 2006, 39(8):939-946.
[41] USTUNOL Z, XIONG Y L, MEANS W J, et al.Forces involved in mixed pork myofibrillar protein and calcium alginate gels[J].Journal of Agricultural and Food Chemistry, 1992, 40(4):577-580.
[42] 汪娟. 大豆分离蛋白与特定风味化合物相互作用机制的研究[D].广州:华南理工大学, 2018.WANG J.Interaction of selected volatile flavor compounds and soy protein isolate[D].Guangzhou:South China University of Technology, 2018.
[43] 沈雨思. 苹果浊汁云状颗粒果胶组分与特征风味化合物相互作用研究[D].锦州:渤海大学, 2021.SHEN Y S.Study on interaction between pectin components of cloudy particles and characteristic flavor compounds in cloudy apple juice[D].Jinzhou:Bohai University, 2021.
[44] TANFORD C.Contribution of hydrophobic interactions to the stability of the globular conformation of proteins[J].Journal of the American Chemical Society, 1962, 84(22):4240-4247.
[45] TERTA M, BLEKAS G, PARASKEVOPOULOU A.Retention of selected aroma compounds by polysaccharide solutions:A thermodynamic and kinetic approach[J].Food Hydrocolloids, 2006, 20(6):863-871.
[46] BAINES Z V, MORRIS E R.Flavour/taste perception in thickened systems:The effect of guar gum above and below C[J].Food Hydrocolloids, 1987, 1(3):197-205.
[47] BULJETA I, PICHLER A, IVI I, et al.Encapsulation of fruit flavor compounds through interaction with polysaccharides[J].Molecules, 2021, 26(14):4207.
I, et al.Encapsulation of fruit flavor compounds through interaction with polysaccharides[J].Molecules, 2021, 26(14):4207.
[48] BOLAND A, DELAHUNTY C, VANRUTH S.Influence of the texture of gelatin gels and pectin gels on strawberry flavour release and perception[J].Food Chemistry, 2006, 96(3):452-460.
[49] GHASEMI S, JAFARI S M, ASSADPOUR E, et al.Nanoencapsulation of D-limonene within nanocarriers produced by pectin-whey protein complexes[J].Food Hydrocolloids, 2018, 77:152-162.
[50] TYAPKOVA O, BADER-MITTERMAIER S, SCHWEIGGERT-WEISZ U, et al.Characterisation of flavour-texture interactions in sugar-free and sugar-containing pectin gels[J].Food Research International, 2014, 55:336-346.
[51] LUNDGREN B, PANGBORN R M, DAGET N, et al.An interlaboratory study of firmness, aroma, and taste of pectin gels[J].Lebensmitel-Wissenschaft &Technologie, 1986, 19(1):66-76.
[52] SU K, FESTRING D, AYED C, et al.Reducing sugar and aroma in a confectionery gel without compromising flavour through addition of air inclusions[J].Food Chemistry, 2021, 354:129579.
[53] VOILLEY A, SOUCHON I.Flavour retention and release from the food matrix:An overview[M]//Flavour in Food.Amsterdam:Elsevier, 2006:117-132.
[54] JIN Y M, YANG N.Array-induced voltages assisted extraction of pectin from grapefruit (Citrus paradisi Macf.) peel and its characterization[J].International Journal of Biological Macromolecules, 2020, 152:1205-1212.
[55] KIM M J, JU H K, KIM Y, et al.Effects of amidation and/or methylesterification of pectin on aroma release at different calcium concentration[J].Food Hydrocolloids, 2016, 52:343-349.
[56] GUICHARD E, ISSANCHOU S, DESCOURVIERES A, et al.Pectin concentration, molecular weight and degree of esterification:Influence on volatile composition and sensory characteristics of strawberry jam[J].Journal of Food Science, 1991, 56(6):1621-1627.
[57] HANSSON A, ANDERSSON J, LEUFVÉN A.The effect of sugars and pectin on flavour release from a soft drink-related model system[J].Food Chemistry, 2001, 72(3):363-368.
[58] KIM Y, KIM Y S, YOO S H, et al.Molecular structural differences between low methoxy pectins induced by pectin methyl esterase II:Effects on texture, release and perception of aroma in gels of similar modulus of elasticity[J].Food Chemistry, 2014, 145:950-955.
[59] BYLAITE E, ADLER-NISSEN J, MEYER A S.Effect of xanthan on flavor release from thickened viscous food model systems[J].Journal of Agricultural and Food Chemistry, 2005, 53(9):3577-3583.
[60] REINERS J, NICKLAUS S, GUICHARD E.Interactions between β-lactoglobulin and flavour compounds of different chemical classes.Impact of the protein on the odour perception of vanillin and eugenol[J].Le Lait, 2000, 80(3):347-360.
[61] AYED C, LUBBERS S, ANDRIOT I, et al.Impact of structural features of odorant molecules on their retention/release behaviours in dairy and pectin gels[J].Food Research International, 2014, 62:846-859.
[62] GUO J, YUE T L, YUAN Y H.Impact of polyphenols on the headspace concentration of aroma compounds in apple cider[J].Journal of the Science of Food and Agriculture, 2019, 99(4):1635-1642.
[63] XIAO Z B, JIANG X Y, NIU Y W.Study on the interaction of sweet protein (thaumatin) with key aroma compounds in passion fruit juice using electronic nose, ultraviolet spectrum, thermodynamics, and molecular docking[J].LWT, 2022, 162:113463.
[64] 张晓鸣, 夏书芹, 宋诗清.食品风味化学[M].北京:中国轻工业出版社, 2013.ZHANG X M.Food Flavor Chemistry[M].Beijing:China Light Industry Press, 2013.
[65] KOH J, XU Z M, WICKER L.Binding kinetics of blueberry pectin-anthocyanins and stabilization by non-covalent interactions[J].Food Hydrocolloids, 2020, 99:105354.
[66] BENJAMIN O, SILCOCK P, LEUS M, et al.Multilayer emulsions as delivery systems for controlled release of volatile compounds using pH and salt triggers[J].Food Hydrocolloids, 2012, 27(1):109-118.
[67] DICKINSON E.Stability and rheological implications of electrostatic milk protein-polysaccharide interactions[J].Trends in Food Science &Technology, 1998, 9(10):347-354.
[68] LUBBERS S, BUTLER E.Effects of texture and temperature on the kinetic of aroma release from model dairy custards[J].Food Chemistry, 2010, 123(2):345-350.
[69] SRIAMORNSAK P.Chemistry of pectin and its pharmaceutical uses:A review[J].Silpakorn University International Journal, 2003.
[70] JOUQUAND C, DUCRUET V, GIAMPAOLI P.Partition coefficients of aroma compounds in polysaccharide solutions by the phase ratio variation method[J].Food Chemistry, 2004, 85(3):467-474.