多酚、类胡萝卜素和维生素等营养素以及益生菌在维持人体健康中扮演着不可或缺的角色,它们参与调节能量代谢、促进生长发育、增强免疫功能等重要生理活动[1-4]。然而,这些外源的各类营养素和益生菌在体内消化吸收过程中却面临着一系列复杂的挑战。消化道内变化的pH、体内外波动的温差以及纷繁复杂的肠道微生物环境等因素往往不利于外源营养素和益生菌保持稳定的生物活性或生物利用度。例如,pH敏感型营养素在消化道内不同的pH条件下可能会发生结构变化,导致其生物活性下降[5];而众多的活性营养成分往往对温度敏感,加工贮藏等环节的高温可能会大幅降低这些营养素的生物利用度[6]。此外,肠道微生物的活动也可能引起营养素的失活[7-10]。因此,如何确保摄入的营养素能在机体代谢过程中充分发挥其生物活性,是众多食品科学或营养学研究者关注的热点之一。
凝胶是指分散介质中的胶体粒子或高分子溶质通过物理或化学交联方式形成的具有复杂三维网络结构的软物质,而食品凝胶通常是指少量的多糖或蛋白等大分子相互交联缠结将大量的水、油或气体束缚在三维网络结构中形成的可食性软物质[11]。在适宜的条件下,食品凝胶形成的稳定凝胶网络可以有效地包裹水分、油脂、气体等小分子成分,并赋予食品独特的质构特性和感官特性。食品凝胶往往具有较好的安全性,通常不会引发显著的不良反应或过敏问题[12]。因此,食品凝胶被视为多种营养物质的理想载体,常被用于构建不同类型的递送体系以适应各类营养素或生物活性成分的体内传递。当前,关于各类营养素或生物活性的凝胶递送体系的构建、营养素的稳定性及控释机理等已有大量报道。然而,鲜有研究者对此领域的研究结果作全面系统的梳理与归纳。本文梳理了国内外有关食品凝胶在营养素递送领域的研究成果,特别聚焦于探讨不同种类凝胶在构建递送系统以及实现营养素传递方面的机制、优势和限制。在此基础上,对食品凝胶递送系统的应用前景进行了探讨和展望,有望为功能性食品凝胶的定向设计与研发提供一定的理论支撑和借鉴思路。
1 多糖类凝胶递送体系
如表1所述,根据多糖来源不同,糖凝胶递送体系可分为海藻多糖凝胶、植物多糖凝胶和微生物凝胶三大类[13]。
表1 不同多糖来源的凝胶递送体系
Table 1 Gel delivery systems constructed with different polysaccharide sources

类别来源制备条件优点作用机制应用举例海藻多糖凝胶从海洋中的藻类中提取的线性多糖[14],例如卡拉胶、琼脂糖热诱导二价金属离子[15-16]在弱酸性、中性和弱碱性环境中性质稳定[17]植物多糖凝胶从植物或其分泌物中提取,经加工制得的多糖类胶体[14],例如淀粉、阿拉伯胶、纤维素、魔芋葡甘聚糖、果胶调节pH热诱导[21]添加交联剂天然来源和良好的生物相容性微生物凝胶一种由微生物(如细菌、真菌等)生产的多糖类化合物[14],例如黄原胶、可得然胶、结冷胶二价金属离子调节pH热诱导添加交联剂具有高保水性、高稳定性利用多糖凝胶的三维网络结构和多孔特性,对营养素实现物理包裹,保护营养素不受环境因素的损害,并通过精确控制交联的密度和孔隙的大小,调节营养素的释放速度,从而实现营养素持续稳定的供应用于递送药物[18]、营养素[19]以及益生菌[20]适用于递送药物、生物活性物质以及食品包装等[22]用作递送药物、生物活性物质[23]
1.1 多酚的递送
多酚是一类广泛存在于植物中具有苯环结构的多羟基化合物,具有抗氧化、抗炎、抗癌、抗菌等多种生理功能,但其较低的水溶性和不稳定的物化性质限制了多酚作为食品功能性成分在人体内的高效吸收和利用。研究者发现,将多酚包裹在特定的多糖凝胶中可有效应对上述困境。已有大量研究探讨了多糖凝胶递送体系对多酚的稳定性和生物利用率等方面的影响,相关研究如表2所示。GUO等[24]采用藻酸盐和果胶混合物制备藻酸盐果胶水凝胶颗粒用于花青素的递送,其研究结果显示,水凝胶颗粒能够有效减少花青素的光降解,从而延长了花青素的保质期。LI等[19]的研究表明,调整乳液凝胶中乳液的比例,可以精确控制姜黄素的释放程度,以满足最低抑菌浓度的需求。在此类递送体系中,乳液凝胶的微观结构对于活性成分释放行为起着决定性的影响,乳液的比例和分散状态决定了姜黄素与外界环境的接触程度。而LU等[25]则利用新型氧化魔芋葡甘露聚糖和壳聚糖制备凝胶微球以包裹花青素。该研究结果表明,凝胶微球内花青素的吸收和释放受pH值和盐浓度的影响,在pH值为3的低盐体系中,凝胶微球有最大的花青素吸收能力,可在pH值为3的低盐体系中保持稳定,而在环境pH值>5时花青素可从凝胶微球中释放。其释放模型符合控制依赖型释放机制[26],基于此机制设计的递送系统允许通过调节凝胶特性(机械稳定性、溶胀性和刺激响应性等)来控制目标物的释放速率,通常受环境条件影响,且初始释放时间存在延迟。
表2 多糖凝胶体系用于多酚的递送
Table 2 Polysaccharide gel system used for polyphenols delivery
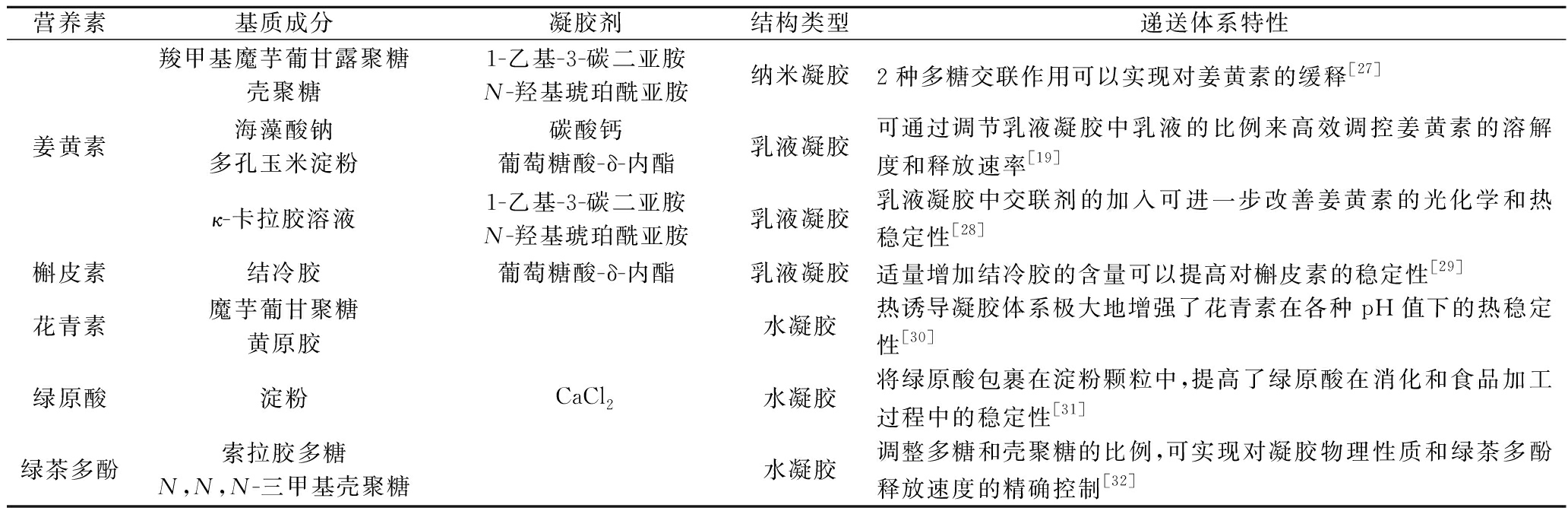
营养素基质成分凝胶剂结构类型递送体系特性姜黄素羧甲基魔芋葡甘露聚糖壳聚糖1-乙基-3-碳二亚胺N-羟基琥珀酰亚胺纳米凝胶2种多糖交联作用可以实现对姜黄素的缓释[27]海藻酸钠多孔玉米淀粉碳酸钙葡萄糖酸-δ-内酯乳液凝胶可通过调节乳液凝胶中乳液的比例来高效调控姜黄素的溶解度和释放速率[19]κ-卡拉胶溶液1-乙基-3-碳二亚胺N-羟基琥珀酰亚胺乳液凝胶乳液凝胶中交联剂的加入可进一步改善姜黄素的光化学和热稳定性[28]槲皮素结冷胶葡萄糖酸-δ-内酯乳液凝胶适量增加结冷胶的含量可以提高对槲皮素的稳定性[29]花青素魔芋葡甘聚糖黄原胶水凝胶热诱导凝胶体系极大地增强了花青素在各种pH值下的热稳定性[30]绿原酸淀粉CaCl2水凝胶将绿原酸包裹在淀粉颗粒中,提高了绿原酸在消化和食品加工过程中的稳定性[31]绿茶多酚索拉胶多糖N,N,N-三甲基壳聚糖水凝胶调整多糖和壳聚糖的比例,可实现对凝胶物理性质和绿茶多酚释放速度的精确控制[32]
改变pH值和离子强度是调控多糖凝胶物性的重要方式,以此为切入点可实现对多糖凝胶递送体系的定向构建,从而达到多酚的控释目的,提高其稳定性和生物利用度,有望为多酚的应用提供更多的可能性。
1.2 类胡萝卜素的递送
β-胡萝卜素、番茄红素和岩藻黄质等常见的类胡萝卜素具有多种重要的生理功能,如抗氧化和促进生长发育等。然而,类胡萝卜素往往亲油而疏水且易受烹饪过程中高温的影响,其在人体内的吸收和利用率较为受限。此外,类胡萝卜素分子在极端的pH值条件下(pH<4.0或pH>8.0)可能会发生去酯化和异构化反应,进一步降低了其生物利用度。如表3所示,为了提高类胡萝卜素的生物利用度,已有众多研究探讨了多糖凝胶用于递送类胡萝卜素的可行性。ZHENG等[33]利用玉米油和κ-卡拉胶制备出双凝胶以递送β-胡萝卜素,结果显示,含有较高比例油凝胶的双凝胶有助于更好地稳定β-胡萝卜素,减少其在载体中与胃酸的接触,从而提高了β-胡萝卜素的吸收效率。在模拟小肠消化过程中,强凝胶网络并不会妨碍脂肪酶的分解和β-胡萝卜素的释放,有助于机体对β-胡萝卜素的高效吸收。此类实验利用凝胶的双重性质:一方面,油凝胶的疏水性为核心成分提供了保护,从而维持了β-胡萝卜素的稳定性;另一方面,水凝胶的亲水性和凝胶网络的孔隙结构则为消化酶提供了作用空间,从而促进了β-胡萝卜素的释放和吸收。
表3 多糖凝胶体系用于类胡萝卜素的递送
Table 3 Polysaccharide gel system used for the polyphenol delivery

营养素基质成分凝胶剂结构类型递送体系特性岩藻黄质壳聚糖糖酯三聚磷酸盐纳米凝胶糖酯的加入增强岩藻黄质并进一步提高岩藻黄质的生物利用度[34]番茄红素海藻酸钠大米淀粉CaCl2水凝胶大米淀粉廉价易得,可在胃肠道条件下实现对番茄红素的精准控释[35]β-胡萝卜素海藻酸钠葡萄糖酸-δ-内酯碳酸钙乳液凝胶利用离子介导的乳液凝胶的空间位阻阻碍β-胡萝卜素对温度的响应并增强其化学稳定性[36]大米淀粉水凝胶水凝胶与脂滴的协同作用可大幅度提高β-胡萝卜素的生物利用度[37]
通过在多糖凝胶中巧妙地引入油凝胶,成功提升了对脂溶性的类胡萝卜素的承载能力,进而提高了类胡萝卜素化学稳定性和生物利用度。油凝胶和水凝胶的有机结合为高效递送类胡萝卜素及其他脂溶性营养素或药物提供了切实可行的研究思路,有望进一步促进脂溶性功能成分发挥其生物活性。
1.3 益生菌的递送
益生菌在治疗肥胖症、糖尿病、癌症、人类免疫缺陷病毒感染、肠易激综合征等多种疾病中备受研究关注。然而,它们在消化道内的存活能力相对脆弱,尤其是胃内的低pH环境,极易导致益生菌的失活。为了延长益生菌在消化道内存活时间,提高其在维护机体肠道微生态平衡方面的效力,如表4所示,构建多糖凝胶体系有目的地递送益生菌已引起了众多研究者的关注。精心设计的凝胶递送体系不仅有助于提高食品体系中益生菌的稳定性,还能有效提升益生菌在肠道内的存活率,从而使其更好的发挥功能特性。ZHU等[21]将植物乳杆菌和唾液乳杆菌添加到桃胶多糖和白背毛木耳多糖混合制备出水凝胶中,其研究发现,该凝胶在模拟胃液中能有效保护这2种益生菌,并在肠道环境中将其释放。另一方面,DENG等[38]使用孢粉质外膜胶囊包裹植物乳杆菌,并将其分散在含有羧甲基茯苓多糖和海藻酸钠的多糖溶胶中,通过制备凝胶来防止益生菌泄漏并保护益生菌活性。该研究通过改变凝胶基质的含量以调控凝胶外壳的微观结构和溶胀行为,从而实现了益生菌的可控释放。
表4 多糖凝胶体系用于益生菌的递送
Table 4 Polysaccharide gel system used for the probiotics delivery

益生菌基质成分凝胶剂结构类型递送体系特性酵母菌海藻酸钠壳聚糖CaCl2凝胶珠内源乳化法制备的凝胶提高了益生菌在模拟胃肠道条件下的存活率[20]干酪乳杆菌果胶壳聚糖CaCl2凝胶珠凝胶外壳聚糖涂层进一步在胃肠道中保护益生菌[39]植物乳杆菌海藻酸钠水凝胶静电纺丝法制备的核壳结构,可提高湿热处理下植物乳杆菌的热稳定性,并增强其对模拟胃环境的耐受性[40]短乳杆菌干酪乳杆菌植物乳杆菌大米淀粉CaCl2水凝胶原料来源经济、价格低廉,可满足商业化应用,可提高益生菌的热稳定性以及在模拟胃肠和热条件下的生存能力[41]鼠李糖乳杆菌果胶乳清蛋白CaCl2水凝胶珠乳清蛋白涂层成功提高了鼠李糖乳杆菌在低pH环境中的存活率[42]嗜酸乳杆菌甲氧基酰胺化果胶乳清分离蛋白CaCl2水凝胶乳清蛋白涂层调控微粒在模拟胃肠道条件下的破裂,实现嗜酸乳杆菌在肠道的释放[43]
通过将益生菌针对性地封装于精心设计的多糖凝胶中,不仅有助于提高它们在胃内低酸环境下的生存能力,同时也能更高效地将它们引导至肠道并释放,进一步发挥其对宿主健康的积极影响。当前,尽管此类研究相对较为有限,但多糖凝胶在递送益生菌方面的突出表现势必将引发更多的关注。
1.4 其他营养素的递送
对于包括植物甾醇、蛋白和短链脂肪酸在内的众多性质各异的功能性营养成分,多糖凝胶体系展现出来巨大的递送潜力,已有的相关研究结果见下表5。在UBEYITOGULLARI等[44]的研究中,采用超临界二氧化碳浸渍法,将植物甾醇浸渍到纳米多孔淀粉气凝胶中,制备了低结晶度的植物甾醇纳米颗粒。实验结果表明,经模拟体外消化后,植物甾醇纳米颗粒的生物可及性显著高于植物甾醇粗品。纳米孔淀粉气凝胶可降低植物甾醇的结晶性、减小尺寸、改善其溶解性和稳定性,使其以可控且适应生理条件的方式被释放。并且植物甾醇纳米颗粒释放与淀粉凝胶的水解同步进行,进一步提高了生物可及性。YAN等[45]的研究表明,超声处理可以促进芹菜纤维素水凝胶基质中短链脂肪酸的爆发性释放,凸显了多糖凝胶在递送系统中的可调控性。芹菜纤维素水凝胶符合扩散控制依赖型释放机制[26]。基于此机制设计的递送体系可以快速释放小分子物质且易于操作,但在实际应用中可能会遭遇初始的快速释放现象,即所谓的“初始爆发效应”,并且在释放过程的后期会出现释放速度不均匀的问题。
表5 多糖凝胶体系用于其他营养素的递送
Table 5 Polysaccharide gel system for delivery of other nutrients
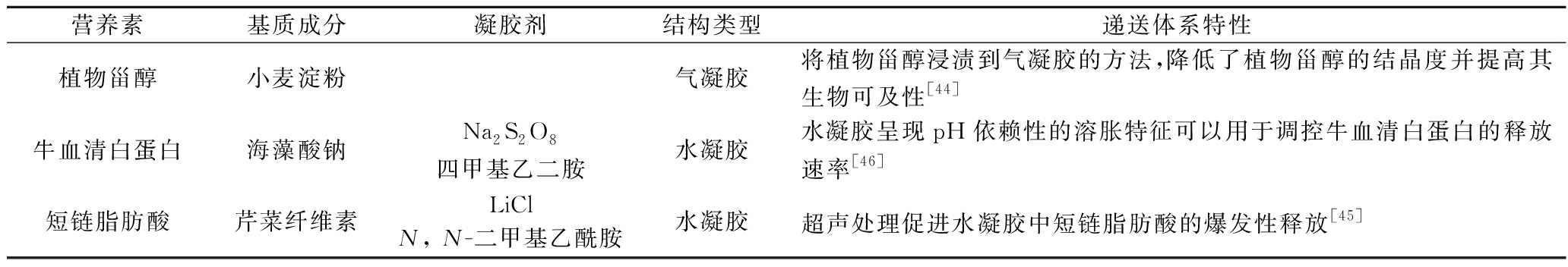
营养素基质成分凝胶剂结构类型递送体系特性植物甾醇小麦淀粉气凝胶将植物甾醇浸渍到气凝胶的方法,降低了植物甾醇的结晶度并提高其生物可及性[44]牛血清白蛋白海藻酸钠Na2S2O8四甲基乙二胺水凝胶水凝胶呈现pH依赖性的溶胀特征可以用于调控牛血清白蛋白的释放速率[46]短链脂肪酸芹菜纤维素LiClN, N-二甲基乙酰胺水凝胶超声处理促进水凝胶中短链脂肪酸的爆发性释放[45]
多糖凝胶不仅在提升营养素稳定性方面发挥着关键作用,还为营养素精准靶向递送提供物质基础。此类创新性的递送系统有望为各类营养素的应用开辟更广阔的前景,为更好地满足人体健康需求提供了强有力的支持。
2 蛋白质类凝胶递送体系
如表6所述,根据蛋白质凝胶构建方式不同,蛋白质凝胶递送体系分为明胶凝胶、脂质体凝胶以及聚合物凝胶三大类。
表6 构建方式不同的蛋白质凝胶递送体系
Table 6 Protein gel delivery systems constructed with different methods

类别构建方式制备条件优点缺点作用机制应用举例明胶凝胶溶解明胶[47]、热溶解、冷却凝胶、加入蛋白质、再凝胶化热诱导[48]生物降解速度快凝胶结构稳定性不足[49]脂质体凝胶蛋白质被包裹在磷脂双分子层的水包油微乳液中金属离子交联剂高度的生物相容性和生物可降解性承载量相对有限[50]聚合物凝胶蛋白质和蛋白质或多糖通过静电相互作用、氢键的作用力凝胶化交联剂高调控性能降解速率易受到环境因素的影响[52]利用蛋白质凝胶氨基酸残基与交联剂之间的相互作用来稳定地封装营养素,使得蛋白质凝胶能够对特定的生理条件产生响应,从而在人体内以一种持续且均匀的速率释放营养素,最终为身体提供稳定而长效的营养支持药物和生物活性物质的载体包载水溶性和脂溶性等生物活性物质[51]用于生物传感器、创面愈合
2.1 多酚的递送
蛋白质凝胶体系在多酚的递送中展现出引人注目的潜力,其具备与多糖凝胶相似的可调控性和稳定性。研究人员通过精密调整蛋白质凝胶的物化特性,成功实现了对多酚释放速率的精确控制,从而显著提升了多酚的生物利用度,相关实验结果如表7所示。ZHAN等[53]采用乳清蛋白分离物和玉米醇溶蛋白混合制备了载有姜黄素的复合纳米颗粒。该实验结果显示,这种包裹方式使得姜黄素具有更佳的溶解性和稳定性,得益于乳清蛋白分离物和玉米醇溶蛋白之间的亲水性和疏水性。LI等[54]利用脱酰胺玉米醇溶蛋白制备纳米凝胶作为姜黄素的载体。该实验表明,这种纳米凝胶成功抑制了姜黄素结晶,并提高了姜黄素的生物可及性。WANG等[55]利用大米蛋白和虫胶制备了包裹芹菜素的纳米凝胶球,该实验表明,通过微调纳米凝胶球的结构,可以调整芹菜素的释放速率,从而影响芹菜素对HepG2细胞的抑制生物活性。BETZ等[56]的研究发现,花青素在pH值为1.5的乳清蛋白凝胶中更具有稳定性。这种pH响应型水凝胶在酸性胃液的溶胀较小,可物理隔绝花青素使之免受外界不利因素的破环作用,而当水凝胶通过pH值为中性的肠道时,其网格结构迅速溶胀,便于花青素的快速扩散。
表7 蛋白质凝胶体系用于多酚的递送
Table 7 Protein gel systems used for polyphenols delivery

营养素基质成分凝胶剂结构类型递送体系特性姜黄素高粱醇溶蛋白Na2CO3纳米凝胶通过静电逐层沉积法制备空心纳米颗粒对姜黄素的包封效率高于传统的固体纳米颗粒[57]玉米醇溶蛋白酪蛋白酸钠纳米凝胶果胶包衣进一步提高了纳米颗粒包埋姜黄素的能力,并在胃肠道条件下表现出缓释作用[58]玉米醇溶蛋白酪蛋白酸钠纳米凝胶含有果胶的纳米颗粒进一步提高了姜黄素的稳定性[59]槲皮素大豆分离蛋白CaCl2乳液凝胶与粗乳液、高内相乳液相比,乳液凝胶内的槲皮素表现出更高的生物可及性[60]
蛋白质凝胶的亲水性和疏水性使得多酚具有更好的溶解性和稳定性,从而提高了其生物可及性。这种凝胶还可以有效抑制多酚的结晶,增强其生物活性。此外,通过调节凝胶的pH值能够进一步提高多酚的稳定性。因此,蛋白质凝胶用于多酚递送在提高其生物可及性方面显示出了较为广阔的应用前景。
2.2 类胡萝卜素的递送
乳蛋白不仅是将必需营养物质从母亲输送到新生儿的天然载体,同时在食品领域也展现出广泛的应用前景,其高可用性和卓越的营养价值使得乳蛋白成为食品制备中备受追捧的原材料。研究人员将类胡萝卜素与乳蛋白相结合,为开发功能性食品提供了具有前景的策略,相关实验结果如表8所示。MEHRAD等[51]通过利用棕榈酸、玉米油、乳清分离蛋白制备了固体脂质纳米颗粒用于包裹β-胡萝卜素。该实验结果表明,乳清分离蛋白的引入增强了体系的胶体稳定性,从而提高了β-胡萝卜素的物化稳定性,并显著增强了其抗氧化稳定性。LU等[61]发现在乳液凝胶中添加椰子油有助于形成结构致密、强度高的凝胶,从而提高β-胡萝卜素在光刺激和热处理下的稳定性。另外,LU等[62]观察到变性蛋白质含量高的乳液凝胶能够更好地保留β-胡萝卜素,研究人员推测可能是因为变性蛋白质含量高的凝胶具有更致密的结构,可以有效防止嵌入的功能成分与外部环境压力的接触。LU等[63]将变性乳清蛋白引入到乳清分离蛋白、酪蛋白、大豆分离蛋白和乳铁蛋白的细乳液中,并制备出乳液凝胶。该研究揭示了通过改变凝胶的物理特性,能够精确控制β-胡萝卜素的释放速度。这一发现为针对特定人群健康需求开发定制化功能性食品提供了依据,尤其是胃肠系统的健康状况要求β-胡萝卜素缓慢释放的老年群体或有特殊营养需求的疾病患者或健康消费者。此外,通过调整凝胶的特性,不仅能够优化营养成分的释放,还能够提升食品的感官品质,确保消费者拥有更好的食用体验。
表8 蛋白质凝胶体系用于类胡萝卜素的递送
Table 8 Protein gel systems used for carotenoid delivery

营养素基质成分凝胶剂结构类型递送体系特性番茄红素海藻酸钠乳清分离蛋白大豆分离蛋白CaCl2乳液凝胶珠乳液凝胶珠在肠道消化过程中实现了对番茄红素的缓释作用[64]岩藻黄素阿拉伯胶海藻酸钠明胶CaCl2水凝胶珠水凝胶珠提高了岩藻黄素的稳定性,并在小肠中实现对其的缓释作用[65]叶黄素玉米醇溶蛋白大豆多糖水凝胶制备方法简便,可增加叶黄素水化学稳定性和生物利用度[66]虾青素壳寡糖玉米醇溶蛋白水凝胶工艺简便,可提高虾青素稳定性和生物利用度,并在一定条件下表现出缓释作用[67]玉米黄质牛奶瓜尔胶黄原胶水凝胶可提高玉米黄质稳定性和生物利用度,并在体外消化中调控其释放速率[68]
通过调整制备工艺(如使用改性乳清分离蛋白、选用特定结构的油相等),研究人员能够开发出结构紧凑且具有高机械强度的凝胶体系,从而保护类胡萝卜素免受环境因素的影响,确保其营养价值得以被保持。此外,应用此类凝胶体系,可实现对类胡萝卜素的精确控制和靶向释放,提高类胡萝卜素的吸收效率。基于此,乳清分离蛋白因其出色的生物相容性和功能性,目前已成为了递送类胡萝卜素等活性成分的重要载体。
2.3 维生素的递送
维生素是维持生物体正常生命活动所必需的一类有机化合物,具有维持身体健康、预防疾病和调节代谢等多种生理功能。然而,人体不能够自主合成维生素,必须通过饮食来获取。在现实生活中,不恰当的食物储存方式和过度的食物烹饪往往导致维生素在食物中的流失,从而减少人体维生素的摄入量,并降低维生素的生物利用度。为了解决这种维生素摄入不足的问题,研究人员已经开始研发维生素补充食品,其中,使用蛋白质凝胶来保护和递送维生素成为一种重要的方法,相关研究内容如表9所示。TEIMOURI等[69]发现利用京尼平、明胶、维生素B6制备的凝胶不仅增强了维生素B6的稳定性,而且通过这些成分的协同作用,进一步提高了维生素B6的生物利用度。明胶作为一种多功能的生物相容材料,在此类凝胶递送体系中发挥着关键作用。其与交联剂的相互作用形成的稳定水凝胶能够有效地封装并稳定维生素B6。由于维生素B6的释放与可与明胶的降解同步进行,使得维生素B6以一种可控且适应生理条件的方式被释放。通过调整明胶的交联条件,可以精确调节明胶水凝胶的交联密度,从而改变明胶载体的降解速率,进而控制维生素B6的释放速率。此外,CHAPEAU等[70]发现,采用乳铁蛋白共组装的凝胶对维生素B9实现了较高的包封率,保障了维生素B9的稳定性和缓释效果。WANG等[71]则通过制备β-乳球蛋白和α-乳蛋白的复合体,成功提高了维生素B12的热稳定性和光稳定性。该实验表明,在胃液中这种复合体不仅增强了维生素B12的稳定性,还实现了对维生素的缓慢释放,延长了其作用于人体的时间,从而提高了其生物利用度。
表9 蛋白质凝胶体系用于维生素的递送
Table 9 Protein gel systems used for vitamin delivery

营养素基质成分凝胶剂结构类型递送体系特性α-生育酚β-乳球蛋白海藻酸钠鸡蛋清蛋白CaCl2水凝胶使用藻酸盐来包裹水凝胶颗粒,可以进一步调控α-生育酚的释放速率[72]β-乳球蛋白CaCl2乳液凝胶提高了α-生育酚的稳定性并实现了缓慢释放[73]维生素D3乳清分离蛋白莲藕支链淀粉水凝胶提高了维生素D3的储存稳定性,保护其免受光化学降解,并延长其在肠道中的停留时间[74]核黄素玉米纤维胶大豆分离蛋白葡萄糖酸-δ-内酯水凝胶在肠道内实现对核黄素的缓释作用[75]
当前的研究证实了蛋白质凝胶在封装维生素方面的出色表现。该体系能够有效提升维生素在不同环境条件下的稳定性,尤其是能够提高维生素对热和光的抵抗能力。尽管如此,关于蛋白质凝胶在实现维生素靶向释放方面的应用研究还相对匮乏。鉴于不同维生素的独特化学属性和生理功能,未来的研究需要更深入地探讨蛋白质凝胶在维生素靶向释放中的潜力和机制。
2.4 益生菌的递送
目前,大多数益生菌封装方法主要关注益生菌的生存能力,却往往忽略了对其功能和特性的保护。在封装或干燥过程中,益生菌表面性质和功能,涉及到聚集特性、肠黏液黏附能力、拮抗活性和胆盐水解酶活性等方面的特性,可能受到影响。研究人员发现蛋白质凝胶可以为益生菌提供了一个保护性的微环境,有助于维持其生物活性和功能。此外,凝胶多孔的结构和水溶性特性使其成为理想的载体,可以实现益生菌的缓慢释放和靶向输送,相关研究如表10所示。HEIDEBACH等[76]通过采用谷氨酰胺酶诱导的酪蛋白酸盐制备的凝胶,成功封装了副干酪乳杆菌和乳双歧杆菌,并比较了模拟胃液中孵育游离和封装的益生菌的活性和功能,研究人员发现封装在密集的酪蛋白基质中的益生菌能够获得更好的保护。HEIDEBACH等[77]发现蛋白质凝胶体系对两种益生菌有较高的封装率,并且酶促凝胶化这种温和方式能够确保益生菌较高的存活率。GONZ LEZ-FERRERO等[78]利用大豆分离蛋白制备凝胶载体微粒,成功封装了植物乳杆菌和干酪乳杆菌。该研究结果表明,封装在凝胶微粒内的益生菌在储存期间表现出显著的稳定性,并在模拟胃肠液中呈现出更强的生存能力和耐受性。
LEZ-FERRERO等[78]利用大豆分离蛋白制备凝胶载体微粒,成功封装了植物乳杆菌和干酪乳杆菌。该研究结果表明,封装在凝胶微粒内的益生菌在储存期间表现出显著的稳定性,并在模拟胃肠液中呈现出更强的生存能力和耐受性。
表10 蛋白质凝胶体系用于益生菌的递送
Table 10 Protein gel systems used for probiotic delivery
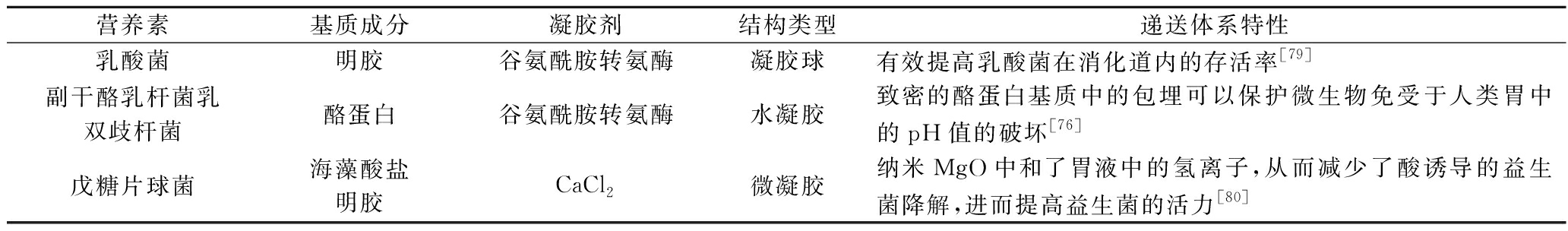
营养素基质成分凝胶剂结构类型递送体系特性乳酸菌明胶谷氨酰胺转氨酶凝胶球有效提高乳酸菌在消化道内的存活率[79]副干酪乳杆菌乳双歧杆菌酪蛋白谷氨酰胺转氨酶水凝胶致密的酪蛋白基质中的包埋可以保护微生物免受于人类胃中的pH值的破坏[76]戊糖片球菌海藻酸盐明胶CaCl2微凝胶纳米MgO中和了胃液中的氢离子,从而减少了酸诱导的益生菌降解,进而提高益生菌的活力[80]
蛋白质凝胶载体的使用为益生菌的稳定性和生物活性维护开辟了创新路径。应用这种封装方法,益生菌得以在酸奶、功能性饮品、营养补充剂、婴幼儿食品以及特医食品中保持其功效。不仅丰富了消费者的健康食品选择,增强了产品的营养价值,也为食品工业注入了新的活力。
2.5 其他营养物质的递送
对于包括白藜芦醇、咖啡因和红曲黄在内的众多性质各异的功能性营养成分,蛋白质凝胶体系展现出来巨大的递送潜力,已有的相关研究结果见表11所示。KLEEMANN等[81]通过谷氨酰胺转氨酶诱导乳清蛋白、蛋清蛋白和酪蛋白酸钠的凝胶化,成功制备了水凝胶球和微粒,实现了对鱼油的稳定包裹和递送,展现出其对消化系统的抵抗力,为肠道递送提供了有前景的载体选择。LUO等[82]则利用NaCl诱导乳清分离蛋白制备出乳液凝胶用于负载辣椒素。该实验表明,凝胶硬度的增加会导致类辣椒素分子通过凝胶颗粒的扩散速率降低,从而减轻口腔灼烧感。该研究对于开发辣度可控的食品具有重要意义,有望改善消费者对辛辣食品的感官体验,也可为辛辣食品的加工提供新的优化方向。
表11 蛋白质凝胶体系用于其他营养素的递送
Table 11 Protein gel systems for delivery of other nutrients

营养素基质成分凝胶剂结构类型递送体系特性白藜芦醇豌豆分离蛋白CaCl2纳米凝胶成功保护白藜芦醇并强化了其抗氧化活性[83]咖啡因乳清蛋白柠檬酸水凝胶乳清蛋白与柠檬酸的低温碱催化交联增加了凝胶硬度并减少了凝胶网络中的咖啡因释放[84]辅酶Q10胡椒碱κ-卡拉胶玉米醇溶蛋白水凝胶水凝胶核壳结构显著提高了辅酶Q10和胡椒碱的化学稳定性,并精确控制了释放速度[85]红曲黄大豆分离蛋白κ-卡拉胶KCl水凝胶通过改变水凝胶的紧密程度,可实现对色素的缓释作用[86]
这些研究成果显著推进了蛋白质凝胶在营养递送系统中的应用,它们不仅验证了蛋白质凝胶在增强其他营养物质稳定性、实现控制释放以及提升生物利用度方面的强大潜力,还为未来的食品和药物递送策略提供了坚实的科学基础。
3 油凝胶递送体系
油凝胶就是将液态油脂限制或固定在一个热可逆的、三维的网络结构中,形成一种具有特定的结构性和功能性的类固体软材料,最终形成由三维网络和其中油脂共存的体系[87]。油凝胶通常通过在有机油相中加入适当的凝胶剂或稳定剂来制备的[88],其稠度和结构特性可通过调整油相成分和凝胶剂浓度来调控,油凝胶的结构为生物活性物质的输送提供了良好的基质,既可以保护生物活性物质的完整性,防止氧化或功能丧失,又可以控制它们的释放速率,相关研究如表12所示。YU等[89]在中链甘油三酯中加热溶解姜黄素,再加入单甘酯硬脂酸酯,最终制备出有机凝胶。该研究结果显示,中链甘油三酯具有高的消化率,从而提高了姜黄素的生物利用率。此外,该研究还比较了几种凝胶剂对中链甘油三酯的凝胶化影响,结果发现只有单甘酯硬脂酸酯作为有机凝胶剂能够形成稳定的有机凝胶并成功转移姜黄素。另一方面,O’SULLIVAN等[90]则利用乙基纤维素和富含β-胡萝卜素的芥花籽油制备了油凝胶。该研究发现,45 Pa·s凝胶网络具有较高的机械强度,使其难以分解,并且具备缓慢释放的能力。由于β-胡萝卜素亲油而疏水,可以通过与油性物质结合的方式来增加凝胶对其的承载量。总之,油凝胶作为载体在生物活性物质递送方面具有巨大的潜力。它能够保护和稳定营养物质,并通过调控凝胶结构实现精准的释放。
表12 油凝胶体系用于营养素的递送
Table 12 Oleogel systems used for nutrient delivery

营养素基质成分凝胶剂递送体系特性姜黄素鱼油氢化菜籽油紧密的凝胶结构不仅可以提高姜黄素的稳定性,还有助于延缓油的氧化[91]玉米油乙基纤维素通过减少脂质氧化、提高姜黄素溶解度和化学稳定性来提高姜黄素的负载量[92]β-胡萝卜素芥花籽油乙基纤维素高机械强度凝胶网络保护了β-胡萝卜素的生物活性[90]玉米油单酰甘油醇单酰甘油醇的加入可以改善β-胡萝卜素的热/光稳定性和溶解度[93]叶黄素向日葵油单酰甘油醇单酰甘油醇含量的增加,成功提高了叶黄素的光稳定性[94]阿魏酸橄榄油多廿烷醇油凝胶为阿魏酸在胃肠道内提供了有效的缓释作用[95]D-柠檬烯中链甘油三酯硬脂酸调节硬脂酸的浓度可以提高了D-柠檬烯的储存稳定性[96]
尽管油凝胶递送体系在脂溶性营养素的应用上已取得初步成果,但该领域的研究仍处于起步阶段,主要集中在油凝胶对脂溶性成分的封装与保护。对于水溶性营养素的油凝胶递送系统,相关研究尚显不足。未来的研究工作需致力于深入探索和改进油凝胶的结构设计及功能特性,以便更有效地递送水溶性营养素,提升其在复杂生理环境中的稳定性和生物利用度。这将为开发新型高效营养递送系统提供理论基础和技术支持,进一步拓宽油凝胶在食品科学和营养健康领域的应用前景。
4 总结与展望
食品凝胶以其卓越的生物相容性和稳定性被认为是生物活性成分的优良递送载体,可有效保护生物活性成分免受氧化、光照和酶降解等环境因素的侵害,并通过结构变化实现对营养物质的精准释放。在实际应用中,食品凝胶在调整食品的质构、加工工艺、感官特性、稳定性和营养特性等方面发挥关键作用。随着人们对食品营养和健康的日益关注,未来的研究可致力于开发适应特定人群需求的功能性食品,从而进一步拓展食品凝胶在个性化饮食中的应用。然而,作为递送体系的物质基础,凝胶本身与其他食品成分的相互作用仍需要深入研究,这将有助于更好地发挥食品凝胶在食品科学和营养学领域的潜力,为创新的食品科技和更健康的生活方式提供有益的指导。
[1] MAURYA V K, SINGH J, RANJAN V, et al.Factors affecting the fate of β-carotene in the human gastrointestinal tract:A narrative review[J].International Journal for Vitamin and Nutrition Research.Internationale Zeitschrift Fur Vitamin- Und Ernahrungsforschung.Journal International De Vitaminologie et De Nutrition, 2022, 92(5-6):385-405.
[2] RAUF A, IMRAN M, ORHAN I E, et al.Health perspectives of a bioactive compound curcumin:A review[J].Trends in Food Science &Technology, 2018, 74:33-45.
[3] WINTERGERST E S, MAGGINI S, HORNIG D H.Immune-enhancing role of vitamin C and zinc and effect on clinical conditions[J].Annals of Nutrition &Metabolism, 2006, 50(2):85-94.
[4] REID G.Probiotics:Definition, scope and mechanisms of action[J].Best Practice &Research.Clinical Gastroenterology, 2016, 30(1):17-25.
[5] 邢慧颖, 黄莉, 丁波, 等.体外消化对不同极性植物多酚的抗氧化能力及生物利用度的影响[J].食品与发酵工业, 2020, 46(16):70-77.XING H Y, HUANG L, DING B, et al.Effects of in vitro digestion on antioxidant activity and bioavailability of plant polyphenols with different polarities[J].Food and Fermentation Industries, 2020, 46(16):70-77.
[6] 朱荻, 陈莎男, 梅晓宏, 等.提高益生菌耐加工贮藏稳定性和体内存活率的递送系统研究进展[J].食品科学, 2023, 44(21):1-13.ZHU D, CHEN S N, MEI X H, et al.Advances in the delivery systems for improving the processing stability, storage stability and in vivo survival rate of probiotics[J].Food Science, 2023, 44(21):1-13.
[7] ZHENG B J, PENG S F, ZHANG X Y, et al.Impact of delivery system type on curcumin bioaccessibility:Comparison of curcumin-loaded nanoemulsions with commercial curcumin supplements[J].Journal of Agricultural and Food Chemistry, 2018, 66(41):10816-10826.
[8] QIAN C, DECKER E A, XIAO H, et al.Inhibition of β-carotene degradation in oil-in-water nanoemulsions:Influence of oil-soluble and water-soluble antioxidants[J].Food Chemistry, 2012, 135(3):1036-1043.
[9] KAMESHIMA Y, SASAKI H, ISOBE T, et al.Synthesis of composites of sodium oleate/Mg-Al-ascorbic acid-layered double hydroxides for drug delivery applications[J].International Journal of Pharmaceutics, 2009, 381(1):34-39.[10] KRUNI T Ž, BULATOVI
T Ž, BULATOVI M L J, OBRADOVI
M L J, OBRADOVI N S, et al.Effect of immobilisation materials on viability and fermentation activity of dairy starter culture in whey-based substrate[J].Journal of the Science of Food and Agriculture, 2016, 96(5):1723-1729.
N S, et al.Effect of immobilisation materials on viability and fermentation activity of dairy starter culture in whey-based substrate[J].Journal of the Science of Food and Agriculture, 2016, 96(5):1723-1729.
[11] BANERJEE S, BHATTACHARYA S.Food gels:Gelling process and new applications[J].Critical Reviews in Food Science and Nutrition, 2012, 52(4):334-346.
[12] 胡新宇. 植物单宁构筑的水凝胶材料及其生物医药应用[J].生物质化学工程, 2023, 57(4):1-16.HU X Y.Plant tannin-based hydrogel materials and their biomedical applications[J].Biomass Chemical Engineering, 2023, 57(4):1-16.
[13] 黄来发. 食品增稠剂[M].2版.北京:中国轻工业出版社, 2009.HUANG L F.Food Thickener[M].2nd ed.Beijing:China Light Industry Press, 2009.
[14] 杨镕, 臧一宇, 吴鹏, 等.多糖类食品胶体的功能特性及其在食品加工中的应用研究进展[J].食品科学, 2024, 45(5):283-292.YANG R, ZANG Y Y, WU P, et al.Research progress on functional properties of polysaccharide-based food colloids and their application in food processing[J].Food Science, 2024, 45(5):283-292.
[15] 孟凡玲, 罗亮, 宁辉, 等.κ-卡拉胶研究进展[J].高分子通报, 2003(5):49-56.MENG F L, LUO L, NING H, et al.Advances in the research of κ-carrageenan[J].Polymer Bulletin, 2003(5):49-56.
[16] 王秀娟, 张坤生, 任云霞, 等.海藻酸钠凝胶特性的研究[J].食品工业科技, 2008, 29(2):259-262.WANG X J, ZHANG K S, REN Y X, et al.Study on the gelling properties of sodium alginate[J].Science and Technology of Food Industry, 2008, 29(2):259-262.
[17] 刘海燕, 张健, 李贞, 等.不同理化因素对海藻酸钠凝胶特性的影响[J].粮油食品科技, 2018, 26(2):45-48.LIU H Y, ZHANG J, LI Z, et al.Effects of different physicochemical factors on properties of sodium alginate gel[J].Science and Technology of Cereals, Oils and Foods, 2018, 26(2):45-48.
[18] ZHONG H W, GAO X R, CHENG C, et al.The structural characteristics of seaweed polysaccharides and their application in gel drug delivery systems[J].Marine Drugs, 2020, 18(12):658.
[19] LI Y H, WANG Y S, ZHAO J S, et al.A pH-sensitive curcumin loaded microemulsion-filled alginate and porous starch composite gels:Characterization, in vitro release kinetics and biological activity[J].International Journal of Biological Macromolecules, 2021, 182:1863-1873.
[20] SONG H Y, YU W T, GAO M, et al.Microencapsulated probiotics using emulsification technique coupled with internal or external gelation process[J].Carbohydrate Polymers, 2013, 96(1):181-189.
[21] ZHU K, YU D, CHEN X Y, et al.Preparation, characterization and controlled-release property of Fe3+ cross-linked hydrogels based on peach gum polysaccharide[J].Food Hydrocolloids, 2019, 87:260-269.
[22] 王亦欣, 陈茜, 匡映, 等.植物多糖气凝胶材料应用的研究进展[J].武汉工程大学学报, 2017, 39(5):443-449.WANG Y X, CHEN X, KUANG Y, et al.Progress in application of polysaccharide aerogels[J].Journal of Wuhan Institute of Technology, 2017, 39(5):443-449.
[23] MORRIS E R, NISHINARI K, RINAUDO M.Gelation of gellan:A review[J].Food Hydrocolloids, 2012, 28(2):373-411.
[24] GUO J X, GIUSTI M M, KALETUNÇ G.Encapsulation of purple corn and blueberry extracts in alginate-pectin hydrogel particles:Impact of processing and storage parameters on encapsulation efficiency[J].Food Research International, 2018, 107:414-422.
[25] LU M L, LI Z J, LIANG H, et al.Controlled release of anthocyanins from oxidized konjac glucomannan microspheres stabilized by chitosan oligosaccharides[J].Food Hydrocolloids, 2015, 51:476-485.
[26] CAO Y P, MEZZENGA R.Design principles of food gels[J].Nature Food, 2020, 1(2):106-118.
[27] WU C H, SUN J S, JIANG H X, et al.Construction of carboxymethyl konjac glucomannan/chitosan complex nanogels as potential delivery vehicles for curcumin[J].Food Chemistry, 2021, 362:130242.
[28] ZHANG B, MENG R, LI X L, et al.Preparation of Pickering emulsion gels based on κ-carrageenan and covalent crosslinking with EDC:Gelation mechanism and bioaccessibility of curcumin[J].Food Chemistry, 2021, 357:129726.
[29] CHEN X, MCCLEMENTS D J, ZHU Y Q, et al.Gastrointestinal fate of fluid and gelled nutraceutical emulsions:Impact on proteolysis, lipolysis, and quercetin bioaccessibility[J].Journal of Agricultural and Food Chemistry, 2018, 66(34):9087-9096.
[30] JIN W P, XIANG L, PENG D F, et al.Study on the coupling progress of thermo-induced anthocyanins degradation and polysaccharides gelation[J].Food Hydrocolloids, 2020, 105:105822.
[31] LIMWACHIRANON J, HUANG H, LI L, et al.Enhancing stability and bioaccessibility of chlorogenic acid using complexation with amylopectin:A comprehensive evaluation of complex formation, properties, and characteristics[J].Food Chemistry, 2020, 311:125879.
[32] HU X Y, WANG Y M, ZHANG L L, et al.Construction of self-assembled polyelectrolyte complex hydrogel based on oppositely charged polysaccharides for sustained delivery of green tea polyphenols[J].Food Chemistry, 2020, 306:125632.
[33] ZHENG H X, MAO L K, CUI M N, et al.Development of food-grade bigels based on κ-carrageenan hydrogel and monoglyceride oleogels as carriers for β-carotene:Roles of oleogel fraction[J].Food Hydrocolloids, 2020, 105:105855.
[34] RAVI H, BASKARAN V.Biodegradable chitosan-glycolipid hybrid nanogels:A novel approach to encapsulate fucoxanthin for improved stability and bioavailability[J].Food Hydrocolloids, 2015, 43:717-725.
[35] JAIN S, WINUPRASITH T, SUPHANTHARIKA M.Encapsulation of lycopene in emulsions and hydrogel beads using dual modified rice starch:Characterization, stability analysis and release behaviour during in-vitro digestion[J].Food Hydrocolloids, 2020, 104:105730.
[36] SOUKOULIS C, CAMBIER S, HOFFMANN L, et al.Chemical stability and bioaccessibility of β-carotene encapsulated in sodium alginate o/w emulsions:Impact of Ca2+ mediated gelation[J].Food Hydrocolloids, 2016, 57:301-310.
[37] MUN S, KIM Y R, MCCLEMENTS D J.Control of β-carotene bioaccessibility using starch-based filled hydrogels[J].Food Chemistry, 2015, 173:454-461.
[38] DENG Z Y, LI J, SONG R, et al.Carboxymethylpachymaran/alginate gel entrapping of natural pollen capsules for the encapsulation, protection and delivery of probiotics with enhanced viability[J].Food Hydrocolloids, 2021, 120:106855.
[39] BEPEYEVA A, DE BARROS J M S, ALBADRAN H, et al.Encapsulation of Lactobacillus casei into calcium pectinate-chitosan beads for enteric delivery[J].Journal of Food Science, 2017, 82(12):2954-2959.
[40] FENG K, HUANG R M, WU R Q, et al.A novel route for double-layered encapsulation of probiotics with improved viability under adverse conditions[J].Food Chemistry, 2020, 310:125977.
[41] ASHWAR B A, GANI A, GANI A, et al.Production of RS4 from rice starch and its utilization as an encapsulating agent for targeted delivery of probiotics[J].Food Chemistry, 2018, 239:287-294.
[42] GEREZ C L, FONT DE VALDEZ G, GIGANTE M L, et al.Whey protein coating bead improves the survival of the probiotic Lactobacillus rhamnosus CRL 1505 to low pH[J].Letters in Applied Microbiology, 2012, 54(6):552-556.
[43] GEBARA C, CHAVES K S, RIBEIRO M C E, et al.Viability of Lactobacillus acidophilus La5 in pectin-whey protein microparticles during exposure to simulated gastrointestinal conditions[J].Food Research International, 2013, 51(2):872-878.
[44] UBEYITOGULLARI A, MOREAU R, ROSE D J, et al.In vitro bioaccessibility of low-crystallinity phytosterol nanoparticles generated using nanoporous starch bioaerogels[J].Journal of Food Science, 2019, 84(7):1812-1819.
[45] YAN L, WANG L, GAO S J, et al.Celery cellulose hydrogel as carriers for controlled release of short-chain fatty acid by ultrasound[J].Food Chemistry, 2020, 309:125717.
[46] LIMA D S, TEN RIO-NETO E T, LIMA-TEN
RIO-NETO E T, LIMA-TEN RIO M K, et al.pH-responsive alginate-based hydrogels for protein delivery[J].Journal of Molecular Liquids, 2018, 262:29-36.
RIO M K, et al.pH-responsive alginate-based hydrogels for protein delivery[J].Journal of Molecular Liquids, 2018, 262:29-36.
[47] 胡颜寓, 陈凤颖, 曹文琪, 等.加热方式和加热时间对鱼类明胶理化性质的影响[J].食品工业科技, 2022, 43(2):77-83.HU Y Y, CHEN F Y, CAO W Q, et al.Effect of heating method and heating time on physicochemical properties of fish gelatin[J].Science and Technology of Food Industry, 2022, 43(2):77-83.
[48] 尹朝阳, 石文琪, 李卫东, 等.水产品源明胶的制备工艺、理化性质及结构的研究进展[J].食品研究与开发, 2023, 44(7):193-203.YIN Z Y, SHI W Q, LI W D, et al.Preparation technology, physicochemical properties and structure of aquatic product-derived gelatin[J].Food Research and Development, 2023, 44(7):193-203.
[49] 孙哲浩, 赵谋明, 张源, 等.明胶与к-卡拉胶交互作用特性及机理的研究:明胶与卡拉胶共凝胶体的力学特性[J].食品科学, 2001, 22(1):14-18.SUN Z H, ZHAO M M, ZHANG Y, et al.Interaction of gelatin with carrageenan-the mechnical properties of gelatin arrageenan co-gels[J].Food Science, 2001, 22(1):14-18.
[50] PE A-RAMOS E A, XIONG Y L.Antioxidative activity of whey protein hydrolysates in a liposomal system[J].Journal of Dairy Science, 2001, 84(12):2577-2583.
A-RAMOS E A, XIONG Y L.Antioxidative activity of whey protein hydrolysates in a liposomal system[J].Journal of Dairy Science, 2001, 84(12):2577-2583.
[51] MEHRAD B, RAVANFAR R, LICKER J, et al.Enhancing the physicochemical stability of β-carotene solid lipid nanoparticle (SLNP) using whey protein isolate[J].Food Research International, 2018, 105:962-969.
[52] LEE K Y, YUK S H.Polymeric protein delivery systems[J].Progress in Polymer Science, 2007, 32(7):669-697.
[53] ZHAN X Y, DAI L, ZHANG L, et al.Entrapment of curcumin in whey protein isolate and zein composite nanoparticles using pH-driven method[J].Food Hydrocolloids, 2020, 106:105839.
[54] LI L, YAO P.High dispersity, stability and bioaccessibility of curcumin by assembling with deamidated zein peptide[J].Food Chemistry, 2020, 319:126577.
[55] WANG T, YANG Y, FENG W, et al.Co-folding of hydrophobic rice proteins and shellac in hydrophilic binary microstructures for cellular uptake of apigenin[J].Food Chemistry, 2020, 309:125695.
[56] BETZ M, KULOZIK U.Whey protein gels for the entrapment of bioactive anthocyanins from bilberry extract[J].International Dairy Journal, 2011, 21(9):703-710.
[57] LI X F, MALDONADO L, MALMR M, et al.Development of hollow kafirin-based nanoparticles fabricated through layer-by-layer assembly as delivery vehicles for curcumin[J].Food Hydrocolloids, 2019, 96:93-101.
[58] CHANG C, WANG T R, HU Q B, et al.Pectin coating improves physicochemical properties of caseinate/zein nanoparticles as oral delivery vehicles for curcumin[J].Food Hydrocolloids, 2017, 70:143-151.
[59] CHANG C, WANG T R, HU Q B, et al.Caseinate-zein-polysaccharide complex nanoparticles as potential oral delivery vehicles for curcumin:Effect of polysaccharide type and chemical cross-linking[J].Food Hydrocolloids, 2017, 72:254-262.
[60] DU X Q, HU M, LIU G N, et al.Development and evaluation of delivery systems for quercetin:A comparative study between coarse emulsion, nano-emulsion, high internal phase emulsion, and emulsion gel[J].Journal of Food Engineering, 2022, 314:110784.
[61] LU Y, MAO L K, CUI M N, et al.Effect of the solid fat content on properties of emulsion gels and stability of β-carotene[J].Journal of Agricultural and Food Chemistry, 2019, 67(23):6466-6475.
[62] LU Y, MAO L K, ZHENG H X, et al.Characterization of β-carotene loaded emulsion gels containing denatured and native whey protein[J].Food Hydrocolloids, 2020, 102:105600.
[63] LU Y, ZHANG Y H, YUAN F, et al.Emulsion gels with different proteins at the interface:Structures and delivery functionality[J].Food Hydrocolloids, 2021, 116:106637.
[64] LIN D Q, KELLY A L, MAIDANNYK V, et al.Effect of structuring emulsion gels by whey or soy protein isolate on the structure, mechanical properties, and in-vitro digestion of alginate-based emulsion gel beads[J].Food Hydrocolloids, 2021, 110:106165.
[65] LI Y, DOU X Y, PANG J H, et al.Improvement of fucoxanthin oral efficacy via vehicles based on gum Arabic, gelatin and alginate hydrogel[J].Journal of Functional Foods, 2019, 63:103573.
[66] LI H, YUAN Y K, ZHU J X, et al.Zein/soluble soybean polysaccharide composite nanoparticles for encapsulation and oral delivery of lutein[J].Food Hydrocolloids, 2020, 103:105715.
[67] JIANG G L, ZHU M J.Preparation of astaxanthin-encapsulated complex with zein and oligochitosan and its application in food processing[J].LWT, 2019, 106:179-185.
[68] DE CAMPO C, QUEIROZ ASSIS R, MARQUES DA SILVA M, et al.Incorporation of zeaxanthin nanoparticles in yogurt:Influence on physicochemical properties, carotenoid stability and sensory analysis[J].Food Chemistry, 2019, 301:125230.
[69] TEIMOURI S, MORRISH C, PANYOYAI N, et al.Diffusion and relaxation contributions in the release of vitamin B6 from a moving boundary of genipin crosslinked gelatin matrices[J].Food Hydrocolloids, 2019, 87:839-846.
[70] CHAPEAU A L, TAVARES G M, HAMON P, et al.Spontaneous co-assembly of lactoferrin and β-lactoglobulin as a promising biocarrier for vitamin B9[J].Food Hydrocolloids, 2016, 57:280-290.
[71] WANG H H, SHOU Y K, ZHU X, et al.Stability of vitamin B12 with the protection of whey proteins and their effects on the gut microbiome[J].Food Chemistry, 2019, 276:298-306.
[72] SOMCHUE W, SERMSRI W, SHIOWATANA J, et al.Encapsulation of α-tocopherol in protein-based delivery particles[J].Food Research International, 2009, 42(8):909-914.
[73] LIANG L, LEUNG SOK LINE V, REMONDETTO G E, et al.In vitro release of α-tocopherol from emulsion-loaded β-lactoglobulin gels[J].International Dairy Journal, 2010, 20(3):176-181.
[74] LIU K, KONG X L, LI Q M, et al.Stability and bioavailability of vitamin D3 encapsulated in composite gels of whey protein isolate and lotus root amylopectin[J].Carbohydrate Polymers, 2020, 227:115337.
[75] YAN W J, ZHANG B Y, YADAV M P, et al.Corn fiber gum-soybean protein isolate double network hydrogel as oral delivery vehicles for thermosensitive bioactive compounds[J].Food Hydrocolloids, 2020, 107:105865.
[76] HEIDEBACH T, FÖRST P, KULOZIK U.Transglutaminase-induced caseinate gelation for the microencapsulation of probiotic cells[J].International Dairy Journal, 2009, 19(2):77-84.
[77] HEIDEBACH T, FÖRST P, KULOZIK U.Microencapsulation of probiotic cells by means of rennet-gelation of milk proteins[J].Food Hydrocolloids, 2009, 23(7):1670-1677.
[78] GONZ LEZ-FERRERO C, IRACHE J M, GONZ
LEZ-FERRERO C, IRACHE J M, GONZ LEZ-NAVARRO C J.Soybean protein-based microparticles for oral delivery of probiotics with improved stability during storage and gut resistance[J].Food Chemistry, 2018, 239:879-888.
LEZ-NAVARRO C J.Soybean protein-based microparticles for oral delivery of probiotics with improved stability during storage and gut resistance[J].Food Chemistry, 2018, 239:879-888.
[79] NAWONG S, OONSIVILAI R, BOONKERD N, et al.Entrapment in food-grade transglutaminase cross-linked gelatin-maltodextrin microspheres protects Lactobacillus spp.during exposure to simulated gastro-intestinal juices[J].Food Research International, 2016, 85:191-199.
[80] YAO M F, LI B, YE H W, et al.Enhanced viability of probiotics (Pediococcus pentosaceus Li05) by encapsulation in microgels doped with inorganic nanoparticles[J].Food Hydrocolloids, 2018, 83:246-252.
[81] KLEEMANN C, SCHUSTER R, ROSENECKER E, et al.In-vitro-digestion and swelling kinetics of whey protein, egg white protein and sodium caseinate aerogels[J].Food Hydrocolloids, 2020, 101:105534.
[82] LUO N, YE A Q, WOLBER F M, et al.Structure of whey protein emulsion gels containing capsaicinoids:Impact on in-mouth breakdown behaviour and sensory perception[J].Food Hydrocolloids, 2019, 92:19-29.
[83] FAN Y T, ZENG X X, YI J, et al.Fabrication of pea protein nanoparticles with calcium-induced cross-linking for the stabilization and delivery of antioxidative resveratrol[J].International Journal of Biological Macromolecules, 2020, 152:189-198.
[84] ZAND-RAJABI H, MADADLOU A.Citric acid cross-linking of heat-set whey protein hydrogel influences its textural attributes and caffeine uptake and release behaviour[J].International Dairy Journal, 2016, 61:142-147.
[85] CHEN S, ZHANG Y H, QING J, et al.Core-shell nanoparticles for co-encapsulation of coenzyme Q10 and piperine:Surface engineering of hydrogel shell around protein core[J].Food Hydrocolloids, 2020, 103:105651.
[86] ZHANG Q, GU L P, SU Y J, et al.Development of soy protein isolate/κ-carrageenan composite hydrogels as a delivery system for hydrophilic compounds:Monascus yellow[J].International Journal of Biological Macromolecules, 2021, 172:281-288.
[87] PERNETTI M, VAN MALSSEN K F, FLÖTER E, et al.Structuring of edible oils by alternatives to crystalline fat[J].Current Opinion in Colloid &Interface Science, 2007, 12(4-5):221-231.
[88] OKURO P K, MARTINS A J, VICENTE A A, et al.Perspective on oleogelator mixtures, structure design and behaviour towards digestibility of oleogels[J].Current Opinion in Food Science, 2020, 35:27-35.
[89] YU H L, SHI K, LIU D, et al.Development of a food-grade organogel with high bioaccessibility and loading of curcuminoids[J].Food Chemistry, 2012, 131(1):48-54.
[90] O′SULLIVAN C M, DAVIDOVICH-PINHAS M, WRIGHT A J, et al.Ethylcellulose oleogels for lipophilic bioactive delivery-effect of oleogelation on in vitro bioaccessibility and stability of beta-carotene[J].Food &Function, 2017, 8(4):1438-1451.
[91] VELLIDO-PÉREZ J A, RODR GUEZ-REMACHO C, RODR
GUEZ-REMACHO C, RODR GUEZ-RODR
GUEZ-RODR GUEZ J, et al.Optimization of oleogel formulation for curcumin vehiculization and lipid oxidation stability by multi-response surface methodology[J].Chemical Engineering Transactions, 2019, 75:427-432.
GUEZ J, et al.Optimization of oleogel formulation for curcumin vehiculization and lipid oxidation stability by multi-response surface methodology[J].Chemical Engineering Transactions, 2019, 75:427-432.
[92] LIU N, LU Y, ZHANG Y H, et al.Surfactant addition to modify the structures of ethylcellulose oleogels for higher solubility and stability of curcumin[J].International Journal of Biological Macromolecules, 2020, 165(Pt B):2286-2294.
[93] CUI M N, MAO L K, LU Y, et al.Effect of monoglyceride content on the solubility and chemical stability of β-carotene in organogels[J].LWT, 2019, 106:83-91.
[94] JIANG Z J, GENG S, LIU C Z, et al.Preparation and characterization of lutein ester-loaded oleogels developed by monostearin and sunflower oil[J].Journal of Food Biochemistry, 2019, 43(11):e12992.
[95] LUPI F R, GABRIELE D, BALDINO N, et al.Olive oil/policosanol organogels for nutraceutical and drug delivery purposes[J].Food &Function, 2013, 4(10):1512-1520.
[96] ZAHI M R, WAN P Y, LIANG H, et al.Formation and stability of D-limonene organogel-based nanoemulsion prepared by a high-pressure homogenizer[J].Journal of Agricultural and Food Chemistry, 2014, 62(52):12563-12569.