近年来,人口老龄化问题日益凸显,关于衰老的相关研究越来越受重视。衰老是一种复杂的生理退化过程现象。随着个体年龄的增长,细胞、组织和器官会发生退行性变化,从而引起退行性疾病的发生,最终导致衰老相关疾病的发展和生命的终结[1]。如何延缓衰老是现代社会人们面临的一大挑战。在临床上,大多数抗衰老药物,如雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)抑制剂、二甲双胍和烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)增强剂,长期给药会引起严重的副作用[2]。因此,寻找更安全、更有效的延缓衰老的产品是抗衰老研究的目标。
如今越来越多来自天然药物资源的化学成分,如类黄酮、多酚、皂苷、多糖、氨基酸等,已被人们发现在抗衰老方面具有巨大的潜力[3]。卡拉胶(carrageenan),又称角叉菜胶、鹿角菜胶,是一种来源于海洋红藻的重要天然生物活性产物[4]。其富有多种新型的生物活性,如抗氧化、抗肿瘤、抗凝血、抗血管生成活性,具有良好的保健作用和药用效果,多应用于食品、药品、化妆品等工业中[5]。在制药方面,卡拉胶在体内和体外作用中都显示出潜在的抗氧化和免疫调节特性。它还通过动态调节重要的细胞内信号通路、调节活性氧(reactive oxygen species,ROS)积聚,有助于潜在疾病的预防[6]。但卡拉胶是一种大分子硫酸化多糖,水不溶性和组织渗透性差,不易被生物体消化吸收,其应用范围受到限制[7]。卡拉胶寡糖是卡拉胶的降解产物,与卡拉胶多糖相比,其具有分子质量低、理化性质独特等特点,提供了改进的生物学特征和更高的生物医学和治疗应用潜力,极大地拓宽了卡拉胶的应用范围[8]。RELLEVE等[5]指出,分子质量较低的κ-卡拉胶寡糖比多糖表现出更好的抗氧化活性。目前国内外关于卡拉胶寡糖的研究大多局限于抗氧化、抗炎以及抗肿瘤等相关研究领域,基于秀丽隐杆线虫生物模型探究卡拉胶寡糖的抗衰老相关研究报道较少。
在这项工作中,我们研究了卡拉胶寡糖在不同条件下对线虫衰老的影响,以延长生物体寿命。秀丽隐杆线虫具有寿命短、身体透明、基因组序列完整以及长寿途径保守等显著特点,在天然抗氧化剂研究方面取得了许多突破[9]。衰老是一个复杂的生物过程,秀丽隐杆线虫是探索天然抗氧化剂的抗衰老机制的重要模型,其已被广泛用于验证各种天然或化学合成的抗衰老药物的疗效和药理机制[10]。因此,本研究旨在研究卡拉胶寡糖对秀丽隐杆线虫的寿命、运动能力、繁殖力、脂褐素、热应激耐受性以及抗氧化酶活性等健康寿命指数的影响,探索卡拉胶寡糖在缓解氧化应激和健康寿命方面的潜力,为卡拉胶寡糖在抗衰老领域的进一步研究和应用提供科学依据。
1 材料与方法
1.1 材料与试剂
N2野生型线虫(Caenorhabditis elegans),Caenorhabditis Genetics Center(美国明尼苏达大学CGC);κ-卡拉胶,青岛海大海洋寡糖科技有限公司;过氧化氢酶(catalase,CAT)试剂盒、还原型谷胱甘肽(reduced Glutathione,GSH)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、总超氧化物歧化酶(superoxide dismutase,SOD)试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
3111恒温培养箱、Arioskan Flash多功能酶标仪、Lynx 6000 高速落地离心机,美国赛默飞公司;EYELA旋转蒸发仪,日本东京理化公司;AllegraX-15R冷冻离心机,德国BECKMAN公司;MSI Minishaker涡旋混合仪,德国IKA公司;THZ-103B 恒温培养摇床,上海一恒有限公司;SW-CJ-2F双人单面垂直送风净化工作台,广州吉迪仪器有限公司;B60F正立生物荧光显微镜;SRL7045 体式显微镜,北京天诺翔科学仪器有限公司;1200LC高效液相色谱仪,美国Agilent公司。
1.3 方法
1.3.1 卡拉胶寡糖的制备
基于实验室前期关于光降解卡拉胶制备卡拉胶寡糖的工艺优化研究,配制0.8%(质量分数)κ-卡拉胶的水溶液,随后加入0.8%(质量分数)的TiO2,加入0.3%(质量分数)的H2O2,混合后在300 W 紫灯光照1~5 h,随后加入MnO2除去其中的H2O2,最后12 000 r/min离心20 min 去除TiO2和MnO2,透析干燥得到κ-卡拉胶寡糖粉末。定义卡拉胶经过光降解1 h得到的卡拉胶寡糖粉末为KCO-1(分子质量8.47 kDa),卡拉胶经过光降解5 h得到的卡拉胶寡糖粉末为KCO-5(分子质量1.58 kDa)。
1.3.2 线虫培养和同期化处理
将涂布有适量OP50菌液(浓度为1×109 CFU/mL)的线虫生长培养基(nematode growth medium,NGM)于20 ℃培养箱培养线虫。采用NaClO漂白法对线虫进行同期化处理:用M9缓冲溶液将处于产卵期的线虫成虫洗至无菌EP管中,加入1 mL裂解液(含有2 mol/L NaOH、0.5%(质量分数)NaClO和双蒸水,现配现用)裂解线虫,反复振荡2 min,然后3 000 r/min离心1 min,弃去上清液,加入M9反复清洗2遍以除去裂解液,弃去上清液后用移液枪吸取裂解后所得的线虫体内虫卵,滴加于NGM板中,在20 ℃恒温培养箱中饲养2 d后,虫卵基本发育成L4期幼虫,即完成同期化处理[11]。
1.3.3 实验分组
实验分为2组:将L4期线虫分别转移至等量涂布含低(0.25 mg/mL)、中(0.50 mg/mL)、高(1.00 mg/mL)质量浓度卡拉胶寡糖OP50菌液的NGM板上,每天饲喂等量相应加药的OP50菌液;空白对照组(CD)同等每天饲喂等量OP50菌液。
1.3.4 线虫寿命及运动能力测定
寿命测定是根据HUI等[12]报告的方法进行的,并进行了微小的修改。用不同浓度的KCO-1和KCO-5(0、0.25、0.50和1.00 mg/mL)同步培养L4线虫,且NGM含有 200 mmol/L 5-氟-2-脱氧尿苷(5-fluoro-2′-deoxyuridine,FUDR)以防止子代产生。每天计算一次存活和死亡线虫的数量,线虫在用铂丝触碰 10 s后没有运动且没有反应则认为是死亡的,并将其挑出板外。在第 5、8、12 和 16 d使用立体显微镜评估它们的运动性。将它们的运动标准分为以下几类:A类是自发平稳的运动;C类用铂丝探测时的头部和尾部运动;B类是处于A类和C类之间的中间位置[13]。所有测试重复 3 次。
1.3.5 线虫的体长体宽
参照ZHU等[9]的方法,用不同浓度的KCO-5(0、0.25、0.50和1.00 mg/mL)同步培养L4线虫5 d后,然后用铂丝挑到涂有2%(质量分数)琼脂糖的载玻片上,加入适量麻醉剂(10 mmol/L盐酸四咪唑)进行固定。采用倒置荧光显微镜的软件测量刚性状态下每条线虫的体长体宽。每组测量20条线虫。
1.3.6 线虫繁殖力实验
参照HUI等[12]的方法,稍作修改。用不同质量浓度的KCO-5(0、0.25、0.50和1.00 mg/mL)同步培养L4线虫,每组浓度均10条线虫,每板NGM只存活1条线虫。每培养24 h后将线虫转移到新的NGM上,在后代的L2或L3期阶段对其后代进行计数,5 d内后代总数表示为对应线虫的繁殖数。所有测试重复 3 次。
1.3.7 线虫的热应激测定
参照YANG等[14]的方法,稍作修改。用不同质量浓度的KCO-5(0、0.25、0.50和1.00 mg/mL)同步培养L4线虫5 d后,将线虫放置在35 ℃培养箱中孵育,每1 h对存活和死亡的蠕虫进行计数,直至线虫全部死亡。每组共60条线虫。所有测试重复 3 次。
1.3.8 线虫脂褐素测定
参照ZHU等[9]的方法,用不同质量浓度的KCO-5(0、0.25、0.50和1.00 mg/mL)同步培养L4线虫5 d后,将线虫挑于涂有2%琼脂糖的载玻片上,加入适量麻醉剂(10 mmol/L盐酸四咪唑)进行固定。在荧光显微镜下以380和430 nm的激发/发射波长拍摄每组随机选择的20条线虫。使用 Image J计算脂褐素的强度。
1.3.9 线虫体内ROS含量
参考SHI等[15]的方法,使用2′,7′-二氯荧光素二乙酸酯(2′,7′-dichlorofluorescin diacetate, DCFH-DA)测量内源性ROS水平,并稍作修改。用不同质量浓度的KCO-5(0、0.25、0.50和1.00 mg/mL)同步培养L4线虫5 d后,然后用M9清洗收集并加入10 μmol/L(终浓度)DCFH-DA,随后放置在20 ℃培养箱中避光孵育2 h。培养结束后,线虫经PBS洗涤3次后将线虫挑于涂有2%琼脂糖的载玻片上,并用盖玻片覆盖。使用荧光显微镜拍照,荧光强度用Image J软件进行评估。每次处理至少检查20条线虫。
1.3.10 抗氧化酶活性和MDA水平的测定
用不同质量浓度的KCO-5(0、0.25、0.50和1.00 mg/mL)同步培养L4线虫5 d后。每块板约500条线虫,用M9将线虫转移到离心管中,用1×PBS清洗,重复3次。随后用研磨仪研磨并将匀浆在4 500 r/min离心10 min。取出上清液,按说明书(南京建成生物工程研究所)进行SOD、CAT、GSH和MDA含量测定[14]。所有测试重复 3 次。
1.3.11 统计分析
所有数据均从独立的3次重复中收集,并计算平均值±标准差。通过单因素方差分析(ANOVA)和Bonferroni事后检验分析组间差异。P<0.05被认为具有统计学意义。所有图形均使用 Origin 2022和 GraphPad 8 创建。
2 结果与分析
2.1 卡拉胶寡糖分子质量测定
在实验室前期采用光降解制备卡拉胶寡糖的工艺优化条件下,制备光降解1 h卡拉胶(KCO-1)和光降解5 h卡拉胶(KCO-5),KCO-1的分子质量为8.47 kDa(图1-b),KCO-5的分子质量为1.58 kDa。根据相关研究,多糖的生物活性与单糖的组成、分子的大小以及一级结构中的特定糖苷键密切相关[16]。本实验中,将采用光降解得到的2种不同分子质量的卡拉胶寡糖(KCO-1、KCO-5)对线虫的寿命影响进行比较。
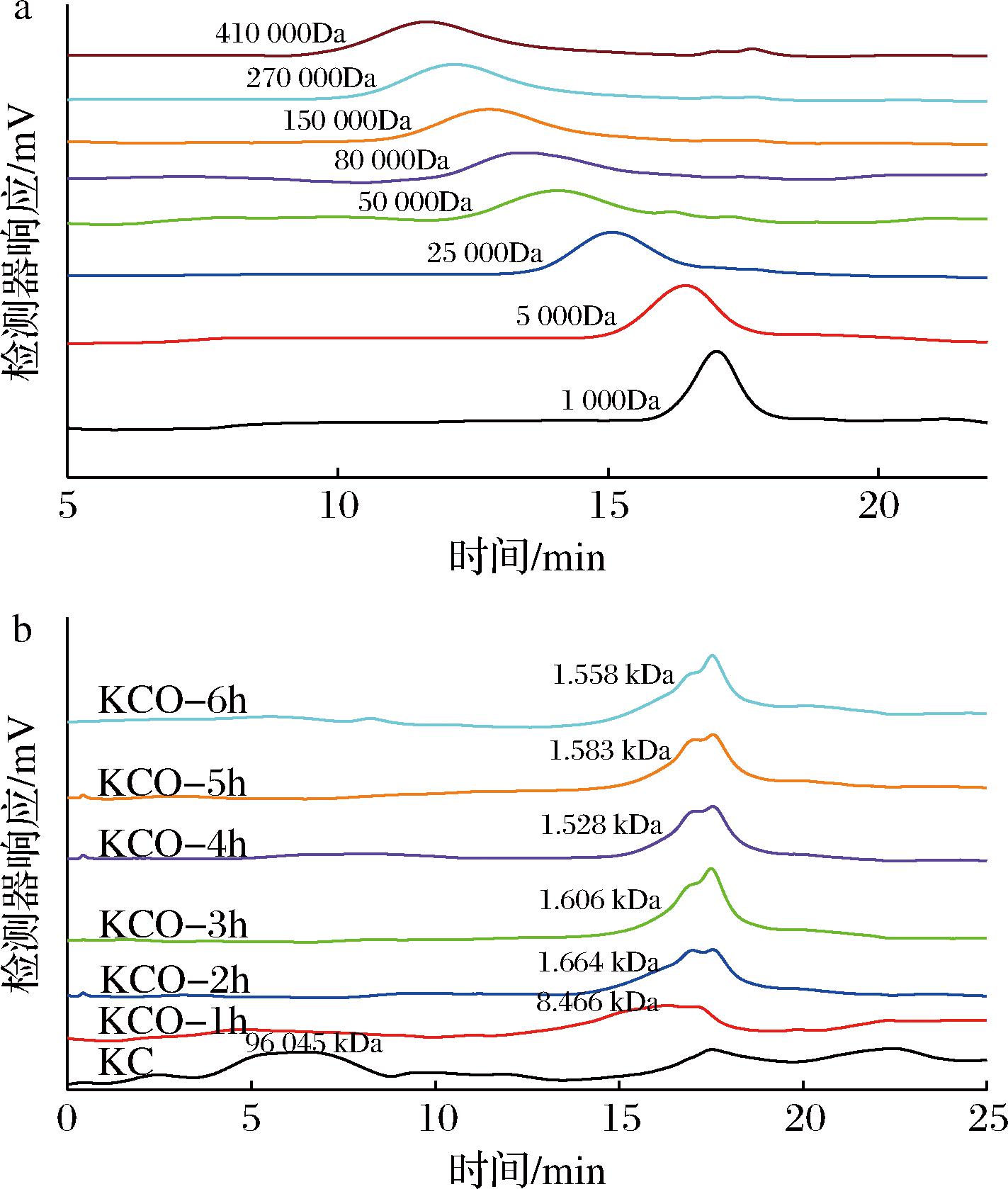
a-葡聚糖标准品的分子质量图;b-不同时间光降解κ-卡拉胶分子质量图
图1 葡聚糖标准品和不同时间光降解κ-卡拉胶分子质量图
Fig.1 Molecular weight diagram of dextran standard and photodegraded κ-carrageenan at different times.
2.2 卡拉胶寡糖促进了C.elegans的寿命
在衰老的过程中,生物体中的胞内稳态系统逐步下降,最后导致死亡。因此,抗衰老研究中的寿命长短可以作为衰老的定量指标[12]。如图2所示,随着卡拉胶寡糖浓度的增加,存活曲线向右移动。如图2-a、2-b所示,空白对照组线虫的平均寿命与浓度为0.25、0.50 mg/mL KCO-1处理的线虫相比无明显差异。在质量浓度为1.00 mg/mL时,线虫在KCO-1作用下的平均寿命提高百分比为8.56%。图2-c、2-d中,在KCO-5的作用下,加药处理组线虫的平均寿命随着浓度的增加,平均寿命增加了4.18%~16.48% (P<0.05)。我们认为KCO-5可能对线虫存在剂量依赖性影响。在低浓度下,效果可能较弱,导致延长寿命的能力相对较弱,趋于接近对照空白组。在较高浓度范围内,可以发挥最佳的生物活性,从而延长寿命。与KCO-1相比,KCO-5延长了线虫的寿命,具有更有效的抗衰老作用。而相关研究发现,多糖的抗衰老作用通常与其分子质量有关。相关的研究报道中,WANG等[17]发现枸杞多糖(Lycium barbarum polysaccharide, LBP)经热水法和酵母发酵法提取得到的产物LBP-Y(2.23×104 g/mol)的抗氧化和抗衰老效果优于LBP-W(5.30×106 g/mol)。而LEE等[18]采用超声辅助H2O2-Vc法制备的低分子质量TFLP在线虫中表现出最高的抗氧化活性和抗逆性。因此,多糖分子质量的降低可能会增强其在线虫模型中的抗氧化和抗衰老功效。
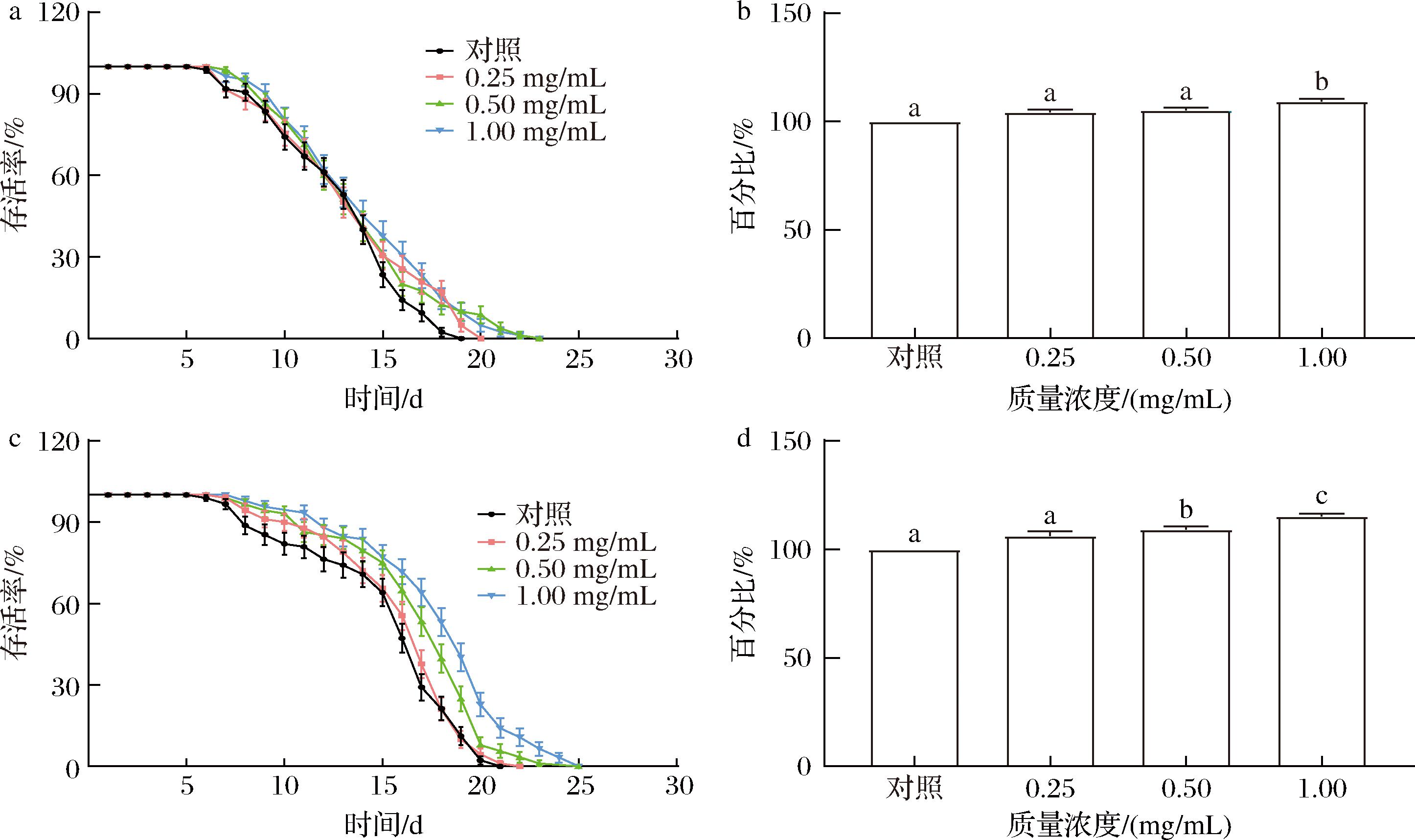
a-饲喂KCO-1线虫的存活率;b-饲喂KCO-1线虫的存活百分比;c-饲喂KCO-5线虫的存活率;d-饲喂KCO-5线虫的存活百分比
图2 KCO-1和KCO-5对C.elegans寿命的影响
Fig.2 Effect of KCO-1 and KCO-5 on the lifetime of C.elegans
注:使用L4阶段(第0 天)的野生型N2线虫暴露于对照、0.25 mg/mL、0.50 mg/mL、1.00 mg/mL卡拉胶寡糖的存活时间,并进行存活时间的相关分析,组间不同字母之间表示差异显著(P<0.05)(下同)。
2.3 卡拉胶寡糖对C.elegans运动能力的影响
线虫的运动性与其生活质量有关,是肌肉完整性的指标[13]。为探究卡拉胶寡糖对线虫健康和活力的影响,对线虫在摄入不同浓度KCO-5的第5、8、12和16天后的运动能力进行分析(如图3)。与空白对照组相比,加药处理组中99%的线虫在第5天都可以自发运动,但到第12天,大约50%的线虫表现出B类运动性,第16天后,大约90%线虫运动困难,但随着KCO-5浓度的增加,KCO-5可以延缓线虫出现C类运动。线虫的运动能力随着加药饲养时间的延长而逐渐降低,但卡拉胶寡糖在一定程度上可以延缓线虫的运动能力的衰退,进而促进衰老过程减慢。结果表明,线虫的寿命得到延长,整体健康状况也有所改善。
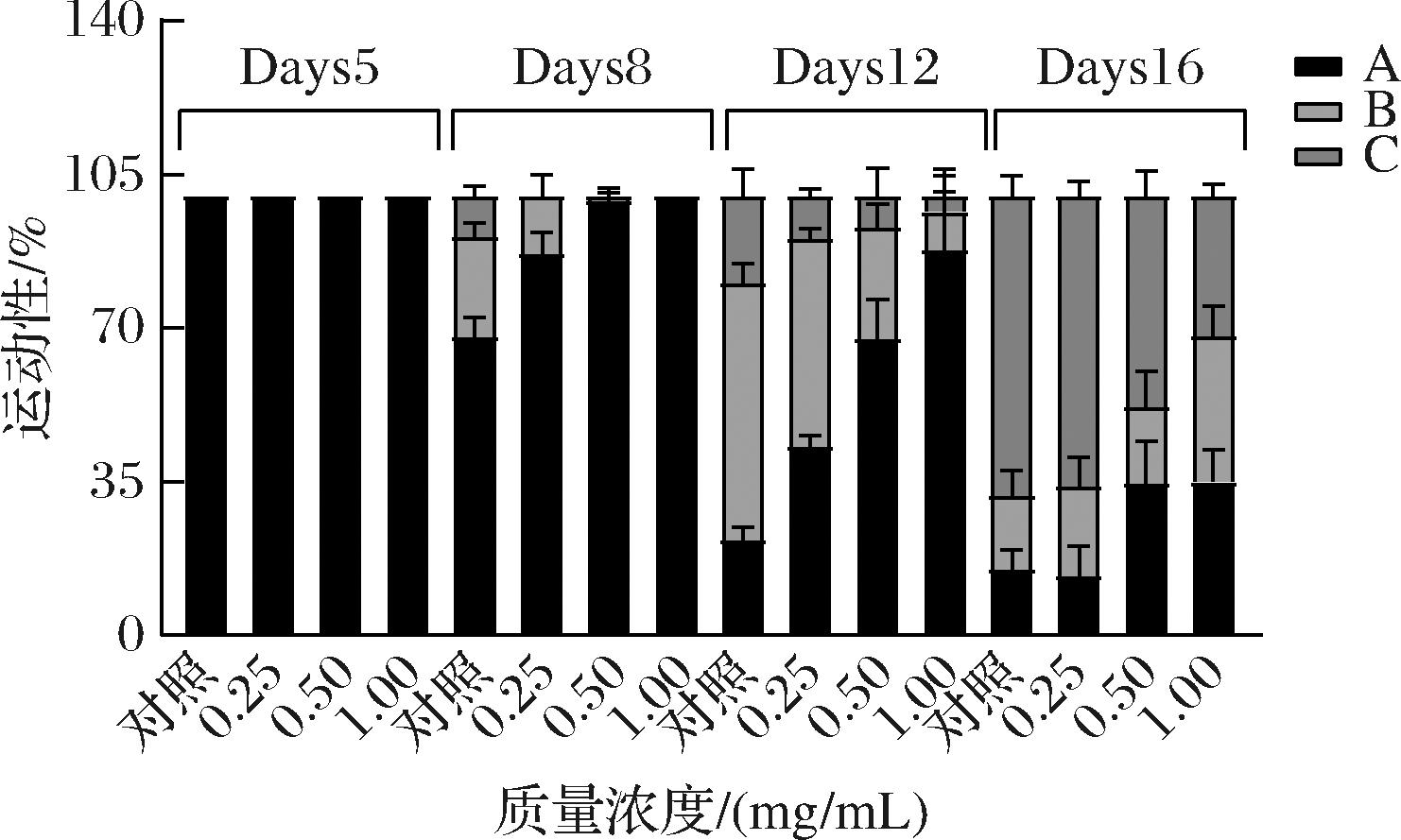
图3 KCO-5对C.elegans第5、8、12和16天运动能力的影响
Fig.3 Effect of KCO-5 on the exercise capacity of C.elegans on days 5, 8, 12, and 16 d
注:将运动能力标准分为3组:A-线虫自发而平稳运动;C-线虫受到刺激后头部或尾部运动;B介于A和C之间。
2.4 卡拉胶寡糖对C.elegans体长体宽的影响
诱导线虫体型的变化已被广泛研究与其寿命的相关性[19]。如图4所示,与空白组相比,不同浓度KCO-5对线虫的体宽没有显著性影响,但线虫的体长显著性提高了5.08%~45.70%(P<0.05),结果表明KCO-5不仅延长了线虫的健康寿命,而且促进了线虫的生长发育。之前的一项研究报道,YANG等[14]在基于线虫模型的绿原酸(chlorogenic acid,CGA)抗衰老作用的研究发现,CGA可以促进体长的增加。CGA浓度为50 μmol/L,对增加线虫体长最有效。这种现象可能是由于具有抗氧化活性的寡糖抑制了自由基而引起的生理损伤,从而增加了线虫的体长。
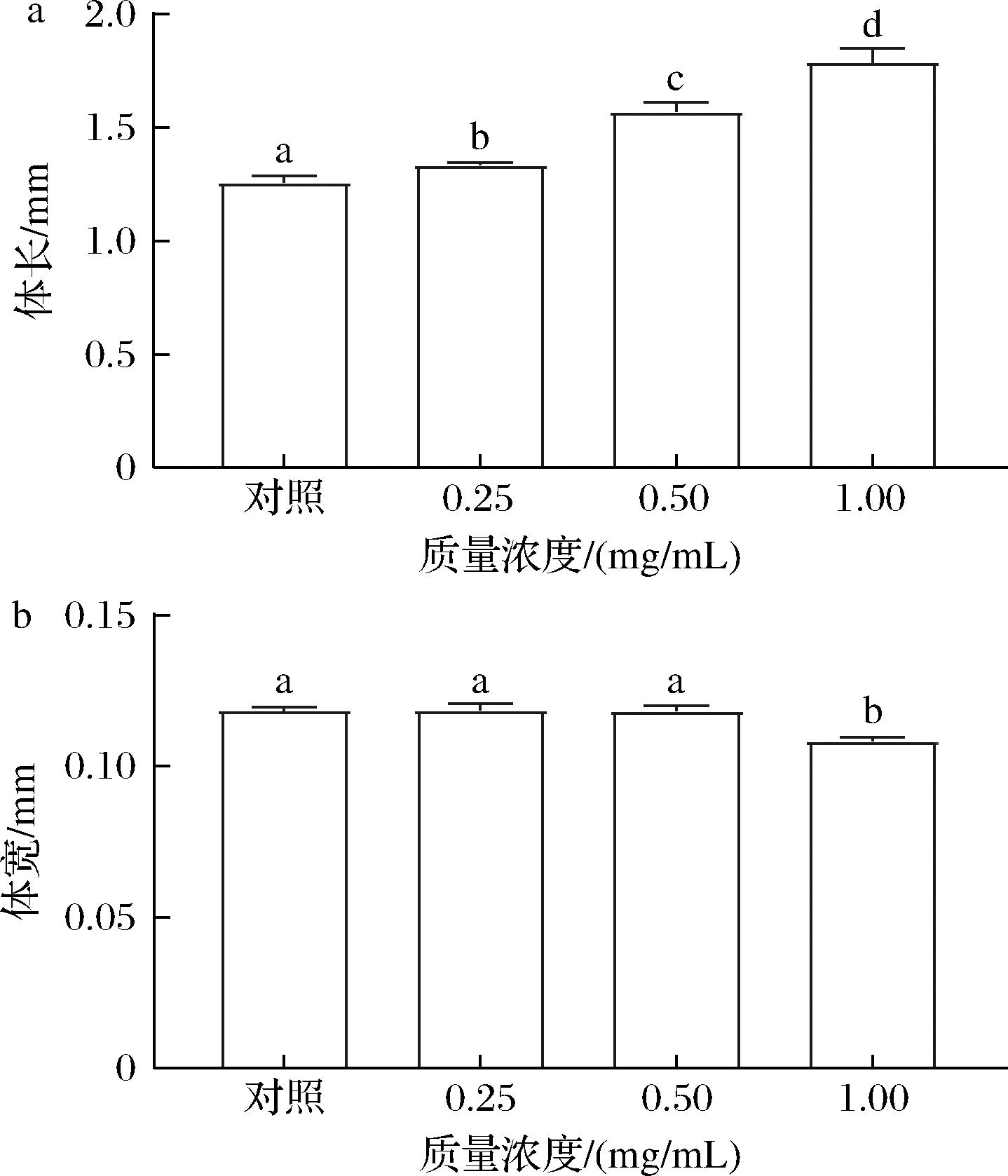
a-线虫体长;b-线虫体宽
图4 KCO-5对C.elegans体长、体宽的影响
Fig.4 Effect of KCO-5 on body length and body width of C.elegans
2.5 卡拉胶寡糖对C.elegans繁殖力的影响
线虫的繁殖能力和寿命是生命的2个基本特征,都是定义生命的基本标准之一[20]。本实验的主要目的是评估线虫在寿命得到延长的情况下,是否会影响其繁殖力。如图5所示,KCO-5加药处理组和空白对照组之间的繁殖能力没有显著差异。这表明KCO-5对线虫的繁殖能力没有影响。在先前的报道中,LIU等[21]研究发现油茶油在延长了线虫的寿命下,对其后代数量和孵化率没有影响。以及CUI等[22]研究表明竹叶青酒(Zhuyeqing liquor,ZYQL)对线虫繁殖力无有害影响。10%(体积分数)ZYQL处理组产卵数显著高于对照组,但孵化率变化不显著。研究表明,物质介导的线虫长寿不是由于其生育力降低。
图5 KCO-5对C.elegans繁殖能力的影响
Fig.5 Effect of KCO-5 on the reproductive ability of C.elegans
2.6 卡拉胶寡糖对热应激下C.elegans寿命的影响
对热应激的耐受性在延缓线虫衰老方面起着相当大的作用。为了确定卡拉胶寡糖处理是否能提高线虫的抗逆性,将同步的 L4 线虫用0.25~1.00 mg/mL KCO-5进行处理,然后暴露于热应激 35 ℃培养箱中。由图6所示,与对照组相比,处理组线虫在胁迫条件下的寿命显著性提高18.82%~39.11%(P<0.05)(图6-b)。耐热性是评价生物老化过程的重要指标,不同处理组线虫在热应激胁迫下的存活曲线表明,KCO-5可以延长线虫在高温胁迫环境中的寿命,进而延缓衰老。
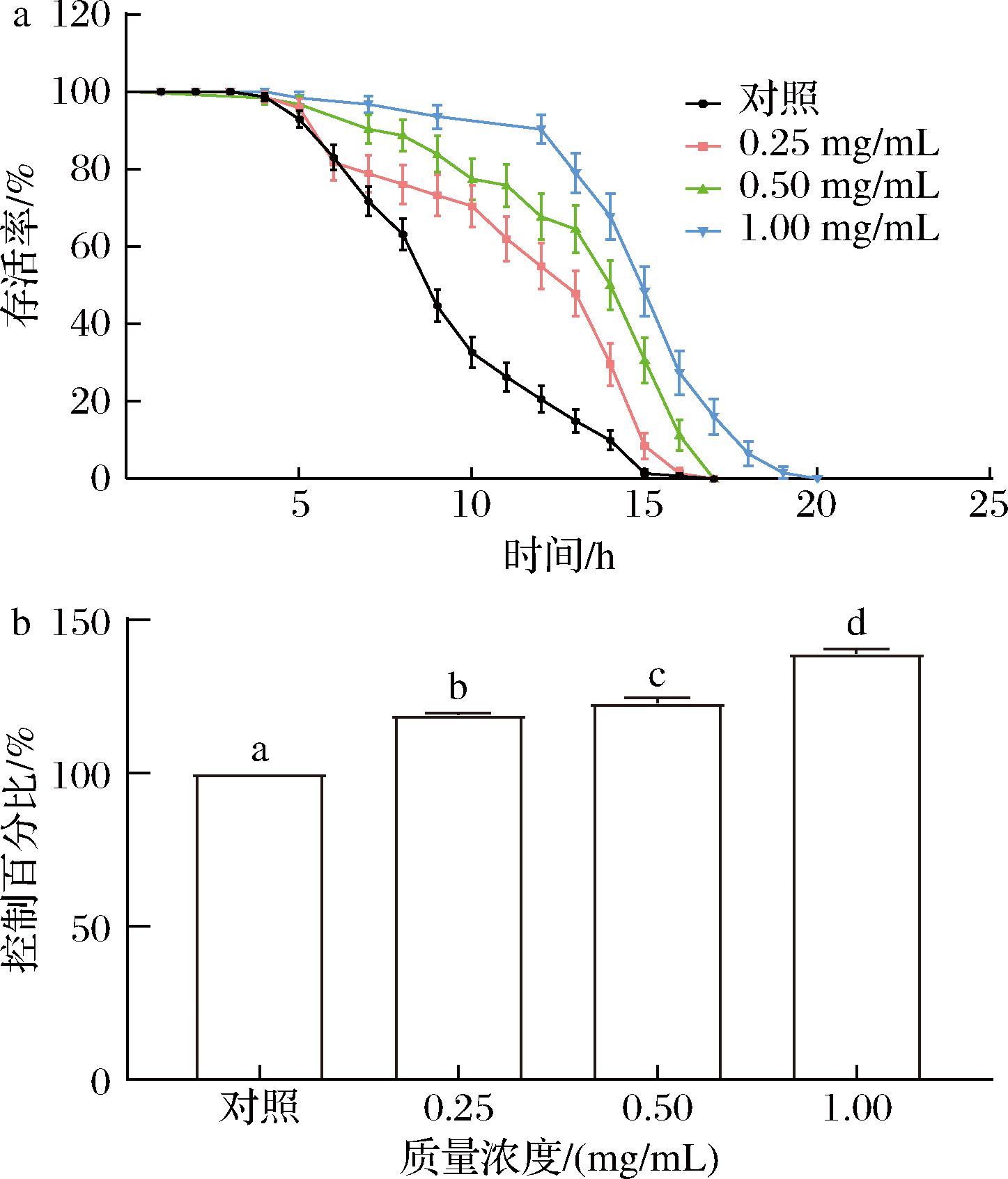
a-线虫抗压存活率;b-线虫抗压存活百分比
图6 KCO-5对35 ℃热冲击处理后线虫存活的影响
Fig.6 Effect of KCO-5 on nematode survival after 35 ℃ thermal shock treatment
2.7 卡拉胶寡糖减少了C.elegans体内脂褐素积累水平
由于细胞成分的氧化降解和自噬,氧化应激促进了线虫体内的脂褐素的形成。线虫体内积累的脂褐素会随着年龄的增长而沉淀并产生自发荧光。而与年龄相关的自发荧光被认为是线虫生存能力、健康和衰老的指标[15]。如图7所示,我们通过使用荧光显微镜观察经过KCO-5处理后的线虫体内脂褐素积累水平,与对照组相比,处理组线虫中的脂褐素积累显著减少18.64%~38.46%(P<0.05),且KCO-5以浓度依赖性方式减少脂褐素沉积。结果与HU等[23]和WANG等[24]报告一致,他们研究发现类黄酮(folium artemisiae argyi,FAAF)和子囊菌Paecilomyces variotii的提取物(Paecilomyces variotii extract , PVE)的提取物降低了线虫体内脂褐素水平。结果表明卡拉胶寡糖能够影响与线虫的年龄相关特征变化。
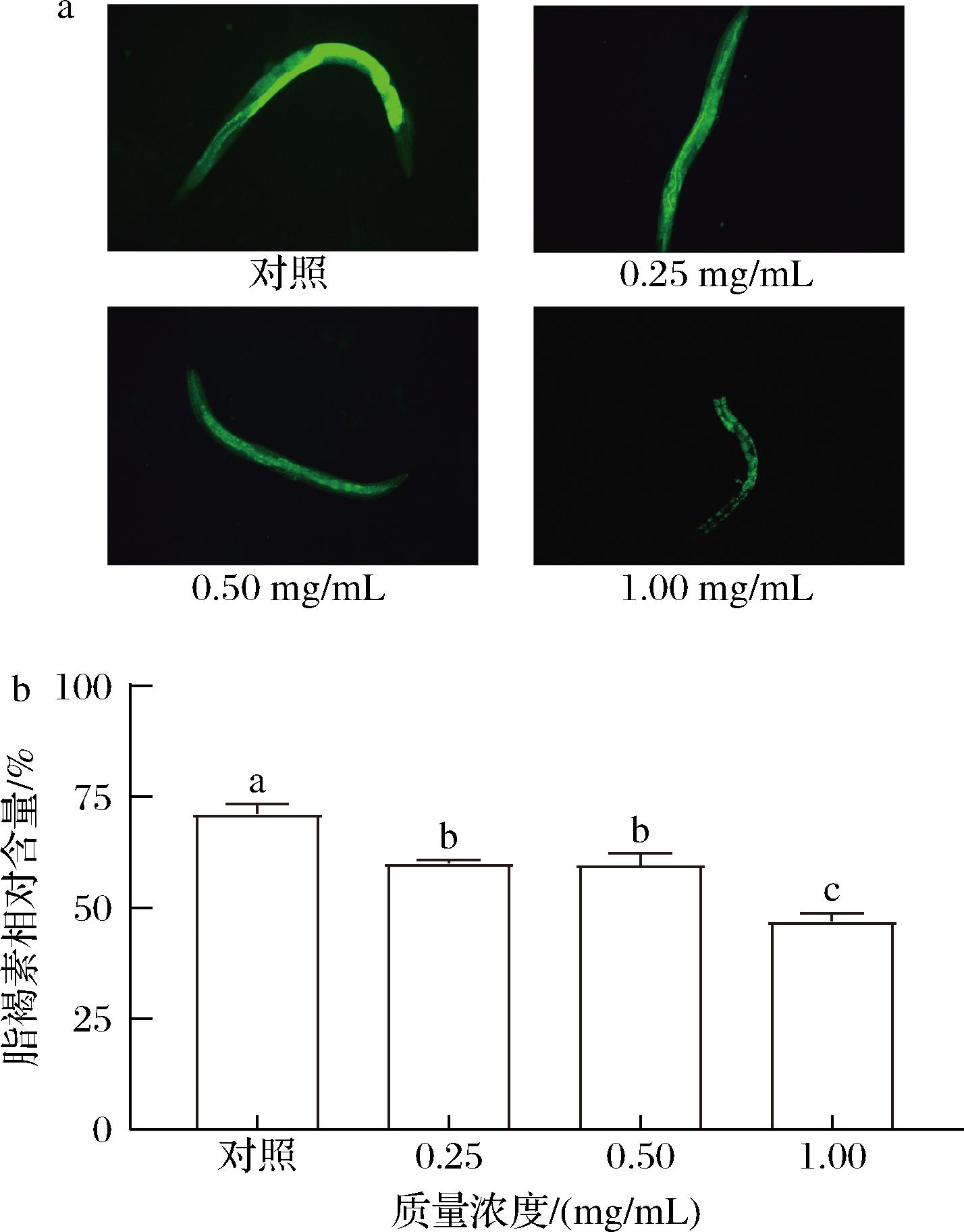
a-代表性荧光图像;b-相对荧光强度
图7 KCO-5对C.elegans体内脂褐素积累的影响
Fig.7 Effect of KCO-5 on lipofuscin accumulation in C.elegans
2.8 卡拉胶寡糖降低了C.elegans体内ROS含量
ROS是一种在细胞信号传导和稳态中起重要作用的物质,其在细胞中的过度积累会导致MDA含量增加,从而对脂质和蛋白质代谢产生不利影响[25]。过量ROS积累可能会缩短生物体的寿命。如图8所示,线虫在KCO-5(0.25~1.00 mg/mL)处理5 d后,与对照组相比,线虫体内所积累的ROS平均荧光强度下降46.95%~73.90%(P<0.05),1.00 mg/mL KCO-5对线虫细胞内ROS水平的影响显著(P<0.05)。线虫细胞内ROS水平与寿命呈负相关。这一发现与相关研究的报道一致,即一种从脱脂圆鲷(Decapterus maruadsi)蛋白水解物中纯化的新型抗氧化肽可以通过清除细胞内ROS来延长线虫的寿命[26]。结果表明,KCO-5可降低了线虫体内ROS含量,进而维持体内的氧化还原平衡,益于线虫延缓衰老。

a-代表性荧光图像;b-相对荧光强度
图8 KCO-5对C.elegans体内ROS含量的影响
Fig.8 Effect of KCO-5 on ROS content in C.elegans
2.9 卡拉胶寡糖增强了C.elegans抗氧化酶活性
提高抗氧化能力以减少ROS积累与抗衰老密切相关。为了探究卡拉胶寡糖减少线虫氧化损伤的能力,探究了线虫的SOD、GSH和CAT的活性。不同浓度(0.25~1.00 mg/mL)的KCO-5处理线虫,其GSH活性提高了8.15%~22.35%(P<0.05)(图9-a),CAT活性提高了11.12%~22.56%(P<0.05)(图9-b),SOD活性提高2.70%~41.24%(P<0.05)(图9-c),在所有剂量组中,抗氧化酶活性都有不同程度的增加。其中1.00 mg/mL组的SOD、CAT和GSH活性水平最高,与空白对照组差异显著。而代谢产物MDA降低了23.51%~48.19%(P< 0.05)(图9-d)。在正常情况下,抗氧化系统包括细胞内抗氧化酶,如SOD、CAT和GSH,它们可以去除生物体内多余的ROS并维持体内的氧化还原平衡[13]。综上所述表明KCO-5可减少ROS的产生,并保护线虫的抗氧化酶系统免受氧化损伤。其可能是影响抗衰老作用的机制之一。
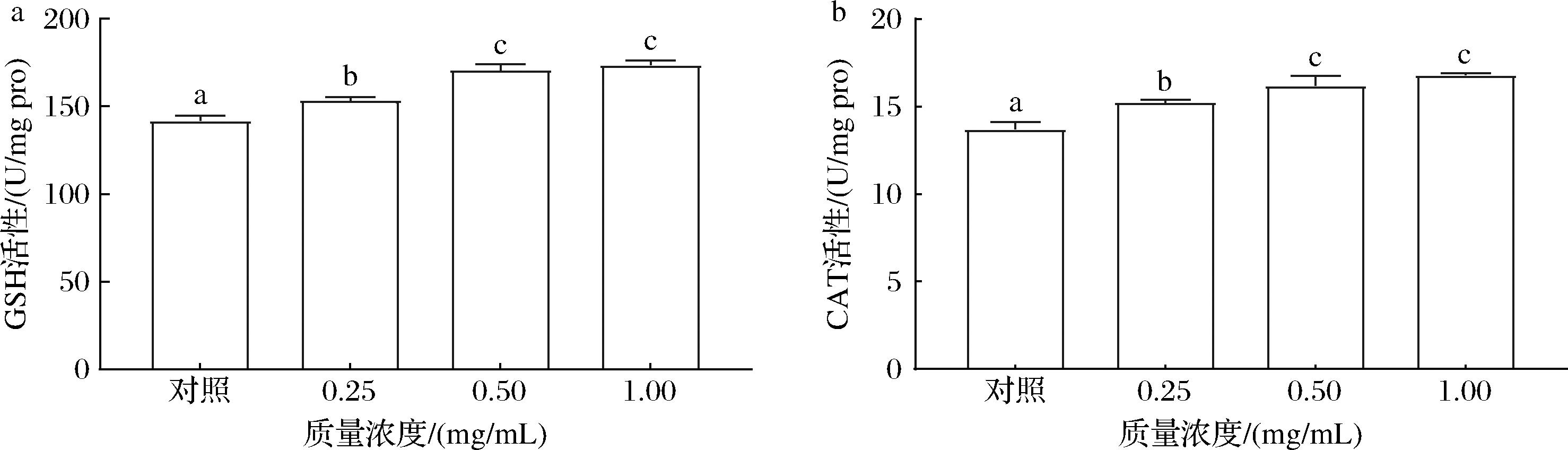
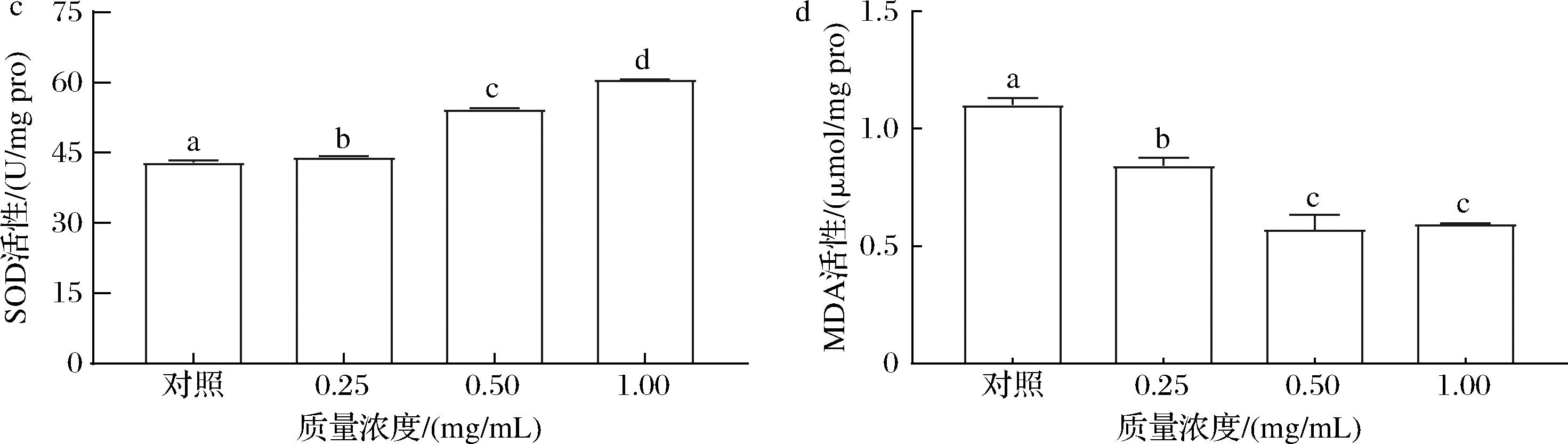
a-GSH活性;b-CAT活性;c-SOD活性;d-MDA活性
图9 KCO-5对C.elegans抗氧化酶活性的影响
Fig.9 Effect of KCO-5 on antioxidant enzyme activity of C.elegans
3 结论与展望
本研究从线虫的寿命、运动能力、脂褐素和热应激以及体内抗氧化酶活力测定等方面探究线虫的健康寿命,结果表明,1.00 mg/L的卡拉胶寡糖KCO-5能够显著延长秀丽隐杆线虫在正常状态寿命以及热应激条件下的寿命,提高了它的抗胁迫能力,并且不影响其生殖能力,同时也改善了应激状态下线虫的运动能力,提高了线虫的抗氧化酶活性。但本研究只局限于健康寿命指数的表型方面,后期我们将会开展基因表达、组学等实验,更加系统性的深入探究其抗衰老机制,为卡拉胶在食品、药品或者化妆品领域中的开发提供科学理论帮助。
[1] YANG J J, ZHAO S L, ZHANG X, et al.Polygonatum kingianum saponins delay cellular senescence through SASP down-regulation and prolong the healthy lifespan of Caenorhabditis elegans by activating sir-2.1/autophagy[J].Industrial Crops and Products, 2023, 201:116903.
[2] LIANG L Y, YUE Y M, ZHONG L Y, et al.Anti-aging activities of Rehmannia glutinosa Libosch.crude polysaccharide in Caenorhabditis elegans based on gut microbiota and metabonomic analysis[J].International Journal of Biological Macromolecules, 2023, 253(Pt 8):127647.
[3] APPAROO Y, PHAN C W, RANI KUPPUSAMY U, et al.Potential role of ergothioneine rich mushroom as anti-aging candidate through elimination of neuronal senescent cells[J].Brain Research, 2024, 1824:148693.
[4] UDO T, MUMMALETI G, MOHAN A, et al.Current and emerging applications of carrageenan in the food industry[J].Food Research International, 2023, 173:113369.
[5] RELLEVE L, ABAD L.Characterization and antioxidant properties of alcoholic extracts from gamma irradiated κ-carrageenan[J].Radiation Physics and Chemistry, 2015, 112:40-48.
[6] PRADHAN B, KI J S.Biological activity of algal derived carrageenan:A comprehensive review in light of human health and disease[J].International Journal of Biological Macromolecules, 2023, 238:124085.
[7] 牟明静. κ-卡拉胶寡糖的降血脂活性研究[D].厦门:集美大学, 2022.MU M J.Study on the Hypolipidemic activity of κ-carrageenan oligosaccharides[D].Xiamen:Jimei University, 2022.
[8] GUO Z L, WEI Y S, ZHANG Y, et al.Carrageenan oligosaccharides:A comprehensive review of preparation, isolation, purification, structure, biological activities and applications[J].Algal Research, 2022, 61:102593.
[9] ZHU J H, JIA Y M, WANG C, et al.Lonicera japonica polysaccharides improve longevity and fitness of Caenorhabditis elegans by activating DAF-16[J].International Journal of Biological Macromolecules, 2023, 229:81-91.[10] TANG L, CHEN X, KONG X M, et al.Anti-aging effect of methylurolithin A and its amide derivatives on nematode Caenorhabditis elegans[J].Tetrahedron Letters, 2023, 118:154389.
[11] 宋兵兵. 蓝莓和苹果皮提取物联合抗衰老活性及作用机制研究[D].广州:华南理工大学, 2020.SONG B B.Antiaging activity of combination of blueberry and apple peel extracts:Mechanisms of action[D].Guangzhou:South China University of Technology, 2020.
[12] HUI H P, XIN A Y, CUI H Y, et al.Anti-aging effects on Caenorhabditis elegans of a polysaccharide, O-acetyl glucomannan, from roots of Lilium davidii var.unicolor Cotton[J].International Journal of Biological Macromolecules, 2020, 155:846-852.
[13] YUE Y M, LIANG L Y, ZHANG H, et al.Antioxidant and anti-aging effects of purified Rehmannia glutinosa polysaccharide in Caenorhabditis elegans[J].Process Biochemistry, 2024, 137:41-53.
[14] YANG Y Q, CHEN X, YE D Y, et al.Exploring the anti-aging effects of chlorogenic acid and the underlying mechanisms based on a Caenorhabditis elegans model[J].Journal of Traditional Chinese Medical Sciences, 2023, 10(2):208-217.
[15] SHI H, HU X Q, ZHENG H, et al.Two novel antioxidant peptides derived from Arca subcrenata against oxidative stress and extend lifespan in Caenorhabditis elegans[J].Journal of Functional Foods, 2021, 81:104462.
[16] LU J, YANG Y J, HONG E K, et al.Analyzing the structure-activity relationship of raspberry polysaccharides using interpretable artificial neural network model[J].International Journal of Biological Macromolecules, 2024, 264:130354.
[17] WANG Z W, SUN Q R, FANG J X, et al.The anti-aging activity of Lycium barbarum polysaccharide extracted by yeast fermentation:in vivo and in vitro studies[J].International Journal of Biological Macromolecules, 2022, 209:2032-2041.
[18] LEE Q C, HAN X J, ZHENG M F, et al.Preparation of low molecular weight polysaccharides from Tremella fuciformis by ultrasonic-assisted H2O2-Vc method:Structural characteristics, in vivo antioxidant activity and stress resistance[J].Ultrasonics Sonochemistry, 2023, 99:106555.
[19] PEIXOTO H, ROXO M, KRSTIN S, et al.An Anthocyanin-rich extract of acai (Euterpe precatoria mart.) increases stress resistance and retards aging-related markers in Caenorhabditis elegans[J].Journal of Agricultural and Food Chemistry, 2016, 64(6):1283-1290.
[20] LI C L, HUANG W J, ZHENG H, et al.Structural elucidation of a novel heteropolysaccharide from Arca inflata Reeve and its immunomodulatory and antioxidant activities[J].Journal of Functional Foods, 2023, 107:105677.
[21] LIU L, ZHOU J S, XU Z, et al.The positive effects of Camellia oleifera oil on lifespan in Caenorhabditis elegans[J].Journal of Functional Foods, 2023, 110:105869.
[22] CUI X D, ZHANG B R, LI Z, et al.Zhuyeqing liquor promotes longevity through enhancing stress resistance via regulation of SKN-1 and HSF-1 transcription factors in Caenorhabditis elegans[J].Experimental Gerontology, 2023, 174:112131.
[23] HU Q, LIU Z G, GUO Y J, et al.Antioxidant capacity of flavonoids from Folium Artemisiae Argyi and the molecular mechanism in Caenorhabditis elegans[J].Journal of Ethnopharmacology, 2021, 279:114398.
[24] WANG Y, LIU H M, FU G H, et al.Paecilomyces variotii extract increases lifespan and protects against oxidative stress in Caenorhabditis elegans through SKN-1, but not DAF-16[J].Arabian Journal of Chemistry, 2022, 15(9):104073.
[25] LI Q C, XIAO M F, LI N, et al.Application of Caenorhabditis elegans in the evaluation of food nutrition:A review[J].eFood, 2023, 4(1):e68.
[26] CHEN H Q, WANG S, ZHOU A M, et al.A novel antioxidant peptide purified from defatted round scad (Decapterus maruadsi) protein hydrolysate extends lifespan in Caenorhabditis elegans[J].Journal of Functional Foods, 2020, 68:103907.