海红米即海水稻,是一种含优质基因的耐盐碱水稻,其生存竞争能力强、营养价值高[1]。我国有1 334万多hm2盐碱地可用于种植海水稻,在未来有望占据我国水稻产业市场的20%[2],其产量非常大。目前海红米主要以成品米及米粉形式销售,而其副产物海红米糠并未得到较好的开发利用。米糠作为稻谷加工的主要副产品[3],价格低廉,主要被用作家畜和养殖鱼类的饲料[4],资源总利用率不超过20%。因其保健价值高、功能活性丰富,具有非常大的商业潜力[5]。目前,米糠中的毛油、蛋白和膳食纤维等营养物质被国内外广泛研究并应用于食品、化妆品等领域,而对米糠多糖的研究还较少。
肝癌是我国第二大癌症,其发病率和死亡率较高。目前,传统的治疗方法有手术切除、化疗和放射疗法等[6]。然而,这些疗法存在易复发、耐药性和毒副作用大等问题,导致治疗效果不理想。因此,寻找一种新型毒副作用小的抗癌药物是目前研究的热点。近年来,多糖因具有抗肿瘤活性而备受关注,目前研究发现,香菇多糖[7]、灵芝多糖[8]等活性多糖都表现出了抗肿瘤活性,而关于海红米糠多糖(sea red rice bran polysaccharide,SRBP)是否具有抗肿瘤活性还未见报道。因此,本文选择海红米糠为原料,通过单因素和响应面试验优化海红米糠多糖的提取工艺,并考察其对HepG2肝癌细胞生长状态的影响。研究结果可为海红米糠多糖在抗肿瘤领域的应用提供理论依据和数据参考。
1 材料与方法
1.1 材料与试剂
海红米糠,广东海洋大学滨海农业学院周鸿凯教授惠赠;无水葡萄糖,广东光华科技股份有限公司;糖化酶(酶活力≥40 Units/mg)、纤维素酶(酶活力≥3 Units/mg),北京索莱宝科技有限公司;α-淀粉酶(酶活力≥6 000 Units/mg)、木瓜蛋白酶(酶活力≥2 000 Units/mg),上海阿拉丁生化科技股份有限公司;人肝癌HepG2细胞,由美国ATCC细胞库提供;DMEM高糖培养基、胎牛血清、PBS、胰蛋白酶、双抗溶液,赛默飞世尔科技(中国)有限公司旗下Gibco品牌;噻唑蓝(methyl thiazolye tetrazolium,MTT),上海源叶生物科技有限公司;二甲基亚砜、苯酚,上海易恩化学技术有限公司。
1.2 仪器与设备
AUW120电子天平,日本岛津公司;XRDKQ-500DB型超声波清洗机,昆山超声仪器有限公司;DBS-100全自动部分收集器,上海青浦沪西仪器厂;FD8508真空冷冻干燥机,韩国ilshin公司;N-1100V-W旋转蒸发仪,东京理化器械株式会社;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;Nicolet iS-5型傅里叶变换红外光谱仪、Varioskan Flash 多功能酶标仪,美国Thermo Fisher Scientific公司;JSM-7610F热场发射扫描电镜,日本电子株式会社;Waters E2695高效液相色谱仪,美国沃特世公司;Agilent 1100高效液相色谱仪,美国安捷伦科技公司。
1.3 实验方法
1.3.1 脱脂米糠制备
参考石海鸽等[9]方法对米糠进行脱脂。称取一定质量的海红米糠,按照料液比为1∶17.5(g∶mL,下同)加入95%乙醇,在功率450 W下超声11 min,抽滤,将得到的固体置于烘箱50 ℃烘干,即为脱脂米糠。
1.3.2 SRBP的提取
1.3.2.1 热水浸提法
将海红米糠浸泡于蒸馏水中,按照1∶20的料液比,在75 ℃温度下水浴提取60 min,将得到的混合物离心(3 000 r/min, 15 min),取上清液。
1.3.2.2 超声辅助水提法
将海红米糠浸泡于蒸馏水中,按照1∶20的料液比,在40 ℃下超声提取60 min,超声功率为400 W[10],将得到的混合物离心(3 000 r/min, 15 min),取上清液。
1.3.2.3 酶辅助提取法
按照1∶20的料液比将海红米糠浸泡于蒸馏水中,调节pH至5,加入质量分数2%的纤维素酶[11],在50 ℃温度下水浴提取60 min,将得到的混合物离心(3 000 r/min, 15 min),取上清液。
1.3.2.4 SRBP的纯化
调节海红米糠多糖提取液的pH值至5.5,分别加入3 mg/mL的α-淀粉酶和体积分数3%的糖化酶,在55 ℃下水浴酶解2 h,100 ℃灭酶15 min脱除淀粉[12];添加2 mg/mL的木瓜蛋白酶,调节pH值为6.0,50 ℃水浴60 min,100 ℃灭酶15 min脱除蛋白[13]。
1.3.2.5 酶辅助提取SRBP的单因素试验
以酶解温度50 ℃、料液比1∶30作为固定因素,考察不同酶解时间(30、60、90、120、150 min)对SRBP得率的影响。以酶解时间60 min、酶解温度50 ℃作为固定因素,考察不同料液比(1∶15、1∶20、1∶25、1∶30、1∶35)对SRBP得率的影响。以酶解时间60 min、料液比1∶30作为固定因素,考察不同酶解温度(40、50、60、70、80 ℃)对SRBP得率的影响。
1.3.2.6 响应面优化酶辅助提取SRBP的工艺参数
在单因素的基础上,用Design-Expert 13中Box-Behnken的中心组合设计原理及响应曲面法建立二次回归模型,按表1对料液比、酶解时间和酶解温度进行三因素三水平设计,优化SRBP的最佳工艺参数。
表1 试验因素水平设计
Table 1 Levels design of test factors
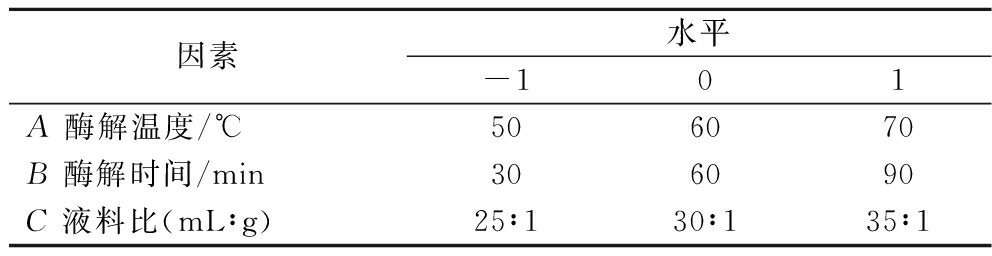
因素水平-101A 酶解温度/℃506070B 酶解时间/min306090C 液料比(mL∶g)25∶130∶135∶1
1.3.3 SRBP的理化性质和结构表征
1.3.3.1 化学组成分析
采用苯酚-硫酸法测定总糖含量;采用间羟基联苯比色法测定糖醛酸含量,以半乳糖醛酸计。
1.3.3.2 分子质量测定
采用高效液相色谱法测定SRBP的分子质量。工作参数如下:色谱柱为Waters Ultrahydrogel Column (7.8 mm×300 mm);流动相为0.2 mol/L的硫酸钠;流速为0.6 mL/min;柱温35 ℃;进样量10 μL;采用示差折光检测器。称取不同分子质量的葡聚糖(410 000、270 000、150 000、80 000、50 000、25 000、5 000 Da)各5 mg,配成2 mg/mL的葡聚糖标准溶液。以葡聚糖标准品分子质量的对数值与保留时间做标准曲线,计算SRBP的分子质量。
1.3.3.3 单糖组成分析
(1)SRBP的PMP衍生化
称取SRBP样品5 mg,加入2 mol/L三氟乙酸1 mL,置于烘箱110 ℃水解6 h,待冷却至室温后,加入2 mL无水甲醇,旋蒸至三氟乙酸挥发完全,加入1 mL超纯水溶解,即为多糖溶液。
称取单糖标准品(葡萄糖Glu、甘露糖Man、鼠李糖Rha、阿拉伯糖Ara、半乳糖Gal、木糖Xy1、岩藻糖Fuc)各5 mg,溶于超纯水,配制成5 mg/mL的单糖溶液和混合单糖标准溶液。
分别取400 μL多糖溶液、单糖标准溶液和混合单糖标准溶液,加入0.3 mol/L的NaOH溶液和0.5 mol/L的PMP溶液(以甲醇为溶剂)各400 μL,70 ℃水浴100 min,冷却至室温后,加400 μL 0.3 mol/L盐酸中和,用氯仿萃取3次,取上清液,0.22 μm 水系膜过滤后,备用。
(2)SRBP的单糖分析
用HPLC法测定单糖组成。色谱柱:Kromasi1 100-5-C18(150 mm×4.6 mm,5 μm);流动相:V[磷酸盐缓冲液(0.02 mol/L,pH 6.74)]∶V(乙腈)=83∶17;流速1 mL/min;柱温30 ℃;检测器为紫外检测器;检测波长245 nm。
1.3.3.4 全波长紫外-可见光谱扫描
取少量SRBP溶于水,配成10 mg/mL的溶液,采用紫外可见光谱仪对其进行全波长200~800 nm扫描,采样间隔为0.5 s。
1.3.3.5 傅里叶红外光谱(Fourier transform infrared spectroscopy,FT-IR)分析
取少量SRBP样品,与KBr研磨后压片,采用傅里叶红外光谱仪对SRBP进行扫描,扫描区间为 500~4 000 cm-1。
1.3.3.6 扫描电镜(scanning electron microscope,SEM)分析
取少量SRBP样品,喷金处理后,用热场发射扫描电镜在500、1 500和3 000倍下观察SRBP的表面微观结构。
1.3.4 SRBP的体外抗肿瘤活性
1.3.4.1 细胞培养
将HepG2细胞接种于细胞培养瓶中,于37 ℃、体积分数5% CO2环境中培养,采用DMEM培养液(含体积分数10%FBS、体积分数1%双抗溶液)培养。传代3~5代后,待对数生长期用于后续实验。
1.3.4.2 MTT法测定SRBP对HepG2细胞的抑制作用
参考CHEN等[14]方法,在96孔板中设实验组与对照组,分别加入4 000个/孔的细胞悬液,每孔100 μL,空白组用DMEM代替。培养24 h后去培养基,实验组中加入200 μL不同质量浓度(50、100、200、400、800 μg/mL)的SRBP溶液,空白组和对照组加200 μL的DMEM。培养24 h,每孔加入20 μL的MTT溶液,继续培养4 h后弃上清液,每孔加125 μL DMSO,振荡混匀10 min,通过酶标仪测量各孔在570 nm处的吸光值。根据公式(1)计算细胞存活率。
细胞存活率![]()
(1)
式中:A0,空白组的OD值;A1,对照组的OD值;A2,实验组的OD值。
1.4 数据处理
实验数据以3次平均值±标准偏差表示,用IBM SPSS Statistics 26 软件对数据进行显著性分析。
2 结果与分析
2.1 不同提取方法对SRBP得率的影响
由图1可知,纤维素酶辅助提取法提取的SRBP得率达(7.05±0.22)%,显著高于热水浸提法和超声辅助提取法,这可能是纤维素酶对海红米皮糠细胞壁破碎效果强于热水和超声波所致[11]。因此,选择纤维素酶辅助提取法作为SRBP的最佳提取方法。
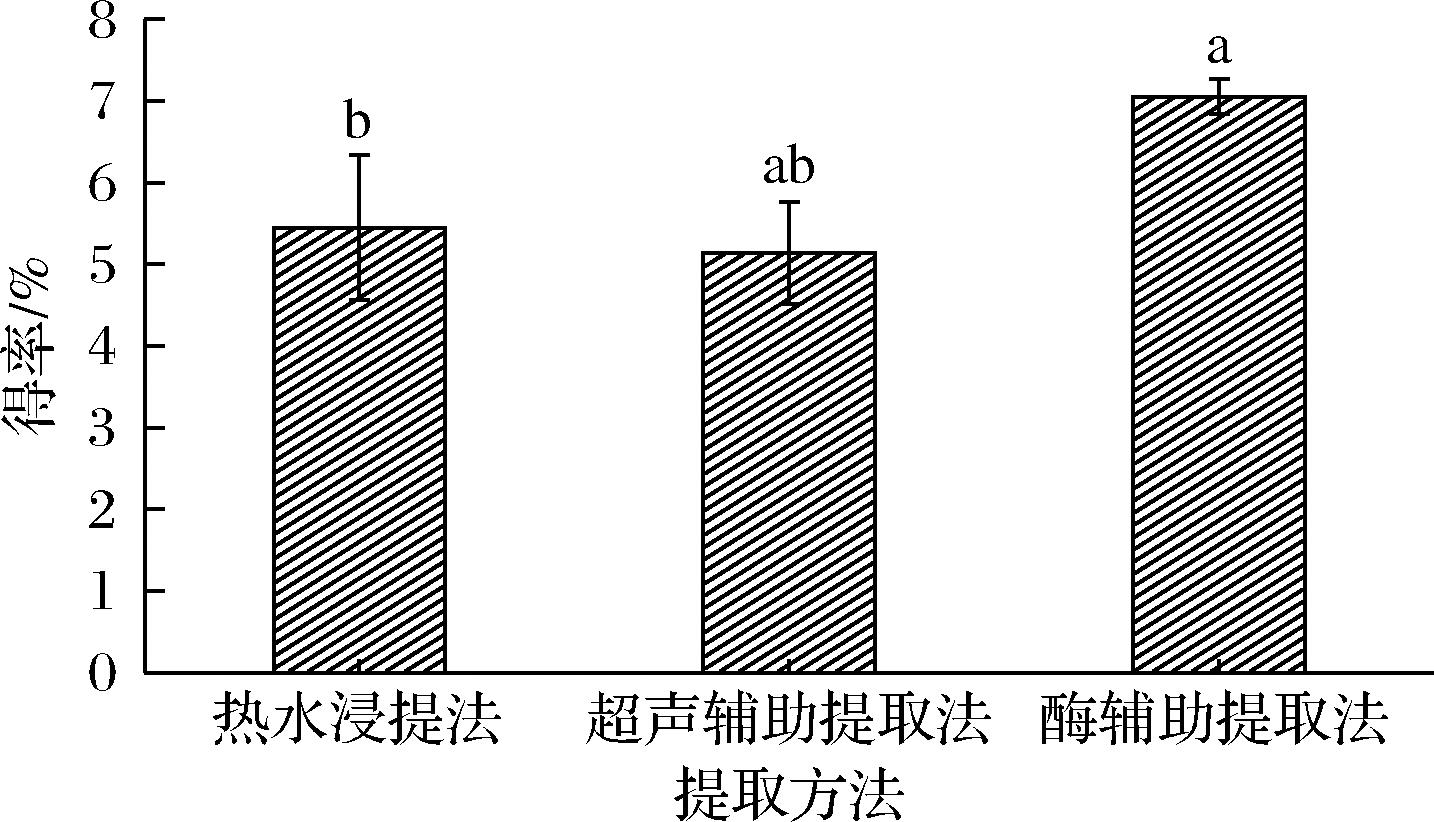
图1 不同提取方法对SRBP得率的影响
Fig.1 Effects of different extraction methods on the yield of SRBP
注:不同字母代表统计学上显著性差异(P<0.05)(下同)。
2.2 不同的酶解时间、料液比和酶解温度对SRBP得率的影响
如图2-a所示,当酶解时间为60 min时,SRBP的得率达到最大为(9.29±0.12)%,当进一步增加酶解时间,SRBP得率降低且随时间增加无显著性差异。这可能是海红米糠的细胞壁在纤维素酶处理60 min时能够达到完全酶解的状态。因此,选择60 min作为最佳酶解时间。
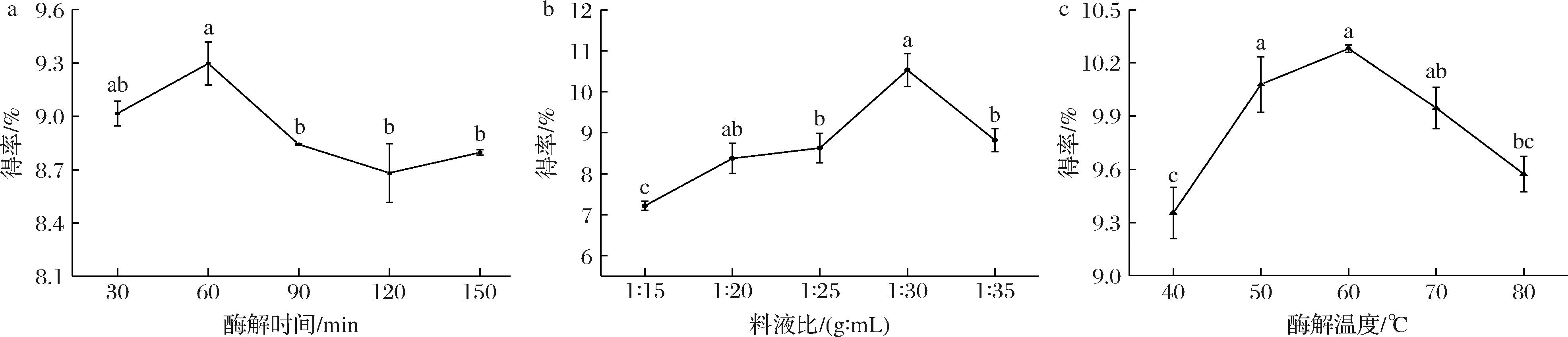
a-不同酶解时间对得率的影响;b-不同料液比对得率的影响;c-不同酶解温度对得率的影响
图2 提取因素对SRBP得率的影响
Fig.2 Effects of extraction factors on the yield of SRBP
如图2-b所示,随着料液比的升高,SRBP的得率呈上升趋势。当料液比达到1∶30时,SRBP的得率达到最大为(10.53±0.41)%,继续增大料液比,SRBP的得率开始降低。这可能是由于料液比较大时易受到传质阻力的影响,从而导致多糖的溶出速度降低[15]。故选择1∶30为最佳料液比。
如图2-c所示,酶解温度较低时,海红米糠细胞壁释放多糖的速度慢,得率较低;当酶解温度为60 ℃时,SRBP的得率为(10.28±0.02)%,此时得率最高,这可能与纤维素酶的最适温度(40~60 ℃)有关。进一步增加温度到70 ℃或80 ℃时会破坏酶的活性,导致SRBP得率降低。故选择60 ℃作为最佳提取温度。
2.3 响应面优化海红米糠多糖的提取工艺条件
2.3.1 响应面模型回归分析
根据单因素试验的结果,运用Box-Behnken试验对影响SRBP得率的3个主要因素进行优化,结果见表2。利用Design-Expert 13软件对表2的数据进行回归分析,得到SRBP得率的非线性多元回归方程:Y=10.58-0.13A+0.09B+1.10C-0.05AB+0.07AC-0.08BC-0.43A2-0.64B2-1.11C2,其中,Y表示SRBP得率,A、B、C分别代表酶解温度、酶解时间和液料比。
表2 Box-Behnken试验设计及结果
Table 2 Box-Behnken design and results
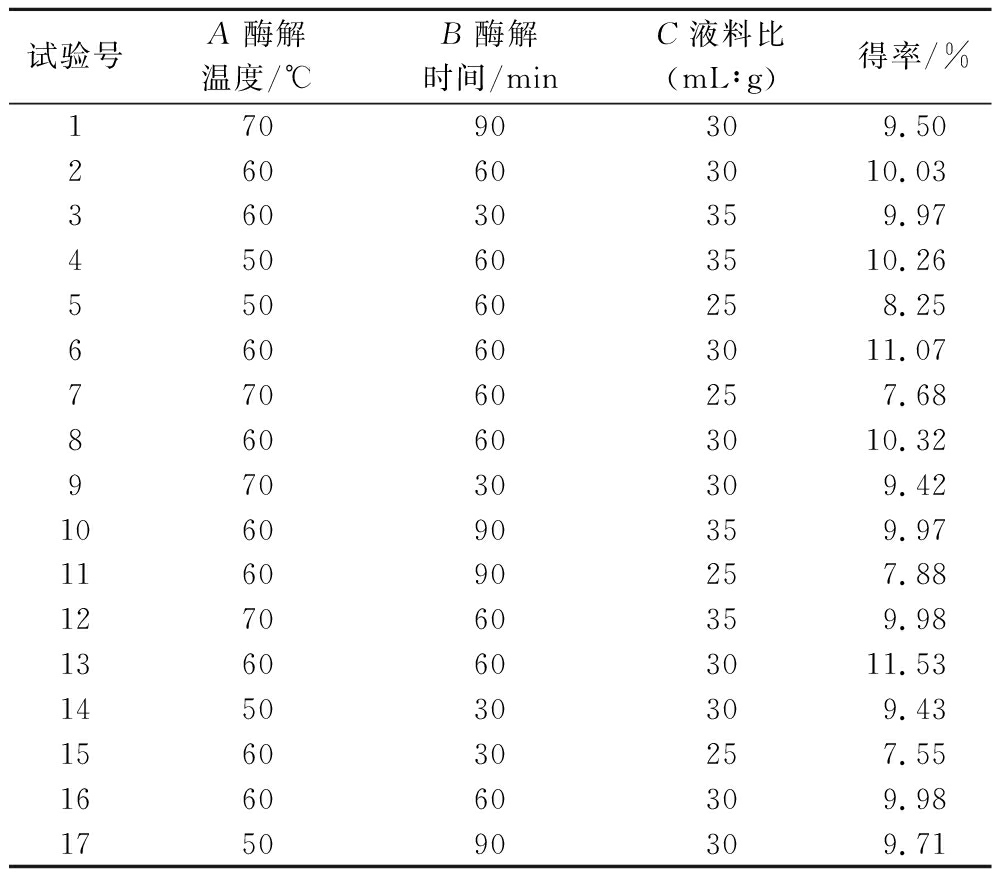
试验号A酶解温度/℃B酶解时间/minC液料比(mL∶g)得率/%17090309.50260603010.0336030359.97450603510.2655060258.25660603011.0777060257.68860603010.3297030309.42106090359.97116090257.88127060359.981360603011.53145030309.43156030257.55166060309.98175090309.71
二次回归模型的方差分析见表3。该模型的F值7.42,P=0.007 49<0.01,说明该模型极显著。失拟项F值为0.04,P=0.987 969>0.05,说明失拟项不显著。综上所述,可知该二次多项方程模型对试验拟合情况较好,误差较小。
表3 二次回归模型方差分析
Table 3 Anovariance analysis of quadratic regression model
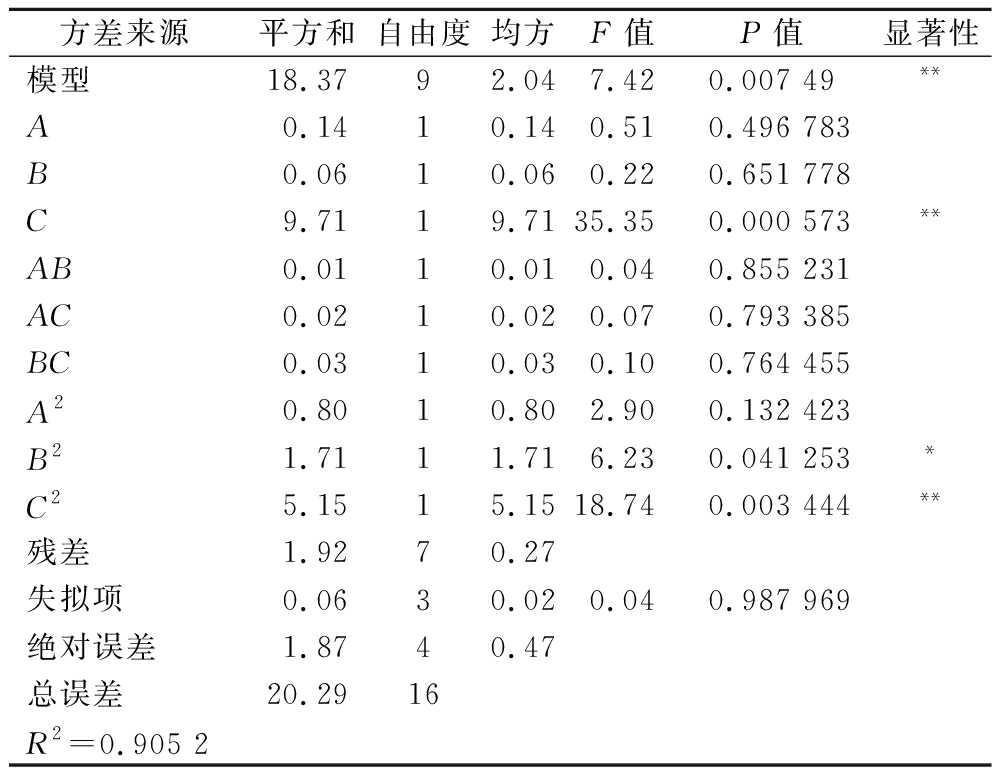
方差来源 平方和自由度均方F值P值显著性模型18.3792.047.420.007 49**A0.1410.140.510.496 783B0.0610.060.220.651 778C9.7119.7135.350.000 573**AB0.0110.010.040.855 231AC0.0210.020.070.793 385BC0.0310.030.100.764 455A20.8010.802.900.132 423B21.7111.716.230.041 253*C25.1515.1518.740.003 444**残差1.9270.27失拟项0.0630.020.040.987 969绝对误差1.8740.47总误差20.2916R2=0.905 2
注:**表示对结果影响极显著(P<0.01);*表明对结果影响显著(P<0.05)。
通过Design-Expert 13软件绘制不同因素之间的响应面图与等高线图,如图3所示。通过三维曲面图的陡峭程度以及等高线图的椭圆程度来判断各因素的交互作用。由图3-a可知,响应曲面平缓,等高线图呈圆形,说明酶解温度和酶解时间之间的交互作用对SRBP得率影响不明显。由图3-b可知,响应曲面图陡峭,等高线图呈椭圆形,说明酶解温度和料液比之间的交互作用对SRBP得率有影响,且酶解温度对SRBP得率的影响大于料液比。由图3-c可知,响应曲面图陡峭,等高线图呈椭圆形,说明酶解时间和料液比之间的交互作用对SRBP得率有影响,且酶解时间对SRBP的得率影响大于料液比。

a-酶解温度与酶解时间对SRBP得率影响的响应面和等高线图;b-酶解温度与料液比对SRBP得率影响的响应面和等高线图;c-酶解时间与料液比对SRBP得率影响的响应面和等高线图
图3 酶解温度、酶解时间和料液比对SRBP得率影响的响应面和等高线图
Fig.3 Response surface and contour map of the effects of enzymolysis temperature, enzymolysis time and solid-liquid ratio on the yield of SRBP
2.3.2 验证实验
根据回归方程和分析各因素的交互作用,得到SRBP的最佳提取工艺为:酶解时间61 min、料液比1∶32.5和酶解温度58.9 ℃。根据实际情况选取酶解时间61 min、料液比1∶33和酶解温度59 ℃。在此条件下进行验证试验,发现SRBP得率的实际值为10.75%,与理论预测值10.87%接近,说明利用该回归模型优化得到的工艺参数准确可靠。
2.4 SRBP的结构鉴定
2.4.1 SRBP的化学组成和分子质量
经测定,SRBP的总糖和糖醛酸含量分别为64.44%和8.07%。进一步采用高效液相色谱测定SRBP的分子质量,实验结果如图4所示。SRBP呈现多峰分布,说明其为非均一性多糖。根据标准曲线lgMw=-2.797 3TR+27.389 (R2=0.998 7,TR为标准品的保留时间,lgMw为分子质量的对数值),计算得到SRBP的相对分子质量分布于4 228.72~13 929.36 Da。
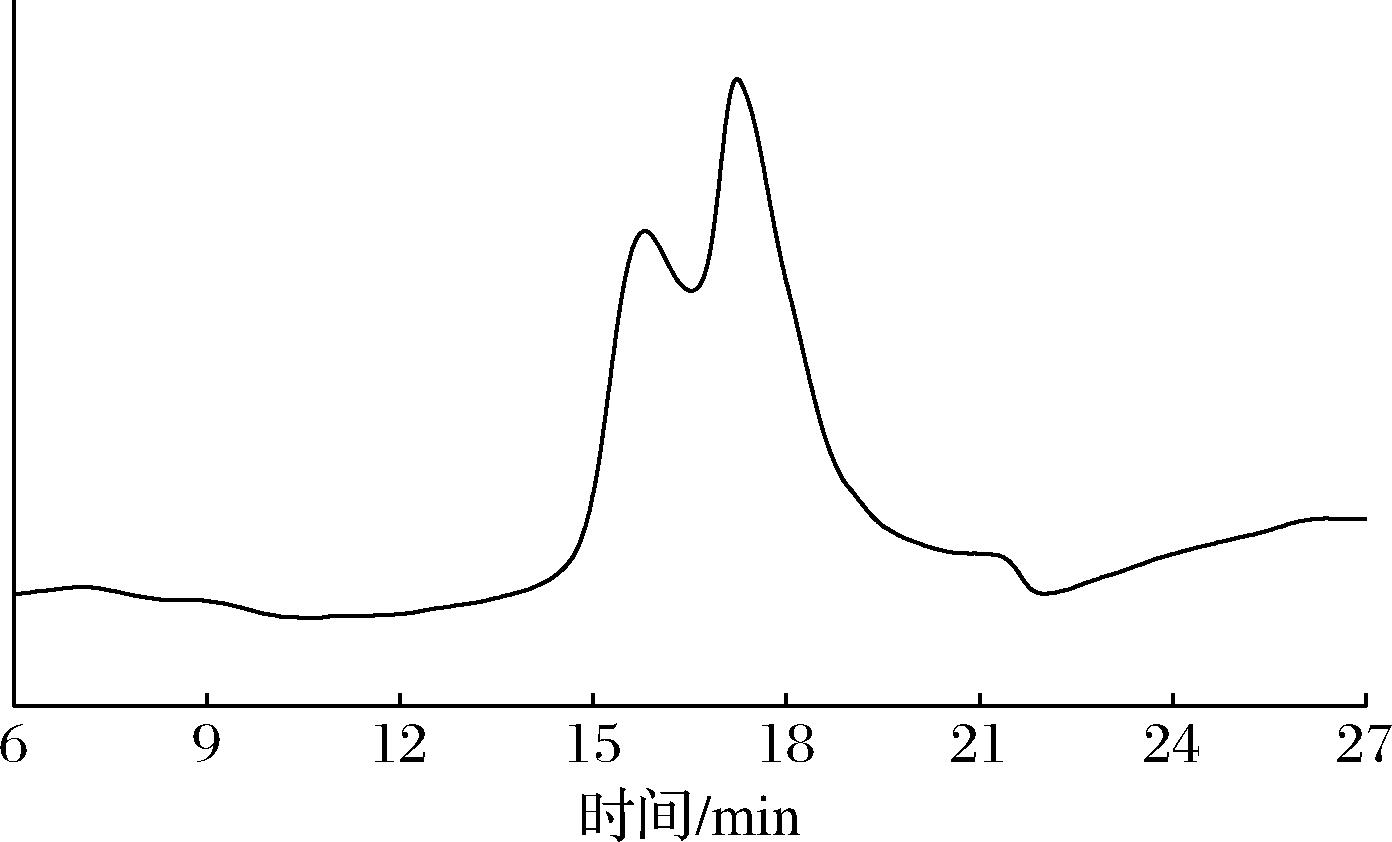
图4 SRBP的分子质量图
Fig.4 Molecular weight map of SRBP
2.4.2 SRBP的单糖组成
由图5可知,SRBP主要由甘露糖构成,还有少量的葡萄糖、鼠李糖、半乳糖,它们的比例为甘露糖∶鼠李糖∶葡萄糖∶半乳糖=27∶3∶9∶5。张潇艳[16]报道的脱脂米糠多糖主要含阿拉伯糖,而潘姝璇等[10]报道的发芽糙米米糠多糖以葡萄糖和半乳糖为主。综上可知,不同来源的米糠多糖其单糖组成差异相对较大。
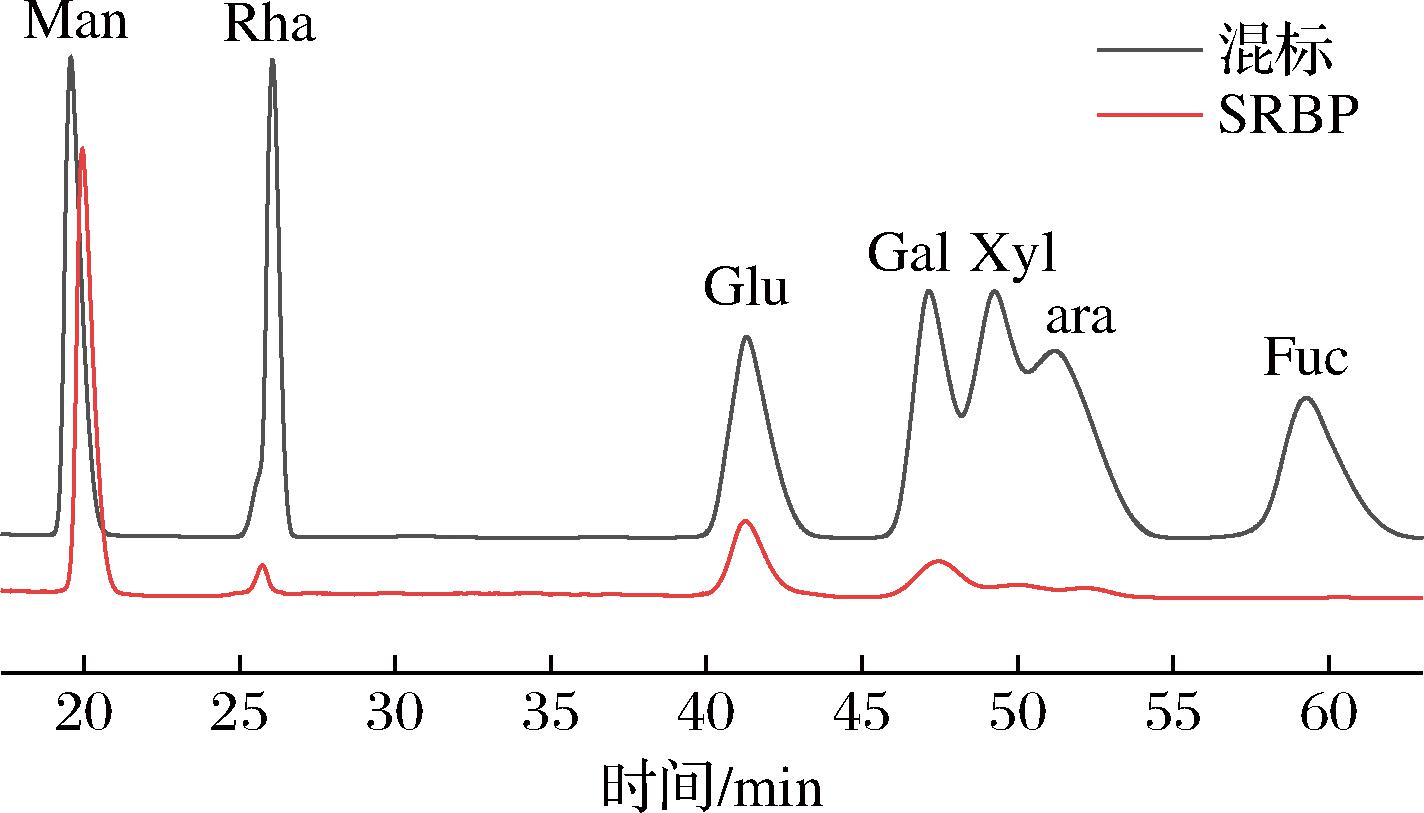
图5 SRBP水解产物的液相色谱图
Fig.5 Liquid chromatogram of polysaccharide hydrolyzed from SRBP
2.4.3 SRBP的紫外-可见光谱与FT-IR
由图6-a可知,SRBP在260 nm与280 nm处均无吸收,表明SRBP不含蛋白质和核酸物质,说明利用木瓜蛋白酶酶解能够有效去除SRBP中的蛋白质。由图6-b可知,SRBP在3 380 cm-1和2 938 cm-1处的吸收峰分别为多糖分子内或分子间氢键—OH伸缩振动和—CH2—伸缩振动[16]。SRBP在1 650 cm-1处的是C![]() O双键伸缩振动强吸收峰,1 100 cm-1的特征吸收峰为C—O—C和C—O—H中的C—O振动吸收,可以确定SRBP是吡喃糖环结构[7]。在900~830 cm-1范围内吸收峰不明显,推测SRBP中含有α和β两种构型的糖苷键[17]。在810 cm-1处出现了甘露聚糖的特征吸收峰[18],这与HPLC的结果一致。
O双键伸缩振动强吸收峰,1 100 cm-1的特征吸收峰为C—O—C和C—O—H中的C—O振动吸收,可以确定SRBP是吡喃糖环结构[7]。在900~830 cm-1范围内吸收峰不明显,推测SRBP中含有α和β两种构型的糖苷键[17]。在810 cm-1处出现了甘露聚糖的特征吸收峰[18],这与HPLC的结果一致。
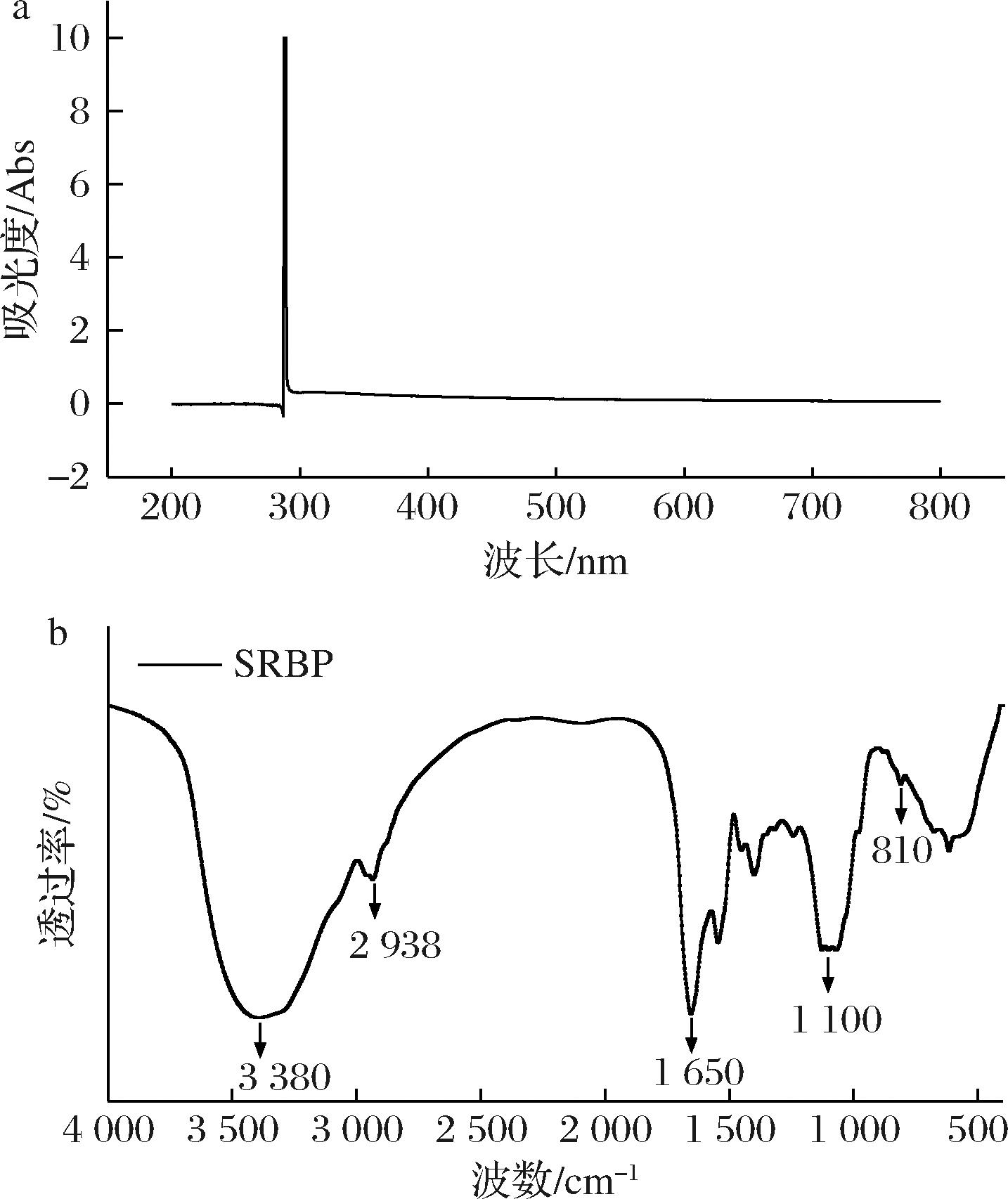
a-紫外光谱图;b-FT-IR
图6 SRBP的紫外光谱与FT-IR
Fig.6 Ultraviolet spectra and FT-IR spectrum of SRBP
2.4.4 SRBP的形貌观察
由图7-a可知,在500倍下观察可知,SRBP的结构主要呈不规则的片状,说明SRBP中不存在晶体结构[19]。在1 500倍下观察可知(图7-b),SRBP的边缘粗糙,表明其比表面积大,能够更好的暴露SRBP的活性区域,有效提高其生物活性[20]。在3 000倍下观察可知,SRBP表面有少量孔隙,这可能是由于冻干过程中失去结合水所致(图7-c)[19]。

a-500倍;b-1 500倍;c-3 000倍
图7 SRBP在不同倍数下的扫描电镜图像
Fig.7 SEM images under different multiples of SRBP
2.5 SRBP对人肝癌HepG2细胞存活率的影响
采用MTT法考察SRBP对HepG2细胞作用24、48、72 h后对其细胞存活率的影响,实验结果由图8所示。随着SRBP浓度的增加,HepG2细胞的存活率呈逐渐下降的趋势,表明在实验浓度范围内能够抑制HepG2细胞的增殖,并呈剂量依赖性。随着作用时间的增加,SRBP在高浓度下对HepG2细胞存活率的影响不显著,表明SRBP抑制HepG2细胞增殖没有表现出时间依赖性。当800 μg/mL SRBP处理HepG2细胞时,细胞存活率仅为(9.77±0.81)%,表明SRBP能够有效抑制HepG2细胞的增殖。
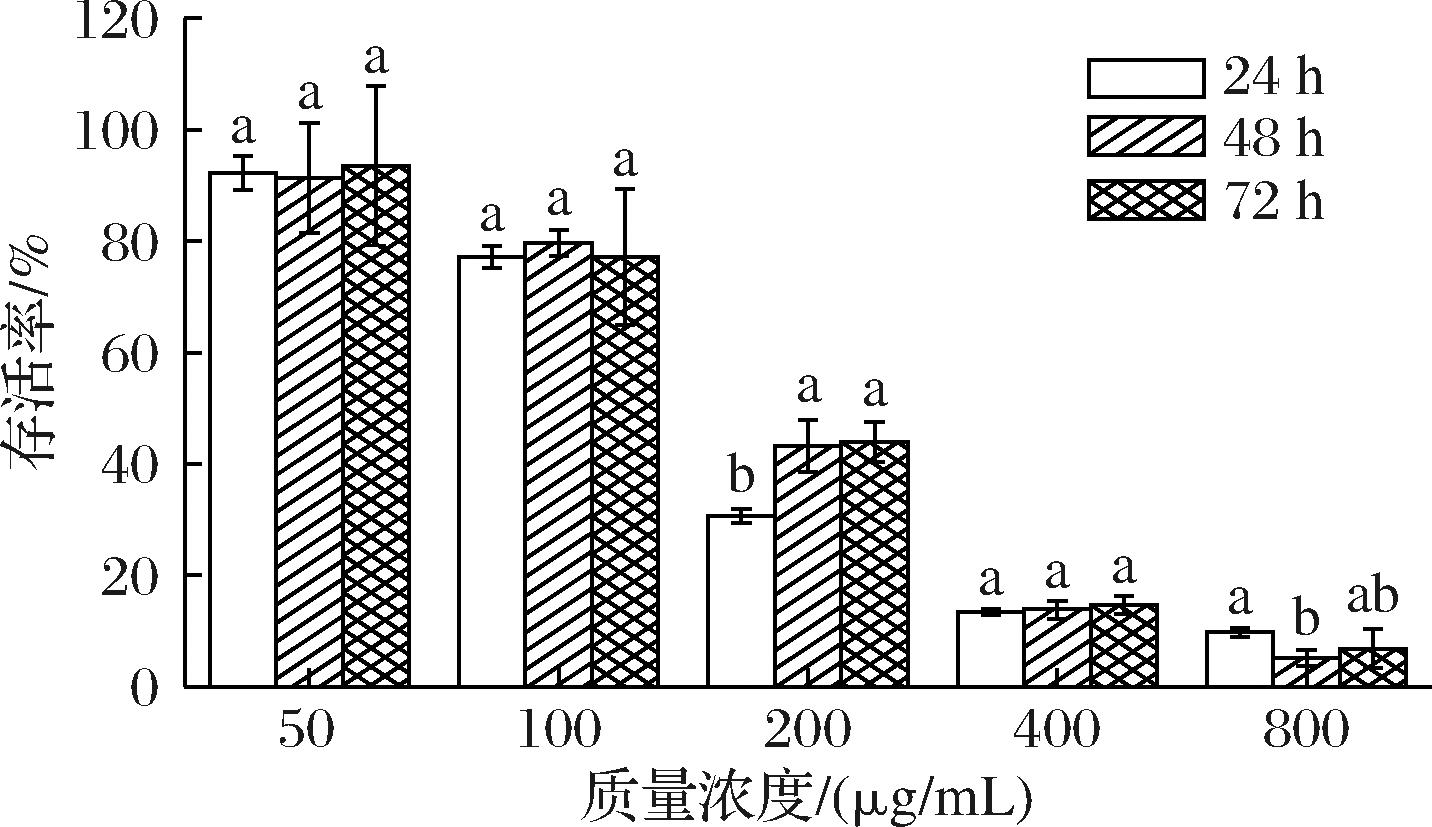
图8 SRBP对HepG2细胞存活率的影响
Fig.8 Effect of SRBP on survival rate of HepG2 cells
注:不同字母表示相同浓度下不同给药时间之间的显著性差异(P<0.05)。
研究发现,多糖的生物活性对分子质量具有明显的依赖性,分子质量过大不利于与细胞受体结合,而分子质量过低也无法形成具有生物活性的聚合结构[8,21]。因此,为了进一步探讨多糖结构与其活性之间的构效关系,本文在对SRBP结构表征的基础上,进一步研究其对HepG2细胞生长的影响。研究发现,SRBP在800 μg/mL时对HepG2细胞作用24 h的存活率仅为(9.77±0.81)%,显著高于目前已报道的米糠多糖对HepG2细胞的存活率(22%~45%和46.75%)[9,22]。上述结果表明,SRBP的抗肿瘤活性强于其他米糠多糖,这可能与海红米糠相比其他米糠多糖含有较高的甘露糖和适宜的分子质量有关。有研究表明,甘露糖相比于半乳糖、岩藻糖、葡萄糖等单糖,能够更为有效的抑制肿瘤细胞的糖代谢,且对免疫细胞也有多重调控作用[23];此外,SRBP的分子质量介于4 228.72~13 929.36 Da,这与前人报道分子质量介于1.0×103~2.0×104 Da的植物多糖具有抗肿瘤活性相一致[8]。研究发现,香菇多糖、芸芝多糖的抗肿瘤活性可能与其含有β-1,3与β-1,4糖苷键结构有关[24],在本研究中,发现SRBP含有α-糖苷键和β-糖苷键,推测其可能通过多糖支链末端α-或 β-所连的Manp残基来启动先天免疫,从而发挥抗肿瘤功能[25]。综上所述可知,分子质量、糖苷键结构和单糖组成对SRBP发挥抗肿瘤活性起到了重要作用,但其具体的抗肿瘤机理还有待进一步研究。
3 结论
本研究通过筛选不同的SRBP提取方法发现,纤维素酶辅助提取法优于热水浸提法和超声辅助提取法,这可能跟纤维素酶对海红米糠细胞壁具有破碎作用有关。进一步通过响应面实验得到了SRBP的最佳工艺参数为酶解时间61 min、料液比1∶33和酶解温度59 ℃。经紫外、红外和SEM鉴定发现,SRBP是一种纯度较高的甘露糖吡喃型杂多糖,不含蛋白及核酸物质,表面粗糙、呈片状结构。抗肿瘤活性评价发现,SRBP对HepG2细胞的生长表现出较强的抑制作用,表明其具有一定的抗肿瘤活性,这为SRBP在膳食干预预防肝癌等方面提供了理论基础和数据支撑。
[1] 王旭明, 赵夏夏, 陈景阳, 等.湛江盐碱地精准开发与海水稻抗盐碱高效栽培展望[J].热带农业科学, 2018, 38(12):25-29.WANG X M, ZHAO X X, CHEN J Y, et al.The precise development of saline-alkali soil and the prospect of high-efficiency cultivation of sea rice resistant to saline-alkali in Zhanjiang[J].Chinese Journal of Tropical Agriculture, 2018, 38(12):25-29.
[2] 郭烽塍. 湛江海水稻产业发展对策建议研究[D].湛江:广东海洋大学, 2019.GUO F C.Research on development countermeasures of sea rice industrialization in Zhanjiang[D].Zhanjiang:Guangdong Ocean University, 2019.
[3] YU Y H, ZHANG J J, WANG J, et al.The anti-cancer activity and potential clinical application of rice bran extracts and fermentation products[J].RSC Advances, 2019, 9(31):18060-18069.
[4] KYU M T, DAR B, AYE S S, et al.Prebiotic oligosaccharides prepared by enzymatic degradation of dietary fibers in rice grains[J].Journal of Nutritional Science and Vitaminology, 2019, 65(Supplement):S143-S147.
[5] GUL K, YOUSUF B, SINGH A K, et al.Rice bran:Nutritional values and its emerging potential for development of functional food: A review[J].Bioactive Carbohydrates and Dietary Fibre, 2015, 6(1):24-30.
[6] 国家卫生健康委员会. 原发性肝癌诊疗指南(2022年版)[J].肿瘤综合治疗电子杂志, 2022, 8(2):16-53.National Health Commission of The People’s Republic Of China.Guidelines for the diagnosis and treatment of primary hepatic carcinoma(2022 edition)[J].Journal of Multidisciplinary Cancer Management (Electronic Version), 2022, 8(2):16-53.
[7] 张琪琳. 香菇多糖的结构鉴定及抗肿瘤作用机制研究[D].武汉:华中科技大学, 2015.ZHANG Q L.Structural elucidation and antitumor mechanisms of polysaccharides isolated from Lentinus edodes[D].Wuhan:Huazhong University of Science and Technology, 2015.
[8] 张桂凤, 刘闯, 刘光东, 等.植物多糖的抗肿瘤机制及其构效关系研究进展[J].食品工业科技, 2023, 44(7):428-437.ZHANG G F, LIU C, LIU G D, et al.Research progress on antitumor mechanism and structure-activity relationship of plant polysaccharides[J].Science and Technology of Food Industry, 2023, 44(7):428-437.
[9] 石海鸽, 杨晓清, 周佳倩, 等.超声波辅助法制备脱脂米糠工艺的优化[J].粮食与油脂, 2019, 32(9):61-65.SHI H G, YANG X Q, ZHOU J Q, et al.Optimization of ultrasonic assisted process for preparing defatted rice bran[J].Cereals &Oils, 2019, 32(9):61-65.[10] 潘姝璇, 王嘉怡, 夏陈, 等.超声波辅助提取发芽糙米米糠多糖的工艺优化及其抗氧化活性研究[J].中国油脂, 2018, 43(2):124-128.PAN S X, WANG J Y, XIA C, et al.Optimization of ultrasound-assisted extraction of polysaccharides from germinated brown rice bran and its antioxidant activity[J].China Oils and Fats, 2018, 43(2):124-128.
[11] 俞兰苓, 刘友明, 全文琴, 等.几种米糠多糖提取工艺的比较[J].粮油食品科技, 2006, 14(6):18-20;23.YU L L, LIU Y M, QUAN W Q, et al.Comparison on extraction technology and property of rice bran polys accharide[J].Science and Technology of Cereals, Oils and Foods, 2006, 14(6):18-20;23.
[12] 鄢宏浩. 米糠多糖的提取优化及载体构建[D].武汉:武汉轻工大学, 2021.YAN H H.Extraction optimization and vector construction of rice bran polysaccharide[D].Wuhan:Wuhan Polytechnic University, 2021.
[13] 秦微微, 金婷, 宋学东, 等.米糠多糖脱蛋白工艺的研究[J].中国食品添加剂, 2014(1):183-187.QIN W W, JIN T, SONG X D, et al.Research on protein removal in rice bran polysaccharides[J].China Food Additives, 2014(1):183-187.
[14] CHEN J P, LI L, SU J Y, et al.Synergistic apoptosis-inducing effects on A375 human melanoma cells of natural borneol and curcumin[J].PLoS One, 2014, 9(6):e101277.
[15] 罗兰心, 张静, 刘洋, 等.响应面法优化酶法提取宁红茶多糖工艺[J].食品研究与开发, 2023, 44(2):66-72.LUO L X, ZHANG J, LIU Y, et al.Optimization of enzymatic extraction of tea polysaccharides from ninghong black tea by response surface methodology[J].Food Research and Development, 2023, 44(2):66-72.
[16] 张潇艳. 米糠多糖的提取、纯化及结构研究[D].无锡:江南大学, 2008.ZHANG X Y.Study on the extraction, purification and structure of polysaccharide from rice bran[D].Wuxi:Jiangnan University, 2008.
[17] 王玉. 海马多糖的分离、结构表征及抗炎抗氧化活性研究[D].上海:上海海洋大学, 2021.WANG Y.Isolation, structure characterization and anti-inflammatory, antioxidant activitys of a polysaccharide from hippocampus mohnikei[D].Shanghai:Shanghai Ocean University, 2021.
[18] 汪文琦, 陆磊, 田卫, 等.香菇多糖分离纯化及结构表征[J].西北民族大学学报(自然科学版), 2023, 44(1):10-15.WANG W Q, LU L, TIAN W, et al.Isolation purification and characterization of Lentinus edodes polysaccharide[J].Journal of Northwest Minzu University (Natural Science Edition), 2023, 44(1):10-15.
[19] CAI L L, ZOU S S, LIANG D P, et al.Structural characterization, antioxidant and hepatoprotective activities of polysaccharides from Sophorae tonkinensis Radix[J].Carbohydrate Polymers, 2018, 184:354-365.
[20] 胡晓波. 鱼腥草多糖的结构表征和抗炎活性研究[D].合肥:合肥工业大学, 2021.HU X B.Structural characterization and anti-inflammatory activity of polysaccharides from houttuynia cordata[D].Hefei:Hefei University of Technology, 2021.
[21] 赵秀婷, 宋志萍, 付萌, 等.食品加工技术影响多糖构效关系和溶液行为的研究进展[J].粮油食品科技, 2021, 29(3):78-86.ZHAO X T, SONG Z P, FU M, et al.Advances on the effect of processing technology on structure activity relationship and solution behavior of polysaccharides[J].Science and Technology of Cereals, Oils and Foods, 2021, 29(3):78-86.
[22] 王莉. 米糠多糖及其硫酸酯的结构、抗肿瘤活性的研究[D].无锡:江南大学, 2009.WANG L.Study on structural feature, antitumor activity of rice bran polysaccharide and their sulfates[D].Wuxi:Jiangnan University, 2009.
[23] 宋蒙蒙, 陈哲文, 李晔, 等.甘露糖抗肿瘤作用的研究进展[J].肿瘤代谢与营养电子杂志, 2019, 6(3):283-286.SONG M M, CHEN Z W, LI Y, et al.Advances in anti-tumor effect of mannose[J].Electronic Journal of Metabolism and Nutrition of Cancer, 2019, 6(3):283-286.
[24] 刘会娟, 李淑芳, 张晶晶, 等.米糠多糖的提取及理化性质研究进展[J].中兽医医药杂志, 2007, 26(1):23-24.LIU H J, LI S F, ZHANG J J, et al.Advance in extraction and physicochemical property of polysaccharide from rice bran[J].Journal of Traditional Chinese Veterinary Medicine, 2007, 26(1):23-24.
[25] 梁杉, 王琨, 刘佩瑶, 等.山药多糖结构、生物活性及其机制研究进展[J].食品科学, 2022, 43(23):296-304.LIANG S, WANG K, LIU P Y, et al.Progress in understanding the structure, biological activity and mechanism of yam polysaccharides[J].Food Science, 2022, 43(23):296-304.