十九大报告将“健康中国战略”作为国家发展的基本方略之一,随我国社会经济发展,人民物质生活水平大幅提高,同时生活环境和饮食结构也发生了很大改变。现在,我国城镇居民的生活环境高度洁净,由于缺乏环境微生物刺激,机体免疫器官发育相对不足,会引起固有免疫力低下问题[1]。此外,油炸食品、精制糖等在国民饮食中的增多会对肠道黏膜组织形态和屏障功能产生不利影响[2-3],而肠道屏障功能缺陷会导致肠道感染性疾病及炎性疾病的易感,对免疫稳态产生进一步不良影响[4]。因此,免疫力低下及相关疾病的发生率逐年上升,免疫力低下的典型表征就是过敏症如儿童过敏性鼻炎、哮喘、荨麻疹等发病率的迅速上升[5],而且免疫低下人群也是多种传染疾病如甲流、新冠病毒、诺如病毒感染等的易感人群[6]。
黄精乌鸡膏(jellied black-bone chicken with rhizoma polygonati,JBR)是以乌鸡肉及黄精、芡实等药食同源中药为原料制备的免疫增强类食品,乌鸡肉富含赖氨酸、蛋氨酸等必需氨基酸和多种维生素,并含有大量具有自由基清除作用的黑色素,所以乌鸡肉具有很高营养和药用价值。JBR原料中的药食同源中药可发挥补脾益气、补中固肾等作用,尤其是黄精的活性成分黄精多糖可提高小鼠胸腺和脾脏指数,增强脾淋巴细胞增殖活性和巨噬细胞吞噬能力,并可剂量依赖性提高NK细胞活性[7],黄精多糖还可促进细胞因子分泌,提高机体细胞和体液免疫水平及免疫清除能力[8],这说明黄精是一种免疫增强类中药,可用于开发免疫保健食品。
芡实也具有益肾补脾、固精益气作用,其必需氨基酸种类齐全、比例均衡,是一种优质的植物源膳食蛋白[9]。此外,芡实中还富含多种微量元素及脂肪酸,并含有多酚、生育酚、脑苷脂等活性成分,可发挥改善黏膜形态、抑菌、抗氧化等药理作用,也具有一定免疫调控效应[10]。JBR将乌鸡肉与黄精、芡实等生物调节功能有机结合到一起,形成具有免疫补益作用的功能性食品,具有提高免疫力的潜在作用。
本研究制备了营养组分与乌鸡汤类似的普通乌鸡膏(jellied black-bone chicken,JB),采用代谢组分析了JBR与JB间的营养组成差异,并结合免疫相关功能性物质组成状况系统评估其营养价值和潜在免疫调节功能。进而采用动物试验评价JBR的免疫增强作用,为分析JBR对不同免疫状态小鼠的影响,构建了4种不同小鼠免疫模型:正常模型、免疫抑制模型(环磷酰胺处理,模拟免疫低下状态)、急性炎症模型[脂多糖(lipopolysaccharide,LPS)攻毒,模拟病原感染]以及免疫抑制小鼠的急性炎症模型(环磷酰胺诱导免疫抑制后LPS攻毒构建急性炎症模型,模拟免疫力低下小鼠的病原感染),用以分析JBR对不同免疫状态C57BL/6小鼠体重、肠道黏膜形态及免疫功能的影响,以确定JBR的免疫温补效应。
1 材料与方法
1.1 主要材料与试剂
JBR所用黄精、芡实等药食同源药材采购自同仁堂大药房;动物模型为C57BL/6小鼠,成都达硕;环磷酰胺和苏木精-伊红染色剂,Sigma公司;鼠源Ig Kappaa 轻链抗体,武汉艾美捷;鼠源IL-2、TNF-α抗体,美国赛默飞;鼠源IL-2、TNF-α ELISA试剂盒,上海mlbio公司;小鼠脾脏淋巴细胞分离试剂盒,北京索莱宝;MTT细胞增殖毒性检测试剂盒,英国Abcam公司。
1.2 仪器与设备
Synergy HT多功能酶标仪,美国BioTek公司;光学显微镜,日本Nikon公司;原子吸收光谱仪,北京海光仪器公司;MJ-250B霉菌恒温培养箱,上海佳胜公司;Ampere chart Mutitron II恒温摇床;生物安全柜,北京东联哈尔仪器制造有限公司等。
1.3 JBR配方和制备工艺
JBR配方:500 g鲜乌鸡肉、30 g芡实、35 g干黄精、5 g干红枣和3 g枸杞,此外还有包含5 g生姜、15 g葱白、2 粒八角、2 g花椒、2 g桂皮、2 g干山楂及红枣和枸杞的调料包。JBR制备工艺如图1所示。

图1 JBR制备工艺
Fig.1 The preparation process of JBR
1.4 试验方法
1.4.1 JBR营养组分分析
采用相同工艺制备了JB和JBR,采用无偏超高效液相串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UHPLC-MS/MS)联用技术分析JB和JBR的代谢物组成状况(美吉生物),对关键代谢物进行差异显著性分析(FCR≥2,P≤0.05),并基于差异代谢物进行KEGG功能富集性分析。
1.4.2 JBR的生物学调控效应分析
本试验动物饲养和试验方案均经陕西中医药大学实验动物伦理委员会的批准(批号:SUCMDL20220612002)。选用120只体重在20~22 g 的雄性SPF C57BL/6小鼠,随机均分为8个处理,每个处理15只小鼠,饲养期14 d,试验处理如表1所示。
表1 试验处理方法
Table 1 Experimental treatment method

试验时间1~14 d7/9/11/13 d14 dAJB-BJBR-CJB环磷酰胺DJBR环磷酰胺EJB-LPSFJBR-LPSGJB环磷酰胺LPSHJBR环磷酰胺LPS
每天14:00~18:00用相应乌鸡膏替代鼠粮饲喂小鼠,第7、9、11、13 天C、D、G、H组小鼠注射50 mg/kg体重环磷酰胺构建免疫抑制模型;第14天小鼠处死前6 h,E、F、G、H组小鼠进行LPS攻毒构建急性炎症模型。试验期内隔天检测小鼠体重,绘制体重曲线,在第14天检测体重后采集血液并分离血清,随后进行屠宰试验,主要组织和试验方法(每个处理5个重复)如下:
(1)石蜡切片
采集3 cm长度十二指肠和空肠肠段,多聚甲醛固定后石蜡包埋,用切片机切割6 μm肠道切片,用苏木精-伊红染色,经脱水、透明和封片后光学显微镜观察并采集图像,用全自动图像分析仪测量绒毛高度和隐窝深度。
(2)脾脏NF-κB、IL-2和TNF-α免疫组化
脾脏经切片染色后参照MaxVisionTM法进行免疫组化,标志物为NF-κB、IL-2和TNF-α,光学显微镜观察免疫组化结果,其中棕黄色和褐色颗粒是靶蛋白。
(3)血清IL-2和TNF-α ELISA分析
采用鼠源IL-2和TNF-α ELISA试剂盒检测外周血相应细胞因子水平,按操作步骤向96孔板中加入试剂和样品,加入终止液后15 min内检测450 nm波长处的OD值。
(4)脾淋巴细胞增殖活性
脾脏剪碎后经100目滤网制备单细胞悬液并分离淋巴细胞,用ConA诱导小鼠脾淋巴细胞转化,根据《保健食品检验与评价技术规范》(2003年版)检测增殖活性。
(5)腹腔巨噬细胞吞噬能力
鸡翅下静脉采血制备红细胞悬液,腹腔注射,60 min后取小鼠腹腔液进行染色、涂片后显微镜观察巨噬细胞吞噬能力。
(6)外周血半数溶血值(half hemolysis concentration,HC50)
参照《保健食品检验与评价技术规范》(2003年版)进行HC50测定。
(7)自然杀伤(natural killer,NK)细胞活力
参照《保健食品检验与评价技术规范》(2003年版)进行NK细胞活性测定。
1.5 数据计算及显著性分析
动物试验数据的ANOVA分析采用SPSS 20.0软件,相关数据图表采用SigmaPlot 12.5绘制,试验数据均表述为平均值±标准差,体重差异显著性为P≤0.1,其他指标显著差异水平为P ≤ 0.05,柱形图中采用字母标注表示Duncan检验下的显著差异性。
2 结果与分析
2.1 JBR与JB间代谢物组成的整体差异性
采用代谢组分析了JBR物质组成状况,主成分分析(图2-a)和样品相关性(图2-c)结果显示JBR与JB的代谢物组成存在显著差异。其中,JB包含165种重要代谢物,JBR有167种重要代谢物(图2-b),火山图分析结果显示两者间存在一定数量的差异代谢物(图2-d)。
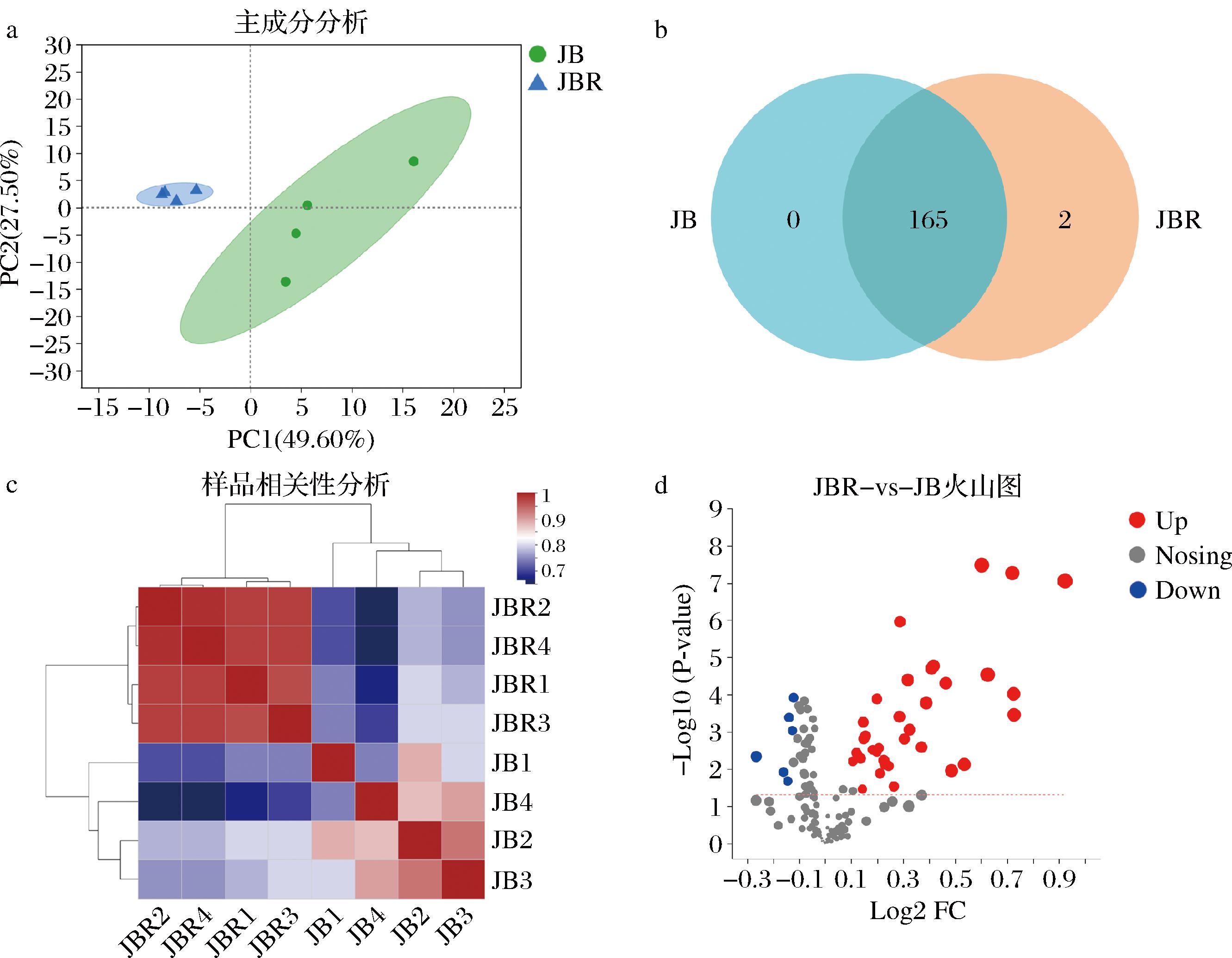
a-主成分分析;b-韦恩图;c-样品相关性;d-火山图
图2 JBR代谢组的主成分分析图、韦恩图、样品相关性和火山图分析结果
Fig.2 PCA plot, Venn diagram, correlation between samples, and volcano plot of the metabolome composition of JBR
2.2 JBR与JB间存在的差异代谢物
与JB相比,JBR中含有41种差异代谢物,JBR中含有更多蛋氨酸、色氨酸、丝氨酸等必须氨基酸及其衍生物,除氨基酸外,JBR中含有更多的维生素B12前体物质、D-鞘氨醇等,均可通过营养作用调控机体功能状态。此外,JBR中含有功能性多糖的单糖组分(素阿糖、果糖、L-山梨糖、半乳糖等)、茴香霉素、胡桃醌等,说明JBR富含具有免疫调节作用的功能性物质(图3)。
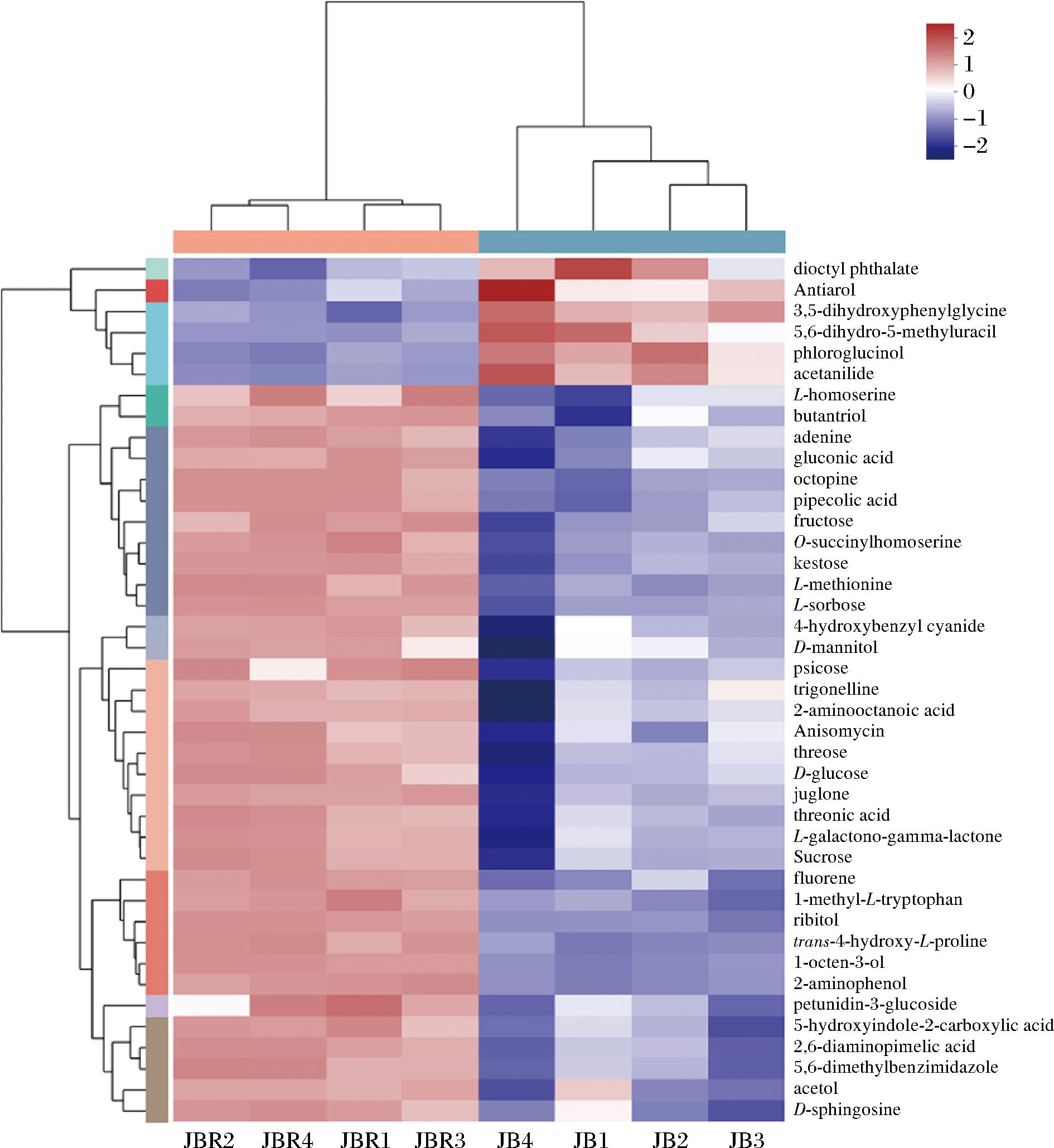
图3 差异代谢物的聚类分析热图
Fig.3 The hierarchical clustering heatmap of differential metabolites KEGG pathway enrichment analysis
2.3 基于差异代谢物的KEGG通路分析
KEGG分析结果显示,20个显著富集通路中有10个与营养代谢相关,其中胰岛素通路、淀粉和蔗糖代谢、磷酸戊糖途径等可调控能量代谢;矿物质吸收、核黄素新陈代谢、硫代谢等通路可影响矿物元素、维生素、氨基酸等的代谢过程。JBR中的差异代谢物还可改变癌症碳代谢、AGE-RAGE通路、Ⅱ型糖尿病、HIF-1通路等疾病和免疫相关通路。此外,JBR还可通过酵母菌减数分裂、霍乱弧菌生物膜形成、磷酸转移酶通路影响肠道菌群代谢和增殖过程,间接调节机体代谢和免疫性能(图4)。以上结果说明JBR具有调控机体营养代谢和免疫性能的潜在作用。
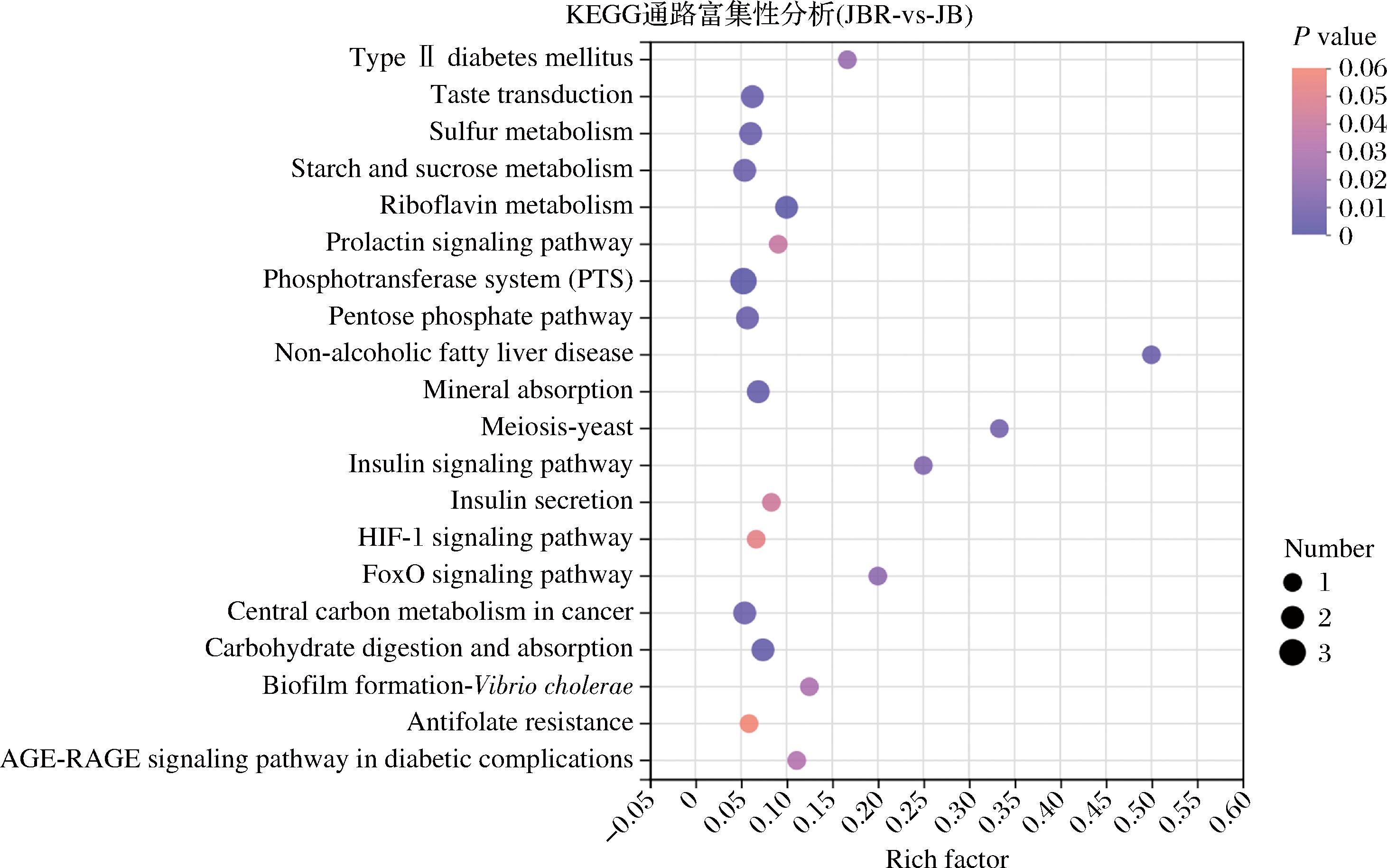
图4 基于差异代谢物的KEGG通路分析
Fig.4 KEGG pathway enrichment analysis of differential metabolites
2.4 JBR对不同免疫状态小鼠体重的影响
如图5-a所示,环磷酰胺可降低小鼠体重,而JBR可缓解环磷酰胺导致的体重损失。第14天体重结果显示LPS对小鼠体重无显著影响,而环磷酰胺可显著降低小鼠体重,JBR可抑制环磷酰胺对小鼠体重的不良影响(图5-b)。
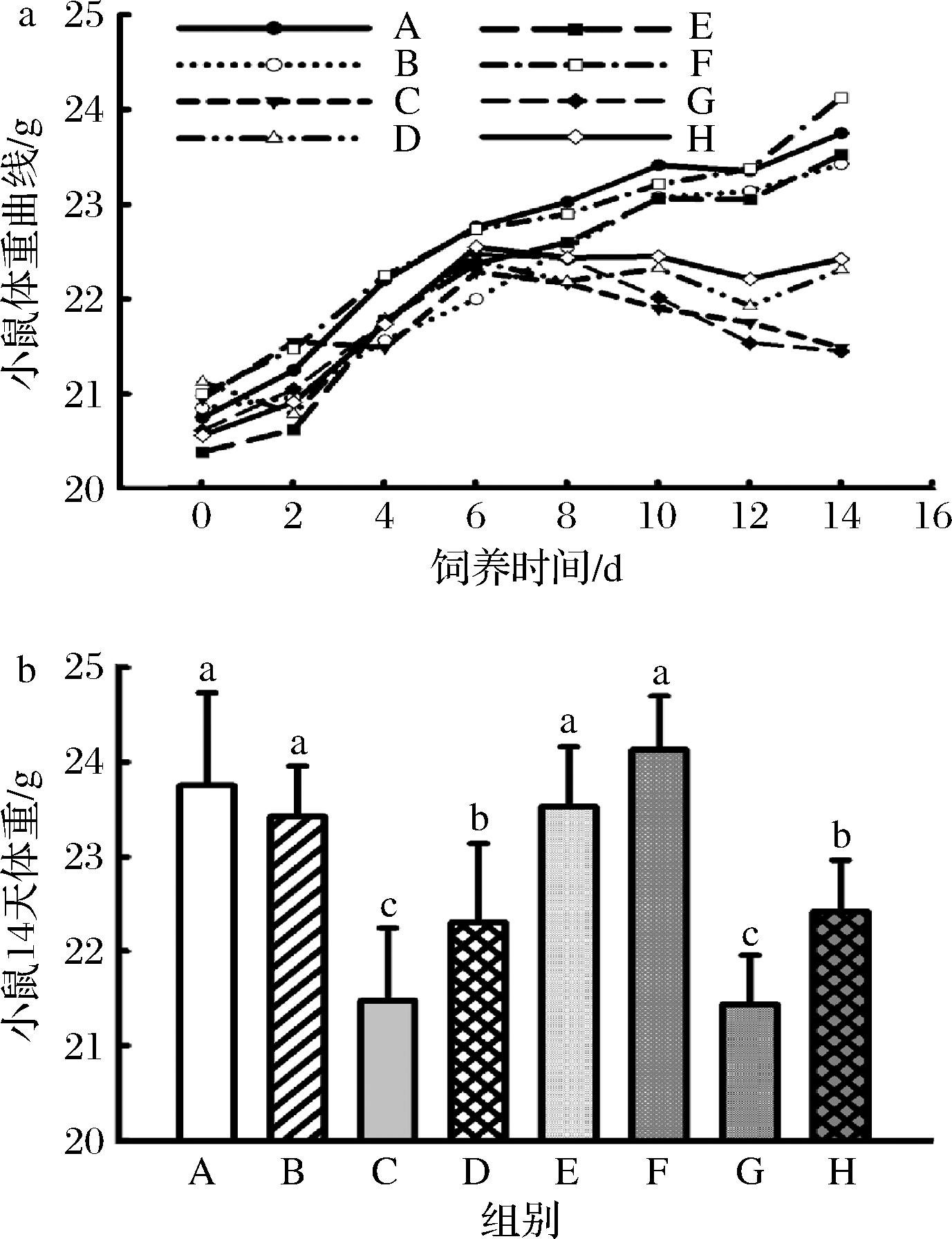
a-体重曲线;b-14 d体重
图5 JBR对小鼠体重曲线和14 d体重的影响
Fig.5 Effects of JBR on body weight of mice
注:不同字母表示差异显著(P≤0.05)(下同)。
2.5 JBR可显著改善环磷酰胺处理小鼠的小肠肠道黏膜组织形态
分析JBR对小鼠十二指肠黏膜形态的影响,结果显示环磷酰胺诱导的免疫抑制小鼠经LPS攻毒可导致十二指肠绒毛损伤,而JBR具有一定改善效应(图6-a)。进一步分析结果显示环磷酰胺可显著降低绒毛高度(图6-b),并显著降低十二指肠的绒毛高度/隐窝深度比值(V/C)(图6-d),而JBR可显著提高环磷酰胺组和环磷酰胺+LPS组的V/C值,说明JBR可显著改善环磷酰胺导致的十二指肠黏膜组织损伤。JBR对小鼠空肠黏膜组织形态的影响与十二指肠类似,环磷酰胺和环磷酰胺+LPS攻毒处理均可导致空肠绒毛损伤,而JBR可改善环磷酰胺导致的绒毛损伤(图7-a)。环磷酰胺和LPS攻毒可显著提高空肠隐窝深度(图7-c)并显著降低V/C值,而JBR可显著提高环磷酰胺和环磷酰胺+LPS组的V/C值(图7-d)。这说明JBR可改善环磷酰胺导致的小肠黏膜损伤,这也解释了为何JBR可缓解环磷酰胺导致的小鼠体重损失。
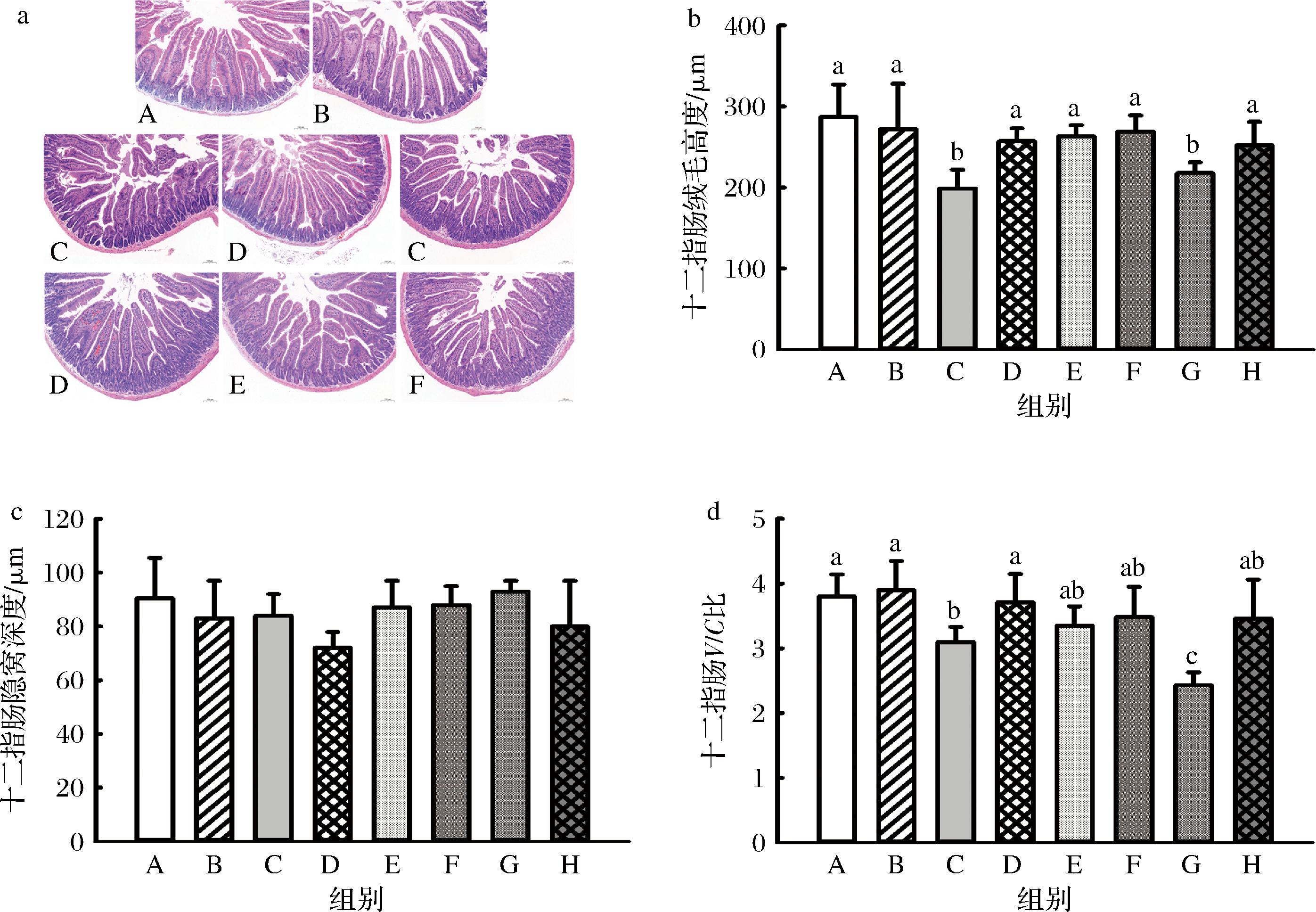
a-十二指肠黏膜组织形态;b-绒毛高度;c-隐窝深度;d-V/C比
图6 JBR对十二指肠黏膜组织的影响
Fig.6 Effects of JBR on mucosa of duodenum
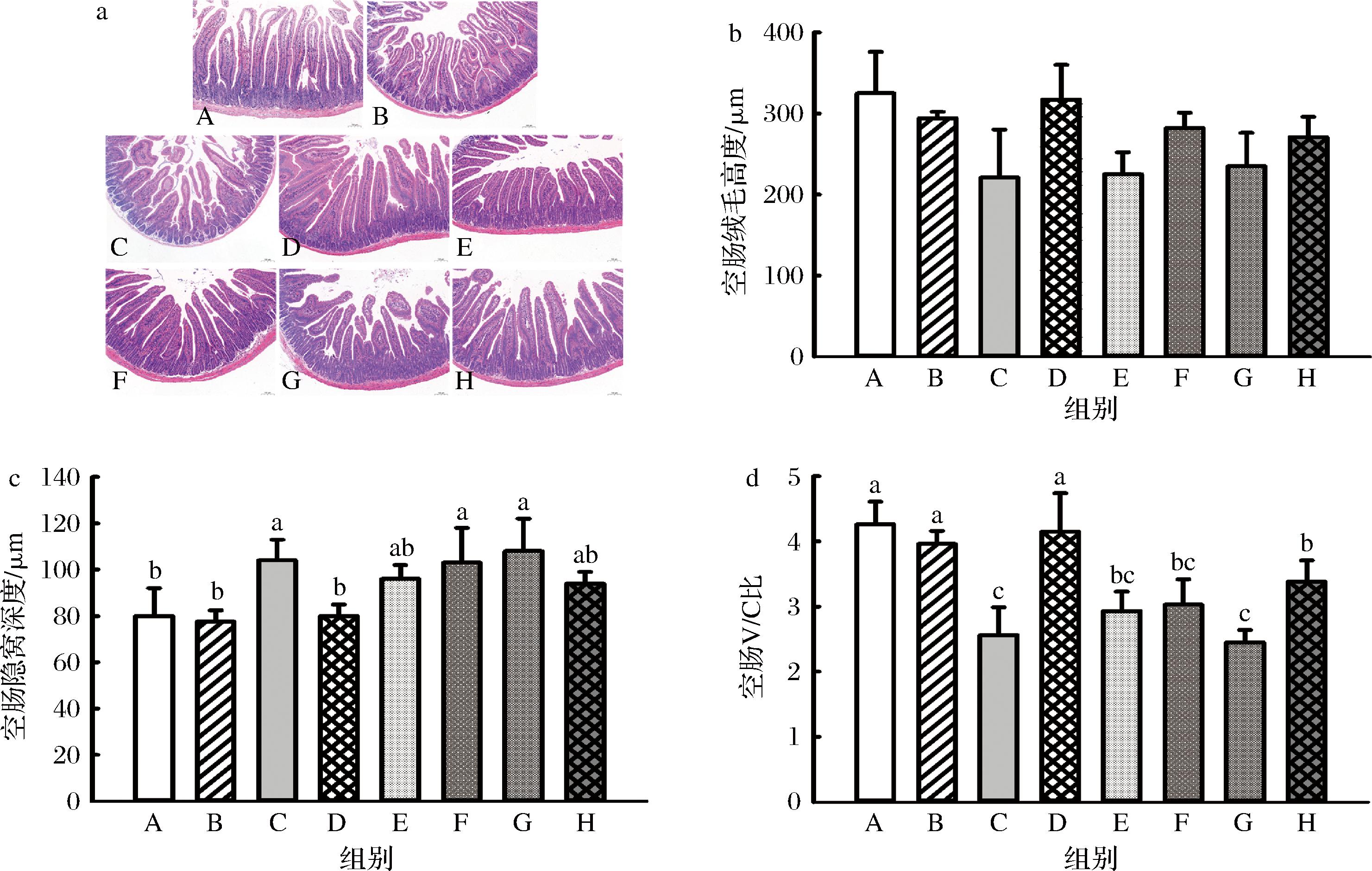
a-空肠黏膜组织形态;b-绒毛高度;c-隐窝深度;d-V/C比
图7 JBR对空肠黏膜组织的影响
Fig.7 Effects of JBR on mucosa of jejunum
2.6 JBR对环磷酰胺处理小鼠免疫器官质量的影响
JBR具有潜在免疫调节功能,本文分析了JBR对小鼠免疫器官质量的影响,试验结果显示环磷酰胺可导致胸腺和脾脏退化,JBR对胸腺和脾脏质量及免疫器官指数均无显著影响(图8),这说明环磷酰胺处理可构建免疫抑制小鼠模型。

a-小鼠胸腺质量;b-脾脏质量;c-胸腺指数;d-脾脏指数
图8 JBR对小鼠免疫器官的影响
Fig.8 Effects of JBR on immune organs of mice
2.7 JBR对小鼠脾脏炎症反应活性的影响
分析JBR对脾脏NF-κB、IL-2和TNF-α水平的影响,如图9所示各处理组间脾脏IL-2水平无显著差异性(图9-b),但JBR可改变脾脏NF-κB和TNF-α水平且两者变化趋势一致,LPS攻毒显著提高脾脏NF-κB和TNF-α水平,尤其是环磷酰胺+LPS处理可显著提高脾脏NF-κB和TNF-α丰度,并造成脾脏组织的严重损伤,而JBR可减少环磷酰胺+LPS组的脾脏NF-κB和TNF-α水平,且可有效缓解脾脏损伤(图9-a、图9-c)。这说明JBR具有抑制免疫低下小鼠脾脏炎症反应的作用。

a-NF-κB;b-IL-2;c-TNF-α
图9 免疫组化分析脾脏 NF-κB、IL-2及TNF-α表达状况
Fig.9 Immunohistochemical analysis of the expression of NF-κB, IL-2, and TNF-α in spleen
2.8 JBR对血清IL-2和TNF-α水平的影响
如图10-a所示,环磷酰胺可降低血清IL-2水平,LPS攻毒可显著提高血清 IL-2 水平,但 JBR 对不同免疫状态小鼠血清IL-2水平均无显著影响。与IL-2不同,LPS攻毒可显著提高血清TNF-α 水平,而JBR 可显著降低环磷酰胺+LPS 处理组的血清 TNF-α 水平,发挥炎症抑制效应(图10-b)。
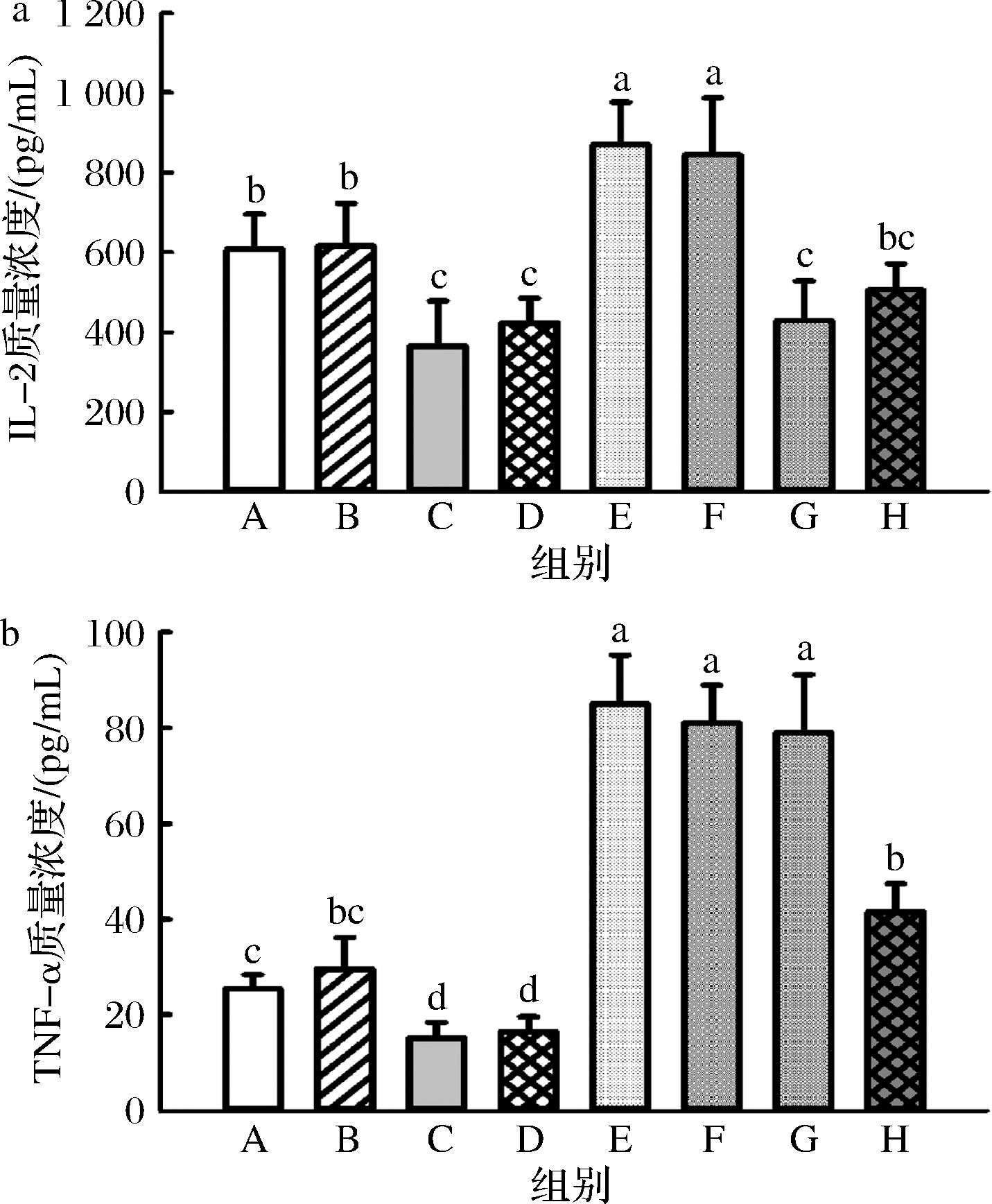
a-IL-2;b-TNF-α
图10 JBR对血清IL-2及TNF-α的影响
Fig.10 Effects of JBR on IL-2 and TNF-α in serum
2.9 JBR对不同免疫状态小鼠免疫性能影响
环磷酰胺可显著降低脾淋巴细胞增殖活性、NK 细胞活力、巨噬细胞吞噬能力和 HC50,而 JBR 可显著提高免疫抑制小鼠的 HC50(图11-d),并可显著提高环磷酰胺+LPS 组脾淋巴细胞增殖活性(图11-a)、NK 细胞活力(图11-b)和HC50(图11-d),这说明 JBR 可提高免疫抑制小鼠的免疫性能,并有利于免疫抑制小鼠应对急性炎症反应。
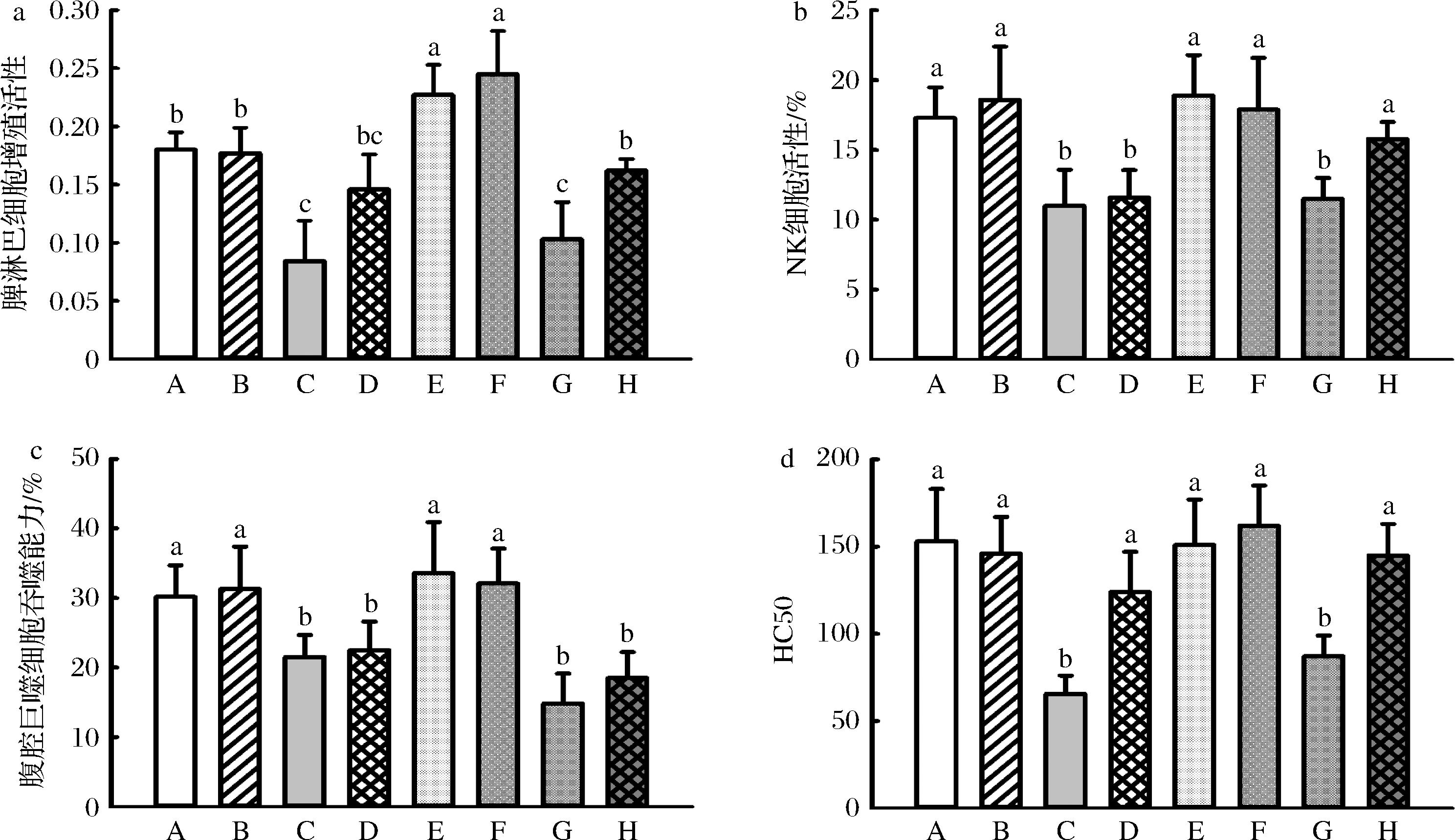
a-淋巴细胞增殖活性;b-NK细胞活性;c-巨噬细胞吞噬能力;d-HC50
图11 JBR对不同免疫状态小鼠免疫性能的影响
Fig.11 Effects of JBR on immuno-functions of mice in different immune status
3 讨论与结论
我国社会经济的迅速发展引致民众饮食结构、生活习惯和居住环境的巨大变化,导致当前广泛存在的固有免疫力低下问题,尤其是儿童和中老年人群免疫力低下问题严重,这也引起感染病(新冠肺炎病毒感染、甲流等)和自身免疫病的频发[11]。尤其在新冠疫情大背景下,新冠病毒感染可导致呼吸系统[12]、心血管系统[13]、消化系统[14]等的炎症相关器质性损伤,感染性疾病造成的组织损伤修复需消耗大量营养物质,而且免疫系统的功能维持和强化也需消耗大量营养物质,所以仅依赖免疫调控提高免疫性能是不够的,营养因素也发挥不可或缺的辅助作用[15]。
JBR富含多种必需氨基酸、维生素和功能性物质,其中的蛋氨酸和色氨酸有利于提高免疫功能[16]。除氨基酸外,维生素B12、D-鞘氨醇等亦可通过营养作用优化免疫功能。此外,JBR中的黄精多糖可通过活化TLR4信号通路发挥其免疫调控效应[17],茴香霉素可通过干预T淋巴细胞增殖发挥免疫调控功能[18],胡桃醌具有抗菌和抑癌作用[19]。进一步KEGG通路分析结果显示JBR可改变营养代谢(能量和氨基酸代谢)和免疫通路活性,这说明JBR可从营养和免疫两个方面发挥生物学调控作用。
进而,本文采用环磷酰胺处理构建了免疫抑制小鼠模型,并结合LPS攻毒构建了正常小鼠和免疫抑制小鼠的急性炎症模型,用以系统评价JBR的免疫调控作用。从中医角度看,免疫力低下的根源是“脾胃虚弱”,免疫低下往往伴随消化吸收功能缺陷,环磷酰胺在抑制小鼠淋巴细胞增殖的同时也对肠道黏膜组织形态产生不利影响,进而降低小鼠消化吸收率和体重[20],而JBR可通过优化肠道黏膜组织形态改善免疫抑制小鼠的肠道黏膜屏障和消化吸收功能。JBR的肠道黏膜保护作用源自黄精核心活性成分黄精多糖,肠道黏膜免疫反应往往导致肠道黏膜组织损伤,同时也激活了肠道黏膜的修复和更新,这种激活作用有利于保证肠道黏膜屏障完整性[21]。中药多糖(如黄芪多糖[22]、鸡血藤多糖[20]等)均具有基于适度免疫激活作用的肠道黏膜屏障优化功能,黄精多糖也具有改善肠道黏膜形态和屏障功能的作用,在老龄小鼠上的研究证实黄精多糖可显著改善肠道黏膜组织形态,优化肠道屏障功能[23],这就解释了JBR为何可缓解环磷酰胺导致的肠道黏膜组织损伤。
本研究发现LPS攻毒可活化免疫抑制小鼠的急性炎症反应,而JBR可显著降低其炎症反应活性并发挥对脾脏组织的保护作用。JBR抗炎作用与黄精多糖有关,黄精多糖可通过抑制LPS活化的TLR4/Myd88/NF-κB通路发挥炎症抑制作用[24],细胞水平的研究也发现黄精多糖可剂量依赖性抑制 LPS 诱导的炎症细胞因子活化,从而发挥炎症抑制作用[25]。除抗炎作用,黄精多糖还具有提高免疫力作用,可显著提高免疫抑制鸡的淋巴细胞增殖活性[26],并可提高免疫抑制小鼠的巨噬细胞吞噬能力[27]、HC50[28]和NK细胞活力[29],陈丹等[30]的研究也发现黄精茶饮可显著提高小鼠免疫力。本研究也发现JBR 具有提高免疫抑制小鼠免疫性能的作用,并有利于免疫抑制小鼠更好的应对急性炎症反应。JBR的免疫调节作用主要源自其核心活性成分黄精多糖,与黄芪多糖[29]、枸杞多糖[31]等一样,黄精多糖亦可通过干预TLR4通路活性发挥适度免疫激活效应,进而可同时发挥抗炎和免疫力增强作用,但JBR对健康小鼠的免疫功能或炎症反应状态均无显著影响,JBR只能改变免疫抑制小鼠的免疫功能状态,或者说JBR可通过免疫增强和抗炎作用提高免疫力低下小鼠应对病原侵染的能力。
综上所述,JBR富含多种必需氨基酸和维生素,并含有具有免疫调节效应的功能性多糖、胡桃醌等生物活性物质,因此JBR可通过营养干预和免疫调控改善机体健康状况。进一步的动物试验结果证实JBR可通过缓解环磷酰胺+LPS攻毒导致的小鼠肠道黏膜损伤,优化其肠道黏膜屏障功能,JBR还具有提高免疫抑制小鼠免疫性能的作用,并可抑制环磷酰胺处理小鼠的急性炎症反应,防止脾脏组织损伤,改善免疫抑制小鼠的健康状况。
[1] ZHENG D P, LIWINSKI T, ELINAV E.Interaction between microbiota and immunity in health and disease[J].Cell Research, 2020, 30(6):492-506.
[2] LEWIS J D, CHEN E Z, BALDASSANO R N, et al.Inflammation, antibiotics, and diet as environmental stressors of the gut microbiome in pediatric Crohn’s disease[J].Cell Host &Microbe, 2017, 22(2):247.
[3] OWCZAREK D, RODACKI T, DOMAGA A-RODACKA R, et al.Diet and nutritional factors in inflammatory bowel diseases[J].World Journal of Gastroenterology, 2016, 22(3):895-905.
A-RODACKA R, et al.Diet and nutritional factors in inflammatory bowel diseases[J].World Journal of Gastroenterology, 2016, 22(3):895-905.
[4] VANCAMELBEKE M, VERMEIRE S.The intestinal barrier:A fundamental role in health and disease[J].Expert Review of Gastroenterology &Hepatology, 2017, 11(9):821-834.
[5] 罗向前, 刘大波.儿童过敏性鼻炎的流行病学[J].中国实用儿科杂志, 2019, 34(3):197-199.LUO X Q, LIU D B.Epidemiology of allergic rhinitis in children[J].Chinese Journal of Practical Pediatrics, 2019, 34(3):197-199.
[6] KEOUGH W L, MICHAELS M G.Infectious complications in pediatric solid organ transplantation[J].Pediatric Clinics of North America, 2003, 50(6):1451-1469.
[7] CHEN Z B, LIU J J, KONG X, et al.Characterization and immunological activities of polysaccharides from Polygonatum sibiricum[J].Biological &Pharmaceutical Bulletin, 2020, 43(6):959-967.
[8] LIU Z G, NI H Y, YU L, et al.Adjuvant activities of CTAB-modified Polygonatum sibiricum polysaccharide cubosomes on immune responses to ovalbumin in mice [J].International Journal of Biological Macromolecules, 2020, 148:793-801.
[9] 陈蓉, 吴启南, 沈蓓.不同产地芡实氨基酸组成分析与营养价值评价[J].食品科学, 2011, 32(15):239-244.CHEN R, WU Q N, SHEN B.Amino acid composition and nutritional evaluation of Semen euryales from different regions[J].Food Science, 2011, 32(15):239-244.[10] 杨晓曦, 张庆林.中药芡实的研究进展[J].国际药学研究杂志, 2015, 42(2):160-164.YANG X X, ZHANG Q L.Research progress in Euryale ferox:A Chinese herb[J].Journal of International Pharmaceutical Research, 2015, 42(2):160-164.
[11] BEKKERING S, DOM NGUEZ-ANDRÉS J, JOOSTEN L A B, et al.Trained immunity:Reprogramming innate immunity in health and disease[J].Annual Review of Immunology, 2021, 39:667-693.
NGUEZ-ANDRÉS J, JOOSTEN L A B, et al.Trained immunity:Reprogramming innate immunity in health and disease[J].Annual Review of Immunology, 2021, 39:667-693.
[12] FLERLAGE T, BOYD D F, MELIOPOULOS V, et al.Influenza virus and SARS-CoV-2:Pathogenesis and host responses in the respiratory tract[J].Nature Reviews.Microbiology, 2021, 19(7):425-441.
[13] 李雷, 彭祎雪, 张洁, 等.新型冠状病毒对心血管系统影响的研究进展[J].中国胸心血管外科临床杂志, 2022, 29(1):106-113.LI L, PENG Y X, ZHANG J, et al.Research progess in effect of novel coronavirus on cardiovascular system[J].Chinese Journal of Clinical Thoracic and Cardiovascular Surgery, 2022, 29(1):106-113.
[14] 张亚军, 樊贞瑜, 李俊, 等.新型冠状病毒(SARS-CoV-2)在消化系统的研究进展[J].胃肠病学和肝病学杂志, 2020, 29(4):392-396.ZHANG Y J, FAN Z Y, LI J, et al.Research progress of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) in digestive system[J].Chinese Journal of Gastroenterology and Hepatology, 2020, 29(4):392-396.
[15] SMITH T J, MCCLUNG J P.Nutrition, immune function, and infectious disease[J].Medical Journal, 2021(PB 8-21-01/02/03):133-136.
[16] MCGAHA T L, HUANG L, LEMOS H, et al.Amino acid catabolism:A pivotal regulator of innate and adaptive immunity[J].Immunological Reviews, 2012, 249(1):135-157.
[17] YELITHAO K, SURAYOT U, PARK W, et al.Effect of sulfation and partial hydrolysis of polysaccharides from Polygonatum sibiricum on immune-enhancement[J].International Journal of Biological Macromolecules, 2019, 122:10-18.
[18] YU C Y, XING F Y, TANG Z L, et al.Anisomycin suppresses Jurkat T cell growth by the cell cycle-regulating proteins[J].Pharmacological Reports:PR, 2013, 65(2):435-444.
[19] DOS S MOREIRA C, SANTOS T B, FREITAS R H C N, et al.Juglone:A versatile natural platform for obtaining new bioactive compounds[J].Current Topics in Medicinal Chemistry, 2021, 21(22):2018-2045.
[20] CHEN X G, SUN W J, XU B C, et al.Polysaccharides from the roots of Millettia speciosa champ modulate gut health and ameliorate cyclophosphamide-induced intestinal injury and immunosuppression[J].Frontiers in Immunology, 2021, 12:766296.
[21] GARRETT W S, GORDON J I, GLIMCHER L H.Homeostasis and inflammation in the intestine[J].Cell, 2010, 140(6):859-870.
[22] LI Y L, LEI X Y, GUO W, et al.Transgenerational endotoxin tolerance-like effect caused by paternal dietary Astragalus polysaccharides in broilers’ jejunum[J].International Journal of Biological Macromolecules, 2018, 111:769-779.
[23] LI L X, FENG X, TAO M T, et al.Benefits of neutral polysaccharide from rhizomes of Polygonatum sibiricum to intestinal function of aged mice[J].Frontiers in Nutrition, 2022, 9:992102.
[24] LIU T Y, ZHAO L L, CHEN S B, et al.Polygonatum sibiricum polysaccharides prevent LPS-induced acute lung injury by inhibiting inflammation via the TLR4/Myd88/NF-κB pathway[J].Experimental and Therapeutic Medicine, 2020, 20(4):3733-3739.
[25] CUI X W, WANG S Y, CAO H, et al.A review:The bioactivities and pharmacological applications of Polygonatum sibiricum polysaccharides[J].Molecules, 2018, 23(5):1170.
[26] SHU G, XU D, ZHAO J, et al.Protective effect of Polygonatum sibiricum polysaccharide on cyclophosphamide-induced immunosuppression in chickens[J].Research in Veterinary Science, 2021, 135:96-105.
[27] 华岩, 李鸿敏, 王春亮, 等.黄精多糖对强迫运动大鼠脾脏免疫功能的影响[J].扬州大学学报(农业与生命科学版), 2019, 40(1):57-61.HUA Y, LI H M, WANG C L, et al.Effect of Polygonatum polysaccharide on spleen immune function of forced exercises rats[J].Journal of Yangzhou University (Agricultural and Life Science Edition), 2019, 40(1):57-61.
[28] 石娟, 邓兴安, 周玲, 等.黄精粗多糖对正常小鼠免疫功能的影响[J].中国现代应用药学, 2011, 28(1):18-21.SHI J, DENG X A, ZHOU L, et al.Effects of crude polysaccharides from Polygonati rhizoma on immune function in normal mice[J].Chinese Modern Applied Pharmacy, 2011, 28(1):18-21.
[29] LIU D, TANG W, HAN C, et al.Advances in Polygonatum sibiricum polysaccharides:Extraction, purification, structure, biosynthesis, and bioactivity[J].Frontiers in Nutrition, 2022, 9:1074671.
[30] 陈丹, 罗丹, 白曦晨, 等.富硒青钱柳-黄精复方茶饮对小鼠的免疫调节作用[J].食品安全质量检测学报, 2021, 12(9):3621-3626.CHEN D, LUO D, BAI X C, et al.Immunoregulatory function of selenium-enriched Cyclocarya paliurus and Polygonatum sibiricum compound tea on mice[J].Journal of Food Safety &Quality, 2021, 12(9):3621-3626.
[31] ZHU W, ZHOU S X, LIU J H, et al.Prebiotic, immuno-stimulating and gut microbiota-modulating effects of Lycium barbarum polysaccharide[J].Biomedicine &Pharmacotherapy = Biomedecine &Pharmacotherapie, 2020, 121:109591.