酪氨酸酶是广泛存在于动植物体内的一种含铜金属酶,在黑色素生成过程中,酪氨酸酶起到了至关重要的作用。研究表明,酪氨酸酶上的铜离子与其催化能力息息相关,当酪氨酸酶中心活性铜离子被占据时,便无法催化酪氨酸和多巴的氧化[1]。除了螯合铜离子来抑制酪氨酸酶外,使酪氨酸酶变性失活、降低底物氧化速率、还原被氧化的底物也是有效抑制酪氨酸酶活性的方法。酪氨酸酶的活性除了影响人体体表黑色素沉积外,食物褐变、黑色素瘤、甚至帕金森疾病都与酪氨酸酶的活性息息相关[2],抑制酪氨酸酶能够有效缓解上述现象的发生。
常见的酪氨酸酶抑制剂有曲酸、熊果苷、间苯二酚等,但它们大多具备刺激性、致病性和一定的生物毒性,或以化学方法合成复杂,因此研究者们开始希望通过生物技术手段,从一些天然产物中找寻替代方案。近年来,微生物发酵技术已在医药、食品、农业及工业等众多领域得到广泛应用。特别是益生菌的运用,这些在人体内定殖并有益健康的活性微生物,已经成为研究热点。通过利用益生菌对天然产物进行发酵处理,可以催化或优化天然活性成分的转化过程[3]。这种生物转化手段能够有效地促进有益活性物质的释放,增强其内在的生物活性,甚至可能产生全新的活性分子。嗜酸乳杆菌是一种存在于人体小肠中的益生菌[4],被称为“公认安全的食品微生物”,具有优秀的安全性和功效性[5]。目前研究已证实通过嗜酸乳杆菌发酵可以提高一些天然产物的生物活性。例如,嗜酸乳杆菌发酵的米糠表现出更强的抗氧化能力[6];梨汁在经过嗜酸乳杆菌发酵后,其褐变速率相比发酵前明显下降[7]。因此嗜酸乳杆菌能够作为安全高效的发酵用菌种应用在天然产物活性开发中。
松茸,又称松口蘑、松蕈等,属于口蘑科口蘑属真菌。松茸是一种生长在松栎等树木外层的菌根真菌,是世界上珍稀名贵的天然药用菌,被誉为“菌中之王”。研究表明,除了丰富的营养成分以外,松茸还富含多种活性物质,包括松茸多糖、松茸多肽、松茸醇[8-9]等成分,为松茸带来了抗肿瘤、抗氧化、降血糖和免疫调节[8-11]等生物活性。然而,由于松茸与松树的共生关系,其人工栽培困难,因此数量稀少且价格昂贵。通过生物发酵的手段能够有效利用松茸资源,松茸中富含的多糖、多肽能够作为天然碳源和氮源供给菌种生长,菌株生长过程中释放复合酶再降解松茸中的天然大分子,释放出活性片段[12],提高松茸的生物活性。因此,本研究通过使用嗜酸乳杆菌作为发酵菌种,对松茸进行发酵处理,以提高其对酪氨酸酶的抑制能力,并探究其抑制酪氨酸酶的机理,为其在美白、抗食物褐变等方面的应用提供一定的理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
发酵菌种:嗜酸乳杆菌(Lactobacillus acidophilus),江南大学化妆品创新研究中心。松茸(Tricholoma matsutake),云南英格生物技术有限公司。
酵母提取物、胰蛋白胨,赛默飞世尔科技有限公司;牛肉浸粉,青岛海博生物技术有限公司;CuCl2、MgSO4、MnSO4、K2HPO4、D-(+)-无水葡萄糖、柠檬酸三铵、磷酸氢二钠、磷酸二氢钠,国药集团化学试剂有限公司;蘑菇来源酪氨酸酶,默克中国股份有限公司;乙酸钠、吐温-80,上海泰坦科技股份有限公司;左旋多巴(levodopa,L-DOPA)、紫脲酸铵,北京伊诺凯科技有限公司。
菌种活化用MRS肉汤培养基:胰蛋白胨10 g、牛肉浸膏10 g、酵母提取物4 g、葡萄糖20 g、柠檬酸三铵2 g、乙酸钠5 g、MgSO4 0.2 g、MnSO4 0.04 g、K2HPO4 2 g、吐温80 1 g、去离子水 1 000 mL,调节pH=5.7±0.2,121 ℃高温灭菌20 min。
1.1.2 仪器与设备
FA 1604数显电子分析天平,上海天平仪器厂;5804R离心机,德国 Eppendorf 公司;DHG-9140A电热恒温鼓风干燥箱,上海精宏仪器设备有限公司;Five Easy实验室pH 计,瑞士 METTLER TOLEDO 公司;CYTATION 5多功能微孔板酶标仪,美国 Bio Tek 公司;SW-CJ-2FD超净工作台,无锡凯派克斯科技有限公司;GI54DWS立式自动压力蒸汽灭菌器,致微仪器有限公司;SCIENTZ-10 N/C冷冻干燥机,宁波新芝生物科技有限公司;ZWYC-2931振荡培养箱,上海智城分析仪器制造有限公司;BJ-150粉碎机,上海圆迈贸易有限公司。
1.2 实验方法
1.2.1 松茸发酵样的制备
将冻存的嗜酸乳杆菌接种至MRS液体培养基中,在37 ℃下振荡培养3代以上,得到活化的嗜酸乳杆菌。将活化的嗜酸乳杆菌以3%接种量接种至MRS液体培养基中,在37 ℃下120 r/min振荡培养24 h,得到发酵种子液。
取风干松茸子实体,剪碎后粉碎机粉碎,过50目筛,即得松茸50目过筛粉末。
取适量的松茸粉末,加入100 mL去离子水,121 ℃高温灭菌20 min。向其中加入适量的活化的发酵种子液,在37 ℃下120 r/min振荡培养一定时间,8 000 r/min离心15 min分离上清液,将上清液冻干保存,即得松茸发酵样品(fermented T. matsutake,FTM)。
1.2.2 酪氨酸酶抑制能力测定
称取14.32 g Na2HPO4·12H2O和6.24 g NaH2PO4·2H2O,分别溶于250 mL去离子水,混合后调节pH 6.8,即得160 mmol/L磷酸盐缓冲液(PBS)。取200 μL样品置于离心管中,加入200 μL PBS,振荡混匀后加入200 μL 250 U/mL 酪氨酸酶(25 KU/mL酪氨酸酶溶于1 mL PBS,使用时稀释100倍),振荡混匀后室温孵育10 min,加入200 μL 6 mmol/L L-DOPA,振荡混匀后在室温下反应20 min,立刻测定475 nm下吸光度值。通过公式(1)计算样品酪氨酸酶抑制率。
酪氨酸酶抑制率![]()
(1)
式中:As,样品组吸光度值;Asb,样品空白组吸光度值;Ac,对照组吸光度值;Acb,对照空白组吸光度值。
1.2.3 松茸发酵工艺条件优化
分别对发酵过程中松茸添加量、菌液接种量、发酵时间进行优化,具体方法如下:
松茸添加量的优化方法:分别称取2、3、4、5、6 g松茸粉末于锥形瓶中,其余步骤参照1.2.1节的方法进行发酵,参照1.2.2节的方法测定发酵样品酪氨酸酶抑制率。
菌液接种量的优化方法:接种发酵液时,分别向发酵底物中接种1、3、5、7、9 mL的发酵种子液,其余步骤参照1.2.1节的方法进行发酵,参照1.2.2节的方法测定发酵样品酪氨酸酶抑制率。
发酵时间的优化方法:参照1.2.1节的方法建立发酵体系,将发酵摇瓶分别培养1、2、3、4、5 d,收集样品后参照1.2.2节的方法测定发酵样品酪氨酸酶抑制率。
1.2.4 松茸发酵前后物质组成变化测定
总蛋白含量采用二喹啉甲酸(bicinchoninic acid,BCA)法进行测定,取20 μL待测样于96孔板中,加入200 μL BCA反应液,振荡混匀后在37 ℃下反应30 min,测定562 nm下吸光度值,以牛血清白蛋白为标准品计算样品当量蛋白浓度。
总糖含量通过苯酚-硫酸法进行测定,以葡萄糖为标准品,计算样品当量葡萄糖浓度。乳酸含量采用Waters 2965 HPLC进行检测,色谱柱为Diamonsil C18色谱柱,流动相A-甲醇∶水∶磷酸=5∶95∶0.05(体积比),流动相B-甲醇∶水∶磷酸=80∶20∶0.05(体积比)。洗脱顺序为:0~5 min,100% A;5~15 min,100%~90% A;15~45 min,90%~0% A。流速0.8 mL/min,检测波长210 nm。
肽分子质量测定使用Waters 2695高效液相色谱仪配2487紫外检测器检测,色谱柱为TSKgel 2000 SWXL 300 mm×7.8 mm,流动相为乙腈∶水∶三氟乙酸=40∶60∶0.1,流速0.5 mL/min,柱温30 ℃,检测波长220 nm。
游离氨基酸含量采用邻苯二甲醛柱前衍生反向高效液相色谱-紫外检测法测定。将发酵前后样品通过三氯乙酸法脱除蛋白质后进行检测。流动相A:27.6 mmol/L醋酸钠-三乙胺-四氢呋喃(体积比为500∶0.11∶2.5);流动相B:80.9 mmol/L醋酸钠-甲醇-乙腈(体积比为1∶2∶2)。洗脱程序为:0 min,8% B;17 min,50% B;20.1 min,0% B;24 min,0% B。流动相流速1 mL/min,柱温40 ℃,紫外检测器检测波长为338 nm,脯氨酸以262 nm检测。氨基酸含量以外标法定量。
1.2.5 FTM酪氨酸酶抑制可逆性测定
参照YANG等[13]的方法,并作一定修改,具体方法如下:用80 mmol/L PBS配置250、200、150、100、50 U/mL的酪氨酸酶溶液,按照1.2.2节方法加入底物、样品和酶,在37 ℃下检测0~15 min样品的吸光度变化,每隔1 min检测1次。以吸光度为纵坐标,时间为横坐标绘制散点图,将直线部分散点线性拟合,得到的直线的斜率即为酶反应初速率,以酪氨酸酶活力为横坐标,酶反应初速率为纵坐标绘图并线性拟合,即得酶反应初速率与酪氨酸酶活力的关系。根据直线交点位置判断酪氨酸酶抑制的可逆性。
1.2.6 FTM酪氨酸酶抑制类型测定
酶促反应一般遵循米氏方程,通过双倒数方程即求出米氏方程(2)中的Vm和Km值,根据拟合直线的交点位置判断抑制类型。
(2)
式中:ν0,酶反应初速度;Vm,酶的最大反应初速度;Km,米氏常数;[S],底物浓度。
通过Lineweaver-Burk双倒数方程(3)得到Km和Vm 的变化关系。
(3)
参照YANG等[13]的方法,并做一定修改,具体方法如下:用80 mmol/L PBS配置9、7.5、4.5、3 mmol/L的左旋多巴溶液,按照1.2.3节的方法加样,在37 ℃下检测0~15 min内样品的吸光度变化,每隔1 min检测1次。以吸光度为纵坐标,时间为横坐标绘制散点图,将直线部分散点线性拟合,得到的直线的斜率即为酶反应初速率,以底物浓度的倒数为横坐标,酶反应初速率的倒数为纵坐标绘图并线性拟合,即得发酵样品的Lineweaver-Burk双倒数曲线图。
1.2.7 FTM铜离子螯合能力测定
参照吴悦[14]的方法,并做一定修改,具体方法如下:配置0.2 mol/L HAc-NaAc缓冲液(pH 3.75),用缓冲液溶解并配置1 mmol/L CuCl2溶液和1 mmol/L紫脲酸铵溶液。在96孔板中加入50 μL CuCl2溶液和50 μL的缓冲液,振荡混匀后再加入100 μL 1 mmol/L紫脲酸铵溶液,在480 nm和540 nm下测定吸光度值,以OD480/OD540为纵坐标,铜离子浓度为横坐标作图,绘制铜离子浓度标准曲线。
样品的检测方法为:取一定浓度的样品与2 mmol/L CuCl2溶液等体积混合,室温下孵育1 h。将50 μL反应液和50 μL的缓冲液加入96孔板中,混匀后再加入100 μL 1 mmol/L紫脲酸铵溶液,振荡混匀后测定480 nm和540 nm下的吸光度值,以OD480/OD540的值表示当量铜离子浓度,并通过公式(4)计算铜离子螯合率:
铜离子螯合率![]()
(4)
式中:[Cu2+],总铜离子浓度,mmol/L;[Cufree2+],游离铜离子浓度,mmol/L。
1.2.8 酪氨酸酶荧光猝灭实验
参照穆燕[15]的方法,并作出一定修改,具体方法如下:向离心管中加入200 μL 250 U/mL酪氨酸酶,再分别加入0~100 μL 1 mg/mL 发酵样品,振荡混匀后加入PBS使得反应总体积为300 μL。振荡混匀后置于298 K下反应30 min。在280 nm下激发荧光,扫描发射波长360~420 nm,步长3 nm。
1.3 数据统计分析
所有实验数据均为平均值,每个实验至少重复3次。实验数据使用Microsoft Excel 2021和Origin 2019进行统计分析和绘图,实验结果以平均值±标准差的形式表示。
2 结果与分析
2.1 松茸发酵前后酪氨酸酶抑制能力测定
FTM的酪氨酸酶抑制率测定结果如图1所示。
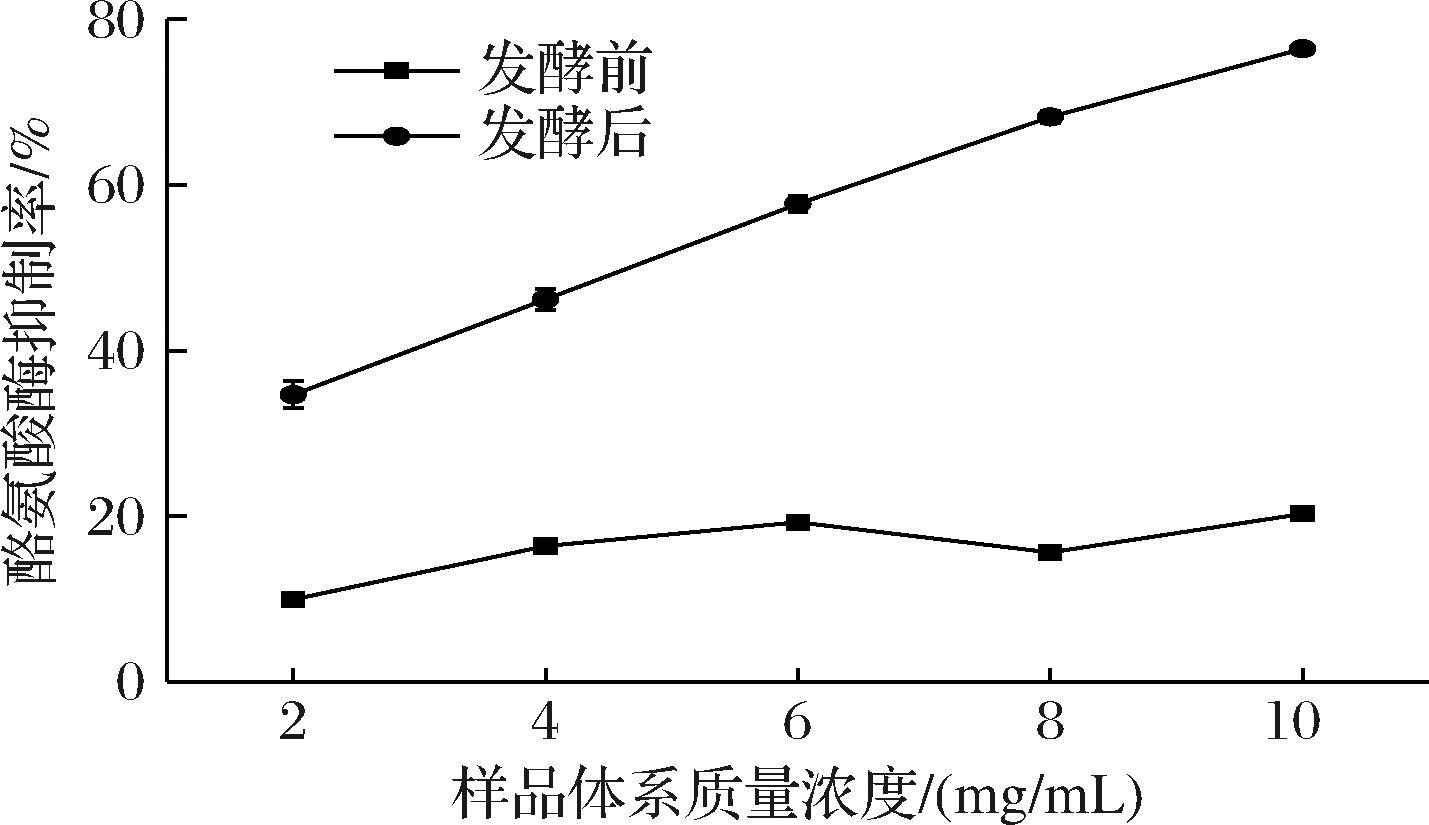
图1 松茸发酵前后酪氨酸酶抑制能力对比
Fig.1 Comparison of tyrosinase inhibition capacity of T. matsutake before and after fermentation
酪氨酸酶在黑色素生成的过程中起到决定性的作用,通过抑制酪氨酸酶的活性可以有效减缓黑色素生成的速率。通过体外酪氨酸酶抑制实验可以判断样品是否具有美白潜力。由图1可知,松茸的酪氨酸酶抑制率从发酵前的(20.3±0.7)%提升至发酵后的(76.4±0.6)%,提升至发酵前的3.76倍。且酪氨酸酶半抑制浓度IC50值从发酵前的大于10 mg/mL下降到了(4.74±0.21) mg/mL。乳酸菌能够通过对纤维素进行酸水解和酶解从而破壁底物,促进活性成分的释放,或对活性成分进行转化,降解大分子物质,从而提高生物活性[16]。嗜酸乳杆菌发酵可能通过上述两个渠道显著提高了松茸的酪氨酸酶抑制能力。
2.2 发酵条件优化
松茸发酵液的酪氨酸酶抑制率受松茸添加量、嗜酸乳杆菌菌液接种量和发酵时间的影响,如图2所示。
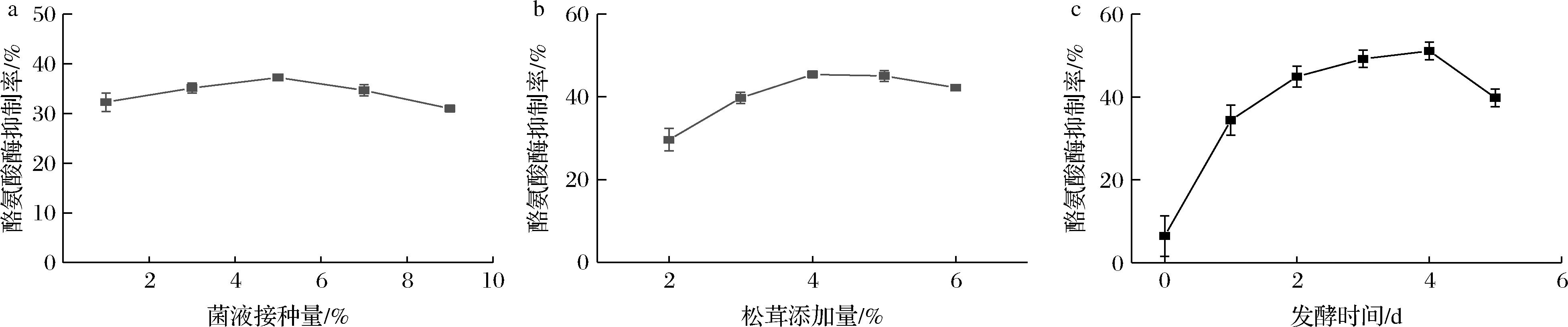
a-菌液接种量;b-松茸添加量;c-发酵时间
图2 不同发酵条件对FTM酪氨酸酶抑制率的影响
Fig.2 Effects of different fermentation conditions on FTM tyrosinase inhibition rate
由图2-a可知,随着菌液接种量的增加,发酵液的酪氨酸酶抑制率呈现先增加后减少的趋势,在菌液接种量为5%时样品的酪氨酸酶抑制率达到最大值。过低的菌液接种量可能导致菌种生长速度缓慢,而过高的接种量可能在发酵初期导致营养物质的快速消耗,不利于发酵的进行;由图2-b可知,随着松茸添加量的增加,发酵液的酪氨酸酶抑制率呈现先增加后减少的趋势,在松茸添加量为4%时样品的酪氨酸酶抑制率达到最大值。过低的松茸添加量可能导致营养物质不足,菌无法充分生长繁殖,过高的松茸添加量可能导致一些抑菌成分的积累从而抑制菌的生长;由图2-c可知,随着发酵时间的增加,发酵液的酪氨酸酶抑制率呈现先上升后下降的趋势,在发酵时间4 d时达到最大值。过长的发酵时间可能导致活性组分被消耗或氧化分解。因此,得到的最优发酵条件为菌液接种量5%,松茸添加量4%,发酵时间4 d。
2.3 发酵前样品总蛋白含量及多肽分子质量对比
通过测定总糖、总蛋白和乳酸含量变化,可以判断发酵过程中碳源、氮源的转移趋势以及松茸是否进一步降解释放出活性物质,测定结果如表1所示。样品发酵前后肽分子质量分布情况如表2所示。
表1 样品发酵前后成分变化
Table 1 Composition changes of samples before and after fermentation

名称发酵前含量/%发酵后含量/%总糖56.4±3.221.2±0.5总蛋白16.7±0.219.1±0.8乳酸< 1 49.4±6.5
表2 发酵前后样品肽分子质量分布
Table 2 Molecular weight distribution of peptides from samples before and after fermentation
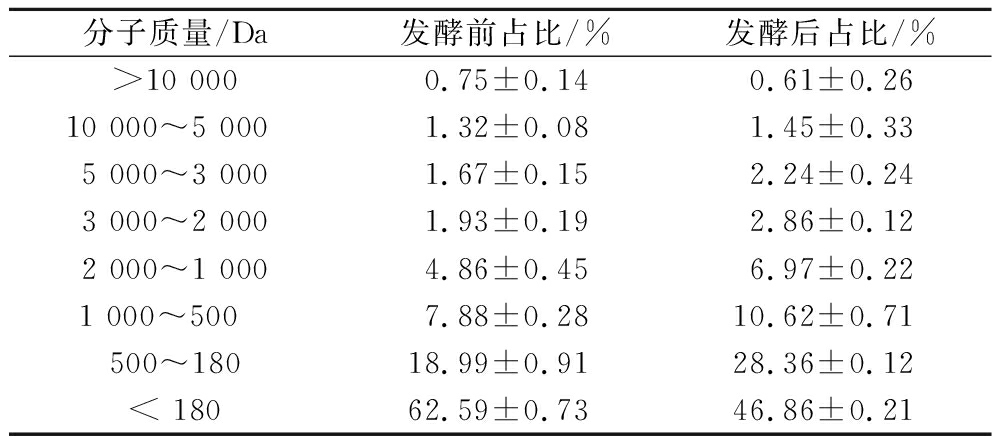
分子质量/Da发酵前占比/%发酵后占比/%>10 0000.75±0.140.61±0.2610 000~5 000 1.32±0.081.45±0.335 000~3 0001.67±0.152.24±0.243 000~2 0001.93±0.192.86±0.122 000~1 0004.86±0.456.97±0.221 000~500 7.88±0.2810.62±0.71500~18018.99±0.9128.36±0.12< 18062.59±0.7346.86±0.21
由表1可知,通过嗜酸乳杆菌发酵,样品的乳酸含量从小于1%(质量分数,下同)提升至(49.4±6.5)%,说明发酵过程中,嗜酸乳杆菌利用了松茸中的碳水化合物,转化为大量的乳酸。总蛋白含量从发酵前(16.7±0.2)%提升至(19.1±0.8)%,相比发酵前提升了14.4%。发酵过程中乳酸菌能够将底物中的碳源转化为乳酸,同时释放复合酶对发酵底物进行酶解,增加活性物的含量[17]。有研究表明,发酵可以促进蛋白分子质量的降低,改变蛋白质二级结构,释放活性多肽片段,提升游离氨基酸含量[18]。表2多肽分子质量分布表明,经过嗜酸乳杆菌发酵,松茸在分子质量180~1 000 Da的肽含量占比[(38.98±0.83)%]相比发酵前[(26.87±1.19)%]提升约45.1%,分子质量180~1 000 Da的肽含量从发酵前(4.47±0.2)%提升至发酵后(7.44±0.16)%,提升约65.9%。有学者的研究表明,一些小分子肽具有酪氨酸酶抑制的能力,例如一些带有疏水性氨基酸的三肽可以与酪氨酸酶结合,从而抑制酪氨酸酶的活性[19]。一些八肽和十肽同时具有抑制蘑菇酪氨酸酶和人酪氨酸酶的作用,并能够降低黑色素细胞产生的黑色素含量[20]。发酵促进了松茸多肽的释放,降解了大分子肽,释放出活性寡肽片段,提高了样品酪氨酸酶抑制能力。
2.4 发酵前后样品游离氨基酸含量对比
氨基酸是蛋白质的基本组成单位,是发酵样品的重要评价指标之一。样品发酵前后游离氨基酸含量变化结果如表3所示。
表3 发酵前后样品游离氨基酸含量对比
Table 3 Comparison of free amino acid content of samples before and after fermentation
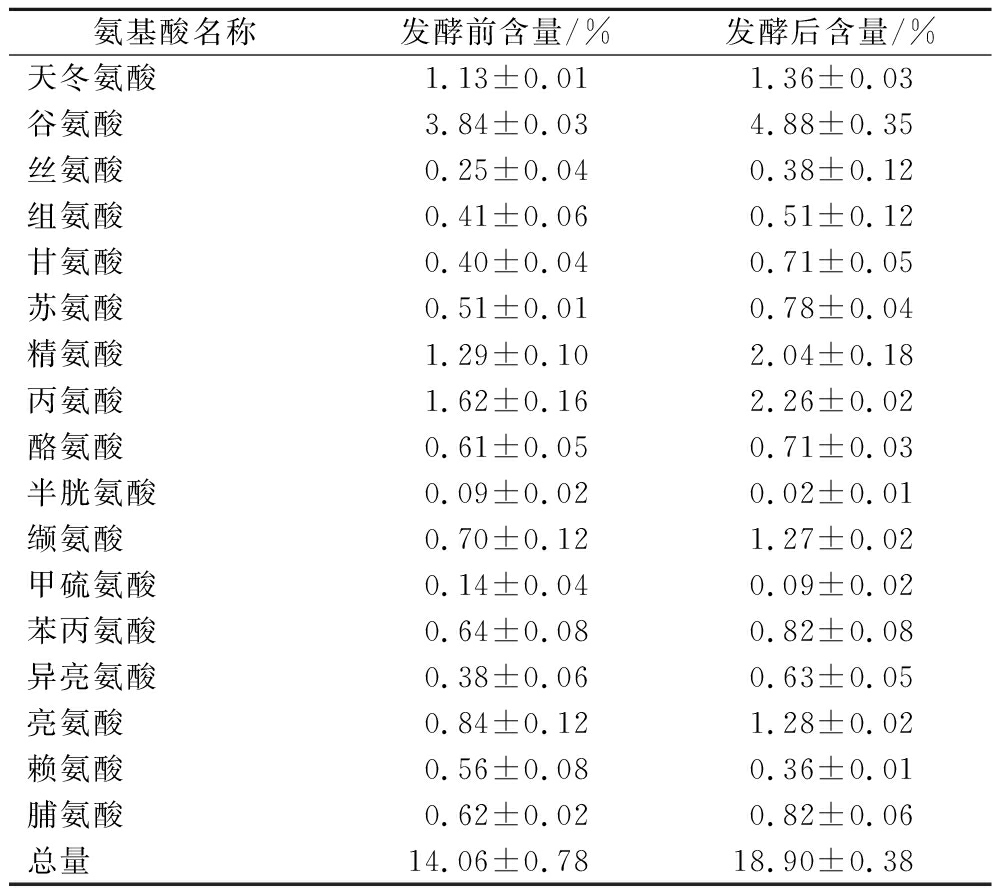
氨基酸名称发酵前含量/%发酵后含量/%天冬氨酸1.13±0.011.36±0.03谷氨酸3.84±0.034.88±0.35丝氨酸0.25±0.040.38±0.12组氨酸0.41±0.060.51±0.12甘氨酸0.40±0.040.71±0.05苏氨酸0.51±0.010.78±0.04精氨酸1.29±0.102.04±0.18丙氨酸1.62±0.162.26±0.02酪氨酸0.61±0.050.71±0.03半胱氨酸0.09±0.020.02±0.01缬氨酸0.70±0.121.27±0.02甲硫氨酸0.14±0.040.09±0.02苯丙氨酸0.64±0.080.82±0.08异亮氨酸0.38±0.060.63±0.05亮氨酸0.84±0.121.28±0.02赖氨酸0.56±0.080.36±0.01脯氨酸0.62±0.020.82±0.06总量14.06±0.7818.90±0.38
由表3可知,经过嗜酸乳杆菌发酵,松茸发酵样的游离氨基酸含量相比发酵前得到提升,从发酵前(14.06±0.78)%提升至发酵后(18.90±0.38)%,提升率为34.4%。除甲硫氨酸、赖氨酸、半胱氨酸外,其余氨基酸含量均有不同程度的提升。在发酵过程中,由于微生物的水解作用,大分子蛋白质降解为小分子蛋白,小分子蛋白进一步降解为游离氨基酸,从而提高发酵底物中游离氨基酸的含量[15]。有研究表明,异亮氨酸和谷氨酸等11种氨基酸能够降低酪氨酸酶活性,从而抑制马铃薯褐变,而赖氨酸则会加重马铃薯褐变[21]。通过嗜酸乳杆菌对松茸进行发酵,提高了发酵液中谷氨酸、亮氨酸等具有抑制酪氨酸酶活性的氨基酸含量,并降低了赖氨酸等具有促进酪氨酸酶活性的氨基酸含量,从而提高了样品的酪氨酸酶抑制能力。
2.5 松茸发酵液对酪氨酸酶抑制的可逆性分析
酶抑制机理可以分为可逆性抑制和不可逆性抑制。通过酶活力对反应初速率作拟合直线的交点判断抑制的可逆性。不同FTM浓度下酪氨酸酶活力和反应初速率的关系如图3所示。
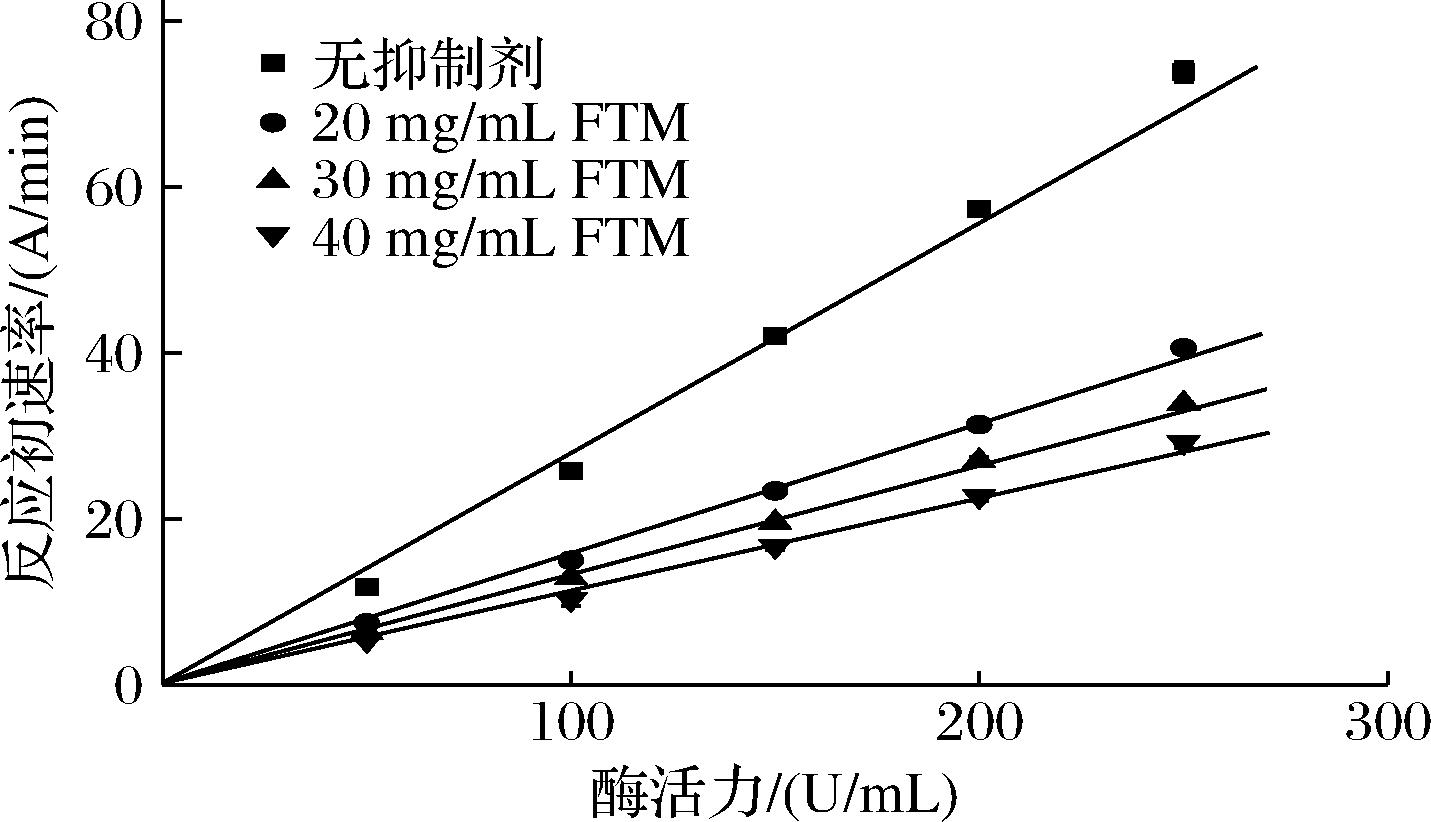
图3 FTM的酪氨酸酶抑制可逆性研究
Fig.3 Studies on the reversibility of tyrosinase inhibition in FTM
以酶活力为横坐标,反应初速率为纵坐标绘图时,改变抑制剂浓度,可逆抑制的斜率改变,直线交于原点;不可逆抑制的斜率不变,直线为不相交的平行线[14]。由图3可知,反应初速率随酶活力的增大而增大,随抑制剂浓度增大而减小,拟合直线的斜率不相等且交于原点,说明FTM以可逆的方式与酪氨酸酶结合。可逆性抑制是指抑制剂分子通过非共价键与酶结合,不与酶发生化学反应,可以通过透析等物理手段去除。一些天然活性物和发酵产物等都能通过可逆性抑制的方式抑制酪氨酸酶活性,例如马鞭草、茶树花、冬虫夏草等[22]。与不可逆抑制剂相比,可逆型抑制剂具有更低的脱靶毒性和致敏感性,且自身不失活,能够更长效的作用于催化体系中[23]。
2.6 松茸发酵液对酪氨酸酶的抑制类型分析
酶抑制类型可以分为竞争性、非竞争性、反竞争性和混合型。Lineweaver-Burk双倒数方程形如y=kx+b的形式,即测定不同底物浓度下的酶反应初速率,即可得到一条斜率为Km/Vm,截距为1/Vm的直线。根据测定结果拟合直线绘制FTM的Lineweaver-Burk双倒数曲线,结果如图4所示。
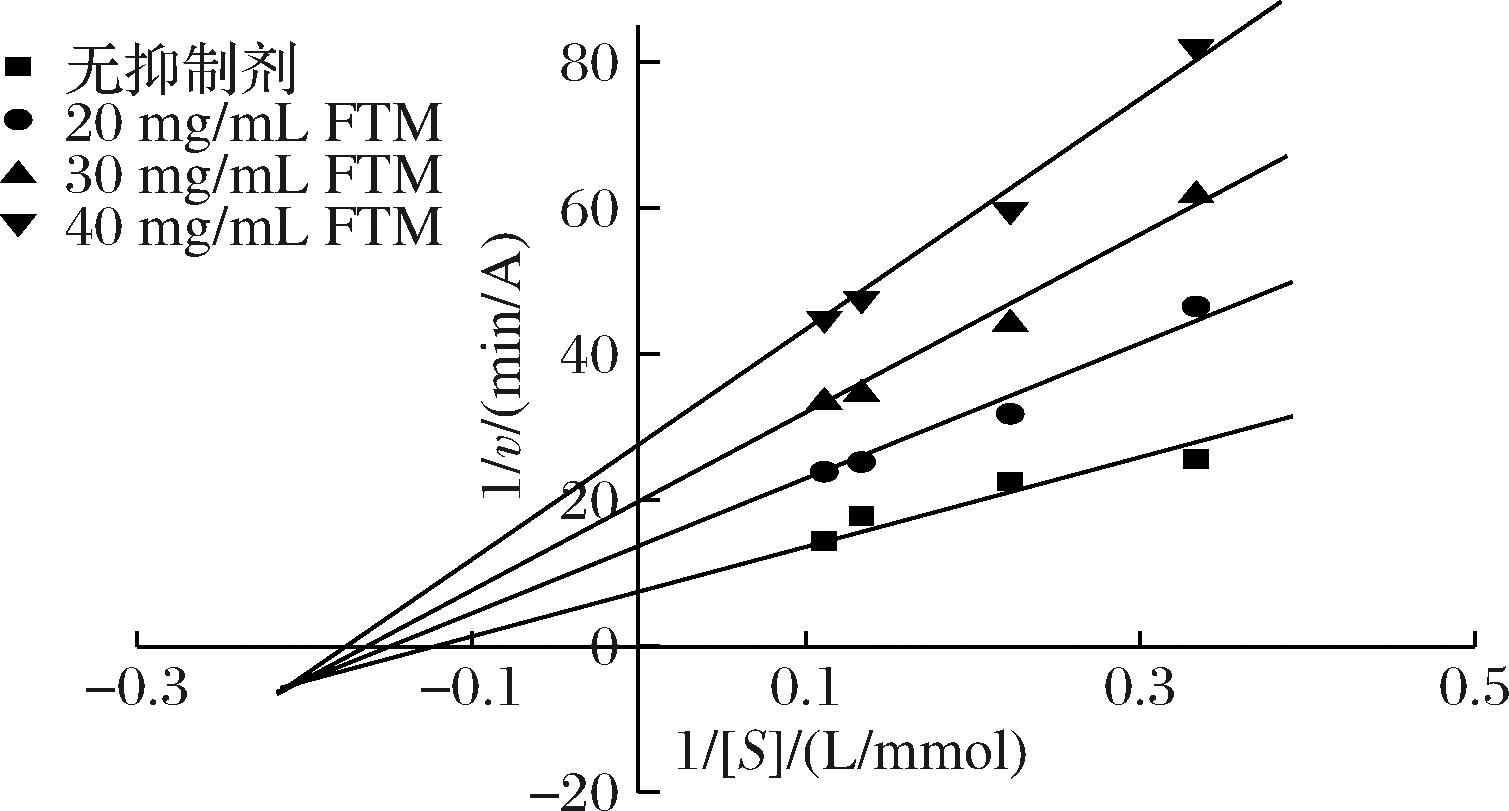
图4 FTM的Lineweaver-Burk双倒数曲线
Fig.4 Lineweaver-Burk double reciprocal curves of FTM
如图4所示,随着FTM浓度增大,直线斜率增大,截距增大,即米氏常数Km增大而Vm下降,双倒数曲线交于第三象限,FTM的抑制类型表现为混合型。在混合型抑制中,自由酶[E]可首先与底物[S]结合成[ES]再与抑制剂结合生成[ESI],也可以首先与抑制剂[I]结合成[EI]而阻止其与底物[S]结合[14]。即FTM既能够与多巴竞争活性位点,阻止多巴与酪氨酸酶结合,以竞争型抑制方式抑制酪氨酸酶活性,又能与多巴-酪氨酸酶的复合物结合,限制或阻止氧化反应的进一步发生。
2.7 松茸发酵液铜离子螯合能力测定
FTM的铜离子螯合率随浓度变化的关系如图5所示。

图5 发酵样的铜离子螯合率
Fig.5 Chelation rates of Cu ions in fermented samples
由图5可知,随着样品浓度的增大,体系中游离铜离子的浓度逐渐下降,铜离子螯合率逐渐上升,具有浓度依赖性,说明FTM具有螯合铜离子的能力。根据曲线在螯合率为50%时横坐标对应的浓度即为FTM的半螯合浓度,其半螯合质量浓度为(9.14±0.04) mg/mL。由于酪氨酸酶是以铜离子为活性中心的一种金属酶,当其催化酪氨酸或多巴的氧化时,底物需先与活性中心的铜离子结合,再发生亲电取代从而氧化底物[24]。当活性铜离子被占据时,催化反应便无法进行。FTM的铜离子螯合能力给予了其与底物竞争酪氨酸酶活性中心的能力,可以通过占据活性中心来抑制酪氨酸酶的活性。
2.8 松茸发酵液对酪氨酸酶荧光猝灭作用
FTM对酪氨酸酶内源性荧光强度的影响如图6所示。
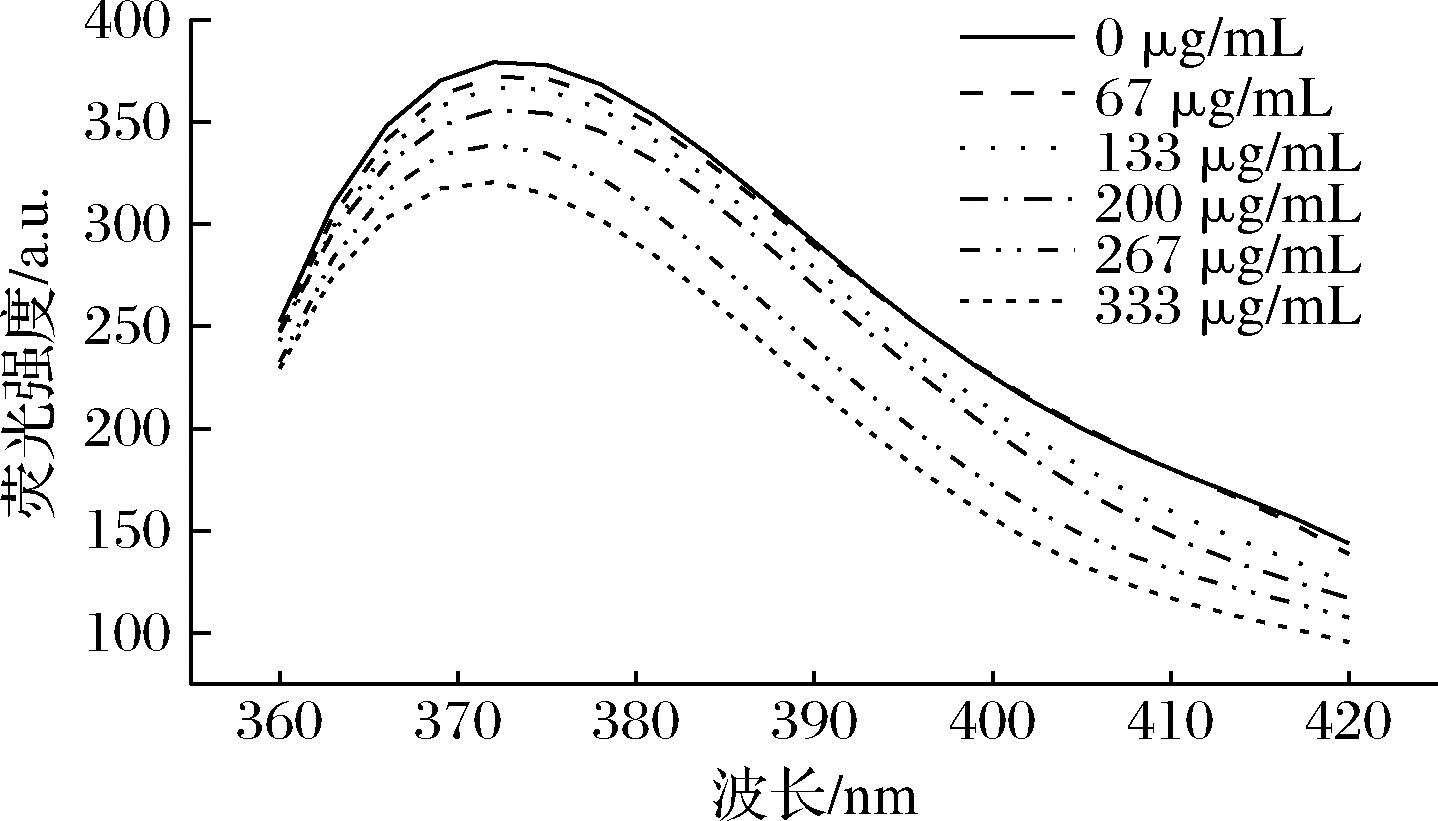
图6 发酵样对酪氨酸酶内源性荧光的猝灭作用
Fig.6 Quenching of the endogenous fluorescence of tyrosinase in fermented samples
由图6可知,酪氨酸酶在375 nm下有最大吸收峰。随着FTM浓度增加,酪氨酸酶内源性荧光强度降低。酪氨酸酶的内源性荧光是由酪氨酸酶中的色氨酸等发色基团残基产生的,当酪氨酸酶的疏水性或构像发生改变时,会引起荧光强度的下降或最大吸收峰的红移或蓝移[25],荧光强度的降低说明FTM与酪氨酸酶发生了相互作用。在FTM加入后,酪氨酸酶最大吸收峰出现蓝移(372 nm),说明FTM的加入改变了酪氨酸酶发色基团的疏水性,使其疏水性增加,极性减弱。荧光猝灭实验表明FTM能够和酪氨酸酶相互作用,在一定程度上改变酪氨酸酶的结构和微环境,从而使酪氨酸酶的活性下降。
3 结论
本研究采用嗜酸乳杆菌对松茸进行发酵处理,显著提高了其对酪氨酸酶的抑制能力。在菌液接种量5%,松茸添加量4%,发酵时间4 d的发酵条件下,FTM具有最高的酪氨酸酶抑制率,在质量浓度为10 mg/mL时其酪氨酸酶抑制率达到(76.4±0.6)%,是发酵前的3.76倍。在发酵过程中,嗜酸乳杆菌主要利用松茸多糖作为其生长繁殖的碳源,伴随着乳酸的生成积累。同时,菌株对松茸的降解也促进了具有生物活性的松茸多肽和游离氨基酸的释放,从而提高了其抑制酪氨酸酶的能力。进一步的研究显示,FTM以混合型可逆抑制的方式抑制酪氨酸酶活性,且能以铜离子螯合的形式与酪氨酸酶结合,其半螯合质量浓度为(9.14±0.04) mg/mL。此外,FTM还能够猝灭酪氨酸酶内源性荧光,使酪氨酸酶最大吸收峰蓝移。综上所述,FTM比未发酵松茸具有更强的酪氨酸酶抑制能力,并通过混合型抑制机制与酪氨酸酶相互作用,这些结果为开发新型美白化妆品原料提供了一定的理论基础。
[1] DECKER H, SCHWEIKARDT T, NILLIUS D, et al.Similar enzyme activation and catalysis in hemocyanins and tyrosinases[J].Gene, 2007, 398(1-2):183-191.
[2] NAGATSU T, NAKASHIMA A, WATANABE H, et al.Neuromelanin in Parkinson’s disease:Tyrosine hydroxylase and tyrosinase[J].International Journal of Molecular Sciences, 2022, 23(8):4176.
[3] ZHAO Y S, EWEYS A S, ZHANG J Y, et al.Fermentation affects the antioxidant activity of plant-based food material through the release and production of bioactive components[J].Antioxidants, 2021, 10(12):2004.
[4] MENG F B, LEI Y T, LI Q Z, et al.Effect of Lactobacillus plantarum and Lactobacillus acidophilus fermentation on antioxidant activity and metabolomic profiles of loquat juice[J].LWT, 2022, 171:114104.
[5] BULL M, PLUMMER S, MARCHESI J, et al.The life history of Lactobacillus acidophilus as a probiotic:A tale of revisionary taxonomy, misidentification and commercial success[J].FEMS Microbiology Letters, 2013, 349(2):77-87.
[6] 张嘉妮, 张晓轩, 王大毛, 等.乳酸菌发酵改善脱脂富硒米糠的抗氧化活性[J].食品科学, 2023, 44(24):146-154.ZHANG J N, ZHANG X X, WANG D M, et al.Improvement of antioxidant activity of defatted selenium-enriched rice bran by lactic acid bacteria fermentation[J].Food Science, 2023, 44(24):146-154.
[7] LI X Y, GAO J, SIMAL-GANDARA J, et al.Effect of fermentation by Lactobacillus acidophilus CH-2 on the enzymatic browning of pear juice[J].LWT, 2021, 147:111489.
[8] YANG S, REN X D, SHENG J X, et al.Preparation and the antitumor activity in vitro of polysaccharides from Tricholoma matsutake[J].World Journal of Microbiology and Biotechnology, 2010, 26(3):497-503.
[9] LI M Q, DONG L, DU H T, et al.Potential mechanisms underlying the protective effects of Tricholoma matsutake singer peptides against LPS-induced inflammation in RAW264.7 macrophages[J].Food Chemistry, 2021, 353:129452.[10] YANG H R, CHEN L H, ZENG Y J.Structure, antioxidant activity and in vitro hypoglycemic activity of a polysaccharide purified from Tricholoma matsutake[J].Foods, 2021, 10(9):2184.
[11] HOSHI H, IIJIMA H, ISHIHARA Y, et al.Absorption and tissue distribution of an immunomodulatory α-D-glucan after oral administration of Tricholoma matsutake[J].Journal of Agricultural and Food Chemistry, 2008, 56(17):7715-7720.
[12] KUBGLOMSONG S, THEERAKULKAIT C, REED R L, et al.Isolation and identification of tyrosinase-inhibitory and copper-chelating peptides from hydrolyzed rice-bran-derived albumin[J].Journal of Agricultural and Food Chemistry, 2018, 66(31):8346-8354.
[13] YANG H B, WANG Z, SONG W, et al.Isolation of proanthocyanidins from Pinus thunbergii needles and tyrosinase inhibition activity[J].Process Biochemistry, 2021, 100:245-251.
[14] 吴悦. 酵母来源酪氨酸酶抑制多肽的制备及其活性研究[D].无锡:江南大学, 2014.WU Y.Preparation and activity of tyrosinase-inhibitory peptide from yeast[D].Wuxi:Jiangnan University, 2014.
[15] 穆燕. 千日红酪氨酸酶抑制剂的分离纯化及其抑制机理研究[D].广州:华南理工大学, 2012.MU Y.Study of tyrosinase inhibitors from the gomphrena globosa and the inhibitory mechanisms[D].Guangzhou:South China University of Technology, 2012.
[16] 屈青松, 周晴, 石艳双, 等.乳酸菌发酵中药功能及其增效机制的研究进展[J].环球中医药, 2022, 15(9):1707-1715.QU Q S, ZHOU Q, SHI Y S, et al.Research progress on the function of TCM fermented by Lactobacillus and its synergistic mechanism[J].Global Traditional Chinese Medicine, 2022, 15(9):1707-1715.
[17] DAVOODI S, BEHBAHANI M, SHIRANI E, et al.Influence of sucrose, glucose, Stevia leaf and stevioside on the growth and lactic acid production by Lactobacillus plantarum, Lactobacillus brevis and Lactobacillus casei[J].Iranian Journal of Science and Technology, Transactions A:Science, 2016, 40(4):275-279.
[18] 王晓雯, 王灵娟, 王哲, 等.发酵对蛋白质组成、结构与功能特性及风味影响的研究进展[J].食品与发酵工业,2024,50(9):314-320.WANG X W, WANG L J, WANG Z et al.Research progress on the effects of fermentation on protein composition, structure, function and flavor[J].Food and Fermentation Industry,2024,50(9):314-320.
[19] XUE W J, LIU X, ZHAO W Z, et al.Identification and molecular mechanism of novel tyrosinase inhibitory peptides from collagen[J].Journal of Food Science, 2022, 87(6):2744-2756.
[20] ABU UBEID A, ZHAO L M, WANG Y, et al.Short-sequence oligopeptides with inhibitory activity against mushroom and human tyrosinase[J].The Journal of Investigative Dermatology, 2009, 129(9):2242-2249.
[21] MENG Z, DONG T T, MALIK A U, et al.Harvest maturity affects the browning of fresh-cut potatoes by influencing contents of amino acids[J].Postharvest Biology and Technology, 2021, 173:111404.
[22] 何毅帆, 龙芸鸾, 李征, 等.天然植物美白成分作用机理的研究进展[J].日用化学品科学, 2022, 45(10):37-43.HE Y F, LONG Y L, LI Z, et al.Research progress on the mechanism of natural plant skin-whitening ingredients[J].Detergent &Cosmetics, 2022, 45(10):37-43.
[23] FARIDOON, NG R, ZHANG G P, et al.An update on the discovery and development of reversible covalent inhibitors[J].Medicinal Chemistry Research:An International Journal for Rapid Communications on Design and Mechanisms of Action of Biologically Active Agents, 2023, 32(6):1039-1062.
[24] 孙笑, 乔青安, 刘昌春,等.酪氨酸酶催化反应机理的研究进展[J].鲁东大学学报(自然科学版), 2016, 32(4):345-350.SUN X, QIAO Q A, LIU C C, et al.Advances in the catalytic mechanism of tyrosinase[J].Journal of Ludong University (Natural Science Edition), 2016, 32(4):345-350.
[25] 张龙. 间苯二酚类黄酮衍生物对酪氨酸酶抑制机理研究[D].无锡:江南大学, 2017.ZHANG L.Study on the inhibitory mechanism of resorcinol flavonoid derivatives on tyrosinase[D].Wuxi:Jiangnan University, 2017.