泸型酒是浓香型白酒的仪称,是中国固态酿造白酒的基本香型之一,以高粱作为主要原料,中高温大曲为糖化发酵剂,糟醅经泥窖固态发酵、固态蒸馏获得基酒,再经陈酿、勾调而成[1]。浓香型白酒酿造环境中的微生物群落复杂多样,微生物自身代谢及种间相互作用产生了多种功能酶及风味物质,赋予了浓香型白酒独特风味及和谐口感[2-3]。研究认为浓香型白酒的糟醅是发酵的主体,糟醅在发酵过程中独特的微生物组成及其产生的挥发性代谢物是形成浓香型白酒“窖香浓郁”的关键[2,4]。宋建阳等[5]研究发现,Thermomyces、Naumovozyma、Saccharomyces、Lactobacillus、Acetobacte、Clostridium、Candida和Aspergillus等8个属的微生物与浓香型白酒中的风味物质累积有关;焦文婧等[6]研究发现,浓香型白酒糟醅中布氏乳杆菌与决定浓香型白酒香型的主要物质己酸乙酯含量存在显著的正相关性。表明浓香型白酒独特风味是来源于微生物发酵所产生的代谢物,这些代谢物的含量与种类组成关系决定浓香型白酒的质量。
糟醅中微生物群落、酶和代谢物随着发酵时间的延长呈现显著的差异[7]。胡晓龙等[8]研究发现,在发酵前期(0~7 d)、中期(7~15 d)和后期(15~60 d),它们之间的微生物存在显著的差异,Acetobacter和Bacillus等绝大多数优势属含量在发酵7 d后明显下降为非优势菌,而Lactobacillus明显上升并成为发酵15~60 d糟醅的绝对优势菌。余松柏等[9]在研究浓香型白酒糟醅发酵过程中30种有机酸空间与时间的分布规律时发现,浓香型白酒糟醅长发酵期有机酸总量高于短发酵期,其中己酸的增加比例最高。表明糟醅的发酵过程中,微生物群落和代谢物组成存在时间上的差异。因此,发掘糟醅发酵过程中主要的微生物,注释其中优势风味代谢物,对于阐明泸型酒“窖香浓郁”的内在机制尤为重要。微生物群落的多样性,决定了糟醅发酵过程中丰富的代谢物变化,也是其时间差异的重要内涵[7]。但是,微生物群落-代谢物的时间变化与泸型酒“窖香浓郁”之间的关系至今仍未阐明。因此,本研究在糟醅发酵的0、7、14、21、28、42、56、90 d分别随机采集3个样本,进行理化性质、挥发性代谢物和微生物组学的测定;利用Pearson’s关联性分析,揭示微生物-挥发性代谢物的时间特征,阐明泸型酒“窖香浓郁”的内在机制。
1 材料与方法
1.1 糟醅的采集
本研究所使用的糟醅样品来自四川泸州市某公司发酵窖池,分别在发酵的0(D0)、7(D7)、14(D14)、21(D21)、28(D28)、42(D42)、56(D56)、90 d(D90)随机取3个平行样本进行理化性质、挥发性代谢物和微生物组学的测定。所有样本均采自发酵窖池中层,样本采集后保存于-80 ℃冰箱。
1.2 理化指标测定
参照《泸型酒技艺大全》[10]中提供的方法,对不同发酵时期泸型酒糟醅样品的理化指标进行测定,其中,水分的测定采用热干燥法,取10 g糟醅在105 ℃烘箱中干燥至质量恒定。还原糖采用斐林试剂滴定法,称取20.0 g试样,于250 mL烧杯中,加水196 mL搅拌30 s,隔5 min再搅拌30 s,共搅拌两次,浸泡30 min,加0.2 mol/L NaOH 溶液4 mL,过滤,滤液使用斐林试剂直接滴定。淀粉含量采用酸水解法,称取10.0 g糟醅于250 mL三角瓶中,加25% 100 mL HCl溶液,热水解30 min,脱脂棉过滤,并定容至500 mL;之后,用吸管吸取25 mL滤液于100 mL的容量瓶中,用200 g/L NaOH溶液中和至微酸性后加水定容至刻度,备用;之后,使用斐林试剂滴定法测量其中还原糖的含量,间接计算出淀粉的含量。酸度的测定采用NaOH滴定法,称取20.0 g试样于250 mL烧杯中,加水200 mL,用玻棒搅30 s,5 min后再搅拌1次,浸泡30 min用脱脂棉过滤,弃去初滤液15 mL,然后接取滤液备用。吸取20 mL滤液于150 mL三角瓶中,加10 mL去CO2的蒸馏水,以酚酞为指示剂,用0.1 mol/L NaOH标准溶液滴定。
1.3 挥发性代谢物分析
挥发性代谢物的提取和测定使用顶空固相微萃取(head space solid-phase micro extraction,HS-SPME)结合气相色谱质谱联用仪(GCMS-QP2020,岛津,日本)进行测定。色谱柱为 DB-WAX (60.0 m×0.25 mm×0.25 μm,J&W,美国)。GC-MS 相关的实验条件如下:GC条件:进样口温度为250 ℃,载气为高纯 He(>99.999%),总流量为50 mL/min,柱流量为1 mL/min,隔垫吹扫流量3 mL/min,进样模式为不分流进样(分流比为-1)。升温程序为40 ℃保持2 min,4 ℃/min升至150 ℃,保持2 min,6 ℃/min升至230 ℃,保持5 min。MS条件:电子轰击(EI)离子源,电子能量70 eV,离子源温度230 ℃,接口温度为250 ℃,检测器电压为相对调谐结果0 kV,扫描速度为1 666,采集方式为SCAN,质量扫描范围m/z 35~500 AMU(atomic mass units)。NIST 20 library用于挥发性代谢物的分析鉴定。向顶空瓶中加入10 μL 0.822 6 mg/mL的2-辛醇作为内标,使用内标物2-辛醇的含量、峰面积,计算其他挥发性代谢物的含量。
1.4 微生物组学分析
微生物总DNA提取按照Fast DNA® Spin Kit for Soil(MP Biomedicals, USA)试剂盒说明书的要求进行。分别使用引物338F-806R和ITS1F-ITS2R对细菌和真菌的PCR扩增,PCR扩增按照Trans Start Fast pfu DNA Polymerase (AP221-02, China)说明书的要求进行。细菌和真菌宏基因组学测序在NovaSeq PE250(Illumina, San Diego, CA, USA)平台上进行,测序服务由上海美吉生物提供。
1.5 数据分析
所有实验均重复3次,基础数据使用SPSS软件包(17.0版)进行单因素方差分析(ANOVA),以平均值±标准差的形式表示。采用EXCLE对挥发性代谢物进行统计分析,热图和主坐标分析(principal coordinates analysis,PCoA)采用Omicshare工具(https://www.omicshare.com/tools/)[11]完成,使用SIMCA 4.1进行正交偏最小二乘法(orthogonal partial least squares discrimination analysis,OPLS-DA)分析和VIP分类注释。宏基因组测序数据采用QIIME2[12]和R packages进行分析,α和β多样性分析与群落组成分析由美吉生物在线平台提供(https://www.majorbio.com)。Pearson’s 关联性分析采用SPSS软件包(17.0版)并在Omicshare中显示。主要的微生物的功能注释采用PICRUSt2软件包[13]。
2 结果与分析
2.1 不同发酵阶段糟醅理化性质的变化
糟醅入窖发酵过程是一个在微生物作用下的生化反应过程。在整个过程中,将糟醅中的淀粉转化成葡萄糖、麦芽糖等还原性糖,酵母菌为主体的微生物利用还原性糖作为碳源发酵成酒精。本研究结果发现,在发酵的0~42 d,糟醅中的淀粉含量逐渐降低,42~90 d,糟醅中的淀粉含量趋于平衡(图1-a);同时0~14 d,糟醅中的微生物消耗淀粉,迅速生成大量的还原糖,随后随着发酵的进行,14~42 d糟醅中还原糖快速减少,至42~90 d还原糖的含量趋于稳定(图1-b);随着糟醅的发酵,产酸微生物利用还原糖产酸,糟醅中酸度的变化分为3个阶段,0 d,7~28 d,42~90 d,这3个阶段糟醅中酸度发生了显著的变化(图1-c)。在发酵过程中,糟醅中的水分逐渐增加,但总体维持在一个较为稳定的范围内,有利于发酵的正常进行(图1-d)。
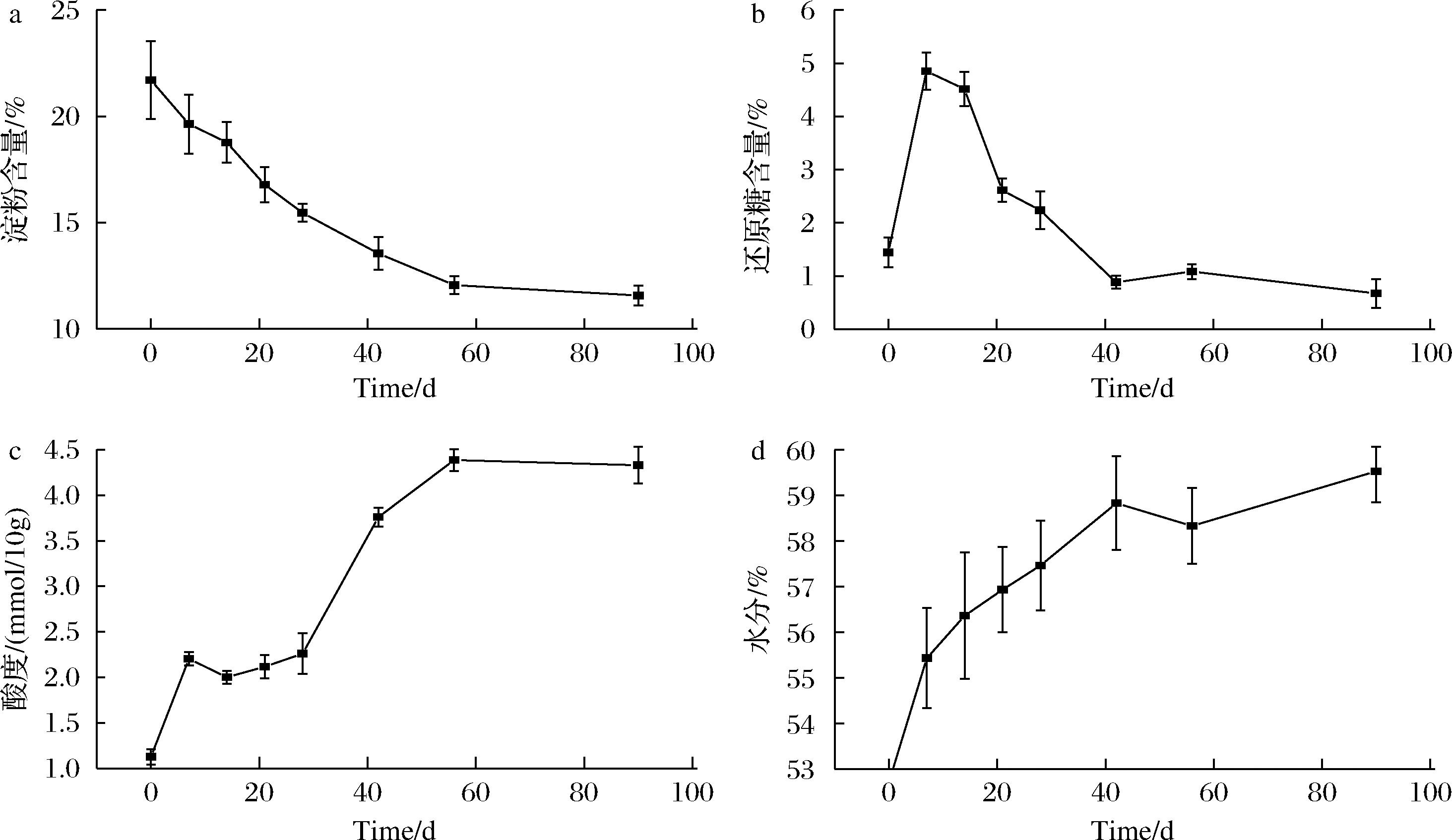
a-淀粉含量;b-还原糖含量;c-酸度;d-水分
图1 不同发酵阶段糟醅理化性质的变化
Fig.1 Changes in physicochemical properties of grains at different stages of fermentation
2.2 不同发酵阶段微生物的组成
PCoA揭示不同发酵时期的糟醅中微生物群落的变化。细菌的PCoA表明,发酵0~7、14 d和21~90 d微生物群落存在显著的差异(图2-a);群落组成分析结构表明,发酵0~7 d的优势菌群主要是Limosilactobacillus、Weissella、Bacillus和Pediococcus等,而21~90 d的优势菌群主要是Lactobacillus(图2-b)。真菌的PCoA表明,发酵0、7 d和14~90 d微生物群落存在显著的差异(图2-c);群落组成分析结构表明,发酵0 d的优势菌群主要是Aspergillus、Thermoascus、Thermomyces和Issatchenkia等,发酵7 d的优势菌群主要是Kazachstania、Aspergillus、Thermoascus、Thermomyces和Issatchenkia等,14~56 d的优势菌群主要是Kazachstania,90 d时的优势菌群主要是Kazachstania、Aspergillus和Thermoascus(图2-d)。

a-细菌的主坐标分析;b-细菌的组成分布;c-真菌的主坐标分析;d-真菌的组成分布
图2 不同发酵阶段微生物的组成
Fig.2 Composition of microorganisms at different fermentation stages
2.3 HS-SPME-GC-MS分析
2.3.1 代谢物分类分析
使用HS-SPME-GC-MS对不同发酵时期的糟醅中代谢物质进行检测,在8组样本中一共检测出163种代谢物质,其中酯类67种、醇类24种、有机酸15种、烷烃14种、酮类8种、醛类8种、酚类8种;在所有的发酵样本中,有39种代谢物约占总含量的90%,主要包括酯类、有机酸类、醇类和酚类,其含量与发酵时间存在密切关系,发酵时间越长,成分含量越大(图3-a)。

a-代谢物热图;b-代谢物的含量分布;c-代谢物的PCoA
图3 不同发酵阶段代谢物的分类和组成
Fig.3 Classification and composition of metabolites at different fermentation stages
不同发酵时期的糟醅中,总共检测出67种酯类物质,酯类物质含量从发酵前(D0)的13.80 μg/g增长到83.73 μg/g(D90),在整个发酵周期内呈逐步增长的趋势,分为缓慢增长期(0~14 d)、快速增长期(14~56 d)、稳定期(56~90 d)3个阶段,己酸乙酯从3.98 μg/g缓慢增长5.88 μg/g,然后快速增长26.91 μg/g,并稳定在27.80 μg/g左右;乙酸乙酯从0.009 5 μg/g缓慢增长0.51 μg/g,然后快速增长9.24 μg/g;乳酸乙酯在缓慢增长期稳定维持在1.52 μg/g左右,然后快速增长4.24 μg/g,并稳定在5.51 μg/g左右。醇类在发酵的过程中表现出先上升后下降的趋势,分为快速增长期(0~42 d)、稳定期(42~56 d)、下降期(56~90 d)3个阶段,乙醇从0.12 μg/g快速增长31.52 μg/g,稳定一段时间后,降到21.65 μg/g;1-己醇从0.096 μg/g快速增长3.22 μg/g;苯乙醇仅从1.32 μg/g增长到2.42 μg/g,并21~90 d其含量较为稳定。在糟醅发酵的过程中,有机酸的变化较小,仅仅从最初的18.58 μg/g(D0)增加到30.39 μg/g(D90)。其中己酸从10.67 μg/g增长到18.26 μg/g,乙酸从1.49 μg/g增长到4.02 μg/g,辛酸从2.06 μg/g增长到2.40 μg/g(图3-a、图3-b)。这些物质可能是决定泸型酒是否呈现“窖香浓郁”风味的关键物质。
PCoA对不同发酵时期糟醅中代谢物的差异性进行分析,代谢物的变化主要集中在第一主成分轴(PCO1)和第二主成分轴(PCO2),分别为74.78%和9.15%,占总变化量的83.93%。在发酵过程中,D0和D7的相似性较高,随着发酵时间的延长,D21和D28样本与0~7 d开始出现较大程度的差异,之后D42、D56、D90的样本与之前的样本差异性也十分显著(图3-c)。表明在发酵前、中、后期其代谢物质含量存在明显的差异。
2.3.2 OPLS-DA
对发酵过程中代谢物采用SIMCA 4.1进行OPLS-DA,在发酵的0~28 d糟醅中代谢物差异不显著,在发酵的42~90 d糟醅中的代谢物差异显著,并与0~28 d糟醅之间存在明显的差异(图4-a)。根据OPLS-DA的结果,对代谢成分进行VIP分类注释(VIP scores>1.0),2-甲氧基-5-甲基苯酚、癸酸乙酯、乙酸、庚酸、己酸己酯、甲氧基乙酸己酯、辛酸、己酸丁酯、1-己醇、2-羟基己酸乙酯是其主要的差异性代谢物(图4-b)。
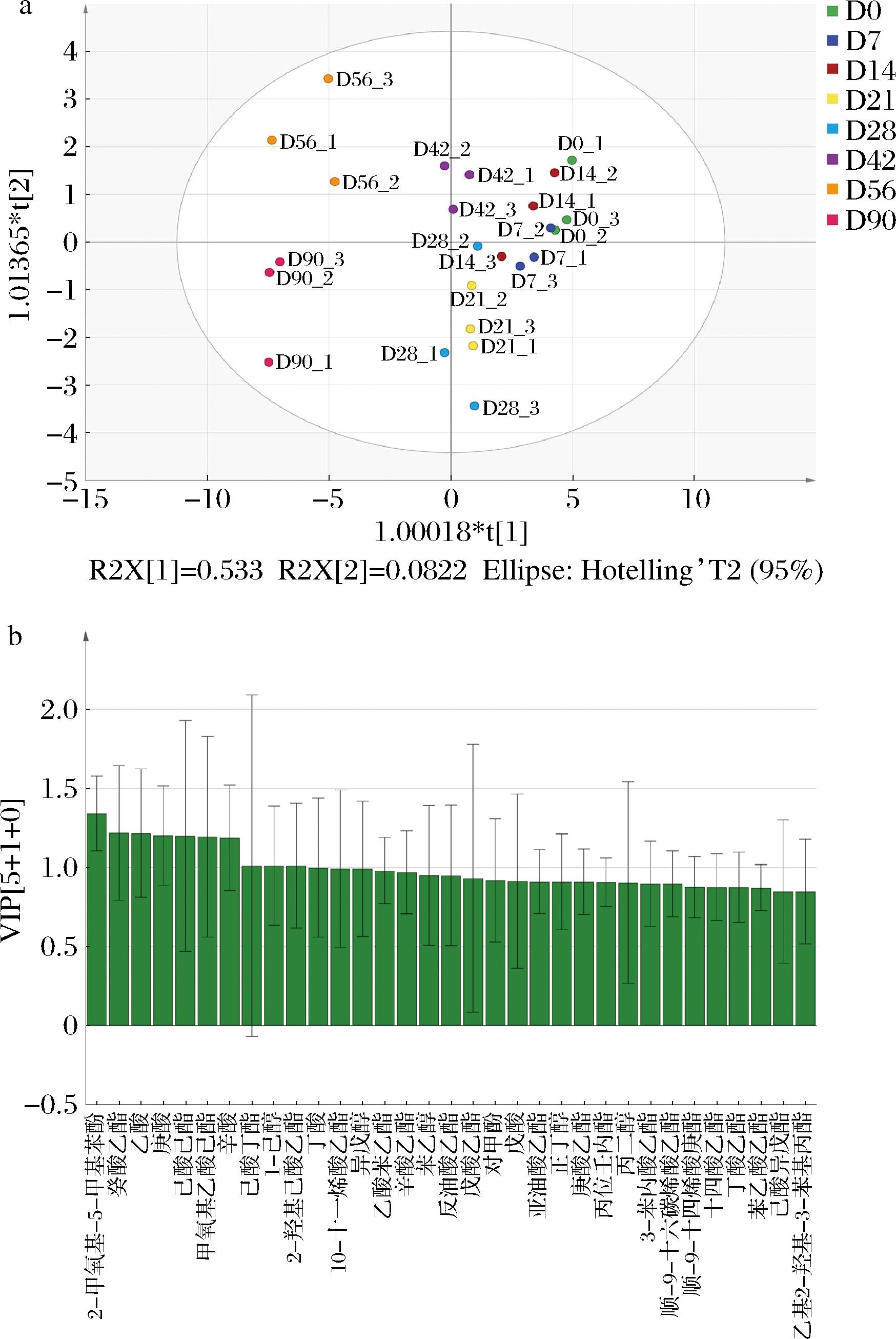
a-OPLS-DA;b-VIP分类注释图
图4 OPLS-DA结果
Fig.4 Results of OPLS-DA
2.4 关联分析
曼特尔检验(Mantel Test)是确定两组距离测度矩阵(而非两组变量矩阵)之间相关性的测试方法,用于判断一个矩阵中的样本距离与另一矩阵中的样本距离是否相关[14]。细菌与糟醅中淀粉、还原糖、水分和酸度具有显著的相关性;而真菌与糟醅中淀粉、还原糖、水分和酸度也有显著的相关性(图5-a)。糟醅中淀粉(Pearson=-0.839)和还原糖(Pearson=-0.461)与Lactobacillus呈显著的负相关,淀粉与Limosilactobacillus(Pearson=0.838)、Weissella(Pearson=0.845)、Pediococcus(Pearson=0.838)、Bacillus(Pearson=0.617)、Kosakonia(Pearson=0.641)、Aspergillus(Pearson=0.569)呈明显的正相关,还原糖与Acetobacter(Pearson=0.733)和Bacillus(Pearson=0.518)呈明显的正相关。糟醅的酸度与Limosilactobacillus(Pearson=-0.599)、Weissella(Pearson=-0.602)和Pediococcus(Pearson=-0.588)呈显著的负相关;与Lactobacillus(Pearson=0.595)、Candida(Pearson=0.540)和Thermoascus(Pearson=0.448)的含量呈明显的正相关(图5-b)。

a-微生物与理化指标相关性分析;b-微生物种类与理化指标相关性分析;c-细菌与代谢物相关性分析;d-真菌与代谢物相关性分析
图5 相关性分析结果
Fig.5 Correlation analysis results
注:图c和图d中正值代表正相关,负值代表负相关。
此后在对主要的细菌、真菌、代谢物的相关性进行分析。在细菌-代谢物的相关性分析中,总共发现161对细菌-代谢物之间明显相关(|Pearson|≥0.4),其中正相关24对,皆为Lactobacillus对代谢物产生的正相关作用,剩余的细菌与代谢物之间皆为负相关作用(图5-c)。在真菌-代谢物的相关性分析中,总共发现90对真菌-代谢物之间明显相关(|Pearson|≥0.4),其中正相关40对,Candida、Thermoascus和Issatchenkia是优势菌群,负相关50对,Thermomyces、Trichosporon和Aspergillus是优势菌群(图5-d)。代谢物-微生物相关性分析共发现251对代谢物-微生物之间明显相关(|Pearson|≥0.4),其中关联微生物10对及以上的代谢物有乙酸、2-苯乙基酯、辛酸乙酯、二氢-5-戊基-2(3H)-呋喃酮、庚酸乙酯、十四酸乙酯、戊酸乙酯、苯乙酸乙酯、己酸乙酯、10-十一烯酸乙酯、十六烷酸乙酯、9-十六碳烯酸乙酯、亚油酸乙酯、3-甲基-1-丁醇等。
2.5 微生物酶的预测与代谢
使用PICRUSt2软件包注释发酵过程中主要的微生物,获得微生物酶的表达信息(图6-a、图6-b)。通过揭示糟醅发酵过程中微生物组学与挥发性代谢物之间内在联系,建立了主要微生物与代谢物关联代谢图谱(图6-c)。在发酵过程中,细菌主要分泌了乙酰辅酶A羧化酶、乙醇脱氢酶、丙酮酸脱氢酶、DNA拓扑异构酶等,这些酶分泌主要分为0~14 d和14~90 d两个阶段,且这些酶在14~21 d迅速升高,之后维持稳定的分泌(图6-a)。真菌主要分泌了L-阿拉伯糖异构酶、淀粉葡萄糖苷酶、乙醇脱氢酶、葡聚糖1,3-β-葡萄糖苷酶、纤维二糖酶等,这些酶的分泌存在0~14 d、14~56 d和90 d 3个阶段,呈现先降低后升高的情况(图6-b)。在糟醅发酵过程中,根据微生物分泌的酶量,发酵主要分为0~14 d、14~56 d和90 d 3个阶段。在发酵0~14 d,酵母菌(Thermoascus、Thermomyces、Issatchenkia)、曲霉菌(Aspergillus)和芽孢杆菌(Bacillus)等分泌淀粉葡萄糖苷酶、葡聚糖1,3-β-葡萄糖苷酶、纤维二糖酶、L-阿拉伯糖异构酶水解淀粉生成葡萄糖。14 d以后,葡萄糖可以通过微生物的磷酸戊糖途径生成丙酮酸,丙酮酸是生产乙醇和乳酸的重要前体,同时也可以通过三羧酸循环生成挥发性醇和有机酸;同时,Limosilactobacillus、Weissella和Pediococcus等产酸菌开始利用葡萄糖生成挥发性脂肪酸,这些挥发性醇和脂肪酸是酯类物质合成的重要前体。挥发性醇和挥发性脂肪酸在Aspergillus、Kazachstania、Candida的参与下生成己酸乙酯等酯类物质,这些酯类物质是泸型酒质量形成的关键(图6-c)。在发酵的90 d,真菌分泌的淀粉葡萄糖苷酶、L-阿拉伯糖异构酶、纤维二糖酶等再次增加,可能与酒糟二次糖化有关。

a-细菌酶的预测热图;b-真菌酶的预测热图;c-微生物与代谢物关联代谢图谱
图6 微生物酶的预测与代谢分析
Fig.6 Prediction and metabolic analysis of microbial enzymes
3 讨论
泸型酒的发酵是以高粱等粮食为原料,以大曲为糖化发酵剂的固态发酵过程;随着发酵的进程,糟醅中的微生物群不断的演替,形成独特的风味型代谢物,是“窖香浓郁”的内在机制[15]。为此,本研究系统地探讨了微生物群落-代谢物随时间的变化规律,明晰了形成泸型酒“窖香浓郁”风味的关键菌群和代谢物。
微生物的发酵过程具有明显的时间特征,即随着发酵的进行糟醅中微生物的群落结构发生了显著的变化[6,8]。糟醅中的细菌群落结构存在0~7 d和21~90 d两个明显的时期(图2-a、图2-b),在0~7 d,糟醅中Limosilactobacillus、Weissella、Pediococcus等产酸菌占据绝对优势[16-18],Bacillus开始分解淀粉产生葡萄糖[19];21~90 d糟醅中的细菌几乎被Lactobacillus占据,Lactobacillus产生的酸能够保持糟醅低pH环境,抑制杂菌生长和驯化有益菌等方面具有积极的作用,此外Lactobacillus、Limosilactobacillus、Weissella、Pediococcus等产酸菌能够产生乙酸和己酸等挥发性脂肪酸,而乙酸和己酸是生成乙酸乙酯和己酸乙酯的前体[20]。相对于细菌的结构特征,真菌群落结构特征变化显得更为丰富,可分为D0、D7、D14~D28和D42~D904个时期(图2-c、图2-d),在0 d,糟醅中以分解淀粉的霉菌为主[21];7 d,由于糟醅中氧气消耗殆尽,好氧特征的霉菌数量急剧下降,转以发酵醇类物质的兼性酵母菌(Kazachstania、Thermoascus、Thermomyces、Issatchenkia)占据优势;14~56 d Kazachstania占据绝对优势;42~90 d,Kazachstania的优势开始减弱,Thermoascus开始逐步替代Kazachstania的优势地位。Kazachstania在发酵旺盛的浓香型糟醅中占据主导地位,与其能够在低pH环境生存,并发酵乙醇具有密切的关系。Lactobacillus可以促进Kazachstania产生乙醇,其共发酵还可促进白酒香味的形成[22-23]。Thermoascus可以产生淀粉酶的作用,发酵后期Thermoascus开始占据优势,可能与其在发酵过程中不断分解淀粉产生还原糖有关,提示随着发酵的进行,糟醅中还原糖逐渐降低,不足以维持产酸菌和产醇菌生产酸和醇,糟醅系统开始有目的的调控Thermoascus的生长,分解糟醅中的淀粉,以确保发酵的持续进行[21, 24-25]。表明糟醅中微生物的群落结构具有明显的时间特征,通过微生物群落之间的演替决定糟醅发酵的质量。
在泸型酒糟醅发酵的不同时期,其风味型代谢物质组成结构存在着显著差异。PCoA揭示不同发酵时期糟醅中代谢物的差异性,糟醅中代谢物的形成主要分为3个时期,且这3个时期与糟醅中代谢物存在密切的时间联系(图3-c);在0~14 d糟醅中主要代谢物是还原糖(图1-b),14~42 d,糟醅中还原糖含量减少,乙醇含量快速增加(图3-a),42 d之后,糟醅中还原糖和乙醇含量基本维持稳定,与泸型酒“窖香浓郁”风味有关的酯、酸和醇等物质快速累积(图3-a,图3-b),表明糟醅在发酵过程中经历了糖化、产醇、生香三个典型的阶段。在糟醅的主要风味型代谢物中,己酸乙酯、己酸、乙酸乙酯、乙酸和丙酸2-羟基乙酯占据绝对优势(图3-a),是决定泸型酒是否呈现“窖香浓郁”风味的关键,与之前的报道一致[15]。表明糟醅中风味型代谢物质的变化具有明显的时间特征,其含量随发酵时间的延长而逐渐累计。
泸型酒是否呈现“窖香浓郁”风味的机制与其糟醅中的关键菌群和代谢物密不可分。相关性分析表明,糟醅中淀粉含量与Limosilactobacillus、Weissella、Pediococcus、Bacillus、Aspergillus、Kosakonia呈明显的正相关,还原糖与Acetobacter和Bacillus呈明显的正相关,糟醅酸度与Lactobacillus、Candida和Thermoascus呈明显的正相关(图5-b);表明糟醅中酵母菌、曲霉菌和芽孢杆菌等共同调控糟醅的发酵。酵母菌、曲霉菌和芽孢杆菌在发酵过程中可产生淀粉葡萄糖苷酶、葡聚糖1,3-β-葡萄糖苷酶、纤维二糖酶、L-阿拉伯糖异构酶等[26-30],这些酶可将淀粉和纤维素水解成葡萄糖等还原糖(图1-a、图1-b和图6-a、图6-b),为乳酸菌、芽孢杆菌和酵母菌生产酸和醇等物质提供了重要的物质基础。随着发酵的进行,Lactobacillus等产酸菌消耗还原糖产生己酸、乙酸、乳酸;同时,Kazachstania等微生物酶以己酸、乙酸、乳酸和醇为底物,合成己酸乙酯、乙酸乙酯和乳酸乙酯等酯类物质[15,30-32]。在本研究中,发现己酸乙酯、乳酸乙酯和乙酸乙酯的含量随着发酵时间的延长,其含量快速增加(图2-a);通过Pearson关联分析可知,Lactobacillus、Candida、Thermoascus和Issatchenkia与己酸乙酯、乳酸乙酯和乙酸乙酯合成明显正相关(图5-c、图5-d)。泸型酒“窖香浓郁”来源于糟醅中挥发性代谢物,己酸乙酯的苹果香和乙酸乙酯的水果香构成泸型酒“窖香浓郁”的主体,结合醇类的甜香味共同构成泸型酒的独特香味。酸类物质是酯类合成的前体,其本身风味较差,但是其能平衡酒体的香味,己酸能为酒体增加刺激感,丰富酒的层次[32-33]。因此,酯类的“窖香”、醇类的“醇甜”、酸类的“刺激感”,共同构成泸型酒“窖香浓郁”的特点,其中己酸乙酯和乙酸乙酯等代谢成分是形成泸型酒“窖香浓郁”风味的主体和物质基础。因此,泸型酒“窖香浓郁”风味的形成是多种微生物协同发酵,多种代谢产物共同衬托体现的结果。
4 结论
本研究揭示了泸型酒“窖香浓郁”风味的代谢机制,糟醅微生物群落-代谢物具有明显的时间特征,其“窖香浓郁”风味的形成是微生物协同发酵,多种代谢产物共同衬托体现的结果。本研究发现,泸型酒糟醅在发酵过程中经历了糖化、产醇、生香三个典型的阶段,尤其生香阶段大量生成的己酸乙酯、乳酸乙酯和乙酸乙酯是泸型酒“窖香浓郁”风味的物质基础。
[1] 卫春会, 郑自强, 李浩, 等.浓香型白酒酒醅发酵过程中风味物质时空差异分析[J].食品与发酵工业, 2022, 48(5):240-246.WEI C H, ZHENG Z Q, LI H, et al.Time and spatial distribution difference of flavor compounds during the fermentation of fermented grains of Luzhou-flavor Baijiu[J].Food and Fermentation Industries, 2022, 48(5):240-246.
[2] 赵亮亮, 盛伟喜, 时晓, 等.浓香型白酒酿造生境中微生物群落多样性及群落间相互作用[J].中国酿造, 2023, 42(11):15-21.ZHAO L L, SHENG W X, SHI X, et al.Research progress on microbial community diversity and interaction in strong-flavor Baijiu brewing habitat[J].China Brewing, 2023, 42(11):15-21.
[3] KANG J M, SUN Y T, HUANG X N, et al.Unraveling the microbial compositions, metabolic functions, and antibacterial properties of Huangshui, a byproduct of Baijiu fermentation[J].Food Research International, 2022, 157:111320.
[4] 李璇, 戚居胜, 韩四海, 等.浓香型白酒杜康酒醅发酵过程中理化指标变化规律[J].食品与发酵工业, 2019, 45(11):52-57.LI X, QI J S, HAN S H, et al.Changes in physicochemical properties of fermented grains of strong-aroma liquor ‘Dukang’during fermentation[J].Food and Fermentation Industries, 2019, 45(11):52-57.
[5] 宋建阳, 梁莉莹, 岑定运, 等.浓香型白酒发酵过程中酒醅微生物群落结构解析及其与风味物质的相关性[J].食品研究与开发, 2023, 44(14):86-92.SONG J Y, LIANG L Y, CEN D Y, et al.Microbial community and its correlation with flavor compounds of fermented grains during strong-flavor Baijiu fermentation[J].Food Research and Development, 2023, 44(14):86-92.
[6] 焦文婧, 谢菲, 高蕾, 等.浓香型酒醅中微生物群落及其与乙酸和乙酸乙酯的相关性分析[J].中国酿造, 2023, 42(4):96-102.JIAO W J, XIE F, GAO L, et al.Microbial community and their correlations with acetic acid and ethyl acetate in fermented grains of strong-flavor Baijiu[J].China Brewing, 2023, 42(4):96-102.
[7] MIAO Z J, BAI Y, WANG X L, et al.Unravelling metabolic heterogeneity of Chinese Baijiu fermentation in age-gradient vessels[J].Foods, 2023, 12(18):3425.
[8] 胡晓龙, 王康丽, 余苗, 等.浓香型酒醅微生物菌群演替规律及其空间异质性[J].食品与发酵工业, 2020, 46(10):66-73.HU X L, WANG K L, YU M, et al.Microbial community succession pattern and spatial heterogeneity in fermented grains of strong-flavor Baijiu[J].Food and Fermentation Industries, 2020, 46(10):66-73.
[9] 余松柏, 赵兴蓉, 邵燕, 等.浓香型白酒酒醅发酵过程中30种有机酸空间与时间的分布规律[J/OL].食品与发酵工业, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.037022.YU S B, ZHAO X R, SHAO Y, et al.Spatial and time distribution of 30 organic acids during the fermentation in fermented grains of nongxiangxing Baijiu[J/OL].Food and Fermentation Industries, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.037022.[10] 泸州老窖集团有限责任公司. 泸型酒技艺大全[M].北京:中国轻工业出版社, 2011:387-399.LUZHOULAOJIAO Group Co., LTD.A Complete List of Lu-Type Wine Techniques [M].Beijing:China Light Industry Press, 2011:387-399.
[11] ZHENG C Z, CAO J M, CHI S Y, et al.Dietary phosphorus supplementation in the diet of Pacific white shrimp (Litopenaeus vannamei) alleviated the adverse impacts caused by high Clostridium autoethanogenum protein[J].Fish &Shellfish Immunology, 2022, 131:137-149.
[12] HALL M, BEIKO R G.16S rRNA gene analysis with QIIME2[J].Methods in Molecular Biology, 2018, 1849:113-129.
[13] DOUGLAS G M, MAFFEI V J, ZANEVELD J R, et al.PICRUSt2 for prediction of metagenome functions[J].Nature Biotechnology, 2020, 38(6):685-688.
[14] ROSENBAUM P R, SMALL D S.An adaptive Mantel-Haenszel test for sensitivity analysis in observational studies[J].Biometrics, 2017, 73(2):422-430.
[15] YAO F, YI B, SHEN C H, et al.Chemical analysis of the Chinese liquor Luzhoulaojiao by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Scientific Reports, 2015, 5:9553.
[16] PORTO M C W, KUNIYOSHI T M, AZEVEDO P O S, et al.Pediococcus spp.:An important genus of lactic acid bacteria and pediocin producers[J].Biotechnology Advances, 2017, 35(3):361-374.
[17] KSIEZAREK M, GROSSO F, RIBEIRO T G, et al.Genomic diversity of genus Limosilactobacillus[J].Microbial Genomics, 2022, 8(7):mgen000847.
[18] KIM E, YANG S M, KIM H Y.Weissella and the two Janus faces of the genus[J].Applied Microbiology and Biotechnology, 2023, 107(4):1119-1127.
[19] BOMRUNGNOK W, ARAI T, YOSHIHASHI T, et al.Direct production of polyhydroxybutyrate from waste starch by newly-isolated Bacillus aryabhattai T34-N4[J].Environmental Technology, 2020, 41(25):3318-3328.
[20] WANG X S, WANG B W, SUN Z G, et al.Effects of modernized fermentation on the microbial community succession and ethyl lactate metabolism in Chinese Baijiu fermentation[J].Food Research International, 2022, 159:111566.
[21] MENDONÇA A P S, DOS REIS K L, BARBOSA-TESSMANN I P.Aspergillus clavatus UEM 04:An efficient producer of glucoamylase and α-amylase able to hydrolyze gelatinized and raw starch[J].International Journal of Biological Macromolecules, 2023, 249:125890.
[22] LIU N, LI X L, HU Y, et al.Effects of Lentilactobacillus buchneri and Kazachstania bulderi on the quality and flavor of Guizhou fermented red sour soup[J].Foods, 2023, 12(20):3753.
[23] LYU W Z, LI F, LI C G.Effect of inoculated Daqu on the spontaneous fermentation of Chinese liquor[J].Food Research International, 2023, 173:113321.
[24] ZHANG Y Y, ZHU X Y, LI X Z, et al.The process-related dynamics of microbial community during a simulated fermentation of Chinese strong-flavored liquor[J].BMC Microbiology, 2017, 17(1):196.
[25] HE M W, JIN Y, LIU M M, et al.Metaproteomic investigation of enzyme profile in Daqu used for the production of Nongxiangxing Baijiu[J].International Journal of Food Microbiology, 2023, 400:110250.
[26] MEADEN P, OGDEN K, BUSSEY H, et al.A DEX gene conferring production of extracellular amyloglucosidase on yeast[J].Gene, 1985, 34(2-3):325-334.
[27] TAN Y L, MA S, LEONHARD M, et al.β-1, 3-glucanase disrupts biofilm formation and increases antifungal susceptibility of Candida albicans DAY185[J].International Journal of Biological Macromolecules, 2018, 108:942-946.
[28] LIU X X, LI Z J, CHEN Z, et al.Production of L-ribulose using an encapsulated L-arabinose isomerase in yeast spores[J].Journal of Agricultural and Food Chemistry, 2019, 67(17):4868-4875.
[29] PERVEZ S, NAWAZ M A, SHAHID F, et al.Characterization of cross-linked amyloglucosidase aggregates from Aspergillus fumigatus KIBGE-IB33 for continuous production of glucose[J].International Journal of Biological Macromolecules, 2019, 135:1252-1260.
[30] TAIBI H, BOUDRIES N, ABDELHAI M, et al.Comparison of immobilized and free amyloglucosidase process in glucose SyrupsProduction from white sorghum starch[J].Chemistry &Biodiversity, 2023, 20(8):e202300071.
[31] CARBONETTO B, NIDELET T, GUEZENEC S, et al.Interactions between Kazachstania humilis yeast species and lactic acid bacteria in sourdough[J].Microorganisms, 2020, 8(2):240.
[32] LIU C J, DU Y F, ZHENG J, et al.Production of caproic acid by Rummeliibacillus suwonensis 3B-1 isolated from the pit mud of strong-flavor Baijiu[J].Journal of Biotechnology, 2022, 358:33-40.
[33] 牟薏,卫春会,曾波, 等.基于黄水线上下层酒醅及基酒的风味特征分析[J/OL].食品与发酵工业, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.037728.MOU Y, WEI C H, ZENG B, et al.Analysis of flavor characteristics of fermented grains above and below the Huangshui line[J/OL].Food and Fermentation Industries, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.037728.