中国白酒历史悠久,现以酱香、浓香、清香和米香作为四大主流香型。其中,酱香型白酒以独具一格的酿造工艺广受消费者好评。高温大曲在主发酵期的过程中,通过自然接种的方式,将环境中的微生物富集起来,形成独特的微生物群落结构,使酱香型白酒区别于其他白酒,产生多种多样的酶类和风味前体物质丰富了酱香型白酒酒体风味[1]。高温大曲在发酵过程中微生物群落结构变化一直是人们研究的重点。
高温大曲主发酵期为细菌、真菌(大部分为丝状真菌)和酵母菌三类微生物为主。在高温大曲整个发酵的过程中,这些耐高温的微生物以麦麸为原材料,分解蛋白质和淀粉,生成各种简单的氨基酸和糖类物质,给产香的细菌提供前体物质,由于发酵时期温度较高所以耐高温的微生物扮演着重要的角色。耐高温的芽孢杆菌利用这些营养物质进行代谢生成吡嗪类物质增加酱香型白酒的风味[2];醋酸菌也是产酸性物质的关键菌种,能氧化葡萄糖和乙醇,生成乙酸,与酒体中醇类物质反应生成酯类化合物[3]。乳酸菌能产生大量的乳酸,通过多种酶的作用与乙醇反应生成乳酸乙酯,从而使带酱香型白酒酒体风格迥异,也影响着酒的品质[4]。
参与高温大曲发酵过程中的真菌大多数为耐高温的根霉和毛霉。特别是作为高温大曲中的优势菌属米根霉,它在代谢的过程产生了芳香化合物,如乙醛、乙酸乙酯、丙酸乙酯、正丙醇等,引起了不少学者的重视[5]。已有多位学者证明,黑曲霉作为高温大曲中所占比例较高的霉菌,在大曲中参与麦麸的糖化和液化,产生多种酶类,促使大曲发酵,使淀粉降解,防止产生裂解等现象[6]。酵母菌是高温大曲产酒的根本,在整个发酵期间起到产酒和酯化增香的作用。酵母菌大量存在于高温的大曲中,以酿酒酵母、酯类酵母、假丝状酵母等为主要成分。不同种属的酵母菌可通过糖酵解途径将麦麸中已分解的葡萄糖分解为乙醇,并通过酯化作用合成酱香型白酒独特的风味物质[7]。
在酱香型白酒固态发酵的过程中,大曲提供各种重要的酶系。糖化酶可以水解原料中麦麸的淀粉,生成葡萄糖等可以发酵的糖类[8]。纤维素酶可以将原料中的淀粉释放出来,与纤维素和半纤维素一同转化成可发酵的糖类,提供给酵母转化成酒精,提高出酒率。蛋白酶可以分解原料中的蛋白质,将其转化为相应营养物质,作为香味物质的前体物质,与酱香型白酒独特的风味有着密不可分的关系。
本研究针对酱香型白酒酿造中制曲工艺,利用高通量测序技术,系统分析高温大曲主发酵期微生物群落结构以及酶系动态变化规律,阐明高温大曲核心微生物和酶系间驱动作用机制,为今后高温大曲酿造工艺优化提供理论基础,也为全面系统的提升酱香型白酒酒质稳定性提供参考依据。
1 材料与方法
1.1 实验材料
样品采自湖南湘窖酒业有限公司高温大曲制曲车间。分别在发酵期阶段第1、2、3、5、7、9、12、15、20、30、40天时进行取样,每次取3组发酵的平行曲块为实验对象。采用五点法进行取样:以高温大曲块对角线中间点为中心抽样点,在对角线上选取等距离的4个点作为抽样点。采集后的大曲样品经粉碎机粉碎并分类标记,保存在无菌袋中贴好标签,放置在-80 ℃冰箱中储存。具体取样信息如表1所示:
表1 大曲样品采集数据
Table 1 Sampling information of Daqu
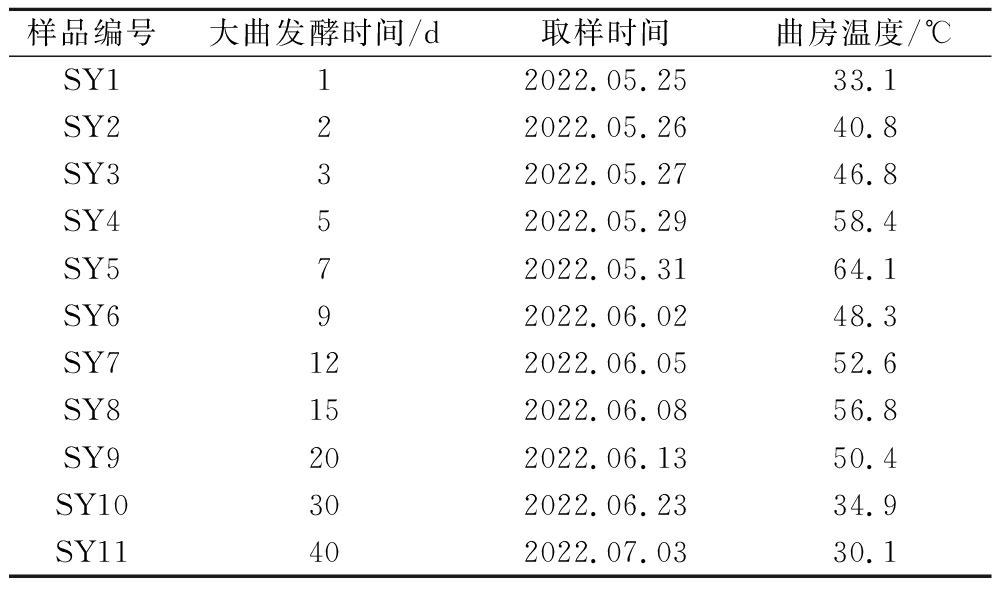
样品编号大曲发酵时间/d取样时间曲房温度/℃SY112022.05.2533.1SY222022.05.2640.8SY332022.05.2746.8SY452022.05.2958.4SY572022.05.3164.1SY692022.06.0248.3SY7122022.06.0552.6SY8152022.06.0856.8SY9202022.06.1350.4SY10302022.06.2334.9SY11402022.07.0330.1
1.2 实验试剂
无水葡萄糖、3, 5-二硝基水杨酸、NaOH、酒石酸钠、酪氨酸、Na2SO3、醋酸钠、K2HPO4、KH2PO4、Na2CO3、柠檬酸、柠檬酸钠,天津市致远化学试剂有限公司。I2、KI、浓硫酸、浓盐酸、可溶性淀粉、三氯乙酸、福林酚溶液、酪素、冰醋酸、无水乙醇、苯酚,国药集团化学试剂有限公司。以上所有试剂均为分析纯。
1.3 主要仪器设备
722型紫外-可见分光光度计,上海舜宇恒平科学仪器有限公司;101-2AB型电热鼓风干燥箱,天津市泰斯特仪器有限公司;FE28型pH计,梅特勒-托利多仪器(上海)有限公司;DZKW-4电热恒温水浴锅,北京中兴伟世纪仪器有限公司;SW-CJ-2D双人单面垂直净化工作台,苏州净化公司;DAY20超纯水机,湖南科尔顿水务有限公司;Sanyo超低温冰箱、DH-6000B培养箱,河北豪威电气设备科技有限公司;GI54DWS全自动灭菌锅,致微(厦门)仪器有限公司;FC酶标仪,赛默飞世尔科技有限公司;HR/T16M台式高速冷冻离心机,湖南赫西仪器装备有限公司;MDF-86V188E医用低温保存箱,安徽中科都菱商用电气股份有限公司。
1.4 高温大曲酶系测定
1.4.1 样本预处理
采集后的样本放入研磨机中粉碎混合,称取10 g大曲样品与90 mL灭菌的20 mmol/L的磷酸盐缓冲液(pH=7.0)充分混合后,60 ℃恒温水浴锅中水浴1 h,期间不停搅拌。然后于10 000 r/min离心10 min,收集上清液,用于酶活力测定。
1.4.2 酶活性的测定
参照袁华伟等[9]对大曲中的酸性和中性纤维素酶活性进行测定。蛋白酶活性和木聚糖酶活性的测定参照范伟业[10]的方法。α-淀粉酶活性的测定参照赵远玲[11]的方法。果胶酶活性的测定参照陈杰等[12]的方法测定。单宁酶活性的测定参照王征等[13]的方法。
1.5 高温大曲微生物群落结构演替变化分析
1.5.1 基因组DNA提取与PCR扩增
称取5 g样品,通过DNA提取试剂盒(DP304)提取DNA,通过微量紫外分光光度计检测DNA浓度与纯度。为了确保准确性使用引物(上海生工生物)细菌16SV3-V4区(引物343F和798R)[14]和真菌ITS区(引物ITS1F和ITS2R)[15]进行PCR扩增。
PCR产物使用凝胶电泳进行检测[16],检测后使用磁珠纯化,纯化后作为二轮PCR模板,并进行二轮PCR扩增,重新进行凝胶电泳检测,检测后继续使用磁珠纯化,纯化后对PCR产物进行Qubit定量。根据PCR产物浓度进行等量混样,并上机测序[17]。
1.5.2 测序数据分析
将原始数据使用cutadapt软件进行剪切取出引物序列。使用DADA2进行质量过滤,降噪,拼接及去嵌合体等质控分析,得到代表序列及ASV丰度表格。
使用QIIME2软件包筛选出ASV的序列后,所有的序列都会和数据库进行比对和标记。用R语言软件包进行原数据的对应分析并绘图。使用Origin2021软件对高温大曲的酶活性变化进行图片绘制。
2 结果与分析
2.1 大曲发酵过程中酶活性变化
由图1-a可知,在高温大曲主发酵期的过程中木聚糖酶活力在第1次翻曲(第9天)和第2次翻曲(第15天)呈迅速上升的变化趋势,20 d~30 d维持不变,发酵后期呈缓慢上升的变化趋势。因为工厂是在曲房达到最高温度时进行翻曲,曲房温度上升时,木聚糖酶活力与曲房温度趋势相同,在第9天出现酶活力的顶点。由图1-b可知,纤维素酶活力从入曲房开始的前2 d与第1、2次翻曲后大幅度上升,到了发酵后期呈缓慢上升的变化趋势。产纤维素酶的微生物在温度较低的环境下代谢迅速,同时影响纤维素酶活力,在第9天出现酶活力的顶点。由图1-c可知,淀粉酶活力在高温大曲主发酵过程中保持稳定,维持在一定范围内波动。说明温度与湿度等环境因素对产淀粉酶的微生物影响不大。由图1-d可知,果胶酶活力在高温大曲主发酵过程的前期在一定范围内波动,第1次翻曲后到发酵结束呈现缓慢上升的变化趋势。在曲房温度逐渐降低的过程中果胶酶的活力逐渐增大,在第37天达到顶点。由图1-e可知,单宁酶活力在发酵第1天到第9天和第10天到第15天呈现迅速上升的变化趋势,第2次翻曲后呈现持续下降趋势,到发酵后期缓慢上升,在第9天和第15天均出现了顶点。由图1-f可知,蛋白酶活力在第2天达到顶峰,并在一定范围内波动,在第2次翻曲后大幅度下降,在发酵的后期保持较高的酶活力,趋近平稳。
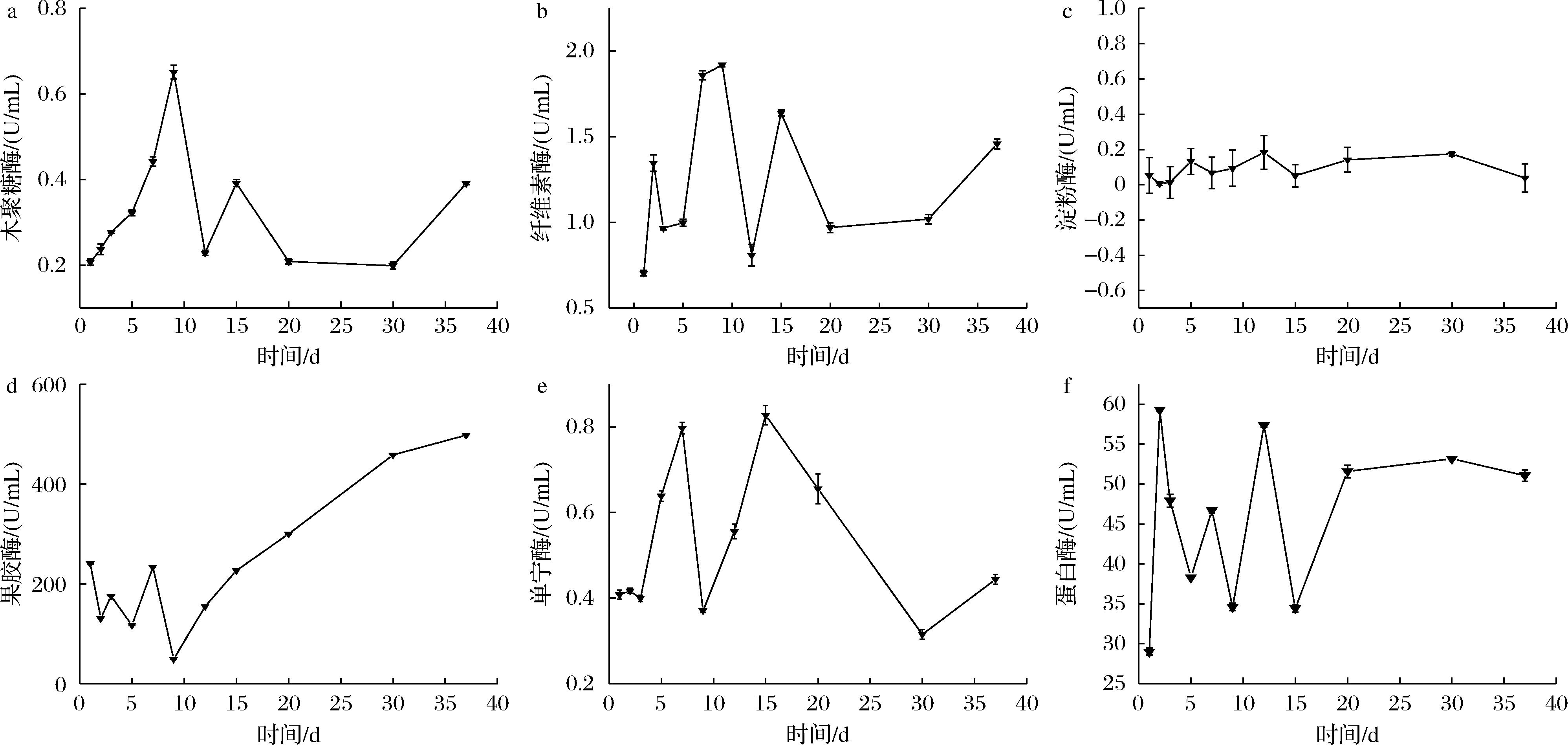
a-木聚糖酶;b-纤维素酶;c-淀粉酶;d-果胶酶;e- 单宁酶;f-蛋白酶
图1 大曲发酵过程中酶活力动态变化
Fig.1 Changes in enzyme activity during Daqu fermentation
综上所述,大曲发酵过程中酶活力变化的规律与窖池的环境和微生物有关,尤其是第9天和第15天为高温大曲制作工艺的翻曲阶段,改变了温度、湿度等条件因素,影响了产酶微生物的活性,对大曲中的酶活力进一步产生影响,同时也影响了大曲中微生物的群落结构。由上述酶活力的测定结果本课题选择1、2、9、12、15、37 d的样品继续研究。
2.2 高温大曲中微生物群落结构
2.2.1 α多样性分析
α多样性分析可以反映出高温大曲中物种的多样性程度。在大曲发酵过程中α多样性分析表明,细菌的丰富度(Chao1指数,图2-a)在大曲发酵的1~12 d,在一定范围内波动;细菌的多样性(Shannon指数,图2-b)在大曲发酵的第1天和第1次翻曲阶段增加,在第15天之后在一定范围内波动。同时,在大曲发酵的第1天、第9天和第37天,出现了较高的真菌的丰富度(Chao1指数,图2-c),其他时间在一定范围内波动。在大曲发酵的第1天和第37天出现高多样性(Shannon指数,图2-d)。因为在大曲刚进入曲房期间温度不高适宜真菌的生长,所以真菌表现出较高的丰富度和多样性。第2天曲房开始升温不适宜真菌的生长,真菌的丰富度和多样性开始下降。第9天进行第1次翻曲,曲房温度降低真菌的多样性与丰富度再次上升。第15天是第2次翻曲结束后,整个曲房保持较高的温度所以真菌的丰富度与多样性下降。发酵后期曲房温度下降真菌开始繁殖,出现较高的丰富度与多样性。同理,细菌在曲房温度较高的环境下适宜生长,表现出较高的丰富度和多样性。发酵后期曲房温度下降但是变化幅度不大,所以细菌的丰富度与多样性在一定范围内波动。
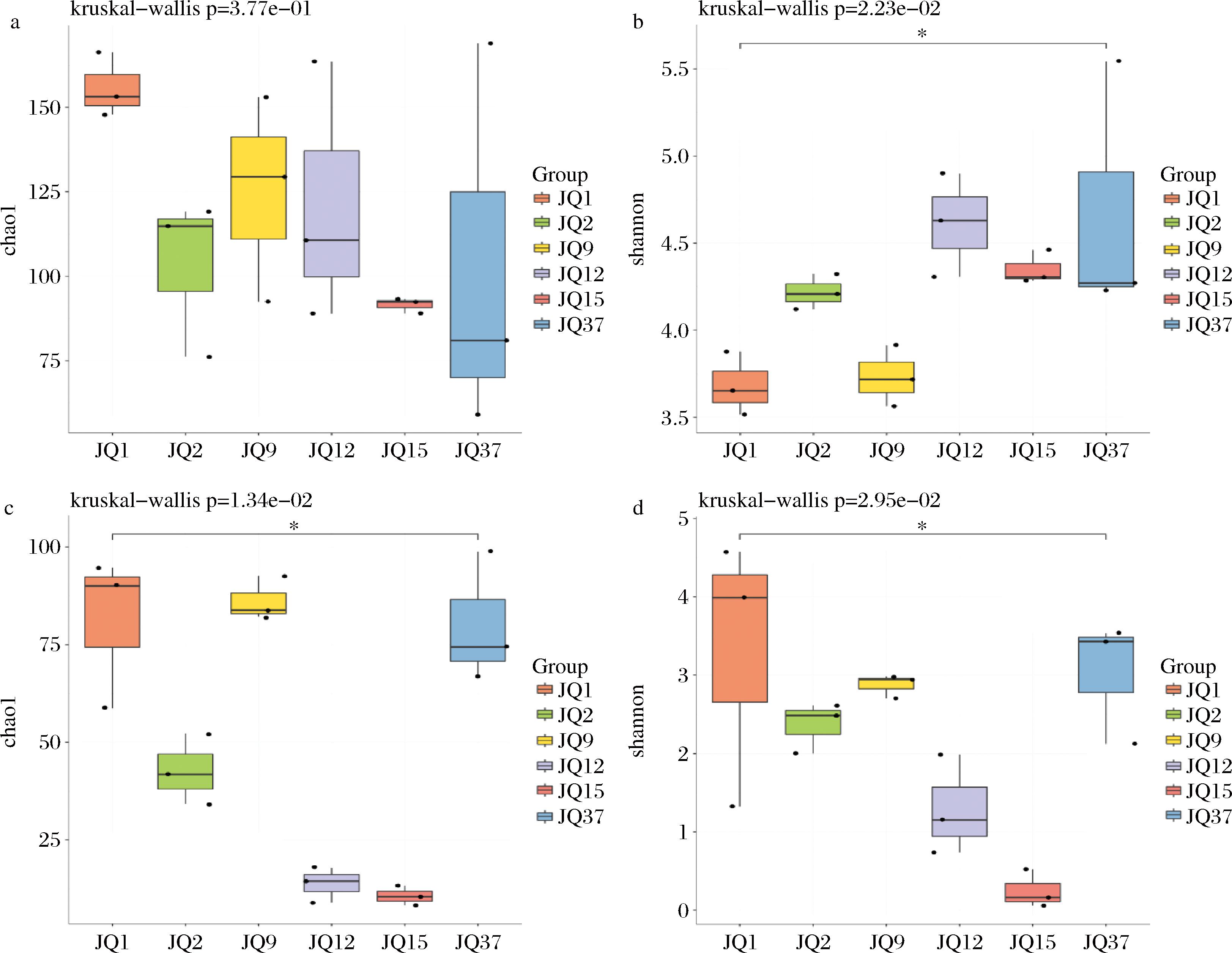
a-细菌的Chao1指数;b-细菌的Shannon指数;c-真菌的Chao1指数;d-真菌的Shannon指数
图2 α多样性指数组间比较boxplot图
Fig.2 α-Diversity index between groups
2.2.2 β多样性分析
为评价大曲连续发酵过程中微生物群落组成的变化,采用Bray-Curtis基质进行主坐标分析(principal co-ordinates analysis, PCoA)。细菌的测序结果第2天、第9天与第12天空间分布靠近,第1天与第37天空间分布靠近,分别表明其微生物组成相似。第15天与其他天数样本距离较远,表明第15天与其他样本的微生物组成差异显著。真菌的测序结果第1天与其他样本空间距离较远,表明第1天组内微生物组成与其他样本组建微生物差异显著。PCoA结果显示,细菌群落结构(ANOSSIM, R=0.842 0, P=0.001,图3-a)和真菌群落结构(ANOSSIM, R=0.823 9, P=0.001,图3-b)具有显著的时间序列规律。
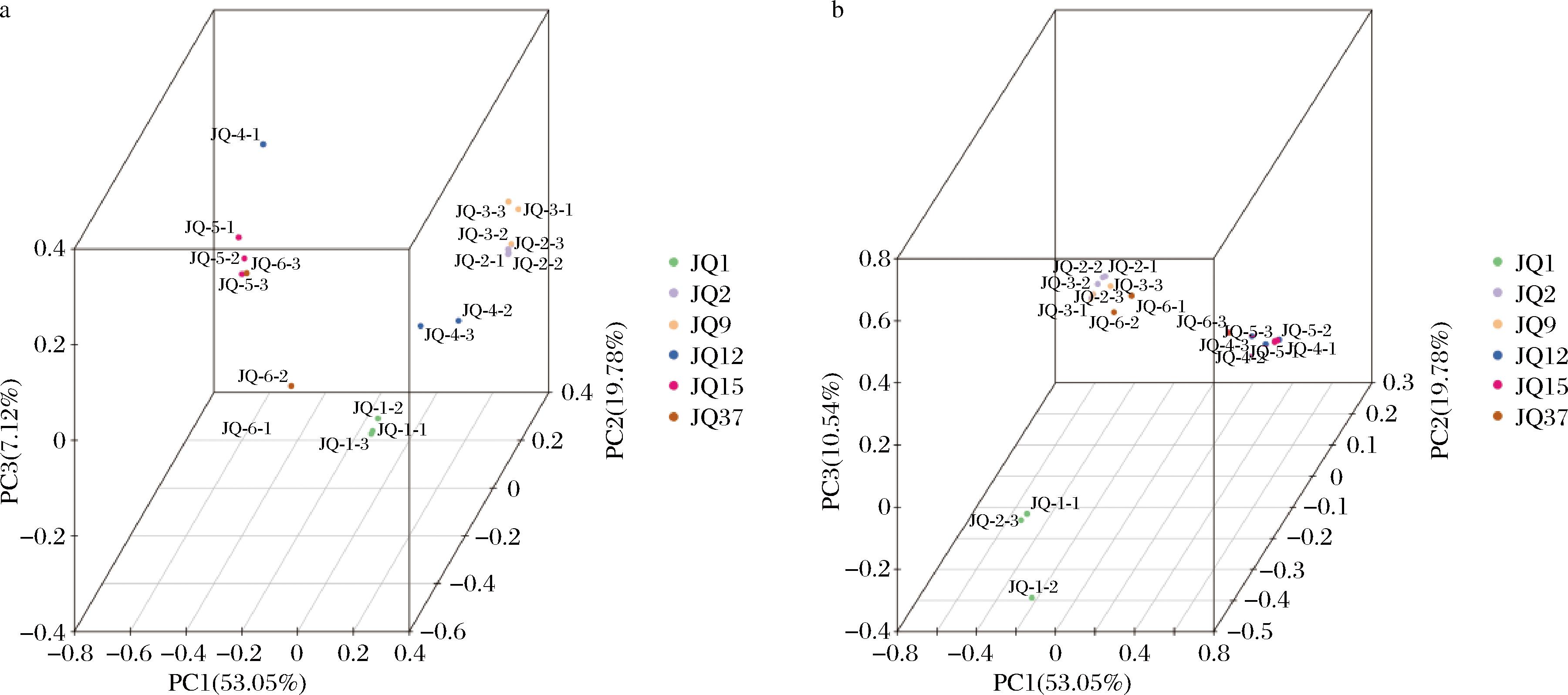
a-细菌ANOSSIM检验;b-真菌ANOSSIM检验
图3 PCoA 3D图
Fig.3 PCoA 3D plot
2.3 微生物群落组成分析
通过微生物种群结构(图4)可知,发酵第1天到第12天主要优势细菌属包括乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、芽孢杆菌属(Bacillus),随着发酵的继续进行大洋杆菌属(Oceanobacillus)、Kroppenstedtia、Virgibacillus占比逐渐提高。发酵第1天到第9天主要真菌属包括假丝酵母菌属(Candida)、曲霉属(Aspergillus)和大量其他未测出的菌属,随着发酵的继续进行红曲霉属(Monascus)、Leiothecium、嗜热子囊菌属(Thermoascus)的占比逐渐提高。
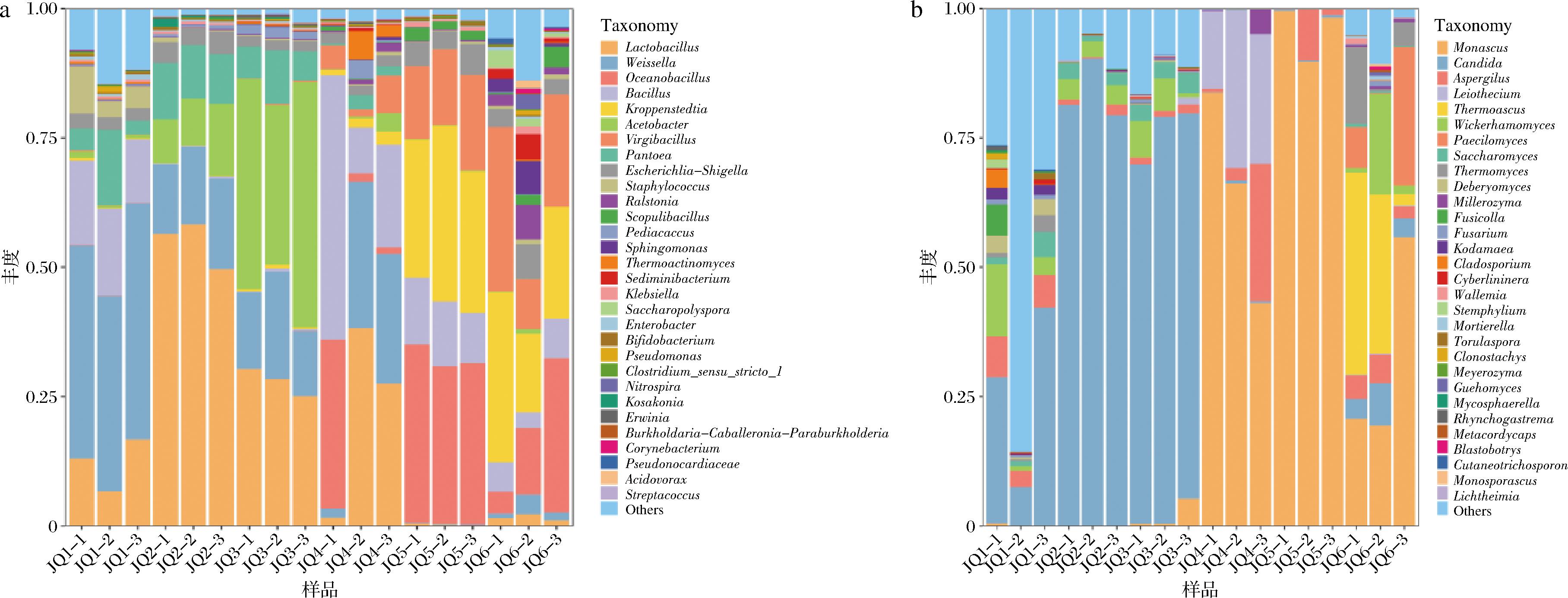
a-细菌;b-真菌
图4 属水平群落结构柱状图
Fig.4 Community structure of microorganism on genus level
2.4 高大曲微生物群落结构演替变化
利用LEfSe分析对高温大曲中微生物群落结构演替变化规律进行了分析,结果如图5所示,在大曲发酵的过程中第1天细菌相对分度较高的差异显著物种为Weissella和Leuconostocaceae。第2天细菌相对分度较高的差异显著物种为Lactobacillus;真菌为Candida。第9天细菌相对分度较高的差异显著物种为变形菌门(Proteobacteria);真菌为酿酒酵母属(Saccharomyces)。第12天细菌相对分度较高的差异显著物种为Bacillus;真菌为Leiothecium和醋酸杆菌属(Acetobacter)。第15天细菌相对分度较高的差异显著物种为厚壁菌门(Firmicutes)、Oceanobacillus和Kroppenstedtia;真菌为Monascus和子囊菌门(Ascomycota)。第37天细菌相对分度较高的差异显著物种为Virgibacillus;真菌为嗜热子囊菌属(Thermoascus)、拟青霉属(Paecilomyces)。
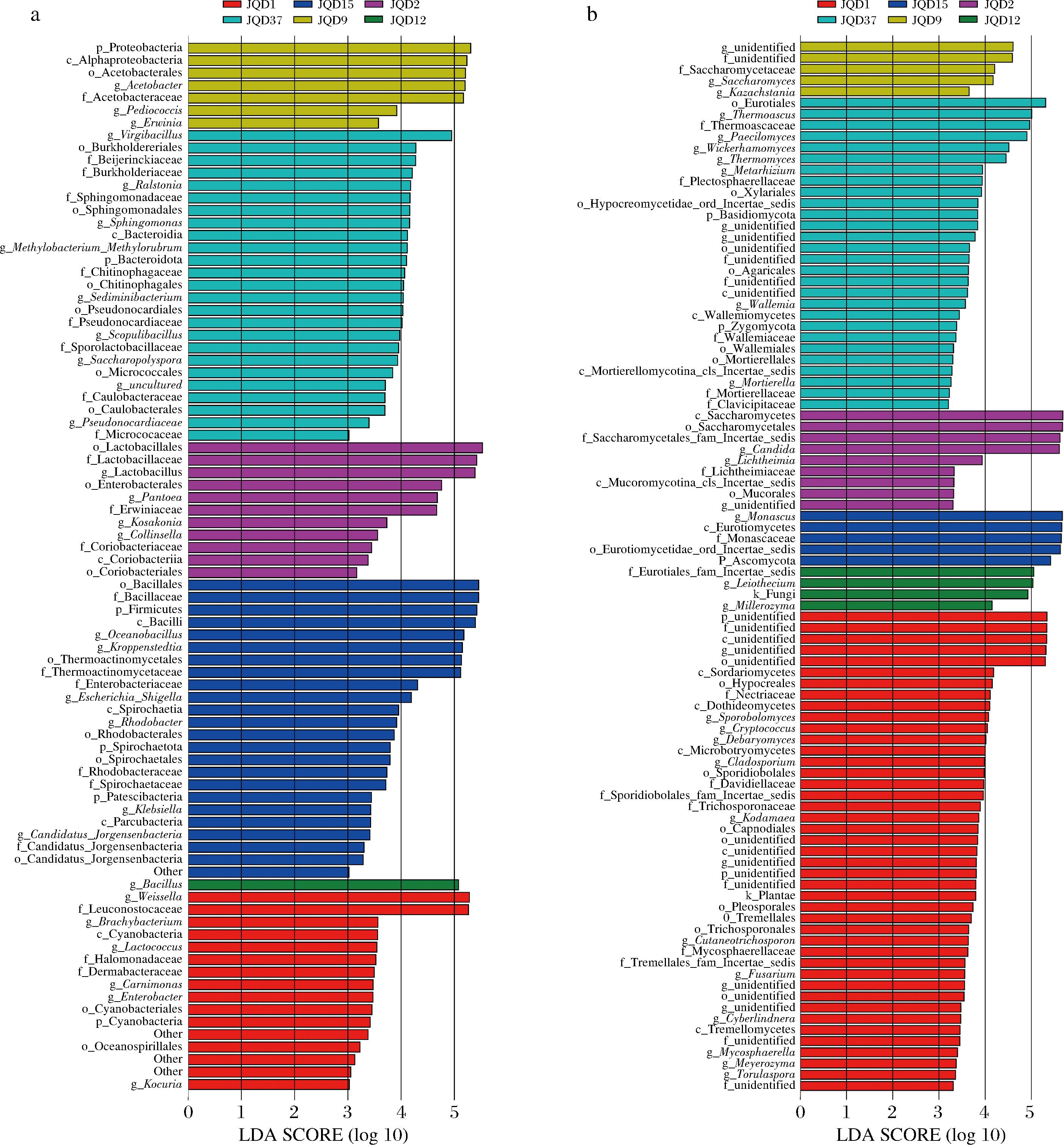
a-高温大曲细菌属水平群落结构演替变化规律;b-高温大曲真菌属水平群落结构演替变化规律
图5 差异物种得分图
Fig.5 Scoring plot of differential species
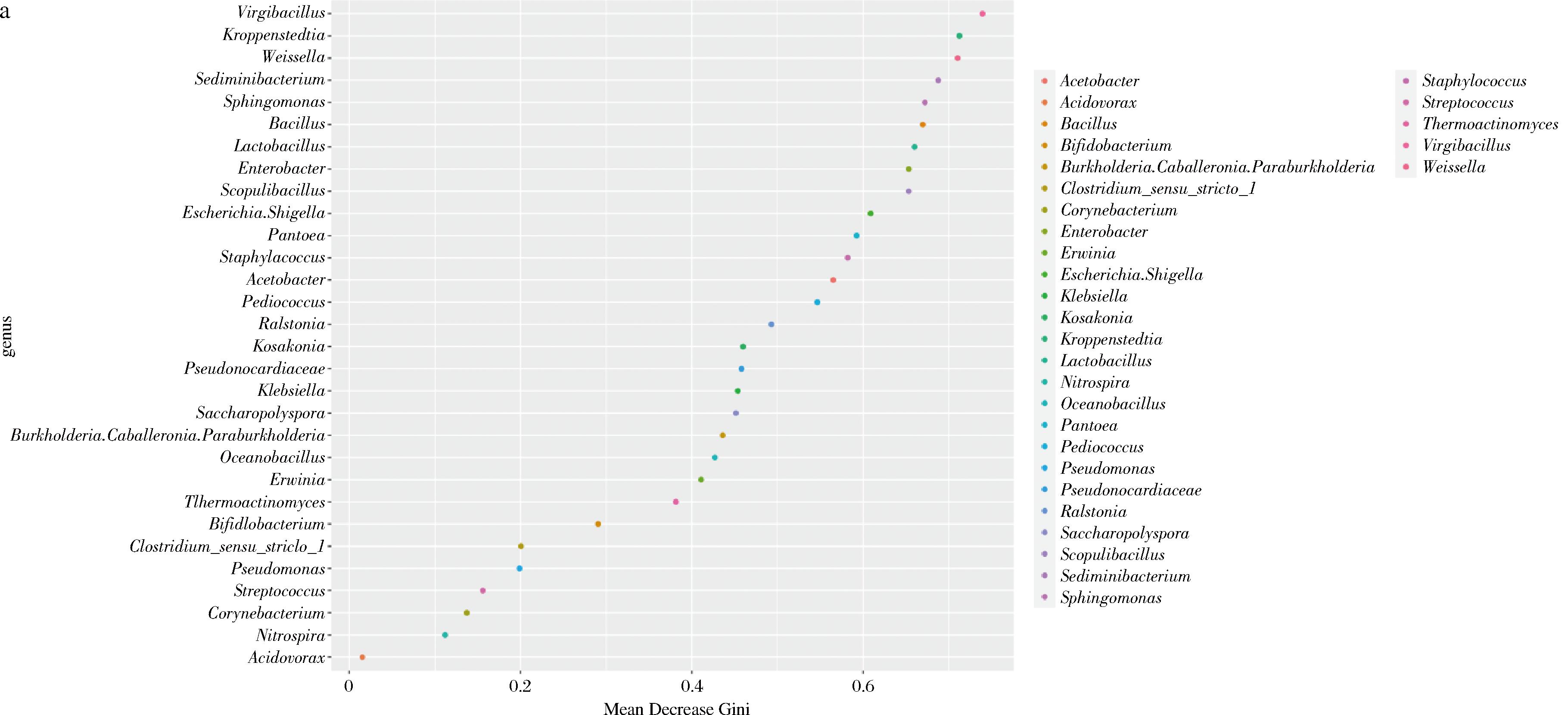
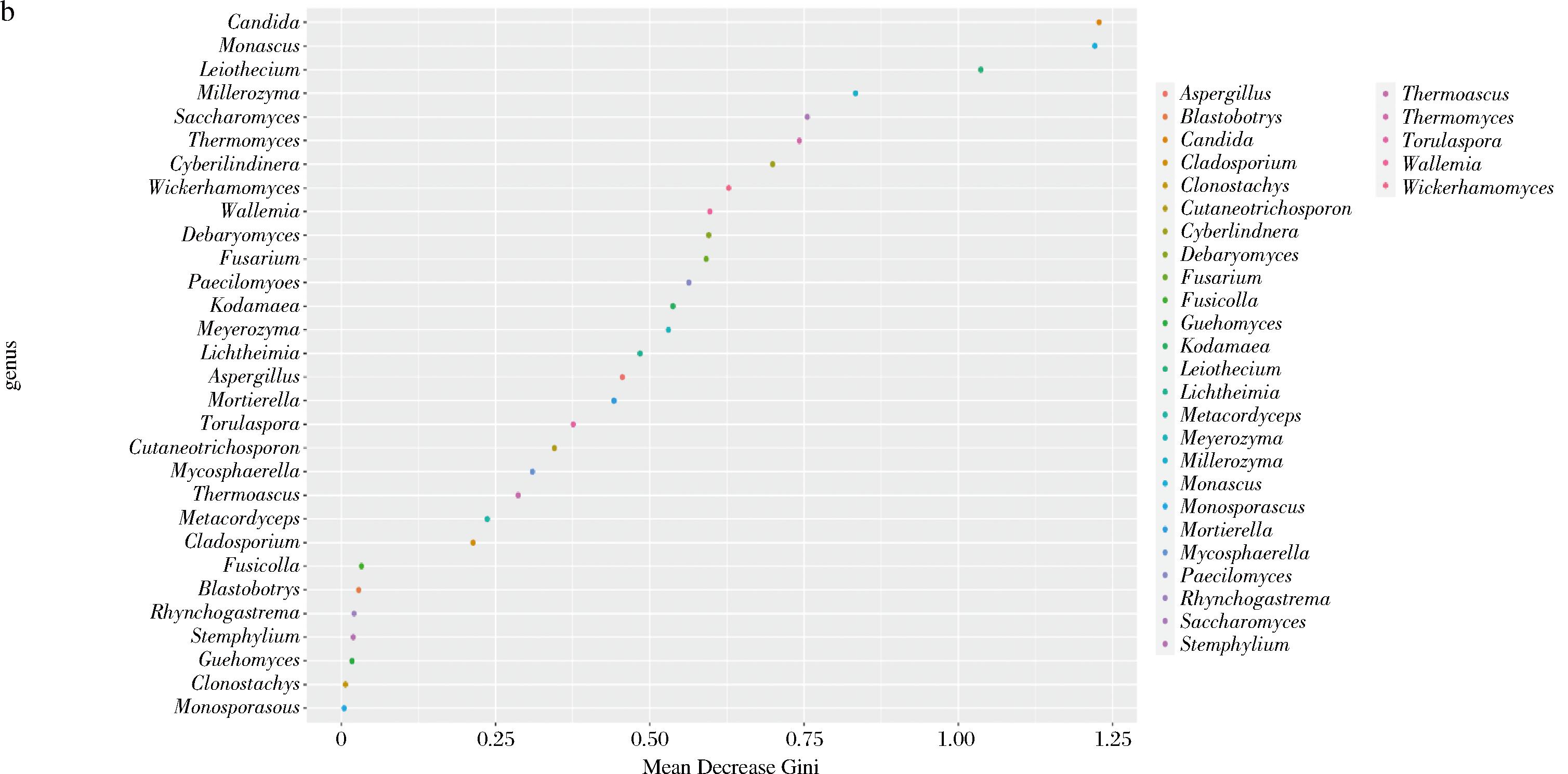
a-细菌;b-真菌
图6 重要物种点图
Fig.6 Point map of important species
2.5 随机森林
为了建立一个模型来说明微生物群落组成与大曲发酵各个阶段之间的关系,使用随机森林学习算法将每个微生物属的相对丰度与相应的发酵阶段进行回归。根据微生物属的重要性值,得出细菌属和真菌属的重要性值分别为前10位和前5位。细菌属为Virgibacillus、Kroppenstedtia、Weissella、Sediminibacterium、Sphingomonas、Bacillus、Lactobacillus、肠杆菌属(Enterobacter)、火山渣芽胞杆菌属(Scopulibacillus)和志贺氏菌属(Escherichia.Shigella)。真菌属为Candida、Monascus、Leiothecium、Millerozyma和Saccharomyces。
2.6 酶活力与微生物相关性分析
为了研究微生物和酶系间驱动机制,采用R语言对微生物和酶系之间相关性进行了分析。如图7所示,淀粉酶活力与Bacillus呈现极显著正相关与Kroppenstedtia呈现显著相关;而且Kroppenstedtia还与蛋白酶呈现极显著相关。纤维素酶活力与Monascus呈现极显著相关;果胶酶活力与Saccharomyces呈现显著相关。
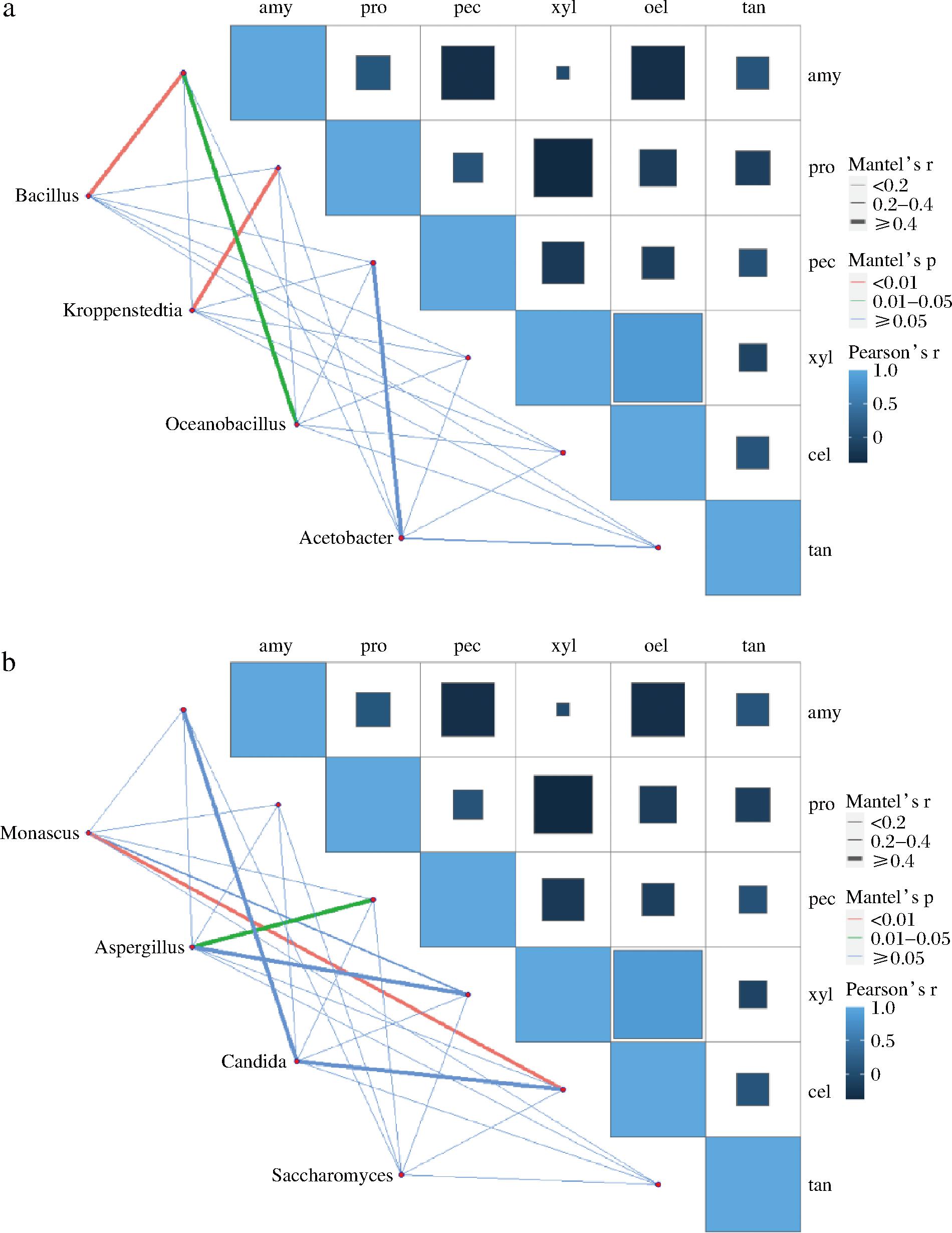
a-细菌;b-真菌
图7 Mantel test相关性分析图
Fig.7 Mantel test correlation analysis diagram
3 结论与讨论
本研究以湘产高温大曲为研究对象,通过测定样品中整个发酵期的酶活力和微生物的群落结构,探究了大曲主发酵期微生物演替的动态规律,得出酶活力在整个发酵过程中受到温度因素的影响,在侧面反应出微生物在大曲中的生长趋势,同时也影响了微生物在大曲中的群落结构组成。通过细菌属的Virgibacillus、Kroppenstedtia、Weissella、Sediminibacterium、Sphingomonas、Bacillus、Lactobacillus、Enterobacter、Scopulibacillus和Escherichia.Shigella;真菌属的Candida、Monascus、Leiothecium、Millerozyma和Saccharomyces这15个重要菌属,起着各种各样的功能,也推动着发酵阶段的进行。杨阳等[18]在高温大曲中发现以Weissella、Lactobacillus等为主的乳酸菌以及包括Kroppenstedtia、Virgibacillus、Oceanobacillus等在内的芽孢杆菌目细菌分别构成了中温大曲与高温大曲的细菌优势类群。陈佩等[19]在大曲中发现优势真菌类群主要为Millerozyma和各种酵母菌属,Saccharomyces与Candida为核心真菌群类。冯佳婷等[20]研究得出随着大曲的温度上升对细菌的群落影响更大,Bacillus相对丰度显著上升,而Lactobacillus和Weissella显著下降,挥发性化合物更为复杂,其中醛类化合物含量显著提升。淀粉酶和纤维素酶随着温度的上升而降低。
在大曲发酵的过程中同时也是驯化微生物的过程,一部分微生物生长繁殖一部分微生物消失灭亡,后期变成几株优势菌种,推动着发酵过程的进行。同时大曲在整个发酵过程中也不断地接收环境中的微生物。由于高温大曲生产过程中的特殊性,曲房温度维持在65 ℃左右,通常的真菌和酵母几乎不生长,因此大部分不耐热的真菌会被淘汰掉,留下大部分耐热的细菌。通过相关性分析可知:细菌与淀粉酶和蛋白酶具有相关性,真菌与果胶酶和纤维素酶具有相关性。微生物的生长和代谢也受环境因素的影响,微生物和酶活力对温度敏感。大曲刚入曲房的前几天各种微生物开始大量繁殖释放热量,曲房温度上升,水分蒸发不再适宜微生物生长和代谢,淘汰掉一部分微生物。当翻曲时挪动曲块,O2充分进入再通过人为补水,微生物又一次大量繁殖。第2次翻曲同理一直使曲房保持较高的温度,细菌大量繁殖并代谢出各种酶,分解大分子物质合成香味物质具有独特风味。
本课题针对酱香型白酒酿造中制曲环节,利用高通量测序技术,系统分析高温大曲主发酵期微生物群落结构以及酶系动态变化规律,阐明高温大曲核心微生物和酶系间驱动作用机制,为今后高温大曲酿造工艺优化提供理论基础,也为全面系统地提升酱香型白酒酒质稳定性提供参考依据。
[1] 张宗启. 酱香型白酒大曲中功能微生物菌群及其酶系研究进展[J].酿酒科技, 2021(3):92-99.ZHANG Z Q.Research progress in functional microbial community and enzymes in Jiangxiang Daqu[J].Liquor-Making Science &Technology, 2021(3):92-99.
[2] BRAMORSKI A, CHRISTEN P, RAMIREZ M, et al.Production of volatile compounds by the edible fungus Rhizopus oryzae during solid state cultivation on tropical agro-industrial substrates[J].Biotechnology Letters, 1998, 20(4):359-362.
[3] 王清龙, 朱甜甜, 刘延波, 等.白酒生产不同酒曲微生物群落结构、理化指标及挥发性风味物质研究[J].中国酿造, 2023, 42(7):93-102.WANG Q L, ZHU T T, LIU Y B, et al.Microbial community structure, physicochemical indexes and volatile substances of different Jiuqu in Baijiu production[J].China Brewing, 2023, 42(7):93-102.
[4] 申孟林, 张超, 王玉霞.白酒大曲微生物研究进展[J].中国酿造, 2016, 35(5):1-5.SHEN M L, ZHANG C, WANG Y X.Research progress on microorganism in Daqu liquor[J].China Brewing, 2016, 35(5):1-5.
[5] 简何, 简江, 周娜.不同酶类物质在白酒酿造中的应用研究进展[J].酿酒科技, 2022(12):85-90.JIAN H, JIAN J, ZOU N.Research progress on application of different enzymes in Baijiu brewing[J].Brewing Technology, 2022(12):85-90.
[6] 陈美竹, 邱树毅, 胡宝东, 等.酱香型白酒酿造体系中酵母菌研究进展[J].中国酿造, 2015, 34(6):5-10.CHEN M Z, QIU S Y, HU B D, et al.Research progress of yeast in Moutai-flavor liquor production[J].China Brewing, 2015, 34(6):5-10.
[7] 翁鹏, 张建敏, 彭志云, 等.大曲酶系的研究现状及展望[J].酿酒科技, 2023(6):112-117.WENG P, ZHANG J M, PENG Z Y, et al.Research progress in enzyme system of Daqu[J].Liquor-Making Science &Technology, 2023(6):112-117.
[8] ASHIKARI T, KUNIKASI S I, MATSUMOTO N, et al.Direct fermentation of raw corn to ethanol by yeast transformants containing a modified Rhizopus glucoamylase gene[J].Applied Microbiology and Biotechnology, 1989, 32(2):129-133.
[9] 袁华伟, 赵余, 王玉婷, 等. 高温大曲制曲过程中水解酶系及理化性质的动态变化研究[J].酿酒, 2023, 50(4): 31-36.YUAN H W, ZHAO Y, WANG Y T, et al. Study on the dynamic changes of hydrolytic enzymes and physicochemical properties during the production of Maotai-flavor Daqu[J]. Liquor Making, 2023, 50(4): 31-36.
[10] 范伟业. 宏蛋白质组学解析浓香型大曲酶系组成[D].无锡:江南大学, 2021.FAN W Y.Metaproteomic analysis of enzymatic composition in Nong-flavor Daqu[D].Wuxi:Jiangnan University, 2021.
[11] 赵远玲. 小麦子粒α-淀粉酶活性测定方法的改进[J].黑龙江农业科学, 2010(4):40-43.ZHAO Y L.Improvement of determination method on α-amylase activity in wheat grain[J].Heilongjiang Agricultural Sciences, 2010(4):40-43.
[12] 陈杰, 李豆南, 刘茂强, 等. 产耐高温果胶酶菌株筛选鉴定、产酶条件优化及酶学性质研究[J]. 中国酿造, 2023, 42(5): 176-183.CHEN J, LI D N, LIU M Q, et al. Screening and identification of high-temperature resistant pectinase-producing strains, optimization of enzyme production conditions and enzymatic properties[J]. China Brewing, 2023, 42(5): 176-183.
[13] 王征, 谢达平, 杨虹琦, 等.单宁酶活力测定方法的研究[J].生物技术, 2000, 10(6):40-42.WANG Z, XIE D P, YANG H Q, et al.Studies on mensuration of tannase activity[J].Biotechnology, 2000, 10(6):40-42.
[14] ROUSK J, BÅÅTH E, BROOKES P C, et al.Soil bacterial and fungal communities across a pH gradient in an arable soil[J].The ISME Journal, 2010, 4(10):1340-1351.
[15] NOSSA C W, OBERDORF W E, YANG L Y, et al.Design of 16S rRNA gene primers for 454 pyrosequencing of the human foregut microbiome[J].World Journal of Gastroenterology, 2010, 16(33):4135-4144.
[16] PIRES A C C, CLEARY D F R, ALMEIDA A, et al.Denaturing gradient gel electrophoresis and barcoded pyrosequencing reveal unprecedented archaeal diversity in mangrove sediment and rhizosphere samples[J].Applied and Environmental Microbiology, 2012, 78(16):5520-5528.
[17] WU L Y, WEN C Q, QIN Y J, et al.Phasing amplicon sequencing on Illumina MiSeq for robust environmental microbial community analysis[J].BMC Microbiology, 2015, 15:125.
[18] 杨阳, 禄凌飞, 刘光钱, 等.不同发酵顶温大曲中细菌群落结构的差异性分析[J].食品与发酵工业, 2023, 49(13):70-77.YANG Y, LU L F, LIU G Q, et al.Difference analysis of bacterial community structure in Daqu with different peak temperatures achieved during fermentation[J].Food and Fermentation Industries, 2023, 49(13):70-77.
[19] 陈佩,翟彩宁,刘莹等.白水地区清香型大曲理化指标及真菌多样性分析[J].食品与发酵工业,2024,50(10):197-204.CHEN P,ZHAI C N,LIU Y.Analysis of physicochemical indicators and fungal diversity of fragrant Daqu in Baishui area[J].Food and Fermentation Industry,2024,50(10):197-204.
[20] 冯佳婷, 陆震鸣, 时伟, 等.不同培养温度对大曲微生物群落结构、酶活及挥发性化合物的影响[J].应用与环境生物学报, 2021, 27(3):760-767.FENG J T, LU Z M, SHI W, et al.Effects of different culture temperatures on microbial community structure, enzyme activity, and volatile compounds in Daqu[J].Chinese Journal of Applied and Environmental Biology, 2021, 27(3):760-767.