β-紫罗兰酮(β-ionone),是一种主链由13个碳原子组成的不规则单萜,可由β-胡萝卜素9、10(9’、10’)双键断裂形成[1],广泛存在于各种蔬菜、水果、花卉、谷物和植物油中[2-3]。β-紫罗兰酮是商业价值极高的萜类香精香料,应用于化妆品、香水、食品、饮料和日化用品等行业[4-5];它还具有驱虫、抗癌、抗氧化和抗炎症等生物活性[4, 6-8],在医疗制药行业热度高。
生物合成法具有经济环保和高效快速的优点,开发高效合成萜类化合物的微生物细胞工厂已成为可持续生产萜类化合物的重要研究方向[9]。β-紫罗兰酮的生物合成首先在酿酒酵母中得以实现[10],目前用作β-紫罗兰酮合成的工程菌有大肠杆菌[11-12]、酿酒酵母[10, 13-14]和解脂耶式酵母[15-17]。近期,LU等[16]通过在解脂耶式酵母中引入外源PK-PTA途径,增强乙酰-CoA供给,单元化过表达关键酶,引入PhCCD1突变体PhCCD1K164L,β-紫罗兰酮摇瓶产量达358 mg/L[1.2 mg/(L·h)],3 L发酵罐产量为980 mg/L[2.4 mg/(L·h)],为目前以简单酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)作为发酵培养基的β-紫罗兰酮最高产量。在此基础上,研究者利用面包渣水解液作为碳源,通过两相发酵工艺,β-紫罗兰酮产量高达4 g/L[17]。目前已报道的微生物合成β-紫罗兰酮的文献中,产物合成均在细胞质或细胞质内膜进行。研究发现,利用酵母细胞的亚细胞器可以提高萜类化合物的产量[9],尤其是过氧化物酶和脂滴,是萜类天然产物良好的动态储存场所[18]。
热带假丝酵母具有生物量大、环境耐受力强、底物谱广和富含油脂等优点,目前已应用于二元酸的工业化生产[19]。本课题组已有报道利用热带假丝酵母合成β-胡萝卜素、蛇麻烯、次丹参酮戊二烯、西柏三烯一醇和鼠尾草酸等天然产物[20-21],在萜类物质的合成方面具有极大的潜力。
本研究选用课题组前期构建的β-紫罗兰酮工程菌perPh作为出发菌株,其β-紫罗兰酮合成模块位于过氧化物酶体。首先通过亚细胞区室组合策略,在菌株perPh的细胞质和脂滴表达β-紫罗兰酮合成的关键基因PhCCD1,实现PhCCD1在细胞质、过氧化物酶体和脂滴的共表达,以期增大β-紫罗兰酮代谢通量。然后,对培养基装液量、培养基碳氮比、发酵温度和辅因子Fe2+浓度等摇瓶发酵条件进行优化,以期进一步提升β-紫罗兰酮产量。最后,在5 L发酵罐进行小试生产。
1 材料与方法
1.1 材料
1.1.1 质粒与菌株
本研究所用质粒和菌株见表1。
表1 本研究所用质粒与菌株
Table 1 Main plasmids and strains used in this study

名称特征来源质粒GPH01Ts-GRE3-gda324-URA3-PGAPDH-PhCCD1-TENO1本实验前期构建SGURA3pUC57-ptsgURA3本实验前期构建QLPP2Ts-LPP2-gda324-URA3本实验前期构建QDPP3Ts-DPP3-gda324-URA3本实验前期构建T-ERG7Ts-ERG7本研究pUC57-PhCCD1pUC57-PhCCD1化学合成LPP2-PK164LTs-LPP2-gda324-URA3-PGAPDH-PhCCD1K164L-TENO1本研究DPP3-PH01Ts-DPP3-gda324-URA3-PGAPDH-PhCCD1-HD2-TENO1本研究菌株perPhU208,-ERG10-ERG13-tHMGR-,定位于细胞质;-ERG12-ERG8-ERG19-IDI1,定位于过氧化物酶体;-ERG20-BTS1-carB-carRP-,定位于过氧化物酶体;YURA3/YURA3::-PGAPDH-ANT1-TE-NO1-;-PhCCD1-,定位于过氧化物酶体本实验室保藏perPh-01perPh,ΔURA3本实验室保藏PC-01perPh-01,ΔLPP2::-gda324-URA3-PGAPDH-PhCCD1K164L-TENO1-本研究PC-02PC-01,ΔURA3本研究PCL-01PC-02,ΔDPP3::-gda324-URA3-PGAPDH-PhCCD1-HD2-TENO1-本研究
1.1.2 引物
本研究所用引物见表2。
表2 本研究所用引物
Table 2 Primers used in this study

引物序列(5’-3’)K164L-FCAAATGTTGAGAGCTTTGTTGAAGATCCK164L-RGGATCTTCAACAAAGCTCTCAACATTTGcytPh-FCGCAATTAAAGAATTTAAACACTCGAGAT-GGGTAGAA-AGGAATCCGcytPh-RCGCAATTAAAGAATTTAAACACTCGAGAT-GGGTAGAA-AGGAATCCGguPPT-FGGGTCGGTGTCAAGGTGAATTCAACGTGG-TATGGTTG-TAAGAguPPT-RGCGAAGACCAGACGTGATTAGGTTGGCGCCERG7-FATGTACTATTCTGAAGAGATTGGTCTCCCERG7-RCTACCTCAATGCATCGTCGCCHD2-FCAAGAACAAGCTAAGTTGGGTGGCGGAGG-TAGTATGG-GTACTAACGGTGTCCAAHD2-RTTTACCTCTTTGCAGAAAACTTAAT-TATCGACTAATCCA-CTCATPh-hd2-RTTGGACACCGTTAGTACCCATACTACCTC-CGCCACCCA-ACTTAGCTTGTTCTTGsgLPP2-FCTGTCGATGAAATCTGGCCGGTTT-TAGAGCTAGAAATA-GCsgLPP2-RCGGCCAGATTTCATCGACAGTGCAAGAAC-CGGGAATC-GAAM13-FTGTAAAACGACGGCCAGTM13-RCAGGAAACAGCTATGAC
注:该表为本研究所用引物,由苏州金唯智生物科技有限公司合成。
1.1.3 培养基
基本(minimal methanol,MM)培养基(g/L):葡萄糖20、YNB 6.7、(NH4)2SO4 10;补充培养基(supplemental medium,SM)培养基(g/L):MM培养基,加入尿嘧啶0.06;SM-5-FOA培养基(g/L):SM培养基础上,加入5-氟乳清酸(5-fluoroorotic acid,5-FOA)2;YPD培养基(g/L):葡萄糖20,蛋白胨20,酵母粉10;2 x YPD培养基(g/L):葡萄糖40,蛋白胨40,酵母粉20。固体培养基,均为液体培养基基础上加入质量分数2%琼脂粉。
Y20、Y40、Y60、Y80、Y100培养基:YPD培养基,葡萄糖质量浓度分别为20、40、60、80和100 g/L;2Y40、2Y60、2Y80、2Y100培养基:2 x YPD培养基,葡萄糖质量浓度分别为40、60、80和100 g/L。
1.1.4 药品试剂与仪器设备
正十二烷,阿拉丁生化科技股份有限公司;正己烷、甲醇、乙酸乙酯、乙腈,国药集团化学试剂有限公司;丙酮、盐酸、无水硫酸钠等常用试剂,国药集团化学试剂有限公司;尿嘧啶,上海麦克林生化科技股份有限公司;5-FOA、β-紫罗兰酮标样,上海源叶生物科技有限公司;一步连接试剂盒,南京诺唯赞生物科技股份有限公司。
AL104电子分析天平,瑞士梅特勒-托利多公司;T20 PCR扩增仪,杭州朗基科学仪器有限公司;WD-9403B琼脂糖凝胶水平电泳系统,北京市六一仪器厂;PH-070A干燥箱,杭州汇尔仪器设备有限公司;LC-2050高效液相色谱仪,日本岛津;Exactive GC高分辨气质联用仪,美国赛默飞世尔科技。
1.2 试验方法
1.2.1 整合框的构建
整合框质粒LPP2-PK164L(PhCCD1K164L胞质表达)的构建:以质粒pUC57-PhCCD1为模板,设计引物K164L-F/R在PhCCD1中引入K164L突变点,全质粒PCR扩增后经Dpn Ⅰ消化转入大肠杆菌JM109,培养后提取质粒,经测序验证正确后获得质粒pUC57-PhCCD1K164L;以质粒pUC57-PhCCD1K164L为模板,设计引物cytPh-F/R,PCR扩增后胶回收纯化获得片段-PhCCD1K164L-。将质粒GPH01用Xho Ⅰ和Sac Ⅰ酶切,经胶回收纯化后获得载体片段-TENO1-Ts-GRE3-gda324-URA3-PGAPDH-,将片段-PhCCD1K164L-与该载体片段经一步连接试剂盒连接后转入大肠杆菌JM109,质粒酶切及测序验证正确后获得质粒Ts-GRE3-gda324-URA3-PGAPDH-PhCCD1K164L-TENO1;以该质粒为模板,引物guPPT-F/R,PCR扩增后经胶回收纯化获得片段-PGAPDH-PhCCD1K164L-TENO1-。质粒QLPP2用EcoR Ⅰ酶切纯化后获得片段-DLPP2-Ts-ULPP2-gda324-URA3-,将该片段与片段-PGAPDH-PhCCD1K164L-TENO1-经一步连接试剂盒连接后转入大肠杆菌JM109,质粒酶切验证正确后获得质粒LPP2-PK164L(Ts-LPP2-gda324-URA3-PGAPDH-PhCCD1K164L-TENO1)。
质粒T-ERG7的构建:以热带假丝酵母基因组为模板,设计引物ERG7-F/R,PCR扩增后经纯化获得片段-ERG7-;将该片段与商业化载体T-vector 19(simple)通过TA克隆法连接后转入大肠杆菌JM109,验证正确后获得质粒Ts-ERG7,即T-ERG7。
整合框质粒DPP3-PH01(PhCCD1脂滴表达)的构建:构建方法同上,以下作简要概述。模板T-ERG7,引物HD2-F/R,获得片段-HD2-;模板pUC57-PhCCD1,引物cytPh-F、Ph-hd2-R,获得片段-PhCCD1-;片段-PhCCD1-、片段-HD2-与载体片段-TENO1-Ts-GRE3-gda324-URA3-PGAPDH-连接,获得质粒Ts-GRE3-gda324-URA3-PGAPDH-PhCCD1-HD2-TENO1;以该质粒为模板,引物guPPT-F/R,获得片段-PGAPDH-PhCCD1-HD2-TENO1-。质粒QDPP3,EcoR Ⅰ酶切,获得片段-DDPP3-Ts-UDPP3-gda324-URA3-,该片段与片段-PGAPDH-PhCCD1-HD2-TENO1-连接,获得质粒DPP3-PH01(Ts-DPP3-gda324-URA3-PGAPDH-PhCCD1-HD2-TENO1)。
1.2.2 热带假丝酵母的LiCl转化及基因组的提取
热带假丝酵母LiCl转化法和基因组的提取方法,详见参考文献[20]。
1.2.3 URA3标记基因的环出
使用sgRNA-URA3瞬时表达盒,通过LiCl转化法以及SM-5-FOA平板筛选,得到工程热带假丝酵母URA3缺陷型菌株。具体原理详见参考文献[19]。
1.2.4 摇瓶发酵方法
将热带假丝酵母在YPD固体培养基上平板划线,置于30 ℃恒温培养箱培养48 h,获取单菌落;挑取单菌落接于YPD液体培养基,30 ℃,200 r/min,培养24 h获取种子液;将种子液转接至发酵培养基Y60,初始OD600为0.1,30 ℃,200 r/min,摇瓶培养8 h后添加10%(体积分数)的正十二烷,摇瓶两相发酵96 h。
1.2.5 5 L发酵罐补料分批发酵
将热带假丝酵母在YPD固体培养基上平板划线,置于25 ℃恒温培养箱培养48 h,获取单菌落;挑取单菌落接于YPD液体培养基,25 ℃,200 r/min,培养24 h获取一级种子液;将一级种子液按1%接种量接种至50 mL YPD培养基中,25 ℃,200 r/min,培养至OD600为12~15,获取二级种子液。将二级种子液按照10%的接种量接种至2 L Y60培养基中(3 mmol/L Fe2+,0.5 g/L MgSO4,5 L发酵罐),pH为5.5,通气量为2~4 L/min,25 ℃,转速为200~1 000 r/min,溶氧控制为20%,在培养8 h后添加10%(体积分数)的正十二烷。在葡萄糖浓度低于5 g/L时流加浓度为800 g/L的葡萄糖,控制糖质量浓度在10 g/L左右。72 h后,控制糖质量浓度为5 g/L左右。过程中,用氨水调节pH;分批添加正十二烷,维持有机相体积占比为10%左右。
1.2.6 细胞干重的测量
预先将1.5 mL离心管称重;吸取1 mL发酵液于管中,离心收集菌体;用无菌水清洗菌体3遍;置于65 ℃烘箱,烘干84 h,称重;作差计算,得出细胞干重(dry cell weight,DCW)。
1.2.7 前体β-胡萝卜素的提取与检测分析
β-胡萝卜素的提取及其检测方法详见参考文献[20]。
1.2.8 β-紫罗兰酮的提取与检测分析
摇瓶两相发酵结束后,离心收集上层有机相;在有机相中加入无水硫酸钠,振荡10 min,静置2 h,除水;12 000 r/min,离心5 min,收集有机相,用正己烷适当稀释,0.22 μm有机滤膜过滤,待检测分析。发酵罐由于剧烈搅拌,正十二烷乳化严重,为保证测量值准确,取5 mL样品,加入5 mL水与10 mL正己烷,涡旋振荡10 min,将β-紫罗兰酮重新萃取至正己烷相,再参照上述步骤处理需要检测的样品。
β-紫罗兰酮的检测:采用GC-MS;进样量1 μL;分流比10∶1。检测条件:初始柱温50 ℃,保持1 min;以10 ℃/min的速度升温到160 ℃,再以20 ℃/min的速度升温到230 ℃,保持10 min;进样口温度,250 ℃;离子源温度260 ℃,质谱扫描范围35~350 m/z。β-紫罗兰酮标品纯度为98%,质量浓度为1~50 mg/L。
1.3 数据分析
所有实验均进行3次生物学重复,采用Origin 2019和Adobe Illustrator进行图表绘制。
2 结果与分析
2.1 亚细胞区室组合合成β-紫罗兰酮工程菌构建
前期研究发现,β-胡萝卜素合成模块位于过氧化物酶体,在脂滴中也可以观察到β-胡萝卜素。为了增强β-紫罗兰酮代谢通量,提升β-紫罗兰酮产量,本研究以实验室前期构建的β-紫罗兰酮工程菌perPh为出发菌株(菌株特性见表1)。尝试利用亚细胞区室组合策略,在菌株perPh的细胞质和脂滴表达PhCCD1,构建PhCCD1同时在细胞质、过氧化物酶体和脂滴表达的β-紫罗兰酮工程菌PCL-01(图1-a),更大程度地利用前体β-胡萝卜素。

a-工程菌PCL-01的β-紫罗兰酮合成路径图;b-β-紫罗兰酮产量;c-生物量及前体β-胡萝卜素浓度
图1 亚细胞区室组合合成β-紫罗兰酮
Fig.1 Synthesis of β-ionone by combining subcellular compartments
注:Cytoplasm:细胞质;Peroxisomes:过氧化物酶体;Lipid Droplets:脂滴;Acetyl-CoA:乙酰-辅酶A;Aceto-acetyl-CoA:乙酰-乙酰-辅酶A;HMG-CoA:羟甲基戊二酰辅酶A;Mevalonate:甲羟戊酸;IPP:异戊二烯焦磷酸;DMAPP:二甲基烯丙基焦磷酸;GPP:香叶基焦磷酸;FPP:法尼基焦磷酸;GGPP:香叶基香叶基焦磷酸;β-carotene:β-胡萝卜素;β-ionone:β-紫罗兰酮。
PhCCD1的酶突变体PhCCD1K164L在酿酒酵母[14]和解脂耶式酵母[16]细胞质中均可提升β-紫罗兰酮产量,所以在菌株perPh细胞质引入变体PhCCD1K164L,即用Mlu Ⅰ将质粒LPP2-PK164L线性化后整合至菌株perPh-01基因组,获得工程菌PC-01;环出标记基因URA3后获得菌株PC-02。将质粒DPP3-PH01经Mlu Ⅰ线性化后整合至菌株PC-02基因组,在脂滴引入PhCCD1,获得工程菌PCL-01。初始摇瓶发酵条件参考前期β-胡萝卜素工程菌的发酵条件[20],15 mL Y60,30 ℃,摇瓶发酵96 h,工程菌PCL-01的β-紫罗兰酮产量为152.4 mg/L(图1-b),较出发菌株perPh(101.4 mg/L)增加50%,生物量也未受影响(图1-c),说明关键酶在胞质、过氧化物酶体和脂滴共表达的亚细胞区室组合策略能显著提升β-紫罗兰酮产量。
2.2 摇瓶发酵条件优化
为了获得最佳摇瓶发酵条件,分别对培养基装液量、培养基碳氮比、发酵温度和辅因子Fe2+浓度进行优化,以进一步提升β-紫罗兰酮产量。
2.2.1 培养基装液量的优化
在固定体积的容器内(250 mL锥形瓶),装液量影响溶氧。考察不同体积的Y60培养基条件下,30 ℃,摇瓶发酵96 h,工程菌PCL-01的β-紫罗兰酮产量变化情况。发酵结束后,发酵液体积损失均在2~3 mL,装液量为15、20、25、30、50 mL时,对应的β-紫罗兰酮产量分别为152.4、121.6、62.7、20.2、10.8 mg/L(图2-a),15 mL装液量下β-紫罗兰酮产量最高,故发酵培养基装液量选择15 mL。
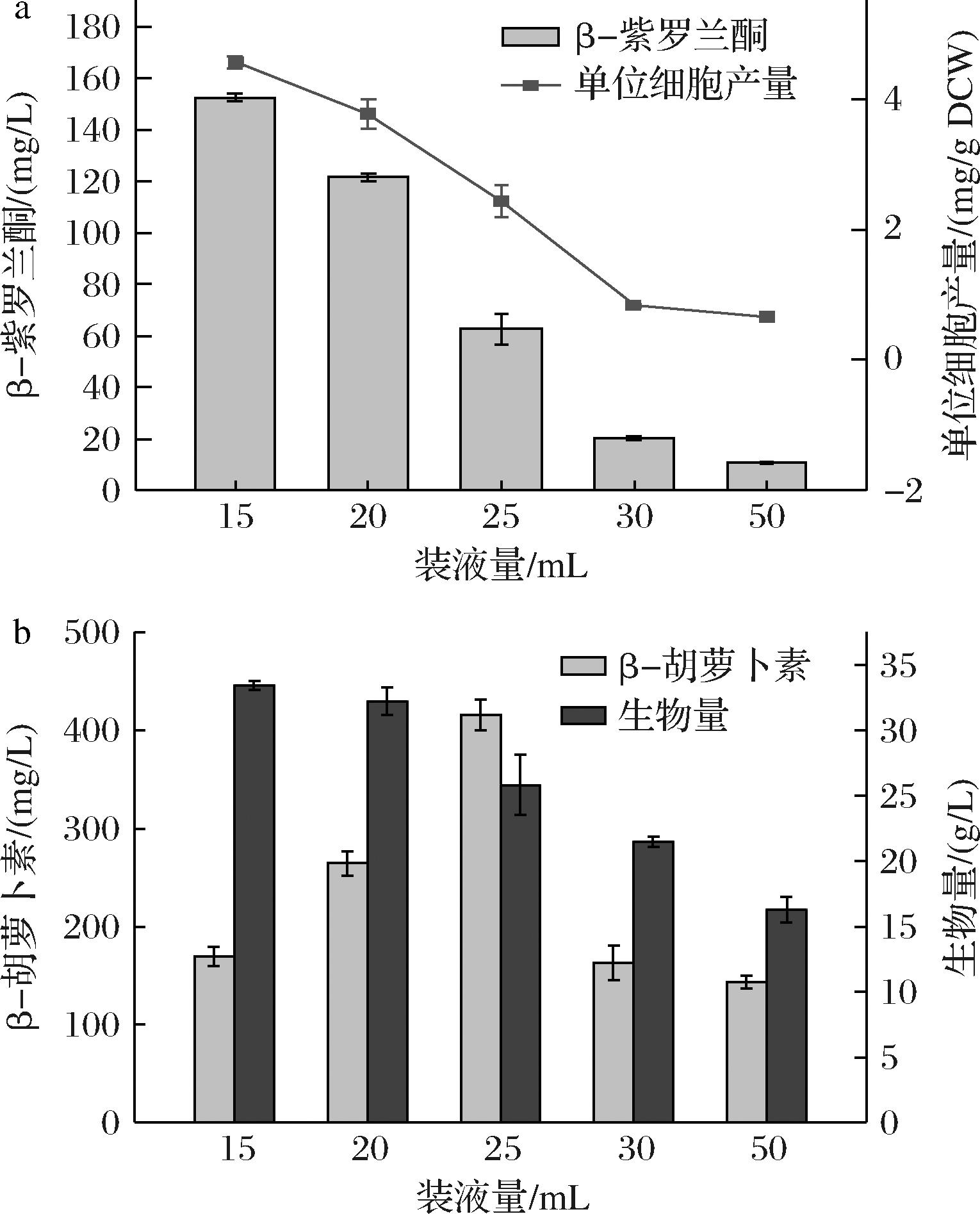
a-不同装液量下β-紫罗兰酮产量;b-不同装液量下菌株生物量及其前体β-胡萝卜素浓度
图2 装液量的优化
Fig.2 Optimization of the liquid loading volume.
2.2.2 培养基碳氮比的优化
研究表明,最优的培养基碳氮比可以大幅提升萜类化合物的产量[16],利用MM亦能高产萜类化合物[22]。本研究比较了两种常见的培养基YPD和2 x YPD中不同碳氮比以及MM培养基条件下工程菌PCL-01的β-紫罗兰酮变化情况,即以YPD为基础的培养基Y20(2∶2)、Y40(4∶2)、Y60(6∶2)、Y80(8∶2)和Y100(10∶2),以2 x YPD为基础的培养基2Y40(4∶4)、2Y60(6∶4)、2Y80(8∶4)和2Y100(10∶4)。
结果表明,Y60和2Y60培养基条件下,β-紫罗兰酮产量较高(图3-a),分别达到152.4 mg/L(4.6 mg/g DCW)和150.7 mg/L(4.3 mg/g DCW),即培养基碳氮比为6∶2和6∶4时,有利于β-紫罗兰酮的生产;Y60较2Y60培养基β-紫罗兰酮产量略高,选择Y60作为后续的发酵培养基。然而,MM培养基中,β-紫罗兰酮产量和生物量均很低(图3-a、图3-c),可能是营养成分不足,难以维持菌株生长,不适合用作热带假丝酵母β-紫罗兰酮的生产。
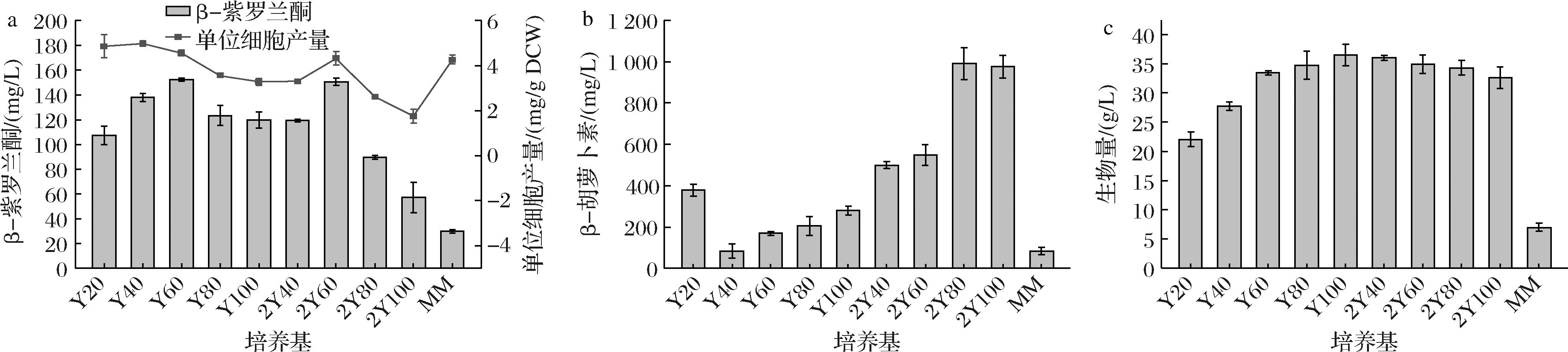
a-β-紫罗兰酮产量;b-前体β-胡萝卜素浓度;c-菌株生物量
图3 培养基碳氮比优化
Fig.3 Optimizing the carbon-to-nitrogen ratio in the culture medium
2.2.3 发酵温度的优化
有研究报道,酿酒酵母[23]和解脂耶式酵母[16]的发酵温度从30 ℃降为20 ℃或者15 ℃时,β-紫罗兰酮的产量分别可提升30%和67%。本研究比较了不同温度下工程菌PCL-01的β-紫罗兰酮合成能力。在15 ℃时,热带假丝酵母生长受到显著抑制(图4-b);25 ℃和30 ℃条件下,β-紫罗兰酮产量分别为155.9 mg/L(4.6 mg/g DCW)、152.4 mg/L(4.5 mg/g DCW)(图4-a),最适合热带假丝酵母β-紫罗兰酮工程菌的产物合成及菌株生长(图4)。考虑到降低温度可减少β-紫罗兰酮及发酵液的挥发,后续选择25 ℃条件下进行摇瓶或发酵罐发酵。
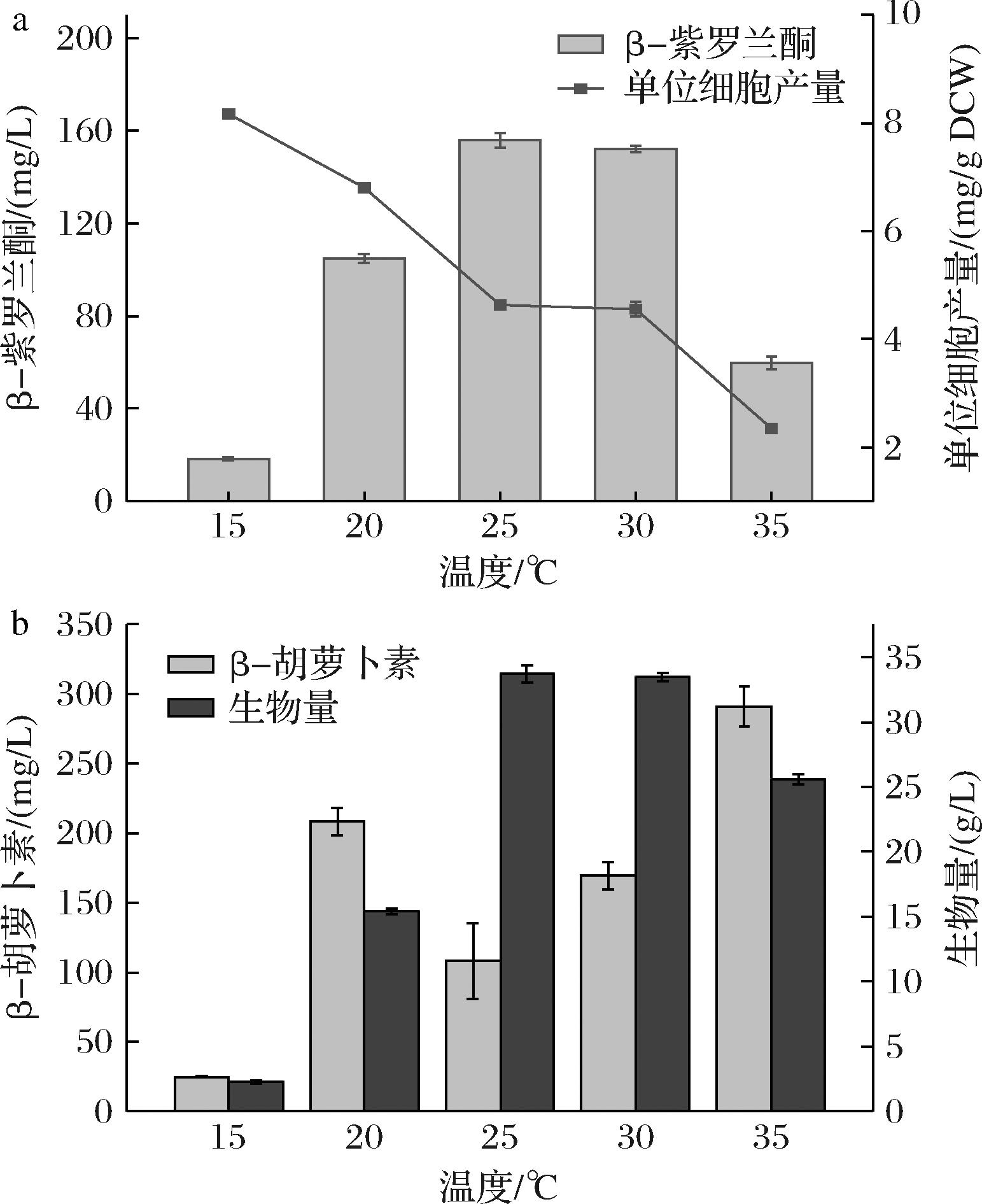
a-β-紫罗兰酮产量;b-菌株生物量及其前体β-胡萝卜素浓度
图4 发酵温度优化
Fig.4 Optimization of fermentation temperature
2.2.4 Fe2+浓度的优化
来源于植物矮牵牛的类胡萝卜素裂解双加氧酶PhCCD1是一种非血红素含铁酶,辅因子为Fe2+[24]。尝试在发酵培养基中添加不同浓度的Fe2+,观察其对菌株PCL-01的β-紫罗兰酮合成是否有影响。15 mL Y60,25 ℃条件下,摇瓶发酵96 h,结果表明,随着Fe2+浓度的升高,生物量和β-胡萝卜素均呈下降趋势(图5-b),推测该离子的添加可能影响了β-胡萝卜素合成的关键酶。在Fe2+浓度为3 mmol/L时,利于β-紫罗兰酮合成,为185.8 mg/L,相较于未添加时(155.9 mg/L)增加19%。

a-β-紫罗兰酮产量;b-菌株生物量及其前体β-胡萝卜素浓度
图5 辅因子Fe2+浓度的优化
Fig.5 Optimizing the concentration of cofactor Fe2+
2.3 5 L发酵罐补料分批发酵
在优化后的发酵条件(15 mL, Y60培养基,3 mmol/L Fe2+,25 ℃)下,工程菌PCL-01摇瓶发酵96 h后,β-紫罗兰酮产量为185.8 mg/L[1.9 mg/(L·h),摇瓶生产强度较此前报道高[16])],相较于未优化之前(2.1节,152.4 mL),提升22%。本研究进一步考察了工程菌PCL-01的5 L发酵罐小试生产。
在第248 h,β-紫罗兰酮产量为403.9 mg/L[1.6 mg/(L·h)],较摇瓶提升117%,说明发酵时间的延长对β-紫罗兰酮的积累有利(图6)。但是,在β-紫罗兰酮积累到一定程度时,菌体生物量后续出现下降趋势(图6),这个现象在此前积累胡萝卜素的工程菌中未见出现[20],推测高浓度的β-紫罗兰酮可能对热带假丝酵母的生长有轻微的抑制作用。
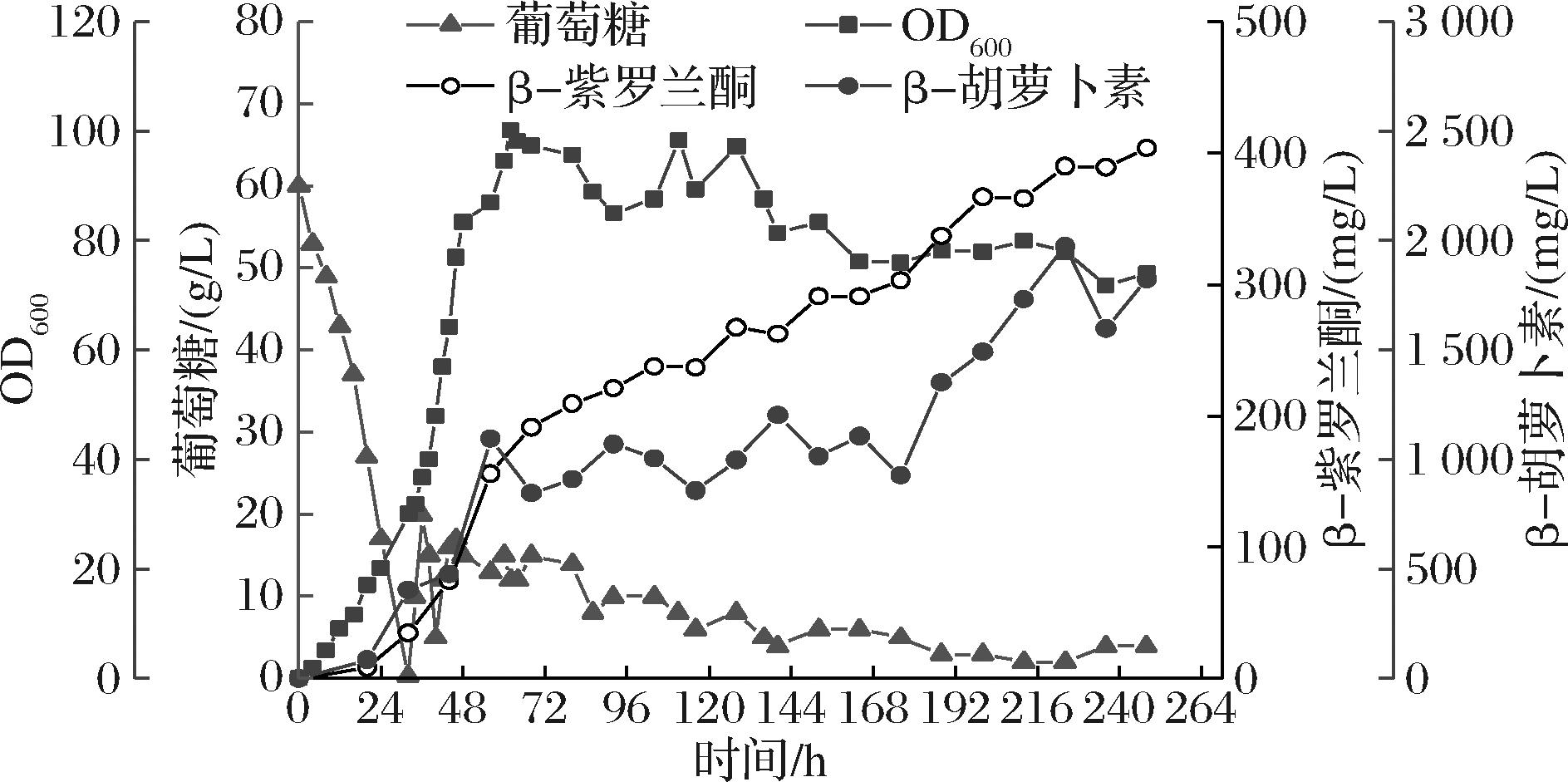
图6 β-紫罗兰酮工程菌PCL-01在5 L发酵罐中的补料分批发酵
Fig.6 The fed-batch fermentation of strain PCL-01 for the β-ionone production in a 5 L bioreactor
3 结论
本研究利用亚细胞器工程改造热带假丝酵母,通过β-紫罗兰酮合成关键酶PhCCD1在细胞质、过氧化物酶体和脂滴的区室组合表达,使得β-紫罗兰酮产量提升50%(152.4 mg/L);经过摇瓶发酵优化,在最佳发酵条件下(15 mL Y60,25 ℃,3 mmol/L Fe2+),工程菌PCL-01的β-紫罗兰酮产量可达185.8 mg/L,较未优化前提升22%;在5 L发酵罐中进行补料分批发酵,第10天时β-紫罗兰酮产量达403.9 mg/L。为了更进一步提升产量,未来可进行菌株的适应性实验室进化、酶的理性改造或定向进化以及发酵工艺优化等。本研究采用的酶的区室组合策略,可增大局部酶浓度以及酶对底物的可及度,从而增强β-紫罗兰酮的合成,这对于其他萜类物质合成的菌株代谢改造具有借鉴意义。本研究进行的发酵优化,亦可为其他菌种发酵性能的研究提供参考。
[1] YAHYAA M, BERIM A, ISAACSON T, et al.Isolation and functional characterization of carotenoid cleavage dioxygenase-1 from Laurus nobilis L.(bay laurel) fruits[J].Journal of Agricultural and Food Chemistry, 2015, 63(37):8275-8282.
[2] NAWADE B, SHALTIEL-HARPAZ L, YAHYAA M, et al.Analysis of apocarotenoid volatiles during the development of Ficus carica fruits and characterization of carotenoid cleavage dioxygenase genes[J].Plant Science:An International Journal of Experimental Plant Biology, 2020, 290:110292.
[3] YAHYAA M, BAR E, DUBEY N K, et al.Formation of norisoprenoid flavor compounds in carrot (Daucus carota L.) roots:Characterization of a cyclic-specific carotenoid cleavage dioxygenase 1 gene[J].Journal of Agricultural and Food Chemistry, 2013, 61(50):12244-12252.
[4] ALOUM L, ALEFISHAT E, ADEM A, et al.Ionone is more than a violet’s fragrance:A review[J].Molecules, 2020, 25(24):5822.
[5] LALKO J, LAPCZYNSKI A, MCGINTY D, et al.Fragrance material review on beta-ionone[J].Food and Chemical Toxicology, 2007, 45(1):S241-S247.
[6] PAPARELLA A, SHALTIEL-HARPAZA L, IBDAH M.β-ionone:Its occurrence and biological function and metabolic engineering[J].Plants, 2021, 10(4):754.
[7] SHI J N, CAO C, XU J Y, et al.Research advances on biosynthesis, regulation, and biological activities of apocarotenoid aroma in horticultural plants[J].Journal of Chemistry, 2020, 2020:2526956.
[8] ANSARI M, EMAMI S.β-Ionone and its analogs as promising anticancer agents[J].European Journal of Medicinal Chemistry, 2016, 123:141-154.
[9] JIN K, XIA H Z, LIU Y F, et al.Compartmentalization and transporter engineering strategies for terpenoid synthesis[J].Microbial Cell Factories, 2022, 21(1):92.[10] BEEKWILDER J, VAN ROSSUM H M, KOOPMAN F, et al.Polycistronic expression of a β-carotene biosynthetic pathway in Saccharomyces cerevisiae coupled to β-ionone production[J].Journal of Biotechnology, 2014, 192(Pt B):383-392.
[11] ZHANG C Q, CHEN X X, LINDLEY N D, et al.A “plug-n-play” modular metabolic system for the production of apocarotenoids[J].Biotechnology and Bioengineering, 2018, 115(1):174-183.
[12] YE L J, ZHU X N, WU T, et al.Optimizing the localization of astaxanthin enzymes for improved productivity[J].Biotechnology for Biofuels, 2018, 11:278.
[13] L PEZ J, BUSTOS D, CAMILO C, et al.Engineering Saccharomyces cerevisiae for the overproduction of β-ionone and its precursor β-carotene[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:578793.
PEZ J, BUSTOS D, CAMILO C, et al.Engineering Saccharomyces cerevisiae for the overproduction of β-ionone and its precursor β-carotene[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:578793.
[14] WERNER N, RAMIREZ-SARMIENTO C A, AGOSIN E.Protein engineering of carotenoid cleavage dioxygenases to optimize β-ionone biosynthesis in yeast cell factories[J].Food Chemistry, 2019, 299:125089.
[15] CZAJKA J J, NATHENSON J A, BENITES V T, et al.Engineering the oleaginous yeast Yarrowia lipolytica to produce the aroma compound β-ionone[J].Microbial Cell Factories, 2018, 17(1):136.
[16] LU Y P, YANG Q Y, LIN Z L, et al.A modular pathway engineering strategy for the high-level production of β-ionone in Yarrowia lipolytica[J].Microbial Cell Factories, 2020, 19(1):49.
[17] CHEN S Y, LU Y P, WANG W, et al.Efficient production of the β-ionone aroma compound from organic waste hydrolysates using an engineered Yarrowia lipolytica strain[J].Frontiers in Microbiology, 2022, 13:960558.
[18] SON S H, PARK G, LIM J, et al.Chain flexibility of medicinal lipids determines their selective partitioning into lipid droplets[J].Nature Communications, 2022, 13(1):3612.
[19] 张利华. 热带假丝酵母遗传操作系统的建立及在二元酸合成中的应用[D].无锡:江南大学, 2016.ZHANG L H.Development of the genetic manipulation system for candida tropicalis and its application in dicarboxylic acid production[D].Wuxi:Jiangnan University, 2016.
[20] 张利华. 热带假丝酵母生产萜类天然产物的系统代谢工程 [D].无锡:江南大学, 2023.ZHANG L H.Systems metabolic engineering of Candida tropicalis for terpenoid production[D].Wuxi:Jiangnan University, 2023.
[21] 霍达, 陈献忠, 杨海泉, 等. 代谢工程改造热带假丝酵母生产鼠尾草酸[J]. 食品与发酵工业, 2024, 50(3): 45-51.HUO D, CHEN X Z, YANG H Q, et al. Metabolic engineering of Candida tropicalis for carnosic acid production[J]. Food and Fermentation Industries, 2024, 50(3): 45-51.
[22] YE M, GAO J Q, ZHOU Y J.Global metabolic rewiring of the nonconventional yeast Ogataea polymorpha for biosynthesis of the sesquiterpenoid β-elemene[J].Metabolic Engineering, 2023, 76:225-231.
[23] L PEZ J, ESSUS K, KIM I K, et al.Production of β-ionone by combined expression of carotenogenic and plant CCD1 genes in Saccharomyces cerevisiae[J].Microbial Cell Factories, 2015, 14:84.
PEZ J, ESSUS K, KIM I K, et al.Production of β-ionone by combined expression of carotenogenic and plant CCD1 genes in Saccharomyces cerevisiae[J].Microbial Cell Factories, 2015, 14:84.
[24] SUI X W, ZHANG J Y, GOLCZAK M, et al.Key residues for catalytic function and metal coordination in a carotenoid cleavage dioxygenase[J].The Journal of Biological Chemistry, 2016, 291(37):19401-19412.