筒鲜鱼是信阳商城风味独特的传统发酵食品,它是以新鲜花鲢为原料,加入盐、花椒、辣椒面、葱丝、姜丝、高度白酒,装入竹筒或砂罐自然条件下短期腌制而成,其鱼肉鲜嫩、芳香可口、味道独特、营养丰富,因此深受广大人民群众的喜爱。目前,筒鲜鱼的加工生产主要采用传统自然发酵的方法,发酵过程的微生物来源主要是新鲜花鲢鱼和发酵环境,这些微生物相互混合、相互作用,参与不同的代谢活动,从而引发鱼肉质地、风味的变化。但参与发酵的微生物群落结构未知且复杂,使得筒鲜鱼的发酵工艺不可控,产品质量稳定性差、安全性低,导致筒鲜鱼生产的产业化难上加难。发酵食品的关键是微生物[1],因此对筒鲜鱼中的微生物菌群和功能性菌进行研究,有利于制备优良发酵剂,进而提高筒鲜鱼的产量和品质、缩短发酵时间、提高其工业化生产的稳定性。
目前,高通量测序技术由于其通量高、准确率高的特点[2],被广泛应用于研究发酵鱼制品中的微生物多样性。吴永祥等[3]通过高通量测序技术比较分析了臭鳜鱼发酵前后的微生物多样性差异,发现发酵前后鳜鱼的菌群组成差异较大,菌群中优势细菌的种类也各不相同。张继辉等[4]对臭鳜鱼发酵过程中的微生物群落变化进行16S高通量测序分析,发现不同发酵时期臭鳜鱼的细菌多样性具有明显差异,可能明显影响鱼风味的形成。在发酵过程中,各种微生物相互作用将发酵原料中的大分子物质代谢分解成易被身体消化吸收的小分子活性物质,从而使得成品的发酵时间、质地、风味、营养含量、香气成分等均发生显著变化[5]。
目前关于筒鲜鱼的报道均是关于其文化底蕴和历史内涵,而尚无对其加工过程中的微生物多样性及品质特性的研究。基于此,本文采用以高通量测序技术为基础的宏基因组测序对筒鲜鱼发酵过程中的微生物菌群的多样性和演替规律进行分析,明确优势菌群,并对其理化性质、质构特性、微观结构进行测定,为明晰筒鲜鱼发酵过程中的生物群落组成及发酵品质变化提供一定理论参考。
1 材料与方法
1.1 材料与试剂
取新鲜花鲢10斤,切成均匀小块,与100 g盐、7.5 g姜丝、25 g粗辣椒面、50 g花椒以及25 g料酒充分混合至鱼肉表面有黏液出现,放入陶罐中并用保鲜膜密封,于4 ℃中发酵。分别取发酵0、1、3、5、7、10、12、15 d的鱼肉编号T0、T1、T3、T5、T7、T10、T12、T15,然后真空密封包装,置于-80 ℃冰箱冷冻保存备用。E.Z.N.A®Mag-Bind® Stool DNA Kit基因组DNA抽提试剂盒,Omega Engineering公司。
NaOH、HNO3、石油醚、乙酸锌,开封开化有限公司。
1.2 仪器与设备
SW-CJ-1D单人单面垂直净化工作台,上海尚道仪器制造有限公司;DHP-260生化培养箱,上海梅香有限公司;TDL-40B高速离心机,上海安亭科学仪器厂;CFX Opus Duet PCR扩增仪,美国伯乐公司;FDE40086FV ULTS -80 ℃冰箱、Qubit 4.0荧光定量仪,美国Thermo Scientific公司;Regulus8100场发射扫描电子显微镜,日立公司;TMS-PRO质构仪,美国FTC公司;ST-04半自动凯氏定氮仪,山东盛泰仪器有限公司;SX-500全自动高压灭菌锅,日本Tomy Digital Biology公司;DYY-11电泳仪,北京市六一生物科技有限公司;FR-980A生物电泳图像分析系统,上海复日科技有限公司;S220超声波DNA破碎仪,美国Covaris公司;Agilent 2100生物分析仪,安捷伦科技有限公司。
1.3 实验方法
1.3.1 筒鲜鱼发酵过程中微生物DNA提取
在无菌超净工作台上操作,使用高温灭菌后的剪刀将不同发酵时期的筒鲜鱼样品剪碎后混合均匀,分别称取0.3 g样品放入2 mL样品管中在组织破碎仪中进行破碎。按照Omega基因组DNA抽提试剂盒的操作说明书对发酵不同时期的筒鲜鱼中的微生物总DNA进行提取,并采用琼脂糖凝胶电泳检测DNA完整性。
1.3.2 宏基因组高通量测序
使用DNA破碎仪对基因组DNA进行片段化,借助DNB-SEQ T7平台完成宏基因组测序。通过Fastp对测序的原始数据进行质量评估,使用megahit进行多样本混合拼接,使用Metawrap组合套件进行分箱,采用Prodigal对拼接结果进行开放阅读框(open reading frame,ORF)预测,并将其翻译为氨基酸序列。使用CD-HIT与bowtie2软件对所有样本中预测出的基因进行非冗余基因集的构建并统计基因在对应样本中的丰度信息。最后使用DIAMOND、hmmscan软件对基因集代表序列与NR、eggNOG、COG、CAZy、SEED等数据库进行比对注释,同时得到各样本中物种的相对丰度。建库测序及数据分析由生工生物工程(上海)股份有限公司完成。
1.3.3 筒鲜鱼发酵过程中理化指标的测定
水分含量的测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》;灰分含量的测定参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》;粗脂肪含量的测定参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》;粗蛋白含量的测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白的测定》;挥发性盐基氮(total volatile basic nitrogen,TVB-N)含量的测定参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》;pH值的测定参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》。
1.3.4 筒鲜鱼发酵过程中质构特性的测定
参考刘婧懿等[6]的方法稍作修改。取大小为2 cm×2 cm×2 cm不同发酵时期的筒鲜鱼样品,在室温下采用TPA模式测定硬度、弹性、内聚性及咀嚼性。仪器参数为P/50探头,量程500 N,弹性形变百分比60%,压缩速率60 mm/min,返回速率60 mm/min,回到样品表面高度为15 mm,压缩间隔时间为2 s。
1.3.5 筒鲜鱼发酵过程中微观结构的测定
参考谢思芸等[7]的方法稍作修改。取大小为1 cm×1 cm×1 cm不同发酵时期的筒鲜鱼样品,脱水冻干后喷金,然后用扫描电子显微镜观察并拍照(500、5 000倍)。
1.3.6 数据处理
所有试验重复3次,结果均以平均值±标准差表示。使用SPSS 26统计分析软件对结果进行处理,采用单因素方差分析中的Duncan多重比较法进行显著性分析;采用Pearson法分析发酵过程中筒鲜鱼理化指标与微生物的相关性。
2 结果与分析
2.1 筒鲜鱼发酵样本的宏基因组测序数据质量评估及质量控制
采用宏基因组测序分析筒鲜鱼发酵过程中的微生物多样性,得到原始数据共28.1 G,去除低质量数据后共获得27.9 G的有效数据用于后续分析。如表1所示,8个样品的所有序列数目为4.28×107~6.94×107条,碱基数目为6.08×109~1.04×1010,平均序列长度为150 bp,Q20比例均在97%以上,Q30比例均在91%以上,GC数量含量为40%~46%,说明宏基因组测序质量合格[8]。
表1 宏基因组测序得到的有效数据的质量信息
Table 1 Quality information of effective data obtained from metagenomic sequencing
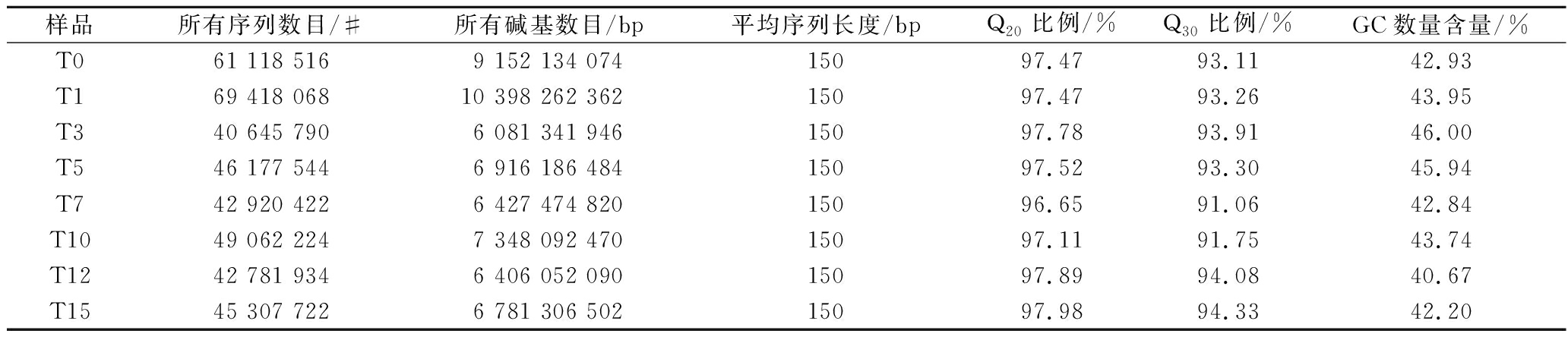
样品所有序列数目/#所有碱基数目/bp平均序列长度/bpQ20比例/%Q30比例/%GC数量含量/%T061 118 5169 152 134 07415097.4793.1142.93T169 418 06810 398 262 36215097.4793.2643.95T340 645 7906 081 341 94615097.7893.9146.00T546 177 5446 916 186 48415097.5293.3045.94T742 920 4226 427 474 82015096.6591.0642.84T1049 062 2247 348 092 47015097.1191.7543.74T1242 781 9346 406 052 09015097.8994.0840.67T1545 307 7226 781 306 50215097.9894.3342.20
2.2 筒鲜鱼发酵过程中微生物群落的α多样性分析
由表2可知,所有样本的覆盖率均大于0.97,本次测序的覆盖率较高,测序结果真实有效[9]。T12的Chao1指数和ACE指数高于其余发酵时期的样品,说明筒鲜鱼发酵第12天时,其中的物种丰富度最高[10]。发酵第10天的筒鲜鱼中Shannon指数最高,说明筒鲜鱼发酵至第10天时,样品的生物多样性最高[11]。筒鲜鱼发酵不同阶段的微生物多样性及群落丰度有一定差异,因此微生物菌落在发酵过程中处于动态平衡。
表2 筒鲜鱼发酵过程中微生物群落α多样性分析
Table 2 α-Diversity statistics of microbial community of Tongxian fish during the fermentation process
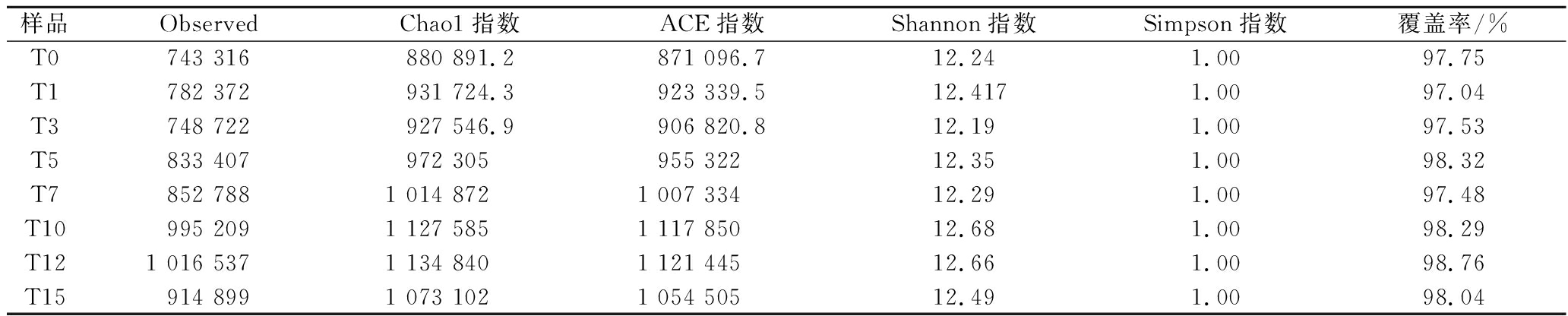
样品ObservedChao1指数ACE指数Shannon指数Simpson指数覆盖率/%T0743 316880 891.2871 096.712.241.0097.75T1782 372931 724.3923 339.512.4171.0097.04T3748 722927 546.9906 820.812.191.0097.53T5833 407972 305955 32212.351.0098.32T7852 7881 014 8721 007 33412.291.0097.48T10995 2091 127 5851 117 85012.681.0098.29T121 016 5371 134 8401 121 44512.661.0098.76T15914 8991 073 1021 054 50512.491.0098.04
2.3 筒鲜鱼发酵过程中微生物菌群落结构分析
2.3.1 基于门水平微生物群落结构分析
对所得序列进行物种分类注释,共注释得到23个门、47个纲、100个目、193个科、443个属、2 946个种的微生物。如图1所示,基于门水平分析,不同发酵时期的筒鲜鱼菌群主要分布在变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和放线菌门(Actinobacteria)3个门中,其中Proteobacteria在发酵过程中一直是优势菌门,其相对丰度均在77%以上。未发酵时样品中Proteobacteria及Actinobacteria是优势菌属,相对丰度分别为89.53%、10.08%。随着发酵时间的延长,Actinobacteria相对丰度呈下降趋势,在第15天降为0.82%,Firmicutes的相对丰度在第5天增长至18.94%,然后飞降至平稳,在发酵第15天达到4.14%。
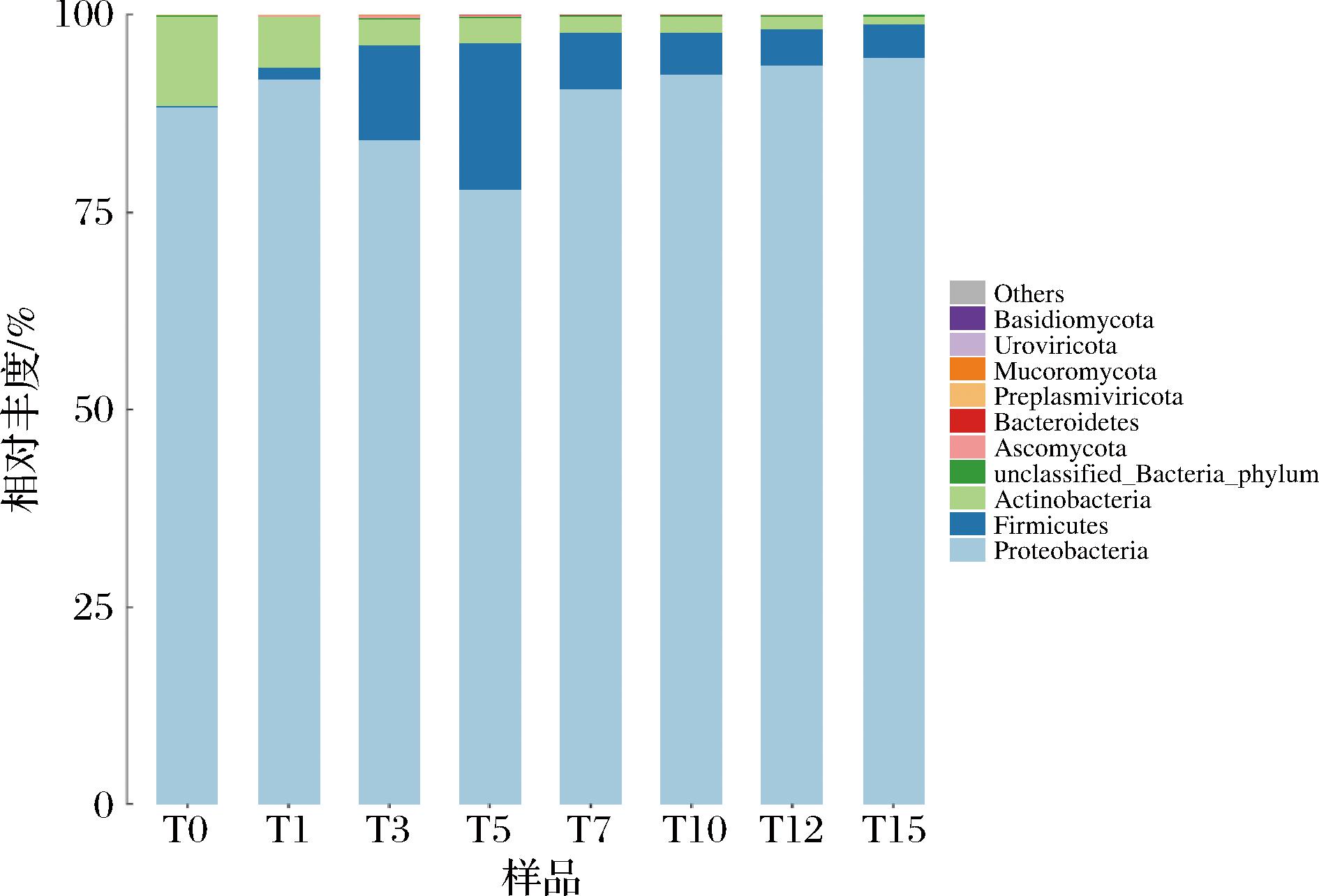
图1 基于门分类水平上的不同发酵时期筒鲜鱼菌群分布图
Fig.1 Distribution of Tongxian fish microorganisms at different fermentation stages on phylum level
2.3.2 基于属水平微生物群落结构分析
如图2所示,基于属水平分析,不同发酵时期筒鲜鱼的筒鲜鱼菌群主要分布在假单胞菌属(Pseudomonas)、嗜冷杆菌属(Psychrobacter)、不动杆菌属(Acinetobacter)、尤因氏菌属(Ewingella)、克雷伯菌属(Klebsiella)、拉恩氏菌属(Rahnella)、分枝杆菌属(Mycobacterium)、葡萄球菌属(Staphylococcus)、沙雷氏菌属(Serratia)、泛菌属(Pantoea)10个属中。
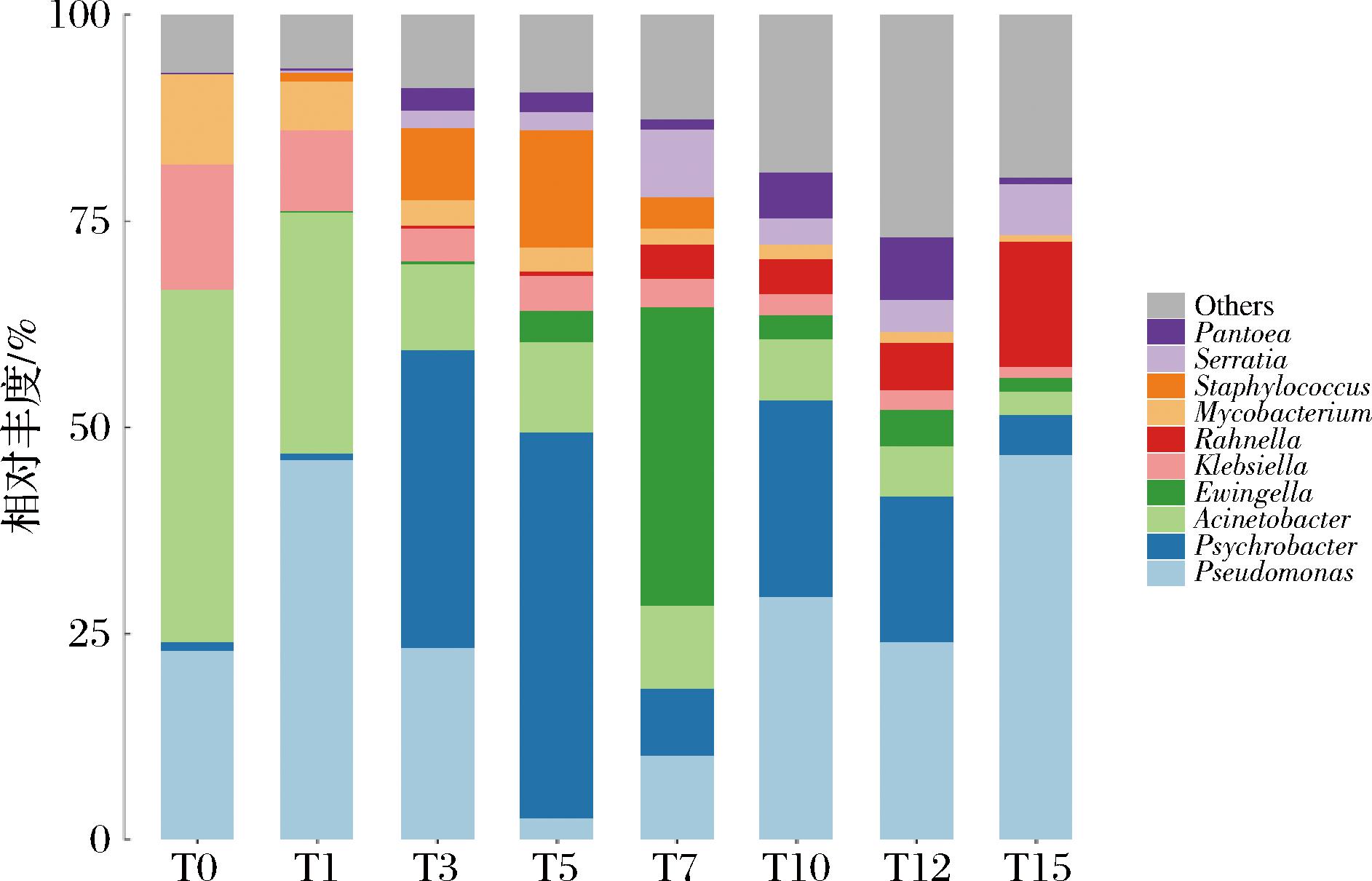
图2 基于属分类水平上的不同发酵时期筒鲜鱼菌群分布图
Fig.2 Distribution of Tongxian fish microorganisms at different fermentation stages on genus level
未发酵的样品中Acinetobacter及Pseudomonas是优势菌属,分别占41.01%和19.82%。发酵第1天,Pseudomonas及Acinetobacter的相对丰度分别为47.14%、29.04%,是当前发酵时间的优势菌属。在发酵3~5 d时,Pseudomonas相对丰度持续降低,至第5天相对丰度已经降至2.48%。Psychrobacter的相对丰度则是持续增长,并于发酵第5天达到47.59%,成为相对丰度最高的优势菌属。发酵第7天,菌群相对丰度发生剧烈变化,Ewingella相对丰度突增至36.79%,成为优势菌属。在接下来的发酵过程中,原本相对丰度降低的Pseudomonas再次上升,并于发酵第15天增至46.68%,成为相对丰度最高的优势菌属。推测在发酵开始后,原本相对丰度占比较大的Pseudomonas迅速生长繁殖成为前期的优势菌属,Acinetobacter作为弱致腐败菌而被强致腐败菌的Pseudomonas抑制,相对丰度持续降低。而Psychrobacter则因为Pseudomonas进行生命活动产生的大量营养物质而迅速生长。在发酵中期,Acinetobacter和Psychrobacter压制了Pseudomonas的生长,使其相对丰度降至最低。而在失去了Pseudomonas的压制后,Ewingella开始生长繁殖,并在发酵第7天成为优势菌属。Ewingella作为肠道细菌,其生命活动产生了大量营养物质[12]。同时,在发酵后期,Pseudomonas不再受到Psychrobacter和Acinetobacter的抑制,迅速生长繁殖成为优势菌群。在发酵后期,发酵环境中氧气稀少,只有Pseudomonas这种兼性厌氧型杆菌才能正常进行生命活动[13],这也是Pseudomonas能够在发酵后期保持优势菌属的原因之一。张继辉等[4]研究发现臭鳜鱼发酵初期,Psychrobacter和红球菌属(Rhodococcus)为优势菌属,Psychrobacter在发酵的第6天比例大幅度上升,与本研究结果类似。
2.3.3 基于种水平微生物群落结构分析
如图3所示,基于种水平分析,不同发酵时期筒鲜鱼的筒鲜鱼菌群明显优势种为鲍曼不动杆菌(Acinetobacter baumannii)、美洲尤因氏菌(Ewingella americana)、克雷白杆菌(Klebsiella pneumoniae)、结核分枝杆菌(Mycobacterium tuberculosis)、莓实假单胞菌(Pseudomonas fragi)、热杀索丝菌(Brochothrix thermosphacta)、霍氏肠杆菌(Enterobacter hormaechei)、成团泛菌(Pantoea agglomerans)。
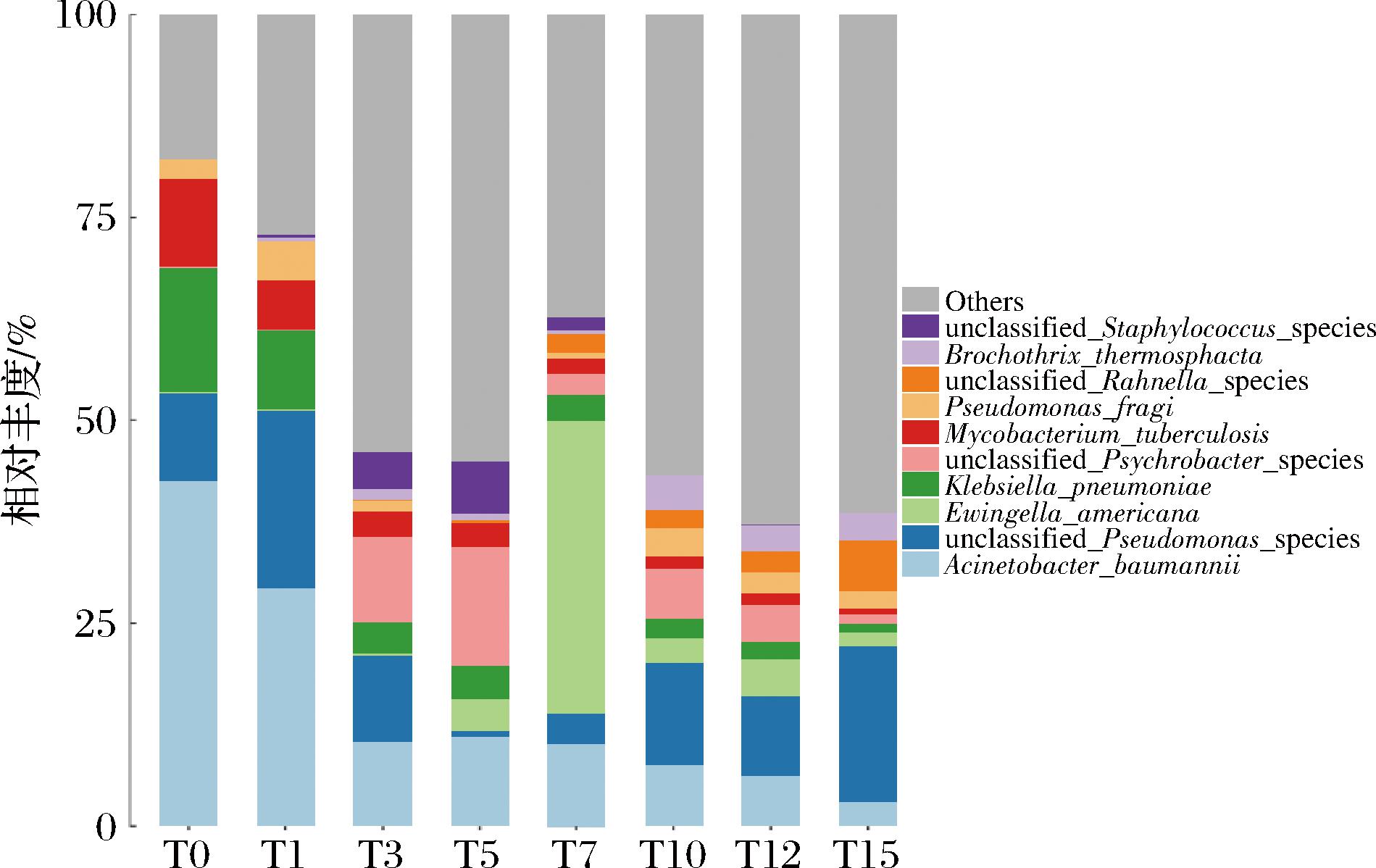
图3 基于种分类水平上的不同发酵时期筒鲜鱼菌群分布图
Fig.3 Distribution of Tongxian fish microorganisms at different fermentation stages on species level
与属水平类似的是,未发酵样品中A. baumannii、K. pneumoniae及M. tuberculosis为优势菌,相对丰度分别为42.15%、15.65%、9.72%。发酵过程中A. baumannii相对丰度持续降低,发酵第7天,E. americana相对丰度突增至39.79%,发酵中后期优势种数目更多且分布较均一。需要指出的是,由于种水平上菌种遗传同源性高、差异小,诸多种水平注释并不能与现有菌种库匹配,因此完全无法分类的种亦占一定比例。
2.4 筒鲜鱼发酵过程中理化性质分析
2.4.1 理化特性分析
由表3可知,随着发酵时间的延长,鱼肉的水分含量、粗脂肪含量、粗蛋白含量、pH值呈显著下降趋势(P<0.05)。这可能是由于食盐的扩散渗透作用使得盐分不断渗入的同时水分不断渗出,因而水分含量降低。同时发酵中微生物产生酶的作用使得脂肪和蛋白质分解为小分子物质,导致其含量降低。鱼肉中的糖被微生物发酵后会分解成乳酸,造成酸碱度降低[14]。
表3 不同发酵时期筒鲜鱼理化性质统计
Table 3 Statistics of physicochemical properties of Tongxian fish at different fermentation periods
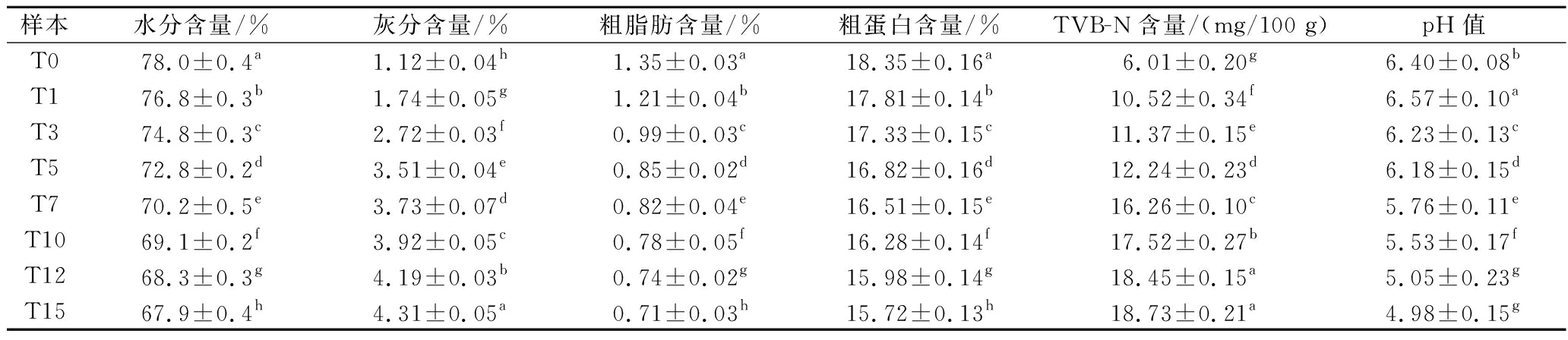
样本水分含量/%灰分含量/%粗脂肪含量/%粗蛋白含量/%TVB-N含量/(mg/100 g)pH值T078.0±0.4a1.12±0.04h1.35±0.03a18.35±0.16a6.01±0.20g6.40±0.08bT176.8±0.3b1.74±0.05g1.21±0.04b17.81±0.14b10.52±0.34f6.57±0.10aT374.8±0.3c2.72±0.03f0.99±0.03c17.33±0.15c11.37±0.15e6.23±0.13cT572.8±0.2d3.51±0.04e0.85±0.02d16.82±0.16d12.24±0.23d6.18±0.15dT770.2±0.5e3.73±0.07d0.82±0.04e16.51±0.15e16.26±0.10c5.76±0.11eT1069.1±0.2f3.92±0.05c0.78±0.05f16.28±0.14f17.52±0.27b5.53±0.17fT1268.3±0.3g4.19±0.03b0.74±0.02g15.98±0.14g18.45±0.15a5.05±0.23gT1567.9±0.4h4.31±0.05a0.71±0.03h15.72±0.13h18.73±0.21a4.98±0.15g
注:表中小写字母不同表示差异显著(P<0.05)(下同)。
发酵过程中,鱼肉的灰分含量、TVB-N含量呈显著上升趋势(P<0.05)。筒鲜鱼发酵过程中伴随着盐分含量的增长,导致其灰分含量增加。TVB-N是衡量发酵鱼新鲜程度的一个指标。随着发酵时间的延长,筒鲜鱼鱼肉中TVB-N含量整体呈上升趋势,新鲜花鲢的TVB-N含量6.01 mg/100 g,发酵15 d后为18.73 mg/100 g,显著增长(P<0.05)约3倍。这主要是因为微生物在发酵时加速了鱼肉蛋白质的分解,引起其含量升高,从而降低了产品的新鲜度[15]。张子一[15]研究臭鲈鱼和臭鳜鱼发酵7 d后鱼肉中TVB-N含量为106.80、86.62 mg/100 g,显著高于筒鲜鱼中TVB-N含量(P<0.05),这可能是因为发酵方式不同和鱼类选择不同导致。参考T/MDSZ 006—2022《腌鱼》中规定亚硝酸盐含量≤25 mg/100 g,建议筒鲜鱼发酵时间不宜过长。
2.4.2 筒鲜鱼发酵过程中理化特性与微生物相关性分析
已有许多研究表明发酵食品微生物群落与其理化指标具有一定的相关性。孙海鑫等[16]研究表明乳杆菌属、哈萨克斯坦酵母属与自然发酵酸鱼中的氨基酸态氮呈正相关,而与TVB-N、丙二醛、组胺和尸胺均呈负相关。吴永祥等[3]研究发现,漫游球菌属与臭鳜鱼的pH值、粗蛋白含量呈显著负相关(P<0.05),假单胞菌属、肉杆菌属、沙雷氏菌属和乳杆菌属与pH值呈显著正相关(P<0.05)。漫游球菌属与可溶性多肽、可溶性总糖含量呈显著正相关(P<0.05)。本研究对筒鲜鱼发酵过程中的理化指标与微生物变化(基于种水平)进行Pearson法相关性分析,结果如表4所示。Acinetobacter baumanni、Enterobacter hormaechei、Klebsiella pneumoniae和Mycobacterium tuberculosis与灰分含量和TVB-N含量呈极显著负相关(P<0.01),与水分含量、粗脂肪含量、粗蛋白含量呈极显著正相关(P<0.01),与pH值呈显著正相关(P<0.05)。Brochothrix thermosphacta与水分含量、粗脂肪含量、粗蛋白含量、和pH值呈显著负相关(P<0.05),与灰分含量、TVB-N含量呈显著正相关(P<0.05)。推断在发酵过程中Brochothrix thermosphacta能合成脂肪酶和蛋白酶等,促进了脂肪与蛋白的分解,致使发酵后粗脂肪含量和粗蛋白含量下降[17]。结果揭示了筒鲜鱼发酵过程中理化指标与部分微细菌群落呈现显著相关性,而细菌群落代谢的复杂酶体系可能是引起发筒鲜鱼发酵过程中理化性质变化的主要原因。
表4 理化指标和微生物相关性分析
Table 4 Correlation analysis between physicochemical indexes and bacterial genera in Tongxian fish
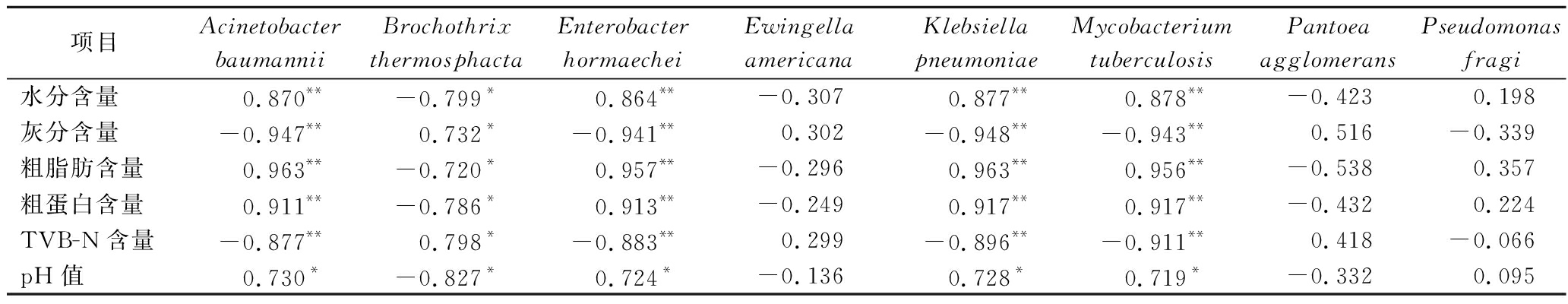
项目Acinetobacter baumanniiBrochothrix thermosphactaEnterobacter hormaecheiEwingella americanaKlebsiella pneumoniaeMycobacterium tuberculosisPantoea agglomeransPseudomonas fragi水分含量 0.870**-0.799* 0.864**-0.307 0.877** 0.878**-0.423 0.198灰分含量-0.947**0.732*-0.941**0.302-0.948**-0.943**0.516-0.339粗脂肪含量0.963**-0.720*0.957**-0.2960.963**0.956**-0.5380.357粗蛋白含量0.911**-0.786*0.913**-0.2490.917**0.917**-0.4320.224TVB-N含量-0.877**0.798*-0.883**0.299-0.896**-0.911**0.418-0.066pH值0.730*-0.827*0.724*-0.1360.728*0.719*-0.3320.095
注:*表示在0.05水平上具有显著性;**表示在0.01水平上具有显著性。
2.5 筒鲜鱼发酵过程中质构特性分析
如表5所示,随着发酵时间的延长,筒鲜鱼的硬度、弹性、咀嚼性、内聚性变化趋势基本一致,即先下降后持续上升,黏附性则是一直保持上升趋势,并具有显著性差异(P<0.05)。发酵至第3天,微生物初始活动导致蛋白质降解,细胞间组织密度松软,使得鱼肉的硬度、内聚性和咀嚼性的下降[18]。而后随着食盐的进一步渗入而导致鱼肉水分流失,使得硬度开始持续上升。且筒鲜鱼样品鱼肉组织由于发酵过程中的微生物及酶的活动,组织重新变得紧密完整,弹性也开始持续增高。同时,鱼肉的肌球蛋白、肌动蛋白和肌动球蛋白等盐溶蛋白逐渐溶解,筒鲜鱼的内聚性持续增大,从而促进了咀嚼性的增大[19]。而在发酵后期假单胞菌属再次成为优势菌属后,内聚性开始降低,硬度、弹性以及咀嚼性增幅降低。假单胞菌属这种嗜冷微生物拥有较强的生物黏附能力,同时,在整个发酵过程中,假单胞菌属都有不小的相对丰度,因此筒鲜鱼样品的黏附性持续上升。
表5 不同发酵时期筒鲜鱼质构特性比较
Table 5 Comparison of texture characteristics of Tongxian fish at different fermentation periods
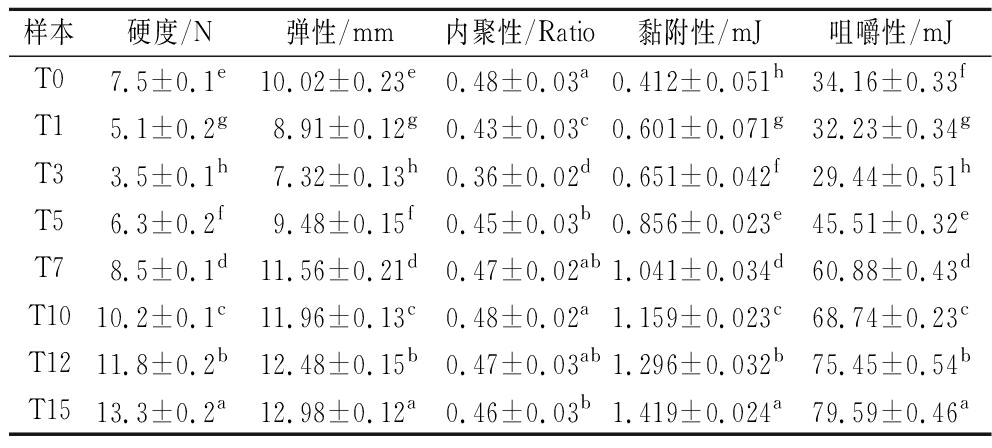
样本硬度/N弹性/mm内聚性/Ratio黏附性/mJ咀嚼性/mJT07.5±0.1e10.02±0.23e0.48±0.03a0.412±0.051h34.16±0.33fT15.1±0.2g8.91±0.12g0.43±0.03c0.601±0.071g32.23±0.34gT33.5±0.1h7.32±0.13h0.36±0.02d0.651±0.042f29.44±0.51hT56.3±0.2f9.48±0.15f0.45±0.03b0.856±0.023e45.51±0.32eT78.5±0.1d11.56±0.21d0.47±0.02ab1.041±0.034d60.88±0.43dT1010.2±0.1c11.96±0.13c0.48±0.02a1.159±0.023c68.74±0.23cT1211.8±0.2b12.48±0.15b0.47±0.03ab1.296±0.032b75.45±0.54bT1513.3±0.2a12.98±0.12a0.46±0.03b1.419±0.024a79.59±0.46a
2.6 筒鲜鱼发酵过程中微观结构分析
通过扫描电镜对发酵0、6、12 d筒鲜鱼的微观结构进行观察,如图4所示。

a-×5 000 第0天;b-×5 000 第6天;c-×5 000 第12天;d-×500 第0天;e-×500 第6天;f-×500 第12天
图4 筒鲜鱼在发酵过程中的SEM图
Fig.4 SEM photograph of Tongxian fish at different fermentation periods
经发酵处理后,筒鲜鱼的组织结构形态发生了明显变化。首先鱼体表面呈现出明显的干枯、失水现象,并呈现出褶皱和卷曲的特点。其次,肌肉纤维之间的距离也随着增加而增大。研究发现,在发酵过程中,鱼肉中的一些组分,如蛋白、脂肪等,都会产生一定程度的降解,进而影响鱼肉的质量。发酵前后扫描电镜观察结果和实验研究的水分含量,硬度具有一定的相关性,扫描电镜图像从微观角度进一步验证了发酵对筒鲜鱼质构特性的影响。
3 结论与讨论
本文通过高通量宏基因组测序技术对筒鲜鱼发酵过程中的微生物菌群组成及变化进行分析,明确优势菌群,并对其发酵过程中的理化指标、质构特性及微观结构进行表征。结果表明,发酵第10天微生物物种总数较多、生物多样性最高。在发酵过程中,Pseudomonas和Acinetobacter在未发酵及发酵第1天属于优势菌属;发酵3~5 d,Psychrobacter是唯一优势菌属;发酵第7天,Ewingella成为唯一优势菌属;发酵第10~15天,Pseudomonas为优势菌属。发酵后筒鲜鱼的理化指标、质构特性及微观结构都发生显著变化,鱼肉的水分含量、粗脂肪含量、粗蛋白含量、pH值显著下降(P<0.05),灰分含量、TVB-N含量显著上升(P<0.05)。硬度、弹性、咀嚼性、内聚性先下降后持续上升,而黏附性则是一直保持上升趋势。发酵后筒鲜鱼鱼肉表面呈现出明显的干枯、失水现象,并呈现出褶皱和卷曲的特点,肌肉纤维之间的距离也随着增加而增大。通过分析理化指标与微生物菌群相关性发现,菌群的种类和丰度与筒鲜鱼发酵过程中的理化指标有显著相关性,其中影响较为明显的是Acinetobacter baumanni、Enterobacter hormaechei、Klebsiella pneumoniae、Brochothrix thermosphacta和Mycobacterium tuberculosis。
本研究阐明了筒鲜鱼发酵过程中优势菌群的变化,以及筒鲜鱼理化指标、质构特性及微观结构的差异和微生物菌群的一定相关性,研究结果可为进一步认识筒鲜鱼的微生物群落结构组成和相应品质变化提供一定理论参考,同时也可为筒鲜鱼的深加工及综合开发利用提供可能性。
[1] 沈颖莹. 发酵鳜鱼食品加工工艺与品质控制技术研究[D].舟山:浙江海洋大学, 2021.SHEN Y Y.Study on food processing and quality control technology of fermented mandarin fish[D].Zhoushan:Zhejiang Ocean University, 2021.
[2] 张慧林, 王永胜, 李冲伟.传统发酵豆酱的微生物群落结构和游离氨基酸组成及其相关性分析[J].食品科学, 2019, 40(14):192-197.ZHANG H L, WANG Y S, LI C W.Correlation between microbial community structure and free amino acid composition of traditional fermented soybean paste[J].Food Science, 2019, 40(14):192-197.
[3] 吴永祥, 王婷婷, 张梦婷, 等.徽州臭鳜鱼微生物多样性、品质特性及其酶解产物抗氧化能力分析[J].食品科学, 2021, 42(2):128-134.WU Y X, WANG T T, ZHANG M T, et al.Microbial diversity and quality characteristics of Huizhou stinky mandarin fish and antioxidant activity of its enzymatic hydrolysates[J].Food Science, 2021, 42(2):128-134.
[4] 张继辉, 赵丹丹, 张爽.徽州臭鳜鱼发酵过程中微生物多样性分析[J].绵阳师范学院学报, 2023, 42(5):61-67.ZHANG J H, ZHAO D D, ZHANG S.Microbial diversity analysis of Huizhou stinky mandarin fish during fermentation[J].Journal of Mianyang Teachers’ College, 2023, 42(5):61-67.
[5] 吴燕燕, 陈茜, 王悦齐, 等.传统发酵水产品微生物群落与品质相关性的研究进展[J].水产学报, 2021, 45(7):1248-1258.WU Y Y, CHEN Q, WANG Y Q, et al.Advances in research on the correlation between microbial community and quality of traditional fermented aquatic products[J].Journal of Fisheries of China, 2021, 45(7):1248-1258.
[6] 刘婧懿, 赵前程, 程少峰, 等.鱼肉质构的影响因素及测定方法研究进展[J].食品安全质量检测学报, 2020, 11(9):3035-3043.LIU J Y, ZHAO Q C, CHENG S F, et al.Research progress on the influencing factors and determination methods of fish muscle texture[J].Journal of Food Safety &Quality, 2020, 11(9):3035-3043.
[7] 谢思芸, 李怡菲, 罗丹娴, 等.真空腌制过程中鱼肉水分迁移和组织结构变化规律研究[J].食品研究与开发, 2021, 42(14):1-7.XIE S Y, LI Y F, LUO D X, et al.Studies of water migration and tissue structure changes in fish during the vacuum curing process[J].Food Research and Development, 2021, 42(14):1-7.
[8] KEISAM S, ROMI W, AHMED G, et al.Quantifying the biases in metagenome mining for realistic assessment of microbial ecology of naturally fermented foods[J].Scientific Reports, 2016, 6:34155.
[9] 马肖肖. 高通量测序分析不同酒糟鱼中微生物菌群多样性及其功能预测[D].南昌:江西科技师范大学, 2020.MA X X.High throughput sequencing analysis of microbial flora diversity and functional prediction in different vinasse fishs[D].Nanchang:Jiangxi Science and Technology Normal University, 2020.[10] WU L J, LI F, RAN L S, et al.Insight into the effects of nisin and cecropin on the oral microbial community of rats by high-throughput sequencing[J].Frontiers in Microbiology, 2020, 11:1082.
[11] HU Y Y, WANG H, KONG B H, et al.The succession and correlation of the bacterial community and flavour characteristics of Harbin dry sausages during fermentation[J].LWT, 2021, 138:110689.
[12] JIA S L, HUANG Z, LEI Y T, et al.Application of Illumina-MiSeq high throughput sequencing and culture-dependent techniques for the identification of microbiota of silver carp (Hypophthalmichthys molitrix) treated by tea polyphenols[J].Food Microbiology, 2018, 76:52-61.
[13] 臧金红. 酸鱼发酵过程中特征风味形成与微生物的关系研究[D].无锡:江南大学, 2020.ZANG J H.Study on the relationship between characteristic flavors formation and microorganisms in Suanyu fermentation[D].Wuxi:Jiangnan University, 2020.
[14] 刘冬敏, 王建辉, 刘永乐, 等.草鱼肌肉脂肪酸组成及其在冷藏中的含量变化[J].食品科学, 2013, 34(2):194-198.LIU D M, WANG J H, LIU Y L, et al.Changes in fatty acid composition during cold storage of fresh grass carp muscle[J].Food Science, 2013, 34(2):194-198.
[15] 张子一. “臭鲈鱼”发酵过程中肌肉品质的变化规律研究[D].武汉:华中农业大学, 2021.ZHANG Z Y.Research on the change regularity of muscle quality during fermentation of stinkty bass[D].Wuhan:Huazhong Agricultural University, 2021.
[16] 孙海鑫, 陈力, 石文琪, 等.自然发酵酸鱼中微生物群落多样性与理化性质分析[J].食品研究与开发, 2023, 44(12):187-195.SUN H X, CHEN L, SHI W Q, et al.Analysis of microbial community diversity and physicochemical properties of naturally fermented Suanyu[J].Food Research and Development, 2023, 44(12):187-195.
[17] 贺永玲, 杨松, 闫晓明, 等.鳜鱼发酵过程营养物质动态变化[J].食品工业, 2016, 37(2):73-76.HE Y L, YANG S, YAN X M, et al.Research on the dynamic change of nutrient during the mandarin fish fermentation process[J].The Food Industry, 2016, 37(2):73-76.
[18] 武文玉, 丁丽丽, 白凤翎, 等.鲅鱼香肠发酵过程中凝胶特性、微生物群落和风味物质的演替规律[C].中国食品科学技术学会第十九届年会论文摘要集.北京:中国食品科学技术学会, 2022.WU W Y, DING L L, BAI F L, et al.The succession law of gel characteristics, microbial community and flavor substances during fermentation of Spanish mackerel sausage[C].Abstracts of the 19th Annual Meeting of CIFST.Beijing:CIFST, 2022.
[19] MØRETRØ T, MOEN B, HEIR E, et al.Contamination of salmon fillets and processing plants with spoilage bacteria[J].International Journal of Food Microbiology, 2016, 237:98-108.