Pickering乳液是利用超细颗粒吸附在两相界面而代替传统乳化剂稳定的乳液,具有长期的乳化稳定性[1]。食品级Pickering乳液通过天然大分子原料如蛋白质、多糖等自组装形成刚性且多孔的纳米粒子,降低界面处的流动性,提供更厚的屏障。常用于负载疏水活性成分,如油溶性维生素和营养素等[2],与其他体系相比具有可食用安全性、高吸收率等优点[3],在活性物质的封装、释控和靶向释放方面具有显著优势[4]。
可生物降解的玉米醇溶蛋白(zein)是一种疏水性蛋白质,可溶于乙醇,利用这一特性通过反溶剂沉淀法制备zein纳米颗粒[5]。然而,zein纳米颗粒的高表面疏水性导致无法很好地吸附在油滴表面而单独用于形成和稳定Pickering乳液[6]。有关研究表明,将zein与多糖、多酚等物质结合,能够显著提高其形成Pickering乳液的能力[7]。层层组装(layer-by-layer self-assembly,LBL)和复合组装(directly mixing,DM)是基于多糖、蛋白添加顺序不同的乳液构建方式,二者在界面层的厚度和体系的致密性存在差异[8]。LIU等[9]利用蚕豆分离蛋白和壳聚糖制备乳液探究界面层组装对乳液稳定性的影响,结果表明层层界面结构的形成,增加了界面层厚度,提高了乳液的物理稳定性。FALSAFI等[10]发现阿拉伯树胶和乳清蛋白稳定的层层组装乳液具有更大的静电排斥力和更高的物理稳定性并在β-胡萝卜素包封中具有较大潜力。
具有高分子质量、pH稳定性、生物相容性和胶凝特性的黄原胶(xanthan gum,XG)[11],已被广泛应用于制备凝胶、乳液和纳米颗粒[12],在活性物质的包封、控释以及稳定载药颗粒方面具有优势。
姜黄素(curcumin,Cur)是一种从姜黄根茎中分离的天然多酚化合物,研究表明,Cur具有抗炎、抗氧化、抗肿瘤和脂质调节活性[13]。然而,由于其溶解度低、热稳定性差以及对pH和金属离子敏感[14],限制了其在食品和制药行业的应用。基于Cur的高疏水性特点,水包油(O/W)Pickering乳液已经被广泛用于封装和保护Cur,Cur包封在油滴内或油滴表面层中[15],避免与水相中其他物质反应和受环境因素影响。
油(oil)和乙醇(etoh)可作为溶解Cur的溶剂,为其在乳液中的荷载提供两种思路,文献报道多以Cur溶解在油中的形式荷载于乳液。如ZHANG等[16]使用木糖糖化的蛙卵蛋白制备Pickering乳液包封油相姜黄素;将姜黄素溶解在乙醇中,常用以与蛋白质和多糖制备成复合纳米颗粒,如REN等[17]将Cur封装在zein和改性壳聚糖的复合物中;ZHANG等[18]利用抗溶剂沉淀法制备Cur-zein-XG纳米粒子,实现了姜黄素的有效包封。而使用此类复合物构建Pickering乳液的研究鲜有报道。对于两种溶剂荷载Pickering乳液中姜黄素的差异,CUI等[19]对比了Pickering乳液中的姜黄素,在分别以油相Cur和Cur-zein-植酸复合纳米颗粒荷载时的姜黄素包封和保护潜力,结果显示当姜黄素被用于制备Pickering乳液复合物纳米颗粒中时,其稳定性有所提升,为姜黄素的荷载方式提供了更加可行的策略。
本研究以zein和XG为原料构建荷载姜黄素的Pickering乳液,经过前期的实验已经成功构建由zein和XG稳定的乳液,并确定了较为合适的浓度比例,本研究旨在探究界面组装方式和姜黄素的溶解相对Pickering乳液基本性质和稳定性影响。
1 材料与方法
1.1 材料与试剂
玉米醇溶蛋白,合肥博美生物科技有限公司;黄原胶,上海麦克林生化科技有限公司;姜黄素,天津希恩思生化科技有限公司;尼罗红、尼罗蓝,北京酷来搏科技有限公司;金龙鱼玉米油,重庆永辉超市。其他试剂均为分析纯。
1.2 仪器与设备
HJ-4A数显恒温磁力搅拌器,济南欧莱博科学仪器有限公司;Mastersizer3000激光粒度仪,马尔文帕纳科公司;XHF-DY高速分散器,宁波新芝生物科技股份有限公司;MCR302模块化旋转与界面流变仪,奥地利ANTON PAAR公司;BX53荧光正置显微镜,日本OLYMPUS公司;LSM880激光共聚焦显微镜(confocal laser scanning microscope,CLSM),德国卡尔蔡司公司;TGL-18MS高速冷冻离心机,上海卢湘仪仪器有限公司;Biotek Synergy H1多功能酶标仪,美国Biotek仪器有限公司。
1.3 实验方法
1.3.1 相关溶液配制
称取一定量的zein粉末溶于乙醇溶液(80%,体积分数)中,常温下磁力搅拌使其完全溶解,随后使用1.0 mol/L的盐酸溶液调整溶液的pH值至4.0,形成0.08、0.04、0.02 g/mL的zein溶液。称取0.8 g的XG粉末溶于100 mL去离子水中,常温下磁力搅拌约4 h形成8 g/L XG溶液。称取姜黄素分别溶于乙醇和玉米油中,常温下磁力搅拌制备2 mg/mL Cur-etoh溶液和0.125 mg/mL Cur-oil溶液。
1.3.2 Pickering乳液制备
通过复合组装和层层组装策略,利用Cur-etoh溶液和Cur-oil溶液,制备含油量为50%,姜黄素含量为0.062 5 mg/mL的Pickering乳液,分别用DM-etoh、DM-oil、LBL-etoh、LBL-oil指代这些乳液体系,制备流程如图1所示。
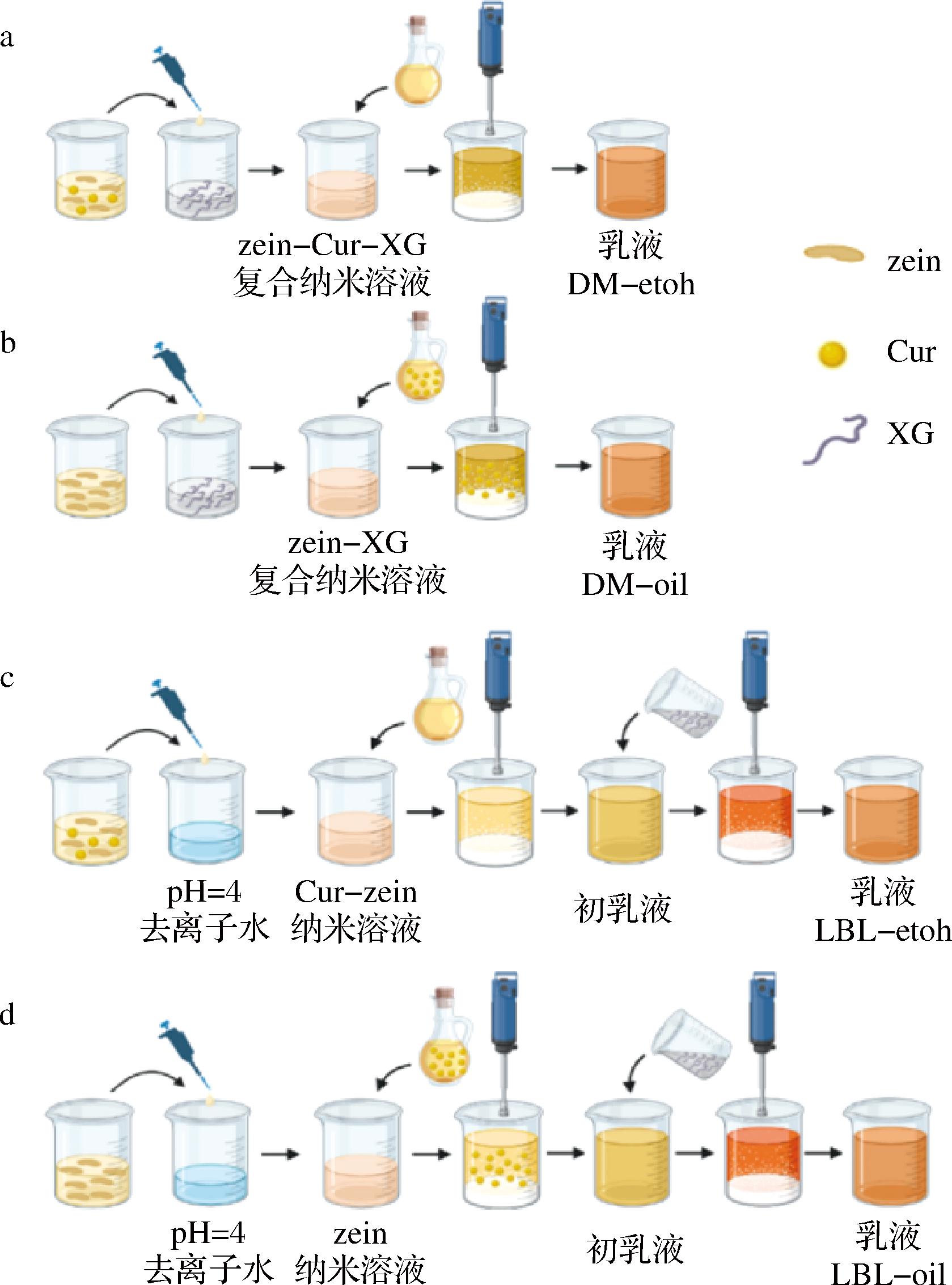
a-乳液DM-etoh;b-乳液DM-oil;c-乳液LBL-etoh;d-乳液LBL-oil
图1 四种乳液的制备流程图(由BioRender.com绘制)
Fig.1 Flow diagrams of the preparation of four emulsions
1.3.2.1 乳液DM-etoh
取2 mL 0.04 g/mL zein溶液、1 mL Cur-etoh溶液和1 mL 80%乙醇溶液磁力搅拌下混合后,将其缓慢滴加入12 mL XG溶液中,在快速磁力搅拌下形成Cur-zein-XG复合纳米溶液,加入16 mL玉米油,高速分散(10 000 r/min,3 min)形成乳液DM-etoh,见图1-a。
1.3.2.2 乳液DM-oil
取4 mL 0.02 g/mL zein溶液缓慢加入到12 mL XG溶液,在快速磁力搅拌下形成zein-XG复合纳米溶液,加入16 mL Cur-oil溶液,高速分散(10 000 r/min,3 min)形成乳液DM-oil,见图1-b。
1.3.2.3 乳液LBL-etoh
取1 mL 0.08 g/mL zein溶液和1 mL 0.02 g/mL Cur-etoh溶液磁力搅拌下混合后,将其缓慢滴加入2 mL pH 4的去离子水中,快速磁力搅拌下形成Cur-zein纳米溶液,加入16 mL玉米油高速分散(10 000 r/min,1.5 min)进行第1次乳化,再加入12 mL XG溶液,继续分散1.5 min,形成乳液LBL-etoh,见图1-c。
1.3.2.4 乳液LBL-oil
取2 mL 0.04 g/mL zein溶液将其缓慢滴加入2 mL pH 4的去离子水中,快速磁力搅拌下形成zein纳米溶液,加入16 mL Cur-oil溶液高速分散(10 000 r/min,1.5 min)进行第1次乳化,再加入12 mL XG溶液,继续分散1.5 min,形成乳液LBL-oil,见图1-d。
1.3.3 显微结构测定
使用光学显微镜观察乳液形态,吸取10 μL新鲜的Pickering乳液于载玻片上,盖上盖玻片后,在20倍的物镜下观察并拍照。
使用共聚焦显微镜(confocal laser scanning microscope,CLSM)观察乳液的微观结构。用1 g/mL的尼罗红(脂肪染色)和1 g/mL尼罗蓝(蛋白质染色)对新鲜Pinckering乳液进行染色。吸取10 μL染色后的乳液于载玻片上,并将盖玻片轻轻地放置在样品上,将玻片倒置用633 nm和488 nm的激发光激发获取乳液的微观结构图。
1.3.4 粒度测定
使用激光粒度仪对乳液液滴的尺寸进行测定,设定样品折射率为1.42,分散介质折射率为1.33,用d4,3表示液滴的平均直径。
1.3.5 流变学性质测试
使用流变仪测试乳液的流变学特性,采用直径为25 mm平行板,设置间隙为1 mm,测定温度为25 ℃下测试。速率扫描:剪切速率从1 s-1增加到100 s-1样品进行速率扫描,获得乳液的表观黏度图像;振幅扫描:固定频率为1 Hz,设置振幅扫描范围在0.1%~100%,记录储能模量G′和损耗模量G″随振幅变化情况;频率扫描:固定振幅为0.1%,设置频率扫描范围在0.1~10 Hz,记录储能模量G′和损耗模量G″随频率变化情况;触变性测定:设置剪切速率范围5~131 s-1,记录黏度和屈服应力随剪切速率正向递增和反向递减的变化情况;三段式触变测试(three interval thixotropic test,3ITT):在交替的剪切速率(1 s-1和10 s-1)对样品进行扫描,设置低速剪切:1 s-1、120 s;高速剪切:10 s-1、60 s;低速剪切1 s-1、180 s。获取黏度-时间图像,并计算回收率,用以评估乳液的恢复能力。
1.3.6 稳定性测试
1.3.6.1 加热稳定性
将新鲜乳液样品放入不同的热水浴中,设置60 ℃保持30 min和90 ℃保持15 min,冷却至室温后测定乳液粒度分布并拍摄微观图像,以评估乳液的加热稳定性。
1.3.6.2 贮藏稳定性
将新鲜乳液样品放置在4 ℃冰箱保存,记录35 d后乳液的粒度分布和微观图像。
1.3.6.3 冻融稳定性
参考WANG等[20]方法,将乳液样品置于-20 ℃下保存22 h后在室温下解冻2 h,以此为1次循环,并循环3次,观察乳液外观并拍摄微观图像。
1.3.6.4 离心稳定性
取5 mL左右新鲜乳液于10 mL离心管中离心(10 000 r/min,20 min)后,观察乳液外观并拍照。参考ALIABBASI等[21]的方法测定Pickering乳液的持水力(water-holding power,WHC),用针管吸去离心后的水层,按如下公式(1)计算WHC:
(1)
式中:m0,空离心管的质量,g;m1和m2,离心前乳液和离心管的质量和离心后弃去水层的乳液和离心管质量,g。
1.3.7 封装效率
参考ZHANG等[22]和JIANG等[23]的方法加以修改,称取0.20 g乳液样品用80%乙醇提取姜黄素,然后10 000 r/min离心5 min,取上清液使用酶标仪在425 nm测定吸光度。姜黄素标准曲线绘制:梯度稀释制成不同浓度的Cur-etoh溶液在425 nm处测定吸光值,以吸光度为纵坐标、姜黄素浓度为横坐标,得到标准曲线:y =15.724x+0.060 4;R2=0.992 3其中y为吸光值,x为姜黄素质量浓度(mg/mL)。用以下公式(2)计算姜黄素的封装效率(encapsulation efficiency,EE)。
(2)
1.3.8 保留率
参考LI等[24]的方法,对乳液和对照样品进行加热、强碱、和盐离子处理后测定体系中姜黄素的保留率,使用溶于油中的姜黄素作为对照,保证与乳液体系中姜黄素的初始添加浓度相同,体系中残留姜黄素的方法根据1.3.7节中描述的方法按公式(3)测定:
保留率![]()
(3)
1.3.8.1 加热处理
将不同的乳液样品放入沸水浴保温1 h中,将样品冷却至室温,测定姜黄素保留率。
1.3.8.2 强碱处理
将不同的乳液样品在pH 12的NaOH溶液处理1 h,测定姜黄素保留率。
1.3.8.3 盐离子处理
将不同的乳液样品用0.5 mol/L MgCl2溶液处理1 h,测定姜黄素保留率。
1.3.9 数据分析
每组实验平行3次,利用Origin 8.1作图,采用SPSS 26.0软件进行数据分析。
2 结果与分析
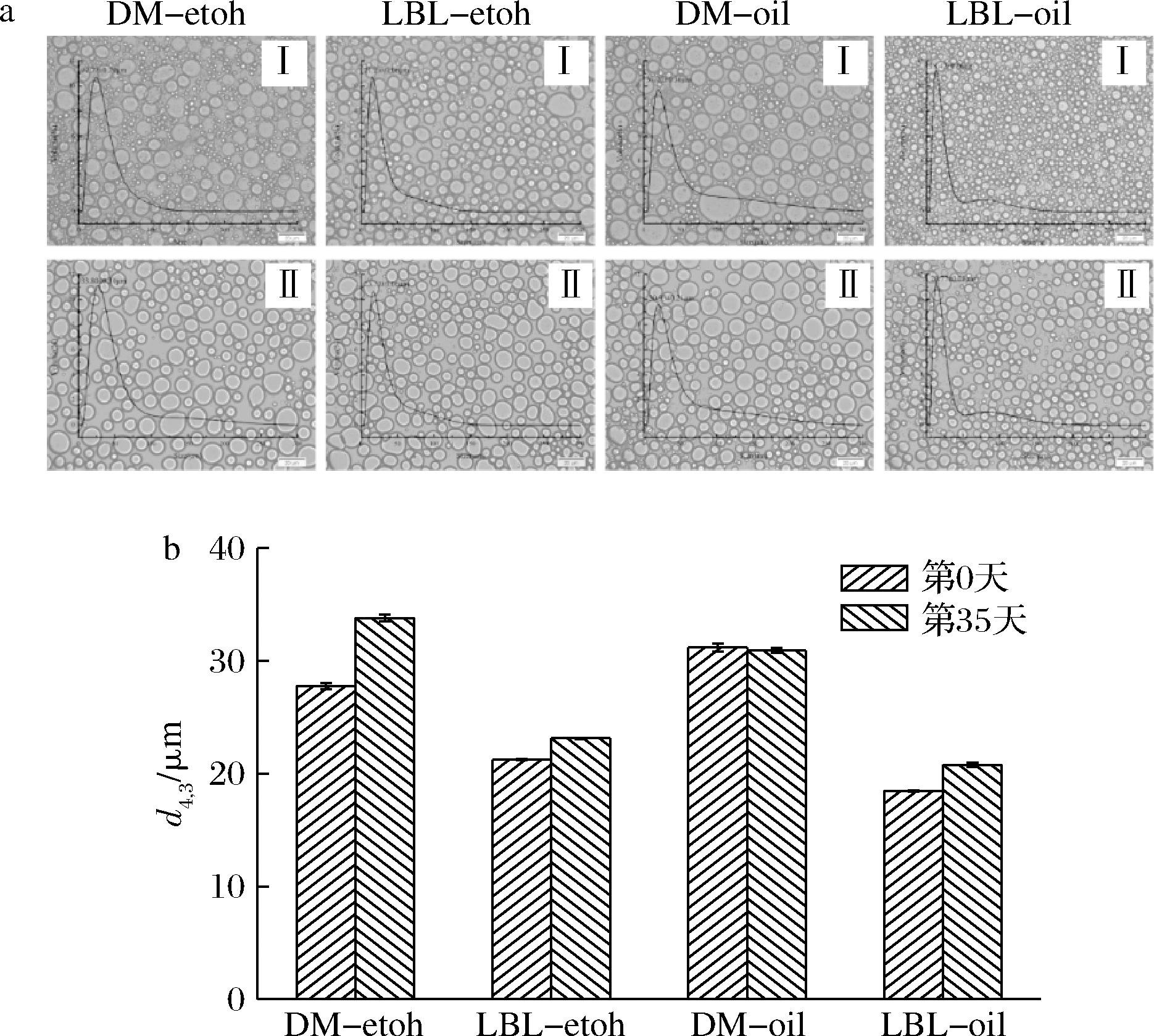
2.1 乳液粒径分析和微观结构表征
不同乳液的粒度分布和显微镜照片如图2所示,结合表1可知,相比于LBL-teoh和LBL-oil层层组装方式来说,DM-teoh和DM-oil的复合组装方式下的液滴尺寸更大,这与谢安琪等[25]的结果相似,其原因可能是由于zein-XG、zein-cur-XG较大颗粒复合物的形成并吸附到油滴表面,导致油滴的平均粒径增大。根据粒度分布图2-a可以发现,乳液DM-oil和LBL-oil出现双峰分布,而乳液DM-teoh和LBL-teoh则呈现出单峰分布,说明随着复合物中cur的加入,双峰消失,乳液稳定性增加[26]。
表1 乳液的粒径
Table 1 Particle size
指标DM-teohLBL-teohDM-oilLBL-oild4,3/μm27.77±0.24b21.23±0.05c31.20±0.29a18.47±0.05d
注:不同小写字母代表显著性差异(P <0.05)。

a-粒径分布;b-表观图片、微观图像;c-新鲜乳液的CLSM图像
图2 新鲜乳液的粒径分布表观图片、微观图像(标尺:20 μm)和新鲜乳液的CLSM图像(标尺:50 μm)
Fig.2 Particle size distribution apparent, microscopic images of fresh emulsions(scales:20 μm)and CLSM images of fresh emulsions (scale:50 μm)
注:Ⅰ、Ⅱ、Ⅲ、Ⅳ分别表示乳液DM-etoh、LBL-etoh、DM-oil、LBL-oil;下角标1、2、3分别表示红色、绿色、叠加通道。
通过激光共聚焦显微镜研究乳液的微观结构差异。根据图2-c发现zein(图中绿色部分)吸附在油滴(图中红色部分)表面,形成致密的水油屏障,阻止油滴絮凝、聚结和奥斯瓦尔德熟化[27]。乳液DM-teoh和DM-oil中的乳化复合物zein-cur-XG和zein-XG包围在油滴表面,此外它们还分散在连续相当中,形成了凝胶网络结构。乳液LBL-teoh和LBL-oil的蛋白质附着在油滴表面,而在连续相中未观察到额外的蛋白质,这说明在层层组装策略中,zein纳米颗粒完全吸附在油水界面上形成致密的界面层,同时在二次乳化中XG液滴与油滴表面蛋白质通过静电作用形成了均匀的第二层界面层,同样形成了乳液的凝胶网络结构。
2.2 流变学性质表征
2.2.1 表观黏度
4种不同乳液的表观黏度如图3-a所示,所有乳液均呈现出剪切变稀的现象,属于非牛顿流体的假塑性流体。乳液LBL-teoh和LBL-oil黏度均小于乳液DM-teoh和DM-oil,这表明无论姜黄素溶解在何种溶液中,层层组装策略制备的乳液黏度总是大于复合组装策略的黏度,这与谢安琪等[25]、WANG等[28]的研究结果一致。

a-表观黏度图像;b-振幅扫描图像;c-频率扫描图像;d-触变性恢复实验图像;e-三段式触变测试图像
图3 四种乳液的流变学特性图像
Fig.3 Images of rheological properties of four emulsions
2.2.2 振幅扫描
对乳液进行振幅扫描结果如图3-b所示,在LVR中乳液DM-teoh和DM-oil的G′值明显低于乳液LBL-teoh和LBL-oil,表明相比于复合组装策略,层层组装下的乳液样品具有更高的凝胶强度。对比乳液LBL-teoh和LBL-oil,前者G′值更高,乳液LBL-teoh的凝胶网络结构更具弹性,说明姜黄素和zein作用的复合物促进了乳液的弹性提升。在剪切应变大于40%时,所有乳液样品G′<G″,意味着此时乳液的弹性凝胶结构被破坏。
2.2.3 频率扫描
在0~70 rad/s频率范围内的扫描图像如图3-c所示,在频率变化范围内,所有乳液均显示出G′>G″,表明具有弹性凝胶状结构[29]。乳液LBL-teoh和LBL-oil的G′在测量范围内都比DM-teoh和DM-oil的值更高,说明层层组装策略能够提升乳液的黏弹性[10],这与振幅扫描的结果一致。
2.2.4 触变性实验
为了研究乳液样品的触变性,如图3-d所示,所有乳液的上行曲线均高于下行曲线,表现出明显的触变行为,同时表明乳液结构被破坏后的液滴重排和网络结构重建的速度比破坏的速度慢[30]。图3显示了乳液流动曲线的滞后环面积,滞后环面积大小代表着乳液的触变性强弱,其中乳液DM-etoh的触变性最强,表明该乳液具有高度稳定的内部网络和良好的抗变形能力,并在修复乳液内部网络和恢复自身黏度上具有优势[31]。
2.2.5 3ITT测试
通过3ITT实验研究乳液的剪切结构恢复性能,结果如图3-e所示。在初始120 s的低速剪切下,黏度几乎不发生变化,而当剪切速率突然增加,所有乳液的黏度均出现显著降低。当剪切速率再次降低至初始值时,黏度迅速恢复到初始状态,此时在高速剪切下遭受破坏的乳液结构已经重新建立。为比较不同乳液之间的恢复性能差异,取第一阶段结束时的黏度值为100%,与第三阶段的最大黏度值进行比较,计算样品的回收率,结果如表2所示。当乳液的回收率达到70%时,可认为具有良好的恢复性能[32],所有乳液都具有可恢复的凝胶结构,可以抵抗剪切速率的变化,并发现层层组装策略制备的乳液剪切结构恢复性能更佳。
表2 乳液流动曲线的滞后环面积和3ITT回收率
Table 2 Hysteresis loop area and 3ITT recovery of emulsion flow curves
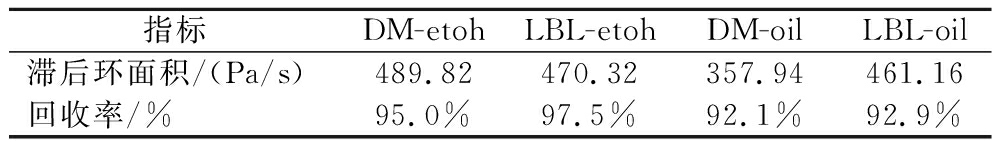
指标DM-etohLBL-etohDM-oilLBL-oil滞后环面积/(Pa/s)489.82470.32357.94461.16回收率/%95.0%97.5%92.1%92.9%
2.3 乳液稳定性测试
2.3.1 加热稳定性
通过加热前后微观图像和平均粒径变化探究乳液的加热稳定性,如图4所示。

a-不同加热条件下乳液微观和粒度分布图像;b-平均粒径d3,4变化
图4 不同加热条件下乳液微观和粒度分布图像(标尺:20 μm)和平均粒径d3,4变化
Fig.4 Microscopic and particle size distribution of emulsion under different heating conditions (scale:20 μm) and average particle size d3,4 change respectively
注:Ⅰ、Ⅱ、Ⅲ分别指新鲜、60 ℃加热30 min、90 ℃加热15 min
4种乳液加热后的粒径都发生了不同程度的增大,并随着温度的上升而逐步增大,说明在加热时小液滴发生絮凝和聚结,并且温度越高液滴絮凝和聚结程度越大,这可能与加热过程中分子间布朗运动加剧和蛋白质的变性聚集有关。而乳液在不同温度下的粒径变化程度的不同与乳液的组装方式和姜黄素的位置直接相关,低温长时加热下,乳液DM-oil和LBL-oil的平均粒径变化大于乳液DM-teoh和LBL-teoh,这可能是因为DM-teoh和LBL-teoh纳米颗粒中姜黄素的存在有助于对抗高温环境下液滴的絮凝和聚结。而在高温短时加热的条件下,相比于乳液LBL-teoh和LBL-oil,乳液样品DM-teoh和DM-oil的粒径增大程度更大,说明此时液滴尺寸由组装方式主导,层层组装策略下得到的乳液,液滴的变化程度较小,稳定性更高。
2.3.2 储藏稳定性
乳液的贮藏稳定性结果如图5所示,随着贮藏时间的延长,液滴尺寸似乎变得更加均匀化,这可能是由于高黏度的XG连续相形成了厚的界面层,从而限制了液滴聚集和分子运动[33]。同时发现除了乳液DM-oil外,其他乳液样品均呈现平均粒径增长,这是在时间尺度下液滴聚结的结果。
a-贮藏前后乳液的微观和粒度分布图像;b-平均粒径d3,4变化
图5 贮藏前后乳液的微观和粒度分布图像(标尺:20 μm)和平均粒径d3,4变化
Fig.5 Microscopic and particle size distribution image of emulsion before and after storage (scale:20 μm) and changes in mean particle size d3,4
注:Ⅰ、Ⅱ 分别指第0天、第35天
2.3.3 冻融稳定性
经历3次冻融循环,如图6所示,观察乳液外观可以发现,第1次冻融结束时,乳液DM-oil出现了明显的漏油现象(图中箭头),呈现相分离,但仍然保留着网络结构,形成肉眼可见的细小孔洞,与微观图像中呈现出的严重破乳现象吻合,并在此后的两次冻融后同样呈现漏油现象。随着乳液冻融次数的增加,乳液DM-etoh的液滴尺寸明显增加,同时在乳液外观上观察到部分微小孔洞(图中箭头)形成。乳液样品LBL-etoh和LBL-oil在经过3次冻融循环后,外观并未发生变化,而通过比较二者的微观图像可以看出乳液LBL-oil液滴尺寸明显增加,乳液样品LBL-etoh液滴尺寸改变不大,但都出现了液滴絮凝的现象(图中箭头)。乳液的冻融稳定性排序:LBL-etoh>LBL-oil>DM-etoh>DM-oil,这与LI等[34]使用乳铁蛋白和透明质酸构建不同组装方式的乳液结果一致。说明受层层组装策略和姜黄素参与乳化过程的影响,可能阻止了油滴结晶在液滴间的渗透,从而抑制反复冻融对界面层的破坏,有助于提升乳液的冻融稳定性。

图6 三次冻融循环前后的表观照片(从左到右:DM-etoh、DM-oil、LBL-etoh、LBL-oil)和微观图像
Fig.6 Epigrams and microscopic images before and after the three freeze-thaw cycles
2.3.4 离心稳定性
对离心后的乳液进行拍照,如图7-a所示,4种乳液离心后均出现了相分离,离心管下层为水,上层为析水后的乳液,未发现破乳导致油漏出的情况。同时观察到乳液DM-oil和LBL-oil的水层更加清澈,表明大多数组分都被保留在原乳液中[35],原因可能是以溶于油荷载在乳液中的姜黄素保留在上层乳液的油相,而以乙醇溶解的姜黄素则进入下层水。组装方式和姜黄素溶解相对Pickering乳液持水性的影响如图7-b所示,所有乳液的持水力均达到60%以上,乳液稳定的凝胶网络结构能够截留较多的水分,乳液的组装方式和姜黄素的位置对于持水力的影响不大。
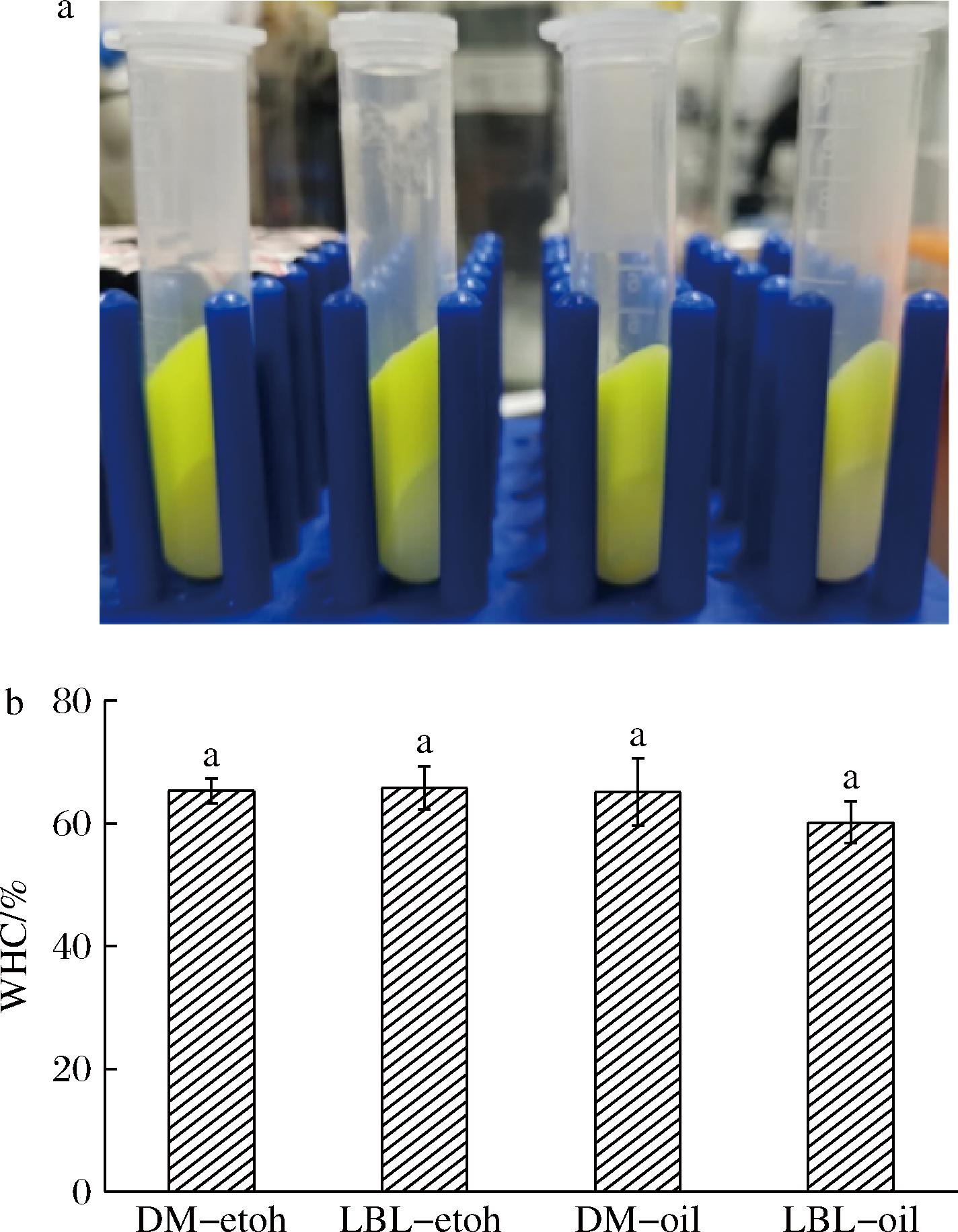
a-离心后乳液表观照片;b-持水力
图7 离心后乳液表观照片和持水力
Fig.7 Apparent photograph and water holding capacity of the emulsions after centrifugation
注:从左到右为DM-etoh、DM-oil、LBL-etoh、LBL-oil,小写字母代表显著性差异(P <0.05)(下同)。
2.4 封装效率
姜黄素在不同乳液中的封装效率如图8-a所示,其中乳液DM-etoh和LBL-etoh的封装效率分别大于乳液DM-oil和LBL-oil,说明与Cur-oil溶液相比,使用Cur-etoh溶液封装在zein纳米颗粒和zein-XG复合物中的形式添加至乳液中,可以显著提升姜黄素的封装效率。而其中乳液DM-etoh的封装效率达到98.12%,说明姜黄素封装在zein-XG复合物中的复合组装乳液很大程度上提升cur的封装效率。

a-封装效率EE;b-加热处理保留率;c-强碱处理保留率;d-盐离子处理保留率
图8 不同乳液的姜黄素封装效率EE和保留率
Fig.8 Curcumin encapsulation efficiency EE and retention of different emulsions
2.5 保留率测定
2.5.1 热稳定
热加工有助于保证食品安全,但高温环境会促使姜黄素降解,热处理后不同乳液和游离姜黄素的保留率如图8-b所示,加热条件下,姜黄素在乳液中的稳定性显著高于游离姜黄素,说明Pickering乳液有利于姜黄素的稳定。其中乳液LBL-etoh的保留率最高,可以抵抗食品热加工工艺中的姜黄素降解。
2.5.2 碱稳定
食品加工常需要应对不同的pH条件,姜黄素处于碱性环境时极易降解,不同乳液和游离姜黄素处于强碱环境一段时间的保留率如图8-c所示,乳液DM-oil和LBL-oil可以较好地稳定姜黄素,可能是因为溶解在油滴中的姜黄素受到界面层的保护,从而减缓了碱性液滴与姜黄素的直接接触。
2.5.3 盐离子稳定
姜黄素对金属离子敏感,镁是人体必需的常量元素之一,可从加工食品中获取。乳液和游离姜黄素与Mg2+接触后保留率如图8-d所示,所有乳液不同程度上提高了姜黄素的保留率,其中乳液DM-etoh和LBL-etoh的稳定性最好,可作为抵抗Mg2+环境的理想载体。
3 结论与讨论
本研究以XG和zein为原料,构建不同组装方式下将姜黄素溶解在油和乙醇中荷载的4种Pickering乳液,研究乳液的微观结构和流变学特性,以及加热、冻融、贮藏和离心稳定性,并评价乳液中姜黄素的封装效率和不同加工条件下姜黄素的保留率。结果显示所有乳液都形成凝胶网络结构,与层层组装的乳液相比,复合组装的zein除分布在乳液界面层外,还分布在连续相当中。3ITT结果显示所有乳液具有良好的触变恢复性能。4种不同的乳液都具有较好的加热、贮藏和离心稳定性,而在冻融稳定性上体现出明显差异,稳定性排序为LBL-etoh>LBL-oil>DM-etoh>DM-oil。以Cur-etoh溶液荷载Cur的Pickering乳液显著提升了封装效率,其中乳液DM-etoh对于姜黄素的封装效率最高,可达98.12%。本研究拓宽了Pickering乳液荷载姜黄素的思路,并对亲脂活性物质的装载应用具有积极意义。
[1] CHEVALIER Y, BOLZINGER M A.Emulsions stabilized with solid nanoparticles:Pickering emulsions[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2013, 439:23-34.
[2] MCCLEMENTS D J.Enhanced delivery of lipophilic bioactives using emulsions:A review of major factors affecting vitamin, nutraceutical, and lipid bioaccessibility[J].Food &Function, 2018, 9(1):22-41.
[3] BAO C, JIANG P, CHAI J J, et al.The delivery of sensitive food bioactive ingredients:Absorption mechanisms, influencing factors, encapsulation techniques and evaluation models[J].Food Research International, 2019, 120:130-140.
[4] LEI L, CHEN Y L, ZHU C H, et al.The novel Pickering emulsion gels stabilized by zein hydrolysate-chitin nanocrystals coacervates:Improvement on stability and bioaccessibility for curcumin[J].Food Research International, 2022, 161:111877.
[5] LI M, YU M H.Development of a nanoparticle delivery system based on zein/polysaccharide complexes[J].Journal of Food Science, 2020, 85(12):4108-4117.
[6] DAI L, SUN C X, WEI Y, et al.Characterization of Pickering emulsion gels stabilized by zein/gum Arabic complex colloidal nanoparticles[J].Food Hydrocolloids, 2018, 74:239-248.
[7] GAO J, LIANG H S, LI S G, et al.Development of zein/soluble soybean polysaccharide nanoparticle-stabilized Pickering emulsions[J].Journal of Food Science, 2021, 86(5):1907-1916.
[8] LI M T, MCCLEMENTS D J, LIU X B, et al.Design principles of oil-in-water emulsions with functionalized interfaces:Mixed, multilayer, and covalent complex structures[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(6):3159-3190.
[9] LIU C, PEI R S, PELTONEN L, et al.Assembling of the interfacial layer affects the physical and oxidative stability of faba bean protein-stabilized oil-in-water emulsions with chitosan[J].Food Hydrocolloids, 2020, 102:105614.[10] FALSAFI S R, ROSTAMABADI H, NISHINARI K, et al.The role of emulsification strategy on the electrospinning of β-carotene-loaded emulsions stabilized by gum Arabic and whey protein isolate[J].Food Chemistry, 2022, 374:131826.
[11] BHAT I M, WANI S M, AHMAD MIR S, et al.Advances in xanthan gum production, modifications and its applications[J].Biocatalysis and Agricultural Biotechnology, 2022, 42:102328.
[12] ALLE M, BHAGAVANTH REDDY G, KIM T H, et al.Doxorubicin-carboxymethyl xanthan gum capped gold nanoparticles:Microwave synthesis, characterization, and anti-cancer activity[J].Carbohydrate Polymers, 2020, 229:115511.
[13] WU L X, QIAO Z R, CAI W D, et al.Quaternized curdlan/pectin polyelectrolyte complexes as biocompatible nanovehicles for curcumin[J].Food Chemistry, 2019, 291:180-186.
[14] CHEN Y Y, WANG J T, RAO Z N, et al.Study on the stability and oral bioavailability of curcumin loaded (-)-epigallocatechin-3-gallate/poly(N-vinylpyrrolidone) nanoparticles based on hydrogen bonding-driven self-assembly[J].Food Chemistry, 2022, 378:132091.
[15] CHENG H, ZHANG H X, LI D, et al.Impact of oil type on the location, partition and chemical stability of resveratrol in oil-in-water emulsions stabilized by whey protein isolate plus gum Arabic[J].Food Hydrocolloids, 2020, 109:106119.
[16] ZHANG Y T, ZHANG Y, CHEN N, et al.Glycated modification of the protein from Rana chensinensis eggs by Maillard reaction and its stability analysis in curcumin encapsulated emulsion system[J].Food Chemistry, 2022, 382:132299.
[17] REN G R, HE Y, LIU C Z, et al.Encapsulation of curcumin in ZEIN-HTCC complexes:Physicochemical characterization, in vitro sustained release behavior and encapsulation mechanism[J].LWT, 2022, 155:112909.
[18] ZHANG D C, JIANG F Y, LING J H, et al.Delivery of curcumin using a zein-xanthan gum nano complex:Fabrication, characterization, and in vitro release properties[J].Colloids and Surfaces B:Biointerfaces, 2021, 204:111827.
[19] CUI S, MCCLEMENTS D J, SHI J L, et al.Fabrication and characterization of low-fat Pickering emulsion gels stabilized by zein/phytic acid complex nanoparticles[J].Food Chemistry, 2023, 402:134179.
[20] WANG Y Y, ZHANG A Q, WANG X B, et al.The radiation assisted-Maillard reaction comprehensively improves the freeze-thaw stability of soy protein-stabilized oil-in-water emulsions[J].Food Hydrocolloids, 2020, 103:105684.
[21] ALIABBASI N, EMAM-DJOMEH Z, ASKARI G, et al.Pinto bean protein ultrasonicated cold-set emulsion gels catalyzed by transglutaminase/glucono-δ-lactone:Development, characterization and in vitro release characteristics[J].Journal of Drug Delivery Science and Technology, 2023, 81:104239.
[22] ZHANG L, CHEN D L, WANG X F, et al.Enzymatically modified quinoa starch based Pickering emulsion as carrier for curcumin:Rheological properties, protection effect and in vitro digestion study[J].Food Bioscience, 2022, 49:101933.
[23] JIANG T, CHARCOSSET C.Encapsulation of curcumin within oil-in-water emulsions prepared by premix membrane emulsification:Impact of droplet size and carrier oil type on physicochemical stability and in vitro bioaccessibility[J].Food Chemistry, 2022, 375:131825.
[24] LI Z Y, HU W X, DONG J J, et al.The use of bacterial cellulose from kombucha to produce curcumin loaded Pickering emulsion with improved stability and antioxidant properties[J].Food Science and Human Wellness, 2023, 12(2):669-679.
[25] 谢安琪, 邓苏梦, 左白露, 等.面筋蛋白粒子-黄原胶Pickering乳液的制备及其表征[J].食品科学, 2019, 40(16):38-44.XIE A Q, DENG S M, ZUO B L, et al.Preparation and characterization of wheat gluten nanoparticles-xanthan gum Pickering emulsions[J].Food Science, 2019, 40(16):38-44.
[26] 吕思伊, 卢琪, 潘思轶.包封姜黄素的果胶-核桃蛋白复合物乳液稳定性及体外消化[J].食品科学, 2021, 42(8):1-9.LYU S Y, LU Q, PAN S Y.Stability and in vitro digestion of pectin-walnut proteins stabilized emulsions encapsulating curcumin[J].Food Science, 2021, 42(8):1-9.
[27] GU R H, LI C C, SHI X T, et al.Naturally occurring protein/polysaccharide hybrid nanoparticles for stabilizing oil-in-water Pickering emulsions and the formation mechanism[J].Food Chemistry, 2022, 395:133641.
[28] WANG X, LI X, XU D X, et al.Comparision of heteroaggregation, layer-by-layer and directly mixing techniques on the physical properties and in vitro digestion of emulsions[J].Food Hydrocolloids, 2019, 95:228-237.
[29] JIANG F C, PAN Y J, PENG D F, et al.Tunable self-assemblies of whey protein isolate fibrils for Pickering emulsions structure regulation[J].Food Hydrocolloids, 2022, 124:107264.
[30] ZHOU B B, DRUSCH S, HOGAN S A.Confined flow behavior under high shear rates and stability of oil/water high internal phase emulsions (HIPEs) stabilized by whey protein isolate:Role of protein concentration and pH[J].Food Research International, 2022, 160:111674.
[31] WANG H X, OUYANG Z Y, HU L D, et al.Self-assembly of gelatin and phycocyanin for stabilizing thixotropic emulsions and its effect on 3D printing[J].Food Chemistry, 2022, 397:133725.
[32] SHAHBAZI M, J GER H, ETTELAIE R, et al.Construction of 3D printed reduced-fat meat analogue by emulsion gels.Part I:Flow behavior, thixotropic feature, and network structure of soy protein-based inks[J].Food Hydrocolloids, 2021, 120:106967.
GER H, ETTELAIE R, et al.Construction of 3D printed reduced-fat meat analogue by emulsion gels.Part I:Flow behavior, thixotropic feature, and network structure of soy protein-based inks[J].Food Hydrocolloids, 2021, 120:106967.
[33] WANG K, LI Y, SUN J X, et al.The physicochemical properties and stability of myofibrillar protein oil-in-water emulsions as affected by the structure of sugar[J].Food Chemistry:X, 2023, 18:100677.
[34] LI M T, SUN Y W, MCCLEMENTS D J, et al.Interfacial engineering approaches to improve emulsion performance:Properties of oil droplets coated by mixed, multilayer, or conjugated lactoferrin-hyaluronic acid interfaces[J].Food Hydrocolloids, 2022, 133:107938.
[35] ZHANG J N, ZHAO S Q, LIU Q, et al.High internal phase emulsions stabilized by pea protein isolate modified by ultrasound and pH-shifting:Effect of chitosan self-assembled particles[J].Food Hydrocolloids, 2023, 141:108715.