在玉米湿法淀粉生产过程中,每浸泡1 t玉米产生0.8 t浸泡水,浸泡水浓缩后的液体称为玉米浆[1-2]。玉米浆的产量约为玉米加工量的13%,其含有可溶性蛋白、可发酵性糖、无机盐等营养物质,常被作为微生物培养剂以促进微生物生长和代谢[3-4]。玉米浆制备存在成本低廉的优势,但成分不均一、稳定性差、极容易沉淀等特点导致其存储和运输都较为困难,限制了玉米浆的资源化利用[5]。玉米浆中蛋白质含量约45%(质量分数)[6],如果能对玉米浆中蛋白质等有效成分进行加工利用,将大大提高玉米加工企业的经济效益。研究表明,玉米浆可以作为食用菌液体菌种培养时的氮源组分之一,添加量一般在0.25%~4%[7-8]。
黑龙江省是我国食用菌主产区,栽培历史悠久,生产种类繁多,在农业经济中占有重要地位[9]。在食用菌的菌袋培养基中,需要大量的氮源营养素和促生长剂。目前,菌袋氮源营养素常用豆粕和麸皮。近年来,麸皮、豆粉、稻糠等原材料价格持续上涨[10],同时豆粕和麸皮也是饲料原料[11],导致菌袋原料成本居高不下,需要有替代传统食用菌基质配方中氮源的廉价原料。
针对玉米浆没有找到资源化利用的有效途径以及食用菌产业需要有效且廉价氮源的问题,本课题组先用米曲霉发酵玉米浆使其具有食用菌生长繁殖需要的短、中和长效氮源,再将其用作食用菌营养剂,既有效利用了玉米浆中的蛋白质,又在一定程度上缓解了食用菌产业菌包价格偏高的问题,为玉米浆的综合利用提供了新途径[12-14]。但是,玉米浆成分复杂,且其酸度较高,pH值一般在3.7~4.1[15],而米曲霉的最适生长pH值为5~6[16],因此,将米曲霉直接接种到100%玉米浆中,米曲霉难以生长繁殖,导致原料利用率低。为了更好的利用玉米浆中的蛋白质资源,并且加大玉米浆的处理量,本实验先用100%玉米浆固体培养基连续驯化米曲霉,使米曲霉更好的适应玉米浆的复杂环境而生长。然后采用驯化的米曲霉为菌株,对100%玉米浆(不加入任何辅料,仅小幅度的调节pH,目的是降低工业化应用的成本)进行液体发酵,以氨基酸态氮和可溶性蛋白含量为指标,通过单因素试验和正交试验确定米曲霉发酵100%玉米浆的最佳工艺条件,为玉米浆源食用菌营养剂的开发奠定基础。
1 材料与方法
1.1 材料与试剂
玉米浆,齐齐哈尔阜丰集团;米曲霉(Aspergillus oryzae),齐齐哈尔大学食品与生物工程学院保藏;牛血清白蛋白,上海生工生物股份有限公司;福林-酚乙试剂,实验室自制;其他试剂均为分析纯。
1.2 仪器与设备
ZGP-2160隔水式恒温培养箱,北京市永光明医疗仪器厂;SX-500灭菌锅,日本Tomy公司;ZQZY-CF9.9振荡培养箱,上海知楚仪器有限公司;722S可见分光光度计,上海佑科仪器仪表有限公司;TDL-5-A高速离心机,上海安亭科学仪器厂;PB-10型pH计,赛多利斯科学仪器(北京)有限公司。
1.3 100%玉米浆固体培养基驯化米曲霉菌株
为了解玉米浆对米曲霉生长状况的影响,在PDA培养基中分别添加20%、30%、40%、50%、60%、70%、80%、90%、100%(体积分数,下同)的玉米浆,混合均匀后调节pH值至6.3,121 ℃下灭菌20 min,倒平板接种米曲霉孢子进行培养,观察并记录米曲霉的生长状态及孢子成熟时间。
在100 mL玉米浆中加入2 g琼脂,混合均匀后调pH值至6.3,121 ℃下灭菌20 min后倒平板,接种米曲霉孢子后放入32 ℃恒温培养箱中培养。待米曲霉白色菌丝长满培养基表面,并且有黄绿色孢子生成,称为一代米曲霉。将一代米曲霉孢子继续接种至100%玉米浆固体培养基中培养至孢子成熟,称为二代米曲霉,重复传代至四代米曲霉,观察并记录每一代米曲霉的生长状况及孢子成熟时间。
1.4 驯化米曲霉发酵100%玉米浆的效果评价
以未驯化的米曲霉为对照,用驯化后的米曲霉发酵100%玉米浆。首先将玉米浆用8 mol/L NaOH溶液调节pH值至6.3,然后每个锥形瓶加入100 mL玉米浆,为了防止发生过度的美拉德反应而加重玉米浆的褐变,112 ℃灭菌15 min,在接种量1.25×106孢子/100 mL、温度30 ℃、装液量100 mL/250 mL、摇床转速150 r/min的条件下发酵5 d。发酵结束后沸水浴灭菌10 min,3 000 r/min离心10 min,取上清液测定氨基酸态氮及可溶性蛋白含量。
1.5 米曲霉发酵100%玉米浆的条件优化
1.5.1 单因素试验
配制100%玉米浆培养基100 mL,112 ℃灭菌15 min。以氨基酸态氮含量及可溶性蛋白含量为指标,对米曲霉接菌量(1.25×104、1.25×105、1.25×106、1.25×107孢子/100 mL)、发酵温度(20、25、30、35 ℃)、装液量(80、90、100、110、120 mL/250 mL)、发酵初始pH值(4.4、5.0、5.6、6.2、6.8)和发酵时间(1、3、5、7、9 d)进行优化。发酵结束后将锥形瓶放入沸水浴灭菌10 min,3 000 r/min离心10 min,取上清液测定氨基酸态氮含量及可溶性蛋白含量。
1.5.2 正交试验
在发酵温度25 ℃、装液量90 mL/250 mL、摇床转速150 r/min条件下,以氨基酸态氮和可溶性蛋白含量为指标,进一步采用L9(34)正交试验优化米曲霉发酵100%玉米浆的工艺条件,因素水平见表1。
表1 L9(34)正交试验的因素水平表
Table 1 The factors and levels for L9(34) orthogonal tests
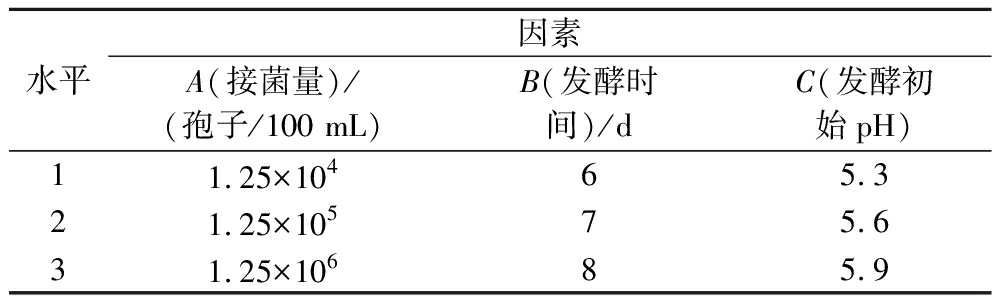
水平因素A(接菌量)/(孢子/100 mL)B(发酵时间)/dC(发酵初始pH)11.25×10465.321.25×10575.631.25×10685.9
1.6 可溶性蛋白含量的测定
采用福林-酚法测定[17]。
1.7 氨基酸态氮含量测定
采用GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》甲醛滴定法测定。
1.8 数据处理
试验数据为3次重复的均值,误差项以标准偏差表示。使用SPSS 19.0软件进行方差分析,实验指标间以Duncan法(P<0.05)进行差异显著性分析。
2 结果与分析
2.1 米曲霉菌种的驯化
2.1.1 不同浓度玉米浆对米曲霉生长状态及孢子成熟时间的影响
如图1所示,在PDA培养基中培养2 d时,米曲霉菌丝铺满培养基表面,且有大量黄绿色孢子形成。当玉米浆的添加量为20%~50%、培养3 d时,米曲霉菌丝铺满培养基表面,但孢子的颜色由绿色逐渐转变成黄绿色;当玉米浆的添加量增加至60%~70%、培养3 d时,米曲霉菌丝不能覆盖整个培养基表面;当玉米浆添加量为80%时,米曲霉的由扩散性生长转变为局限性生长;在90%~100%玉米浆培养基中培养3 d时,未见米曲霉生长,说明高浓度的玉米浆抑制了米曲霉菌株的发育和分生孢子的形成,使米曲霉的生长周期延长。

图1 不同玉米浆浓度对米曲霉生长状态的影响
Fig.1 Effect of different concentrations of corn steep liquor on the growth state of Aspergillus oryzae
2.1.2 米曲霉菌株的驯化
为了使米曲霉逐渐适应100%玉米浆的生长环境,将米曲霉接种至100%玉米浆固体培养基中培养至12 d,并连续传代3次,观察并记录在培养时间内米曲霉的生长状态及孢子形成时间,结果如图2所示。在100%玉米浆固体培养基上培养9 d时,一代米曲霉开始有黄色孢子形成;10~12 d时,米曲霉菌丝呈局限性生长,孢子颜色由黄色变成深黄色。二代米曲霉培养至9~12 d时,有大量黄色孢子形成,但仍为局限性菌落。三代米曲霉培养至9 d时,培养基表面有大量白色菌丝形成并向周围扩散,同时有少量淡黄色孢子形成;10~12 d时在培养基表面形成大量黄绿色的孢子。四代米曲霉在培养5~6 d时,菌丝体基本可以覆盖培养基表面,且有少量淡黄色孢子生成;7~8 d时,黄色孢子覆盖培养基表面。与第一代米曲霉相比,第四代米曲霉在100%玉米浆固体培养基上菌丝形成和孢子成熟时间分别缩短40%和30%,说明米曲霉逐渐适应了100%玉米浆的培养环境。
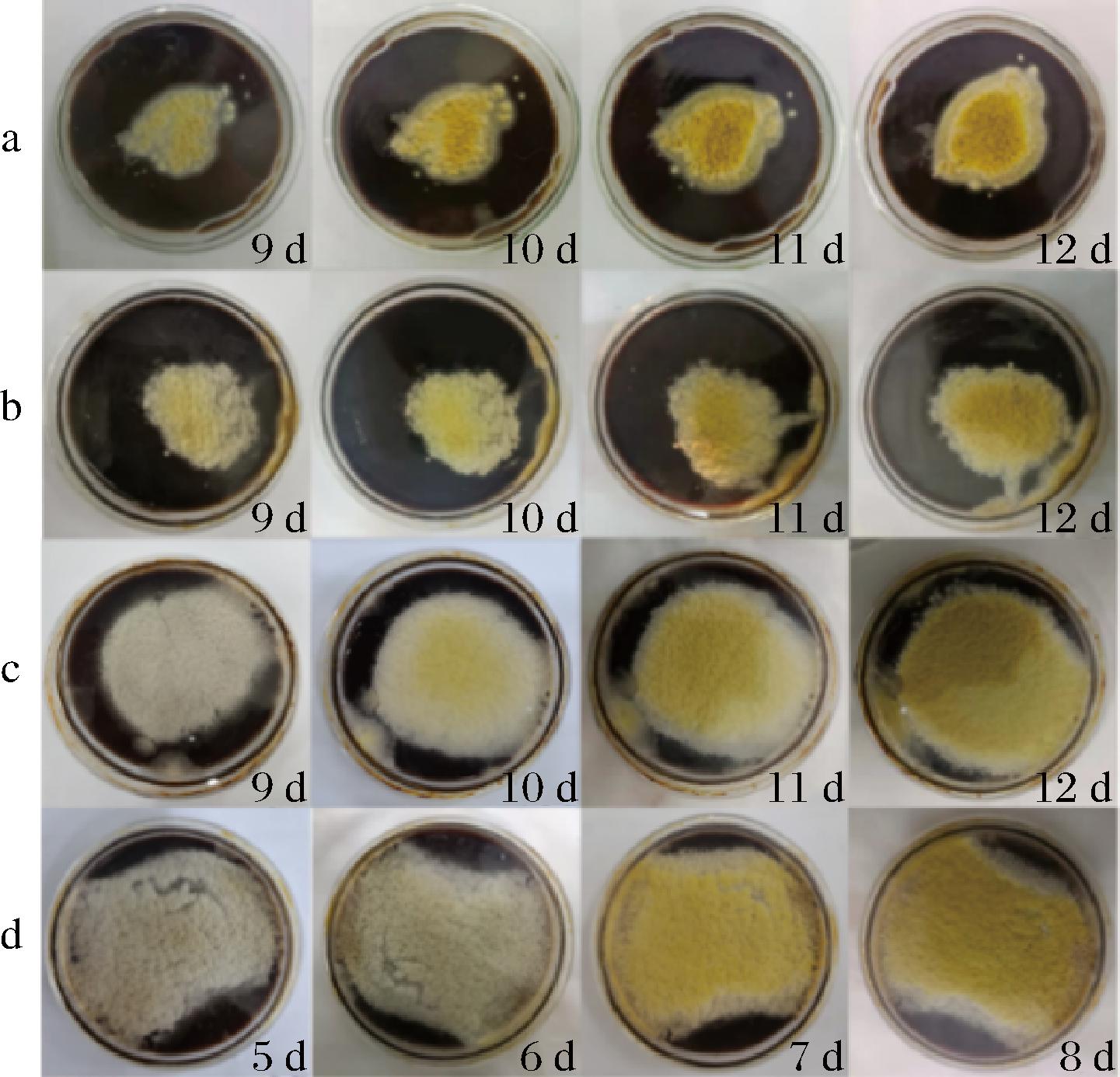
a-一代米曲霉;b-二代米曲霉;c-三代米曲霉;d-四代米曲霉
图2 100%玉米浆条件下米曲霉的生长状态
Fig.2 Growth state of A.oryzae under 100% corn steep liquor condition
2.1.3 驯化米曲霉发酵100%玉米浆的效果评价
以未驯化的米曲霉为对照,驯化米曲霉对100%玉米浆的发酵效果如图3所示。与对照组相比,未驯化组和驯化组中的可溶性蛋白含量分别增加了2.04%和3.38%;氨基酸态氮含量分别增加了1.59%和3.00%,说明经100%玉米浆驯化后米曲霉已适应了玉米浆的培养环境,可以达到更好的发酵效果。因此,在后续实验中均采用驯化的米曲霉为发酵菌种。
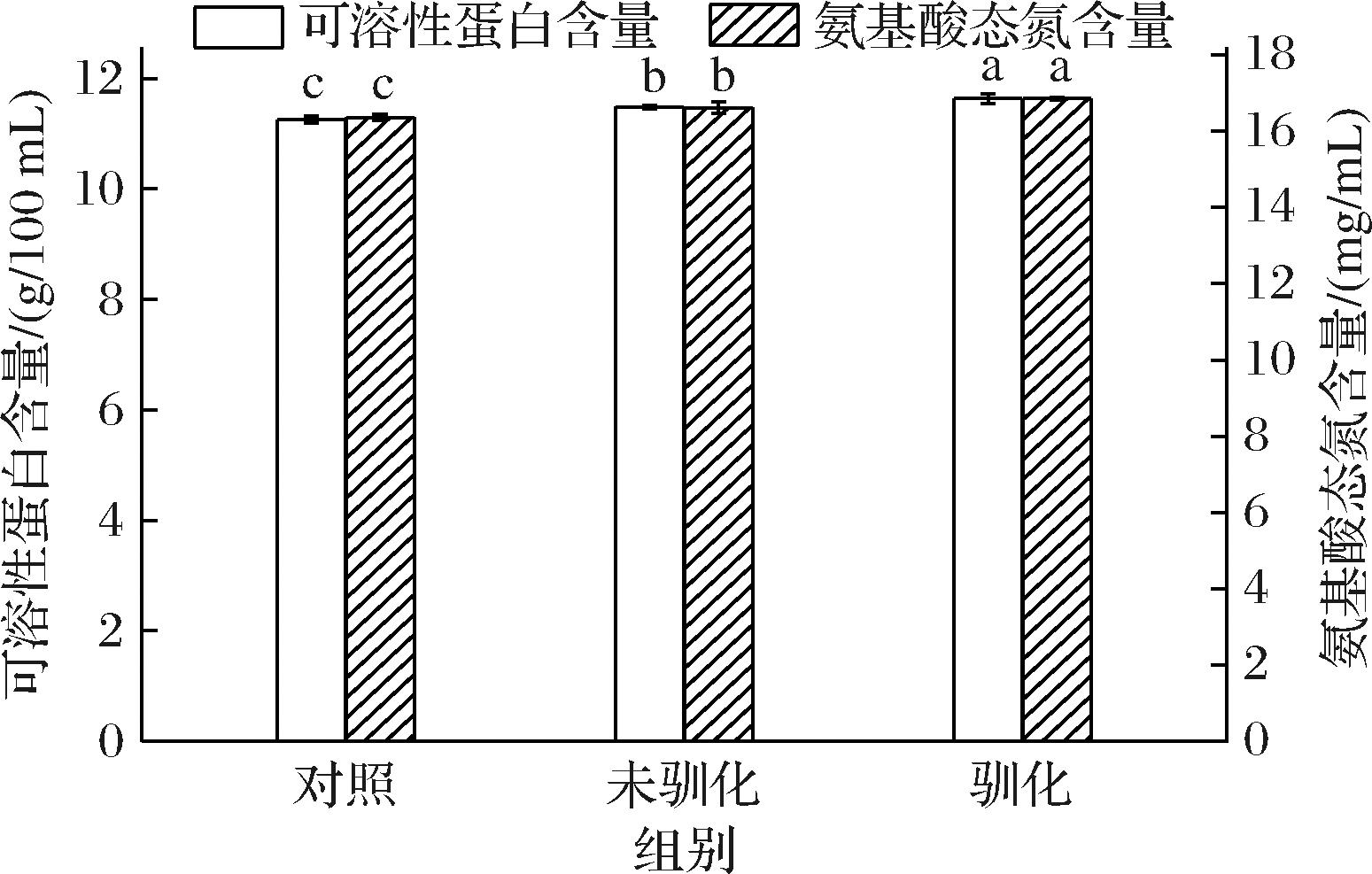
图3 驯化前后米曲霉发酵100%玉米浆的效果
Fig.3 Fermentation effect of 100% corn steep liquor by A.oryzae before and after acclimation
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 单因素试验优化米曲霉发酵100%玉米浆的工艺条件
2.2.1 接菌量
为了了解米曲霉分泌蛋白酶的能力是否具有细胞密度的依赖性,考察了米曲霉接菌量对氨基酸态氮含量和可溶性蛋白质含量的影响,结果如图4所示。与对照组相比,随着米曲霉接菌量的增大,发酵液中可溶性蛋白含量呈先升高后降低的变化趋势,在接菌量为1.25×106孢子/100 mL时,发酵液中可溶性蛋白含量最高,为12.64 g/100 mL。在100%玉米浆中,玉米浆中的蛋白质及淀粉等成分为米曲霉的生长繁殖提供了氮源和碳源,使米曲霉能够生长繁殖,同时淀粉等成分能刺激米曲霉分泌蛋白酶[18],在蛋白酶作用下,玉米浆中大分子质量蛋白质被降解,使发酵液中可溶性蛋白含量提高。当接菌量为1.25×107孢子/100 mL时,发酵液中可溶性蛋白含量显著降低(P<0.05),分析有以下3方面的原因:1)由于接菌量过多,菌体间营养物质及氧气竞争性增加,导致菌体生长状况较差,进而影响蛋白酶的产生;2)SAMARNTARN等[19]利用基因工程米曲霉U1521以脱脂大豆为底物生产碱性蛋白酶,发现蛋白酶的产生不取决于脱脂大豆含量的有效性,而取决于在该范围内脱脂大豆大分子的水解活性[19],因此,可能由于玉米浆中可水解的大分子质量蛋白质达到上限而抑制了蛋白酶的产生;3)当玉米浆中营养物质缺乏时,米曲霉可能会吸收利用发酵液中的小分子肽和氨基酸等物质维持自身生长。以上实验结果说明,米曲霉发酵100%玉米浆的效果与米曲霉的接种量具有一定的相关性。
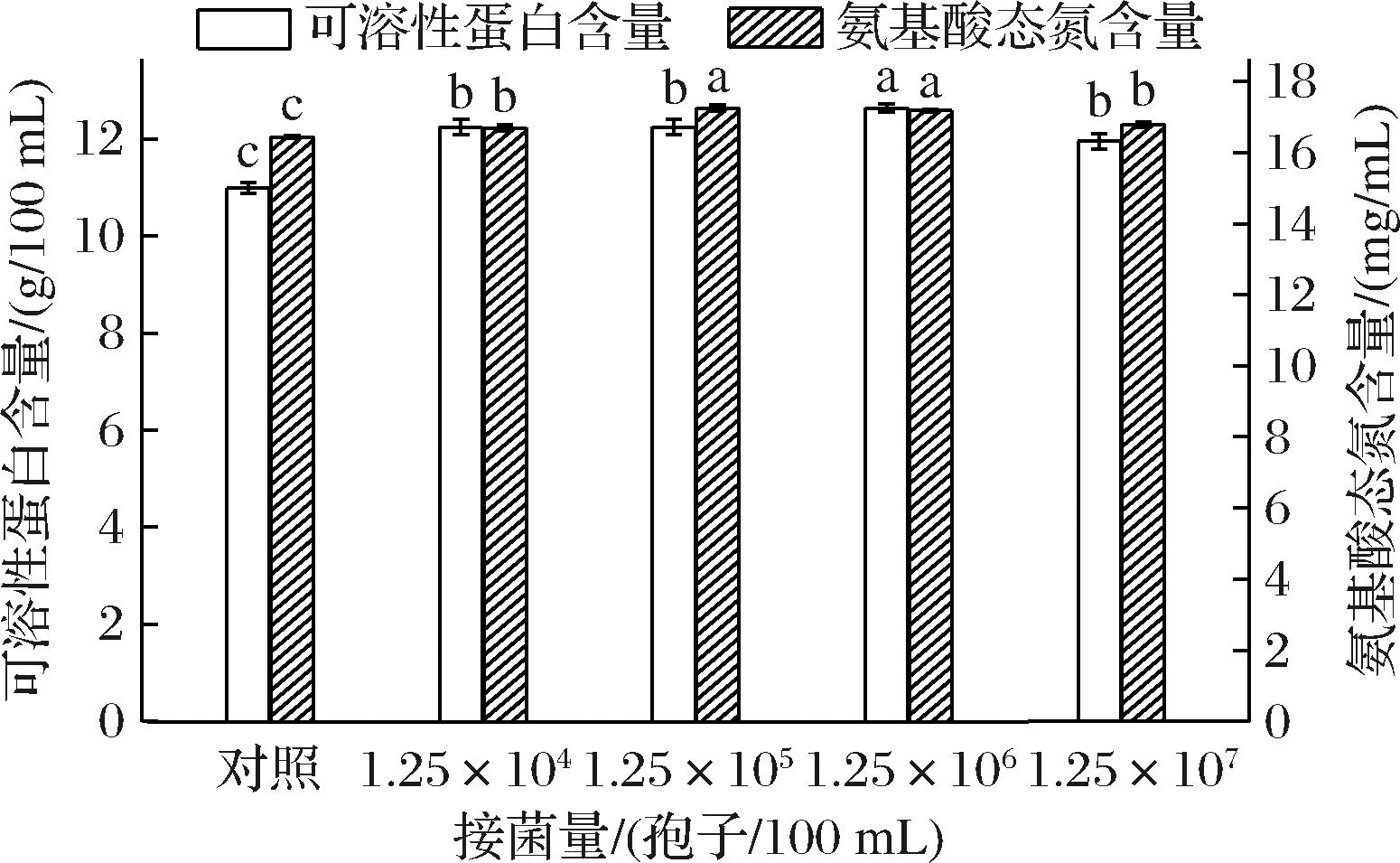
图4 接菌量对氨基酸态氮和可溶性蛋白含量的影响
Fig.4 Effect of inoculation amount on the contents of amino acid nitrogen and soluble protein
由图4可知,当接菌量为1.25×105孢子/100 mL时,发酵液中的氨基酸态氮含量最高,为17.25 mg/mL,比发酵前提高了4.99%。分析可能的原因是当接菌量为1.25×104孢子/100 mL时,由于接菌量较低,发酵速度慢,产生游离氨基酸的数量较少,氨基酸态氮含量较低。当接菌量超过1.25×105孢子/100 mL时,接菌量过大,底物中营养成分消耗增多,氨基酸态氮含量也随之降低。接菌量从1.25×105孢子/100 mL增加至1.25×106孢子/100 mL时,氨基酸态氮含量变化不显著(P>0.05),可溶蛋白含量仅提高3.19%,因此,从节约成本角度考虑,确定米曲霉的最适接菌量为1.25×105孢子/100 mL。
2.2.2 发酵温度
米曲霉的生长需要适宜的温度,这关系到菌体内酶的生成和活性[19]。如图5所示,当发酵温度为25 ℃时,玉米浆发酵液中的氨基酸态氮和可溶性蛋白含量均最高,分别为17.65 mg/mL和13.63 g/100 mL,说明此温度下会诱导米曲霉蛋白酶基因的表达,促进了玉米浆的发酵。继续升高温度,氨基酸态氮和可溶性蛋白含量逐渐降低,但与25 ℃相比变化不显著(P>0.05)。发酵温度为20 ℃时,细胞代谢缓慢,低温不利于米曲霉的生长繁殖,菌体生长滞后,菌体总量较低,导致米曲霉产生的蛋白酶量较少,对玉米浆的发酵程度较低。当发酵温度超过25 ℃时,可能是由于影响菌体内源性酶发挥作用或氮代谢物抑制了米曲霉蛋白酶的合成[20],导致氨基酸态氮和可溶性蛋白含量降低。因此,确定米曲霉发酵100%玉米浆的最适温度为25 ℃。
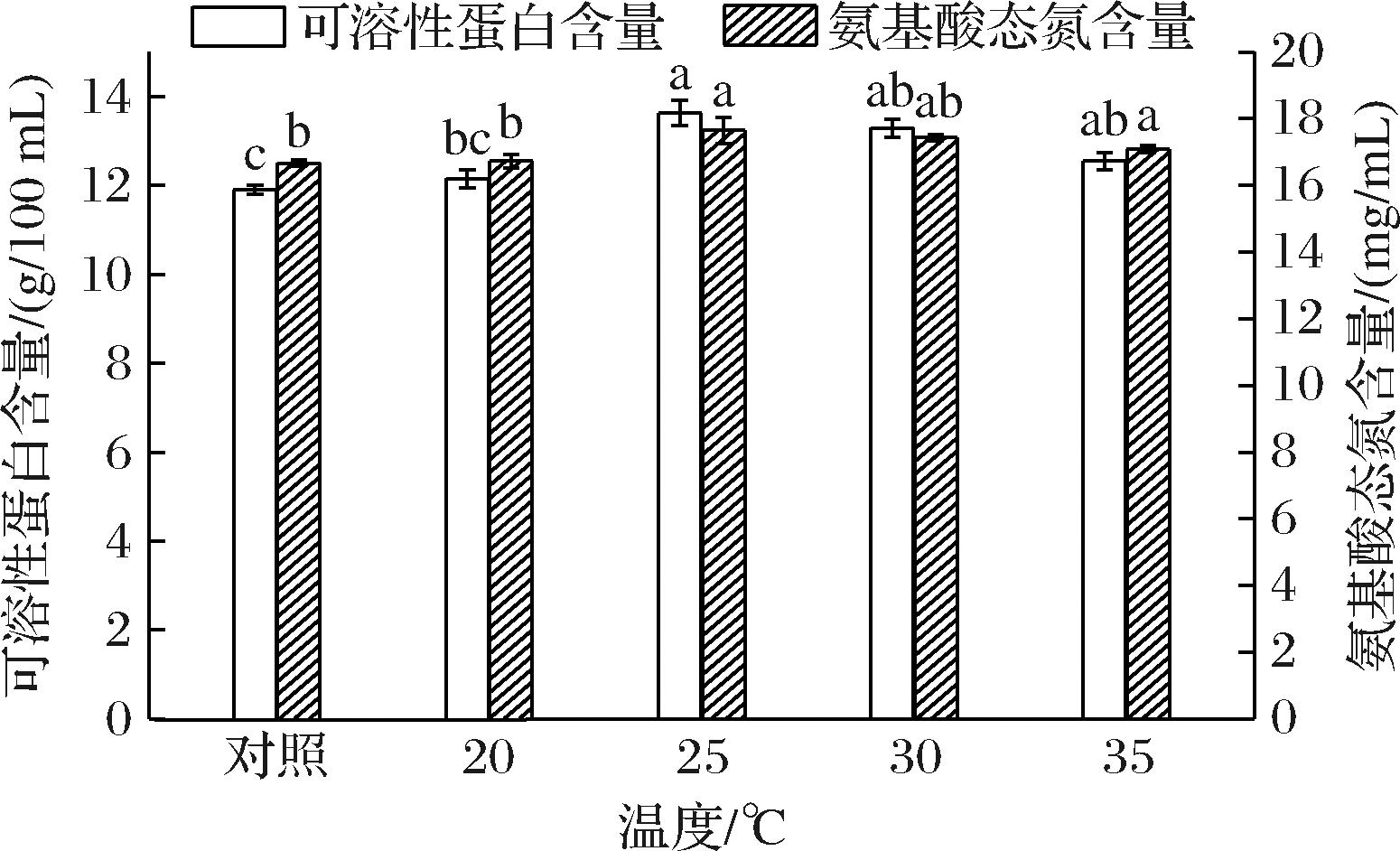
图5 发酵温度对氨基酸态氮和可溶性蛋白含量的影响
Fig.5 Effect of fermentation temperature on the contents of amino acid nitrogen and soluble protein
2.2.3 装液量
在摇瓶培养中,供氧量与摇瓶内培养基体积和转速有关。减小培养基体积或提高转速均可提高培养基中的溶氧水平[21]。如图6所示,随着装液量的增加,氨基酸态氮含量和可溶性蛋白含量均呈先升高后降低的变化趋势,在装液量为90 mL/250 mL时,氨基酸态氮含量和可溶性蛋白含量均达到最高,分别为18.65 mg/mL和13.95 g/100 mL,分别比对照组高9.00%和10.80%,可能的原因是米曲霉为好氧菌,在发酵100%玉米浆的过程中,需要适量的氧气供给,当装液量>90 mL/250 mL时,发酵系统供氧受限,影响了米曲霉的生长和繁殖及蛋白酶的产生,进而影响玉米浆的发酵程度。当装液量<90 mL/250 mL时,由于发酵体系中营养物质缺乏,发酵效率不高。因此,确定最佳装液量为90 mL/250 mL。
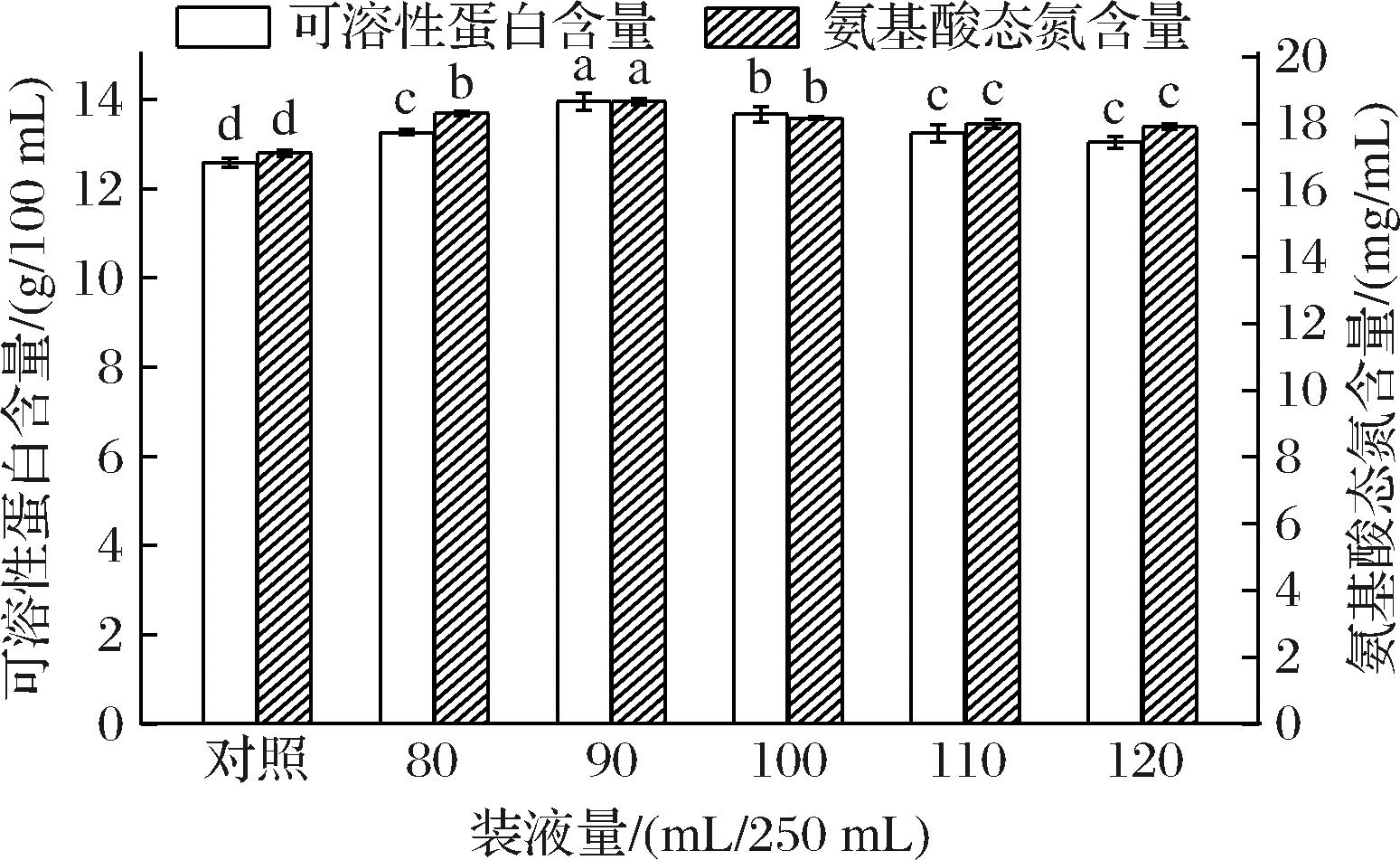
图6 装液量对氨基酸态氮和可溶性蛋白含量的影响
Fig.6 Effect of liquid loading amount on the contents of amino acid nitrogen and soluble protein
2.2.4 发酵初始pH
在温度25 ℃、接菌量1.25×105孢子/100 mL、装液量90 mL/250 mL和发酵时间为5 d条件下,研究发酵初始pH对氨基酸态氮含量和可溶性蛋白含量的影响,结果如图7所示。与对照组相比,发酵初始pH对氨基酸态氮和可溶性蛋白含量影响显著(P<0.05)。在发酵初始pH为5.6时,氨基酸态氮和可溶性蛋白含量均达到最大值,分别为18.88 mg/mL和15.54 g/100 mL,分别比对照组高17.71%和9.13%。pH值通过菌体营养物质离子化程度、细胞膜电荷及膜渗透性而影响菌体对营养成分的吸收和利用[22]。对于绝大多数微生物菌种而言,在最适pH环境下,新陈代谢和各种酶反应都更加活跃。由图7可知,pH值为5.6为米曲霉最适生长pH,能对100%玉米浆进行更好地发酵,产生更多氨基酸态氮,同时可溶性蛋白的含量也相应增加。而当pH超过米曲霉最适生长范围时,影响了米曲霉的生长繁殖及蛋白酶的产生,进而影响了100%玉米浆的发酵效率。因此,确定最适的发酵初始pH值为5.6。
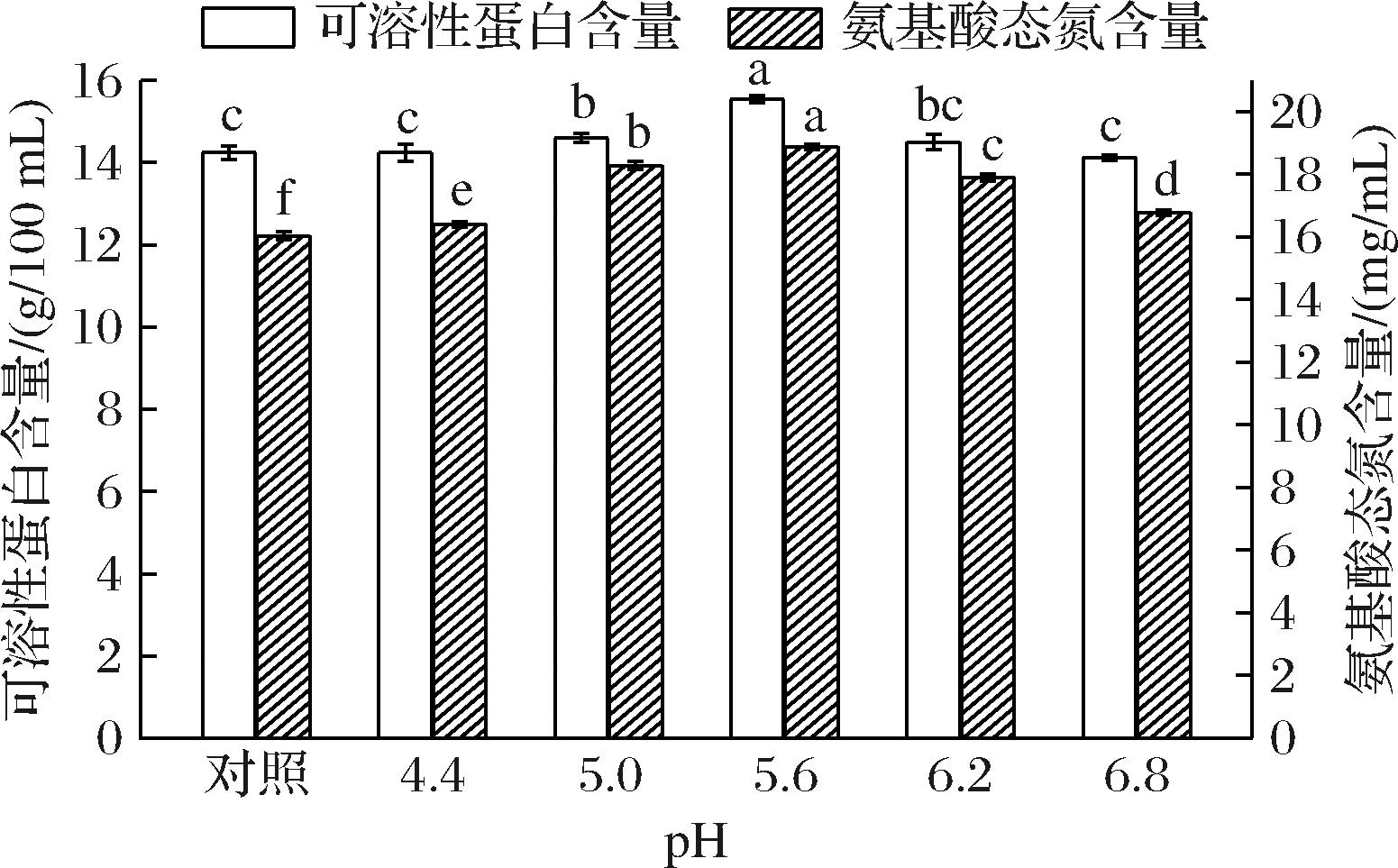
图7 发酵初始pH对氨基酸态氮及可溶性蛋白含量的影响
Fig.7 Effect of initial pH on the contents of amino acid nitrogen and soluble protein
2.2.5 发酵时间
发酵时间是影响发酵效果的关键因素,时间过短,菌种的发酵作用不充分,时间过长,菌种容易老化影响发酵效果,且会造成资源浪费[23]。由图8可知,随着发酵时间的延长,发酵液中氨基酸态氮含量和可溶性蛋白含量均呈先上升后下降的变化趋势。发酵7 d时,发酵液中氨基酸态氮含量和可溶性蛋白含量均达到最大值,分别为20.71 mg/mL和16.11 g/100 mL,分别比对照组高25.67%和27.15%,可能此时米曲霉在100%玉米浆中繁殖较快,玉米浆中的大分子质量蛋白质被快速分解成可溶性的小分子质量组分。在发酵前期(1~3 d),米曲霉生物量少,菌体分泌的蛋白酶量少,玉米浆发酵不充分,氨基酸态氮和可溶性蛋白含量较低。在发酵9 d时,随着碳源、氮源等营养物质消耗,米曲霉开始吸收利用发酵液中的小分子肽和氨基酸等物质维持自身生长,导致氨基酸态含量及可溶性蛋白含量显著降低(P<0.05)。因此,确定米曲霉发酵100%玉米浆的最佳时间为7 d。
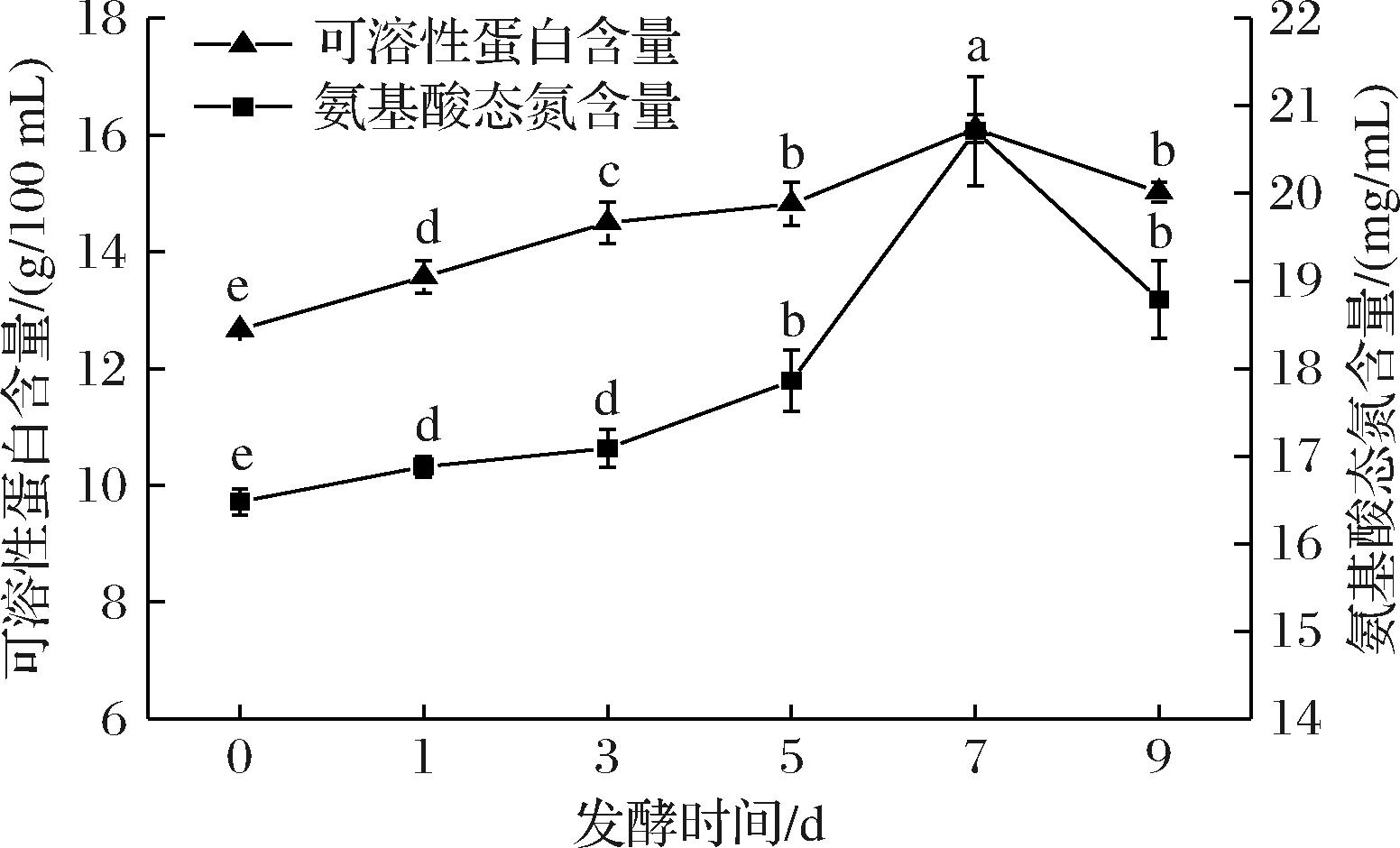
图8 发酵时间对氨基酸态氮和可溶性蛋白含量的影响
Fig.8 Effect of fermentation time on the contents of amino acid nitrogen and soluble protein
综上,单因素确定米曲霉发酵100%玉米浆的最佳条件:接菌量1.25×105孢子/100 mL、发酵温度25 ℃、装液量90 mL/250 mL、初始pH 5.6、发酵时间7 d。
2.3 正交试验优化米曲霉发酵100%玉米浆的工艺条件
如表2~表4所示,各因素对氨基酸态氮含量影响的顺序为A(接菌量)>C(初始pH)>B(时间),根据Ki值确定最佳试验组合为A2B3C3;各因素对可溶性蛋白含量影响的顺序为B(时间)>A(接菌量)>C(初始pH),根据Ki值确定最佳试验组合为A2B2C2,本实验以氨基酸态氮含量为主要指标,因此,确定米曲霉发酵100%玉米浆的最佳条件:米曲霉接菌量1.25×105孢子/100 mL,发酵时间8 d,发酵初始pH 5.9。3次验证实验,氨基酸态含量和可溶性蛋白含量分别为(21.75±0.12) mg/mL和(18.15±0.08) g/100 mL,表明正交试验得出的理想组合确实是最佳组合。
表2 正交试验结果与极差分析
Table 2 The results of orthogonal test and range analysis
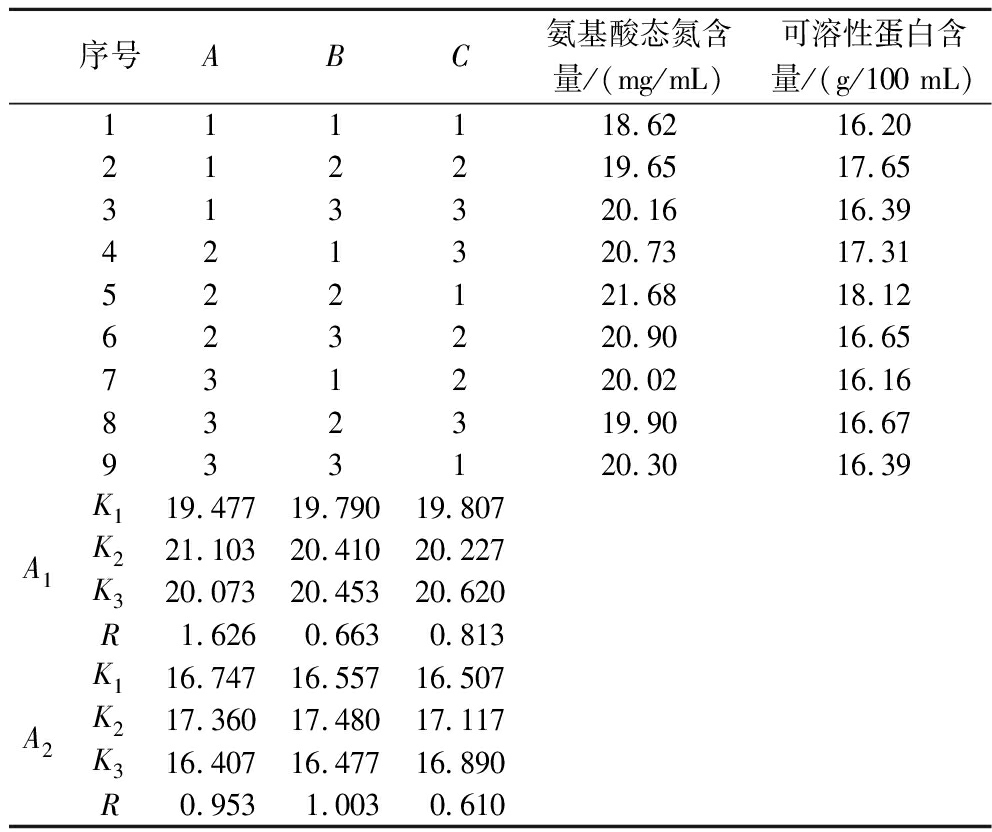
序号ABC氨基酸态氮含量/(mg/mL)可溶性蛋白含量/(g/100 mL)111118.6216.20212219.6517.65313320.1616.39421320.7317.31522121.6818.12623220.9016.65731220.0216.16832319.9016.67933120.3016.39A1K119.47719.79019.807K221.10320.41020.227K320.07320.45320.620R1.6260.6630.813A2K116.74716.55716.507K217.36017.48017.117K316.40716.47716.890R0.9531.0030.610
注:A1为氨基酸态氮含量的Ki值和R值,A2为可溶性蛋白含量的Ki值和R值。
表3 氨基酸态氮含量的方差分析结果
Table 3 Results of variance analysis of amino acid nitrogen content
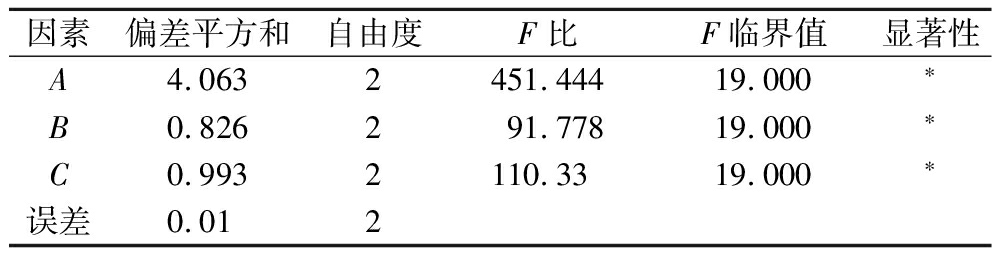
因素偏差平方和自由度F比F临界值显著性A4.0632451.44419.000∗B0.826291.77819.000∗C0.9932110.3319.000∗误差0.012
注:*为显著(P<0.05)(下同)。
表4 可溶性蛋白含量的方差分析结果
Table 4 Results of variance analysis of soluble protein content
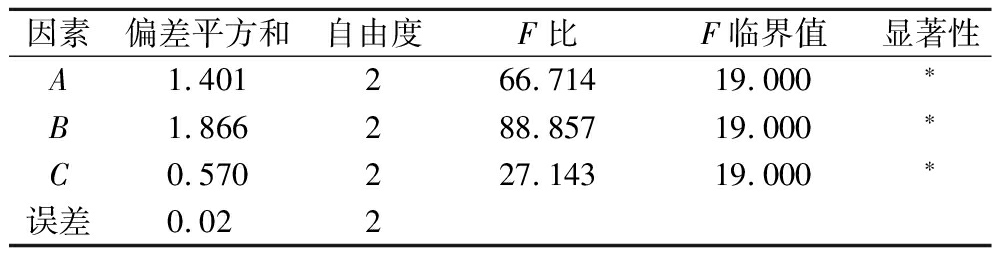
因素偏差平方和自由度F比F临界值显著性A1.401266.71419.000∗B1.866288.85719.000∗C0.570227.14319.000∗误差0.022
3 结论
为了获得对玉米浆复杂条件更耐受的米曲霉菌株,在100%玉米浆固体培养基中连续驯化米曲霉菌株。经过4次连续传代驯化后,米曲霉在玉米浆培养基上菌丝形成和孢子成熟时间分别缩短40%和30%,且驯化后的米曲霉能更好的发酵玉米浆中的蛋白质,表明米曲霉经过驯化后逐渐适应了玉米浆的培养环境。采用驯化米曲霉为菌种发酵高浓度玉米浆,以氨基酸态氮含量为主要指标,结合可溶性蛋白含量,通过单因素试验和正交试验确定了米曲霉发酵100%玉米浆的最佳工艺条件。在最佳条件下,氨基酸态含量和可溶性蛋白含量分别比未发酵玉米浆提高了71.67%和10.74%。在此基础上,可以将100%玉米浆发酵产物应用于黑木耳等食用菌栽培生产中,用于替代或部分替代豆粕和麸皮等菌袋氮源营养素,以降低食用菌栽培的价格。
[1] 尤新. 玉米深加工技术[M].北京:中国轻工业出版社, 1999.YOU X.Corn Deep Processing Technology[M].Beijing:China Light Industry Press, 1999.
[2] JIAO Y, CHEN H D, HAN H, et al.Development and utilization of corn processing by-products:A review[J].Foods, 2022, 11(22):3709.
[3] ZHOU K M, YU J, MA Y H, et al.Corn steep liquor:Green biological resources for bioindustry[J].Applied Biochemistry and Biotechnology, 2022, 194(7):3280-3295.
[4] 张嘉雨, 曹越, 马文萱, 等.玉米浆中蛋白提取及酶解工艺[J].食品工业, 2019, 40(5):93-95.ZHANG J Y, CAO Y, MA W X, et al.Extraction and enzymolysis technology of protein from corn steep liquor[J].The Food Industry, 2019, 40(5):93-95.
[5] 李晶, 郑喜群, 刘晓兰, 等.玉米浆发酵液对杏鲍菇菌丝生长的影响[J].黑龙江八一农垦大学学报, 2021, 33(6):60-64.LI J, ZHENG X Q, LIU X L, et al.Effect on mycelium growth and nutritional value of Pleurotus eryngii with fermentated corn steep liquor[J].Journal of Heilongjiang Bayi Agricultural University, 2021, 33(6):60-64.
[6] CHOVATIYA S G, BHATT S S, SHAH A R.Evaluation of corn steep liquor as a supplementary feed for Labeo rohita (Ham.) fingerlings[J].Aquaculture International, 2011, 19(1):1-12.
[7] 熊雪, 万丽英, 向准, 等.马桑香菇液体菌种发酵条件的研究[J].江西农业学报, 2023, 35(3):137-145.XIONG X, WAN L Y, XIANG Z, et al.Research on fermentation conditions for liquid strain of Lentinula edodes[J].Acta Agriculturae Jiangxi, 2023, 35(3):137-145.
[8] 李春霞, 吴建金, 黄亮, 等.香菇0912液体菌种培养基及摇瓶发酵条件的筛选[J].天津农业科学, 2019, 25(2):1-6.LI C X, WU J J, HUANG L, et al.Screening of liquid medium and fermentation conditions for Lentinus edodes 0912 by shaking flask[J].Tianjin Agricultural Sciences, 2019, 25(2):1-6.
[9] 叶青雷, 马云桥.黑龙江省食用菌产业发展现状及对策[J].安徽农学通报, 2022, 28(1):24-25.YE Q L, MA Y Q.Development status and countermeasures of edible fungi industry in Heilongjiang Province[J].Anhui Agricultural Science Bulletin, 2022, 28(1):24-25.[10] 王明友, 宋卫东, 王帅洋, 等.我国黑木耳生产技术研究[J].中国农机化学报, 2022, 43(3):99-103.WANG M Y, SONG W D, WANG S Y, et al.Research on production technology of Auricularia auricula in China[J].Journal of Chinese Agricultural Mechanization, 2022, 43(3):99-103.
[11] 黄磊, 刘玫, 浦媛媛, 等.食用菌固体培养基的开发与应用综述[J].湖北农业科学, 2013, 52(10):2246-2249;2263.HUANG L, LIU M, PU Y Y, et al.Review on the development and application of edible fungus solid culture medium[J].Hubei Agricultural Sciences, 2013, 52(10):2246-2249;2263.
[12] 李晶, 郑喜群, 刘晓兰.玉米浆发酵液对杏鲍菇营养价值和非挥发性呈味物质含量的影响[J].食品与机械, 2021, 37(12):46-51.LI J, ZHENG X Q, LIU X L.The effect on nutritional value and non-volatile flavor substance content of Pleurotus eryngii with fermentable corn steep liquor[J].Food &Machinery, 2021, 37(12):46-51.
[13] 姜未公, 刘晓兰.毛霉水解玉米浆制备植物蛋白调味液的条件初探[J].齐齐哈尔大学学报(自然科学版), 2019, 35(2):68-72.JIANG W G, LIU X L.Preliminary study on the conditions for the preparation of vegetable protein flavoring liquid by the mildew hydrolysis of corn pulp[J].Journal of Qiqihar University(Natural Science Edition), 2019, 35(2):68-72.
[14] 王晓燕, 刘晓兰, 刘井权, 等.菌酶协同水解玉米浆制备植物蛋白调味液工艺优化[J].食品研究与开发, 2022, 43(20):156-163.WANG X Y, LIU X L, LIU J Q, et al.Preparation optimization of hydrolyzed vegetable protein from corn steep liquor by Aspergillus oryzae and flavourzyme[J].Food Research and Development, 2022, 43(20):156-163.
[15] 李海燕. 玉米浆及其副产物的制备与应用[D].武汉:湖北工业大学, 2013.LI H Y.The preparation and applications of corn syrup and its by-products[D].Wuhan:Hubei University of Technology, 2013.
[16] 韩蒙蒙. 米曲霉发酵绿豆皮条件的优化及产物分析[D].天津:天津科技大学, 2022.HAN M M.Optimization of Aspergillus oryzae fermentation conditions of mung bean skin and its product analysis[D].Tianjin:Tianjin University of Science and Technology, 2022.
[17] 陈雅蕙, 俞瑞元, 袁明秀, 等.生物化学实验原理和方法[M].北京:北京大学出版社, 2005:236-238.CHEN Y H, YU R Y, YUAN M X, et al.Experimental Principles and Methods of Biochemistry[M].Beijing:Peking University Press, 2005:236-238.
[18] PADMANABHAN S, RAMANA MURTHY M V, LONSANE B K.Potential of Aspergillus oryzae CFTRI 1480 for producing proteinase in high titres by solid state fermentation[J].Applied Microbiology and Biotechnology, 1993, 40(4):499-503.
[19] SAMARNTARN W, CHEEVADHANARAK S, TANTICHAROEN M.Production of alkaline protease by a genetically engineered Aspergillus oryzae U1521[J].The Journal of General and Applied Microbiology, 1999, 45(3):99-103.
[20] 朱运平, 郗梦露, 李秀婷, 等.高产柚苷酶菌株米曲霉的诱变育种及发酵条件优化[J].中国食品学报, 2018, 18(8):115-124.ZHU Y P, XI M L, LI X T, et al.Screening and mutagenesis of Aspergillus oryzae for high yield naringinase and the optimization of fermentation conditions[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(8):115-124.
[21] WANG Y H, FENG J T, ZHANG Q, et al.Optimization of fermentation condition for antibiotic production by Xenorhabdus nematophila with response surface methodology[J].Journal of Applied Microbiology, 2008, 104(3):735-744.
[22] LONG R, YANG W J, HUANG G L.Optimization of fermentation conditions for the production of epothilone B[J].Chemical Biology &Drug Design, 2020, 96(2):768-772.
[23] DUAN S B, SHI Z P, FENG H J, et al.An on-line adaptive control based on DO/pH measurements and ANN pattern recognition model for fed-batch cultivation[J].Biochemical Engineering Journal, 2006, 30(1):88-96.