大曲被誉为“酒之骨”,其品质对于白酒发酵至关重要[1]。目前对中高温大曲质量的判断主要依赖于工人长期积累的生产经验及部分理化性质的测定[2],但仅通过这些简单方式对大曲品质进行评判具有一定的局限性,使得大曲的品质稳定性较差,“批次效应”严重。近年来,大曲内所蕴含的微生物及其功能成为研究热点,MAO等[3]研究了中高温大曲在制备过程中细菌的多样性及其群落演替与大曲理化性质的相关性,发现驱动细菌群落演替的关键因素是大曲的理化性质,例如酶活性、酸度及水分等;YANG等[4]研究了乳酸菌在中高温大曲中的潜在功能,发现乳酸菌与大曲的含氮风味物质的产生密切相关;ZHOU等[5]发现3种不同类型大曲的真菌群落结构差异较大,并且发酵温度对于真菌群落多样性的影响较大;ZHU等[6]通过宏基因组分析揭示了7个地区的大曲微生物群落和功能差异,发现不同大曲样本之间的微生物和功能代谢存在显著差异;MA等[7]研究了5个不同产区的中高温大曲,同样发现彼此之间的微生物群落结构、挥发性代谢物及功能存在显著差异,不同地区的大曲具有明显的“独特性、唯一性”。
当前,邛崃产区作为中国最大的浓香型白酒原酒生产基地,有关邛崃产区中高温大曲在制备过程中的性能及微生物动态变化的专门研究报道依然较少,邛崃产区中高温大曲制备过程的动态变化尚不明确。基于此,本研究以邛崃某白酒企业生产制备过程中不同阶段的中高温大曲为样本,研究其在制备过程中的性能及微生物动态变化,探究适宜的生产周期,以期为邛崃产区的中高温大曲“标准化”品控提供一定的理论依据,助力邛酒的“提质振兴”。
1 材料与方法
1.1 材料与试剂
戊酸乙酯标准物质(纯度≥98%),国药集团化学试剂有限公司;细菌基因组DNA提取试剂盒,OMEGA bio-tek有限公司。
1.2 仪器与设备
DHP-9082电热恒温培养箱,上海一恒科技有限公司;BS210S电子分析天平,德国Sartorius公司;CS501恒温水浴锅,上海浦东荣丰科学仪器有限公司;PHS-3C型pH计,安亭科学仪器厂;TU-1901紫外分光光度计,上海仪电科学仪器有限公司;7820A气相色谱仪,美国Agilent公司;TSQ9000Ⅱ色谱-质谱联用仪,美国Thermo Fisher公司;50/30 μmDVB/CAR/PDS三项萃取头,美国Supelco公司。
1.2 样品采集
大曲样品由邛崃市某白酒企业提供。样品制备于第二轮制曲(9月),大曲制备30、60、90、120、150 d命名为样品30、60、90、120、150 d。
将大曲按照图1均分成4小块,取整块大曲的对角小块经粉碎机粉碎并充分混合,按四分法取100 g曲粉在-20 ℃冰柜保存备用。
图1 大曲取样示意图
Fig.1 Schematic diagram of Daqu sampling
1.3 DNA提取和高通量测序
称取5 g大曲,使用试剂盒提取DNA,用紫外分光光度计测定其浓度与纯度。使用引物338F/806R(5′-ACTCCTACGGGAGGCAGCAGAG-3′/5′-GGACTA-CHVGGTWTCTAAT-3′)扩增细菌16S rRNA基因的V3~V4可变区域,用引物ITS1f/2043R(5′-CTTGGTCATTAGGAAGA-3′/5′-GCTGCGTTCTTCATCGATGC-3′)扩增真菌rRNA基因的ITS区。
扩增体系(25 μL):TCATT缓冲液5 μL,5uGC缓冲液5 μL,Dtnp(2.5 mmol/L) 2 μL,正向引物(10 μL),反向引物(10 μL),DNA模板2 μL,ddH2O 8.75 μL,Q5 DNA聚合酶0.25 μL。细菌扩增程序为98 ℃预热2 min,98 ℃变性15 s,55 ℃退火30 s,72 ℃延伸30 s,一共25个循环,最后72 ℃保持5 min。真菌扩增程序:95 ℃预热3 min,95 ℃变性30 s,61 ℃退火30 s,72 ℃延伸45 s,共32个循环,最后72 ℃保持10 min。采用Illumina平台进行测序。
1.4 理化性质的测定
参照QB/T 4257—2011《酿酒大曲通用分析方法》进行测定。水分:称取10 g大曲样品于105 ℃烘箱中烘干至恒重,测定其前后差重,以此确定其水分含量。酸度:用酸碱滴定法,将处理后的样品用0.1 mol/L的NaOH标准溶液滴定至pH=8.2,根据公式计算酸度。根据测定方法中的描述,糖化力和液化力的定义:35 ℃条件下,1 g大曲在乙酸-乙酸钠缓冲体系中,1 h能够液化淀粉和释放葡萄糖的能力。酯化力定义:35 ℃条件下,50 g大曲在己酸和乙醇的混合液中每7 d所产生的己酸乙酯的能力。发酵力的定义:30 ℃条件下,1 g大曲每72 h把碳水化合物转化成CO2的能力。所有测定均设置3个平行组,结果均以大曲干重表示。
1.5 挥发性物质的测定
样品预处理:参考JIA等[8]所述方法稍作修改。称取大曲样品1.00 g与25 mL顶空瓶中,加入50 μL乙酸戊酯溶液(0.087 5 mg/mL)作为内标。将顶空瓶置于恒温磁力搅拌器中500 r/min、(60±1) ℃预热30 min,用萃取头吸附提取50 min。结束后,将SPME纤维插入GC进样口解吸5 min,检测其挥发性组分。
GC-MS检测操作条件:40 ℃保持2 min,以5 ℃/min升至230 ℃,保持8 min,进样口温度为250 ℃。进样后延迟2 min后开始检测。
检测质谱数据通过与标准谱库(NIST 2017)对比进行组分鉴定,对比匹配度≥75的物质予以分析。根据加入内标浓度,采用峰面积归一法确定挥发性组分的相对含量。
2 结果与分析
2.1 中高温大曲制备过程中性能变化
依据QB/T 4257—2011《酿酒大曲通用分析方法》中的指标,从大曲的外观、断面和风格3个方面进行评分设计,外观和断面分值皆为10分。大曲的风格尤为重要,设计分值20分,总分40分。从酒厂随机挑选10名专业人士,对不同制备时间的大曲进行感官评分,统计结果汇总表1。
表1 不同制备时间的大曲感官评分
Table 1 Sensory score of Daqu at different preparation times

项目总分30 d60 d90 d120 d150 d特征得分特征得分特征得分特征得分特征得分外观10灰白色带微黄色,上霉均匀无裂口6灰白色带微黄,少许异色,上霉较好,少许裂口8灰白色带微黄,少许异色,上霉较好,少许裂口8灰白色带微黄,上霉较好,少许裂口8灰白色,上霉较好,少许裂口8断面10断面较规整,略微死板;曲心有较多菌丝,少许黄色菌点5曲香较为浓郁;断面欠泡气,皮张略薄6曲香较为浓郁;断面欠泡气,皮张略薄6浓香泡气色正,皮张薄8曲香较为浓郁,泡气色正,皮张薄7风格20曲香寡淡,有些许酸味及霉味15曲香味单薄,些许霉味16曲香不明显,略带霉味17曲香浓郁,无明显杂味19曲香味单薄,无明显杂味18总分402630313533
由表1可知,样本30 d的大曲菌丝较多,但曲香寡淡,并且带有些许霉味。可能是由于前期水分较高,霉菌活性代谢旺盛导致的[9]。但随着制备时间的增加,香味物质逐渐在大曲中积累[10]。样本60 d大曲曲香较为浓郁,略微带有霉味。样本120 d大曲从断面观察,皮张薄、泡气色正、曲香浓郁、无霉味。在制备150 d时,大曲香味变淡,但仍无明显杂味。
根据大曲感官评分,前期曲香寡淡,随着制备时间增加,香味逐渐浓郁。霉味在前期较为明显,后期消失。大曲感官差异较为明显,其中样本120 d评分较高。
从图2可知,大曲的水分基本稳定在8%~10%左右,样本120 d水分含量显著性下降24.25%,可能是由于该段时间正处于邛崃冬季最寒冷的12月,空气寒冷干燥,湿度下降,导致大曲中的水分挥发更快,因此大曲水分含量下降。制备过程中,酸度总体呈下降趋势,与GUAN等[11] 的研究结果相反。样本120 d的酸度急速下降,可能与水分含量的下降有关[12]。大曲内水分的含量与微生物的代谢高度相关,水分下降时,产酸微生物代谢变缓,产物减少,因此大曲酸度大幅下降[13]。样本150 d水分含量显著上升,大曲酸度随即上升,恢复至正常水平,趋于稳定,维持在0.5 mmol/10 g曲水平波动。由此可见,大曲中水分与酸度的趋势具有“同步性”。制备过程中大曲的发酵力则是在0.7~1.3 g/(0.5 g·72 h)之间呈现相对规律的波动。液化力在30 d样本中水平较低[(0.37±0.02) g/(g·h)],在60 d样本中达到最高水平[(1.25±0.07) g/(g·h)],入库前后相对提升237.84%。大曲的糖化力在整个制备过程中变化较小,总体呈上升趋势,在样本120 d中达到最高水平[(457.67±6.31) g/(g·h)]后略微下降。酯化力在大曲制备前期(30~90 d)逐渐提升后缓慢下降,其中样本90 d较60 d显著提升55.35%达到最高水平[(1 044.17±4.34) mg/(50 g·7 d)]。性能结果表明,大曲在制备过程中(特别是储存期),水分含量不断下降,微生物活性逐渐降低,大曲的性能差异显著但逐渐趋于稳定。因此,经过适宜储存且性能较稳定的优质大曲才能够运用在白酒的实际生产中。

a-水分、酸度及发酵力;b-液化力、糖化力及酯化力
图2 不同制备时间大曲的主要理化性质
Fig.2 Main physicochemical properties of Daquwith different preparation times
2.2 中高温大曲制备过程中挥发性物质的变化
大曲中的风味物质能够作为白酒香味物质的直接来源或前体合成物质[10,14]。在本次实验中,共检测出35种挥发性物质,其中17种酯类、6种醇类、1种醛类、2种吡嗪类、1种酮类、5种烷烃类以及3种其他类,酸类和酚类在样品中均未检测出。
如图3-a所示,风味物质的主要贡献者酯类至少占挥发性物质总类的60%以上。其中酯类占比在制备了120 d的大曲中达到了最高水平(94.72%)。在样本60 d中,出现了不同于其他样本酯类与醇类的总占比急剧下降,较样本30 d显著下降了28.46%。可能是由于30 d样本的大曲在曲房培菌,该环境下长期培养大曲,微生物丰富,适合大曲发酵,因此产香浓郁[15]。而60 d样本在为更换环境后入库的首次测试样本。库房环境不同于曲房,湿度与温度下降,因此微生物活性受限,大曲生香较少,并且库房较曲房相比,空间更大,风味物质的挥发性增强。因此60 d样本占比呈现显著差异,在图3-b中也有着同样的结果。挥发性物质在制备30 d的大曲中总含量最高,但该样本水分含量较高(图2-a),微生物活跃,造成其性能与微生物群落结构的不稳定,不能直接投入到白酒酿造中。此外,30 d样本风味中含有霉味,杂味较多(表1),同样不符合优质大曲选用标准。相反,样本120 d的大曲感官评分最高,曲香浓郁,无明显杂味(表1),水分含量低(图2-a),微生物活性小,结构稳定,且酯类的占比以及挥发性物质的含量达到较高水平,有利于白酒的生香,提高白酒的品质[16]。
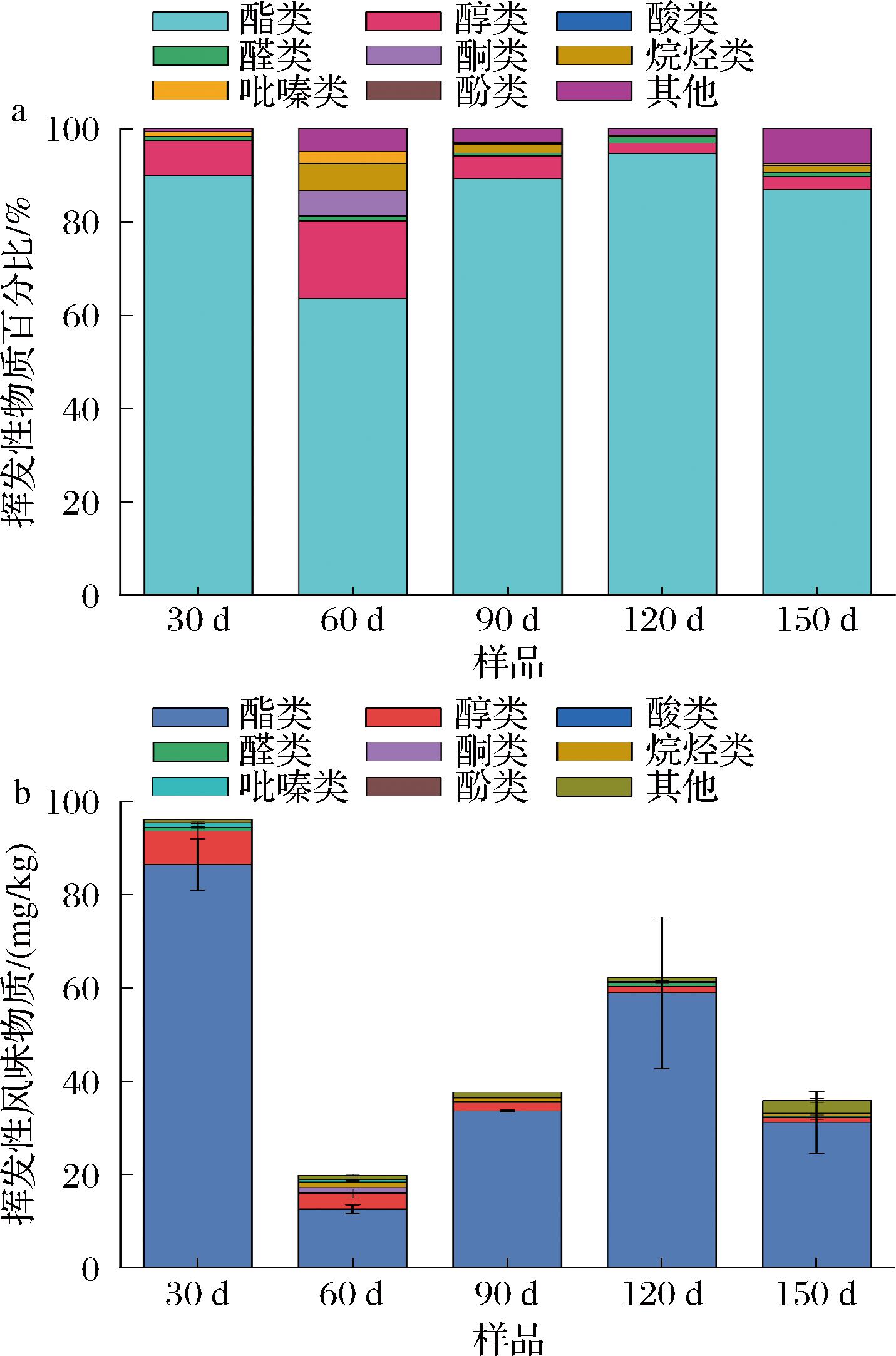
a-挥发性物质占比;b-挥发性物质含量
图3 大曲中挥发性物质占比和含量
Fig.3 The proportion and content of volatile substances in Daqu
样本30、60、90、120、150 d的大曲中分别含有18、18、21、17及18种挥发性物质(表2)。
表2 不同制备时间的大曲中挥发性物质明细
Table 2 Details of volatile substances in Daquat different preparation times
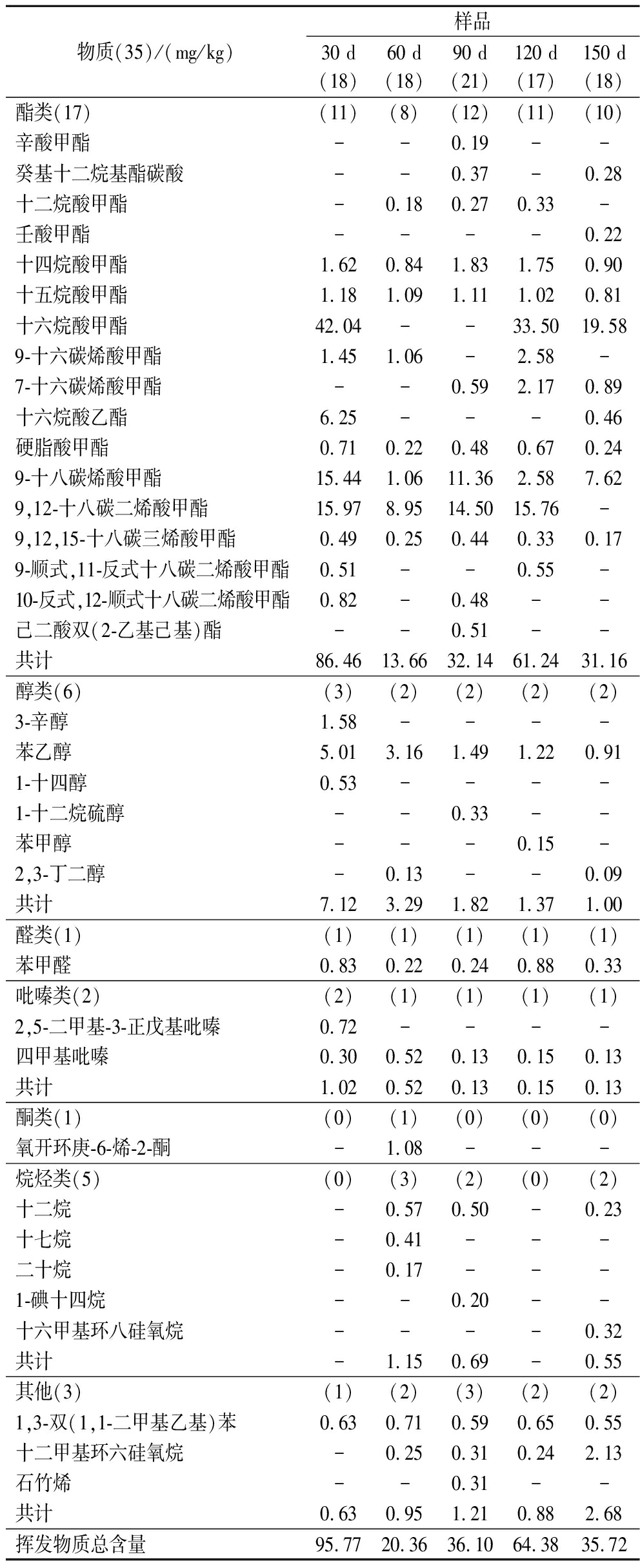
物质(35)/(mg/kg)样品30 d(18)60 d(18)90 d(21)120 d(17)150 d(18)酯类(17)(11)(8)(12)(11)(10)辛酸甲酯--0.19--癸基十二烷基酯碳酸--0.37-0.28十二烷酸甲酯-0.180.270.33-壬酸甲酯----0.22十四烷酸甲酯1.620.841.831.750.90十五烷酸甲酯1.181.091.111.020.81十六烷酸甲酯42.04--33.5019.589-十六碳烯酸甲酯1.451.06-2.58-7-十六碳烯酸甲酯--0.592.170.89十六烷酸乙酯6.25---0.46硬脂酸甲酯0.710.220.480.670.249-十八碳烯酸甲酯15.441.0611.362.587.629,12-十八碳二烯酸甲酯15.978.9514.5015.76-9,12,15-十八碳三烯酸甲酯0.490.250.440.330.179-顺式,11-反式十八碳二烯酸甲酯0.51--0.55-10-反式,12-顺式十八碳二烯酸甲酯0.82-0.48--己二酸双(2-乙基己基)酯--0.51--共计86.4613.6632.1461.2431.16醇类(6)(3)(2)(2)(2)(2)3-辛醇1.58----苯乙醇5.013.161.491.220.911-十四醇0.53----1-十二烷硫醇--0.33--苯甲醇---0.15-2,3-丁二醇-0.13--0.09共计7.123.291.821.371.00醛类(1)(1)(1)(1)(1)(1)苯甲醛0.830.220.240.880.33吡嗪类(2)(2)(1)(1)(1)(1)2,5-二甲基-3-正戊基吡嗪0.72----四甲基吡嗪0.300.520.130.150.13共计1.020.520.130.150.13酮类(1)(0)(1)(0)(0)(0)氧开环庚-6-烯-2-酮-1.08---烷烃类(5)(0)(3)(2)(0)(2)十二烷-0.570.50-0.23十七烷-0.41---二十烷-0.17---1-碘十四烷--0.20--十六甲基环八硅氧烷----0.32共计-1.150.69-0.55其他(3)(1)(2)(3)(2)(2)1,3-双(1,1-二甲基乙基)苯0.630.710.590.650.55十二甲基环六硅氧烷-0.250.310.242.13石竹烯--0.31--共计0.630.951.210.882.68挥发物质总含量95.7720.3636.1064.3835.72
注:“()”内为挥发性物质数量;“-”为未检测出。
酯类物质大多为产脂酵母、丝状真菌或细菌的代谢产物,或是在乙醇存在的情况下,通过脂肪酸酯化形成[17],是白酒香气的主要贡献者,能够为白酒提供果味及花香[16,18]。十四烷酸甲酯具有似蜂蜜和鸢尾样的独特香气[19],其含量在样本60 d(0.84 mg/kg)与150 d(0.90 mg/kg)水平较低,显著低于其他样本含量(P<0.05)。十六烷酸乙酯呈微弱蜡香和奶油香气,能够为白酒复合香气做出一定贡献[20-21],但本研究仅在30 d(6.25 mg/kg)和150 d(0.46 mg/kg)样本中检测到,可能是由于大曲制备过程中微生物群落结构变化所导致的代谢物种类改变。醇类物质是白酒酿造中的重要副产品,但仍对白酒的风味和口感有一定的贡献度,具有中和白酒风味与口感,增加白酒甜度与回味等作用[22]。苯乙醇具有清甜的玫瑰花香,能够为白酒提供果味,在苹果、杏仁、香蕉、桃子、梨子、草莓、可可、蜂蜜等天然植物中都有所发现[22-23]。苯甲醇具有茉莉花香,被认定为米酒的主要香气成分之一,能够为白酒提供花香味[24]。也有相关研究报道,3-辛醇、2,3-丁二醇等也有助于白酒风味的形成[22]。吡嗪类物质主要通过糖类物质与含氮物质之间的美拉德反应形成,具有烤花生、榛子、可可和坚果香气[18, 25-26],能够为白酒提供坚果、焦香味[26-27]。另外,四甲基吡嗪具有治疗心血管疾病作用[28],也是白酒中的有益物质,一般在酱香型白酒中占比较高[20]。本研究发现,四甲基吡嗪与苯乙醇的含量都与大曲储存时间呈现显著负相关(P<0.05,表2),与HE等[29]的研究结果相反,原因可能是大曲储存过程中水分含量下降致使微生物菌群活性降低,间接造成挥发性物质含量的减少。另一方面,大曲储存期(60~150 d)挥发性物质的“逃逸现象”也有可能是其原因之一。总之,大曲的挥发性风味物质在储存过程中会不断地发生演替和交联,但逐渐趋于动态稳定和相对平衡状态,适宜的大曲储存期将助力实现“品质化”和“经济性”的平衡。
2.3 中高温大曲制备过程中微生物群落演替变化
2.3.1 α多样性指数分析
基于Chao1的稀释曲线都趋于饱和,测序结果覆盖足以评估系统中的微生物群落范围。如表3所示,制备过程中大曲的群落α多样性的变化趋势类似。结合Shannon指数和Simpson指数来看,真菌和细菌的多样性均呈现降升交替规律。在30 d时,细菌和真菌的多样性较高。细菌的多样性在90 d达到最高水平,真菌在120 d达到最高水平,后续逐渐降低。在整个制备的过程中,细菌对于大曲群落内多样性的影响较大,真菌则是较为平缓。
表3 不同制备时间的大曲中α多样性
Table 3 α-Diversity of Daqu at different preparation times
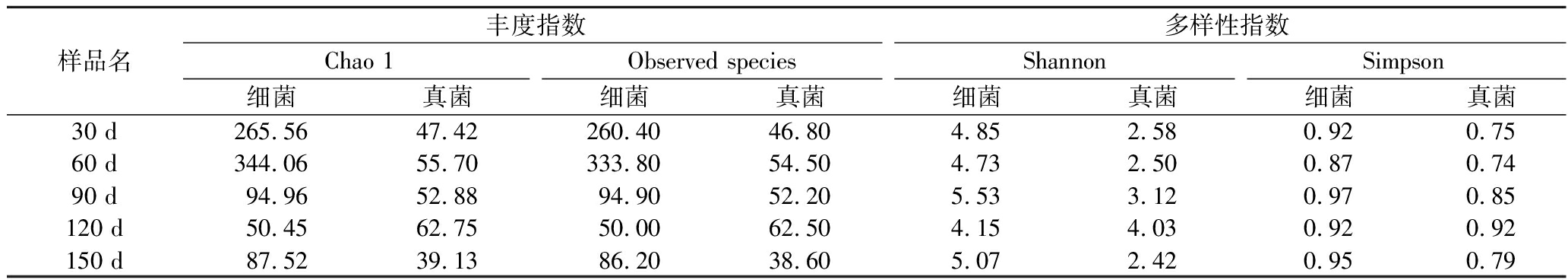
样品名丰度指数多样性指数Chao 1Observed speciesShannonSimpson细菌真菌细菌真菌细菌真菌细菌真菌30 d265.5647.42260.4046.804.852.580.920.7560 d344.0655.70333.8054.504.732.500.870.7490 d94.9652.8894.9052.205.533.120.970.85120 d50.4562.7550.0062.504.154.030.920.92150 d87.5239.1386.2038.605.072.420.950.79
2.3.2 主坐标分析(principal coordinates analysis,PCoA)
为了探寻大曲制备过程中微生物群落结构的变化,对大曲样品进行PCoA。由图4-a可知,PCo1轴和PCo2轴对细菌群落组成差异的解释度分别为44.7%和26.1%,共计70.8%。制备30、60 d时细菌结构相近,制备90、120、150 d样本相互分离较远,说明在制备90~150 d时,大曲细菌群落组成发生改变,具有差异。图4-b所示的PCo1轴和PCo2轴对真菌群落组成差异的解释度分别是37.3%和26.8%,总解释度为64.1%。制备30 d和制备60 d样本坐标几乎重合,说明其真菌群落结构差异极小,从图6中也可得知,微生物的群落结构类似,无显著性差异。在大曲制备90~150 d时,真菌群落结构在PCo1轴无差异,但在PCo2轴存在差异。
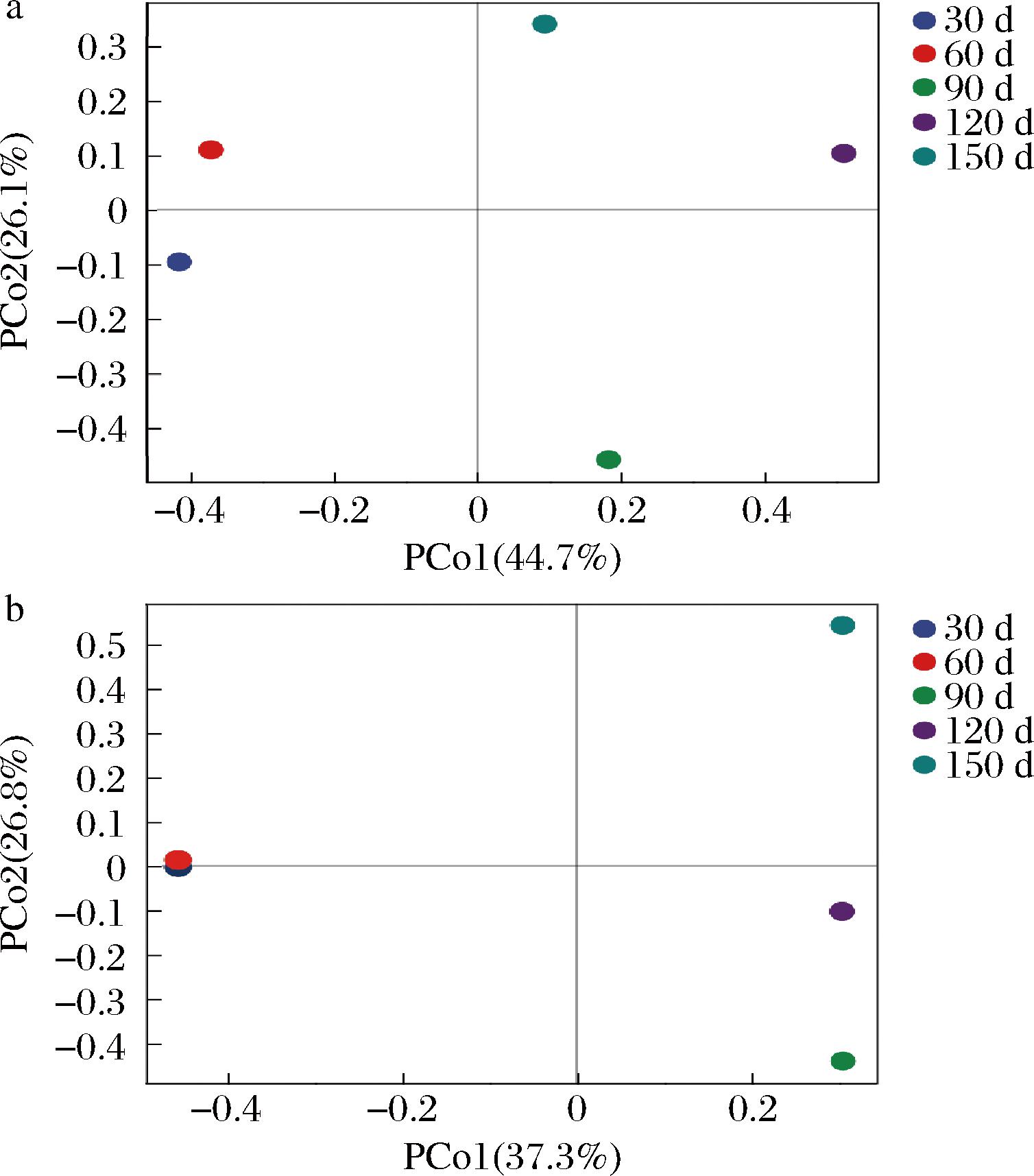
a-细菌;b-真菌
图4 大曲中细菌与真菌PCoA结果
Fig.4 PcoA results of bacteria and fungi in Daqu
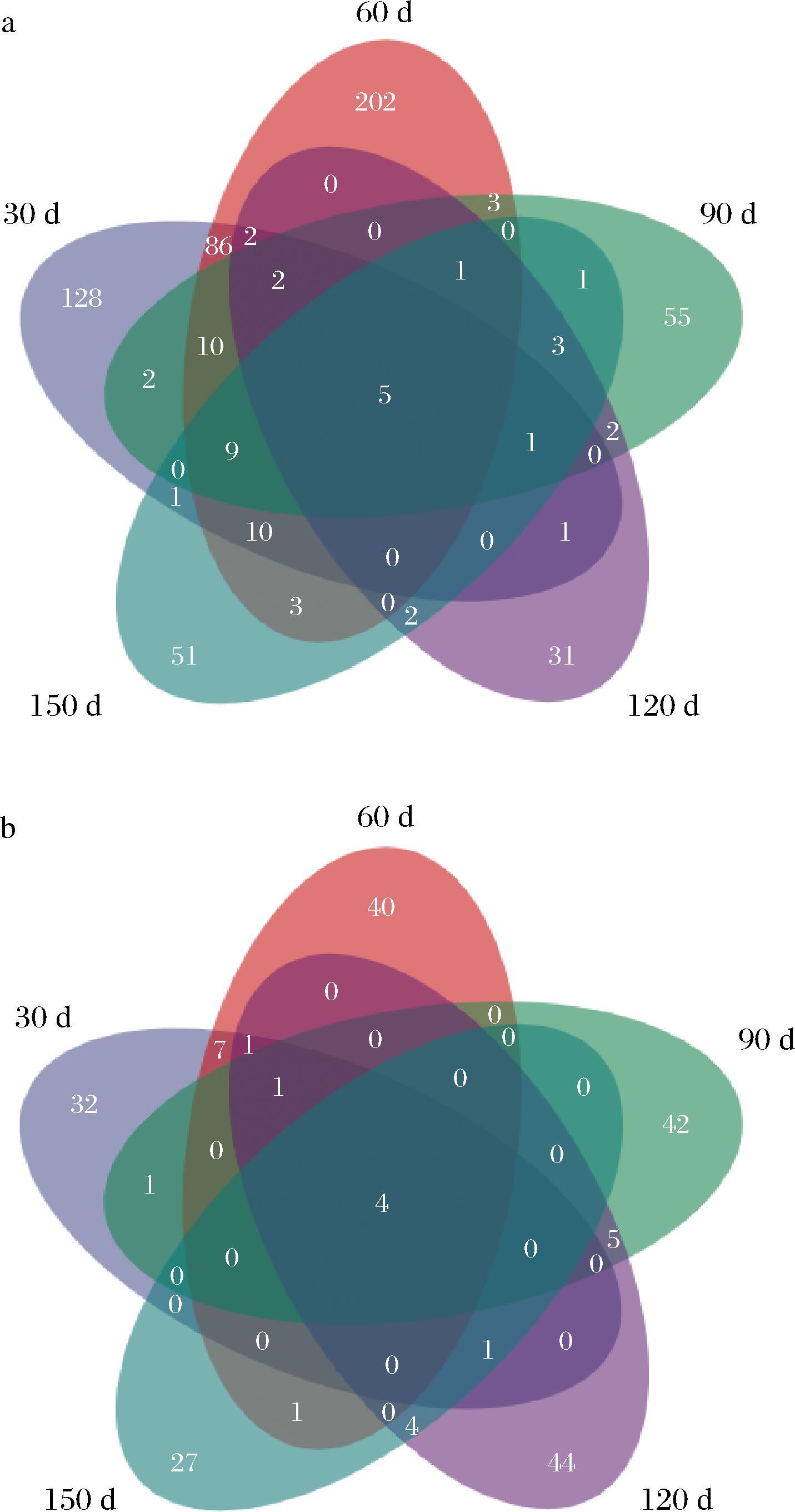
a-细菌;b-真菌
图5 OTU分布的Venn图
Fig.5 Venn plots of bacteria and fungi in OTU distribution

a-细菌门水平;b-细菌属水平;c-真菌门水平;d-真菌属水平
图6 细菌及真菌相对丰度图
Fig.6 Relative abundance map of bacteria and fungi at the phylum and genus levels
2.3.3 操作分类单元(operational taxonomic units, OTU)分布的Venn图
为了进一步了解大曲制备期间,微生物的群落结构组成,Venn图展示了不同制备时间,大曲样品所共有和独有的OTU数目,直观地展示了大曲样本中OTU数目的组成的相似性以及重叠情况。如图5-a所示,大曲从制备30~150 d,其独有的OTU数目分别为128、202、55、31、51,其中制备60 d的大曲样本中独自含有的物种数目所占比例最高,该样本的独特性最高;5个样品共有的OTU为5个,其所代表的细菌物种长期存在于大曲的整个制备期内。图5-b所示,大曲从制备30~150 d,其独有的OTU数目分别为32、40、42、44、27,共有的OTU为7个,其中制备120 d的大曲样本的物种数所占比例最高,独特性高。
2.3.4 微生物群落演替特征
样品经过高通量测序后,将这些样品测序结果按照细菌真菌分类,分别检测出11个细菌门、157个细菌属、7个真菌门、88个真菌属。将其中平均相对丰度前10的优势微生物门以及平均相对丰度前15的优势微生物属的变化情况绘制成柱状图展示(图6)。
将这些样品测序结果按照细菌真菌分类,在门水平上,细菌主要包括厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、蓝菌门(Cyanobacteria)、放线菌门(Actinobacteriota)、拟杆菌门(Bacteroidota)等,其中主要是厚壁菌门和变形菌门,其相对丰度总和超过70%。真菌主要是子囊菌门(Ascomycota)和担子菌门(Basidiomycota),其相对丰度总和超过75%。
在属水平上,大曲制备30 d优势细菌主要是Pediococcus、Bacillus、Weissella和Companilactobacillus,相对丰度分别为22.21%、19.98%、13.68%和15.44%。这种优势地位直至制备60 d后,发生了显著改变,其优势被Staphylococcus等取代(相对丰度达到了38.62%)。有研究表明,Staphylococcus在大曲中占主导地位,与白酒中主要有机酸的生物合成有关,具有形成氨基酸、生物胺、醛、游离脂肪酸[30]和酯类[31-32]的潜力。因此,Staphylococcus可能对浓香型白酒的4种主要酯(乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯)的合成具有重要的调控作用[2],对白酒的品质有一定的影响。在制备90 d时,Staphylococcus优势地位被Escherichia-Shigella(10.84%)和Pantoea(14.26%)逐渐取代。在制备120 d时,Escherichia-Shigella发展成为了主要的优势细菌(22.45%)。在制备第150天的大曲样本中,Staphylococcus(28.36%)重新夺回优势细菌属,与Escherichia-Shigella(18.16%)一起成为了该样本的主要细菌属。
大曲制备30、60 d的优势真菌主要是Thermoascus、Pichia和Aspergillus,三者相对丰度总和超过90%,其真菌群落结构类似(图6-d)。并且在图4-b中,2个样本PCoA坐标几乎重叠,由此可知,二者并无显著差异。在制备90 d后,原本的优势真菌属(Thermoascus、Pichia和Aspergillus)的相对丰度显著降低(<1%)。Archaeorhizomyces替代之前的3种优势真菌属一直保持着优势真菌属的地位,相对丰度从样本90 d中的48.18%不断上升至样本150 d中的66.47%。这与YAN等[33]和XIAO等[34]的研究结果一致。制备前期主要以Pichia和Thermoascus为主,二者在大多数中高温大曲中被认定为核心真菌属[5,35]。Pichia能够在酒醅发酵中产生乳酸[36]及乙醇[33],乳酸能够作为浓香型白酒的4种主要酯之一(乳酸乙酯)的直接来源,对于白酒品质及风味有一定贡献。并且乳酸对抑制有害微生物和保持食品质量及安全具有重要意义。Thermoascus能够分泌降解碳水化合物的嗜热酶系[5,37],提高大曲性能(液化力和糖化力),影响白酒酿造体系中微生物生长。
总体来看,大曲的制备过程中细菌的群落变化较大但相对较稳定,基本以Staphylococcus、Escherichia-Shigella、Pediococcus以及Bacillus此消彼长为主,这与GUAN 等[11]的研究结果较为相似。真菌的群落结构的变化基本以Thermoascus或Archaeorhizomyces为优势菌属的稳态更替为主。Bacillus能够产生淀粉酶、糖化酶以及酯酶等多种水解酶[29, 38-39],Pediococcus也被报道过具有酯酶活性作用,有利于白酒风味物质的形成[11]。因此,大曲在制备过程中,微生物群落结构的动态变化和相对稳态有利于大曲的生香及后续白酒发酵的品质的稳定和提升。
2.4 中高温大曲制备过程中性能及主要挥发性风味物质与优势微生物的相关性
整个制备过程大曲微生物群落动态演替,通过代谢活动引起了相关酶活力的变化。通过冗余分析(redundancy analysis,RDA)探寻大曲主要性能与优势微生物(相对丰度排名前10属水平)之间的相关性。
如图7-a所示,Acinetobacter与发酵力呈正相关,该菌属在样本120 d中相对丰度达到最高(图6),这可能是其发酵力水平最高的原因(图2)。Pediococcus与液化力呈正相关,Escherichia-Shigella与糖化力呈正相关,该菌属在样本120 d中相对丰度达到最高(图6),这可能是其糖化力水平最高的原因(图2)。Pseudomonas与酯化力呈正相关,该菌属在样本90、120 d中相对丰度较高(图6),这可能是其酯化力较高的原因(图2)。图7-c所示,大曲中优势真菌Archaeorhizomyces和Trichoderma与糖化力酯化力呈正相关,Botrotricham、Plectosphacercha、Humicola和Saitozyma与液化力呈正相关。总的来说,微生物的群落结构组成对于大曲的性能有着决定性作用[29,40-42]。大曲核心微生物通过调控各种酶系改变大曲的性能从而影响后续的白酒发酵。例如大曲性能较优,有助于淀粉的液化和糖化,会后续白酒酒醅发酵提供能量,并且大曲内积累的挥发性风味物质以及前体物质能够为后续风味化合物的形成奠定基础[43-44]。
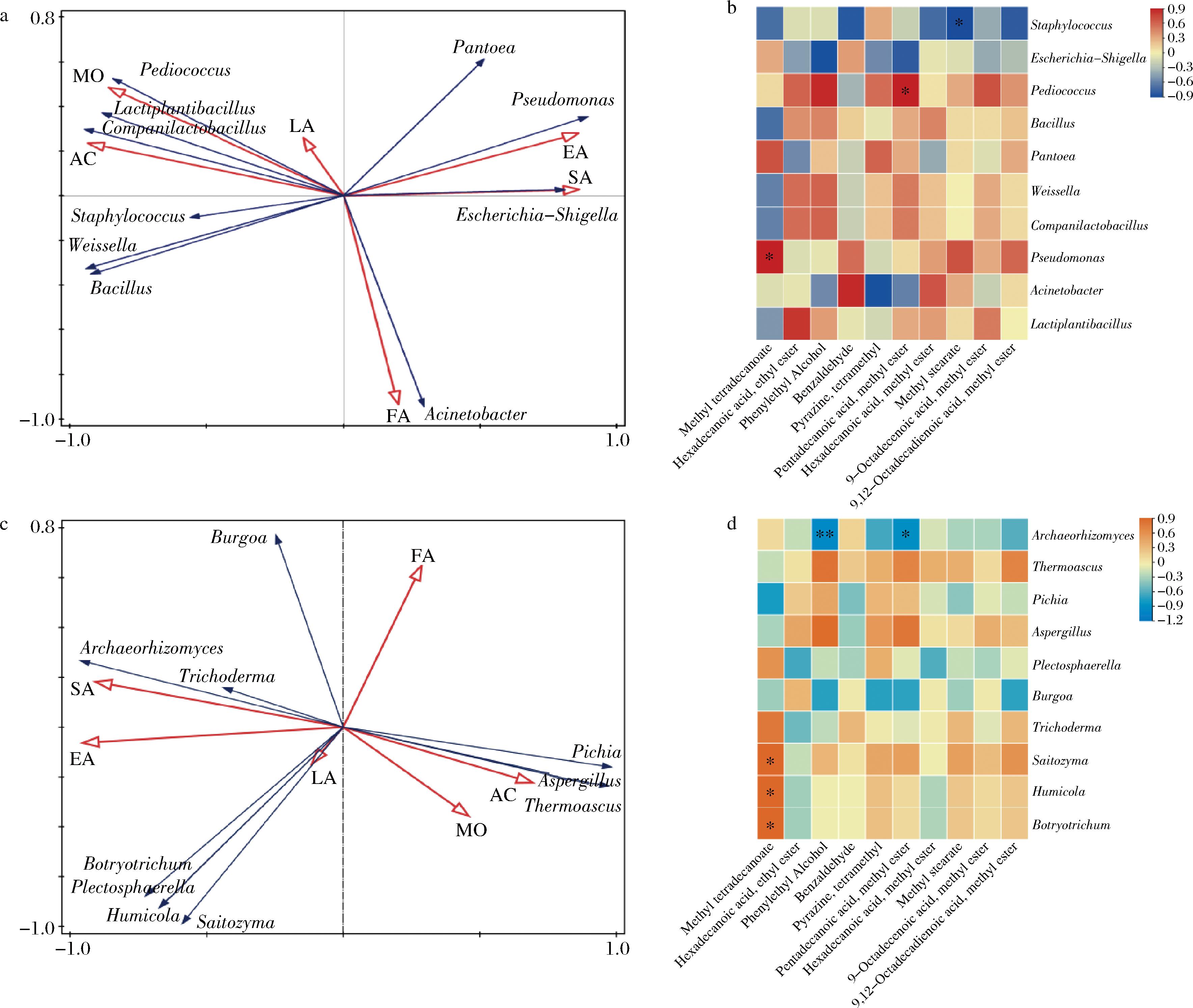
a-细菌与理化性质;b-细菌与风味物质;c-真菌与理化性质;d-真菌与风味物质
图7 细菌和真菌与理化性质RDA图及与风味物质热图相关性分析
Fig.7 RDA plots of bacteria and fungi with physicochemical properties and Heatmap of bacteria and fungi with flavor substances
注:SA-糖化力;LA-液化力;EA-酯化力;FA-发酵力;MO-水分;AC-酸度;Methyl tetradecanoate-十四烷酸甲酯;Hexadecanoic acid, ethyl ester-十六烷酸乙酯;Phenylethyl Alcohol-苯乙醇;Benzaldehyde-苯甲醛;Pyrazine, tetramethyl-四甲基吡嗪;Pentadecanoic acid, methyl ester-十五烷酸甲酯;Hexadecanoic acid, methyl ester-十六烷酸甲酯;Methyl stearate-硬脂酸甲酯;9-Octadecenoic acid, methyl ester-9-十八烯酸甲酯; 9,12-Octadecadienoic acid, methyl ester-9,12-十八碳二烯酸甲酯。
为探究大曲制备期间挥发性风味物质变化的微生物机制,利用Spearman相关性分析评估挥发性化合物与微生物菌属的相关性。挑选大曲挥发性物质明细中贡献度排名前十的物质与大曲优势微生物菌属作相关性热图分析。从图7-c中可知,细菌中的优势微生物属Pediococcus、Pseudomonas与十五烷酸甲酯、十四烷酸甲酯呈正显著相关(P<0.05)。Staphylococus与硬脂酸甲酯呈显著负相关(P<0.05),与图7-a中该菌属与酯化力呈负相关趋势保持一致。Staphylococcs在样本60 d中相对丰度最高,查阅大曲挥发性物质明细表(表2),样本60 d的硬脂酸甲酯的物质含量显著低于其他样本。图7-d中的真菌优势微生物属Saitozyma、Humicola和Botryotrichum与十四烷酸甲酯呈显著正相关(P<0.05)。Archaeorhizomyces与十五烷酸甲酯(P<0.05)、苯乙醇(P<0.01)呈极显著负相关。从样本90 d至150 d,Archaeorhizomyces的相对丰度在不断的增加(图6),而随着其相对丰度的增加,十五烷酸甲酯和苯乙醇的含量在不断的下降(表2)。由此可见,在大曲制备过程中,微生物群落中关键菌属的动态演替可能对部分挥发性物质进行着决定性调控,大曲的品质与微生物群落的动态演替密切相关。此结果能够为后续通过生物强化策略扰动大曲微生物群落的动态演替,提高大曲挥发性风味物质的质量,改善大曲品质提供一定的理论依据。
3 结论
本实验研究了邛崃产区中高温大曲制备过程中的性能及微生物动态变化,结果显示,大曲在制备的过程中,随着水分含量的下降,酸度逐渐下降,其他各项性能指标小范围内波动。大曲的核心细菌属主要是Bacillus、Staphylococcus、Escherichaia-Shigella、Pseudomonas等,真菌属主要以Archaeorhizomyces、Thermoasus、Aspergillus等为核心进行动态演替。在大曲制备过程中,微生物群落中关键菌属的动态演替可能对部分挥发性物质进行着决定性调控,大曲的品质与微生物群落的动态演替密切相关。此外,综合大曲的性能及挥发性风味物质等多因素考虑,制备120 d的中高温大曲性能稳定优良、曲香浓郁,适合实际浓香型白酒酿造生产。因此,优选120 d(发酵30 d,储存90 d)作为邛崃产区中高温大曲适宜生产周期。
[1] GAO L, ZHOU J, HE G Q.Effect of microbial interaction on flavor quality in Chinese Baijiu fermentation[J].Frontiers in Nutrition, 2022, 9:960712.
[2] FAN G S, FU Z L, TENG C, et al.Effects of aging on the quality of roasted sesame-like flavor Daqu[J].BMC Microbiology, 2020, 20(1):67.
[3] MAO J J, LIU X L, GAO T, et al.Unraveling the correlations between bacterial diversity, physicochemical properties and bacterial community succession during the fermentation of traditional Chinese strong-flavor Daqu[J].LWT, 2022, 154:112764.
[4] YANG L, CHEN J, LI Z J, et al.Effect of lactic acid bacteria on the structure and potential function of the microbial community of Nongxiangxing Daqu[J].Biotechnology Letters, 2023, 45(9):1183-1197.
[5] ZHOU Q F, MA K, SONG Y, et al.Exploring the diversity of the fungal community in Chinese traditional Baijiu Daqu starters made at low-, medium- and high-temperatures[J].LWT, 2022, 162, 113408.
[6] ZHU C T, CHENG Y X, SHI Q L, et al.Metagenomic analyses reveal microbial communities and functional differences between Daqu from seven provinces[J].Food Research International, 2023, 172:113076.
[7] MA S Y, SHANG Z C, CHEN J, et al.Differences in structure, volatile metabolites, and functions of microbial communities in Nongxiangxing Daqu from different production areas[J].LWT, 2022, 166:113784.
[8] JIA Y, NIU C T, LU Z M, et al.A bottom-up approach to develop a synthetic microbial community model:Application for efficient reduced-salt broad bean paste fermentation[J].Applied and Environmental Microbiology, 2020, 86(12):e00306-e00320.
[9] YAN S B, CHEN X S, GUANG J Q.Bacterial and fungal diversity in the traditional Chinese strong flavour liquor Daqu[J].Journal of the Institute of Brewing, 2019, 125(4):443-452.[10] WANG Z, WANG S, LIAO P F, et al.HS-SPME combined with GC-MS/O to analyze the flavor of strong aroma Baijiu Daqu[J].Foods, 2022,11(1):116.
[11] GUAN T W, YANG H, OU M Y, et al.Storage period affecting dynamic succession of microbiota and quality changes of strong-flavor Baijiu Daqu[J].LWT, 2021, 139:110544.
[12] MA S Y, LUO H B, ZHAO D, et al.Environmental factors and interactions among microorganisms drive microbial community succession during fermentation of Nongxiangxing Daqu[J].Bioresource Technology, 2022, 345:126549.
[13] XIAO C, YANG Y, LU Z M, et al.Daqu microbiota exhibits species-specific and periodic succession features in Chinese Baijiu fermentation process[J].Food Microbiology, 2021, 98:103766.
[14] WEI Y, ZOU W, SHEN C H, et al.Basic flavor types and component characteristics of Chinese traditional liquors:A review[J].Journal of Food Science, 2020, 85(12):4096-4107.
[15] ZUO Q C, HUANG Y G, GUO M.Evaluation of bacterial diversity during fermentation process:A comparison between handmade and machine-made high-temperature Daqu of Maotai-flavor liquor[J].Annals of Microbiology, 2020, 70(1):57.
[16] FAN G S, FU Z L, TENG C, et al.Comprehensive analysis of different grades of roasted-sesame-like flavored Daqu[J].International Journal of Food Properties, 2019, 22(1):1205-1222.
[17] WU X H, ZHENG X W, HAN B Z, et al.Characterization of Chinese liquor starter, “Daqu”, by flavor type with1H NMR-based nontargeted analysis[J].Journal of Agricultural and Food Chemistry, 2009, 57(23):11354-11359.
[18] HE G Q, HUANG J, ZHOU R Q, et al.Effect of fortified Daqu on the microbial community and flavor in Chinese strong-flavor liquor brewing process[J].Frontiers in Microbiology, 2019, 10:56.
[19] WELKE J E, MANFROI V, ZANUS M, et al.Characterization of the volatile profile of Brazilian Merlot wines through comprehensive two dimensional gas chromatography time-of-flight mass spectrometric detection[J].Journal of Chromatography A, 2012, 1226:124-139.
[20] HUANG P, JIN Y, LIU M M, et al.Exploring the successions in microbial community and flavor of Daqu during fermentation produced by different pressing patterns[J].Foods, 2023, 12(13):2603.
[21] ZHUANSUN W W, XU J, LI Z Q, et al.Dynamic changes in the microbial community, flavour components in Jiupei of a novel Maotai-Luzhou-flavoured liquor under various Daqu blending modes and their correlation analysis[J].LWT, 2022, 172, 114167
[22] LE V D, ZHENG X W, CHEN J Y, et al.Characterization of volatile compounds in Fen-Daqu-a traditional Chinese liquor fermentation starter[J].Journal of the Institute of Brewing, 2012, 118(1):107-113.
[23] XIAO L, LEE J, ZHANG G, et al.HS-SPME GC/MS characterization of volatiles in raw and dry-roasted almonds (Prunus dulcis)[J].Food Chemistry, 2014, 151:31-39.
[24] CHEN L H, REN L X, LI D N, et al.Analysis of microbiomes in three traditional starters and volatile components of the Chinese rice wines[J].Food Science and Biotechnology, 2020, 30(1):87-96.
[25] SCALONE G L L, LAMICHHANE P, CUCU T, et al.Impact of different enzymatic hydrolysates of whey protein on the formation of pyrazines in Maillard model systems[J].Food Chemistry, 2019, 278:533-544.
[26] FAN G S, FU Z L, SUN B G, et al.Roles of aging in the production of light-flavored Daqu[J].Journal of Bioscience and Bioengineering, 2019, 127(3):309-317.
[27] WANG X X, FAN W L, XU Y.Comparison on aroma compounds in Chinese soy sauce and strong aroma type liquors by gas chromatography-olfactometry, chemical quantitative and odor activity values analysis[J].European Food Research and Technology, 2014, 239(5):813-825.
[28] JIA J, ZHANG X, HU Y S, et al.Protective effect of tetraethyl pyrazine against focal cerebral ischemia/reperfusion injury in rats:Therapeutic time window and its mechanism[J].Thrombosis Research, 2009, 123(5):727-730.
[29] HE G Q, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT, 2019, 111:1-8.
[30] YANG Y, WU Y N, CE L G E, et al.Analysis of microbial community and its correlation with flavor compounds during congee fermentation[J].Food Bioscience, 2023, 51:102261.
[31] UDOMSIL N, RODTONG S, TANASUPAWAT S, et al.Improvement of fish sauce quality by strain CMC5-3-1:A novel species of Staphylococcus sp[J].Journal of Food Science, 2015, 80(9):M2015-M2022.
[32] WANG X D, BAN S D, QIU S Y.Analysis of the mould microbiome and exogenous enzyme production in Moutai-flavor Daqu[J].Journal of the Institute of Brewing, 2018, 124(1):91-99.
[33] YAN S B, TONG Q Q, GUANG J Q.Yeast dynamics and changes in volatile compounds during the fermentation of the traditional Chinese strong-flavor Daqu[J].LWT, 2019, 106:57-63.
[34] XIAO C, LU Z M, ZHANG X J, et al.Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Applied and Environmental Microbiology, 2017, 83(23):e01550-e01517.
[35] ZHAO L N, WANG Y, XING J L, et al.Distinct succession of abundant and rare fungi in fermented grains during Chinese strong-flavor liquor fermentation[J].LWT, 2022, 163:113502.
[36] LIU C C, FENG S B, WU Q, et al.Raw material regulates flavor formation via driving microbiota in Chinese liquor fermentation[J].Frontiers in Microbiology, 2019, 10:1520.
[37] ZHU M, ZHENG J, XIE J, et al.Effects of environmental factors on the microbial community changes during medium-high temperature Daqu manufacturing[J].Food Research International, 2022, 153:110955.
[38] YAN Z, ZHENG X W, HAN B Z, et al.1H NMR-based metabolomics approach for understanding the fermentation behaviour of Bacillus licheniformis[J].Journal of the Institute of Brewing, 2015, 121(3):425-431.
[39] YAN Z, ZHENG X W, CHEN J Y, et al.Effect of different Bacillus strains on the profile of organic acids in a liquid culture of Daqu[J].Journal of the Institute of Brewing, 2013, 119(1-2):78-83.
[40] ZHANG L Q, HUANG J, ZHOU R Q, et al.Evaluating the feasibility of fermentation starter inoculated with Bacillus amyloliquefaciens for improving acetoin and tetramethylpyrazine in Baoning bran vinegar[J].International Journal of Food Microbiology, 2017, 255:42-50.
[41] LIU P H, ZHANG L H, DU X W, et al.Dynamic Analysis of physicochemical and biochemical indices and microbial communities of light-flavor Daqu during storage[J].Journal of the American Society of Brewing Chemists, 2019, 77(4):287-294.
[42] HE G Q, HUANG J, WU C D, et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong-flavor liquor brewing microecosystem[J].Food Research International, 2020, 129:108851.
[43] PANG Z M, LI W W, HAO J, et al.Correlational analysis of the physicochemical indexes, volatile flavor components, and microbial communities of high-temperature Daqu in the northern region of China[J].Foods, 2023, 12(2):326.
[44] CHEN L C, YI Z L, FANG Y, et al.Biochemical and synergistic properties of a novel alpha-amylase from Chinese Nong-flavor Daqu[J].Microbial Cell Factories, 2021, 20(1):80.