白酒酿造历史悠久,文化源远流长,是中华民族传统饮食文化的重要组成部分。固态法酿造是白酒重要的生产工艺之一,高粱、小麦、玉米等淀粉质原料经蒸煮后拌入酒曲进行厌氧发酵,在此过程中,糟醅经蛋白酶、糖化酶和酯化酶等多种酶及多种微生物发酵,产生酒精、单宁、糖类、氨基酸和香味前体物质等,这些物质随窖池中的水分缓慢下渗,在窖池底部逐渐积累,形成一种棕黄色、黏稠且具有独特气味的液体,称为黄水[1]。黄水的产量十分巨大,据报道,每生产1 t大曲白酒,可产生0.3~0.4 t的黄水,如直接排放,不仅会改变土壤、水质的理化性质,造成严重的环境污染,还会导致黄水中碳资源和生物资源的严重浪费[1]。
近年来,随着“双碳”目标的提出和黄水中丰富物质的解析与应用,可持续利用黄水已成为各酒厂节能减排的目标之一。目前,黄水的回收利用主要集中在蒸馏取酒、制备酯化液、养护窖池、制曲与制糟,以及微生物培养等方面[2]。酿酒黄水中含量最丰富的物质是有机物,包括谷物淀粉、蛋白质、有机酸、醇类、酯类等,另外含有大量微生物菌群,如乳酸菌、己酸菌和酵母菌等[1]。而在这些有机物中,碳水化合物是最主要的成分之一,据报道,每100 mL黄水中约含有4.61~5.96 g糖类物质[3]。研究表明,从天然产物中提取的多糖具有抗氧化、促进肠道益生菌生长、修复肠屏障损伤等功效[4],而在黄水生物活性多糖的研究方面报道较少。
本实验室前期采用水提醇沉法从五粮液白酒酿造过程产生的黄水中分离提取到1种粗多糖,编号Str6-0,其总糖含量为(77.66±0.71)%,葡萄糖占总糖含量的92.9%,在Str6-0中鉴定出重均分子质量(Mw)分别为1.50×106 Da(占23.61%)和1.80×104 Da(占76.38%)的2种多糖组分[5-6]。研究发现该粗多糖能够清除DPPH自由基、ABTS阳离子自由基,表现出较好的体外抗氧化活性[6]。将该粗多糖经过DEAE-FF离子交换柱层析和Sephacryl-S300凝胶柱层析纯化后,得到1种纯化多糖,编号WLY-0,该纯化多糖是一种α-D-葡聚糖,Mw为11.12 kDa,主链为→1)-Glcp-(4→,支链为分支点在O-6连接的1,6和1,3,4连接的D-葡萄糖残基,首次证明了该纯化多糖能够改善由脂多糖(lipopolysaccharide, LPS)诱导的Caco-2单层细胞模型肠道屏障功能损伤[7]。肠道微生物能够给机体带来许多益处,包括营养吸收、病原体防御等[8],而研究证明,具有抗氧化活性的多糖可能具有益生活性,这是由于多糖降低了氧化损伤从而保护细胞和组织免受自由基的伤害,有助于促进肠道中有益微生物菌属的增殖[9]。因此,推测上述2种黄水多糖可能具有体外肠道益生活性,而目前尚未有相关报道。
体外发酵模型是研究肠道微生物的实用方法,其目的是在可控条件下培育复杂肠道微生物群,用于微生物调控和代谢的相关研究[10]。现阶段,黄水中糖类物质生物活性的研究尚处在起步阶段。因此,本实验以粗多糖Str6-0和纯化多糖WLY-0作为额外碳源,运用体外发酵模型,测定发酵过程中的短链脂肪酸含量变化,并进行菌群丰度组成的鉴定,旨在评估黄水多糖是否具有益生活性潜力。本研究将为黄水的高附加值利用提供新途径与数据支撑。
1 材料与方法
1.1 材料与试剂
黄水,宜宾五粮液股份有限公司;黄水多糖,实验室前期制备获取[5,7];Bradford法蛋白浓度试剂盒,北京索莱宝科技有限公司;无菌PBS缓冲液,北京博奥拓达科技有限公司;脑心浸出肉汤(brain heart infusion,BHI)培养基,北京奥博星生物技术有限责任公司;菊糖(主要由D-呋喃果糖分子以β(2→1)键连接而成的线性直链多糖,末端带有一个葡萄糖残基,分子式为[C6H10O5]n,聚合度为2~60),上海麦克林生化科技有限公司;AxyPrepDNA凝胶回收试剂盒,美国AXYGEN公司;其他无特殊说明的试剂均为分析纯等级。
1.2 仪器与设备
厌氧产气袋,日本三菱化学株式会社;Alpha 1-4 LSCbasic冷冻干燥机,德国Marin Christ公司;超净工作台,美国NUAIRE公司;7890A气相色谱仪[配备有氢火焰离子化检测器(flame ionization detector, FID)],美国Agilent公司;GeneAmp 9700 PCR扩增仪,美国ABI公司;MSE224-000-DU分析天平,德国Sartorius公司;DW-HL528超低温冰箱,中国长虹美菱公司;CR22N冷冻离心机,日本株式会社日立制作所;PHSJ-4F pH计,中国上海雷磁公司。
1.3 实验方法
1.3.1 粗多糖与纯化多糖中总酚、总酯及总蛋白质含量测定
采用Folin-酚法测定黄水粗多糖和纯化多糖的总酚含量[11]。使用指示剂法测定黄水粗多糖和纯化多糖的总酯含量[12]。使用Bradford法蛋白浓度试剂盒测定黄水粗多糖和纯化多糖的总蛋白含量,根据试剂盒说明书进行操作。
1.3.2 黄水多糖的体外发酵实验
4名受试者(2男2女,24~28岁,近2个月内没有服用抗生素)将粪便排泄到干净的容器中,尽量避免尿液、马桶壁等对粪便样本的污染。使用无菌勺等量挖取中部内侧的粪便作为样本放入无菌保存管中,放入-80 ℃冰箱进行低温保存。超净台中称取5 g混合粪便样品,用50 mL无菌PBS缓冲液充分振荡混匀,以得到粪浆悬浮液。粪浆悬浮液以500 r/min离心5 min,舍弃不溶性颗粒,备用。
厌氧发酵基础培养基使用BHI培养基。实验前,将配制好的培养基加入不同底物后高温高压灭菌(121 ℃,20 min),放到超净台冷却至室温。向已灭菌的血清瓶中加入29 mL BHI培养基,吹扫恒定N2流至培养基血清瓶中以排除氧气,吹扫结束后立即盖上橡胶塞。
使用无菌注射器穿透橡胶塞向发酵瓶中注射粪便旋浆上清液1 mL,分别加入100 mg黄水粗多糖、100 mg纯化多糖和100 mg菊糖并进行标记分组。每组做3个平行。
1.3.3 发酵过程中pH和短链脂肪酸含量的测定
使用pH计测定发酵过程中发酵液的pH。使用气相色谱测定发酵过程中短链脂肪酸含量。具体如下,取发酵0、6、12、24 h的发酵液1.5 mL以10 000 r/min离心5 min,取400 μL发酵液加入20 μL 2-乙基丁酸混匀,再加入100 μL体积分数 50% H2SO4溶液酸化,涡旋振荡后加入1 000 μL无水乙醚,再次涡旋振荡10~15 s后静置2 min萃取。3 000 r/min离心5 min,转移上层有机相至气相小瓶中。使用配备FID的气相色谱仪检测生成的短链脂肪酸,使用DB-WAX检测柱。检测条件:初始柱温100 ℃,持续1 min,以5 ℃/min的速度升温至180 ℃,再以20 ℃/min速度升温至230 ℃,保持2 min。FID检测器温度为250 ℃,进样口(注射器)温度250 ℃。进样量为1 μL,分流比为5∶1,载气为N2,流速为2.5 mL/min,尾吹气为N2,吹起流速为30 mL/min;H2流量为40 mL/min,空气流量为400 mL/min。
1.3.4 发酵过程中2种黄水多糖分子质量的测定
发酵液离心,取上清液,根据之前的方法,测定发酵过程中2种多糖的分子质量变化[7]。
1.3.5 群落组成的鉴定
通过DNA提取、16S rRNA基因测序和生物信息学分析,在体外发酵24 h后对4组样品的微生物群落组成进行鉴定。采用CTAB/SDS法提取样品中的总基因组DNA。选择16S rRNA的V4区域进行PCR扩增,所用引物为338F(ACTCCTACGGGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT),扩增条件为:95 ℃持续3 min;然后在95 ℃下进行27个循环,持续30 s,退火至55 ℃,持续30 s,升温至72 ℃保持45 s;最后在72 ℃下保持10 min。使用AxyPrepDNA凝胶回收试剂盒回收PCR产物。使用Illumina MiSeq进行高通量测序。使用USEARCH对高通量读数进行聚类以产生操作分类单元(operational taxonomic units, OTU)。使用微生物生态学定量洞察(quantitative insights into microbial ecology,QIIME) v1.9.1软件包对测序数据进行分析。标签以97%的序列相似性聚类到OUT。OTU的相对丰度用于比较样品之间OTU的丰富度和均匀度。最后,基于OTU和分类等级,使用UniFrac距离度量分析了α-多样性、β-多样性和不同物种的筛选。
1.4 数据处理
本研究所有数据和分析都是对3次平行实验进行的。实验数据采用SPSS 25进行单因素方差分析(ANONA),数据表示为3次的平均值±标准差。数据由Origin 2021和Graphpad Prism 9.5处理。P<0.05确定为具有统计学意义。
2 结果与分析
2.1 两种多糖中总酚、总酯及总蛋白质含量测定结果
2种多糖中的总酚、总酯和总蛋白含量如表1所示。可知,2种多糖中总酚的含量均为极少量,分别约为总质量的0.05%和0.01%,推测可能是在白酒生产过程中由微生物代谢产生的酚类物质极大量地进入到酒醅中,而黄水中留存的含量相对较少,且在粗多糖与纯化多糖的分离富集/纯化过程中,由于醇沉及超滤操作而使得其中的多酚物质流失。值得注意的是,粗多糖中的总酯含量、总蛋白含量均显著高于纯化多糖。此外,先前的研究表明,该粗多糖含有分子质量分别为1.50×106 Da和1.80×104 Da的2种多糖[5],而该纯化多糖分子质量为1.11×104 Da[7]。因此,粗多糖和纯化多糖的组成及分子质量都有明显的差别。
表1 两种多糖中总酚、总酯及总蛋白含量对比 单位:%
Table 1 Comparison of molecular weight and contents of total phenol, total ester, and total protein of two polysaccharides

粗多糖纯化多糖总酚含量0.05±0.02a0.01±0.01a总酯含量2.35±0.71a0.38±0.14b总蛋白含量0.25±0.02a0.05±0.03b
注:同行数据不同小写字母上标表示差异显著(P<0.05)(下同)。
2.2 发酵过程中pH与短链脂肪酸含量的测定及变化
肠道微生物能够利用碳水化合物产生有机酸、短链脂肪酸等一系列代谢产物,进而改变肠道环境的酸碱度,本研究中不同时间发酵液的pH值如图1-a所示。黄水粗多糖组、纯化多糖组和菊糖组的pH值在发酵前6 h差距不大,但在12 h后急剧下降(分别为5.90、6.03、6.11),显著低于阴性对照组(pH值为6.45,P<0.05),随后慢慢趋于稳定,在24 h时pH值分别为5.70、5.90、6.05,均显著低于阴性对照组的pH 6.36(P<0.05)。这表明肠道菌群能够利用2种多糖作为碳源生长,并产生有机酸、短链脂肪酸等酸性物质,导致整个发酵体系的pH呈现下降趋势,而后pH趋于稳定则表明肠道微生物生长进入稳定期[13]。
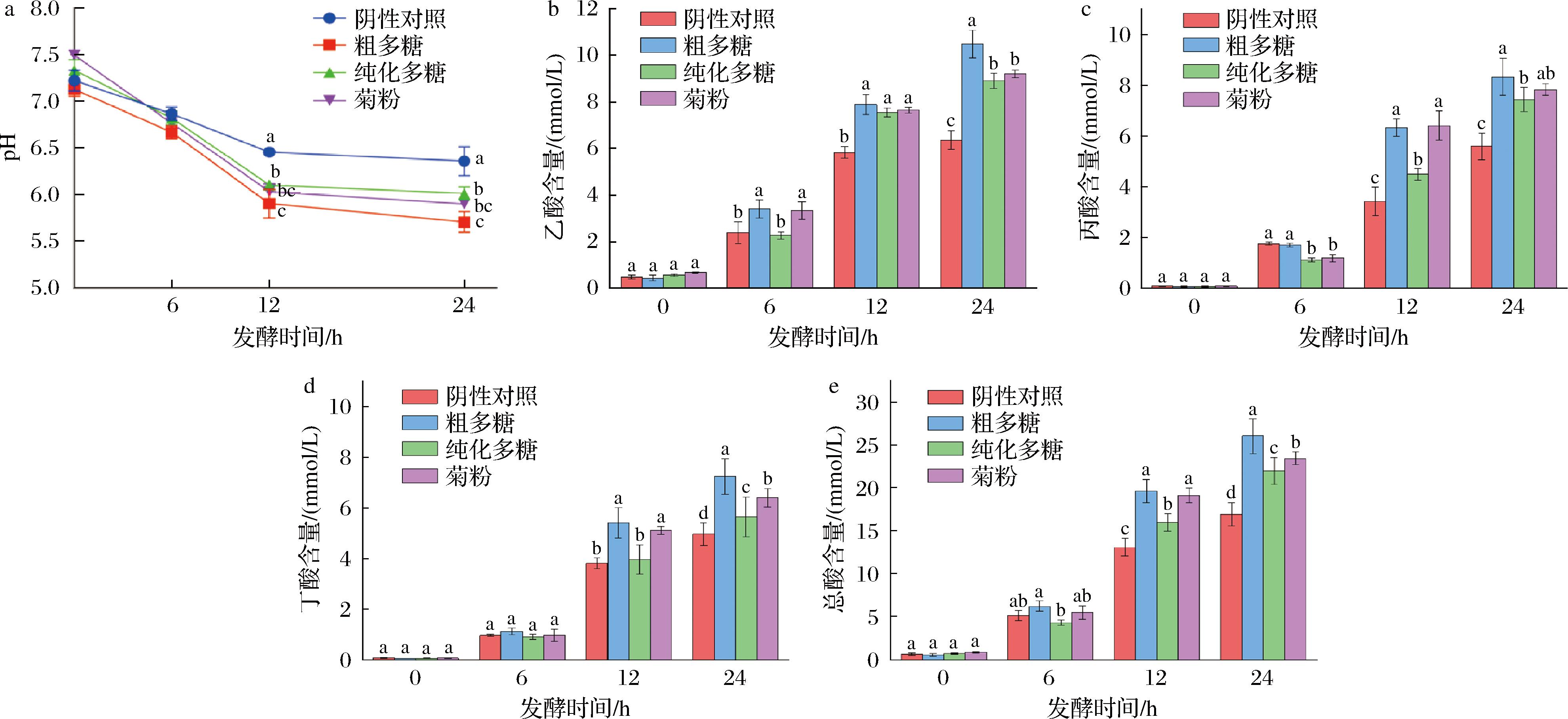
a-pH;b-乙酸;c-丙酸;d-丁酸;e-总酸
图1 发酵过程中pH、短链脂肪酸含量随发酵时间的变化
Fig.1 The changes of pH and short-chain fatty acid in the fermentation process during different fermentation time
注:同一时间下的不同字母表示具有显著性差异(P<0.05)。
短链脂肪酸(short chain fatty acids, SCFAs),又称挥发性脂肪酸,是由1~6个碳原子组成的有机脂肪酸,是肠道菌群的重要代谢产物之一,主要是由非消化性碳水化合物经结肠内厌氧菌酵解产生,少量来源于蛋白质或氨基酸,主要包括乙酸、丙酸和丁酸,其浓度和类型取决于饮食和肠道微生物群的组成。SCFAs在维持肠道屏障功能、预防结直肠癌和调节免疫反应方面发挥了巨大作用[14]。本研究中,在发酵过程中产生乙酸、丙酸、丁酸及总酸含量分别如图1-b~图1-e所示。
乙酸是结肠中多数厌氧细菌发酵碳水化合物产生的主要代谢产物,可供人体日总能量的10%,同时,乙酸还能够通过中央稳态机制穿过血脑屏障降低食欲,因此能够协同缓解肥胖症[15]。由图1-b可知,发酵前6 h,纯化多糖组(2.27 mmol/L)和阴性对照组(2.38 mmol/L)所产生的乙酸含量相差不大,但略低于粗多糖组(3.41 mmol/L)和菊糖组(3.34 mmol/L),这说明粗多糖在短时间发酵阶段就展现出一定的提升乙酸含量能力;发酵12 h后,纯化多糖组的乙酸含量(7.54 mmol/L)得到显著提升(P<0.05),粗多糖组的乙酸含量达到了7.89 mmol/L,二者均显著高于阴性对照组(5.83 mmol/L,P<0.05),且与菊糖组(7.63 mmol/L)无显著性差异;发酵24 h后,粗多糖组所产乙酸含量最高,为10.46 mmol/L,显著高于菊糖组(9.20 mmol/L,P<0.05),而纯化多糖组乙酸含量为8.89 mmol/L,与菊糖组含量无显著性差异。以上研究说明,纯化多糖和粗多糖均具有提升体外发酵模型中乙酸含量的能力,尤其是在发酵12 h以后提升效果更加明显。但值得注意的是,在相同发酵时间下,粗多糖提升乙酸含量的能力较纯化多糖更为突出,在发酵24 h时比菊糖的效果还要显著。
丙酸是拟杆菌门主要的发酵产物,经结肠吸收后由肝脏代谢,能够参与糖异生作用,并能够抑制胆固醇合成[16]。由图1-c可知,发酵前6 h,纯化多糖组(1.11 mmol/L)和菊糖组(1.19 mmol/L)的丙酸含量略低于阴性对照(1.76 mmol/L)和粗多糖组(1.70 mmol/L),与模型中乙酸产量的趋势类似;而发酵12 h后,粗多糖组与纯化多糖组的丙酸含量分别达到了6.34 mmol/L和4.48 mmol/L,均显著高于阴性对照组(3.43 mmol/L,P<0.05),且粗多糖组的丙酸含量与菊糖组(6.41 mmol/L)无显著性差异,说明粗多糖对于提升丙酸含量具有很明显的作用;发酵24 h后,粗多糖组丙酸含量达到8.32 mmol/L,为4组样品中含量最高,纯化多糖组丙酸含量(7.43 mmol/L)显著高于阴性对照组(5.59 mmol/L,P<0.05),与菊糖组(7.82 mmol/L)无显著性差异。由此说明,发酵12 h后,黄水多糖能够显著提升体外发酵模型中丙酸含量,且粗多糖的效果相较于纯化多糖更加明显。
丁酸是结肠上皮细胞能量的主要能源物质,能抑制肿瘤细胞分化[17],对结肠炎和结肠癌起到预防作用。由图1-d可知,发酵前6 h,4个实验组的丁酸含量差别不大;发酵12 h后,粗多糖组丁酸含量为5.41 mmol/L,与菊糖组(5.11 mmol/L)无显著差异,且显著高于阴性对照(3.81 mmol/L,P<0.05),纯化多糖组(3.96 mmol/L)与阴性对照组差异不大,说明此时粗多糖对提升丁酸含量有明显的效果;发酵24 h后,纯化多糖组的丁酸含量(5.64 mmol/L)显著提升,粗多糖组的丁酸含量为7.24 mmol/L,二者均显著高于阴性对照组(4.95 mmol/L),同时粗多糖组丁酸含量也显著高于菊糖组(6.39 mmol/L),说明经过长时间发酵后,无论是粗多糖还是纯化多糖,都展现出了较强的提升丁酸含量的能力。同样值得注意的是,发酵粗多糖产生丁酸的效果非常明显,尤其是在发酵24 h后,其丁酸含量最高。
综上并结合图1-e可知,肠道菌群通过发酵2种黄水多糖产生了较多的乙酸、丙酸和丁酸,其增加趋势与菊糖一致。在发酵12 h后,粗多糖组总酸含量达到19.65 mmol/L,与菊糖组(19.15 mmol/L)无显著性差异,纯化多糖组总酸含量为15.99 mmol/L,2个多糖组的总酸含量均高于阴性对照组(13.08 mmol/L,P<0.05);发酵24 h后,粗多糖组总酸含量为26.03 mmol/L,显著高于菊糖组(23.42 mmol/L,P<0.05),纯化多糖总酸含量为21.96 mmol/L,显著高于阴性对照组(16.91 mmol/L,P<0.05)。总之,粗多糖组较纯化多糖组产生了更高量的短链脂肪酸。HUANG等[18]从竹屑中得到乙酰阿拉伯木聚糖(BSH-1)与肠道微生物进行体外共培养,发现BSH-1影响肠道菌群主要通过提高短链脂肪酸含量,尤其是乙酸、丙酸和丁酸。本实验结果与其相接近,证明黄水多糖经肠道微生物代谢后可以产生对人体具有健康效应的短链脂肪酸,具有益生活性。
2.3 发酵过程中多糖分子质量的变化
采用HPGPC测定了发酵过程中2种黄水多糖的Mw变化。如图2所示,随着发酵的进行,2种多糖的分子质量保留时间曲线明显右移,表明2种多糖在体外发酵过程中分子质量下降。发酵12 h后,黄水粗多糖的Mw由20 658 Da降为12 695 Da和6 095 Da,纯化多糖的Mw由10 892 Da降为4 278 Da和2 030 Da,说明发酵前12 h是肠道微生物利用2种多糖的最主要时期,2种多糖的部分糖苷键被破环[19]形成了分子质量不同的多糖片段。发酵24 h后,黄水粗多糖的Mw降为3 895 Da,纯化多糖的Mw降为2 670 Da,表明2种多糖继续被肠道菌群所利用。之前的研究表明,体外发酵过后,枇杷叶多糖的分子质量显著下降,其可能的原因是多糖被肠道菌群降解成低分子质量片段[19],这与本实验结果相类似,证明了黄水粗多糖和纯化多糖能够被肠道微生物利用。
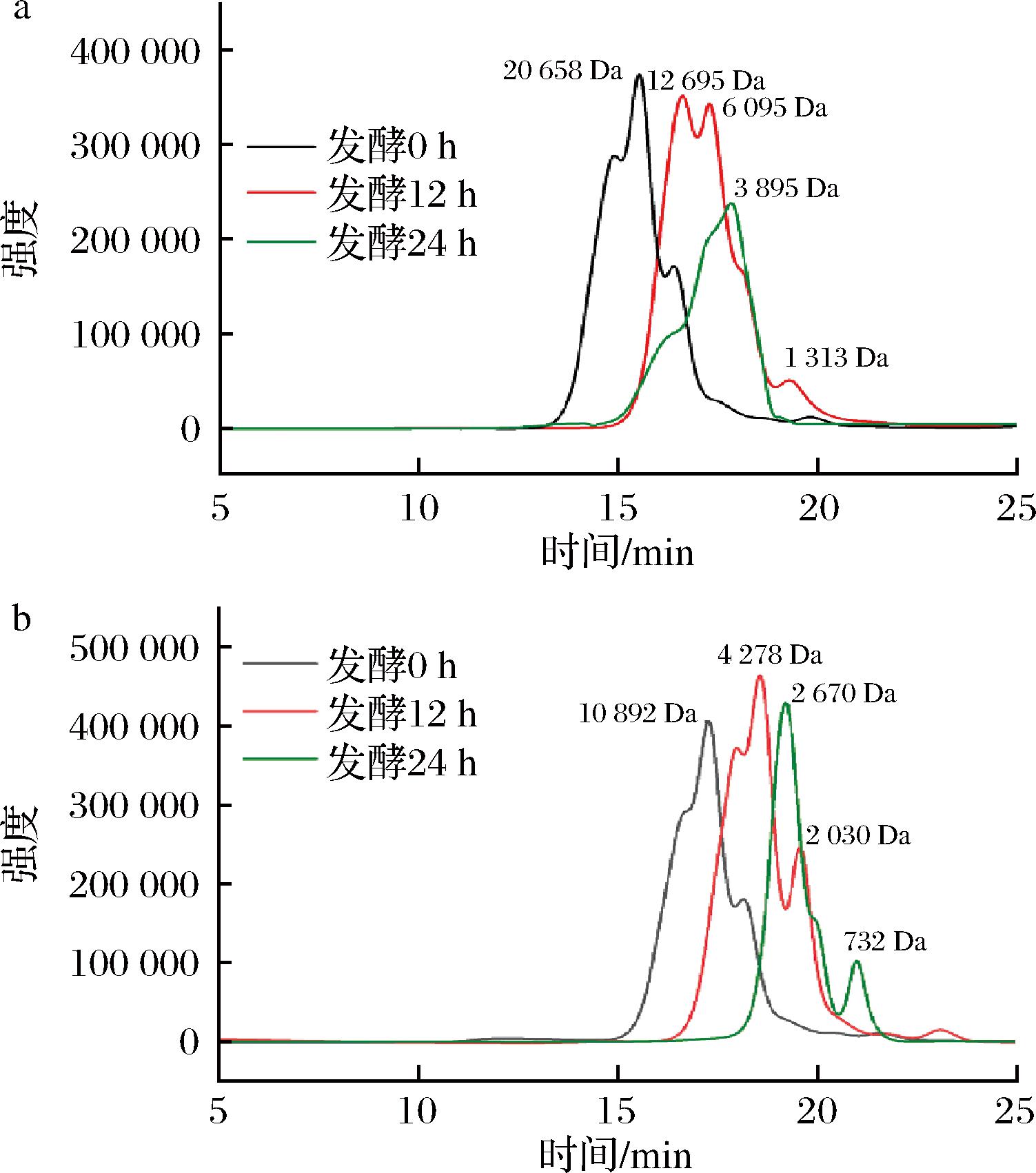
a-黄水粗多糖;b-纯化多糖
图2 体外发酵24 h两种多糖分子质量的变化
Fig.2 Molecular weight changes of 2 polysaccharides during 24 h in vitro fermentation
2.4 群落组成分析
有研究表明,人体肠道中正常的微生物群主要由拟杆菌门(16.9%)和厚壁菌门(79.4%)组成,它们的丰度比例变化与机体肥胖疾病有关[20]。α-多样性反映了微生物群落的丰富度和多样性,而Simpson指数与微生物多样性呈正相关[21]。如图3-a所示,粗多糖组和菊糖组在OTU水平上的Simpson指数显著降低(P<0.05),说明这可能与优势菌群的竞争作用相关。β-多样性反映不同样本之间微生物丰度的差异,选择weighted UniFrac结合主坐标分析(principal co-ordinates analysis, PCoA)来衡量β-多样性[22]。如图3-b所示,发酵24 h后,粗多糖组群落较菊糖组和阴性对照组发生显著变化(P<0.05)。以上结果可以说明,在体外发酵过程中,粗多糖能够改变肠道菌群的组成结构。
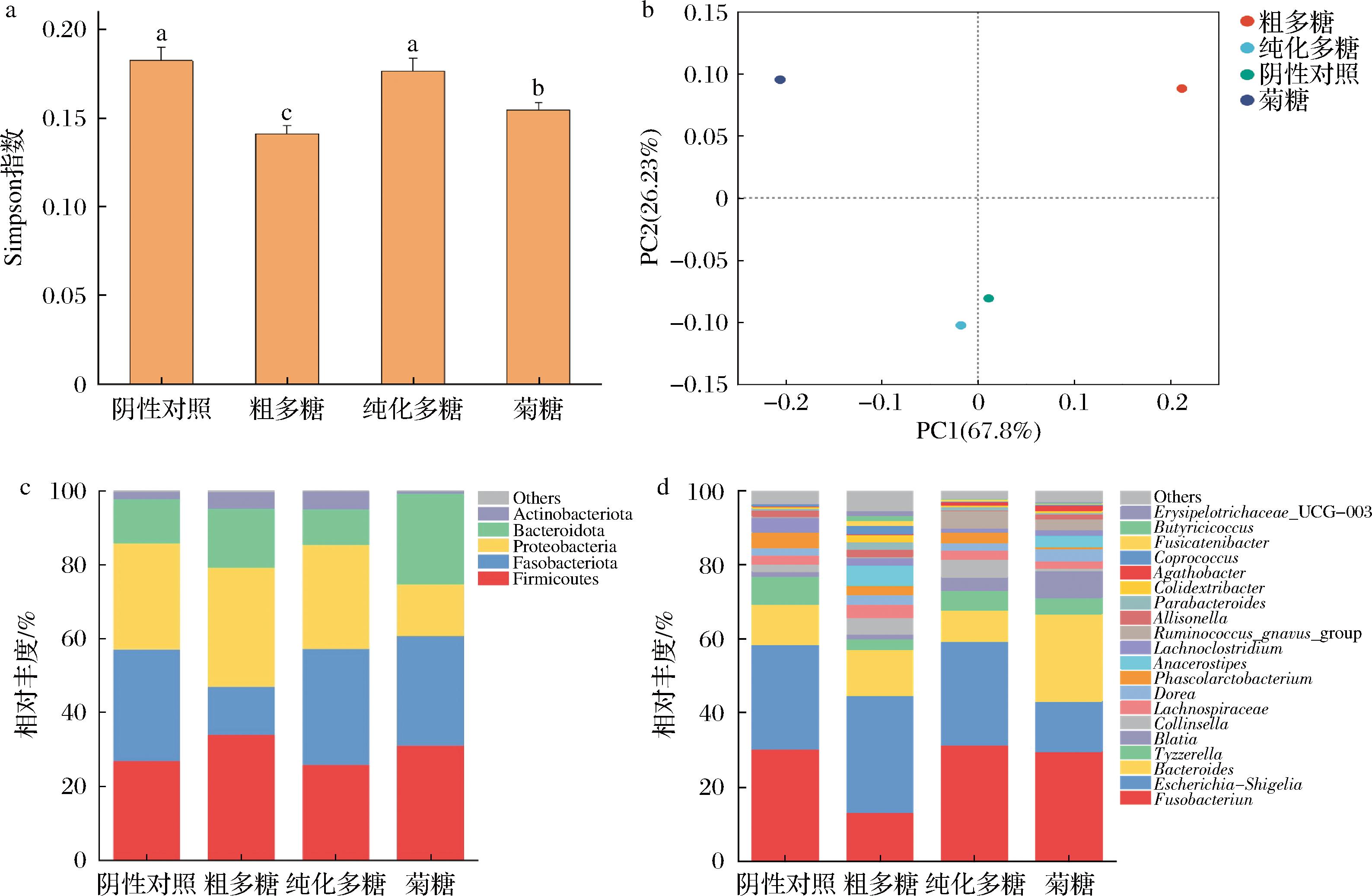
a-α多样性;b-β多样性;c-门水平微生物组成;d-属水平微生物组成
图3 体外发酵24 h后粪便菌群的组成及结构变化
Fig.3 Composition and structural changes of fecal microbiota after 24 h in vitro fermentation
图3-c显示了阴性对照组与3个实验组在门水平上的肠道微生物组成。可以看出,与阴性对照组相比,粗多糖组的厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)和放线菌门(Actinobacteriota)水平较高,而梭杆菌门(Fusobacteriota)比例较低。WU等[23]研究发现,高纤维膳食能够降低体重可能与其能够增加Bacteroidota和Actinobacteriota的数量有关。粗多糖上调了Bacteroidota和Actinobacteriota的比例,可能表现出潜在的抗肥胖效果,值得后续深入研究。但与阴性对照组相比,纯化多糖组略微降低了Bacteroidota的相对丰度,增加了Actinobacteriota的相对丰度。通过发酵不易消化的糖类物质,肠道中的Bacteroidota主要产丙酸和丁酸,Firmicutes主要产生丁酸,Actinobacteriota也是短链脂肪酸的重要生产者[24],而Fusobacteriota则被认为是有害菌[25],这与2种多糖对模型中短链脂肪酸的提升效果是一致的。黄靖航等[26]在研究大豆种皮多糖对肠道菌群的影响时发现,2种不同方式提取的大豆种皮多糖(MOSP和MCSP)通过增加Bacteroidota和Firmicutes的丰度来提高多糖的利用率,本实验也可得到类似结论。
图3-d显示了阴性对照组与3个实验组在属水平上肠道微生物组成,粗多糖组增加了拟杆菌属(Bacteroides)的相对丰度,降低了梭杆菌属(Fusobacterium)、泰泽雷拉菌属(Tyzzerella)等有害菌的相对丰度。Bacteroides中许多种细菌能够编码多种碳水化合物水解酶代谢复杂碳水化合物,产生乙酸和丙酸[24],这与黄水多糖对模型中乙酸和丙酸含量的提升效果一致。廖强等[27]研究发现山楂多糖能够提高Bacteroides的相对丰度,表现出良好的益生元活性。纯化多糖组虽降低了Bacteroides的相对丰度,但增加了布劳特氏菌属(Blautia)等有益菌的丰度。而粗多糖组的大肠杆菌志贺菌属的比例较高,推测可能是粗多糖中含有一些低分子质量的糖,而大肠杆菌志贺菌容易利用低分子质量的碳源来维持生长,这与ZHANG等[28]发现龙须菜琼脂低聚糖能够促进大肠杆菌志贺菌生长的结论相同。
图4的热图显示了阴性对照组与3个实验组在属水平上丰度较高的30种细菌及其相对丰度差异。通过与阴性对照组和菊糖组对比,在粗多糖组中发现了几种有益细菌属的相对丰度增加,如Bacteroides、粪球菌属(Coprococcus)、柯林斯氏菌属(Collinsella)、厌氧棒状菌属(Anaerostipes)等。而纯化多糖组上调了Collinsella和Blautia等有益菌属。可见粗多糖和纯化多糖均能够促进多种肠道有益菌生长,且粗多糖促进生长的有益菌属的种类更加丰富。本研究与文献报道的结果类似,如MORISHIMA等[29]在评估抹茶对人类粪便微生物的影响时,发现抹茶组肠道微生物群中Coprococcus丰度增加,Fusobacterium丰度减少,这为宿主带来了潜在的健康益处;WANG等[30]的研究发现枯草芽孢杆菌发酵黄芪能够上调节Collinsella等产丁酸的细菌丰度,具有治疗高尿酸血症的作用。
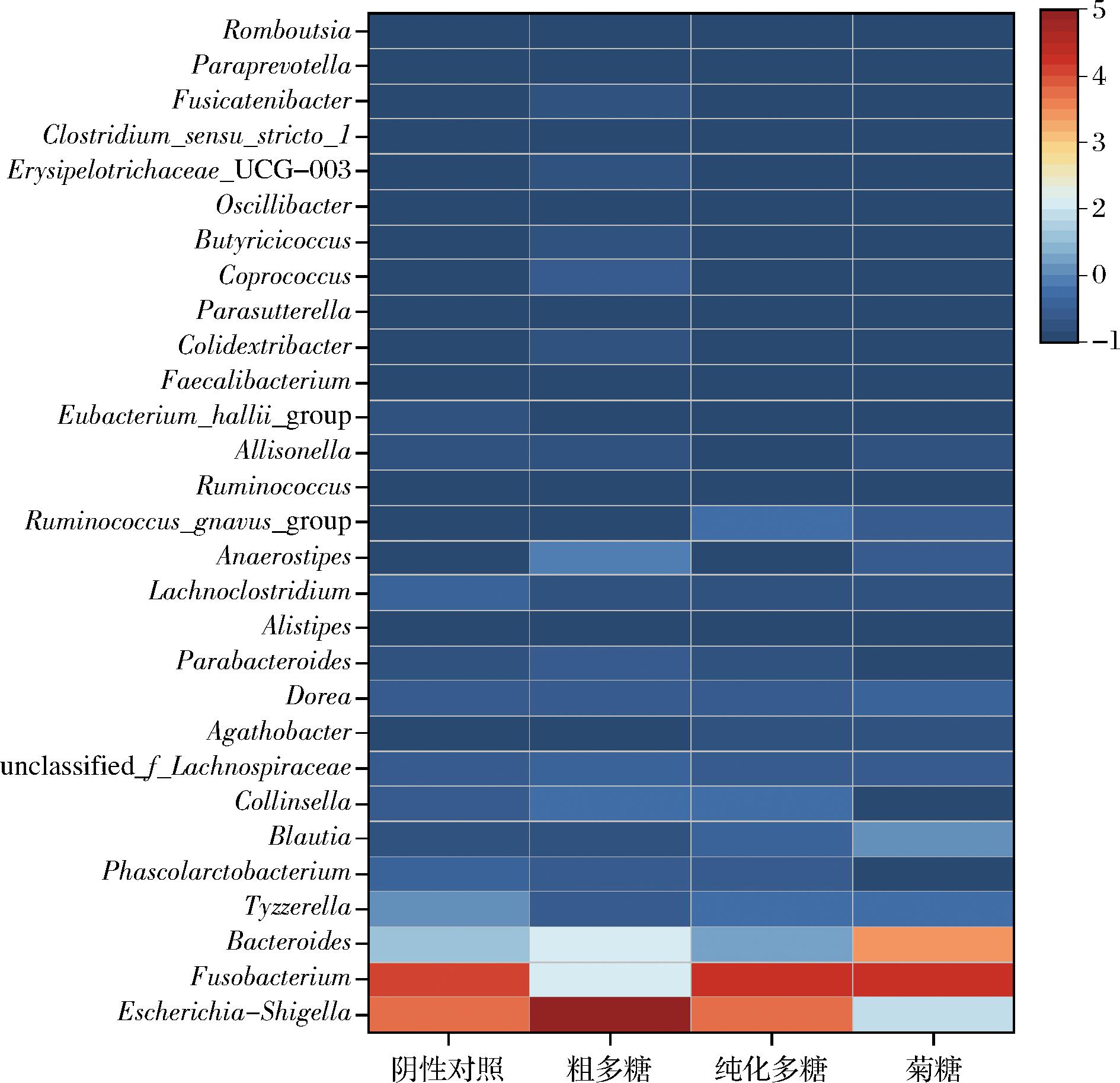
图4 属水平肠道微生物组成热图
Fig.4 Heatmap of gut microbiota composition at genus level
综上,菌群丰度的测定结果能够与短链脂肪酸的含量结果发生较高的吻合,以上这些结果再次证明,黄水粗多糖和纯化多糖都具有一定的肠道益生活性潜力。
3 结论
本研究首次对2种黄水多糖(粗多糖和纯化多糖)进行体外发酵实验,并进行了发酵过程中pH、SCFAs含量、分子质量的变化和肠道菌群组成鉴定。研究结果表明,在发酵过程中,以2种黄水多糖为额外碳源的发酵液pH显著降低,发酵液中SCFAs的含量增加,且2种多糖的分子质量有不同程度的降低。粗多糖组有效促进了发酵液中Bacteroidota、Firmicutes、Actinobacteriota、Bacteroides、Coprococcus、Collinsella和Anaerostipes等的增殖,降低了Fusobacteriota、Bacteroides和Tyzzerella的相对丰度;纯化多糖组上调了Collinsella和Blautia的相对丰度。这2种多糖均能够被肠道内的微生物利用,从而表现出潜在的益生元效果,此研究将为黄水的可持续利用提供新参考。在后续研究中,还应通过多组学联用的技术手段(如微生物组学-代谢组学、微生物组学-转录组学-蛋白组学等)深入考察2种多糖在体外模型中对于微生物的代谢等研究,从而系统探究黄水多糖的益生活性机制。
此外,将粗多糖与纯化多糖在体外肠道益生活性模型中得到的实验结果相比,发现粗多糖的益生效果较纯化多糖好,推测可能是由于与纯化多糖相比,粗多糖中含有多种多糖以及更高含量的酯类、蛋白质等物质,这些物质所发挥的益生活性机制及其在发酵过程中的降解规律,需进一步探索。在黄水的可持续利用中,不该忽视粗多糖组分的研究与应用。
[1] 王子豪, 黄平, 郑佳, 等.白酒酿造副产物黄水研究现状及综合利用研究进展[J].中国酿造, 2023, 42(4):20-28.WANG Z H, HUANG P, ZHENG J, et al.Research progress and comprehensive utilization of Huangshui, a by-product from Baijiu brewing[J].China Brewing, 2023, 42(4):20-28.
[2] 车路萍, 陈垚, 黄朝兵, 等.浓香型白酒酿造废水回收利用研究进展[J].中国酿造, 2023, 42(3):18-22.CHE L P, CHEN Y, HUANG C B, et al.Research progress on recycling and utilization of the wastewater in strong-flavor Baijiu brewing[J].China Brewing, 2023, 42(3):18-22.
[3] 彭太升. 黄水调酒液在浓香型白酒中的应用[J].酿酒, 2011, 38(6):36-37.PENG T S.The application of yellow water to wine to strong aromatic Chinese spirits[J].Liquor Making, 2011, 38(6):36-37.
[4] 梁单. 马铃薯抗性淀粉调节肠道菌群及改善肥胖的作用机制[D].北京:中国农业科学院, 2021.LIANG D.Study on the mechanism of potato resistant starch inhibits obesity by modulating the composition of intestinal microbiota[D].Beijing:Chinese Academy of Agricultural Sciences, 2021.
[5] WU Z Y, LIAO Q J, CHEN P P, et al.Synthesis, characterization, and methylene blue adsorption of multiple-responsive hydrogels loaded with Huangshui polysaccharides, polyvinyl alcohol, and sodium carboxyl methyl cellulose[J].International Journal of Biological Macromolecules, 2022, 216:157-171.
[6] HUO J Y, WU Z Y, ZHAO H, et al.Structure-activity relationship of antioxidant polysaccharides from Huangshui based on the HPLC fingerprint combined with chemometrics methods[J].LWT, 2022, 159:113201.
[7] HUO J Y, LIAO Q J, WU J H, et al.Structure elucidation and intestinal barrier protection of an α-D-glucan in Huangshui[J].International Journal of Biological Macromolecules, 2022, 223:595-605.
[8] GUERGOLETTO K B, COSTABILE A, FLORES G, et al.In vitro fermentation of juçara pulp (Euterpe edulis) by human colonic microbiota[J].Food Chemistry, 2016, 196:251-258.
[9] 薛丽洁, 马丽苹, 焦昆鹏, 等.挤压对山药中非淀粉多糖理化性质和生物活性的影响[J].中国食品添加剂, 2022, 33(1):164-172.XUE L J, MA L P, JIAO K P, et al.Effect of extrusion on physicochemical properties and biological activity of non-starch polysaccharides from Chinese yam[J].China Food Additives, 2022, 33(1):164-172.[10] 支梓鉴, 俞邱豪, 程焕, 等.肠道微生物体外发酵模型研究进展及其在食品中的应用[J].食品工业科技, 2016, 37(14):353-358.ZHI Z J, YU Q H, CHENG H, et al.Advances in in vitro fermentation model of gut microbiota and its applications in food[J].Science and Technology of Food Industry, 2016, 37(14):353-358.
[11] 毕静, 冯悦, 王静, 等.固态发酵对白酒糟总酚含量及抗氧化活性的影响[J].广东化工, 2022, 49(23):102-105.BI J, FENG Y, WANG J, et al.Effects of solid-state fermentation on total phenol content and antioxidant activity of white distiller’s grains[J].Guangdong Chemical Industry, 2022, 49(23):102-105.
[12] 黄河, 王媚, 黄婷, 等.白酒中总酯含量检测分析技术的研究与探讨[J].酿酒, 2022, 49(3):127-130.HUANG H, WANG M, HUANG T, et al.Study and discussion on determination and analysis of total ester content in liquor[J].Liquor Making, 2022, 49(3):127-130.
[13] 刘晓丹, 肖瀛, 周建金, 等.基于体外消化与发酵模型的多花黄精多糖对肠道菌群的影响[J].食品工业科技, 2024, 45(9):115-123.LIU X D, XIAO Y, ZHOU J J, et al.Effects of Polyonatum cyrtonema Hua.polysaccharide on intestinal microorganisms based on in vitro-simulated digestion and fermentation model[J].Science and Technology of Food Industry, 2024, 45(9):115-123.
[14] HU J M, LIN S L, ZHENG B D, et al.Short-chain fatty acids in control of energy metabolism[J].Critical Reviews in Food Science and Nutrition, 2018, 58(8):1243-1249.
[15] FROST G, SLEETH M L, SAHURI-ARISOYLU M, et al.The short-chain fatty acid acetate reduces appetite via a central homeostatic mechanism[J].Nature Communications, 2014, 5:3611.
[16] 屠友金, 胡彩虹.低聚果糖和丙酸钠对肥育猪胆固醇代谢的影响[J].中国粮油学报, 2005, 20(1):65-68.TU Y J, HU C H.Effects of fructo- oligosaccharide and sodium propionate on cholesterol metabolism of finishing pigs[J].Journal of the Chinese Cereals and Oils Association, 2005, 20(1):65-68.
[17] WLODARSKA M, KOSTIC A D, XAVIER R J.An integrative view of microbiome-host interactions in inflammatory bowel diseases[J].Cell Host &Microbe, 2015, 17(5):577-591.
[18] HUANG J Q, WANG Q, XU Q X, et al.In vitro fermentation of O-acetyl-arabinoxylan from bamboo shavings by human colonic microbiota[J].International Journal of Biological Macromolecules, 2019, 125:27-34.
[19] WU D T, FU Y, GUO H, et al.In vitro simulated digestion and fecal fermentation of polysaccharides from loquat leaves:Dynamic changes in physicochemical properties and impacts on human gut microbiota[J].International Journal of Biological Macromolecules, 2021, 168:733-742.
[20] MILLION M, LAGIER J C, YAHAV D, et al.Gut bacterial microbiota and obesity[J].Clinical Microbiology and Infection:the Official Publication of the European Society of Clinical Microbiology and Infectious Diseases, 2013, 19(4):305-313.
[21] ZHANG Z S, WANG X M, HAN S W, et al.Effect of two seaweed polysaccharides on intestinal microbiota in mice evaluated by illumina PE250 sequencing[J].International Journal of Biological Macromolecules, 2018, 112:796-802.
[22] FENG Y, WANG L, KHAN A, et al.Fermented wheat bran by xylanase-producing Bacillus cereus boosts the intestinal microflora of broiler chickens[J].Poultry Science, 2020, 99(1):263-271.
[23] WU G D, CHEN J, HOFFMANN C, et al.Linking long-term dietary patterns with gut microbial enterotypes[J].Science, 2011, 334(6052):105-108.
[24] FANG Q, LAI Y, ZHANG D, et al.Gut microbiota regulation and prebiotic properties of polysaccharides from Oudemansiella raphanipes mushroom[J].World Journal of Microbiology &Biotechnology, 2023, 39(7):167.
[25] BI D X, ZHU Y, GAO Y H, et al.Profiling Fusobacterium infection at high taxonomic resolution reveals lineage-specific correlations in colorectal cancer[J].Nature Communications, 2022, 13(1):3336.
[26] 黄靖航, 杨立娜, 赵亚凡, 等.大豆种皮多糖对模拟肠液流变特性和肠道菌群的影响[J].中国食品学报, 2020, 20(12):48-55.HUANG J H, YANG L N, ZHAO Y F, et al.Effects of soy hull polysaccharide on the rheological properties of simulated intestinal fluid and intestinal flora[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(12):48-55.
[27] 廖强, 邓志扬, 刘佳, 等.山楂多糖的分离纯化及其对粪便菌群的影响[J].食品与发酵工业, 2023, 49(12):54-61.LIAO Q, DENG Z Y, LIU J, et al.Isolation and purification of polysaccharides from hawthorn fruit and the effects on fecal microbiota[J].Food and Fermentation Industries, 2023, 49(12):54-61.
[28] ZHANG X, AWEYA J J, HUANG Z X, et al.In vitro fermentation of Gracilaria lemaneiformis sulfated polysaccharides and its agaro-oligosaccharides by human fecal inocula and its impact on microbiota[J].Carbohydrate Polymers, 2020, 234:115894.
[29] MORISHIMA S, KAWADA Y, FUKUSHIMA Y, et al.A randomized, double-blinded study evaluating effect of matcha green tea on human fecal microbiota[J].Journal of Clinical Biochemistry and Nutrition, 2023, 72(2):165-170.
[30] WANG R Y, LIN F, YE C, et al.Multi-omics analysis reveals therapeutic effects of Bacillus subtilis-fermented Astragalus membranaceus in hyperuricemia via modulation of gut microbiota[J].Food Chemistry, 2023, 399:133993.