赭曲霉毒素(ochratoxin, OTA)是由青霉属和曲霉属中某些真菌物种产生的次级代谢产物,是一组结构上相关的异香豆素衍生物真菌毒素,根据其化学结构,赭曲霉毒素主要分为赭曲霉毒素A(ochratoxin A, OTA)、赭曲霉毒素B(ochratoxin B, OTB)、赭曲霉毒素C(ochratoxin C, OTC)、赭曲霉毒素α(ochratoxin α, OTα)、赭曲霉毒素β(ochratoxin β, OTβ)5种类型,其中以OTA毒性最强[1]。OTA是由含有氯元素的异香豆素衍生物经酰胺键缩合而成,动物实验证实:低浓度、长时间摄入OTA可能会危害人体健康[2]。OTA被认为是食品和农产品中分布最广泛、毒性最强的真菌毒素[3]。
酿酒葡萄在生长成熟以及发酵前的采收过程中容易受到真菌病害的侵染而导致OTA含量增加,在葡萄酒酿造过程中,OTA随着压榨和浸渍的进行而进入葡萄酒中,对葡萄酒质量安全造成一定影响[4-5]。在红葡萄酒的生产过程中,葡萄采收前控制OTA的方法在于防止田间病害或运输过程中的机械损伤,进而防止霉菌毒素的生成,但在多数情况下,这些方法是远远不够的,葡萄酒中OTA的控制策略应结合整个酿酒工艺流程进行[6]。在浸渍过程中,葡萄皮渣与葡萄汁充分接触,导致葡萄皮渣中的OTA进入到葡萄汁中,并随着发酵的进行进入葡萄酒中[7-8]。主发酵阶段是葡萄酒酿造过程中去除OTA的关键控制点之一,而澄清工艺对葡萄酒中OTA的去除效果仅次于主发酵阶段。澄清剂不仅可以澄清葡萄酒中的杂质,还可被用于吸附OTA[9]。OTA具有弱酸性,pKa为4.4,因此它在葡萄酒的pH值下会发生部分解离,携带负电荷,与带正电的壳聚糖表面相结合而被除去[10]。然而,澄清剂的加入不仅能够吸附葡萄酒中的OTA,还会引起多酚类物质的损失。BEHFAR等[11]综合评估了明胶、膨润土和硅藻土对葡萄汁中OTA的吸附作用,并利用响应面试验设计优化了了最大限度地去除OTA的同时减少抗氧化化合物损失的工艺参数,证明了葡萄酒澄清剂对OTA的吸附效果。
目前国内对OTA的研究多集中于检测方法的创新上,主要有同位素稀释-超高效液相色谱-串联质谱法(ultra performance liquid chromatography/tandem mass spectrometry, UPLC-MS/MS)[12]、化学发光传感器法[13]等,但对于降低葡萄及其制品中OTA含量,以及在葡萄酒酿造过程中降低OTA污染发生率方面的工作仍显不足。本研究拟以‘赤霞珠’干红葡萄酒为材料,以澄清工艺为切入点,采用HPLC测定壳聚糖、明胶、皂土3种澄清剂在不同浓度处理下对葡萄酒中OTA的含量的影响,计算其吸附率,结合酒体理化指标和多酚类物质等品质指标综合评估其适用性,筛选最合适的OTA吸附剂,以期为控制葡萄酒中OTA含量,降低成品酒中霉菌毒素污染的潜在安全隐患提供可靠的技术支撑。
1 材料与方法
1.1 材料与试剂
‘赤霞珠’干红葡萄酒取自实验室自酿酒样,葡萄原料于2022年9月采收自新疆鄯善县楼兰酒庄股份有限公司葡萄园内,葡萄植株树形均为“厂”字形,树龄八年,葡萄园行距为3.0 m,株距为1.0 m,采用常规田间管理。
壳聚糖、柠檬酸、NaOH、NaCl、NaHCO3、K2HPO4、吐温-20(均为分析级),天津致远化学试剂有限公司;甲醇、乙腈、盐酸、冰乙酸(均为色谱级),北京化学试剂公司;酿酒酵母(FX10)、明胶、皂土,上海鼎唐国际贸易有限公司;赭曲霉毒素A标准品(色谱级),青岛普瑞邦生物工程有限公司;赭曲霉毒素A免疫亲和柱,青岛普瑞邦生物工程有限公司。
1.2 仪器与设备
LC-20AD高效液相色谱仪配荧光检测器,日本岛津公司;FE22 pH计、LE204E电子天平,梅特勒-托利多仪器有限公司;FOSS全自动葡萄酒分析检测仪,丹麦福斯公司;T6紫外可见分光光度计,北京普析通用仪器有限责任公司;SHZ-B恒温水浴振荡器,上海博讯医疗生物仪器股份有限公司;SF-TGL-20R冷冻离心机,上海安亭科学仪器厂。
1.3 实验方法
1.3.1 OTA标准溶液配制
利用减重法配制OTA标准储备液,先擦拭干净瓶外壁,将标准品连同外包装一起称重,用纯度99.9%的甲醇溶液将瓶内的OTA固体标准品转移至容量瓶中,荡洗瓶内壁和瓶盖数次并转移至此容量瓶中,在同一台天平上称重,精确至0.01 mg,2次称重的差值即为容量瓶内溶解的OTA标准品含量,计算并稀释至0.1 mg/mL,液体保存于-20 ℃条件下。移取OTA标准储备液,用甲醇稀释,分别配制成1、5、10、20、50、100 μg/L标准工作液,-20 ℃保存待用。
1.3.2 澄清剂溶液的配制
参考唐智等[14]的方法,制备1%明胶溶液、1%壳聚糖溶液和1%皂土悬液。
1.3.3 样品处理
对采摘后的‘赤霞珠’葡萄果实进行破碎浸渍处理,24 h后加入200 mg/L酿酒酵母(FX10)进行酒精发酵,发酵结束后得到原酒,加入10 μg/L OTA标准工作液使葡萄酒初始OTA质量浓度为3.3 μg/L,取30份加标原酒分装于250 mL锥形瓶中,每份50 mL,分成3组,每个处理浓度设置2组平行,分别加入1%壳聚糖溶液、1%明胶溶液、1%皂土悬液使澄清剂质量浓度分别为0.2、0.4、0.6、0.8、1.0 g/L,然后将样品充分置于恒温振荡水浴锅中180 r/min,25 ℃恒温振荡2 h后静置48 h,5 000 r/min再离心5 min,取上清液测定理化指标、透光率和OTA含量。
1.3.4 分析检测
1.3.4.1 葡萄酒理化指标测定
酒精度、总酸、pH、还原糖采用FOSS全自动葡萄酒分析仪测定,将25 mL处理好的酒样离心后装入试管中置于葡萄酒分析检测仪探头下测定,每个处理酒样重复测定3次,结果以平均值±标准差表示。
1.3.4.2 色度的测定
参考张宁波等[15]的方法,以蒸馏水为对照,测定处理酒样在420、520、620 nm下的吸光值,以A=A420nm+A520nm+A620nm表示色度,每个酒样重复测定3次。
1.3.4.3 透光率的测定
参考唐智等[14]的方法,以蒸馏水为对照,测定处理酒样在680 nm下的透光率,以透光率表示葡萄酒的澄清度,每个处理酒样重复测定3次。
1.3.4.4 总酚的测定
总酚的测定参考冯磊[16]的方法,含量以没食子酸计(mg/L)。
1.3.4.5 总花色苷的测定
参考翦祎等[17]的方法,含量以矢车菊素-3-O-葡萄糖苷计(mg/L)。
1.3.4.6 单宁的测定
参考冯磊[16]的方法,由吸光度值从标准曲线查出相应的单宁含量(mg/L)。
1.3.4.7 OTA提取与测定
参考GB 5009.96—2016《食品安全国家标准 食品中赭曲霉毒素A的测定》第一法免疫亲和层析净化液相色谱法。
1.3.4.8 OTA定量分析
采用外标法,结合6个浓度OTA标准工作液的浓度X与峰面积Y之间的关系,绘制标准曲线。OTA标准工作液在1~100 μg/L线性范围内,相关系数R2为0.999 9,线性关系良好,结果如表1所示。
表1 OTA峰面积回归分析
Table 1 OTA peak area regression analysis
标准品名称保留时间/min线性范围/(μg/L)回归方程相关系数(R2)OTA7.1711~100Y=5 101.23X+248.2750.999 9
1.3.5 计算公式
1.3.5.1 透光率的计算
澄清剂对葡萄酒的澄清效果以透光率T表示,其计算如公式(1)所示:
透光率T/%=10-A×100
(1)
式中:A,酒样在680 nm下的吸光度。
1.3.5.2 OTA吸附率的计算
澄清剂对葡萄酒中OTA的吸附效果以吸附率R表示,其计算如公式(2)所示:
吸附率![]()
(2)
式中:C1,原酒样中OTA质量浓度,μg/L;C2,处理酒样中OTA质量浓度,μg/L。
1.4 数据处理
采用 Excel 2021处理数据并由SPSS 22.0进行统计与分析,图片使用Origin 2021和Graphpad prism 8.0绘制。
2 结果与分析
2.1 不同澄清剂对葡萄酒基础理化指标的影响
通过对3种不同种类和浓度澄清剂处理的酒样进行基础理化指标检测,由表2可知,添加不同种类和浓度的澄清剂后葡萄酒理化指标均呈现不同程度的波动,且不同种类和浓度澄清剂处理间有一定差异,其中0.2、0.6 g/L壳聚糖和0.2 g/L皂土处理后与原酒相比酒精度显著提高(P<0.05),0.4、0.8 g/L明胶处理酒精度最低,3种澄清剂处理后酒精度均呈现波动趋势,这一结果与卢新军等[18]的研究结果相似,但目前对于不同澄清剂对葡萄酒酒精度的影响机制尚不清晰;不同澄清剂处理酒样与原酒相比总酸含量均不同程度下降,其中0.8 g/L皂土、0.4 g/L和0.8 g/L明胶对葡萄酒总酸含量降低的效果最明显,原因可能是不同类型的澄清剂会与葡萄酒中部分酸有不同的亲和力和相互作用,或者会与一些有机酸结合并生成沉淀后随着过滤作用除去,进而在一定程度上降低葡萄酒总酸含量;原酒的pH最低,其次是1.0 g/L壳聚糖和1.0 g/L明胶且2个处理间没有显著差异(P>0.05),0.8 g/L皂土处理后酒样pH最高,表明3种澄清剂处理均会使葡萄酒总酸含量下降。在不同类型和浓度澄清剂作用下,葡萄酒中总糖的变化与酒精度相似,均呈现不同程度的波动趋势,其中0.4 g/L明胶处理后葡萄酒总糖含量最高,而0.2 g/L皂土处理下葡萄酒总糖含量最低,添加0.6 g/L明胶与原酒总糖含量没有显著差异(P>0.05),以上结果表明皂土处理会在一定程度上影响葡萄酒的口感,这与先前的研究结果相似[19]。综合比较发现0.4 g/L明胶对葡萄酒理化指标的影响最大,1.0 g/L壳聚糖对葡萄酒理化指标的影响最小,但各处理酒样理化指标均处于国标规定的正常范围,总体上没有改变葡萄酒酒体的平衡,这与吕艳梅等[20]的研究结果相似。
表2 不同浓度澄清剂处理下葡萄酒的基础理化指标
Table 2 Basic physicochemical indexes of wine treated with different concentrations of clarifier

试样质量浓度/(g/L)酒精度/%vol总酸/(g/L)pH总糖/(g/L)样品-13.68±0.02e4.24±0.01a4.41±0.01i4.68±0.01i0.214.11±0.01a3.92±0.06d4.65±0.01f4.19±0.01k0.413.33±0.02h3.70±0.03g4.74±0.01d4.85±0.01e壳聚糖0.613.91±0.01b4.08±0.04c4.55±0.02g4.57±0.02j0.812.54±0.01l3.68±0.02g4.75±0.01d4.90±0.02c1.013.74±0.02d4.16±0.02b4.52±0.01h4.74±0.01h0.213.57±0.02g3.75±0.01f4.75±0.01d4.77±0.01g明胶0.412.02±0.01o3.16±0.01i4.81±0.01b5.13±0.01a0.613.62±0.01f3.83±0.02e4.66±0.01f4.68±0.02i0.812.04±0.01n3.14±0.01i4.82±0.01b4.97±0.02b1.013.74±0.01d4.15±0.01b4.53±0.01h4.67±0.01i皂土0.213.86±0.02c3.75±0.01f4.72±0.01de4.13±0.01l0.413.17±0.01j3.60±0.02h4.78±0.01c4.88±0.01cd0.613.29±0.02i3.85±0.01e4.66±0.01f4.81±0.01f0.812.36±0.01m2.99±0.03j4.93±0.01a4.96±0.02b1.012.99±0.02k3.59±0.01h4.78±0.02c4.87±0.02d
注:同列不同小写字母表示同一指标不同处理间差异显著(P<0.05)。
2.2 不同澄清剂对葡萄酒透光率和色度的影响
透光率是表征葡萄酒澄清效果的重要指标之一,透光率越高,澄清剂的澄清效果越好[21]。不同澄清剂处理下葡萄酒透光率和色度的变化如图1所示,可以看出随着壳聚糖质量浓度的增加,酒样的透光率先逐渐上升,然后趋于稳定,与先前报道的研究结果[22]相一致。当壳聚糖质量浓度超过0.6 g/L时,酒体的色度下降程度较明显,这是由于过量的壳聚糖容易与葡萄酒中其他成分作用形成沉淀或引入杂质进而造成葡萄酒浑浊现象[23]。与之不同的是,随着明胶浓度的增加,酒体透光率增大,当明胶质量浓度为1.0 g/L时,酒体的透光率可达77.5%,但此时酒体色度损失了26.16%。皂土对酒体的澄清效果和色度的影响与壳聚糖相似,但澄清效果不如壳聚糖和明胶。因此,有必要选择合适的澄清剂以维持葡萄酒色泽和外观品质。当澄清剂添加量为0.6 g/L时,3种澄清剂对酒体的澄清效果依次为:壳聚糖>明胶>皂土,此时酒体的色度大小依次为:皂土>壳聚糖>明胶,综合透光率和色度指标来看,添加0.6 g/L壳聚糖是提高葡萄酒透光率和维持酒体色泽品质的有效方法。
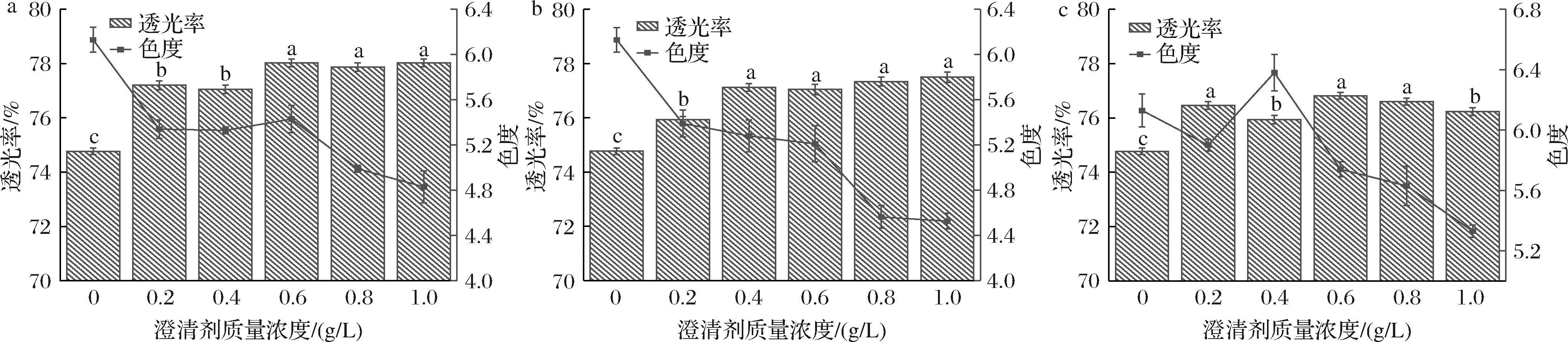
a-壳聚糖;b-明胶;c-皂土
图1 不同澄清剂对葡萄酒透光率和色度的影响
Fig.1 Effect of different clarifying agents on light transmittance of wine
注:图中不同小写字母表示不同浓度澄清剂处理下透光率的差异(P<0.05)。
2.3 不同澄清剂对葡萄酒多酚类物质损失的影响
不同澄清剂种类对葡萄酒多酚含量的影响明显不同,并且随澄清剂质量浓度的变化而改变,这些变化主要取决于不同澄清剂的分子结构、等电点和表面电荷密度[24]。从图2-a可以看出,不同质量浓度的3种澄清剂对葡萄酒总酚损失的影响总体呈现波动趋势并且处理间差异较大,其中明胶对葡萄酒总酚损失的影响最大,在0.4 g/L明胶处理下葡萄酒总酚损失率达39.78%,显著高于同质量浓度皂土处理组(P<0.05),而0.6 g/L壳聚糖对酒体总酚损失的影响最小。总花色苷含量损失率如图2-b所示,经澄清处理后酒样总花色苷均有不同程度的损失,且总体上随质量浓度增加而呈递增趋势,尤其是0.4 g/L皂土和1.0 g/L明胶处理总花色苷损失较大(相较于对照(201.5 mg/L)分别损失47.44%和50.34%),而0.6 g/L皂土处理对酒体总花色苷损失影响较小(仅降低8.97%)。由此表明明胶对葡萄酒多酚含量影响较大,这是由于明胶作为一种蛋白质,主要通过静电吸附、氢键结合以及疏水作用与葡萄酒中酚类物质发生相互作用。从分子结构角度来看,明胶的分子结构中含有大量的羟基和胺基官能团,这些官能团和酚类物质中的羟基、羧基等官能团能够通过氢键和化学键等强相互作用力进行作用,增强吸附能力,相比之下,壳聚糖分子中的羟基较少,皂土则没有相应官能团可与酚类物质进行强相互作用[25]。
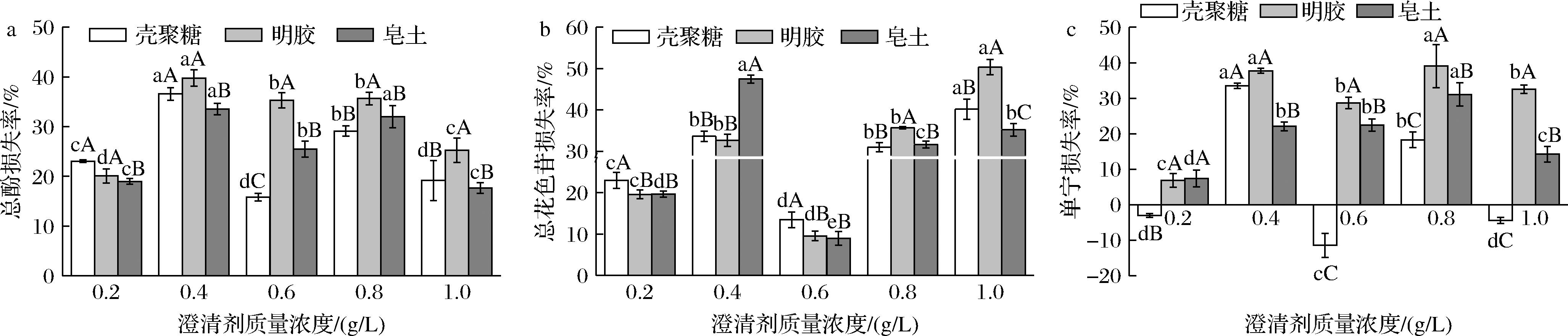
a-葡萄酒总酚;b-总花色苷;c-单宁
图2 不同澄清剂对葡萄酒总酚、总花色苷以及单宁损失率的影响
Fig.2 Effect of different clarifiers on the rate of loss of total phenols, total anthocyanins and tannins from wine
注:大写字母表示同一浓度不同种类澄清剂处理下总酚损失率的差异(P<0.05),小写字母表示同一种类不同浓度澄清剂处理下总酚损失率的差异(P<0.05)。
而单宁随澄清过程的变化与总酚和总花色苷略有不同,如图2-c所示,壳聚糖质量浓度为0.2、0.6、1.0 g/L时,单宁的损失率分别为-3.01%、-11.41%、-4.34%,意味着在此质量浓度下单宁含量反而上升了,造成这一现象的原因可能是壳聚糖通过静电吸附作用结合了酒体中果胶和蛋白质以及其他酚类物质,减少了单宁通过氢键或疏水相互作用与壳聚糖结合的几率,从而增加酒体中单宁的含量[26]。
2.4 不同澄清剂对葡萄酒OTA吸附率的影响
不同澄清剂对葡萄酒的澄清效果不同,对OTA的吸附作用也有所不同。由图3可以看出,在相同质量浓度下,壳聚糖对OTA的吸附率最高,明胶和皂土对OTA的吸附率较低,在1.0 g/L质量浓度处理下壳聚糖分别比明胶和皂土处理下OTA吸附率高11.27%和21.02%,综合来看,壳聚糖的吸附率最高,且OTA的吸附率在不同质量浓度和种类澄清剂作用下显著差异(P<0.05)。不同澄清剂在1.0 g/L处理下的吸附效果最好,随着澄清剂浓度的降低OTA吸附率逐渐递减。因此,较高浓度的澄清剂有利于降低葡萄酒中的OTA含量,这一结果与先前研究的结论一致[24],而ZHANG[9-10]的结果表明0.02%~0.1%的明胶对OTA的吸附作用高于同剂量的壳聚糖,不同澄清剂对透光率的影响也呈现与之相似的结果,这与本研究的结果相反,原因可能是澄清剂浓度以及处理条件的不同[12]。表明澄清剂对OTA的吸附存在剂量依赖性,1.0 g/L壳聚糖对OTA的吸附效果更好,因此在实际生产中可将添加1.0 g/L壳聚糖作为降低成品酒中OTA含量的方法之一。
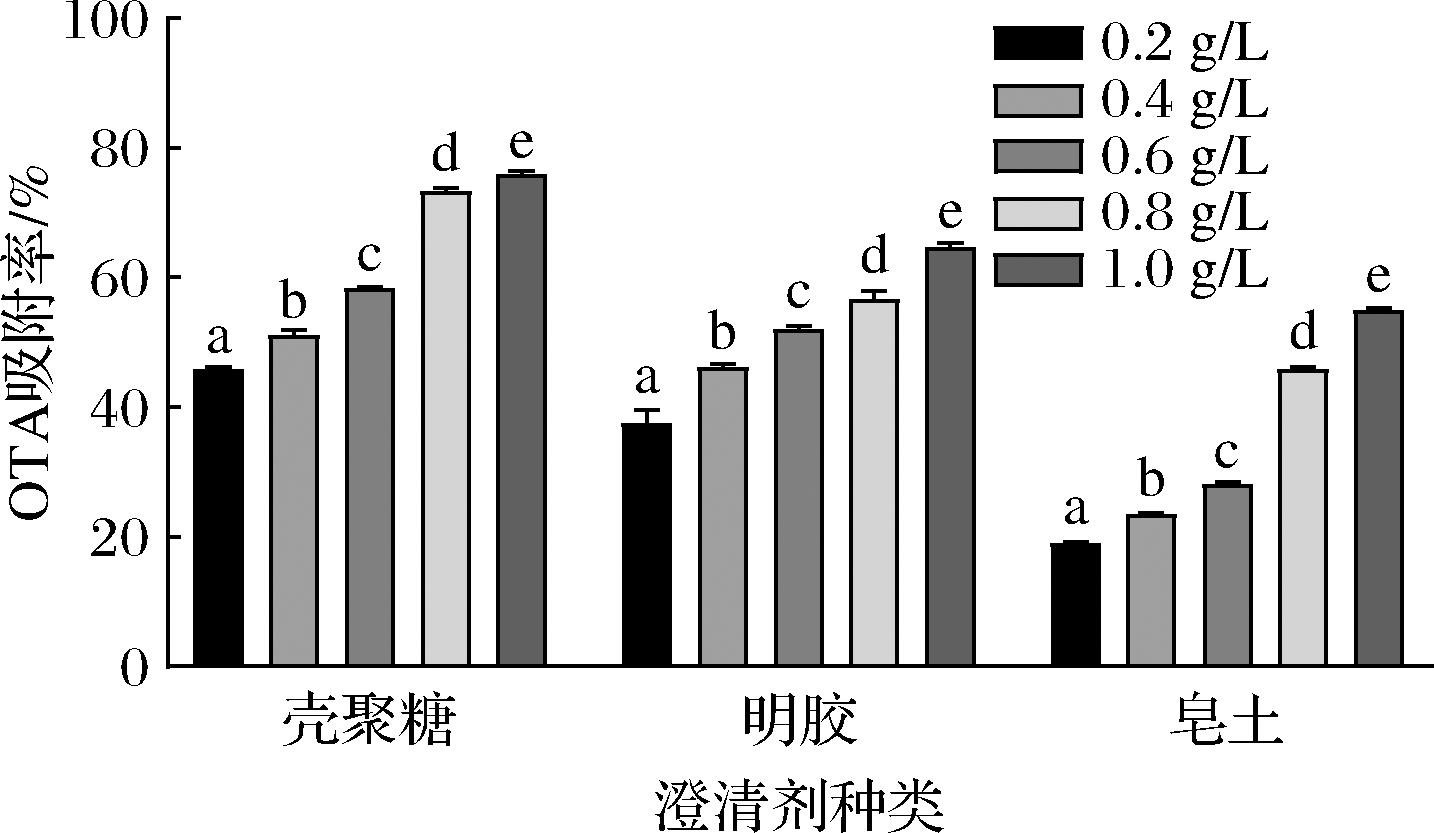
图3 不同澄清剂及其不同质量浓度对葡萄酒中OTA
吸附率的影响
Fig.3 Effect of different clarifiers and their different concentrations on the adsorption rate of OTA in wine
注:不同字母表示不同浓度处理下指标的差异(P<0.01)。
2.5 澄清过程中OTA与葡萄酒品质指标的关系
澄清过程中,葡萄酒中部分成分会被澄清剂吸附后随着过滤作用而除去。图4为澄清过程中OTA与葡萄酒各品质指标之间的相关性矩阵,散点图中的模式表明了2个变量之间关系的类型和强度,红色代表正相关,蓝色代表负相关,每个单独的散点图中散点的趋势代表相关性强度。在不同澄清剂处理下,葡萄酒透光率与OTA含量呈显著负相关(r=-0.757),进一步说明随着澄清作用的进行,酒体透光率逐渐增加的同时OTA逐渐降低,但多酚类物质以及葡萄酒色度与透光率也呈负相关关系,证明了澄清剂除能够吸附OTA外对葡萄酒色泽和外观品质存在一定影响。因此,需要选择合适的澄清剂种类和最适处理质量浓度以最大程度降低OTA含量的同时避免影响葡萄酒的色泽和外观品质。
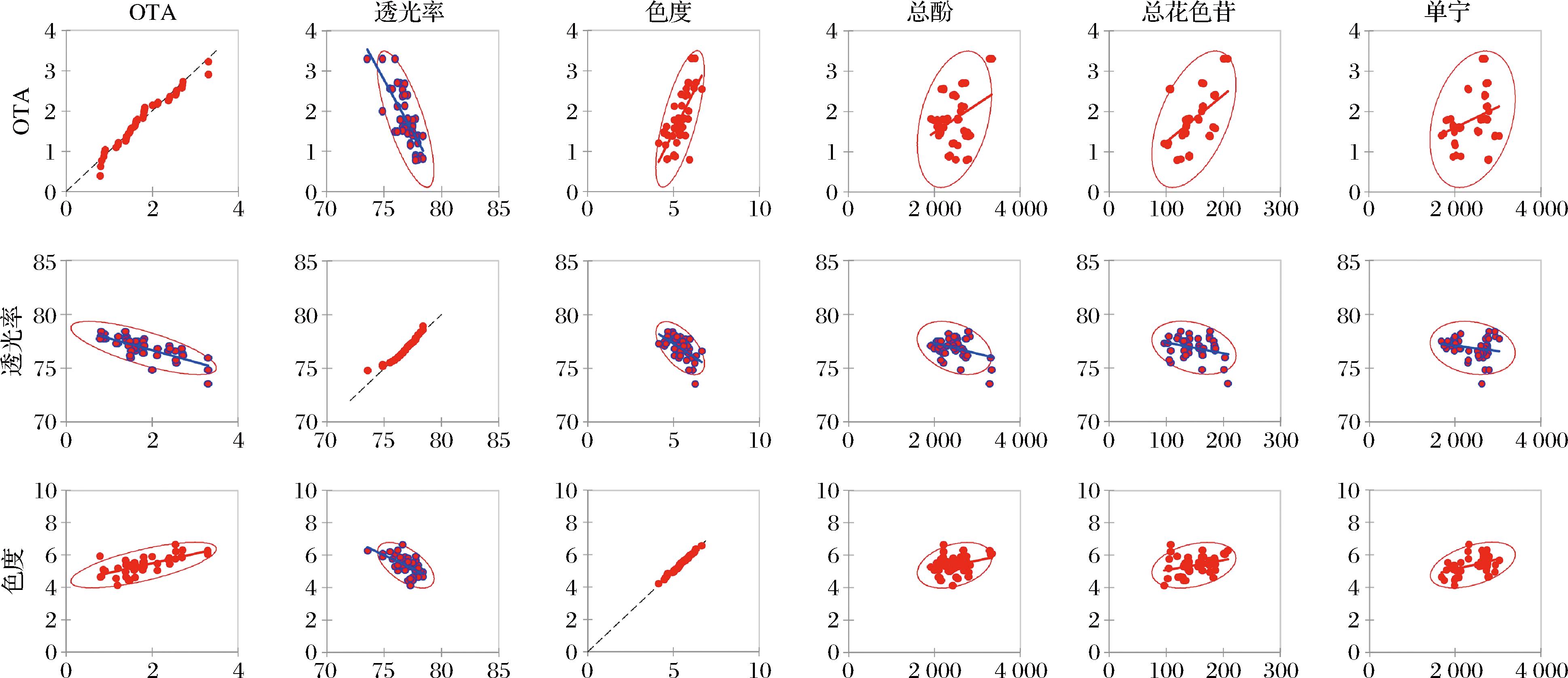
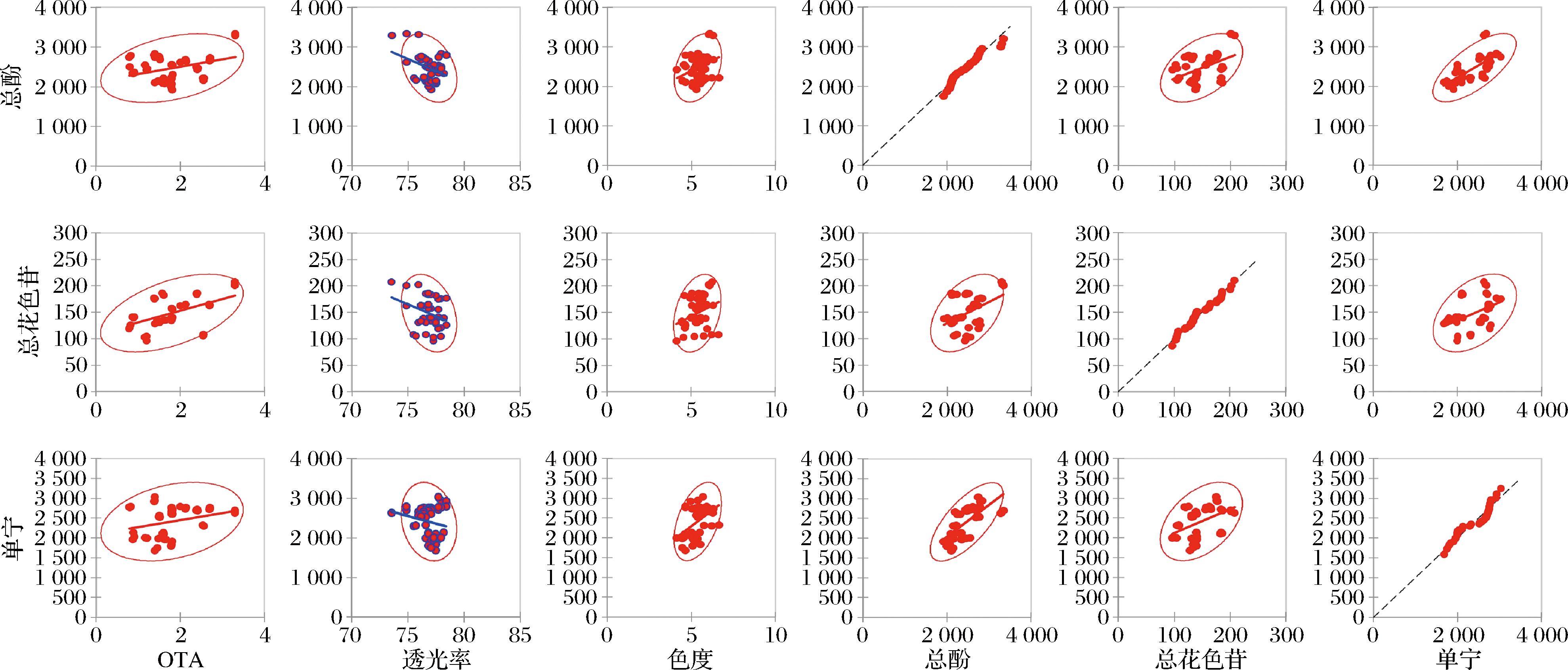
图4 OTA与葡萄酒品质指标之间的相关性矩阵
Fig.4 Correlation matrix between OTA and wine quality indicators
3 结论
分别利用壳聚糖、明胶和皂土3种不同质量浓度澄清剂对葡萄酒中OTA进行吸附效果研究,并初步探究其对葡萄酒理化品质的影响。结果表明,3种澄清剂均能够有效吸附葡萄酒中的OTA,壳聚糖的吸附效果最好,OTA吸附率随澄清剂质量浓度增加而升高,综合比较3种不同质量浓度澄清剂对葡萄酒OTA吸附率及品质的影响,以澄清剂对OTA吸附率最高、对葡萄酒品质影响较小为目的,筛选出1.0 g/L壳聚糖作为吸附葡萄酒中OTA的最适方法。在此处理下,OTA吸附率可达75.87%,透光率为78.22%,相比其他组合对葡萄酒基础理化成分和多酚类物质影响不大,可为降低葡萄酒中OTA污染的潜在安全隐患提供一定的科学指引。
[1] 高婧, 刘惠卿, 张真真, 等.赭曲霉毒素A的产生、毒性机制与生物合成研究进展[J].微生物学通报, 2023, 50(3):1265-1280.GAO J, LIU H Q, ZHANG Z Z, et al.Production, toxicity and biosynthesis of ochratoxin A:A review[J].Microbiology China, 2023, 50(3):1265-1280.
[2] EL KHOURY A, ATOUI A.Ochratoxin a:General overview and actual molecular status[J].Toxins, 2010, 2(4):461-493.
[3] WANG L, HUA X, SHI J, et al.Ochratoxin A:Occurrence and recent advances in detoxification[J].Toxicon:Official Journal of the International Society on Toxinology, 2022, 210:11-18.
[4] REYNOLDS A G.Managing Wine Quality Volume 1:Viticulture and Wine Quality[M].New York:Woodhead, 2010.
[5] ABRUNHOSA L, PATERSON R R M, VEN NCIO A.Biodegradation of ochratoxin a for food and feed decontamination[J].Toxins, 2010, 2(5):1078-1099.
NCIO A.Biodegradation of ochratoxin a for food and feed decontamination[J].Toxins, 2010, 2(5):1078-1099.
[6] 南米娜, 辛雪燕, 薛华丽, 等.葡萄及其制品中赭曲霉毒素A的污染现状及检测技术研究进展[J].食品安全质量检测学报, 2023, 14(3):122-130.NAN M N, XIN X Y, XUE H L, et al.Research advance on the contamination status and detection of ochratoxin A in Vitis vinifera L.and its products[J].Journal of Food Safety &Quality, 2023, 14(3):122-130.
[7] 全莉. 新疆葡萄酒酿造过程中赭曲霉毒素A含量的变化及影响因素研究[D].乌鲁木齐:新疆农业大学, 2019.QUAN L.Study on the changes of Ochratoxin A content and its influencing factors in Xinjiang wine brewing process[D].Urumqi:Xinjiang Agricultural University, 2019.
[8] LA PLACA L, TSITSIGIANNIS D, CAMARDO LEGGIERI M, et al.From grapes to wine:Impact of the vinification process on ochratoxin A contamination[J].Foods, 2023, 12(2):260.
[9] ZHANG J R, CAI R, YUE T L, et al.Assessment of traditional clarifiers on the adsorption of ochratoxin A in Cabernet Sauvignon red wine and their kinetics[J].Food Chemistry, 2022, 373(Pt B):131592.[10] CASTRO MAR N A, COLANGELO D, LAMBRI M, et al.Relevance and perspectives of the use of chitosan in winemaking:A review[J].Critical Reviews in Food Science and Nutrition, 2021, 61(20):3450-3464.
N A, COLANGELO D, LAMBRI M, et al.Relevance and perspectives of the use of chitosan in winemaking:A review[J].Critical Reviews in Food Science and Nutrition, 2021, 61(20):3450-3464.
[11] BEHFAR M, HESHMATI A, MEHRI F, et al.Removal of ochratoxin A from grape juice by clarification:A response surface methodology study[J].Foods, 2022, 11(10):1432.
[12] 杨雪丽, 王猛, 李菁, 等.葡萄酒中16种真菌毒素的同位素稀释-超高效液相色谱-串联质谱同时测定法[J].职业与健康, 2023, 39(11):1447-1454.YANG X L, WANG M, LI J, et al.Simultaneous determination of 16 kinds of mycotoxins in wine by isotope dilution-ultra performance liquid chromatography-tandem mass spectrometry[J].Occupation and Health, 2023, 39(11):1447-1454.
[13] 杨成, 张亚旗, 林黛琴, 等.激活式复合功能核酸化学发光传感器检测葡萄酒中的赭曲霉毒素A[J].分析化学, 2021, 49(4):496-503.YANG C, ZHANG Y Q, LIN D Q, et al.Chemiluminescence sensor based on composite functional nucleic acid for detection of ochratoxin A in wine[J].Chinese Journal of Analytical Chemistry, 2021, 49(4):496-503.
[14] 唐智, 喻学淳, 胡永奇, 等.复合澄清剂对桂圆果酒的澄清作用研究[J].食品与发酵科技, 2022, 58(4):25-31.TANG Z, YU X C, HU Y Q, et al.Study on the clarification effect of compound clarifier on Longan fruit wine[J].Food and Fermentation Science &Technology, 2022, 58(4):25-31.
[15] 张宁波, 王箐瑶.4种非动物源澄清剂对赤霞珠葡萄酒澄清效果的影响[J].食品安全导刊, 2022(32):78-80;85.ZHANG N B, WANG J Y.Study on the effect of four non-animal fining agents on wine clarification[J].China Food Safety Magazine, 2022(32):78-80;85.
[16] 冯磊. 新疆产区赤霞珠红葡萄酒色泽稳定性研究[D].烟台:烟台大学, 2022.FENG L.Study on color stability of Cabernet Sauvignon red wine in Xinjiang region[D].Yantai:Yantai University, 2022.
[17] 翦祎, 韩舜愈, 张波, 等.单一pH法、pH示差法和差减法快速测定干红葡萄酒中总花色苷含量的比较[J].食品工业科技, 2012, 33(23):323-325;423.JIAN Y, HAN S Y, ZHANG B, et al.Comparison of single pH method, pH-differential method and substraction method for determining content of anthocyanins from red wine[J].Science and Technology of Food Industry, 2012, 33(23):323-325;423.
[18] 卢新军, 何少华, 范永, 等.几种下胶材料对干红葡萄酒澄清效果及品质的影响[J].食品与发酵工业, 2019, 45(19):159-165.LU X J, HE S H, FAN Y, et al.Effect of several gluing materials on clarification effect and quality of dry red wine[J].Food and Fermentation Industries, 2019, 45(19):159-165.
[19] 焦红茹, 刘爱国, 谢春梅, 等.蛋清粉对蛇龙珠干红葡萄酒澄清效果的研究[J].保鲜与加工, 2022, 22(8):29-33;40.JIAO H R, LIU A G, XIE C M, et al.Study on the clarification effects of egg white powder on cabernet gernischt dry red wine[J].Storage and Process, 2022, 22(8):29-33;40.
[20] 吕艳梅, 依力努尔, 宋长冰, 等.不同澄清剂对‘赤霞珠’干红葡萄酒澄清效果及品质的影响[J].中外葡萄与葡萄酒, 2022(4):40-44.LYU Y M, ELAM E, SONG C B, et al.Effects of different clarifying agents on clarifying effect and quality of‘Cabernet Sauvignon’dry red wine[J].Sino-Overseas Grapevine &Wine, 2022(4):40-44.
[21] 吴安迪. 壳聚糖/海藻酸钠复合澄清杨梅汁的工艺及机理研究[D].杭州:浙江大学, 2022.WU A D.Study on the technology and mechanism of chitosan/sodium alginate composite clarification of bayberry juice[D].Hangzhou:Zhejiang University, 2022.
[22] 赵玲燕, 谭晓辉, 龙运忠, 等.复合澄清剂处理柚子发酵酒的澄清效果研究[J].中国酿造, 2020, 39(3):115-119.ZHAO L Y, TAN X H, LONG Y Z, et al.Clarification effect of fermented grapefruit wine with compound clarifiers[J].China Brewing, 2020, 39(3):115-119.
[23] BORNET A, TEISSEDRE P L.Chitosan, chitin-glucan and chitin effects on minerals (iron, lead, cadmium) and organic (ochratoxin A) contaminants in wines[J].European Food Research and Technology, 2008, 226(4):681-689.
[24] GHANEM C, TAILLANDIER P, RIZK M, et al.Analysis of the impact of fining agents types, oenological tannins and mannoproteins and their concentrations on the phenolic composition of red wine[J].LWT - Food Science and Technology, 2017, 83:101-109.
[25] VERSARI A, BARBANTI D, POTENTINI G, et al.Physico-chemical characteristics of some oenological gelatins and their action on selected red wine components[J].Journal of the Science of Food and Agriculture, 1998, 78(2):245-250.
[26] DE FREITAS V, MATEUS N.Protein/polyphenol interactions:Past and present contributions.mechanisms of astringency perception[J].Current Organic Chemistry, 2012, 16(6):724-746.