近年来,我国的苹果年产量稳步提高,2020—2021年产量达4 406.6万t,稳居世界第一大苹果生产国[1]。苹果加工主要以苹果浓缩汁、果汁饮料、苹果酒、苹果蒸馏酒等为主,其中苹果酒是由苹果汁经过部分或全部发酵而制成的酒精饮料,因其酒精含量较低深受年轻消费者的喜爱,在中国具有良好的市场前景[2]。
不同品种苹果的酿造特性不同,在果酒加工过程中会利用自身果胶酶或者通过加入一些商业用果胶酶,使原料中部分难溶的果胶物质进一步分解,从而提高水果的出汁率和产量,并加速果汁澄清,改善果酒的品质[3-4]。果胶是植物细胞壁主要组成成分之一,是一种多糖聚合物,对细胞起着软化和黏合作用,影响果汁的黏稠性和稳定性,主要由原果胶(protopectin,SP)、水溶性果胶(water-soluble pectin,WSP)等组成,其中原果胶亦称不溶性果胶,在酸、碱等化学试剂及酶的作用下,转变成可溶性果胶,并进一步转化为半乳糖醛酸;而果胶酶(pectinase,PT)是一种复杂的负责降解果胶物质的酶系统,主要由果胶酯酶(pectinesterase,PE,EC 3.1.1.11)、多聚半乳糖醛酸酶(polygalacturomase,PG,EC 3.2.1.15)、果胶裂解酶(pectinlyase,PL,EC 4.2.2.10)等组成,可以催化水解果胶生成半乳糖醛酸,增加果胶在水中的溶解度,从而提高苹果出汁率,改善过滤效率[5-6]。在实际生产中,商业果胶酶的利用在增加果酒产量的同时,还有增加苹果酒中甲醇等有害物质含量的风险[7]。文良娟等[7]研究发现,Cortland、Fuji、Crispin和Empire 4种不同品种的苹果在发酵过程中加入果胶酶对发酵醪液中甲醇含量的影响不一样,加入果胶酶后与未加入果胶酶相比,甲醇含量分别增加了0.138%、0.090%、0.0139%、0.096%,与ANDRAOUS等[8]对Gala、Red Delicious、Granny Smith、Bartlett pears品种的研究结果一致,因此有必要对苹果原料中果胶类物质以及天然存在的果胶酶类物质的活性进行更为深入的了解。
目前,关于苹果酒的研究主要是在原料[9-11]、发酵菌种筛选[12-13]、生产工艺[14-15]等方面的探索,对于果胶酶主要是集中在商业果胶酶对于苹果出汁率以及果汁澄清等方面[16],对于苹果原料本身果胶类物质以及天然存在的果胶酶活性的研究还非常少。本研究以不同品种的苹果为原料,对苹果汁及其发酵酒理化指标以及果胶、果胶酶类物质等差异进行研究分析,并对自然发酵以及商业接种发酵条件下不同品种苹果酒中甲醇含量的差异进行分析,通过更好地了解苹果原料成分的差异以及对苹果酒中甲醇的影响,以期为苹果酒适宜酿酒品种的选择以及更安全的苹果酒产品的发酵生产提供数据参考。
1 材料与方法
1.1 材料与试剂
6个苹果品种:红富士、青香蕉、小国光、粉红佳人、澳洲青苹、红将军,2021年12月采自烟台产区,选取健康无伤的苹果用于实验。
活性干酵母EC1118,法国Laffort公司;偏重亚硫酸钾,上海麦克林生化科技有限公司。
1.2 仪器与设备
L12-Energr61破碎机,山东九阳股份有限公司;BS124S电子天平,德国赛多利斯公司;BX-1手持折光计,德国SCHMIDT+HAENSCH公司;TU5200酒精计,江苏金怡仪器科技有限公司;PHS-25pH计,上海仪电科学仪器股份有限公司;7890B安捷伦气相色谱仪、HP-INNOWAX色谱柱(30 m×0.25 mm,0.25 μm),美国Agilent公司。
1.3 实验方法
1.3.1 苹果酒酿造及处理
苹果酒酿造工艺流程:
苹果清洗→去核切块→粉碎榨汁→低温静置→过滤取汁→接菌低温发酵→澄清分离→苹果酒
选取新鲜健康苹果,去核切块,破碎榨汁,过滤取汁,自然发酵处理;对于接种发酵处理,榨汁后,以200 mg/L苹果汁的比例接种酿酒酵母,酿酒酵母先用35 ℃温水活化15 min,将活化后的酵母分别加到苹果汁中混匀。随后所有处理的苹果汁18 ℃控温发酵。2周左右酒精发酵结束后澄清分离,4 ℃低温保存至待测。每个处理3个重复。
1.3.2 理化指标测定
苹果出汁率计算如公式(1):
出汁率![]()
(1)
可溶性固形物测定:通过手持折光计测定;酒精度、总酸(以苹果酸计)、pH等指标,参考GB/T 15038—2006《葡萄酒、果酒通用分析方法》中的方法测定。
1.3.3 果胶含量及PT活性测定
总果胶(total pectin,TP)、WSP、原果胶(protopectin,PP):Solarbio果胶含量检测试剂盒,可见分光光度法。
PT活性、PE活性、PL活性、PG活性:Solarbio果胶酶活性检测试剂盒。
1.3.4 甲醇含量测定
采用气相色谱法测定甲醇[17]:色谱柱HP-INNOWAX 30 m×0.25 mm×0.25 μm;检测器为FID;升温程序:35 ℃保持5 min,2 ℃/min升至90 ℃,10 ℃/min升至220 ℃,保持10 min。分流比1∶10,载气流速1 mL/min。
定性、定量方法:采用保留时间定性,外标法定量。
1.4 数据统计与分析
采用 SPSS 21.0 软件进行数据分析,多组间比较采用One-Way ANOVA法。
2 结果与分析
2.1 不同品种苹果汁及苹果酒的理化指标
出汁率最终会影响苹果原料的出酒率。从表1中可以看出,6个品种的苹果出汁率都超过了45%,品种间具有差异。其中红富士的出汁率最高,达64.88%,澳洲青苹和红将军的出汁率较低,分别为47.32%和48.31%,其余3个品种的出汁率差异不大。
表1 不同品种苹果苹果汁及苹果酒的理化指标
Table 1 Physicochemical indexes of apple juice and cider of different apple varieties
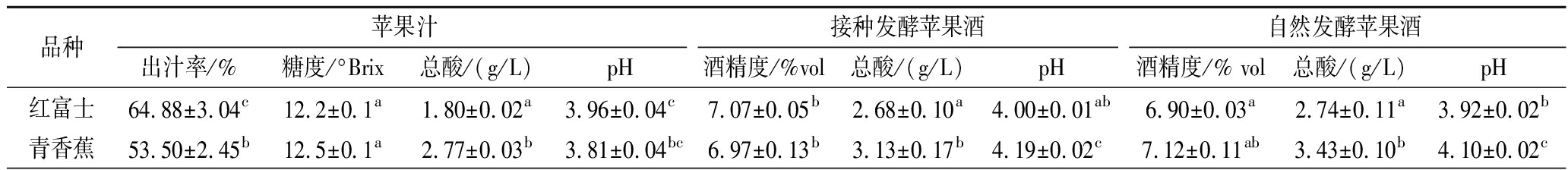
品种苹果汁接种发酵苹果酒自然发酵苹果酒出汁率/%糖度/°Brix总酸/(g/L)pH酒精度/%vol总酸/(g/L)pH酒精度/% vol 总酸/(g/L)pH红富士64.88±3.04c12.2±0.1a1.80±0.02a3.96±0.04c7.07±0.05b2.68±0.10a4.00±0.01ab6.90±0.03a2.74±0.11a3.92±0.02b青香蕉53.50±2.45b12.5±0.1a2.77±0.03b3.81±0.04bc6.97±0.13b3.13±0.17b4.19±0.02c7.12±0.11ab3.43±0.10b4.10±0.02c
续表1
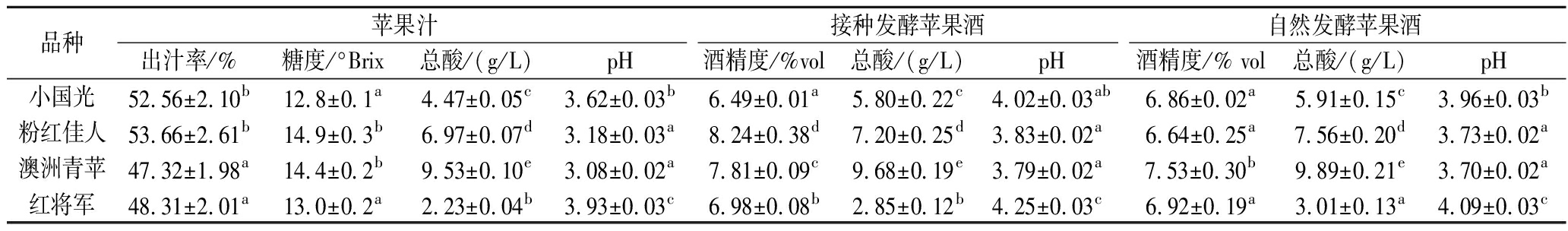
品种苹果汁接种发酵苹果酒自然发酵苹果酒出汁率/%糖度/°Brix总酸/(g/L)pH酒精度/%vol 总酸/(g/L)pH酒精度/% vol 总酸/(g/L)pH小国光52.56±2.10b12.8±0.1a4.47±0.05c3.62±0.03b6.49±0.01a5.80±0.22c4.02±0.03ab6.86±0.02a5.91±0.15c3.96±0.03b粉红佳人53.66±2.61b14.9±0.3b6.97±0.07d3.18±0.03a8.24±0.38d7.20±0.25d3.83±0.02a6.64±0.25a7.56±0.20d3.73±0.02a澳洲青苹47.32±1.98a14.4±0.2b9.53±0.10e3.08±0.02a7.81±0.09c9.68±0.19e3.79±0.02a7.53±0.30b9.89±0.21e3.70±0.02a红将军48.31±2.01a13.0±0.2a2.23±0.04b3.93±0.03c6.98±0.08b2.85±0.12b4.25±0.03c6.92±0.19a3.01±0.13a4.09±0.03c
注:不同小写字母表示差异显著(P<0.05)。
6个品种苹果含糖量均超过12 °Brix,其中粉红佳人和澳洲青苹的糖度最高,分别为14.9 °Brix和14.4 °Brix,相对应的其接种发酵苹果酒的酒精度也是最高的,分别为8.24%和7.81%,而自发苹果酒酒精度则以澳洲青苹的最高,为7.53%,其次是青香蕉为7.12%,粉红佳人最低,为6.64%,这可能与不同品种苹果表面的自然酵母菌群及其活性不同有关。
供试的苹果品种的酸度之间有着显著的差异,总酸含量为1.80~9.53 g/L,其中澳洲青苹的总酸最高,达到9.53 g/L,其次是粉红佳人,红富士的酸度最低,仅为1.80 g/L。苹果汁pH值为3.08~3.96,其中澳洲青苹果汁pH最低,红富士果汁pH值最高为3.96。接种发酵苹果酒的总酸含量为2.68~9.68 g /L,其中红富士的总酸含量最低,为2.68 g /L,澳洲青苹酒的总酸含量最高,为9.68 g/L。自然发酵苹果酒的总酸含量均比接种发酵苹果酒略高,这可能与自然发酵中菌群结构复杂,形成的挥发酸含量较高有关。供试的6个品种苹果发酵前后均表现出显著的品种差异性,这种差异不会影响正常的发酵,但是会对苹果酒的风味成分及感官品质等产生影响。
2.2 不同品种苹果果胶类物质含量的差异
果酒中的甲醇主要是来源于水果原料中的果胶水解。成熟的苹果中,尤其是苹果皮中含有较多的果胶类物质,这些呈胶态结构的果胶类物质不仅会使得果汁黏稠不易过滤,影响出汁率和澄清,而且经过水解会产生果胶酸和甲醇,从而影响苹果酒中甲醇的含量[18]。从图1中可以看出,红富士、小国光的TP含量最低,分别为5.02 μmol/g和4.21 μmol/g,青香蕉、澳洲青苹、红将军的TP含量相对较高,均超过6 μmol/g,这3个品种之间没有显著差异。红将军中的WSP含量最高,为4.65 μmol/g,这类果胶具有较高的酯化度,小国光和粉红佳人的WSP含量相对较低,分别为0.85 μmol/g和0.94 μmol/g。SP以红富士和青香蕉含量最高,粉红佳人中含量最低。供试的6个品种苹果的果胶类物质含量之间表现出品种差异。

图1 不同品种苹果果胶类物质的含量
Fig.1 Content of pectic substances in different apple varieties
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 不同品种苹果原料中果胶酶类活性的差异
果胶酶是指分解果胶物质的多种酶的总称,可源于动物植物和微生物,这些果胶酶在果酒发酵过程中对果胶的水解程度不同,最终酒中甲醇的含量也会有所不同。水果果实在成熟过程中,硬度降低,与半乳糖醛酸酶和果胶酯酶等果胶酶活性增加有着重要关系。果胶酶前体一般都含有N端信号区和糖基化位点,N端信号底一般由16~27个氨基酸组成,果胶酶多为糖蛋白,低聚糖以糖苷键的形式与酶蛋白的N-端结合。如图2所示,红将军、青香蕉、小国光原料中天然存在的内源果胶酶活性相对较高,均超过80 U/g,显著高于澳洲青苹的55.48 U/g。红将军的果胶酯酶活性最高,为1.78 U/g,其次是青香蕉为1.50 U/g,红富士和粉红佳人的活性最低,分别为1.00 U/g和1.01 U/g。果胶裂解酶和多聚半乳糖醛酸酶的活性均以红将军最高,分别达80.38 U/g和70.32 U/g,最低均为青香蕉和小国光,分别均低于20 U/g和30 U/g。
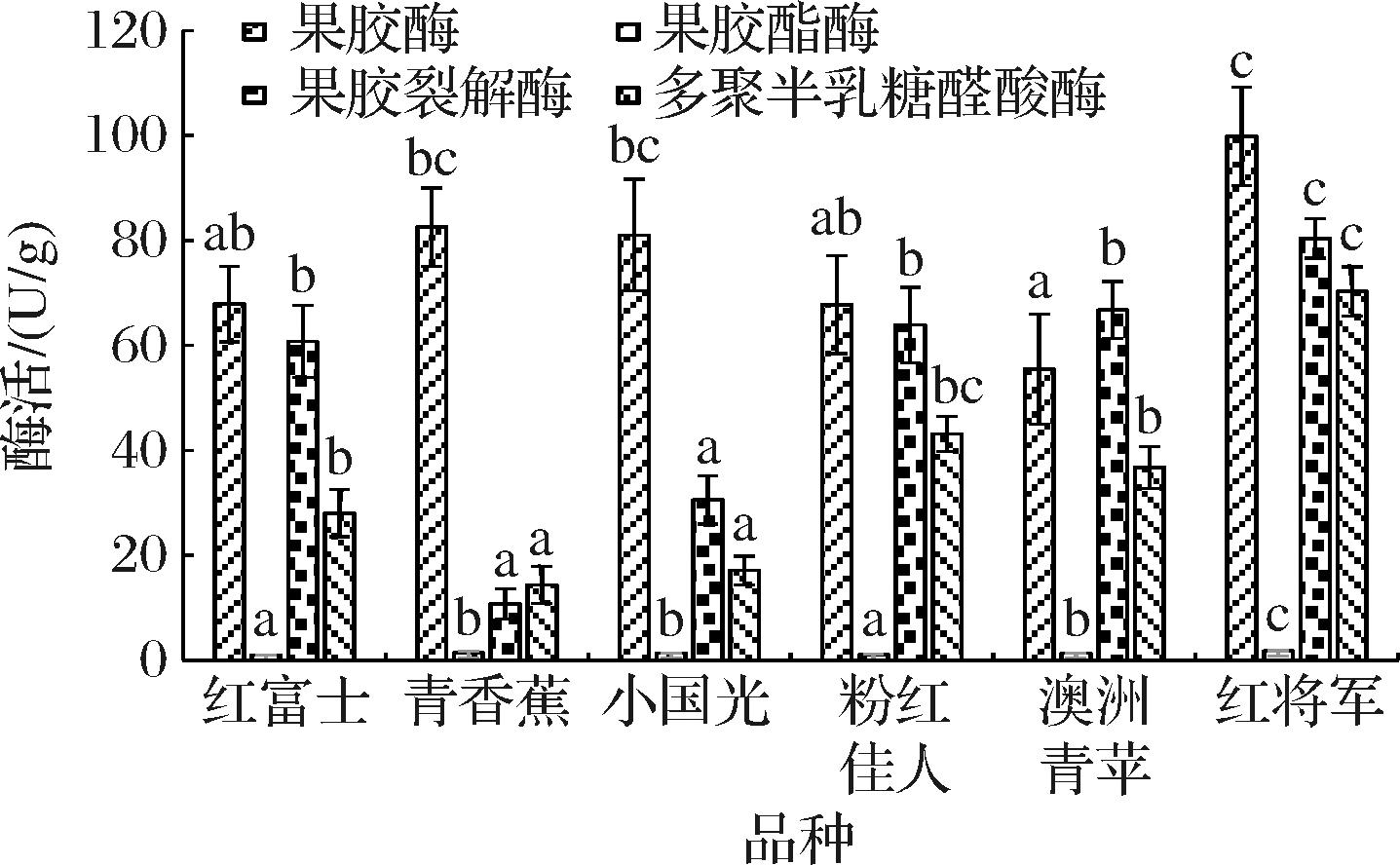
图2 不同品种苹果中果胶酶类活性
Fig.2 The pectinase activities in different apple varieties
不同品种苹果原料中天然存在的果胶酶类的活性具有显著的差异性,这与原料成熟度以及原料中糖分、氨基酸等成分的代谢差异有关,另外酶只有在其最适pH值下才能表现出最大活性,不同苹果原料的pH值不同,可能对原料中的酶活性也会产生影响[5]。
2.4 不同品种苹果酒中甲醇含量
甲醇含量是发酵酒生产过程中需要严格控制的重要指标。苹果酒中的甲醇含量受很多因素的影响,如果胶含量、果胶酶类活性、发酵条件和酿酒酵母等[19-20]。从图3可以看出,对于接种发酵处理,红富士苹果酒的甲醇含量最低,为0.17 g/L,而青香蕉苹果酒最高,为0.29 g/L,这可能与青香蕉中较高的果胶物质含量和PT活性,尤其是较高的PE活性有关,其余4个品种间没有显著差异。对于自然发酵处理,甲醇含量最高的是小国光苹果酒,为0.61 g/L,最低的为粉红佳人和澳洲青苹果,分别为0.42 g/L和0.41 g/L,与原料中果胶物质含量和PT活性没有线性关系,而可能与原料中果胶酯化度及苹果汁pH对酶活性影响有关。不同品种苹果自然发酵处理的甲醇含量均显著高于接种发酵处理,这可能与不同发酵方式下微生物源PT活性差异有关。
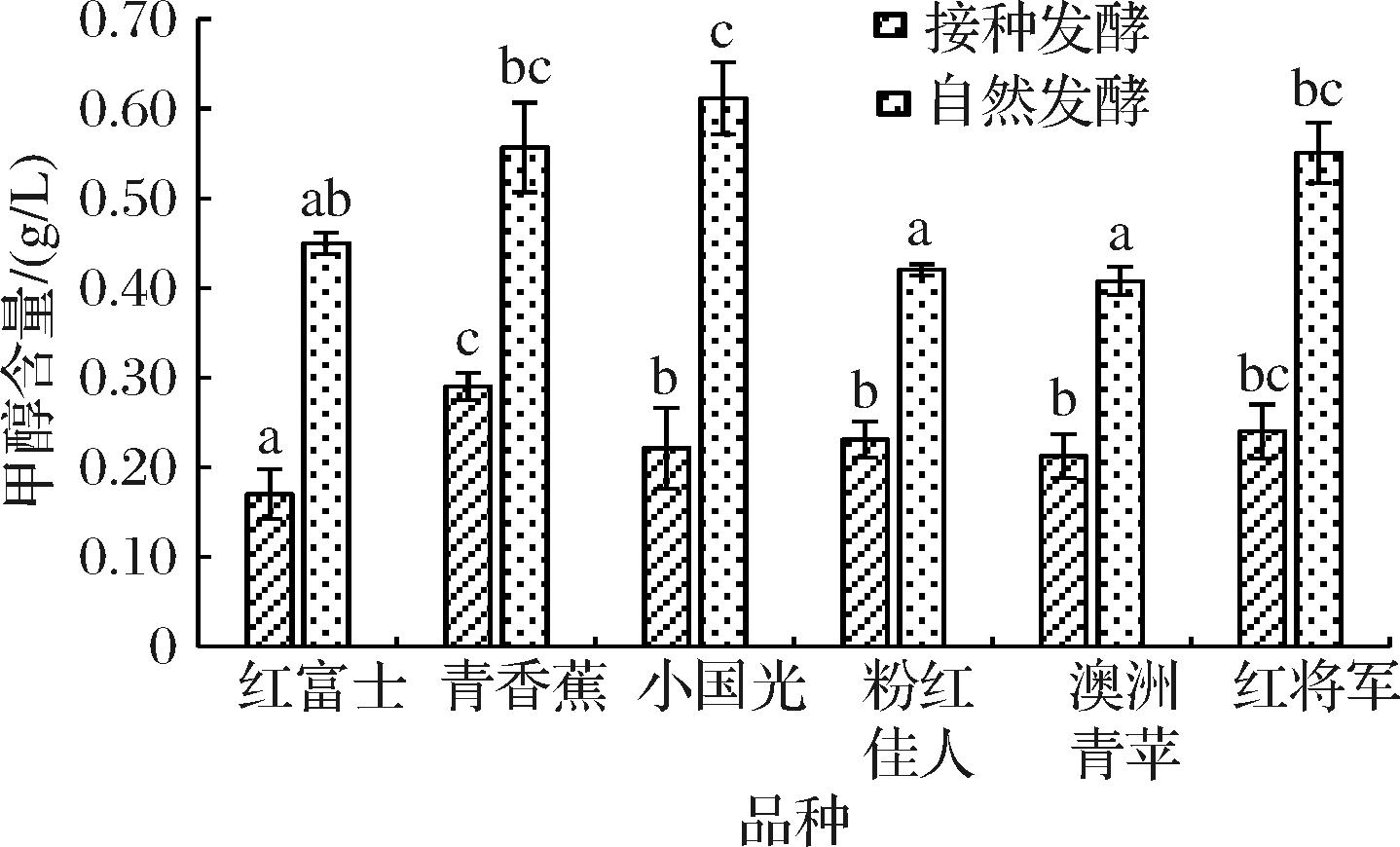
图3 不同品种苹果自然发酵及接种发酵苹果酒中的甲醇含量
Fig.3 The content of methanol in ciders produced by natural fermentation or inoculation with yeast of different apple varieties
2.5 不同发酵方式发酵过程中微生物源PT活性的变化
以红富士苹果为原料,采用EC1118酵母接种发酵和自然发酵处理,对两种方式发酵过程中微生物源PT类的活性变化进行了监测。由图4可知,发酵时间在1~5 d时,两种处理方式的4种PT类活性均有不同程度下降,但是接种发酵的PE下降速度大于自然发酵处理,而PT活性下降速度小于自然发酵。发酵前5天接种发酵和自然发酵PE的PT活性分别降低65.60%和64.22%,PE活性分别降低25.86%和14.89%,PL活性分别下降46.13%和42.06%,PG活性分别下降52.79%和55.35%。发酵时间>5 d后,除PL之外,其余3种酶的活性下降幅度减缓,开始逐渐平稳。到发酵结束时除PE外,两种发酵方式之间的其他果胶酶类活性没有显著差异。整个发酵过程中,自然发酵的微生物源PE活性始终显著高于接种发酵处理,可能是由于自然发酵过程中菌群结构丰富而复杂,与酿酒酵母相比,自发体系中含有丰富的产PT的微生物,而其中可能有的菌株产PE活性较高,这可能也是前面6个品种苹果酒中自然发酵处理的甲醇含量高于接种发酵处理(图3)的原因。
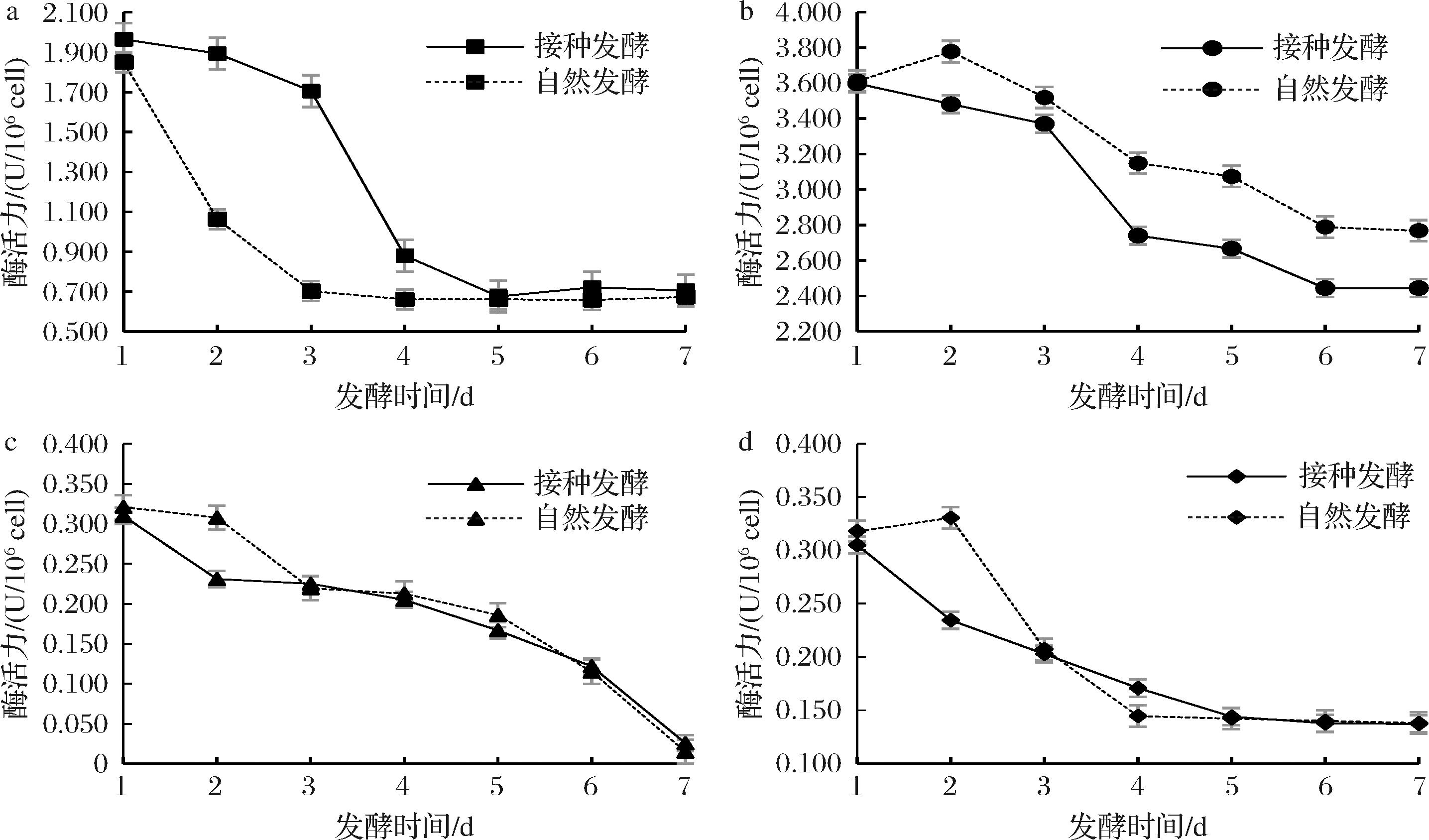
a-PT;b-PE;c-PL;d-PG
图4 苹果汁发酵过程中微生物源PT类活性变化
Fig.4 Changes of microbial-derived pectinase activities during apple juice fermentation
2.6 相关性分析
以3种果胶类物质、4种果胶酶类以及甲醇含量的定量数据为参数,对不同品种苹果及苹果酒样品进行主成分分析。提取前两个主成分作图,累计方差贡献率为78.13%,结果见图5和图6,表明了各指标相对于第一、第二主成分的分布情况及各样品与各指标的相关情况。从图5可以看出,PT、PE、PG活性、可溶性果胶含量与第一主成分正相关;果胶类物质含量、PE、PL、PG与第二主成分正相关。主成分中某一组分的载荷越高,说明该物质对该主成分所起作用越大。在第一主成分中正载荷较高的为PT和PE;在第二主成分中正载荷较高的为可溶性果胶、PL、PG。

M-IF-接种发酵甲醇;M-NF-自然发酵甲醇
图5 果胶及果胶酶活性及甲醇对两个主成分的散点图
Fig.5 The content of methanol in ciders produced by natural fermentation or inoculation with yeast of different apple varieties
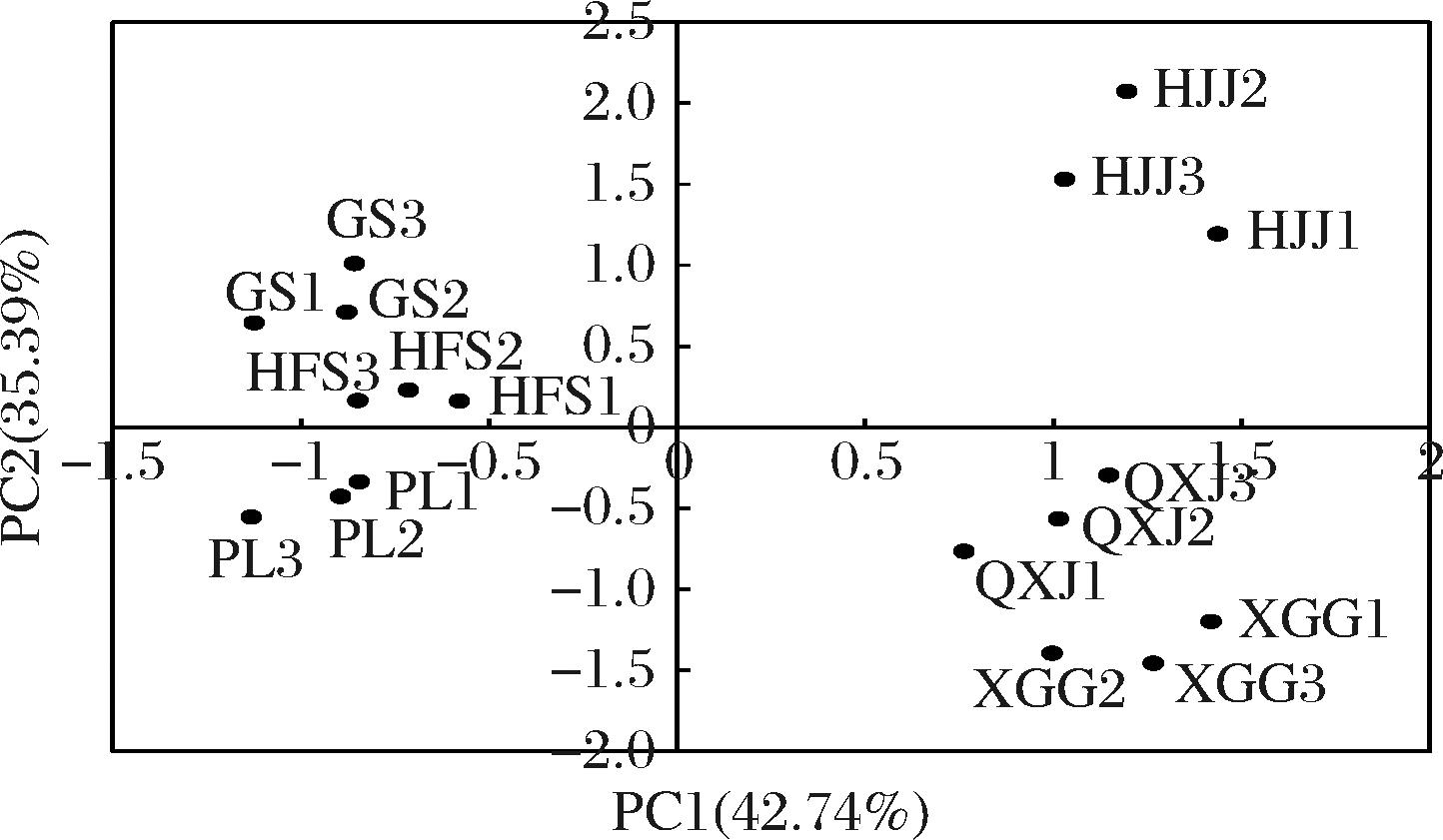
HFS-红富士;QXJ-青香蕉;HJJ-红将军;XGG-小国光;GS-澳洲青苹;PL-粉红佳人
图6 六个苹果品种对两个主成分的散点图
Fig.6 PC1 versus PC2 scatter plot of six apple varieties
由图6可以看出,不同品种苹果分布在不同的象限,表明它们之间果胶类物质、PT活性等存在显著差异。红将军苹果分布在第一象限,与其密切相关的物质主要是PE、PG和可溶性果胶;青香蕉和小国光苹果分布在第四象限,与其关系较为密切的是PT活性;红富士和澳洲青苹分布在第二象限,与其关系密切的主要是PL、TP、原果胶等。从图5和图6中还可以看出,位于第四象限的青香蕉苹果酒与接种发酵甲醇含量更为密切,小国光苹果酒则与自然发酵甲醇含量更为接近,这与前面的分析结果相一致。此外,果胶类物质以及PT类活性指标与甲醇含量之间的相关性分析发现,不同品种苹果接种发酵产生的甲醇与原料中TP含量以及PE、PL相关性较强,而自然发酵产生的甲醇与PT、PE、PL的相关系数较大,P值均小于0.05。
3 结论
本实验主要对不同品种苹果原料中果胶类物质含量以及PT类活性等对苹果酒中甲醇生成量的影响及其之间的关系进行了初步探索。结果发现,不同品种苹果原料中的果胶类物质和PT活性表现出较大差异,在供试的6个品种苹果中,青香蕉、红将军、澳洲青苹中的果胶含量最高,均超过6 μmol/g,红富士和小国光中的总果胶含量最低;而红将军、青香蕉和小国光中天然存在的PT活性相对较高,均超过80 U/g,而且红将军原料中的PE活性最高,为1.78 U/g。在接种发酵苹果酒中,红富士苹果酒中甲醇含量最低,为0.17 g/L,青香蕉接种发酵酒最高,为0.29 g/L;但是在自然发酵苹果酒中,则以小国光苹果酒中甲醇含量最高,为0.61 g/L,最低的为澳洲青苹和粉红佳人,分别为0.42 g/L和0.41 g/L。整个发酵过程中,自然发酵方式下微生物源PE活性始终高于接种发酵处理,相应的自然发酵苹果酒中甲醇含量显著高于接种发酵处理。在实际生产中,利用不同品种苹果生产果酒以及添加商业果胶酶的时候,需要综合考虑原料中不同果胶类物质以及天然存在的PT活性。
[1] 中国苹果产业协会. 2021年度中国苹果产业发展报告:第一章 世界苹果产业发展概况[R/OL].[2023-04-28].https://mp.weixin.qq.com/s/U5VBeaW7aLevHwU7LHHWBA The China Apple Industry Association.2021 China apple industry development report:Chapter I-Overview of the development of the world apple industry[R/OL].[2023-04-28].https://mp.weixin.qq.com/s/U5VBeaW7aLevHwU7LHHWBA
[2] 张志勇, 刘震, 周峻岗, 等.微生物与发酵工艺对苹果酒品质影响的研究概述[J].食品与发酵工业, 2022, 48(19):287-294.ZHANG Z Y, LIU Z, ZHOU J G, et al.Effect of microorganisms and fermentation process on the quality of apple cider:A review[J].Food and Fermentation Industries, 2022, 48(19):287-294.
[3] 杨辉, 陈永康, 张智锋, 等.果胶酶提高苹果出汁率工艺条件的优化[J].食品科技, 2006, 31(5):76-78.YANG H, CHEN Y K, ZHANG Z F, et al.Optimization of technological parameters of the apple juice treating with pectase[J].Food Science and Technology, 2006, 31(5):76-78.
[4] ALONSO J, RODR GUEZ M T, CANET W.Purification and characterization of four pectinesterases from sweet cherry (Prunus aviumL.)[J].Journal of Agricultural and Food Chemistry, 1996, 44(11):3416-3422.
GUEZ M T, CANET W.Purification and characterization of four pectinesterases from sweet cherry (Prunus aviumL.)[J].Journal of Agricultural and Food Chemistry, 1996, 44(11):3416-3422.
[5] 王胜. 双结构域双功能果胶甲酯酶/多聚半乳糖醛酸酶协同催化果胶的分子机制研究[D].北京:中国农业科学院, 2021.WANG S.The molecular mechanism underlying the synergistic action of a multimodular pectin methylesterase/polygalacturonase in the pectin degradation[D].Beijing:Chinese Academy of Agricultural Sciences, 2021.
[6] 沈雨思. 苹果浊汁云状颗粒果胶组分与特征风味化合物相互作用研究[D].锦州:渤海大学, 2021.SHEN Y S.Study on Interaction between pectin components of cloudy particles and characteristic flavor compounds in cloudy apple juice[D].Jinzhou:Bohai University, 2021.
[7] 文良娟, YONG D H, EDWARD E W.果胶酶对苹果酒发酵中甲醇的影响[J].酿酒科技, 2008(8):51-53.WNE L J, HANG Y D, WOODAMS E E.Effects of pectinase on methanol content during cider fermentation[J].Liquor-making Science &Technology, 2008 170(8):51-53.
[8] ANDRAOUS J I, CLAUS M J, LINDEMANN D J, et al.Effect of liquefaction enzymes on methanol concentration of distilled fruit spirits[J].American Journal of Enology and Viticulture, 2004, 55(2):199-201.
[9] 闵卓, 蒋媛, 贾伟豪, 等.不同原料苹果酒的酿造特性研究[J].中国酿造, 2022, 41(9):61-67.MIN Z, JIANG Y, JIA W H, et al.Brewing characteristics of ciders with different apple varieties[J].China Brewing, 2022, 41(9):61-67.[10] LAAKSONEN O, KULDJ RV R, PAALME T, et al.Impact of apple cultivar, ripening stage, fermentation type and yeast strain on phenolic composition of apple ciders[J].Food Chemistry, 2017, 233:29-37.
RV R, PAALME T, et al.Impact of apple cultivar, ripening stage, fermentation type and yeast strain on phenolic composition of apple ciders[J].Food Chemistry, 2017, 233:29-37.
[11] LANZERSTORFER P, WRUSS J, HUEMER S, et al.Bioanalytical characterization of apple juice from 88 grafted and nongrafted apple varieties grown in Upper Austria[J].Journal of Agricultural and Food Chemistry, 2014, 62(5):1047-1056.
[12] COUSIN F J, LE GUELLEC R, SCHLUSSELHUBER M, et al.Microorganisms in fermented apple beverages:Current knowledge and future directions[J].Microorganisms, 2017, 5(3):39.
[13] 赵娟娟, 吴荣荣, 李琳.苹果酒优良酵母菌剂的制备[J].中国酿造, 2017, 36(11):138-142.ZHAO J J, WU R R, LI L.Preparation of excellent Saccharomyces cerevisiae powder for cider wine[J].China Brewing, 2017, 36(11):138-142.
[14] 王玉莹, 戴洪义.响应面法优化苹果酒发酵工艺[J].中国酿造, 2012, 31(8):19-23.WANG Y Y, DAI H Y.Optimization of fermentation process for apple wine by response surface methodology[J].China Brewing, 2012, 31(8):19-23.
[15] PANDO BEDRI ANA R, PICINELLI LOBO A, SU
ANA R, PICINELLI LOBO A, SU REZ VALLES B.Influence of the method of obtaining freeze-enriched juices and year of harvest on the chemical and sensory characteristics of Asturian ice ciders[J].Food Chemistry, 2019, 274:376-383.
REZ VALLES B.Influence of the method of obtaining freeze-enriched juices and year of harvest on the chemical and sensory characteristics of Asturian ice ciders[J].Food Chemistry, 2019, 274:376-383.
[16] 宿智聪, 杜金华.皂土、硫酸处理对苹果汁发酵过程中果胶甲酯酶活性以及苹果蒸馏酒甲醇含量的影响[J].中国酿造, 2022, 41(8):149-155.SU Z C, DU J H.Effect of bentonite and sulfuric acid treatment on pectin methylesterase(PME) activity during apple juice fermentation and methanol content of apple distilled liquor[J].China Brewing, 2022, 41(8):149-155.
[17] ZHANG H, WOODAMS E E, HANG Y D.Factors affecting the methanol content and yield of plum brandy[J].Journal of Food Science, 2012, 77(4):T79-T82.
[18] CALVETE-TORRE I, MU OZ-ALMAGRO N, PACHECO M T, et al.Apple pomaces derived from mono-varietal Asturian ciders production are potential source of pectins with appealing functional properties[J].Carbohydrate Polymers, 2021, 264:117980.
OZ-ALMAGRO N, PACHECO M T, et al.Apple pomaces derived from mono-varietal Asturian ciders production are potential source of pectins with appealing functional properties[J].Carbohydrate Polymers, 2021, 264:117980.
[19] OHIMAIN E I.Methanol contamination in traditionally fermented alcoholic beverages:The microbial dimension[J].SpringerPlus, 2016, 5(1):1607.
[20] RICHTER C L, DUNN B, SHERLOCK G, et al.Comparative metabolic footprinting of a large number of commercial wine yeast strains in Chardonnay fermentations[J].FEMS Yeast Research, 2013, 13(4):394-410.