蔬菜腌渍是用食盐将新鲜蔬菜通过渍或腌的方式贮藏起来的方法,以满足蔬菜生产淡季时的食物需求[1]。经过长期的经验积累和实践,我国出现了许多具有地方特色的酱腌菜制作工艺和配方,这些工艺和配方的创新不仅改变了传统酱腌菜的生产方式,也制造出了风味多样的酱腌菜产品,如四川泡菜、涪陵榨菜、东北酸菜、辣白菜等。蔬菜腌渍是利用有益微生物、食盐、香辛料来保持或增加蔬菜营养、安全性、感官和保质期的生物工艺技术[2],然而,随着人们对食品安全意识的逐渐提高,酱腌菜中的生物胺安全性逐渐被关注。研究发现,大多数发酵食品中都含有生物胺,如果蔬制品、水产品制品、酒类、肉制品、乳制品等[3-4]。过量摄入生物胺会引起头疼、腹部痉挛、呕吐等不良生理反应,并且生物胺还是致癌性亚硝胺的前体物质,具有潜在致癌风险[5]。我国酱腌菜种类繁多,大多生产技术水平不高,以自然发酵为主,利用原料自身携带的微生物发酵,可能存在生物胺积累的风险。目前,国际上尚未制定食品中生物胺的统一限量标准,我国对酱腌菜生物胺的安全评估、调控和标准制定等方面仍缺少理论参考。
生物胺的形成与加工工艺、发酵体系环境(pH、温度、盐度)、微生物菌群等多因素密切相关。如李梅等[6]报道加工工艺和卫生状况是影响酱腌菜生物胺产生的最重要因素;TEIXEIRA等[7]报道生物胺的产生与细菌对酸性环境的保护作用有关,细菌体内的氨基酸脱羧酶在低pH值下表现出来的活力更强;XIE等[8-9]研究表明盐度和温度不仅能影响微生物的生长,也能改变氨基酸脱羧酶的活性。探明生物胺形成的原因,确定控制技术,对指导酱腌菜工艺改良、提高食品安全性具有重要意义。
基于此,本研究从宏观分析角度出发,通过收集全国各地的典型酱腌菜样品,详细记录各地酱腌菜的加工工艺和发酵细节,采用高效液相色谱法对全国酱腌菜的生物胺含量分布进行分析,并基于Pearson相关性对8种典型酱腌菜(四川传统泡菜、四川工业盐渍菜、资中冬尖、南充冬菜、宜宾芽菜、涪陵榨菜、东北酸菜、辣白菜)的基本理化因子(盐度、总酸、pH、水分、前体氨基酸)、发酵时间和微生物菌群与生物胺含量进行相关性分析,确定影响酱腌菜生物胺积累的关键因素。
1 材料与方法
1.1 材料
根据全国各地区的特色酱腌菜类型进行取样,从四川、贵州、福建、广东、山东、辽宁、陕西、新疆等14个省市收集了490份酱腌菜样品,其中包装成品136份,半成品354份,包括四川泡菜、东北酸菜、涪陵榨菜、西北浆水、贵州酸菜等各地典型酱腌菜。包装成品为超市、网店购买,半成品主要取自企业发酵池、农贸市场、餐馆。详细记录样品制作地区、工艺、发酵时间、包装类型等信息,然后装入无菌自封袋中低温(4 ℃)条件下迅速运回实验室分析。
表1 取样信息
Table 1 Sampling information

包装类型样品类型样品数量包装成品市售调味泡菜、鱼酸菜、萝卜干等136半成品四川传统泡菜93四川工业盐渍菜66资中冬尖5南充冬菜5宜宾芽菜17涪陵榨菜10东北酸菜20辣白菜14其他(广东、福建、陕西、天津等地酱腌菜)124
1.2 试剂
8种生物胺标准品(腐胺putrescine、尸胺cadaverine、组胺histamine、酪胺tyramine、苯乙胺phenethylamine、色胺tryptamine、亚精胺spermidine、精胺spermine),上海源叶生物科技有限公司;5种生物胺前体氨基酸混合标准品(精氨酸、鸟氨酸、赖氨酸、酪氨酸、组氨酸),美国Sigma公司;乙腈、甲醇等色谱纯溶剂,天津市致远化学试剂有限公司;其他试剂均为国产分析纯。
1.3 仪器与设备
雷磁PHS-3C pH计,上海仪电科学仪器股份有限公司;LC-2030型高效液相色谱仪、RID-20A型示差折光检测器,日本岛津公司;Carbomix H-NP10:8%型色谱柱(7.8 mm×300 mm,10 μm),苏州赛分科技有限公司;Ultimate Amino Acid 型色谱柱(4.6 mm×250 mm,5 μm),上海月旭科技股份有限公司。
1.4 实验方法
1.4.1 基本理化检测
盐度:参考GB 5009.44—2016《食品安全国家标准 食品中氯化物的测定》进行测定,结果以NaCl含量计;
总酸:参考GB 12456—2021《食品安全国家标准 食品中总酸的测定》进行测定,结果以乳酸含量计;
pH值:参考GB 5009.237—2016《食品安全国家标准 食品pH值的测定》进行测定,使用沸水将菜中的酸溶出,菜水质量比1∶1,室温冷却后使用pH计直接测定;
水分:参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》进行测定。
1.4.2 生物胺含量分析
参考GB 5009.208—2016《食品安全国家标准 食品中生物胺的测定》中的液相色谱法。样品切碎研磨,准确称取10 g置于50 mL离心管中,按照调味品中生物胺的检测法进行样品提取和衍生,标准溶液衍生的条件及方法与样品相同,色谱柱及色谱条件参考唐小曼等[10]的测定方法。
1.4.3 生物胺前体物质氨基酸含量分析
参考迟原龙等[11]的测定方法并稍作修改。样品切碎研磨,准确称取5 g样品,加水5 mL,50 ℃水浴30 min,离心,取上清液待用,取100 μL氨基酸标准品或待测样品置于5 mL试管中;加入200 μL衍生试剂,涡旋混合20 s后室温反应60 min,然后加入2 mL水和1 mL正己烷,涡旋混合1 min后除去上层溶液,再次加入1 mL正己烷,涡旋混合1 min后静置10 min,取下层溶液待用。色谱柱为:月旭Ultimate amino acid色谱柱,流动相A为0.1 mol/L醋酸钠(pH 6.5)∶乙腈=93∶7,流动相B为V(超纯水)∶V(乙腈)=20∶80,柱温40 ℃,流速1.0 mL/min,进样量10 μL,检测波长254 nm,柱温40 ℃,流速1 mL/min,进样量10 μL,氨基酸的梯度洗脱程序如表2所示。
表2 氨基酸的梯度洗脱程序
Table 2 Gradient elution procedure of amino acids
时间/min流动相A/%流动相B/%0.0110001193713.98812148515296634323070350100420100451000601000
1.4.4 细菌和真菌群落结构分析
样品的高通量测序采用上海美吉生物医药科技有限公司MiSeq测序平台。采用338F-806R为引物扩增细菌16S DNA V3~V4区序列,采用ITS 1F-ITS 2R为引物扩增真菌ITS区序列,将PCR扩增较好的产物进行电泳检测,对2%琼脂糖(质量分数)凝胶电泳进行切胶回收。将获得的原始序列使用Trimmomatic软件质控获得有效序列,利用UPARSE软件按97%的相似度对序列进行OTU聚类分析,利用RDPclassifier对每条序列进行物种分类注释,细菌在Silva数据库中比对,ITS 真菌在Unite数据库中比对,最后采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并统计每个样品的群落组成。
1.5 数据统计分析
每个样品重复测定3次。实验结果采用SPSS 25进行Pearson相关性分析和单因素方差分析(one way ANOVA),P<0.05为差异显著,采用Origin 2021进行作图。
2 结果与分析
2.1 生物胺含量
对490个酱腌菜的8种主要生物胺含量进行了检测。总体上,样品的生物胺总量范围在0~2 093.49 mg/kg,平均值为(303.47±349.84) mg/kg。其生物胺含量分布见图1-a,有80.4%左右的生物胺总量<500 mg/kg,13.5%的在500~1 000 mg/kg,仅有6.1%的样品含量≥1 000 mg/kg。美国食品药物管理局建议食品中生物胺总量<1 000 mg/L[12],可见绝大部分酱腌菜的生物胺是相对安全的。
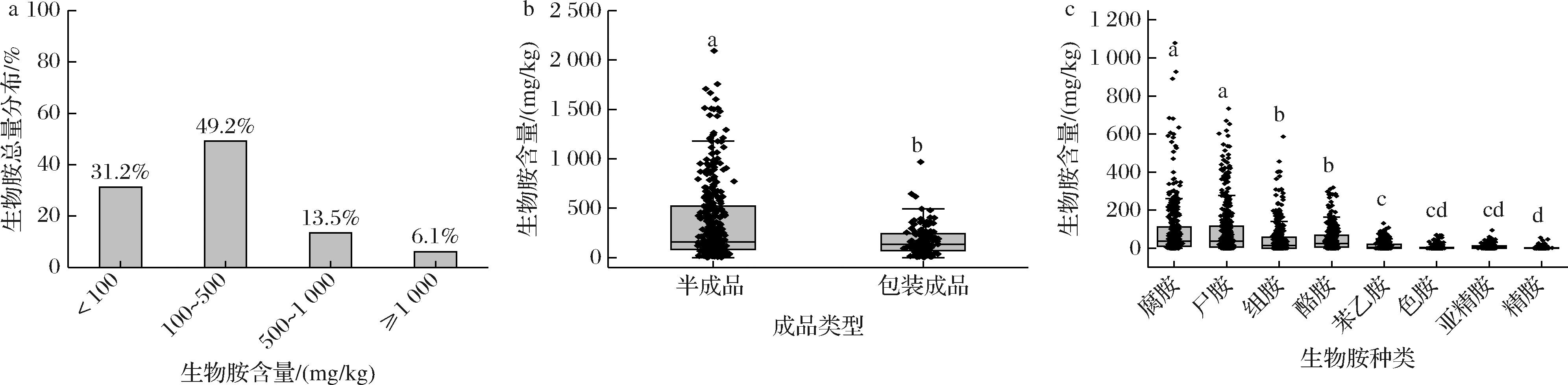
a-生物胺总量分布;b-散装与包装样品生物胺含量;c-主要生物胺种类
图1 全国传统酱腌菜的生物胺含量分布
Fig.1 Distribution of biogenic amine content in traditional Chinese pickled vegetables
注:图中小写字母不同表示组间差异显著(P<0.05)(下同)。
半成品和包装成品的生物胺含量分布见图1-b,半成品的生物胺含量显著高于包装成品(P<0.05),含量范围分别为0~2 093.49 mg/kg和0~968.23 mg/kg,平均含量分别为(345.28±390.28) mg/kg和(218.81±142.53) mg/kg。这可能是因为产品在包装之前通常会经过清洗、脱盐等工序,会脱掉部分生物胺,因此降低了生物胺含量,而半成品多为发酵过程样品,且更多暴露在空气中,更易受杂菌污染,因此生物胺含量更高。
样品生物胺种类分布情况见图1-c,腐胺、尸胺、组胺、酪胺是酱腌菜中主要的生物胺。腐胺和尸胺含量最高,含量范围分别为0~1 078.47 mg/kg和0~733.91 mg/kg,平均含量分别为(90.13±135.51)mg/kg和(90.31±132.03) mg/kg;其次是组胺和酪胺,含量分别为0~586.60 mg/kg和0~318.96 mg/kg,平均含量为(45.31±75.43) mg/kg和(48.25±21.42) mg/kg。在生物胺中,组胺的毒性最大,其水平偏高会导致头痛、面部潮红、低血压、心悸、呕吐、腹泻等,甚至会引起神经性毒性;酪胺毒性次之,过量会引起头痛和高血压等反应;尸胺和腐胺的自身毒性较小,但是能抑制组胺和酪胺相关代谢酶的活性,而增加组胺和酪胺的不良影响;此外,腐胺、尸胺、精胺和亚精胺可以与食物中的亚硝酸盐反应产生致癌物质亚硝基胺[13-15]。欧盟对食品中组胺的限量为100 mg/kg,对酪胺的限量范围为100~800 mg/kg[12]。本研究中有13.8%样品的组胺含量超过100 mg/kg,17.0%样品的酪胺含量超过100 mg/kg。相关研究报道人体摄入40~100 mg的组胺后可能会出现不良症状[16],目前针对酱腌菜中生物胺的含量还没有统一的限量标准,根据本研究结果,若酱腌菜中的组胺含量在100~500 mg/kg,那么人体每天摄入酱腌菜的最大安全量应控制在80~400 g。因此,通常情况下,人们正常摄入大部分酱腌菜是相对安全的。然而,少数酱腌菜可能存在一定的安全隐患。
2.2 生物胺形成原因分析
2.2.1 理化特征
通过理化指标可以反映酱腌菜的发酵程度、成熟度、滋味等特征,8种典型酱腌菜(半成品)的基本理化特征见表3。南充冬菜的总酸含量最高,为(1.36±0.20) mg/kg,且发酵时间长(1~4年),发酵程度较深;东北酸菜、辣白菜的盐度相对较低(<5.0 g/100 g),总酸含量较高(>1.0 g/100 g),但东北酸菜的pH值更低(3.70±0.13),水分活度更高,为(93.74±1.26)%,发酵时间更长;四川传统泡菜的食盐含量较高,为(8.91±2.7) g/100 g,发酵时间范围较大(0~2年),其总酸含量为(0.91±0.58) g/100 g、pH值为3.69±0.29;四川工业盐渍菜和涪陵榨菜的制作工艺相近,盐度均在11%左右,但本研究收集的四川工业盐渍菜的发酵时间更长(4~48月),总酸含量更高,为(0.67±0.24) g/100 g,pH值更低(4.18±0.36);宜宾芽菜和和资中冬尖的盐度均较高(>15 g/100 g),总酸含量低(<0.50 g/100 g),发酵程度较弱。
表3 典型酱腌菜的基本理化特征
Table 3 Basic physical and chemical characteristics of typical pickles

编号工艺盐度/(g/100 g)总酸/(g/100 g)pH值水分含量/%前体氨基酸/(mg/kg)发酵时间GY1南充冬菜10.37±1.15bc1.36±0.2a4.20±0.08b72.35±1.43d789.36±191.97a1~4年GY2四川工业盐渍菜11.87±3.43b0.67±0.24b4.18±0.36b81.86±4.33c198.37±95.74c4~48月GY3四川传统泡菜8.91±2.7c0.91±0.58ab3.69±0.29c83.85±4.27bc562.84±512.84abc0~2年GY4东北酸菜2.10±0.41d1.23±0.23a3.70±0.13c93.74±1.26a460.90±177.97abc0~2月GY5涪陵榨菜11.30±1.27bc0.51±0.19b4.26±0.39b81.67±1.05c277.22±90.08bc4~12月GY6辣白菜3.04±2.3d1.24±0.64a4.09±0.51b86.77±3.3b698.81±187.56ab3~10 dGY7资中冬尖17.70±2.36a0.43±0.05b5.09±0.16a68.31±3.02de767.04±255.84a1~10年GY8宜宾芽菜16.49±2.67a0.48±0.31b4.80±0.33a66.21±5.22e569.86±409.51abc4~36月
注:前体氨基酸含量为精氨酸、鸟氨酸、赖氨酸、酪氨酸、组氨酸的总含量。
2.2.2 生物胺含量分布
对8种酱腌菜生物胺含量进行了分析,结果见表4。南充冬菜的生物胺含量最高,平均生物胺含量为(1 031.64±509.26) mg/kg;四川工业盐渍菜、东北酸菜、涪陵榨菜次之,平均含量分别为(722.1±406.10)、(572.88±158.13)和(360.72±318.18) mg/kg;四川传统泡菜、资中冬尖、宜宾芽菜、辣白菜的平均生物胺含量均小于500 mg/kg。这表明制作工艺对生物胺的影响较大。本研究结果与李梅等[6]研究发现的“发酵程度越深,产生物胺含量越高”的结果一致。根据理化特征,南充冬菜的发酵程度最深,其生物胺含量也最高;宜宾芽菜和资中冬尖的发酵程度弱,生物胺含量相应较低;东北酸菜与辣白菜的总酸含量相近,但东北酸菜的pH更低,发酵时间更长,生物胺含量更高;四川传统泡菜的制作工艺与东北酸菜的工艺相近,但由于发酵程度不如东北酸菜,生物胺含量相对较低。
表4 典型酱腌菜的生物胺含量分布
Table 4 Distribution of biogenic amine content in typical pickled vegetables
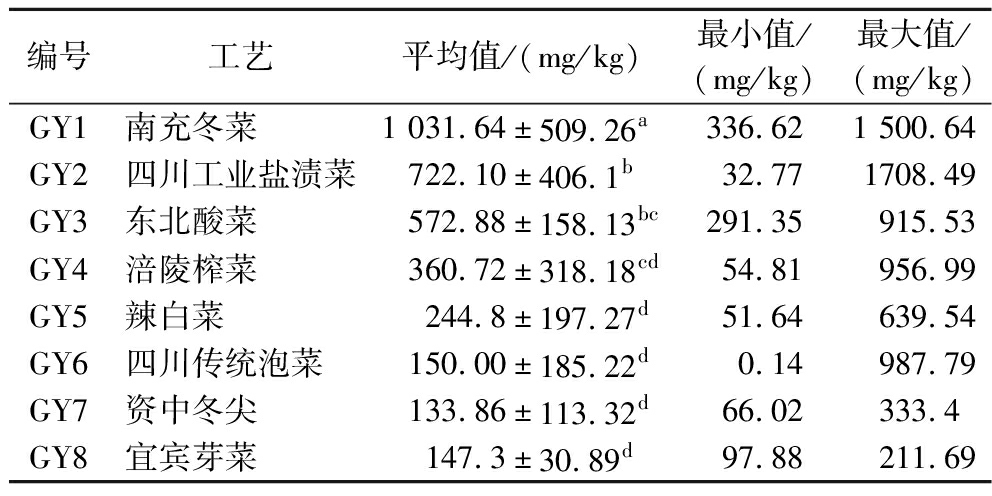
编号工艺平均值/(mg/kg)最小值/(mg/kg)最大值/(mg/kg)GY1南充冬菜1 031.64±509.26a336.621 500.64GY2四川工业盐渍菜722.10±406.1b32.771708.49GY3东北酸菜572.88±158.13bc291.35915.53GY4涪陵榨菜360.72±318.18cd54.81956.99GY5辣白菜244.8±197.27d51.64639.54GY6四川传统泡菜150.00±185.22d0.14987.79GY7资中冬尖133.86±113.32d66.02333.4GY8宜宾芽菜147.3±30.89d97.88211.69
注:小写字母不同表示组间差异显著(P<0.05)。
2.2.3 理化特征及与生物胺含量的相关性分析
生物胺积累与发酵环境(温度、盐度、总酸、pH、水分活度、前体氨基酸含量等)密切相关。采用Pearson相关性对4种主要生物胺及总胺与各项理化指标的相关性进行了分析,结果如图2所示。结果表明,生物胺含量与总酸呈显著正相关(P<0.05),与pH呈显著负相关(P<0.05),表明酸度越高,生物胺含量越高。这可能是由于酸性环境下氨基酸脱羧酶活性更强[17]。
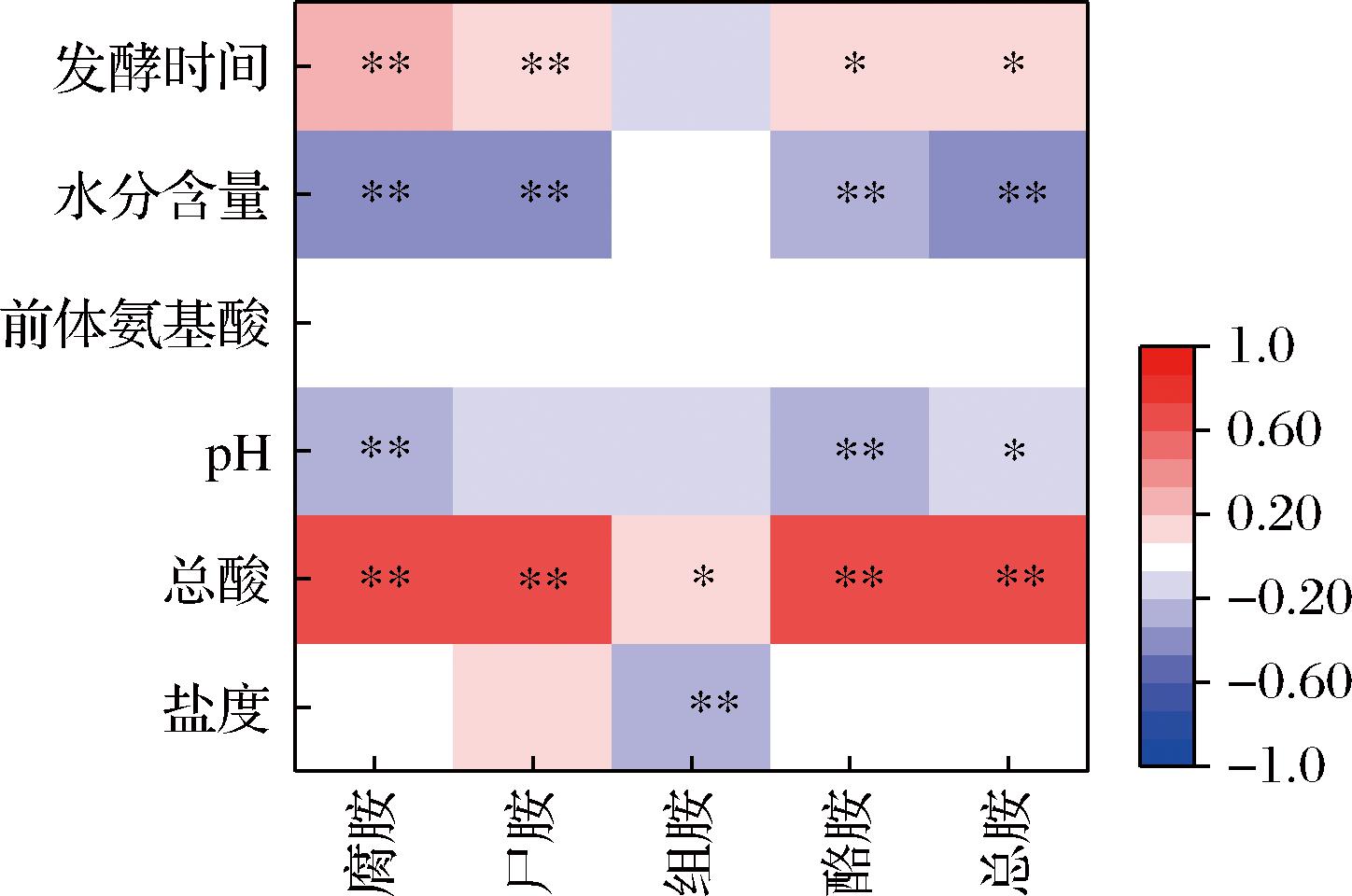
图2 生物胺与理化的相关性分析
Fig.2 Correlation analysis between biogenic amines and physicochemical properties
水分含量与生物胺呈显著负相关(P<0.05),表明低水分含量的酱腌菜的生物胺含量可能更高,这可能是由于水分含量降低,生物胺在酱腌菜中富集,因此含量更高。
盐度与组胺呈显著负相关(P<0.05),而与总胺的相关性不大,推测低盐泡菜可能更容易产生组胺。有研究报道组胺形成与肠杆菌、葡萄球菌等不耐盐微生物相关,可能是在低盐条件下更有利于这些微生物的生长[18]。
发酵时间与生物胺呈显著正相关(P<0.05),发酵时间越长,生物胺含量更高。许多研究表明发酵食品中的生物胺含量随着发酵时间延长呈现逐渐积累并最终趋于稳定的趋势,很少有降解情况[19],说明发酵食品中的生物胺一旦形成,现有的技术很难将其去除。
2.2.4 细菌群落结构及与生物胺的相关性分析
根据国内外研究报道,生物胺主要由细菌的氨基酸脱酸酶作用产生[20]。各典型工艺的细菌群落结构如图3-a所示,各类型酱腌菜均以乳酸菌和芽孢杆菌占主导,乳酸菌主要包括乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc),芽孢杆菌包括芽孢杆菌属(Bacillus)、慢生芽孢杆菌属(Lentibacillus)、碱性芽孢杆菌(Alkalibacillus)、盐枝芽孢杆菌属(Virgibacillus)。其中乳杆菌属是各典型工艺的主导优势菌属。
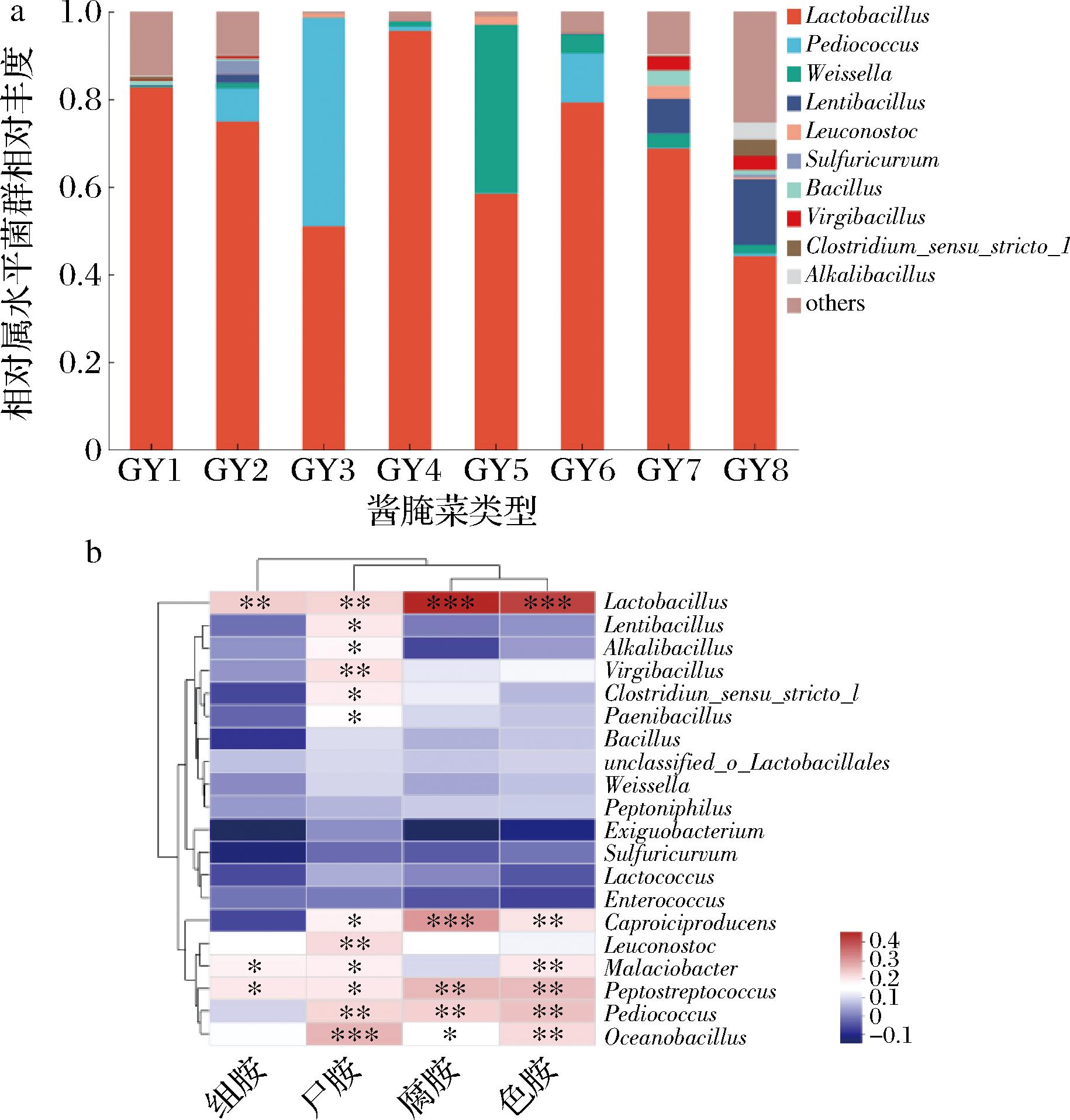
a-细菌菌群结构;b-相关性热图
图3 生物胺与细菌群落结构的相关性分析
Fig.3 Correlation analysis between biogenic amines and bacterial community composition
注:GY1~GY8分别代表南充冬菜、四川工业盐渍菜、东北酸菜、涪陵榨菜、辣白菜、四川传统泡菜、资中冬尖、宜宾芽菜(下同)。
对酱腌菜中的4种主要生物胺:腐胺、酪胺、尸胺、组胺与细菌菌群结构的Pearson相关性进行了分析,结果见图3-b。研究表明,4种生物胺与乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)和海洋芽孢杆菌属(Occanobacillus)呈正相关,其中与乳杆菌属的呈显著正相关(P<0.05);与其他各类芽孢杆菌(Lentibacillus、Alkalibacillus、Virgibacillus等)及魏斯氏菌属(Weissella)、乳球菌属(Lactococcus)、肠球菌属(Enterococcus)呈负相关。不同菌属之间产生物胺能力存在差异,其中乳杆菌属是被报道最多的生物胺产生菌。PE AS等[21]研究表明以植物乳杆菌作为发酵剂的酱腌菜生物胺含量要比自然发酵的生物胺含量高;COTON等[22]使用多重PCR技术对810株乳酸菌进行氨基酸脱羧酶检测,发现18%的测试菌株中含有氨基酸脱羧酶基因;LADERO等[23]通过定量PCR对乳制品中的产胺菌株定量时,发现短乳杆菌、弯曲乳杆菌和乳酸乳杆菌与腐胺的产生积累相关。乳酸菌发酵是有益的,它产生的有机酸可以抑制不良微生物的生长,延长保质期,但也存在产生有毒代谢物生物胺的风险,这可能是因为在相对低pH和营养匮乏的条件下,乳酸菌为了维持自身生长,受胁迫机制调控而代谢产生碱性的生物胺[24]。另外有研究显示,同一种属的不同菌株的产胺能力有很大差异,例如LIU等[25]通过下一代测序技术筛选出不形成生物胺的植物乳杆菌(Lactobacillus plantarum) JN01,在接种发酵醪进行黄酒发酵时,生物胺浓度显著降低24%。乳杆菌属是酱腌菜的主要优势微生物,因此,可以通过接种产胺性能弱的菌剂以及调控微生物组成等措施来降低生物胺积累的风险。
AS等[21]研究表明以植物乳杆菌作为发酵剂的酱腌菜生物胺含量要比自然发酵的生物胺含量高;COTON等[22]使用多重PCR技术对810株乳酸菌进行氨基酸脱羧酶检测,发现18%的测试菌株中含有氨基酸脱羧酶基因;LADERO等[23]通过定量PCR对乳制品中的产胺菌株定量时,发现短乳杆菌、弯曲乳杆菌和乳酸乳杆菌与腐胺的产生积累相关。乳酸菌发酵是有益的,它产生的有机酸可以抑制不良微生物的生长,延长保质期,但也存在产生有毒代谢物生物胺的风险,这可能是因为在相对低pH和营养匮乏的条件下,乳酸菌为了维持自身生长,受胁迫机制调控而代谢产生碱性的生物胺[24]。另外有研究显示,同一种属的不同菌株的产胺能力有很大差异,例如LIU等[25]通过下一代测序技术筛选出不形成生物胺的植物乳杆菌(Lactobacillus plantarum) JN01,在接种发酵醪进行黄酒发酵时,生物胺浓度显著降低24%。乳杆菌属是酱腌菜的主要优势微生物,因此,可以通过接种产胺性能弱的菌剂以及调控微生物组成等措施来降低生物胺积累的风险。
2.2.5 真菌群落结构及与生物胺的相关性分析
各典型工艺的真菌群落结构如图4-a所示。结果显示,毕赤酵母属(Pichia)、德巴利酵母属(Debaryomyces)、哈萨克斯坦酵母属(Kazachstania)、接合酵母属(Zygosaccharomyces)是酱腌菜的主要优势酵母;四川工业盐渍菜和涪陵榨菜以Debaryomyces占主导,四川传统泡菜、资中冬尖、宜宾芽菜以Pichia占主导。
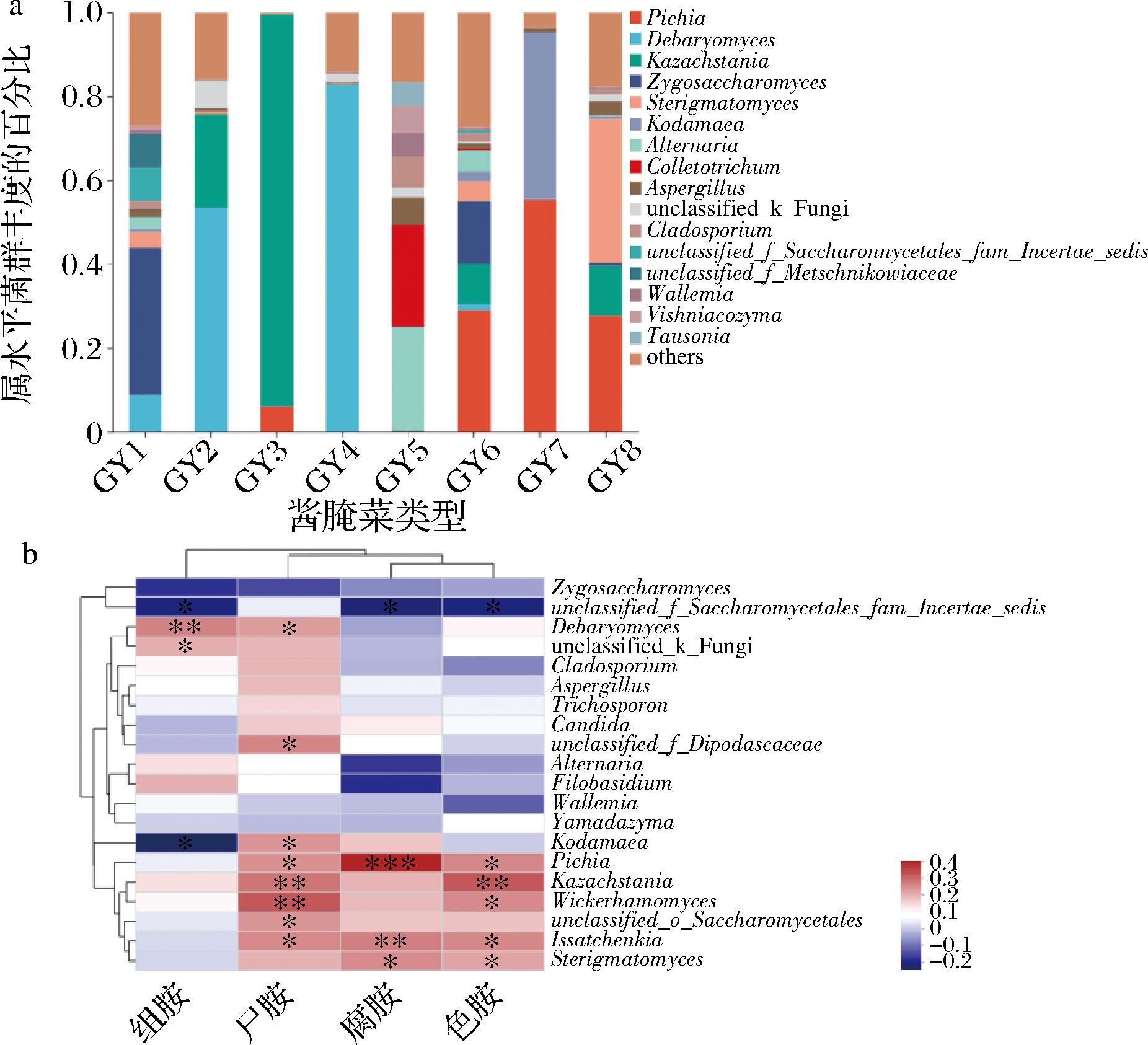
a-真菌菌群结构;b-相关性热图
图4 生物胺与真菌群落结构的相关性分析
Fig.4 Correlation analysis between biogenic amines and fungal community composition
4种主要生物胺与真菌菌群结构的相关性结果如图4-b所示。Debaryomyces与组胺呈显著正相关(P<0.05),Pichia、Kazachstania、威克汉姆酵母属(Wickerhamomyces)、东方伊萨酵母属(Issatchenkia)、梗孢酵母属(Sterigmatomyces)与尸胺、腐胺、酪胺呈正相关,Zygosaccharomyces与4种生物胺呈负相关。目前有关酵母菌生产生物胺的结论尚存在一定争议,有关酵母菌产生物胺的报道较少。DAVIS等[26]报道了Saccharomyces cerevisiae可以使用鸟氨酸进行腐胺的生物合成,而LANDETE等[27]对155株乳酸菌和36株酵母菌在葡萄酒中的生物胺产量进行分析,发现所有酵母菌均不产生物胺,而接种乳酸菌有组胺、酪胺、苯乙胺和腐胺的产生。此外,一些酵母菌被发现有降解生物胺的能力,如郭琳洁等[28]研究发现应用毕赤酵母 DPUY-J8发酵大酱可以减少生物胺的形成;朱翠翠等[29]在天然发酵的鱼露中分离出一株对组胺具有高效降解能力的毕赤酵母菌株,在组胺质量浓度为50 mg/L时降解率高达82.61%。而本研究结果显示部分酵母菌与生物胺含量呈正相关,这可能是因为它们具有较强耐酸耐盐特性,可以长期存在于发酵蔬菜体系中,因此与生物胺积累的相关性较大。
3 结论
对全国各地490份酱腌菜样品的生物胺含量进行分析,发现仅有6.1%的样品含量≥1 000 mg/kg,说明所采集的酱腌菜大部分是安全的。腐胺、酪胺、尸胺、组胺是酱腌菜中的主要生物胺。对8种典型酱腌菜的生物胺形成原因进行分析,发现总酸、pH值、盐度、发酵时间是影响生物胺积累的重要内在因素,酸度较高的酱腌菜更容易积累生物胺,低盐条件下更容易积累组胺。乳杆菌属与生物胺的积累呈显著正相关(P<0.05)。因此,建议通过改良加工工艺、提高卫生条件、接种产胺性能弱的菌剂以及调控微生物组成等措施来降低生物胺积累的风险。同时,针对酱腌菜的生物胺防控,建议重点关注组胺和酪胺的含量。
[1] 陈功. 试论中国泡菜历史与发展[J].食品与发酵科技, 2010, 46(3):1-5.CHEN G.The history and development of Chinese pickles[J].Food and Fermentation Technology, 2010, 46(3):1-5.
[2] RAY R C, EL SHEIKHA A F, KUMAR S.Oriental fermented functional (probiotic) foods[J].Microorganisms and Fermentation of Traditional Foods, 2014:283-311.
[3] WANG J, FANG J, WEI L N, et al.Decrease of microbial community diversity, biogenic amines formation, and lipid oxidation by phloretin in Atlantic salmon fillets[J].LWT, 2019, 101:419-426.
[4] LI L, LIU D M, LI X F, et al.The dynamic changes of microbial diversity and biogenic amines in different parts of bighead carp (Aristichthys nobilis) head during storage at-2 ℃[J].Journal of Food Composition and Analysis, 2023, 118:105228.
[5] ZHANG Y J, ZHANG Y, ZHOU Y, et al.A review of pretreatment and analytical methods of biogenic amines in food and biological samples since 2010[J].Journal of Chromatography.A, 2019, 1605:360361.
[6] 李梅, 汪冬冬, 唐垚, 等.中国市售酱腌菜中生物胺含量分析[J].食品与发酵工业, 2021, 47(14):271-278.LI M, WANG D D, TANG Y, et al.Analysis of the biogenic amines content in Chinese pickles[J].Food and Fermentation Industries, 2021, 47(14):271-278.
[7] TEIXEIRA J S, SEERAS A, SANCHEZ-MALDONADO A F, et al.Glutamine, glutamate, and arginine-based acid resistance in Lactobacillus reuteri[J].Food Microbiology, 2014, 42:172-180.
[8] XIE S Y, LI Z, SUN B, et al.Impact of salt concentration on bacterial diversity and changes in biogenic amines during fermentation of farmhouse soybean paste in Northeast China[J].Current Research in Food Science, 2022, 5:1225-1234.
[9] TIAN X Y, GAO P, XU Y S, et al.Reduction of biogenic amines accumulation with improved flavor of low-salt fermented bream (Parabramis pekinensis) by two-stage fermentation with different temperature[J].Food Bioscience, 2021, 44:101438.[10] 唐小曼, 唐垚, 张其圣, 等.传统发酵蔬菜中生物胺的研究进展[J].食品工业科技, 2019, 40(15):345-348;355.TANG X M, TANG Y, ZHANG Q S, et al.Research progress of biogenic amines in traditional fermented vegetable[J].Science and Technology of Food Industry, 2019, 40(15):345-348;355.
[11] 迟原龙, 张琦弦, 廖学品, 等.柱前衍生高效液相色谱法分析制革皮屑水解物的氨基酸组成[J].四川大学学报(工程科学版), 2012, 44(5):179-183.CHI Y L, ZHANG Q X, LIAO X P, et al.Analysis of amino acid composition in tannery skin bit hydrolysates by HPLC with pre-column derivatization[J].Journal of Sichuan University (Engineering Science Edition), 2012, 44(5):179-183.
[12] HAZARDS E.Scientific opinion on risk based control of biogenic amine formation in fermented foods[J].EFSA Journal, 2011, 9(10):2393.
[13] TAYLOR S L.Histamine food poisoning:Toxicology and clinical aspects[J].Critical Reviews in Toxicology, 1986, 17(2):91-128.
[14] FONG F L Y, EL-NEZAMI H, SZE E T P.Biogenic amines-Precursors of carcinogens in traditional Chinese fermented food[J].NFS Journal, 2021, 23:52-57.
[15] DE MEY E, DE KLERCK K, DE MAERE H, et al.The occurrence of N-nitrosamines in commercial dry fermented sausages in relation to residual nitrite and biogenic amines[J].Meat Science, 2014, 96(2):821-828.
[16] SHAH P, SWIATLO E.A multifaceted role for polyamines in bacterial pathogens[J].Molecular Microbiology, 2008, 68(1):4-16.
[17] 张立飞, 孙明浩, 华成黎, 等.发酵食品中生物胺的形成、检测及其防控策略的研究进展[J].食品与发酵工业, 2023, 49(3):329-339.ZHANG L F, SUN M H, HUA C L, et al.Research progress on the production, detection and prevention of biogenic amine in fermented food[J].Food and Fermentation Industries, 2023, 49(3):329-339.
[18] 钱茜茜. 腌干鱼加工过程微生物群落多样性分析及产胺菌的控制技术研究[D].上海:上海海洋大学, 2016.QIAN X X.The analysis of microbial community diversity in dried-salted fish during process and the control technology of biogenic amine-forming bacteria[D].Shanghai:Shanghai Ocean University, 2016.
[19] 许禄. 黄酒酿造过程中生物胺变化规律的研究[D].上海:上海海洋大学, 2016.XU L.The research on the variation of biogenic amines in the brewing process of yellow rice wine[D].Shanghai:Shanghai Ocean University, 2016.
[20] K
 ŽEK M, MAT
ŽEK M, MAT JKOV
JKOV K, V
K, V CHA F, et al.Biogenic amines formation in high-pressure processed Pike flesh (Esox lucius) during storage[J].Food Chemistry, 2014, 151:466-471.
CHA F, et al.Biogenic amines formation in high-pressure processed Pike flesh (Esox lucius) during storage[J].Food Chemistry, 2014, 151:466-471.
[21] PE AS E, FRIAS J, SIDRO B, et al.Impact of fermentation conditions and refrigerated storage on microbial quality and biogenic amine content of sauerkraut[J].Food Chemistry, 2010, 123(1):143-150.
AS E, FRIAS J, SIDRO B, et al.Impact of fermentation conditions and refrigerated storage on microbial quality and biogenic amine content of sauerkraut[J].Food Chemistry, 2010, 123(1):143-150.
[22] COTON M, ROMANO A, SPANO G, et al.Occurrence of biogenic amine-forming lactic acid bacteria in wine and cider[J].Food Microbiology, 2010, 27(8):1078-1085.
[23] LADERO V, CA EDO E, PÉREZ M, et al.Multiplex qPCR for the detection and quantification of putrescine-producing lactic acid bacteria in dairy products[J].Food Control, 2012, 27(2):307-313.
EDO E, PÉREZ M, et al.Multiplex qPCR for the detection and quantification of putrescine-producing lactic acid bacteria in dairy products[J].Food Control, 2012, 27(2):307-313.
[24] VISCIANO P, SCHIRONE M.Update on biogenic amines in fermented and non-fermented beverages[J].Foods, 2022, 11(3):353.
[25] LIU S P, SUN H L, LIU C X, et al.Reducing biogenic amine in seriflux and Huangjiu by recycling of seriflux inoculated with Lactobacillus plantarum JN01[J].Food Research International, 2021, 150(Pt A):110793.
[26] DAVIS R H.Compartmental and regulatory mechanisms in the arginine pathways of Neurospora crassa and Saccharomyces cerevisiae[J].Microbiological Reviews, 1986, 50(3):280-313.
[27] LANDETE J M, FERRER S, PARDO I.Biogenic amine production by lactic acid bacteria, acetic bacteria and yeast isolated from wine[J].Food Control, 2007, 18(12):1569-1574.
[28] 郭琳洁, 顾金红, 李思怡, 等.黑曲霉DPUM-J2和毕赤酵母DPUY-J8在大酱发酵中的应用[J].食品研究与开发, 2022, 43(18):182-190.GUO L J, GU J H, LI S Y, et al.Application of Aspergillus niger DPUM-J2 and Pichia kudriavzevii DPUY-J8 in soybean paste fermentation[J].Food Research and Development, 2022, 43(18):182-190.
[29] 朱翠翠, 王海英, 赵玉莹, 等.鱼露中组胺降解菌的分离筛选及耐受性[J].食品与生物技术学报, 2022, 41(3):8-15.ZHU C C, WANG H Y, ZHAO Y Y, et al.Isolation, screening and tolerance of histamine degrading strains from fish sauce[J].Journal of Food Science and Biotechnology, 2022, 41(3):8-15.