α-淀粉酶是一种具有三维结构的球状蛋白[1],广泛分布于人体内部,是人体唾液腺和胰腺的主要分泌产物[2],因其在口腔加工和感官知觉中发挥着关键作用而受到广泛研究。之前研究表明,α-淀粉酶可通过2种方式影响香气化合物的释放与感知,一种是和食物基质相互作用从而间接影响香气化合物释放,如RAMSEY等[3]发现在啤酒中加入α-淀粉酶后,会降低己酸乙酯和芳樟醇的释放量,PAG S-HÉLARY等[4]也发现α-淀粉酶具有减少酮和酯释放的能力;另一种则是α-淀粉酶和香气化合物相互作用直接影响香气释放。α-淀粉酶可为香气化合物提供结合位点从而影响香气化合物的释放[2],在进食过程中通过鼻后途径影响对气味的感知从而影响消费者对食品的偏好。DINU等[5]研究表明了绿茶表没食子儿茶素3-没食子酸酯(绿茶多酚)和α-淀粉酶之间存在相互作用,且这种相互作用会显著增强苯甲醛、β-紫罗兰酮和异戊醛等具有绿茶特征风味的香气化合物的释放。在毛若冰[6]的研究中阐明了橄榄多酚影响橄榄油鼻后香气释放的机制。橄榄多酚对α-淀粉酶的猝灭方式为静态猝灭,结合的主要作用力是范德华力和氢键,二者之间的结合作用比香气化合物与α-淀粉酶的结合更强,因此会使与α-淀粉酶结合的香气化合物被释放出来。在最近的一项研究中,JIA等[7]利用分子对接模拟研究了苯甲酸乙酯与α-淀粉酶之间的相互作用,发现α-淀粉酶对香气释放的影响取决于疏水相互作用。然而,现在对于香气化合物和α-淀粉酶相互作用的机制研究不足,其与α-淀粉酶相互作用的结合参数、热力学参数、作用力类型等尚不清楚。
S-HÉLARY等[4]也发现α-淀粉酶具有减少酮和酯释放的能力;另一种则是α-淀粉酶和香气化合物相互作用直接影响香气释放。α-淀粉酶可为香气化合物提供结合位点从而影响香气化合物的释放[2],在进食过程中通过鼻后途径影响对气味的感知从而影响消费者对食品的偏好。DINU等[5]研究表明了绿茶表没食子儿茶素3-没食子酸酯(绿茶多酚)和α-淀粉酶之间存在相互作用,且这种相互作用会显著增强苯甲醛、β-紫罗兰酮和异戊醛等具有绿茶特征风味的香气化合物的释放。在毛若冰[6]的研究中阐明了橄榄多酚影响橄榄油鼻后香气释放的机制。橄榄多酚对α-淀粉酶的猝灭方式为静态猝灭,结合的主要作用力是范德华力和氢键,二者之间的结合作用比香气化合物与α-淀粉酶的结合更强,因此会使与α-淀粉酶结合的香气化合物被释放出来。在最近的一项研究中,JIA等[7]利用分子对接模拟研究了苯甲酸乙酯与α-淀粉酶之间的相互作用,发现α-淀粉酶对香气释放的影响取决于疏水相互作用。然而,现在对于香气化合物和α-淀粉酶相互作用的机制研究不足,其与α-淀粉酶相互作用的结合参数、热力学参数、作用力类型等尚不清楚。
双(2-甲基-3-呋喃基)二硫醚[bis(2-methyl-3-furyl)disulfide,BMFDS]是一种挥发性含硫化合物,具有肉香味、维生素状、米糠状气味[8],被确定为各种肉类中的关键香气化合物[9-12],决定肉类香气特性,对肉类的特征香气有很大贡献。特别是在WANG等[13]对牛肉调味品中的关键气味化合物的表征中,发现BMFDS具有最高的风味稀释度和气味活性值,分别为512和21 875。目前,很少有研究直接探讨香气化合物和口腔α-淀粉酶之间的相互作用,蛋白质与香气化合物结合后的构象变化信息也有限。由于pH可以改变氨基酸残基的微环境,疏水性和蛋白质的二级结构,因此是影响蛋白质与香气化合物之间相互作用的重要因素之一[14-15]。本研究旨在探讨在pH 5.0、7.0、8.5这3种不同的pH条件下,BMFDS和α-淀粉酶的相互作用,这3种pH条件接近实际食物和饮用水的pH环境并且分别属于酸性、中性、碱性3种pH类别。这将有助于理解肉类消费过程中的感官体验,有助于理解肉类食用过程的香气感知,对于调节含有BMFDS的肉类(如牛肉、猪肉、火腿等)的风味至关重要。
1 材料与方法
1.1 材料与试剂
猪胰腺α-淀粉酶(porcine pancreas α-amylase,PPA,≥5 u/mg solid)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS,98%),上海源叶生物技术有限公司;BMFDS(98%)、盐酸胍(guanidine hydrochloride,GuHCl,99.5%)、丙二醇(propylene glycol,PG,>99.4%),上海麦克林生化科技有限公司;甲醇(≥99.9%),美国Sigma-Aldrich公司;实验用水为去离子水。
1.2 仪器与设备
7890B/5977A GC-MS,美国Agilent公司;固相微萃取(solid-phase microextraction,SPME)萃取头(50/30 μm DVB/CAR/PDMS,2 cm),Sigma-Aldrich(上海)贸易有限公司;LAMBDA750紫外分光光度计,珀金埃尔默公司;FS5荧光分光光度计,英国Edinburgh仪器公司;瑞士Tecan M200 PRO多功能酶标仪,北京世贸远东科学仪器有限公司。
1.3 实验方法
1.3.1 储备液配制
实验中使用的缓冲液为0.01 mol/L PBS(pH 5.0、7.0、8.5),分别用于配制不同pH的3 mg/mL的α-淀粉酶溶液,以甲醇为溶剂配制浓度为1 mol/L的BMFDS储备液。将配好的溶液储存于4 ℃冰箱,以备后用。
1.3.2 BMFDS与α-淀粉酶的结合
1.3.2.1 不同浓度的BMFDS与α-淀粉酶的结合
将1 mol/L的BMFDS储备液用PBS缓冲液稀释为100 μmol/L浓度的溶液。在顶空小瓶中加入5 mL 3 mg/mL的α-淀粉酶溶液或对照溶液(0.01 mol/L PBS,pH 7.0),然后在溶液中加入一定体积100 μmol/L 的BMFDS,使BMFDS在溶液中的最终浓度分别为0.1、0.2、0.3、0.4、0.5 μmol/L。立即封盖,用涡旋混合器充分混合。样品置于37 ℃下平衡2 h后进样。
1.3.2.2 不同pH条件下BMFDS与α-淀粉酶的结合
分别用pH值为5.0、7.0、8.5的缓冲液配制α-淀粉酶溶液(3 mg/mL),以对应pH缓冲液作为对照溶液,分别加入5 mL上述溶液于顶空小瓶中,随后加入一定体积的100 μmol/L的BMFDS溶液使其在溶液中的最终浓度为0.3 μmol/L。立即封盖,用涡旋混合器充分混合。样品置于37 ℃下平衡2 h后进样。
1.3.2.3 化学键破坏试剂实验
在顶空小瓶中加入5 mL 3 mg/mL的α-淀粉酶溶液,其中所含GuHCl或PG分别为1.3 mol/L和27%(体积分数),现用现配[16]。以未添加GuHCl、PG的α-淀粉酶溶液为对照。而后加入一定体积100 μmol/L 的BMFDS溶液使其最终浓度为0.3 μmol/L。立即封盖,用涡旋混合器充分混合。样品置于37 ℃下平衡2 h后进样。
1.3.2.4 SPME-GC-MS分析
SPME-GC-MS分析确定了顶空小瓶中BMFDS顶空浓度对应的峰面积。顶空SPME条件:将SPME萃取头插入顶空小瓶中,在37 ℃下吸附40 min,然后在250 ℃的GC注射器中解吸5 min。程序升温条件:烘箱起始温度为40 ℃,保持3 min,然后以9 ℃/min速率升温至170 ℃,保持3 min,再以3 ℃/min速率升温至230 ℃。α-淀粉酶与BMFDS的结合率计算如公式(1)所示[17]:
结合率![]()
(1)
1.3.3 浊度
将BMFDS溶液分别与3种不同pH的0.5 mg/mL的α-淀粉酶溶液混合,使其充分反应,BMFDS在溶液中的最终浓度为0、1、2、4、8、12、16 mmol/L。以对应PBS磷酸盐缓冲液作为空白。每个样品在600 nm处的吸光度表示浊度[18]。
1.3.4 紫外-可见吸收光谱
用3种不同pH的PBS分别配制3 mg/mL的α-淀粉酶溶液,加入BMFDS溶液使其充分反应,BMFDS在溶液中的最终浓度为0、20、40、80、160 μmol/L,以对应缓冲液作为空白。在220~320 nm范围内获得存在和不存在BMFDS的α-淀粉酶的紫外-可见吸收光谱。
1.3.5 荧光光谱
根据LIANG等[19]描述方法稍作修改后测定。将不同浓度的BMFDS溶液与3 mg/mL的α-淀粉酶溶液按比例混合,使BMFDS的最终浓度分别为0、30、60、120、240、320、480 μmol/L。分别在298、303、310 K这3个温度下孵育30 min,然后进行测量。对300~450 nm波长下的荧光发射光谱进行记录,激发波长290 nm,发射和激发狭缝宽度均为5 nm。通过Stern-Volmer方程分析荧光猝灭机理[20],按公式(2)计算:
![]() =1+KSV[Q]=1+Kqτ0[Q]
=1+KSV[Q]=1+Kqτ0[Q]
(2)
式中:F、F0分别代表有、无BMFDS时α-淀粉酶的荧光强度;KSV、[Q]、Kq分别为Stern-Volmer猝灭常数、BMFDS浓度、荧光猝灭速率常数。对于生物大分子,各种荧光猝灭剂的最大动态Kq值约是2.0×1010 L/(mol·s);τ0,不存在BMFDS时α-淀粉酶的平均荧光寿命,一般为10-8 s。
通过静态猝灭双对数方程计算BMFDS与α-淀粉酶结合时的结合常数(Ka)和结合位点数(n),如公式(3)所示:
(3)
在温度变化不大的情况下,焓变(ΔH)和熵变(ΔS)可以作为常数处理。通过Van’t Hoff方程(公式4)计算热力学参数的ΔH和ΔS值的相对大小,以此判断作用过程中的作用力类型。
(4)
式中:R,气体常数,值为8.314 J/(mol·K)。
基于吉布斯自由能公式(公式5)对自由能变化(ΔG)进行求解:
ΔG=ΔH-TΔS=-RTlnKa
(5)
1.3.6 表面疏水性
用PBS分别配制质量浓度为0.1、0.2、0.3、0.4、0.5 mg/mL的α-淀粉酶溶液,BMFDS在溶液中的最终浓度为0、1、8 mmol/L,4 mL混合溶液中加入40 μL 8 mmol/L ANS溶液,在激发波长390 nm、发射波长470 nm条件下测定荧光强度[16]。以α-淀粉酶溶液浓度为横坐标,荧光强度为纵坐标进行线性拟合,斜率即为蛋白质表面疏水性。
1.3.7 Zeta电位
将不同浓度的BMFDS溶液分别与3种不同pH的3 mg/mL的α-淀粉酶溶液混合,使其充分反应,BMFDS最终浓度为0、1、2、4、8、12、16 mmol/L。分析样品的zeta电位。
1.3.8 分子对接
采用AutoDock Vina 1.2.0进行盲分子对接,从分子水平上探究BMFDS与α-淀粉酶之间的相互作用。在对接过程中选择从蛋白质数据库(https://www.rcsb.org/)中获得的α-淀粉酶(PDB代码:4GQR)的三维(3D)结构作为受体。从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov)下载BMFDS (PubChem CID:526624)的三维结构作为配体。根据AutoDock Vina中预定义的评分函数,得到结合亲和力最低对接姿势(kcal/mol)。通过PyMOL 2.4.0和Ligplot 2.2.5软件可视化并分析具有最低结合能的最佳对接姿势。
1.4 数据处理
所有实验重复3次,数据结果均以平均值±标准差表示。运用SPSS 26进行显著性分析(P<0.05为显著)。使用Origin 2021b进行图表绘制。
2 结果与分析
2.1 BMFDS与α-淀粉酶之间的结合率以及pH对二者结合率的影响
图1-a显示了不同浓度的BMFDS与α-淀粉酶之间的结合率。随着BMFDS浓度的增加,α-淀粉酶对BMFDS的结合率从73.40%增加到88.86%,但是浓度超过0.3 μmol/L后增加并不显著(P>0.05)。α-淀粉酶与BMFDS之间的高结合率暗示它们之间存在较强的相互作用。结合率随BMFDS浓度增大而增大,这是因为α-淀粉酶上的结合位点没有被BMFDS完全占据,并且化合物浓度的增加会提供更多的氢原子,有助于形成更多的氢键[21]。YIN等[22]还提出,风味化合物还会引起蛋白质的构象发生变化,这种构象变化也是影响BMFDS与α-淀粉酶结合的一个重要因素。

a-不同浓度;b-不同pH
图1 BMFDS与α-淀粉酶在不同条件下的结合率
Fig.1 Binding rate of BMFDS to α-amylase under different conditions
注:不同小写字母代表差异性显著,P<0.05(下同)。
图1-b显示了不同pH条件对BMFDS与α-淀粉酶之间结合率的影响。pH值会显著影响BMFDS与α-淀粉酶之间的结合率(P<0.05),pH 5.0条件下二者的结合率为17.02%,pH 7.0条件下二者的结合率为87.20%,pH 8.5条件下二者的结合率为58.27%。说明在pH 7.0条件下α-淀粉酶对BMFDS的吸附作用最强,结合香气化合物的能力最高。这可能和pH引起α-淀粉酶构象变化有关。
2.2 浊度
浊度法通过测量光线透过液体时的吸收强度判断小分子和蛋白质的结合情况,并分析不同影响因素下结合程度的高低[23-24]。从图2中观察到α-淀粉酶溶液的浊度随着BMFDS浓度的增加而显著增加(P<0.05),表明BMFDS与α-淀粉酶之间的相互作用是浓度依赖性的,并且这种相互作用可能是BMFDS与α-淀粉酶之间形成复合物或者以香气化合物为桥梁连接2个蛋白质分子形成聚集体而提高溶液浊度[25]。此外,pH对BMFDS与α-淀粉酶间的相互作用具有显著影响(P<0.05)。这可能是因为不同pH条件下蛋白质的离子强度不同,且会诱导α-淀粉酶结构产生变化而发生聚集。当BMFDS浓度为16 mmol/L时,在pH 7.0时具有最高的浊度,其次是pH 8.5和pH 5.0。这表明BMFDS与α-淀粉酶在pH 7.0条件下的相互作用最强。
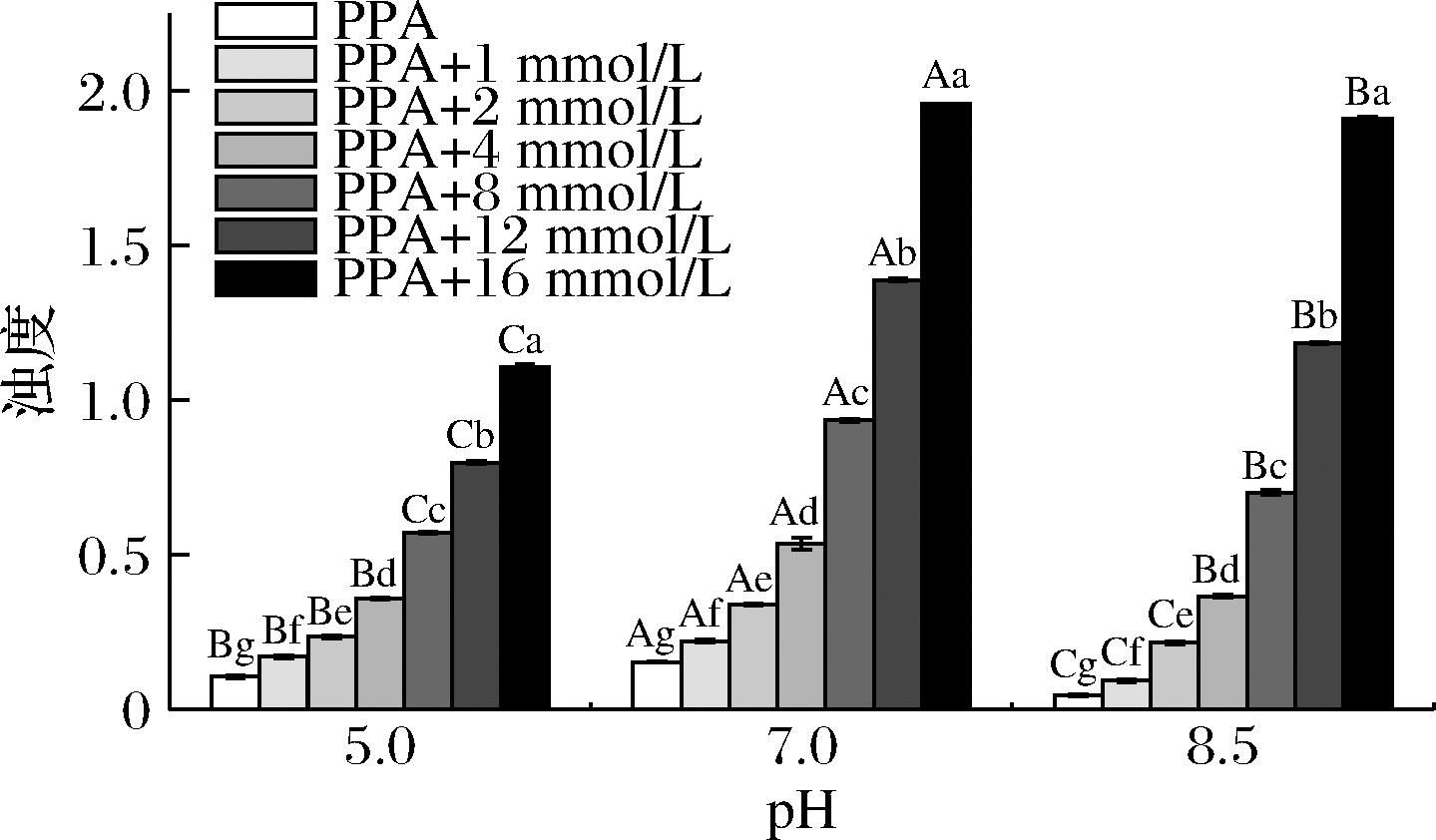
图2 不同浓度的BMFDS与α-淀粉酶在3种pH条件下的浊度
Fig.2 Turbidity of BMFDS at different concentrations with α-amylase at three pH conditions
注:条形上方的不同字母表示差异显著(P<0.05),小写字母代表不同浓度BMFDS的显著性差异,大写字母代表化合物浓度相同时不同pH间的显著性差异(图7同)。
2.3 紫外吸收光谱
紫外吸收光谱属于分子吸收光谱,是利用物质分子对光照射的吸收特性从而建立的一种分析方法,常用于初步分析小分子与蛋白质之间的相互作用。如图3所示,在3种pH条件下,α-淀粉酶在260 nm附近具有典型的吸收峰,这归因于α-淀粉酶的酪氨酸和色氨酸等芳香杂环的π-π*跃迁。BMFDS的加入使α-淀粉酶的紫外吸收强度增大,表明α-淀粉酶的构象发生了变化。在3种pH条件下的吸收强度有差异,pH 7.0>pH 8.5> pH 5.0,表明在pH 7.0时α-淀粉酶与BMFDS的相互作用最强[15]。紫外吸收光谱还可用于初步确定小分子对蛋白质的荧光猝灭类型[22],蛋白质的吸收光谱在动态猝灭过程中没有变化;但就静态猝灭而言,荧光基团和猝灭剂之间形成络合物会改变吸收光谱。因此,BMFDS与α-淀粉酶发生了相互作用,且BMFDS对α-淀粉酶的猝灭机制很可能是静态猝灭。然而,由于紫外吸收光谱灵敏度的限制,需要使用荧光光谱进一步分析。
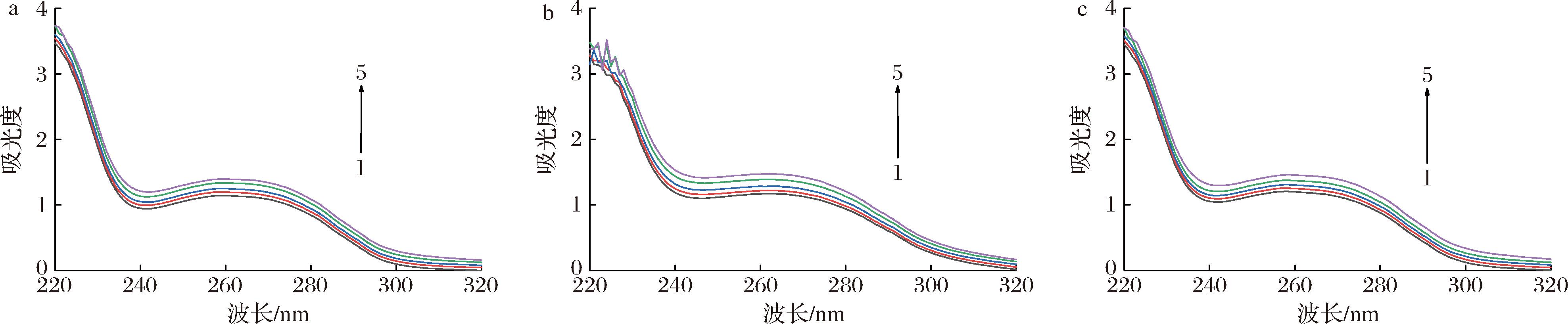
a-pH 5.0;b-pH 7.0;c-pH 8.5
图3 不同pH条件下BMFDS与α-淀粉酶相互作用的紫外吸收光谱图
Fig.3 UV absorption spectra of BMFDS interactions with α-amylase under different pH conditions
注:α-淀粉酶质量浓度为3 mg/mL;BMFDS浓度1~5分别为0、20、40、80、160 μmol/L。
2.4 荧光光谱
2.4.1 荧光发射光谱
蛋白质具有色氨酸和酪氨酸等芳香族氨基酸残基而具有内源性荧光[26],在与小分子物质发生相互作用后,其荧光强度会发生变化。在激发波长为290 nm的条件下,处于不同pH值环境的α-淀粉酶的荧光均在322 nm处最强,且随着BMFDS浓度的增加,其对α-淀粉酶的荧光猝灭程度也增加。当pH值为5.0、7.0、8.5时,α-淀粉酶的荧光强度分别降低了17.45%、23.96%和19.29%,表明pH值会影响BMFDS与α-淀粉酶之间的相互作用,且在pH值为7.0条件下的猝灭效率最高。在3种pH条件下,α-淀粉酶的最大发射波长都向右发生了明显的移动,表明BMFDS的加入使α-淀粉酶的荧光发色基团处于一个更疏水的环境中,改变了其所处的微环境(图4)。
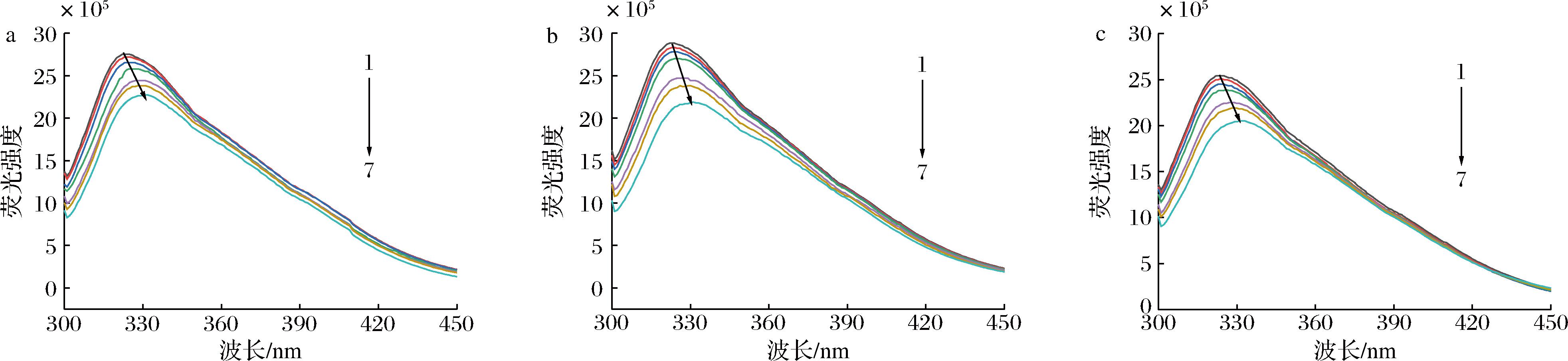
a-pH 5.0;b-pH 7.0;c-pH 8.5
图4 不同pH条件下BMFDS与α-淀粉酶相互作用的荧光光谱图
Fig.4 Fluorescence spectra of BMFDS interactions with α-amylase under different pH conditions
注:α-淀粉酶质量浓度为3 mg/mL;BMFDS浓度1~7分别为0、30、60、120、240、320、480 μmol/L。
2.4.2 荧光猝灭类型
荧光猝灭机制通常分为动态、静态、动静结合3种类型[27]。借助Stern-Volmer方程式探讨BMFDS对α-淀粉酶的荧光猝灭类型。图5表示的是不同pH条件下BMFDS与α-淀粉酶在298、303、310 K温度下的Stern-Volmer曲线,每条曲线的线性关系都良好,由此计算了相应温度下的Ksv和Kq,结果列于表1中。3种pH条件下的Ksv都随温度升高而减小,表明BMFDS与α-淀粉酶的相互作用是形成了基态复合物的静态猝灭。因为温度越高,基态复合物的稳定性越低,Ksv越低。这和紫外的初步判断结果一致。根据所得Ksv值的大小还可以反映猝灭效应的相对强弱[28]。由表1数据可知,不同pH条件下BMFDS对α-淀粉酶的Ksv各不相同(pH 7.0>pH 8.5>pH 5.0),表明pH 7.0时的作用强度最强。
表1 BMFDS与α-淀粉酶相互作用的猝灭常数、结合常数和结合位点数
Table 1 Quenching constant, binding constant, and number of binding sites for BMFDS interaction with α-amylase
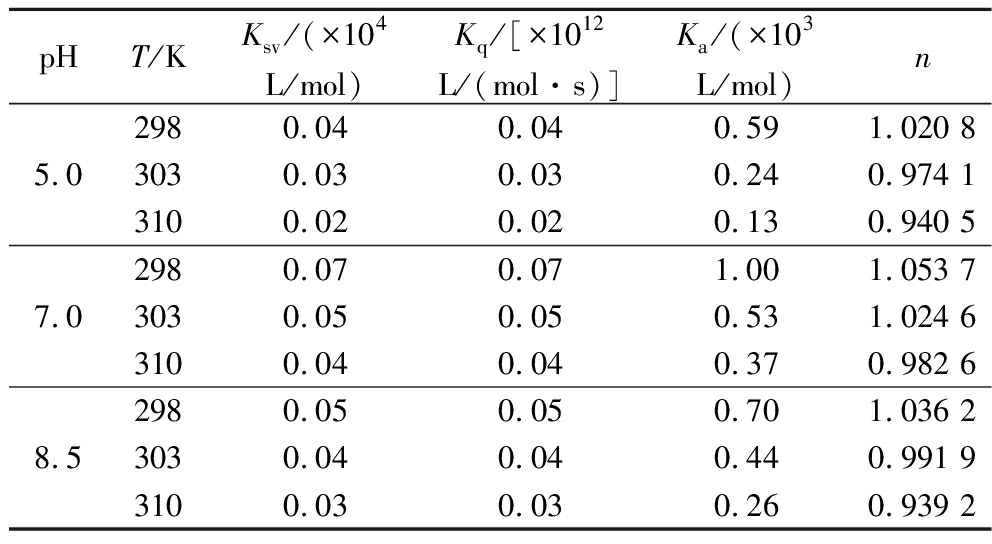
pHT/KKsv/(×104L/mol)Kq/[×1012 L/(mol·s)]Ka/(×103 L/mol)n5.02980.040.040.591.020 83030.030.030.240.974 13100.020.020.130.940 57.02980.070.071.001.053 73030.050.050.531.024 63100.040.040.370.982 68.52980.050.050.701.036 23030.040.040.440.991 93100.030.030.260.939 2
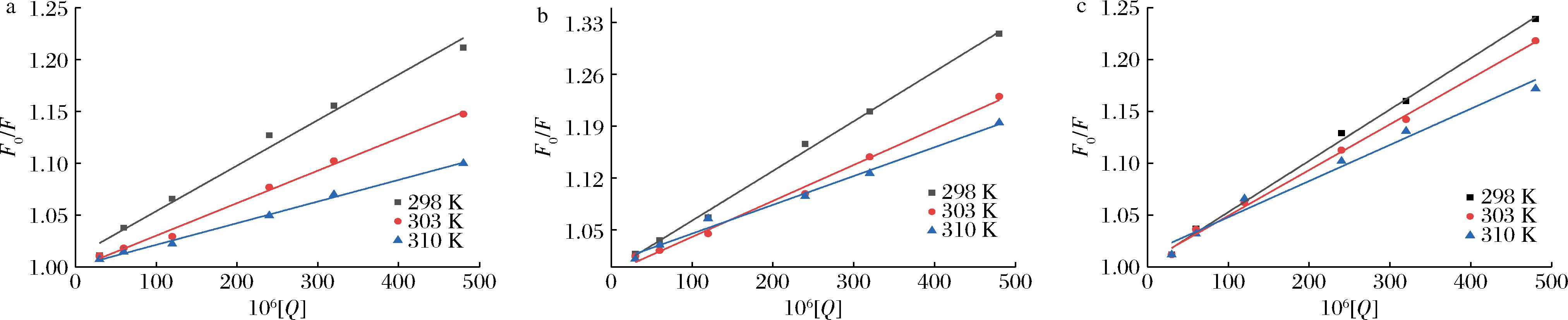
a-pH 5.0;b-pH 7.0;c-pH 8.5
图5 不同pH条件下BMFDS与α-淀粉酶在3种温度下的Stern-Volmer曲线
Fig.5 Stern-Volmer curves of BMFDS and α-amylase at three temperatures under different pH conditions
2.4.3 结合常数和结合位点数
根据静态猝灭双对数方程得到不同温度下BMFDS与α-淀粉酶的双对数曲线(图6),由此计算得到的Ka和n值列于表1中。在3个温度下BMFDS与α-淀粉酶相互作用测得的n值都趋近于1,说明在该浓度范围(0~480 μmol/L)内一分子BMFDS与一分子α-淀粉酶结合。此外,随着温度的升高,BMFDS与α-淀粉酶的Ka值呈下降趋势,更加证实了荧光猝灭机制属于静态猝灭。在3个不同pH条件下的Ka和n值均在pH 7.0时最大,说明在pH 7.0时表现出最强的相互作用。
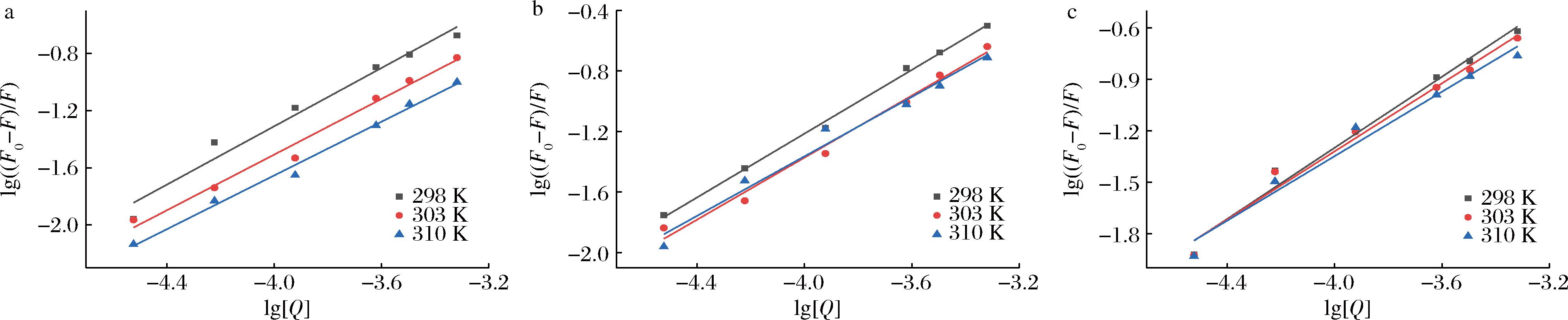
a-pH 5.0;b-pH 7.0;c-pH 8.5
图6 不同pH条件下BMFDS与α-淀粉酶在3种温度下的双对数曲线
Fig.6 Bilogarithmic curves of BMFDS and α-amylase at three temperatures under different pH conditions
2.4.4 热力学参数和作用力类型
小分子与蛋白质发生静态猝灭时,二者结合形成复合物的作用力通常属于氢键、静电作用力、疏水作用力与范德华力这4类非共价作用力[22]。基于作用前、后热力学参数ΔH和ΔS值的相对大小来对双方的主要作用力类型做出判断[29]。计算所得相关参数列于表2中。但应注意α-淀粉酶结构复杂,因此BMFDS和蛋白质之间的作用力通常为诸多不同作用力联合刺激的结果。
表2 α-淀粉酶与BMFDS相互作用的热力学参数
Table 2 Thermodynamic parameters of α-amylase interaction with BMFDS
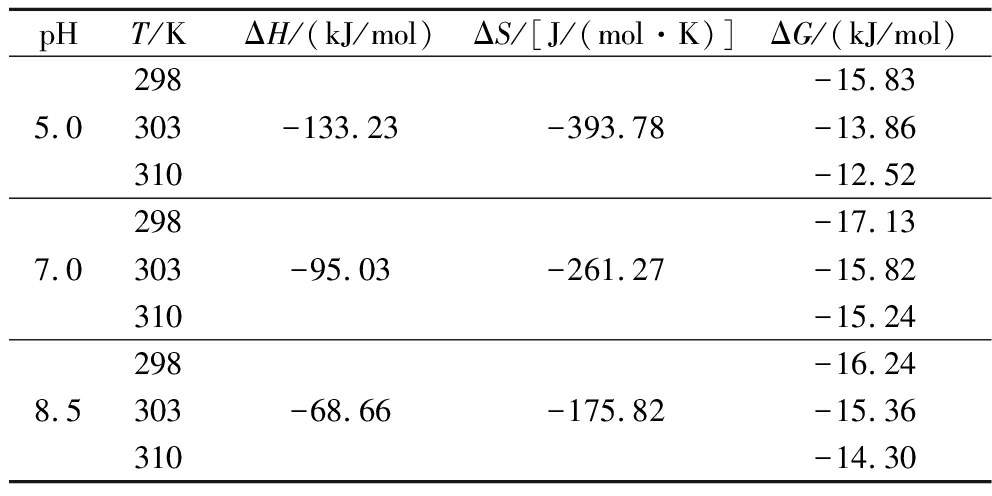
pHT/KΔH/(kJ/mol)ΔS/[J/(mol·K)]ΔG/(kJ/mol)5.0298303310-133.23-393.78-15.83-13.86-12.527.0298303310-95.03-261.27-17.13-15.82-15.248.5298303310-68.66-175.82-16.24-15.36-14.30
在温度变化较小时,可将ΔH与ΔS视为常数。由表2可知,ΔH<0,说明该反应是放热反应,这与前面结合常数随温度升高而减小的结果一致;ΔH<0、ΔS<0,说明在BMFDS与α-淀粉酶结合过程中氢键与范德华力发挥着主要作用;ΔG<0,说明两者之间的相互作用是自发进行的。在3种pH条件下,热力学参数的正负没有发生变化,说明pH值对BMFDS与α-淀粉酶间的作用力和反应类型没有影响。
2.5 表面疏水性
蛋白质表面疏水性的大小与暴露在表面的氨基酸残基数量以及蛋白质的空间结构密切相关。不同pH条件下BMFDS与α-淀粉酶之间的表面疏水性如表3所示。
表3 不同浓度的BMFDS与α-淀粉酶在3种
pH条件下的表面疏水性
Table 3 Surface hydrophobicity of BMFDS at different concentrations with α-amylase at three pH conditions

浓度/(mmol/L)pH 5.0pH 7.0pH 8.509 794.33±484.67Aa6 895.00±610.55Ba3 715.67±69.60Ca16 581.33±210.62Ab4 714.33±202.81Bb2 716.00±254.34Cb85 062.67±387.67Ac3 614.33±265.46Bc1 592.00±121.45Cc
注:不同字母表示差异显著(P<0.05),小写字母代表不同浓度BMFDS的显著性差异,大写字母代表化合物浓度相同时不同pH间的显著性差异。
在3个pH条件下,加入BMFDS之后,α-淀粉酶的表面疏水性均显著下降(P<0.05),说明其二级结构发生了变化,BMFDS中的疏水基团与α-淀粉酶表面的疏水基团相互作用[16]。DAI等[30]发现大豆分离蛋白和儿茶素的非共价相互作用会使大豆分离蛋白疏水性降低。随着pH的升高,α-淀粉酶的表面疏水性降低。这是因为pH诱导蛋白质构象发生了变化,蛋白质之间存在聚集现象,使α-淀粉酶表面的色氨酸、酪氨酸、苯丙氨酸等疏水氨基酸残基被埋藏在了蛋白内部。疏水性的降低也说明BMFDS与α-淀粉酶之间存在疏水相互作用。这和热力学参数判断存在的作用力类型互为补充。
2.6 Zeta电位
Zeta电位指的是固体表面与周围溶液中离子层之间的电势差,是衡量固体表面电荷性质以及固体表面与溶液之间相互作用的重要参数[31]。不同pH条件下,BMFDS对α-淀粉酶溶液zeta电位的影响如图7所示。溶液的zeta电位均表现为负值,说明α-淀粉酶分子带负电。随着BMFDS浓度的增加,zeta电位绝对值有显著增加,说明BMFDS的加入与更强的负电荷有关,增加了α-淀粉酶所带的负电荷,这增加了体系中的静电斥力。然而,样品的浊度是随BMFDS浓度的增加而增大的,可能是因为BMFDS与α-淀粉酶之间形成的其他作用力远强于静电斥力。这和DAI等[30]报告的结果类似。另外,溶液的zeta电位绝对值越高,说明体系的稳定性越好。不同pH下BMFDS与α-淀粉酶混合体系的zeta电位各不相同,总体而言,pH 5.0下的zeta电位绝对值最高,说明稳定性最好,蛋白质以小颗粒的形式分散,溶液中BMFDS与α-淀粉酶之间的静电相互作用更强。
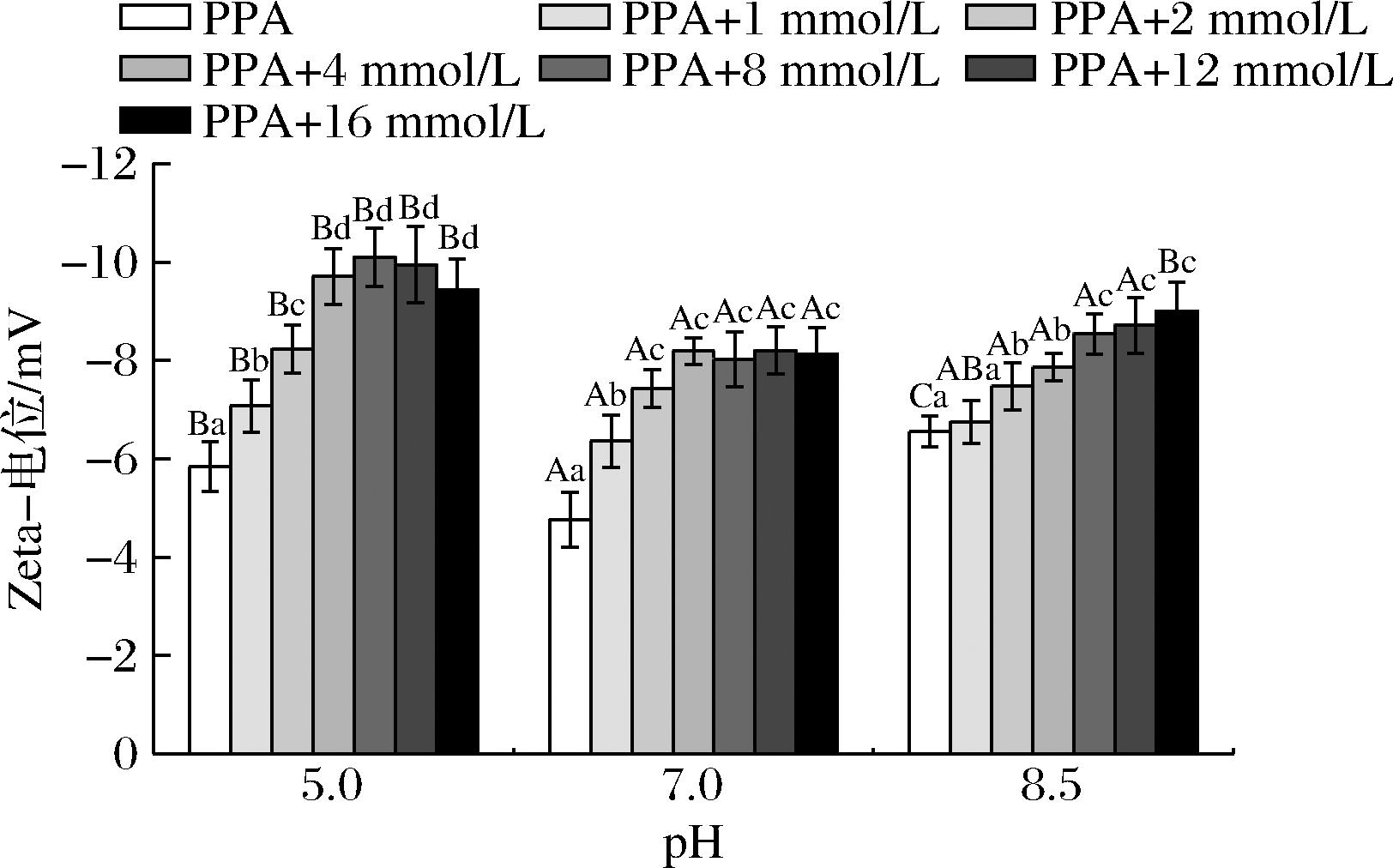
图7 α-淀粉酶与不同浓度BMFDS混合物在3种
pH条件下的zeta电位
Fig.7 Zeta potential of α-amylase mixtures with BMFDS at three pH conditions
2.7 化学键破坏试剂对BMFDS与α-淀粉酶结合的影响
化学键破坏试剂可以破坏特定的化学键,从而确定香气化合物和蛋白质之间分子作用力的具体信息。PG可以弱化疏水相互作用并提高氢键和静电相互作用,GuHCl可以弱化疏水相互作用并抑制氢键和静电相互作用[32]。BMFDS与α-淀粉酶体系中分别加入PG和GuHCl后,BMFDS顶空浓度产生的峰面积如图8所示。加入GuHCl后,顶空中BMFDS的峰面积由1.06×105显著增加到2.88×105,验证了BMFDS与α-淀粉酶之间存在着疏水相互作用。加入PG后,顶空中BMFDS的峰面积相对于对照组也显著增加,说明PG弱化的疏水相互作用增加了BMFDS的释放。在BI等[16]对(E)-2-辛烯醛与豌豆蛋白的研究中也发现相似的结果。综合前文相互作用力的研究,在BMFDS与α-淀粉酶的结合过程中,疏水相互作用是主要作用力。
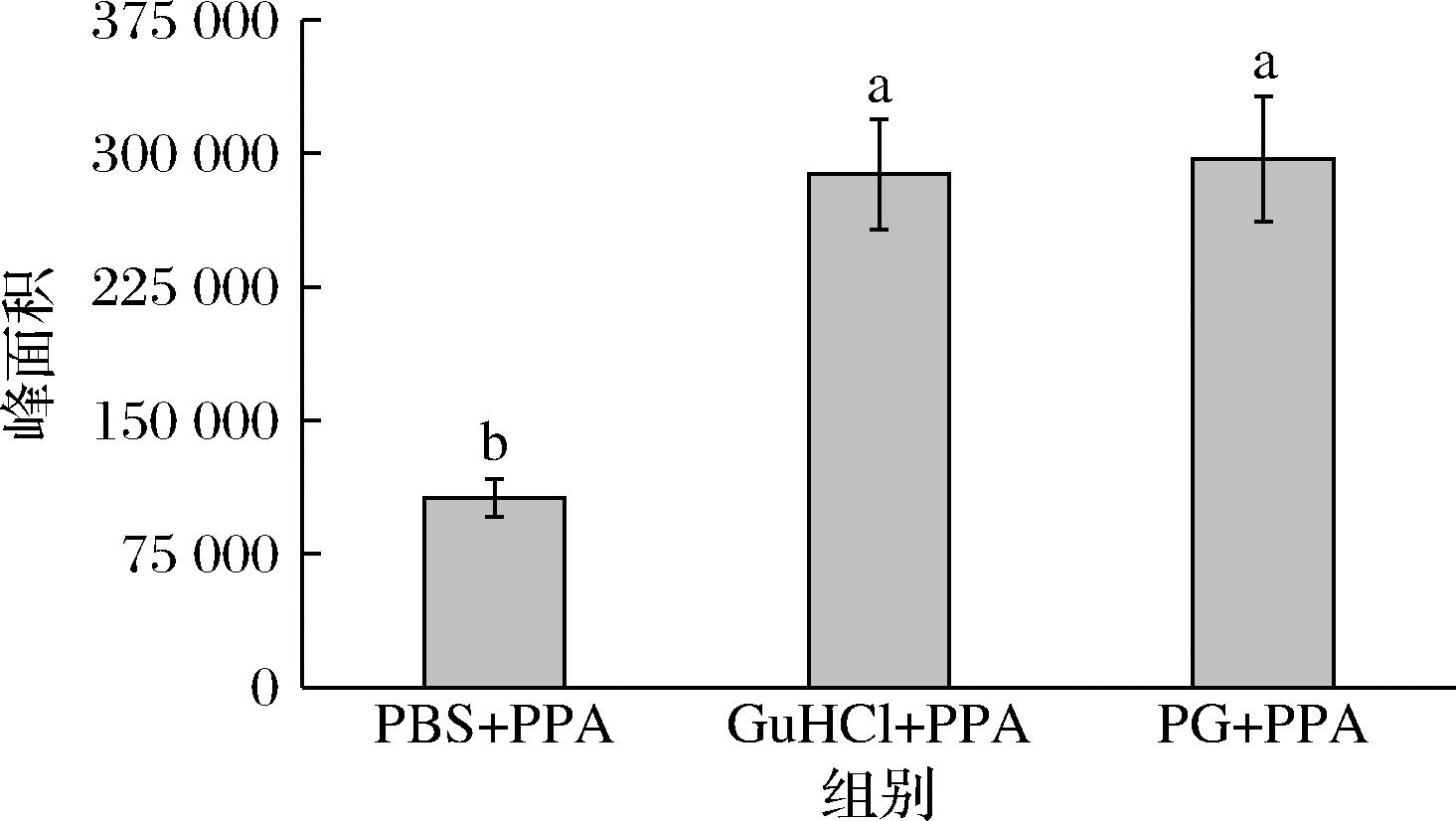
图8 化学键破坏剂加入前后BMFDS顶空浓度产生的面积
Fig.8 The area produced by the BMFDS headspace concentration before and after the addition of the chemical bond breaker
2.8 BMFDS与α-淀粉酶之间的分子对接分析
分子对接是通过计算机模拟来预测蛋白质和小分子物质非共价结合的结合位点[16]。图9为BMFDS与α-淀粉酶的最佳对接构象及二维相互作用,并证实了配体BMFDS与α-淀粉酶通过非共价结合形成了稳定的复合物。使用Ligplot软件可视化分析配体BMFDS与α-淀粉酶之间的相互作用,如图9所示,BMFDS与α-淀粉酶内Trp-59、Leu-165、Glu-233、Tyr-62、Asp-300、Asp-197和His-299形成疏水相互作用,且Gln-63残基与BMFDS中的氧原子之间形成1条氢键,因此,BMFDS与α-淀粉酶的非共价相互作用主要包括疏水相互作用和氢键作用。这些数据与前述结果一致,并相互补充。这一结论与沈荷玉等[33]关于没食子酸与α-淀粉酶相互作用的发现相似。
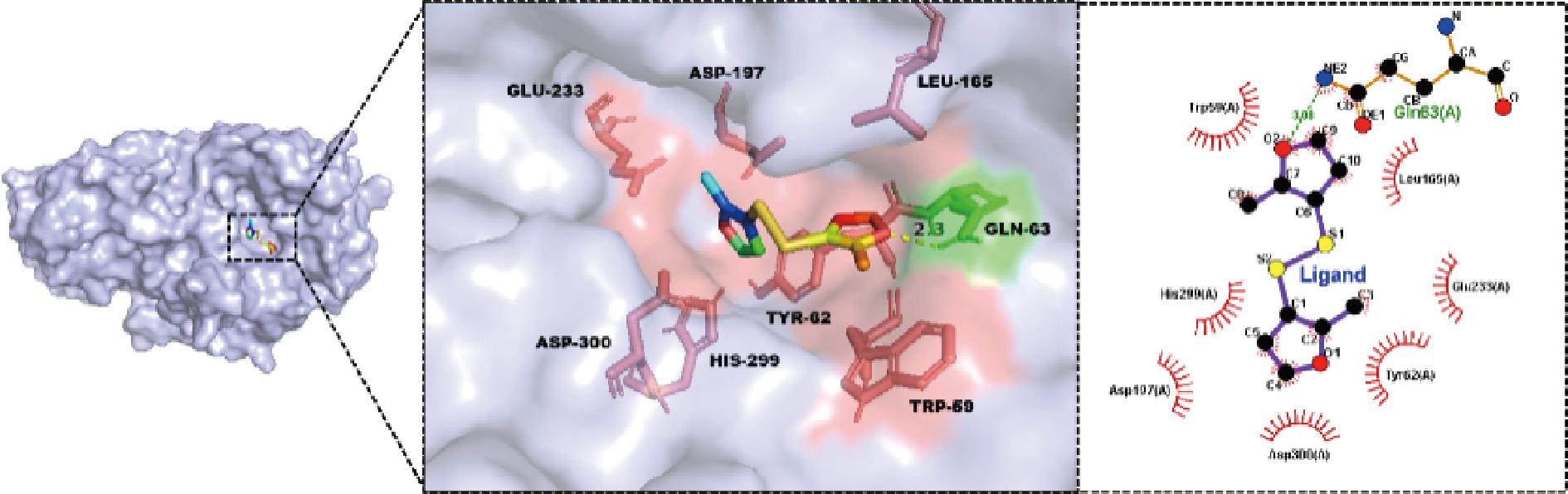
图9 BMFDS与α-淀粉酶之间的结合位点、结合构象和相互作用图
Fig.9 Binding site, binding conformation, and interaction between BMFDS and α-amylase
3 结论
本实验采用SPME-GC-MS、紫外吸收光谱、荧光光谱等方法分析典型肉类香气化合物BMFDS与α-淀粉酶之间的相互作用机制以及pH值对其相互作用的影响。研究发现,BMFDS与α-淀粉酶之间发生了非共价相互作用,BMFDS可以造成α-淀粉酶的荧光猝灭,且猝灭机制属于静态猝灭,二者互作结合形成了复合物。结合热力学参数计算、蛋白质表面疏水性和zeta电位测量、化学键破坏剂的使用以及分子对接分析,确定了BMFDS与α-淀粉酶之间的主要作用力是疏水相互作用。这种相互作用会使α-淀粉酶结构松散,暴露更多的结合位点,氨基酸残基周围微环境的极性增加,疏水性降低。pH条件的改变不会影响二者之间的作用力和反应类型,但会改变二者之间的相互作用强度,其作用强度为pH 7.0>pH 8.5>pH 5.0。本研究从分子水平上揭示了BMFDS与α-淀粉酶之间的非共价相互作用机制,有助于理解肉类食用过程中的香气感知,为调控肉类制品的风味奠定理论基础。
[1] KANDRA L, GYÉM NT G.Examination of the active sites of human salivary α-amylase (HSA)[J].Carbohydrate Research, 2000, 329(3):579-585.
NT G.Examination of the active sites of human salivary α-amylase (HSA)[J].Carbohydrate Research, 2000, 329(3):579-585.
[2] ZHANG Y F, CHEN Y, CHEN J S.The starch hydrolysis and aroma retention caused by salivary α-amylase during oral processing of food[J].Current Opinion in Food Science, 2022, 43:237-245.
[3] RAMSEY I, DINU V, LINFORTH R, et al.Understanding the lost functionality of ethanol in non-alcoholic beer using sensory evaluation, aroma release and molecular hydrodynamics[J].Scientific Reports, 2020, 10(1):20855.
[4] PAG S-HÉLARY S, ANDRIOT I, GUICHARD E, et al.Retention effect of human saliva on aroma release and respective contribution of salivary mucin and α-amylase[J].Food Research International, 2014, 64:424-431.
S-HÉLARY S, ANDRIOT I, GUICHARD E, et al.Retention effect of human saliva on aroma release and respective contribution of salivary mucin and α-amylase[J].Food Research International, 2014, 64:424-431.
[5] DINU V, LIU C J, ALI J, et al.Analytical ultracentrifugation in saliva research:Impact of green tea astringency and its significance on the in-vivo aroma release[J].Scientific Reports, 2018, 8(1):13350.
[6] 毛若冰. 橄榄多酚影响初榨橄榄油鼻后香气释放的机制研究[D].无锡:江南大学, 2022.MAO R B.Study on the mechanism of olive polyphenols affecting the aroma release of virgin olive oil after nose[D].Wuxi:Jiangnan University, 2022.
[7] JIA W, DI C N, ZHANG R, et al.Hydrogen bonds and hydrophobicity with mucin and α-amylase induced honey aroma in Feng-flavor Baijiu during 16 years aging[J].Food Chemistry, 2022, 396:133679.
[8] KOBAYASHI N, MIZOTA Y, KUMAZAWA K, et al.Character impact odorants of high-heat skim milk powder isolated by simultaneous distillation-extraction[J].Journal of Agricultural and Food Chemistry, 2008, 56(7):2469-2476.
[9] THOMAS C, MERCIER F, TOURNAYRE P, et al.Effect of added thiamine on the key odorant compounds and aroma of cooked ham[J].Food Chemistry, 2015, 173:790-795.[10] XIAO Z B, WU M L, NIU Y W, et al.Contribution of chicken base addition to aroma characteristics of Maillard reaction products based on gas chromatography-mass spectrometry, electronic nose, and statistical analysis[J].Food Science and Biotechnology, 2015, 24(2):411-419.
[11] 王蒙, 侯莉, 曹长春, 等.清炖猪肉汤香气物质的分析鉴定[J].食品科学, 2015, 36(24):105-111.WANG M, HOU L, CAO C C, et al.Characterization of the aroma compounds in stewed pork broth[J].Food Science, 2015, 36(24):105-111.
[12] DU W B, ZHEN D W, WANG Y T, et al.Characterization of the key odorants in grilled mutton shashlik with or without suet brushing during grilling[J].Flavour and Fragrance Journal, 2021, 36(1):111-120.
[13] WANG H L, YANG P, LIU C, et al.Characterization of key odor-active compounds in thermal reaction beef flavoring by SGC×GC-O-MS, AEDA, DHDA, OAV and quantitative measurements[J].Journal of Food Composition and Analysis, 2022, 114:104805.
[14] YANG Q L, LOU X W, WANG Y, et al.Effect of pH on the interaction of volatile compounds with the myofibrillar proteins of duck meat[J].Poultry Science, 2017, 96(6):1963-1969.
[15] 唐瑜婉. 不同pH、CaCl2浓度下玉米醇溶蛋白-阿魏酸相互作用、结构表征及理化特性研究[D].重庆:西南大学, 2020.TANG Y W.Study on the interaction, structural characterization and physical and chemical properties of zein-ferulic acid at different pH and CaCl2 concentrations[D].Chongqing:Southwest University, 2020.
[16] BI S, PAN X, ZHANG W T, et al.Non-covalent interactions of selected flavors with pea protein:Role of molecular structure of flavor compounds[J].Food Chemistry, 2022, 389:133044.
[17] WANG K, ARNTFIELD S D.Binding of selected volatile flavour mixture to salt-extracted canola and pea proteins and effect of heat treatment on flavour binding[J].Food Hydrocolloids, 2015, 43:410-417.
[18] JIANG Z M, GAO Y T, LI J P, et al.Consecutive pH-shift and ultrasound treatment modify the physicochemical properties of whey protein isolate[J].International Dairy Journal, 2022, 127:105211.
[19] LIANG W J, ZHANG Z X, ZHU Q Y, et al.Molecular interactions between bovine serum albumin (BSA) and trihalophenol:Insights from spectroscopic, calorimetric and molecular modeling studies[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2023, 287:122054.
[20] WANG H T, ZHANG H W, LIU Q, et al.Exploration of interaction between porcine myofibrillar proteins and selected ketones by GC-MS, multiple spectroscopy, and molecular docking approaches[J].Food Research International, 2022, 160:111624.
[21] LV T, WANG Y, PAN D D, et al.Effect of trypsin treatments on the structure and binding capacity of volatile compounds of myosin[J].Food Chemistry, 2017, 214:710-716.
[22] YIN X Y, GAO M K, WANG H T, et al.Probing the interaction between selected furan derivatives and porcine myofibrillar proteins by spectroscopic and molecular docking approaches[J].Food Chemistry, 2022, 397:133776.
[23] XU Y X, ZHAO J M, WANG R, et al.Effect of heat treatment on the binding of selected flavor compounds to myofibrillar proteins[J].Journal of the Science of Food and Agriculture, 2019, 99(11):5028-5034.
[24] 叶青青. 基于多酚与蛋白质络合作用的儿茶素涩味强度分析模型构建[D].重庆:西南大学, 2020.YE Q Q.Construction of an analytical model for the astringency strength of catechins based on the complexation of polyphenols with protein[D].Chongqing:Southwest University, 2020.
[25] QUINTERO-FL REZ A, S
REZ A, S NCHEZ-ORTIZ A, GAFORIO MART
NCHEZ-ORTIZ A, GAFORIO MART NEZ J J, et al.Interaction between extra virgin olive oil phenolic compounds and mucin[J].European Journal of Lipid Science and Technology, 2015, 117(10):1569-1577.
NEZ J J, et al.Interaction between extra virgin olive oil phenolic compounds and mucin[J].European Journal of Lipid Science and Technology, 2015, 117(10):1569-1577.
[26] SIDDIQUI G A, SIDDIQI M K, KHAN R H, et al.Probing the binding of phenolic aldehyde vanillin with bovine serum albumin:Evidence from spectroscopic and docking approach[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2018, 203:40-47.
[27] 楼燕月. 酰胺类农药与生物大分子相互作用机制的研究[D].杭州:浙江工业大学, 2018.LOU Y Y.Study on the interaction mechanism between amide pesticides and biological macromolecules[D].Hangzhou:Zhejiang University of Technology, 2018.
[28] 江涛. 四种重点黄曲霉毒素与人血清白蛋白的作用及机理研究[D].重庆:西南大学, 2016.JIANG T.Study on the interaction and mechanism of four key aflatoxins with human serum albumin[D].Chongqing:Southwest University, 2016.
[29] WANG H T, GUAN H N, ZHANG H W, et al.Elucidation of interaction mechanisms between myofibrillar proteins and ethyl octanoate by SPME-GC-MS, molecular docking and dynamics simulation[J].LWT, 2022, 154:112787.
[30] DAI S C, LIAN Z T, QI W J, et al.Non-covalent interaction of soy protein isolate and catechin:Mechanism and effects on protein conformation[J].Food Chemistry, 2022, 384:132507.
[31] LI X J, ZENG X Q, XI Y, et al.Effects of non-covalent interactions between pectin and volatile compounds on the flavor release of tomato paste[J].Food Hydrocolloids, 2022, 133:107886.
[32] WANG K, ARNTFIELD S D.Probing the molecular forces involved in binding of selected volatile flavour compounds to salt-extracted pea proteins[J].Food Chemistry, 2016, 211:235-242.
[33] 沈荷玉, 李梦阳, 敖婧芳, 等.没食子酸对α-淀粉酶和α-葡萄糖苷酶的抑制作用及机理[J].食品科学, 2023, 44(22):31-38.SHEN H Y, LI M Y, AO J F, et al.Inhibitory effect and mechanism of Gallic acid on α-amylase and α-glucosidase activities[J].Food Science, 2023, 44(22):31-38.