糖尿病是一种因胰岛素分泌不足和胰岛素抵抗而引起的以高血糖为主要特征的慢性代谢性疾病。据统计,2021年全球糖尿病患病人数为5.4亿,预计到2045年将升至7.8亿,其中Ⅱ型糖尿病约占90%,已成为严重威胁人们健康的世界性公共卫生问题[1]。同时,长期高血糖会导致体内自由基的积累,加重胰岛素抵抗,增加并发症的发病率。因此,抗氧化活性强的降血糖活性成分更有利于预防和治疗糖尿病及其并发症[2]。
目前,Ⅱ型糖尿病临床治疗药物有磺脲类、格列奈类、双胍类等,但长期服用均存在低血糖、胃肠道不适、水肿、体重增加等副作用[3-4]。因此,迫切需要挖掘和开发效果好、副作用低的天然资源来预防和改善糖尿病及其并发症。野生樱桃李属蔷薇科李属灌木,原产于亚洲、东欧和中欧,在我国仅分布在新疆霍城县的一个狭长区域。野生樱桃李果实含有丰富的必需氨基酸、有机酸、维生素和矿物质,可生食或加工成果酱、果汁、果酒和蒸馏酒等产品,被当地哈萨克族居民称为“雪域珍果”[5]。WANG等[6]发现不同种类的樱桃李果实中均含有花青素-3-O-半乳糖苷、花青素-3-O-葡萄糖苷、花青素-3-O-芸香糖苷,但含量差异显著。张静茹等[7]通过高效液相色谱光电二极管矩阵检测从13种不同来源的樱桃李中鉴定出槲皮素、表儿茶素、儿茶素和绿原酸等11种化学成分。课题组前期研究发现野生樱桃李叶提取物具有显著的抑制α-葡萄糖苷酶活性,并鉴定了11个黄酮类、9个苯丙素类、2个酚酸类化合物[8-9]。但是,目前关于野生樱桃李果实的抗氧化和降血糖活性和作用成分尚不清楚,亟需进一步的研究。
本研究以紫色野生樱桃李果实(purple Prunus cerasifera Ehrh.,PPE)为原料,通过体积分数70%的乙醇浸提和溶剂萃取得到提取物及其萃取组分,并测定其总酚和总黄酮含量;通过DPPH自由基和ABTS阳离子自由基清除实验评价抗氧化活性;通过α-葡萄糖苷酶和二肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)抑制能力、促进HepG2细胞葡萄糖消耗能力、抗糖基化能力分析其抗糖尿病活性,并通过高效液相色谱飞行时间质谱联用(HPLC-quadrupole time-of-flight tandem mass spectrometry, HPLC-QTOF-MS/MS)技术对活性成分进行鉴定分析,旨在评估野生樱桃李果实作为新型抗糖尿膳食添加剂的潜力。
1 材料与方法
1.1 材料与试剂
Folin-Ciocalteu试剂、没食子酸、槲皮素、抗坏血酸、西他列汀,上海源叶生物科技有限公司;1, 1-二苯基-2-三硝基苯肼(1, 1-diphenyl-2-picrylhydrazyl,DPPH),上海化成工业有限公司;阿卡波糖、α-葡萄糖苷酶,上海麦克林生物科技有限公司;对硝基苯-α-D-葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG)、2, 2′-联氨-二(3-乙基-苯并噻唑-6-磺酸)二铵盐[2, 2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS],上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
Value旋转蒸发仪,德祥科技有限公司;Synergy H酶标仪,美国BioTek公司;LGJ-10N冷冻干燥箱,北京亚星仪科科技有限公司;TGL-10C高速台式离心机,上海安亭科学仪器厂;F-7000荧光分光光度计,日本日立公司;SCIEX X500R QTOF高分辨率液质联用,美国AB公司。
1.3 实验方法
1.3.1 样品的提取
将PPE去核,冷冻干燥,粉碎。称取600 gPPE粉末,用体积分数70%的乙醇按照1∶20(g∶mL)的料液比常温浸提1 d,抽滤,残渣再在相同条件提取2次,合并上清液,蒸发浓缩得到PPE醇提物(ethanol extract of purple Prunus cerasifera,PCE)。将提取物溶于少量的水中,依次用等体积的石油醚、乙酸乙酯和正丁醇萃取三次,得到石油醚相(petroleum ether fraction,PEF)、乙酸乙酯相(ethyl acetate fraction,EAF)、正丁醇相(n-Butanol fraction,nBuF)和水相(water fraction,WF),浓缩干燥后于4 ℃保存。
1.3.2 总酚含量测定
采用Folin-Ciocalteau法测样品中的总酚含量[10]。取0.2 mL样品与0.1 mL Folin-Ciocalteau反应5 min,加入0.3 mL 200 g/L Na2CO3溶液和1.0 mL蒸馏水,避光反应25 min后,7 000 r/min离心2 min,取200 μL上清液于96孔酶标板上,采用酶标仪测溶液在765 nm的吸光值。以没食子酸为标准品绘制标准曲线(y=0.007x-0.072 4,R2=0.994 4),计算样品的总酚含量,结果表示为没食子酸当量(mg GAE/g E)。
1.3.3 总黄酮含量测定
采用NaOH-NaNO2-AlCl3法测定样品中的总黄酮含量[10]。取0.1 mL与50 μL 50 g/L NaNO2溶液反应6 min,再加入50 μL 100 g/L AlCl3反应6 min,最后加入0.5 mL 40 g/L NaOH和0.5 mL蒸馏水室温反应15 min,最后于510 nm处测其吸光值,以槲皮素为标准品绘制标准曲线(y=0.550 6x-0.014 5,R2=0.995 2),计算样品的黄酮含量,结果表示为槲皮素当量(mg QuE/g E)。
1.3.4 抗氧化活性测定
1.3.4.1 ABTS阳离子自由基清除能力测定
参照文献[11]的方法,取50 μL适宜浓度样品和槲皮素,加入150 μL ABTS溶液混匀,室温避光反应6 min,在734 nm下测定吸光值,自由基清除率按公式(1)计算:
自由基清除率![]()
(1)
式中:As,含所有试剂的反应体系的吸光值;Aj,用蒸馏水代替自由基溶液的反应体系的吸光值;Ac,70%乙醇代替多酚溶液的反应体系的吸光值;Ab,不含样品和自由基溶液的反应体系的吸光值。
1.3.4.2 DPPH自由基清除能力测定
参照文献[11]的方法,取50 μL不同浓度样品或抗坏血酸与150 μL 0.15 mmol/L DPPH溶液于96孔酶标板中室温避光反应30 min,测定样品在517 nm处的吸光值,然后参照公式(1)计算清除率。
1.3.5 抗糖尿病活性分析
1.3.5.1 α-葡萄糖苷酶抑制活性
参考ZHANG等[12]的方法测定PPE及其萃取组分的α-葡萄糖苷酶抑制活性。取50 μL不同浓度样品或阿卡波糖溶液与50 μL 0.1 U/mL的α-葡萄糖苷酶溶液反应10 min,加入50 μL 5 mmol/L pNPG溶液室温反应30 min,最后加入100 μL 0.2 mol/L Na2CO3溶液终止反应,于405 nm波长下测其吸光值AS。α-葡萄糖苷酶抑制率按公式(2)计算:
α-葡萄糖苷酶清除能力![]()
(2)
式中:Ac,控制组吸光度值;Aj,样品空白组吸光度值。
1.3.5.2 DPP-4抑制活性
参考PRASANNARAJA等[13]的方法。取50 μL样品和40 μL 2.5 μg/mL DPP-4常温孵育10 min,加入20 μL 5 mmol/L的N-甘氨酰脯氨酰-对硝基苯胺盐酸盐反应30 min,最后加入100 μL 0.1 mol/L的NaHCO3溶液终止反应,于405 nm下测定其吸光值AS,以西他列汀作为标品,用缓冲盐代替酶作为样品空白,以体积分数70%乙醇代替样品为控制组,参照公式(2)计算抑制率。
1.3.5.3 人肝癌细胞(HepG2)葡萄糖消耗实验
(1)细胞毒性实验
HepG2细胞用完全培养基(DMEM高糖培养基含体积分数10%胎牛血清,体积分数1%青霉素-链霉素混合液)在37 ℃、5% CO2培养至对数生长期,胰蛋白酶消化后,取100 μL HepG2细胞(2×105个/mL)于96孔细胞板中,培养24 h后,加入10 μL不同浓度样品处理24 h,同时添加相同体积PBS为对照组。最后采用CCK-8实验评价细胞存活率。按公式(3)计算细胞存活率:
存活率![]()
(3)
(2)HepG2 胰岛素抵抗(HepG2-insulin resistance, IR-HepG2)细胞模型建立及葡萄糖吸收测定
参考ZHANG等[14]的方法测定样品的促葡萄糖吸收的能力。取100 μL密度为2×105个/ mL的对数期生长的细胞于96孔细胞板中,37 ℃、5% CO2培养12 h,PBS清洗3次后,正常组更换完全培养基,IR组更换为含胰岛素(5×10-7 mol/L)的无血清DMEM培养液,继续培养36 h。PBS清洗3次后,正常组和正常组对照(无细胞)更换完全培养基,IR组和IR组对照组(无细胞)更换含体积分数1%抗生素、体积分数10% PBS的DMEM培养液,IR组细胞分为模型组和实验组。正常组、正常组对照、IR对照组和模型组添加10 μL PBS,实验组分别添加樱桃李提取物(终质量浓度为32.1 μg/mL),二甲双胍作为阳性对照组。37 ℃、5% CO2培养箱中培养24 h后,采用葡萄糖试剂盒测定上清液中的葡萄糖含量,葡萄糖吸收量参照公式(4)、公式(5)计算:
葡萄糖浓度/(mmol/L)=(A待测-A标准)×5.55
(4)
葡萄糖消耗量/(mmol/L)=空白组葡萄糖浓度-待测组葡萄糖浓度
(5)
1.3.5.4 抗糖基化能力测定
参考PENG等[15]方法制备糖基化反应体系,然后用0.1 mol/L pH 7.4的PBS稀释10倍,在激发波长340 nm和发射波长420 nm处测定其荧光强度。激发与发射波长的狭缝宽度为2.5 nm,电压为700 V,扫描速率为1 200 nm/min。晚期糖基化终产物(advance glycation end products,AGEs)形成抑制率按公式(6)计算:
抑制率![]()
(6)
式中:FIs,含有HSA、葡萄糖和提取物的实验组的荧光强度;FIc、FIb和FInb分别为控制组、空白组和样品空白组的荧光强度。
1.3.6 野生樱桃李EAF的鉴定
采用HPLC-QTOF-MS/MS技术对PPE的EAF中的主要化学成分进行分析。
色谱条件:ZORBAX·SB-C18色谱柱(4.6 mm×250 mm,5 μm);柱温30 ℃,进样量10 μL;检测波长190~600 nm;流速:0.5 mL/min;流动相A为0.1%甲酸-水,流动性B为乙腈;洗脱条件:0 min,5% B;5 min,25% B;30 min,65% B;31~35 min 95% B;36~45 min,15% B。
质谱条件:ESI离子源,负离子模式,一级质谱扫描范围为100~2 000 Da,二级质谱碰撞能量范围为(40±20) eV,载气压力50 psi,毛细管电压-4.5 kV,离子源温度550 ℃,簇电位-80 V,雾化气N2和干燥气N2压力50 psi。
1.3.7 数据处理
所有实验均重复3次,实验数据以平均值±标准偏差表示。采用IBM SPSS Statistics 26软件对数据进行单因素方差分析(one-way analysis of variance,ANOVA),并用Tukey 检验进行数据间的显著性分析(P<0.05)。采用Pearson相关性系数分析活性成分与生物活性之间的相关性。
2 结果与分析
2.1 PPE醇提物及其萃取组分总酚和总黄酮含量分析
如表1所示,不同萃取组分样品的总酚和总黄酮含量差异明显(P<0.05),其中EAF组分的总酚和总黄酮含量显著高于其他组分(P<0.05),其含量分别为219.27 mg GAE/g E和165.58 mg QuE/g E,是WF组分的2.2倍和3.3倍,相比于PCE组分分别提高了60.18 mg GAE/g E和72.5 mg QuE/g E。以上实验结果表明萃取能有效富集PPE中的多酚和黄酮类化合物,其中乙酸乙酯的富集效果最佳。这可能是由于乙酸乙酯的极性与多酚和黄酮类物质的极性相似,而糖类等大极性的物质易富集在水相[16]。
表1 PPE提取物及其萃取组分的总酚、总黄酮含量和自由基清除能力及酶抑制活性的IC50值
Table 1 Total phenolics and total flavonoids content, IC50 values for the radical scavenging and enzymes inhibition activities of PPE extracts and its fractions
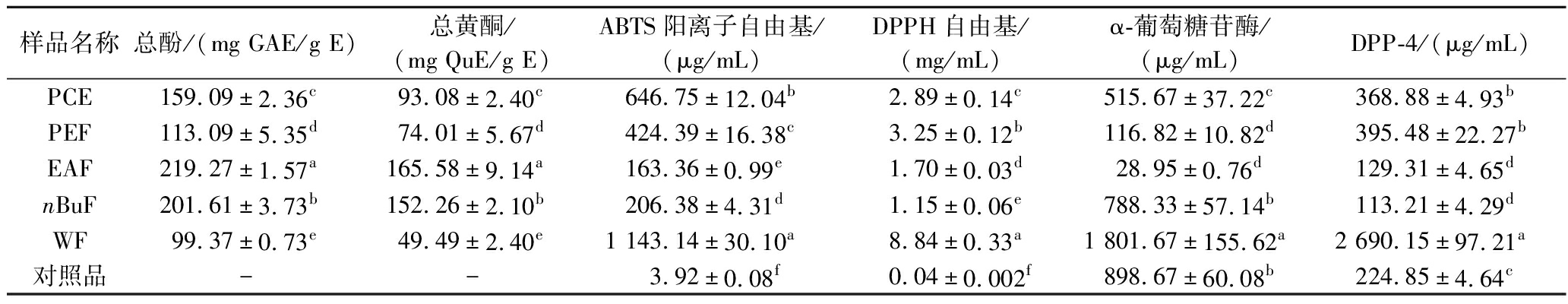
样品名称总酚/(mg GAE/g E)总黄酮/(mg QuE/g E)ABTS阳离子自由基/(μg/mL)DPPH自由基/(mg/mL)α-葡萄糖苷酶/(μg/mL)DPP-4/(μg/mL)PCE159.09±2.36c93.08±2.40c646.75±12.04b2.89±0.14c515.67±37.22c368.88±4.93bPEF113.09±5.35d74.01±5.67d424.39±16.38c3.25±0.12b116.82±10.82d395.48±22.27bEAF219.27 ±1.57a165.58±9.14a163.36±0.99e1.70±0.03d28.95±0.76d129.31±4.65dnBuF201.61±3.73b152.26±2.10b206.38±4.31d1.15±0.06e788.33±57.14b113.21±4.29dWF99.37±0.73e49.49±2.40e1 143.14±30.10a8.84±0.33a1 801.67±155.62a2 690.15±97.21a对照品--3.92±0.08f0.04±0.002f898.67±60.08b224.85±4.64c
注:同一列不同小写字母表示样品间有显著性差异(P<0.05)。
2.2 PPE醇提物及其萃取组分抗氧化活性分析
细胞响应外界刺激和细胞自身代谢过程中均会产生自由基,但自由基的过度产生会导致细胞损伤和蛋白质、DNA等的功能障碍,从而引起糖尿病、癌症和衰老等疾病[17]。因此,本研究通过分析DPPH和ABTS阳离子自由基清除能力来评估PPE醇提物及其萃取组分的抗氧化活性。并对PPE提取物酚含量、黄酮含量、抗氧化能力和降血糖活性进行相关性分析,结果如表2所示。
表2 PPE提取物总酚和总黄酮含量、抗氧化能力和降血糖活性之间的相关性系数表
Table 2 Correlation coefficient among total phenolics and flavonoids contents, antioxidant and hypoglycemic activities of PPE extracts
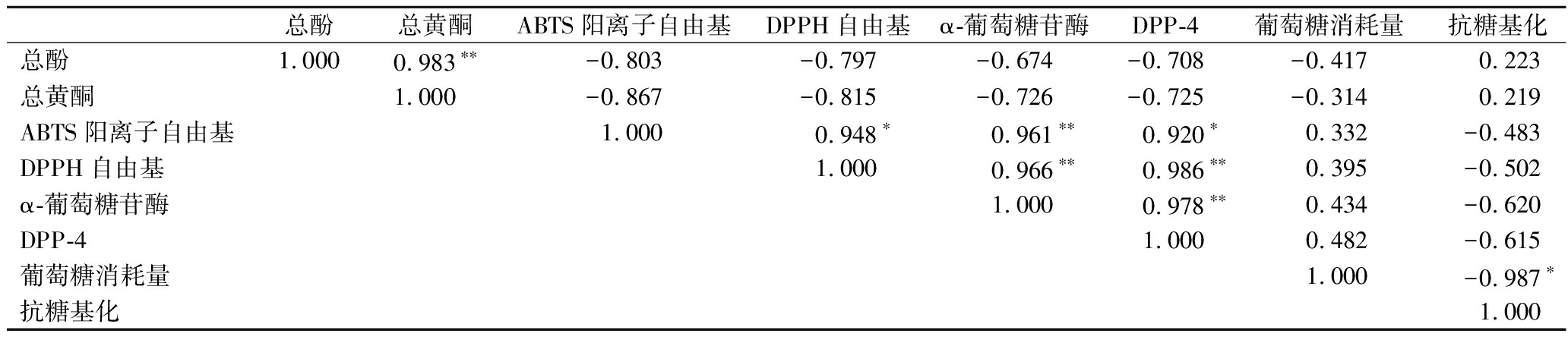
总酚总黄酮ABTS阳离子自由基DPPH自由基α-葡萄糖苷酶DPP-4葡萄糖消耗量抗糖基化总酚1.0000.983∗∗-0.803-0.797-0.674-0.708-0.417 0.223总黄酮1.000-0.867-0.815-0.726-0.725-0.3140.219ABTS阳离子自由基1.0000.948∗0.961∗∗0.920∗0.332-0.483DPPH自由基1.0000.966∗∗0.986∗∗0.395-0.502α-葡萄糖苷酶1.0000.978∗∗0.434-0.620DPP-41.0000.482-0.615葡萄糖消耗量1.000-0.987∗抗糖基化1.000
注:*表示相关性显著(P<0.05);**表示相关性极显著(P<0.01)。
2.2.1 ABTS阳离子自由基清除活性分析
如图1-a和表1所示。随样品浓度的升高,其清除能力不断增强,呈现出明显的剂量效应,且不同萃取组分的抗氧化活性存在显著性差异(P<0.05)。EAF的抗氧化活性最强,IC50值为163.36 μg/mL,其次是nBuF,IC50值为206.38 μg/mL,WF的清除能力最弱,IC50值为1 143.14 μg/mL。相关性结果表明PPE多酚和黄酮对其抗氧化活性有重要的贡献,清除能力与总酚和总黄酮的相关性系数分别为0.803和0.867,ZHANG等[14]研究表明白芍提物乙酸乙酯萃取组分也具有最强的ABTS阳离子自由基清除能力,与本研究结果一致。
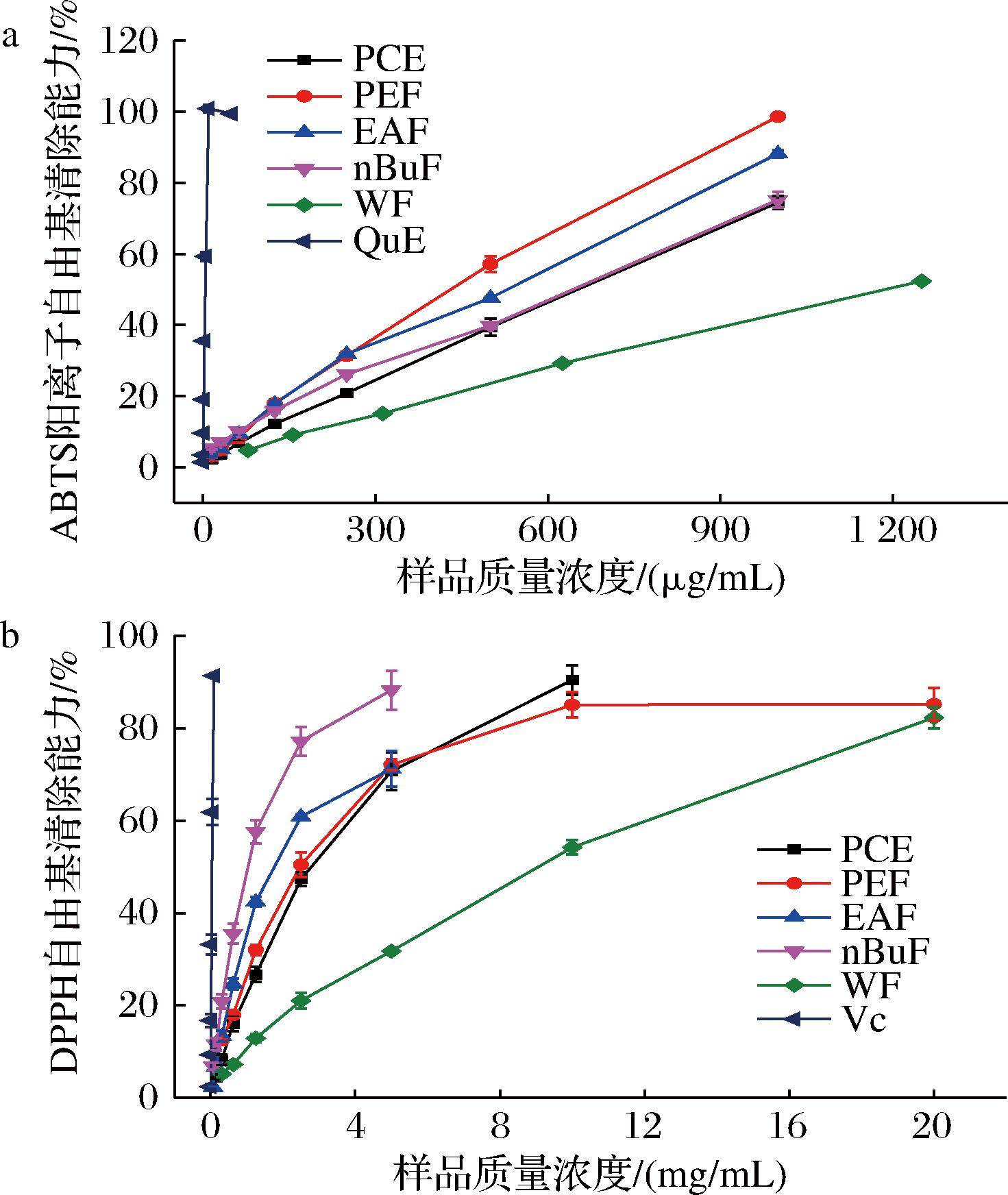
a-ABTS阳离子自由基;b-DPPH自由基
图1 PPE醇提物及其萃取组分自由基清除能力评价
Fig.1 Free radical scavenging ability of PPE extract and its fractions
2.2.2 DPPH自由基清除活性分析
如图1-b和表1所示,每个组分都具有较强的DPPH自由基的清除能力,且呈现出剂量效应。PPE醇提物及萃取组分的DPPH自由基清除能力强弱顺序为:nBuF>EAF>PEF>PCE>WF,且各组分间抗氧化能力差异显著(P<0.05)。nBuF的抗氧化活性最强,IC50值为1.15 mg/mL,其抗氧化活性是WF的8倍。相关性分析结果发现PPE醇提物及萃取组分的DPPH自由基清除能力与总酚和总黄酮含量呈高度相关,相关系数分别为0.796和0.815。以上结果表明多酚和黄酮是PPE中的主要抗氧化剂,且乙酸乙酯和正丁醇萃取能很好的富集PPE中抗氧化成分。另外,PPE中含有原花青素类化合物和槲皮素衍生物,该类化合物是潜在的抗氧化剂,其可能对PPE的抗氧化活性有重要的贡献[7,18]。
2.3 PPE醇提物及萃取组分降血糖活性分析
2.3.1 α-葡萄糖苷酶抑制活性分析
α-葡萄糖苷酶存在于肠细胞腔面,是促使双糖水解裂解成单糖重要的酶,抑制其活性能够延缓碳水化合物的吸收,从而降低餐后血糖。如图2-a所示,PPE醇提物及萃取组分均显示出较强的α-葡萄糖苷酶抑制能力,且表现出浓度依赖性。除WF外,所有组分的降血糖活性都显著高于阳性对照阿卡波糖,表明PPE是α-葡萄糖苷酶抑制剂的优质来源。EAF有最高的α-葡萄糖苷酶抑制能力,IC50值为28.95 μg/mL,其活性是阿卡波糖(898.67 μg/mL)的31倍,其次是PEF,IC50值为116.82 μg/mL,WF活性最低。PPE醇提物及萃取组分的α-糖苷酶抑制能力与总黄酮含量的相关系数为0.726,表明黄酮是PPE中的主要α-葡萄糖苷酶抑制剂。ZHU等[19]研究发现槲皮素衍生物具有很强的α-葡萄糖苷酶抑制活性,其在PPE果实中的含量高,可能起到关键的作用。
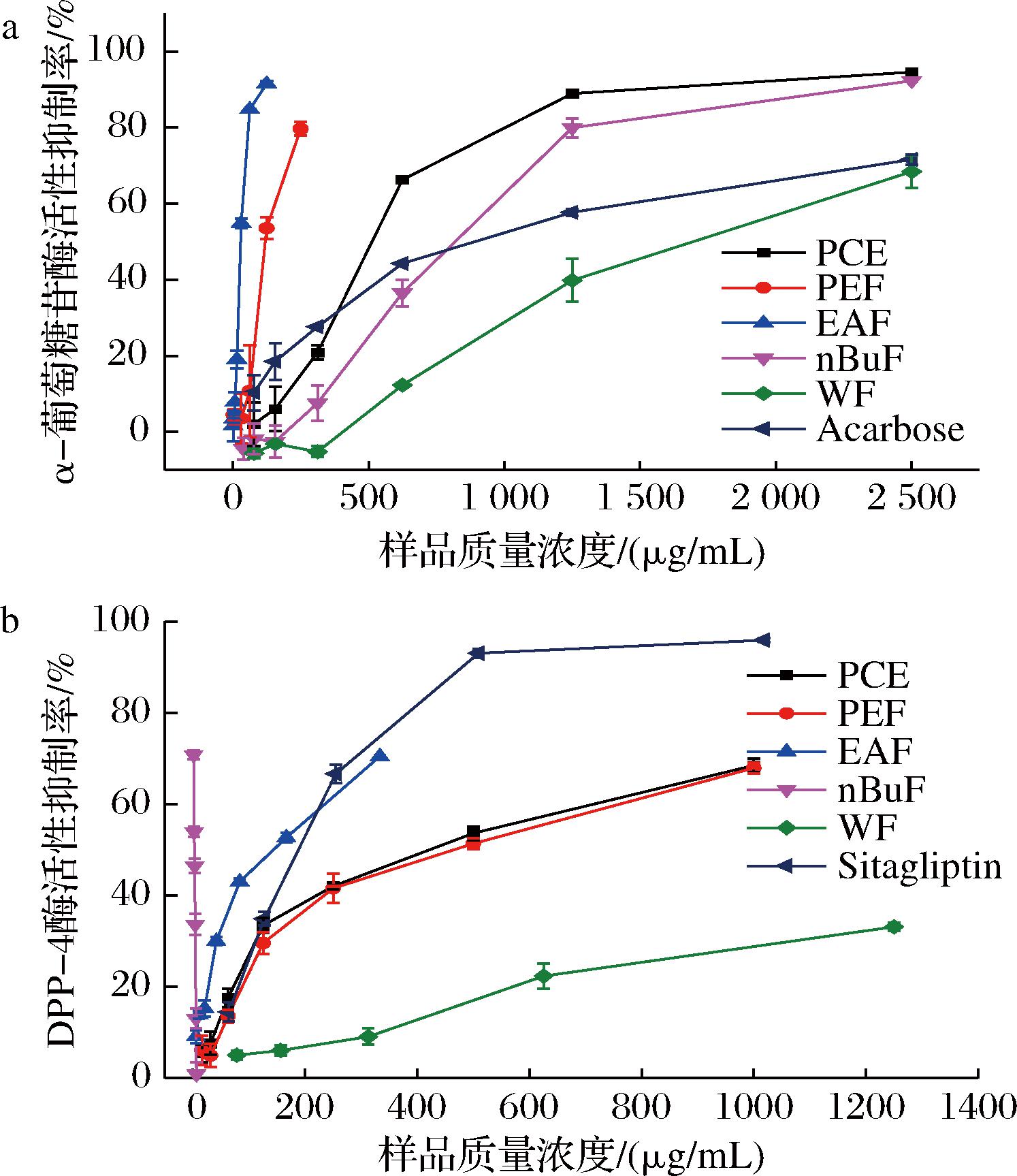
α-葡萄糖苷酶;b-DPP-4
图2 PPE醇提物及萃取组分的降血糖活性
Fig.2 Blood glucose lowering activities of PPE extract and its fractions
2.3.2 二肽基肽酶4(dipeptidyl peptidase-4,DPP-4)抑制活性分析
DPP-4是以二聚体形式存在的高特异性丝氨酸蛋白酶,抑制DPP-4的活性能增强胰高血糖素样肽活性,进而提高葡萄糖耐受水平,达到降血糖的目的,但目前已上市的DPP-4抑制剂会引起胰腺炎和超敏等不良反应,因此挖掘新型DPP-4抑制剂是当前的热点[20]。如图2-b所示,PPE醇提物及其萃取组分均有一定的DPP-4抑制能力,且呈现出剂量效应。nBuF的活性最高(IC50=113.21 μg/mL),其次是EAF(IC50=129.31 μg/mL)、PCE(IC50=368.88 μg/mL)和PEF(IC50=395.48 μg/mL),WF的活性最弱。PEF和EAF的DPP-4抑制活性显著高于阳性对照西他列汀(224.85 μg/mL)和醇提物。Pearson相关性分析表明PPE的DPP-4抑制能力与其总酚含量(r=0.708)和总黄酮含量(r=0.725)的相关性较高,说明PPE中的多酚和黄酮是主要的DPP-4抑制成分。果蔬中花青素类化合物是优质的DPP-4抑制剂来源,PPE中的花青素可能对其DPP-4抑制能力起到重要的作用[20]。
2.3.3 HepG2细胞葡萄糖消耗量分析
胰岛素抵抗是糖尿病的典型特征,HepG2细胞是构建胰岛素抵抗模型的最佳细胞系,葡萄糖消耗是细胞摄取和利用葡萄糖能力及胰岛素敏感性的重要指标[21],因此可通过测定样品的促HepG2细胞葡萄糖吸收能力评价其降血糖活性。首先,通过CCK-8法分析了PPE样品和二甲双胍(Met, 250 μg/mL)对HepG2细胞的损伤能力,以排除假阳性。如图3-a所示,样品浓度<62.5 μg/mL时,细胞存活率均大于85%,表明样品对HepG2细胞无毒无害。如图3-b所示,模型组细胞的葡萄糖消耗量显著低于控制组(P<0.05),表明IR-HepG2模型建立成功。与Mod组相比,经EAF和nBuF处理IR-HepG2细胞的葡萄糖摄取显著增加(P<0.05),其增加量分别为1.14和1.03 mmol/L,其与Met组无显著性差异。同时,PCE和WF与Mod组葡萄糖吸收量无显著差异(P>0.05)。以上结果表明EAF和nBuF具有较强的促进HepG2细胞葡萄糖吸收能力,降血糖效果显著。桑葚和PPE均属于浆果,研究表明桑葚中的花青素提取物能显著促进HepG2细胞的葡萄糖吸收,与本研究结果一致,PPE中的花青素可能也有重要的贡献[22]。
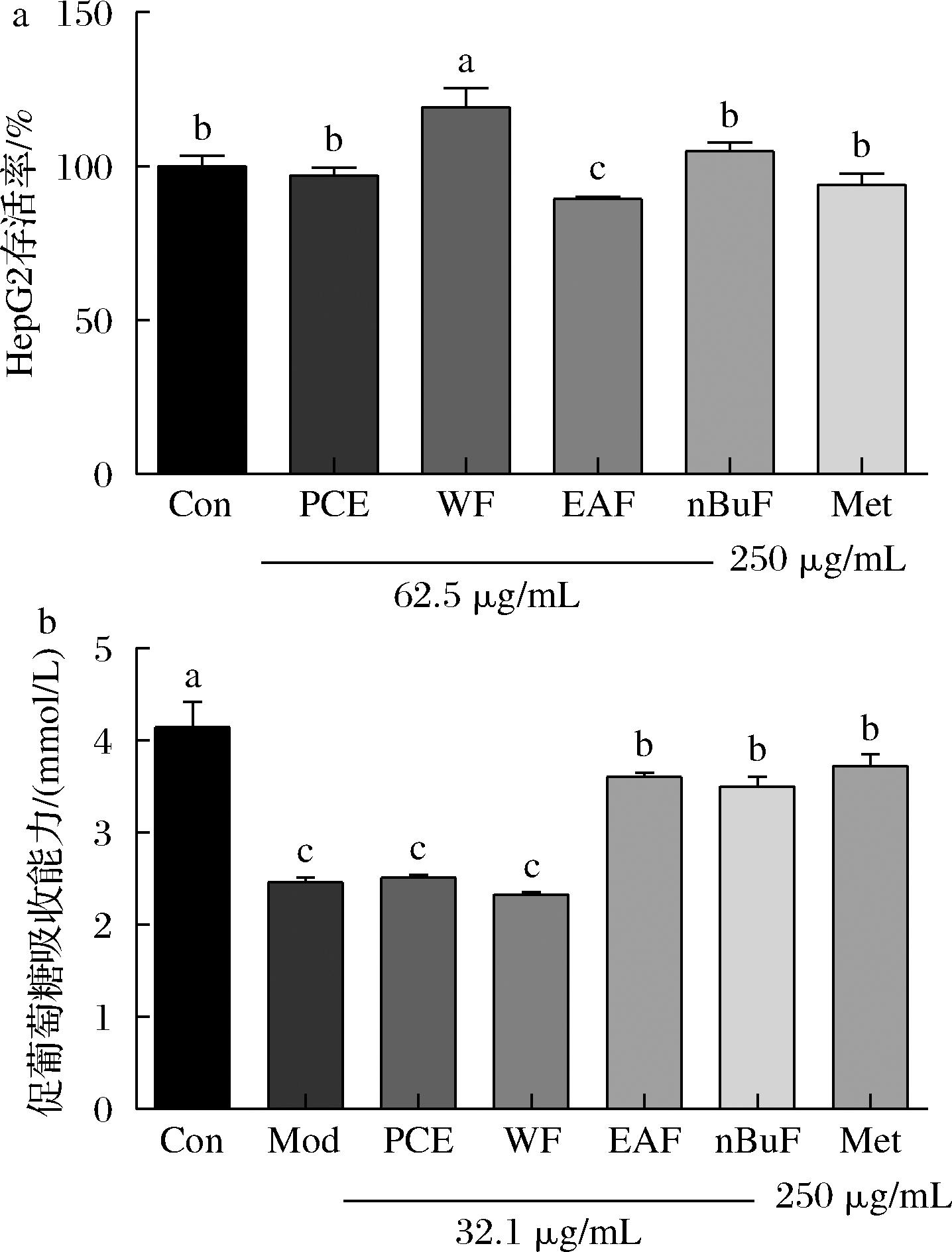
a-HepG2存活率;b-促葡萄糖吸收能力
图3 PPE醇提物及其萃取组分的HepG2细胞毒性和促葡萄糖吸收能力
Fig.3 The cytotoxicity and promotion on glucose absorption of PPE extract and its fractions on HepG2 cells
注:不同小写字母表示样品间有显著性差异(P <0.05)(下同)。
2.3.4 抗糖基化活性分析
糖基化反应又称非酶糖基化反应,是还原糖的羧基与蛋白质或肽的游离氨基之间的亲核加成反应。过量的AGEs对细胞和组织有害,会引发视网膜病变和肾病等多种糖尿病并发症[23],抑制AGEs的形成是预防和治疗糖尿病并发症的重要途径之一。如图4所示,当PPE醇提物及萃取组分浓度为0.2 mg/mL时,EAF具有最强的AGEs形成抑制活性,其次是PEF组分,其抑制率均高于30%,且抑制能力分别是WF的4.26和4.11倍。以上表明PEF和EAF是潜在的抗糖基化抑制剂来源,这可能与其具有较高的总酚和总黄酮含量有关。槲皮素、表儿茶素、儿茶素和绿原酸等多酚已被证明具有很强的糖基化抑制活性,其可能是PPE中主要的糖基化抑制剂[24]。
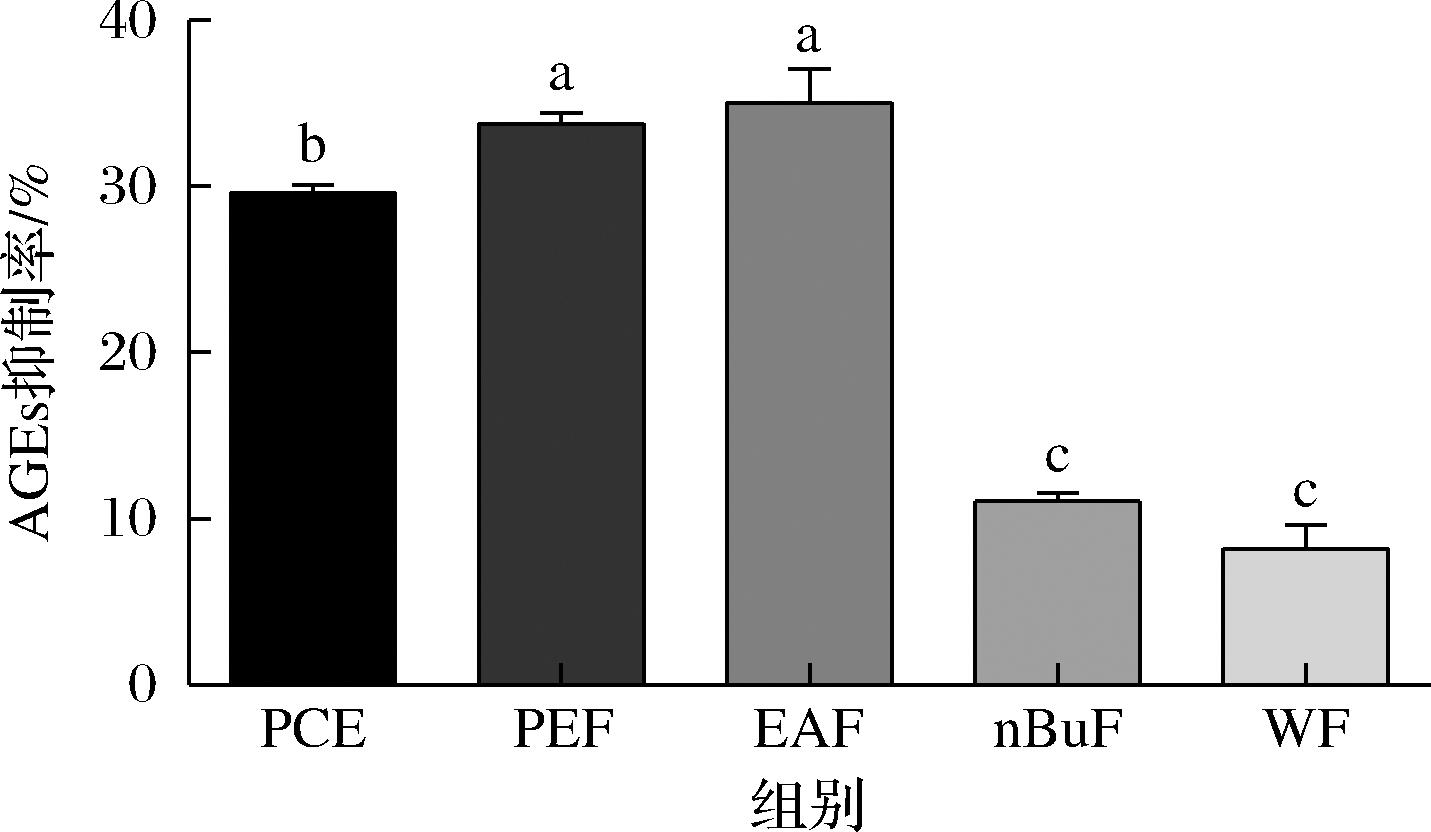
图4 PPE醇提物及萃取组分抑制血清蛋白糖基化的能力
Fig.4 Inhibitory ctivity of PPE extract and its fractions on human serum albumin glycation
2.4 EAF中主要化合物鉴定
EAF中的总酚含量最高且活性最强,因而采用HPLC-QTOF-MS/MS对其主要化学成分进行分析。采用Peakview软件对质谱数据进行分析,EAF负离子模式下的基峰色谱图如图5所示,初步鉴定的化合物及其保留时间、分子离子峰、特征碎片离子、化学式等信息见电子增强出版附件表1(https://doi.org/10.13995/j.cnki.11-1802/ts.039997)。利用Chemspider、PubChem和Massbank等数据库,结合相关文献对化合物的分子式、相对分子质量和MS/MS碎片进行比对分析,对化合物的结构进行初步鉴定。从EAF组分中共鉴定出43个化合物,包括12个有机酸、9个酚酸、16个黄酮类化合物和6个其他化合物。
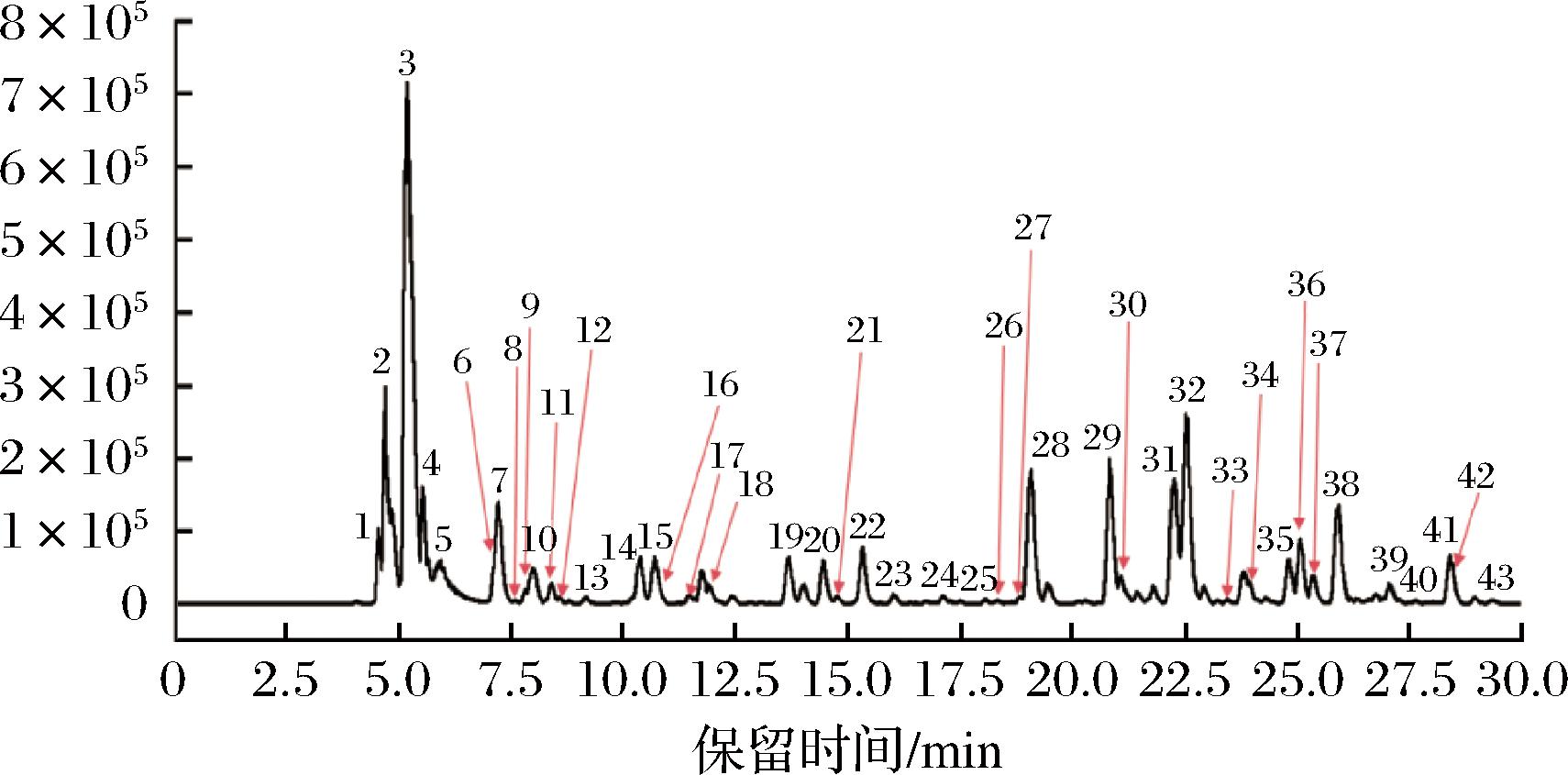
图5 PPE的EAF基峰色谱图
Fig.5 The base peak chromatogram of EAF of PPE
2.4.1 有机酸
有机酸的典型裂解碎片有[M-CO2]-,[M-H2O]-,[M-H2O-CO2]-和[M-H2O-CO]-,当有机酸中含有己糖和戊糖结构时,也可以检测到162 Da和132 Da分子量的损失[12]。化合物2、3、4和5的二级质谱及碎裂模式如图6-a、6-b、6-c和6-d所示。化合物2分子式为C7H12O6,分子离子峰m/z 为191.056 3,特征碎片离子包括m/z 173、127和85,分别表示[M-OH-H]-、[M-2H2O-CO-H]-和[M-C3H6O4-H]-片段,与奎宁酸的裂解方式相同,因此被鉴定为奎宁酸。化合物3被鉴定为苹果酸,其特征碎片离子m/z 115和71,分别对应[M-H2O-H]-和[M-H2O-CO2-H]-片段。化合物4被鉴定为柠檬酸,其母离子为m/z 191,特征碎片离子m/z 111由母离子脱去一分子的H2O、-COOH和-OH产生,相同地,化合物5被鉴定为柠苹酸[12]。化合物1的分子离子[M-H]-为m/z 179.100 0,通过计算分子式为C6H11O6,从而被鉴定为己糖[25]。化合物10的母离子为m/z 205,其特征碎片离子m/z 173和m/z 111表明化合物为2-甲基柠檬酸。通过与文献报道的分子离子、分子式和特征碎片离子对比,化合物12、14和15分别被鉴定为泛酸[26]和羟甲基戊二酸[27]。

a-奎宁酸;b-苹果酸;c-柠檬酸;d-柠苹酸;e-香草酸葡萄糖苷;f-3-O-阿魏酰葡萄糖苷;g-原儿茶酸;h-原儿茶酸-3-葡萄糖苷;i-槲皮素;g-芦丁;k-槲皮素-3-O-己糖苷;l-山奈酚-3-O-戊糖苷
图6 化合物分子二级质谱离子碎片及裂解模式
Fig.6 MS/MS spectra and fragmentation patterns of different compounds
2.4.2 酚酸
从EAF中鉴定出9个酚酸类化合物,部分化合物的MS/MS碎片及裂解模式如图6所示。化合物8的m/z 为169.014 3,通过与文献对比鉴定为没食子酸[28];化合物11被鉴定为香草酸-葡萄糖苷,其分子离子峰为m/z 329.088 0,特征碎片离子m/z 167.037 6、152.012 2、123.047 6依次由母离子丢失—C6H10O5、—CH3、CO部分产生[26]。化合物13([M-H]-,m/z 315.072 4)被鉴定为原儿茶酸-3-葡萄糖苷,裂解方式如图6-H所示,碎片离子m/z 153.022 2和109.030 9依次由母离子丢失一分子的葡萄糖(162 Da)和一分子的CO2(44 Da)产生。化合物18(m/z 153.019 4,C7H6O4)被鉴定为原儿茶酸子峰为167.034 9,特征碎片离子m/z 108[M-H-CH3-CO2]-表示化合物中存在甲基(-15 Da)和羧基(-44 Da),因此被鉴定为香草酸[29];化合物16([M-H-CO2]-,C16H18O9)分子离子峰为m/z 353.087 5,特征碎片离子峰m/z 191.058 6[奎宁酸-H]-由母离子失去162 Da的咖啡酰基所产生,因此被鉴定为咖啡酰奎宁酸。此外对于咖啡酰奎宁酸类化合物,当特征碎片离子m/z 173.05为基峰时,表明咖啡酰基链接在4-OH位上,而以191.06为基峰时,表明咖啡酰基链接在3-OH或5-OH,当同时存在191.06和179.03的碎片离子时,表明咖啡酰基更有可能链接在3-OH,因此化合物22被鉴定为3-O-咖啡酰奎宁酸;同理化合物19被鉴定为3-O-香豆酰奎宁酸[27];化合物21被鉴定为3-O-阿魏酰奎宁酸[30]。化合物27([M-H]-,m/z 385.114 1)的分子式为C17H22O10,被鉴定为芥子酸-己糖[29],特征碎片离子m/z 267.073 4[M-C6H10O5-H]-表示结构中存在芥子酸和己糖基(162 Da)部分。
2.4.3 黄酮
黄酮类化合物一般以糖苷的形式存在,其碎裂方式通常以糖部分的丢失,如己糖(-162 Da)、戊糖(-132 Da)、鼠李糖(-146 Da)、葡萄糖醛酸(-176 Da)、鼠李糖基己糖(-308 Da)等,使特征苷元离子释放出来,如槲皮素(301.03 Da)、山柰酚(285.04 Da)、异鼠李素(315.01 Da)、芹菜素(269.04 Da)和杨梅素(317.03 Da)[31]。化合物20(m/z 401.1487)的分子式为C18H26O10,特征碎片离子m/z 269.105 6([芹菜素-H]-)对应其苷元结构,由母离子丢失一分子的戊糖苷(132 Da)所产生,因此鉴定为芹菜素[29]。化合物29被鉴定为芦丁,二级质谱图及其碎裂模式如图6-J所示,特征碎片离子m/z 301.04([槲皮素-H]-)由[M-H]-离子m/z 609.15丢失一分子中性葡萄糖(162 Da)和一分子鼠李糖(146 Da)产生[29];同理,化合物31([M-H]-、m/z 463.089 2)、33([M-H]-、m/z 433.078 9)、34([M-H]-、m/z 409.149 5)、37([M-H]-、m/z 447.093 4)分别被鉴定为槲皮素-3-O-己糖苷、槲皮素-3-O-戊糖苷、槲皮素-3-O-新橙皮苷、槲皮素-3-O-鼠李糖苷[27],其特征碎片离子m/z 301.04分别由母离子丢失己糖基(162 Da)、戊糖基(132 Da)、鼠李糖基(146 Da)和吡喃葡萄糖基(162 Da)、鼠李糖基(146 Da)所产生。化合物43被鉴定为槲皮素[29],特征碎片离子m/z 273.037 4、m/z 179.000和m/z 151.004 7分别表示[M-H-CO]-、0,4B-和1,3A-结构单元;化合物40、41和42被鉴定为山奈酚-3-O-戊糖苷、山奈酚-3-O-鼠李糖苷和山奈酚-3-O-己糖苷[25],特征碎片离子m/z 285.04分别对应母离子丢失戊糖基(132 Da)、鼠李糖基(146 Da)和己糖基(162 Da)部分产生的片段。与文献对比,化合物38分别被鉴定为Cinchonain Id[11]。化合物36(C15H13O6)具有去质子化的分子离子m/z 289.072 4和特征碎片离子m/z 245.079 9和109.031 0,因此被鉴定为被儿茶素[28]。化合物23被鉴定为玫瑰苷[27]。
2.4.4 其他
化合物17的分子离子峰m/z 为313.093 6(C14H18O8),特征碎片离子m/z 269.107 6、161.048 1、101.025 7分对应[M-CH3-CO-H]-,[M-香草醛-H]-和[M-香草醛-C2H2O2-H]-片段,因此被鉴定为香草醛-4-O-葡萄糖苷。化合物28的碎片离子162对应于母离子葡萄糖基(162 Da)的断裂,因此被初步鉴定为Gardoside[28]。化合物30([M-H]-,m/z 359.134 6)的分子式为C16H24O9, 特征碎片离子m/z 197.084 0和153.094 4分别对应[M-H-Glu]-和[M-H-Glu-CO2]-碎片,因此被鉴定为脱氧甘草酸[32]。化合物35被鉴定为果糖基色氨酸。
共从EAF中鉴定出43个化合物,包括12个有机酸、9个酚酸、16个黄酮类化合物和6个其他化合物。其中己糖、奎宁酸、羟甲基戊二酸、柠苹酸、2-甲基柠檬酸、香草酸葡萄糖苷、泛酸、原儿茶酸-3-葡糖糖苷、香兰素-4-O-葡萄糖苷、3-O-香豆酰奎宁酸、3-O-阿魏酰奎宁酸、苄基戊糖基己糖苷、玫瑰苷、栀子花苷、山奈酸己苷、Gardoside、脱氧甘草酸和槲皮素-3-O-新橙皮苷首次从PPE中鉴定。鉴定的化合物中,部分化合物已被证明具有较好的降血糖活性,如槲皮素通过调节葡萄糖-6-磷酸酶和己糖激酶活性,从而降低糖尿病大鼠血糖值[33]。芦丁通过减少小肠对碳水化合物的吸收、抑制组织葡萄糖生成、增加组织葡萄糖摄取、刺激β细胞分泌胰岛素达到降血糖的目的[34]。CHOUDHARY等[35]的研究表明,没食子酸和儿茶素能显著抑制α-葡萄糖苷酶活性。
3 结论
通过对比研究PPE醇提物及其萃取组分的总酚和总黄酮含量,抗氧化、酶抑制和抗糖基化活性发现,EAF具有最高的总酚和总黄酮含量,其值分别为219.27 mg GAE/g E和165.58 mg QuE/g E,EAF同时具有最强的ABTS阳离子自由基清除能力、α-葡萄糖苷酶活性抑制能力、促IR-HepG2细胞葡萄糖摄取能力和抗糖基化能力,其中抑制α-葡萄糖苷酶活性的IC50值为28.95 μg/mL,约为阿卡波糖的31倍,32.1 μg/mL的EAF促IR-HepG2摄取葡萄糖的能力与250 μg/mL的二甲双胍相近。nBuF的DPPH自由基清除能力和DPP-4酶抑制能力最强,其IC50值分别为1.15 mg/mL和113.21 μg/mL。相关性分析表明,酚酸和黄酮是PPE中主要的抗氧化剂和降血糖成分。通过质谱分析共从EAF中鉴定出43个化合物,包括12个有机酸、9个酚酸、16个黄酮类化合物和6个其他化合物。因此,PPE是潜在的降血糖活性成分的来源,乙酸乙酯和正丁醇可用于富集PPE中的抗氧化和降血糖活性成分,本研究可为PPE的高值化利用提供理论和技术支持。
[1] SUN H, SAEEDI P, KARURANGA S, et al.IDF Diabetes Atlas:Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J].Diabetes Research and Clinical Practice, 2022, 183:109119.
[2] PICKERING R J, ROSADO C J, SHARMA A, et al.Recent novel approaches to limit oxidative stress and inflammation in diabetic complications[J].Clinical &Translational Immunology, 2018, 7(4):e1016.
[3] KANWAL A, KANWAR N, BHARATI S, et al.Exploring new drug targets for type 2 diabetes:Success, challenges and opportunities[J].Biomedicines, 2022, 10(2):331.
[4] ARTASENSI A, PEDRETTI A, VISTOLI G, et al.Type 2 diabetes mellitus:A review of multi-target drugs[J].Molecules, 2020, 25(8):1987.
[5] 刘影, 赵玉, 张相锋.新疆珍稀濒危植物野生樱桃李的研究进展[J].安徽农业科学, 2010, 38(22):11754-11756.LIU Y, ZHAO Y, ZHANG X F.Research advances in rare and endangered Prunus cerasifera Ehrh.[J].Journal of Anhui Agricultural Sciences, 2010, 38(22):11754-11756.
[6] WANG Y, CHEN X L, ZHANG Y M, et al.Antioxidant activities and major anthocyanins of Myrobalan plum (Prunus cerasifera Ehrh.)[J].Journal of Food Science, 2012, 77(4):C388-C393.
[7] 张静茹, 孙海龙, 陆致成, 等.野生樱桃李(Prunus cerasifera)果实多酚多样性分析[J].果树学报, 2017, 34(5):567-575.ZHANG J R, SUN H L, LU Z C, et al.Diversity analysis of phenolic in wild myrobalan plums(Prunus cerasifera)[J].Journal of Fruit Science, 2017, 34(5):567-575.
[8] 刘伟, 腊萍, 杨如箴, 等.野生樱桃李清除DPPH自由基能力及抑制α-葡萄糖苷酶活性[J].江苏农业科学, 2017, 45(17):183-185.LIU W, LA P, YANG R Z, et al.Scavenging ability of wild cherry plum to DPPH free radical and inhibiting α-glucosidase activity[J].Jiangsu Agricultural Sciences, 2017, 45(17):183-185.
[9] LIU W, NISAR M F, WAN C P.Characterization of phenolic constituents from Prunus cerasifera ldb leaves[J].Journal of Chemistry, 2020, 2020:5976090.[10] TAN J, WANG D S, LU Y, et al.Metabolic enzyme inhibitory abilities, in vivo hypoglycemic ability of palmleaf raspberry fruits extracts and identification of hypoglycemic compounds[J].Food Science and Human Wellness, 2023, 12(4):1232-1240.
[11] ZHANG L, TU Z C, XIE X, et al.Antihyperglycemic, antioxidant activities of two Acer palmatum cultivars, and identification of phenolics profile by UPLC-QTOF-MS/MS:New natural sources of functional constituents[J].Industrial Crops and Products, 2016, 89:522-532.
[12] ZHANG L, TU Z C, XIE X, et al.Jackfruit (Artocarpus heterophyllus Lam.) peel:A better source of antioxidants and α-glucosidase inhibitors than pulp, flake and seed, and phytochemical profile by HPLC-QTOF-MS/MS[J].Food Chemistry, 2017, 234:303-313.
[13] PRASANNARAJA C, KAMALANATHAN A S, VIJAYALAKSHMI M A, et al.A dipyrrole derivative from Aloe vera inhibits an anti-diabetic drug target dipeptidyl peptidase (DPP)-IV in vitro[J].Preparative Biochemistry &Biotechnology, 2020, 50(5):511-520.
[14] ZHANG L, PENG C Y, WANG P X, et al.Hypoglycemic and H2O2-induced oxidative injury protective effects and the phytochemical profiles of the ethyl acetate fraction from Radix Paeoniae Alba[J].Frontiers in Nutrition, 2023, 10:1126359.
[15] PENG C Y, ZHU H D, ZHANG L, et al.Urolithin A alleviates advanced glycation end-product formation by altering protein structures, trapping methylglyoxal and forming complexes[J].Food &Function, 2021, 12(23):11849-11861.
[16] 梅强根, 张露, 马天新, 等.鱼腥草水提物萃取组分抗氧化、抗糖尿病活性和化学组成分析[J].食品与发酵工业, 2023, 9(11):70-78.MEI Q G, ZHANG L, MA T X, et al.Antioxidant activity, anti-diabetic activity, and chemical composition of Houttuynia cordata water extract and its fraction[J].Food and Fermentation Industries, 2023, 9(11):70-78.
[17] KAUR C, KAPOOR H C.Antioxidants in fruits and vegetables- the millennium’s health[J].International Journal of Food Science and Technology, 2001, 36(7):703-725.
[18] 郭建峰, 郄浩然, 胡培毅, 等.沙棘籽粕低聚原花青素的制备及结构与抗氧化活性分析[J].中国食品学报, 2023, 23(6):232-245.GUO J F, QIE H R, HU P Y, et al.Preparation of oligomeric proanthocyanidins from seabuckthorn seed meal and analysis of structure and antioxidant activity[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(6):232-245.
[19] ZHU J Z, ZHANG B, TAN C, et al.α-Glucosidase inhibitors:Consistency of in silico docking data with in vitro inhibitory data and inhibitory effect prediction of quercetin derivatives[J].Food &Function, 2019, 10(10):6312-6321.
[20] KAZEEM M, BANKOLE H, OGUNRINOLA O, et al.Functional foods with dipeptidyl peptidase-4 inhibitory potential and management of type 2 diabetes:A review[J].Food Frontiers, 2021, 2(2):153-162.
[21] 刘世锋, 董文静, 杨兰, 等.灵芝多糖及其菌群代谢产物对HepG2细胞胰岛素抵抗的改善作用及机制[J].食品工业科技, 2023, 44(23):314-321.LIU S F, DONG W J, YANG L, et al.Improvement and mechanism of Ganoderma lucidum polysaccharides and its flora metabolites on insulin resistance in HepG2 cells[J].Science and Technology of Food Industry, 2023, 44(23):314-321.
[22] YAN F J, ZHANG J, ZHANG L X, et al.Mulberry anthocyanin extract regulates glucose metabolism by promotion of glycogen synthesis and reduction of gluconeogenesis in human HepG2 cells[J].Food &Function, 2016, 7(1):425-433.
[23] RAMASAMY R, VANNUCCI S J, DU YAN S S, et al.Advanced glycation end products and RAGE:A common thread in aging, diabetes, neurodegeneration, and inflammation[J].Glycobiology, 2005, 15(7):16R-28R.
[24] KHAN M, LIU H L, WANG J, et al.Inhibitory effect of phenolic compounds and plant extracts on the formation of advance glycation end products:A comprehensive review[J].Food Research International, 2020, 130:108933.
[25] ZHANG L, TU Z C, WANG H, et al.Comparison of different methods for extracting polyphenols from Ipomoea batatas leaves, and identification of antioxidant constituents by HPLC-QTOF-MS2[J].Food Research International, 2015, 70:101-109.
[26] ABU-REIDAH I M, CONTRERAS M M, ARR EZ-ROM
EZ-ROM N D, et al.Reversed-phase ultra-high-performance liquid chromatography coupled to electrospray ionization-quadrupole-time-of-flight mass spectrometry as a powerful tool for metabolic profiling of vegetables:Lactuca sativa as an example of its application[J].Journal of Chromatography A, 2013, 1313:212-227.
N D, et al.Reversed-phase ultra-high-performance liquid chromatography coupled to electrospray ionization-quadrupole-time-of-flight mass spectrometry as a powerful tool for metabolic profiling of vegetables:Lactuca sativa as an example of its application[J].Journal of Chromatography A, 2013, 1313:212-227.
[27] DE LA LUZ C DIZ-GURREA M, FERN
DIZ-GURREA M, FERN NDEZ-ARROYO S, JOVEN J, et al.Comprehensive characterization by UHPLC-ESI-Q-TOF-MS from an Eryngium bourgatii extract and their antioxidant and anti-inflammatory activities[J].Food Research International, 2013, 50(1):197-204.
NDEZ-ARROYO S, JOVEN J, et al.Comprehensive characterization by UHPLC-ESI-Q-TOF-MS from an Eryngium bourgatii extract and their antioxidant and anti-inflammatory activities[J].Food Research International, 2013, 50(1):197-204.
[28] QIAO X, HAN J, XU M, et al.Characterization of chemical constituents in Guan Xin II decoction by liquid chromatography coupled with electrospray ionization-mass spectrometry[J].Planta Medica, 2008, 74(14):1720-1729.
[29] AMMAR S, DEL MAR CONTRERAS M, BELGUITH-HADRICH O, et al.Assessment of the distribution of phenolic compounds and contribution to the antioxidant activity in Tunisian fig leaves, fruits, skins and pulps using mass spectrometry-based analysis[J].Food &Function, 2015, 6(12):3663-3677.
[30] ZENGIN G, MAHOMOODALLY M F, PAKSOY M Y, et al.Phytochemical characterization and bioactivities of five Apiaceae species:Natural sources for novel ingredients[J].Industrial Crops and Products, 2019, 135:107-121.
[31] ZHANG L, TU Z C, WANG H, et al.Metabolic profiling of antioxidants constituents in Artemisia selengensis leaves[J].Food Chemistry, 2015, 186:123-132.
[32] SALIDO S, PÉREZ-BONILLA M, ADAMS R P, et al.Phenolic components and antioxidant activity of wood extracts from 10 main Spanish olive cultivars[J].Journal of Agricultural and Food Chemistry, 2015, 63(29):6493-6500.
[33] OYEDEMI S O, NWAOGU G, CHUKWUMA C I, et al.Quercetin modulates hyperglycemia by improving the pancreatic antioxidant status and enzymes activities linked with glucose metabolism in type 2 diabetes model of rats: In silico studies of molecular interaction of quercetin with hexokinase and catalase[J].Journal of Food Biochemistry, 2020, 44(2):e13127.
[34] GHORBANI A.Mechanisms of antidiabetic effects of flavonoid rutin[J].Biomedicine &Pharmacotherapy, 2017, 96:305-312.
[35] CHOUDHARY D K, CHATURVEDI N, SINGH A, et al.Catechin isolated from faba beans (Vicia faba L.):Insights from oxidative stress and hypoglycemic effect in yeast cells through confocal microscopy, flow cytometry, and in silico strategy[J].Journal of Biomolecular Structure and Dynamics, 2022, 40(20):10470-10480.