人体尿酸水平会在一定范围内波动,若在不同天数两次空腹测得血尿酸水平均高于其饱和浓度420 μmol/L,即为高尿酸血症(hyperuricemia,HUA)[1]。近年来我国高血尿酸患病比例逐年走高,平均年龄逐年降低[2]。血尿酸水平若持续一段时间高于饱和浓度或者继续升高致HUA程度加重,约5%~12%比例的患者则会因尿酸单钠盐析出结晶而诱发痛风[3],引发急性关节疼痛及尿酸盐肾病、尿酸性尿路结石、肾功能衰竭等肾损伤症状[4]。HUA还会促进内分泌、心脑血管等疾病。黄嘌呤氧化酶(xanthine oxidase, XOD)是人体内尿酸生成的关键代谢酶,可催化次黄嘌呤生成黄嘌呤,并进一步生成尿酸。鉴于HUA的高发病率及危害,临床使用的别嘌呤醇(allopurinol,ALP)、非布索坦等药物就是通过抑制XOD活性达到降低血尿酸的治疗效果,但毒副作用较大[5-6]。因此开发安全性高的天然来源XOD活性抑制剂具有重要意义。
菊科菊三七属植物平卧菊三七[Gynura procumbens (Lour.) Merr.]是东南亚传统草药,部分国家和地区将其当作蔬菜食用,于2012年被国家卫生部收录为食品新原料,食用安全性高,没有毒理学风险[7-8]。平卧菊三七除了具有降血糖、降血脂、抗炎、抗菌、抗氧化等多种功效外,平卧菊三七醇提物能辅助控制痛风患者的血尿酸水平[9],并被制成固体饮料产品[10],但尚未有文献明确其抗痛风的具体功能成分[11]。
多数研究显示,绿原酸和黄酮是平卧菊三七的潜在功效成分[12-13]。绿原酸类(又称咖啡酰基奎尼酸类)和黄酮类是两类广泛存在于植物界的具有多种生理活性的次生代谢产物,安全性高。但绿原酸类和黄酮成分热稳定性差,高温煎煮法对其活性影响大[14]。超声波提取方法克服了煎煮、浸渍、渗漉等传统方法提取温度高、耗时长的缺点[15],比煎煮提取时间缩短2/3、提取率提高50%~500%[16],被广泛应用于提取各种植物天然功能成分。本文对平卧菊三七的降尿酸功能成分进行研究,鉴于潜在组分的热不稳定性,对超声波提取条件进行优化以获得XOD活性抑制率高的提取物,通过超高效液相色谱串联四级杆飞行时间质谱(ultra-high performance liquid chromatography-tandem quadrupole time of flight mass spectrometry, UPLC-Q/TOF-MS)分析提取物中主要功效成分,并以高血尿酸动物模型研究提取物降血尿酸水平和抗氧化、消炎作用,为其作为未来降血尿酸产品天然植物资源的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
干燥平卧菊三七叶原料,江西省丰城市;SPF级雄性KM小鼠,湖南斯莱克景达实验动物有限公司[许可证SCXK(湘)2019-0004];黄嘌呤(生化试剂),上海旭硕生物科技有限公司;XOD(25 U,生化试剂),美国Sigma公司;色谱纯乙腈、氧嗪酸钾,默克化工技术(上海)有限公司;生理生化指标检测和抗氧化酶活检测试剂盒,南京建成生物工程研究所;其他试剂均为国产分析纯。
1.2 仪器与设备
UV 5500PC型紫外可见分光光度计,上海分析仪器有限公司;AX224ZH/E电子分析天平,美国奥豪斯仪器常州有限公司;MK3酶标仪,芬兰Thermo Multiskan公司;KQ-400KDE超声波清洗器,昆山市超声仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;UPLC-Q/TOF-MS仪[配色谱柱Zorbax Eclipse Plus C18(2.1×100 mm,1.8 μm),配质谱6538 Q/TOF mass spectrometer,ESI源],安捷伦科技有限公司。
1.3 试验方法
1.3.1 平卧菊三七XOD活性抑制提取物的超声波提取制备
将干燥原料粉碎,过100目筛。取原料在一定条件下超声波提取,过滤,提取液浓缩,再用蒸馏水定容至一定体积,按文献[17]方法检测体外XOD活性抑制率。以XOD活性抑制率为评价指标,进行单因素实验和响应曲面法实验,得到优化的提取条件。以此条件提取,将提取液过滤,旋蒸浓缩,冻干保存,即为XOD活性抑制提取物(Gynura procumbens (Lour.) Merr. extract,GE)。
1.3.2 平卧菊三七GE的液质联用分析
采用UPLC-Q/TOF-MS分析提取物的物质成分。UPLC条件:进样体积10 μL,流动相A(0.1%甲酸水溶液)和B(乙腈)以流速0.3 mL/min、柱温45 ℃洗脱,比例设置如下:0~2 min,5% B;2~5 min,5%~10% B;5~23 min,10%~30% B;23~26 min,30%~55% B;26~33 min,55%~75% B;33~39 min,75%~90% B;39~44 min,90%~100% B;44~50 min,100% B;50~52 min,100%~5% B。以负离子模式检测;干燥载气 (N2) 流速 10 L/min;温度 325 ℃;雾化器压力 40 psi;毛细管电压 3 500 V;锥孔电压65 V;OCT RFV 750 V;碎裂电压 175 V;质荷比扫描范围30~1 200 m/z;宽度中等(约4 m/z)。
1.3.3 HUA动物喂养实验
GE水溶液经等体积的有机溶剂石油醚萃取除杂后,再以乙酸乙酯、水饱和正丁醇依次进行萃取,得到乙酸乙酯萃取物(GEA)和正丁醇萃取物(GEB)。各萃取相在旋干有机试剂后冻干,检测XOD抑制活性。由于XOD催化生成尿酸的同时还生成超氧阴离子自由基(·O2-),而多数天然产物具有抗氧化能力,这亦有助于HUA受损机体的恢复,因此也有必要检测提取物的·O2-清除能力[18]。
SPF 级雄性KM小鼠60只,适应期喂养后,随机平均分为6组。自由饮食,环境温度和光照时间按常规控制无特殊要求。实验周期共 2周,除空白组(Control)外,其余5组用次黄嘌呤500 mg/(kg·d)和氧嗪酸钾100 mg/(kg·d)在每天上午按时灌胃造模;造模同时,除模型组(Vehicle)外,阳性对照组(ALP)给予ALP 3 mg/(kg·d),平卧菊三七3个实验组分别灌胃给予GE、GEA、GEB 200 mg/(kg·d)。所有药物均以0.5%羧甲基纤维素钠(sodium carboxymethyl cellulose,CMC-Na)为溶剂溶解。整个实验过程中空白组每天灌胃相应体积的 0.5% CMC-Na。从处死前夜至处死当天禁食 12 h后,按前述剂量行最后一次灌胃,不禁水。于灌胃 1 h 后眼球取血,再脱颈致死,解剖,取完整器官称重,计算器官系数。采用试剂盒测定血液尿酸(uric acid,UA)、肌酐(creatinine,CRE)、尿素氮(blood urea nitrogen,BUN)和炎症因子水平,肝XOD活性、超氧化物歧化酶(superoxide dismutase,SOD)活性、过氧化氢酶(catalase, CAT)活性、丙二醛(malondialdehyde,MDA)含量。肾脏置于多聚甲醛组织固定液中处理后切片、苏木精-伊红染色进行观察。
1.3.4 数据处理
采用Design Expert 13.0软件设计和分析响应面数据,采用Excel绘图和分析。所有数据均为平行实验的平均值。
2 结果与分析
2.1 超声波提取条件优化
以XOD活性抑制率为评价指标,在单因素实验结果基础上,进行乙醇体积分数A、时间B和液料比C为影响因素的3因素3水平响应面试验,获得回归方程为:R=56.24-2.487 5A+0.737 5B-1.125C+0.225AB+2.55AC-1.2BC-9.032 5A2-2.582 5B2-3.357 5C2,模型的Prob>F为0.006 3,非常显著,失拟项值为0.935 9,说明不显著,可知该实验的相对误差较小,模型的选择合适。最佳提取条件:乙醇体积分数69%,提取时间51 min,液料比27∶1 (mL∶g),提取温度45 ℃,超声波功率240 W。重复3次实验,得到提取液的抑制率为(58.6±3.14)%,与预测值56.6%的相对标准偏差为3.53%。以此条件制备GE。
2.2 液质联用分析
对平卧菊三七GE进行UPLC-Q/TOF-MS液质联用分析,根据提取物各色谱峰的质谱信息及文献资料进行物质种类鉴定。令人注意的是,发现了多个具有共同的绿原酸物质裂解特征离子的质谱图。
图1-a是峰4的质谱图,m/z 353.1为分子离子峰[M-H]-,m/z 191.1处为脱去咖啡酰基的奎尼酸特征碎片离子[M-Caffeoyl group-H]-,m/z 707.2处出现具微弱信号的[2M-H]-,m/z 161.0为脱一个水分子的咖啡酸残基[Caffeic acid-H2O-H]-。与峰4相同,峰3、5、6的分子离子[M-H]-均为m/z 353.1,且m/z 191.1处存在奎尼酸特征碎片离子[M-Caffeoyl group-H]-,此外,峰6还有m/z 707.2处的碎片[2M-H]-,峰3的m/z 179.0处碎片离子为咖啡酸离子[Caffeic acid-H]-,峰5 的m/z 135.0碎片离子为咖啡酸脱羧基的残基碎片[Caffeic acid-COOH-H]-,均为单咖啡酰基奎尼酸物质(monoCQAs)裂解形成的特征碎片。依据文献在相同液质条件下monoCQAs洗脱出峰的顺序,将这4个组分依次确认为5-、3-、4-、1-咖啡酰基奎尼酸。
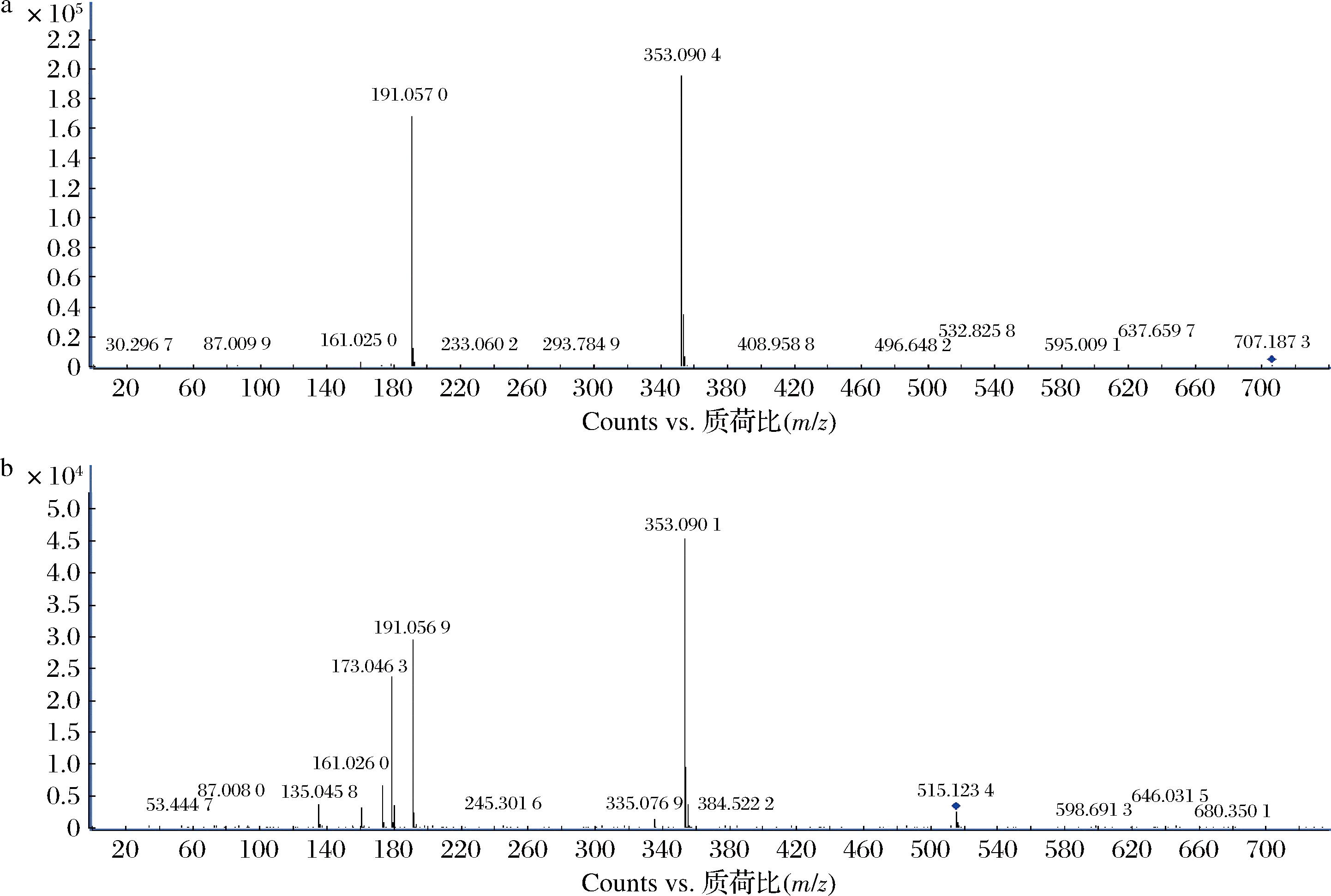
a-峰4的质谱图;b-峰14的质谱图
图1 两个绿原酸类组分的质谱图
Fig.1 Mass spectra of two chlorogenic acid components
图1-b峰14质谱图显示,m/z 515.1为分子离子峰[M-H]-,m/z 353.1为脱除一个咖啡酰基的单咖啡酰基奎尼酸碎片[M-Caffeoyl group-H]-,m/z 191.1处是脱去二个咖啡酰基的奎尼酸碎片峰[M-2 Caffeioyl groups-H]-,m/z 173.0为脱一个水分子的奎尼酸残基[Quinic acid-H2O-H]-,m/z 135.0是咖啡酰残基脱去羰基也即咖啡酸脱去羧基的碎片[Caffeic acid-COOH-H]-。峰15、16、17、18与峰14具有相同的m/z 515.1分子离子峰和m/z 353.1、m/z 191.1这二个特征离子峰,以及m/z 179.0特征离子峰,因此均为二咖啡酰基奎尼酸物质(dicaffeoylquinic acids, diCQAs),参照文献,将这5个组分依次确认为3,4-、3,5-、1,5-、4,5-和1,4-二咖啡酰基奎尼酸。
同时,根据文献的报道,峰20为槲皮素,其分子离子峰m/z 301.0;峰9、10、13均有共同碎片离子m/z 301.0,为槲皮素与不同糖基结合的物质;峰21山奈酚,分子离子峰为m/z 285.0;峰12分子离子峰m/z 593.2,有1个碎片离子m/z 285.0,为山奈酚的糖苷衍生物。
综上,鉴定出GE的主要组成物质共21个(表1),除没食子酸和奎尼酸及衍生物等5个有机酸外,从平卧菊三七GE中发现10个绿原酸类物质和6个黄酮类物质,包括单咖啡酰基奎尼酸4个、二咖啡酰基奎尼酸6个、槲皮素及糖苷4个、山奈酚及糖苷2个。MENG等[19]统计了已报道的107种平卧菊三七化学成分,包括3种单咖啡酰基奎尼酸、3种二咖啡酰基奎尼酸和1种三咖啡酰基奎尼酸。本文率先发现平卧菊三七中含有10种绿原酸类物质,完善了平卧菊三七的植物化学组成。
表1 GE的成分和质谱数据
Table 1 Components and mass spectral data of the XOD activity inhibiting extract
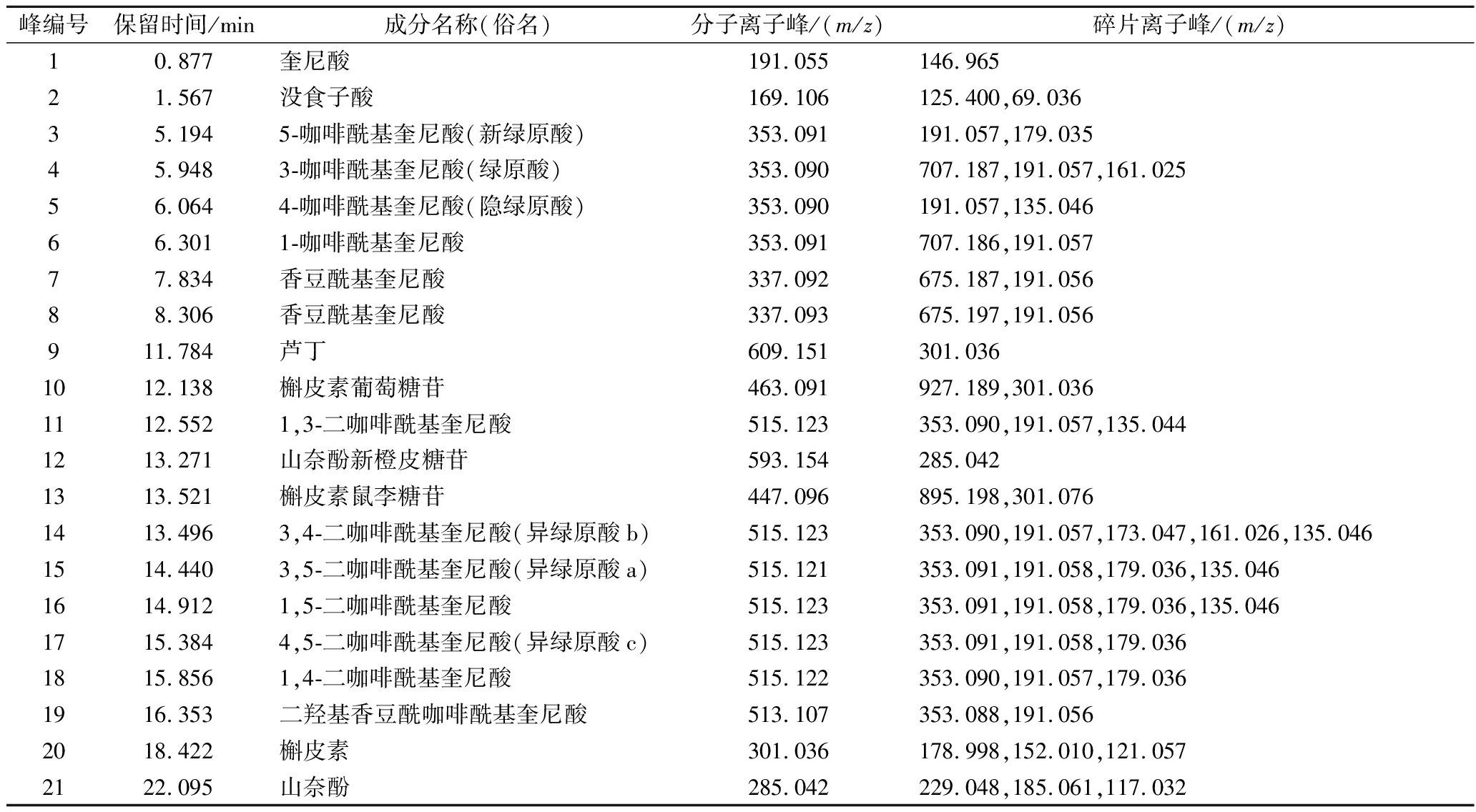
峰编号保留时间/min成分名称(俗名)分子离子峰/(m/z)碎片离子峰/(m/z)10.877奎尼酸191.055146.96521.567没食子酸169.106125.400,69.03635.1945-咖啡酰基奎尼酸(新绿原酸)353.091191.057,179.03545.9483-咖啡酰基奎尼酸(绿原酸)353.090707.187,191.057,161.02556.0644-咖啡酰基奎尼酸(隐绿原酸)353.090191.057,135.04666.3011-咖啡酰基奎尼酸353.091707.186,191.05777.834香豆酰基奎尼酸337.092675.187,191.05688.306香豆酰基奎尼酸337.093675.197,191.056911.784芦丁609.151301.0361012.138槲皮素葡萄糖苷463.091927.189,301.0361112.5521,3-二咖啡酰基奎尼酸515.123353.090,191.057,135.0441213.271山奈酚新橙皮糖苷593.154285.0421313.521槲皮素鼠李糖苷447.096895.198,301.0761413.4963,4-二咖啡酰基奎尼酸(异绿原酸b)515.123353.090,191.057,173.047,161.026,135.0461514.4403,5-二咖啡酰基奎尼酸(异绿原酸a)515.121353.091,191.058,179.036,135.0461614.9121,5-二咖啡酰基奎尼酸515.123353.091,191.058,179.036,135.0461715.3844,5-二咖啡酰基奎尼酸(异绿原酸c)515.123353.091,191.058,179.0361815.8561,4-二咖啡酰基奎尼酸515.122353.090,191.057,179.0361916.353二羟基香豆酰咖啡酰基奎尼酸513.107353.088,191.0562018.422槲皮素301.036178.998,152.010,121.0572122.095山奈酚285.042229.048,185.061,117.032
绿原酸类被报道具有体外XOD抑制活性和体内降血尿酸作用[20-21],例如用来优选彝药痛风颗粒提取工艺的8种指标成分中包括新绿原酸、绿原酸、隐绿原酸3个monoCQAs[22],胡居吾[23]用HPLC从可降低腹腔注射酵母膏和氧嗪酸钾诱导的HUA小鼠血尿酸水平(P<0.05)的平卧菊三七醇提物乙酸乙酯萃取相中检测出4种绿原酸类。很多植物来源的黄酮提取物都被发现具有降血尿酸或抑制XOD作用[24-25]。郝悦等[26]比较了30种黄酮对XOD活性的抑制效果,发现木犀草素、槲皮素、芹菜素、山柰酚这4种的作用最强。SHI等[27]研究表明,每日持续服用槲皮素可降低高尿酸人群的血尿酸水平。文中UPLC-Q/TOF-MS对平卧菊三七醇提XOD活性抑制物中绿原酸类物质和黄酮类物质的检出,尤其是种类齐全的monoCQAs和diCQAs的存在,很好解释了平卧菊三七提取物的较强XOD活性抑制作用。由此可知,绿原酸类物质和黄酮类物质应该是平卧菊三七的主要降尿酸功能成分。
2.3 平卧菊三七提取物的降尿酸作用评价
2.3.1 平卧菊三七提取物及萃取物的体外活性
将平卧菊三七提取物、乙酸乙酯和正丁醇萃取物(以下统称提取组分)配制2 mg/mL的溶液,进行体外XOD抑制及抗氧化活性检测,结果见表2,乙酸乙酯萃取物的XOD抑制活性和·O2-清除能力均最高,表明乙酸乙酯与XOD抑制活性成分有良好亲合性。
表2 平卧菊三七各提取组分得率和体外活性
Table 2 Yield and in vitro activity of each fraction ofGynura procumbens (Lour.) Merr
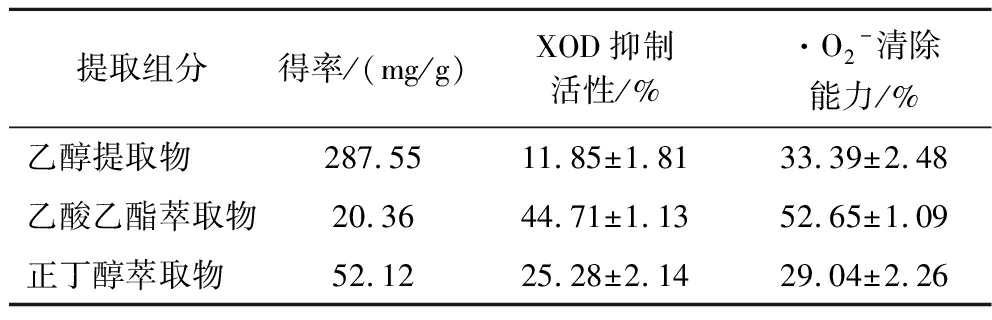
提取组分得率/(mg/g)XOD抑制活性/%·O2-清除能力/%乙醇提取物287.5511.85±1.8133.39±2.48乙酸乙酯萃取物20.3644.71±1.1352.65±1.09正丁醇萃取物52.1225.28±2.1429.04±2.26
2.3.2 动物实验结果
2.3.2.1 平卧菊三七提取组分对模型小鼠血UA、GRE、BUN和肝XOD活性的影响
如图2-a可知,ALP组的肝肾器官系数均最高,说明别嘌呤醇对肝肾存在一定副作用,而平卧菊三七提取物组的器官系数接近空白组,表明其食用安全性高。从图2-b、图2-c可知,与空白组相比模型组小鼠的血尿酸水平和肝XOD活性均显著升高(P<0.01),表明高尿酸小鼠模型造模成功。提取组分3个组(GE、GEA、GEB)的血尿酸水平和肝XOD活性比模型组分别降低20.9%、27.6%、24.9%和17.5%、24.2%、18.8%,表明各提取物可以显著降低小鼠血尿酸水平和肝XOD活性,且接近ALP组。GEA组的肝XOD活性平均值小于GEB和GE,与体外实验结果趋势一致,验证GEA含有更多XOD活性抑制成分。
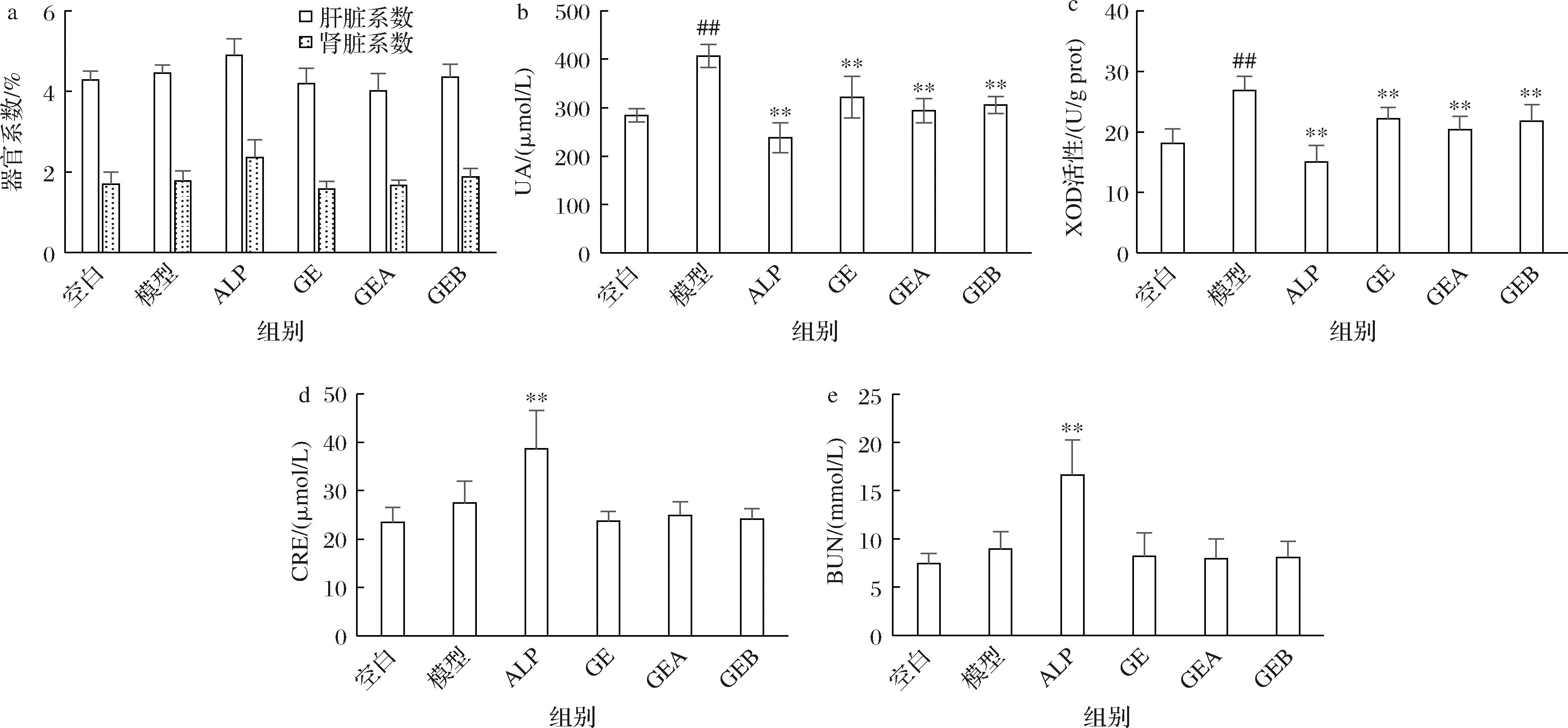
a-器官系数;b-UA水平;c- XOD活性;d-CRE水平;e-BUN水平
图2 小鼠的生理生化指标
Fig.2 Common physiological and biochemical indicators in mice
注:##表示与Control组相比,P<0.01;**表示与Vehicle组相比,P<0.01(下同)。
图2-d、图2-e显示,ALP组的血CRE和BUN水平显著高于其他5组(P<0.01),表明ALP虽然能降低尿酸,但对肾脏造成了很大伤害,与图2-a中ALP组器官系数高的结果相符。提取组分3个组的血CRE和BUN水平均显著低于ALP组、接近对照组。由此可见,平卧菊三七提取物具有良好的降尿酸效果,且对肝肾的安全性高。
2.3.2.2 平卧菊三七提取物对模型小鼠肝脏抗氧化性的影响
XOD催化黄嘌呤和次黄嘌呤生成尿酸的同时产生ROS,MDA含量急剧增高,体内出现氧化损伤。如图3所示,肝脏中MDA含量在模型组中显著高于空白组(P<0.01),在4个治疗组中均显著下降(P<0.01);SOD和CAT(P<0.01)活性在模型组中显著下降,在4个治疗组中均出现提升,其中GEA组提升显著(P<0.05)。可见,平卧菊三七提取物的干预可显著减轻肝脏氧化程度,提高抗氧化酶活性,效果好于ALP。
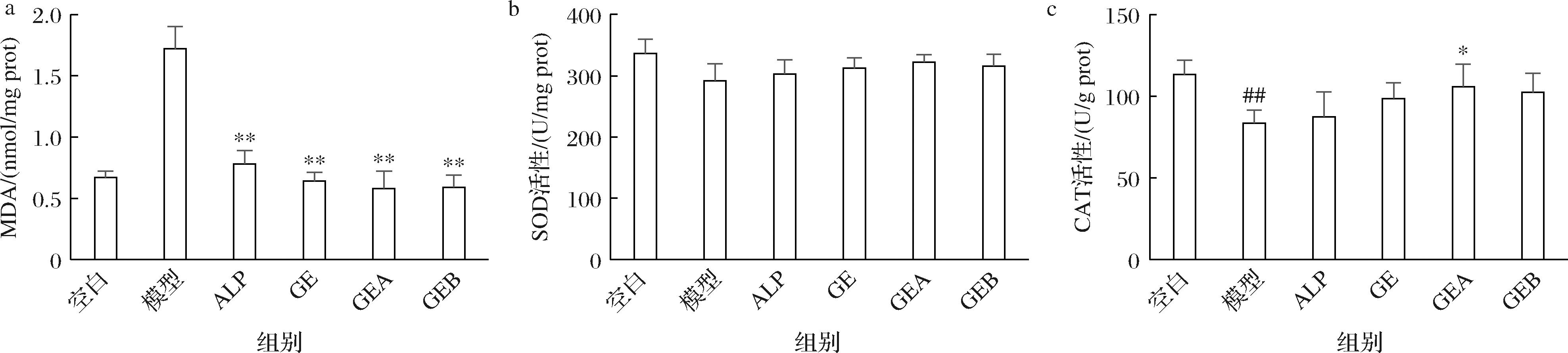
a-MDA水平;b-SOD活性;c-CAT活性
图3 平卧菊三七提取组分对肝脏抗氧化性的影响
Fig.3 Effect of Gynura procumbens (Lour.) Merr.extracted fractions on liver antioxidant capacity
2.3.2.3 平卧菊三七提取物对模型小鼠肾脏形态的影响
约有70%左右尿酸经肾脏排泄,高尿酸会导致肾小球和肾小管病变,使肾脏受损。肾脏切片染色镜检结果见图4,模型组出现多处肾小管因尿酸盐沉积出现的黄褐色区域,肾脏组织水肿,轮廓模糊,有炎性细胞浸润,部分囊腔扩张,皮质层变薄。ALP组经ALP治疗后,黄褐色区域消失,肾脏水肿程度减轻,囊腔扩张情况好转,仍有少量炎性细胞浸润。3个平卧菊三七提取组分组的尿酸盐沉积于肾小管的黄褐色区域面积明显缩小,GE组只零星数处,GEA组和GEB组仅个别区域,且黄褐色泽变浅,显示沉积程度大幅减少;GE组肾间质还有少许炎性细胞浸润,GEA和GEB的干预则使肾脏炎症得到较大的改善,炎细胞反应轻微,无明显浸润现象。镜检结果表明给予平卧菊三七提取组分降低了血尿酸水平,减少了尿酸盐在肾脏的沉积,减轻了肾脏炎症,且GEA和GEB效果好于GE。
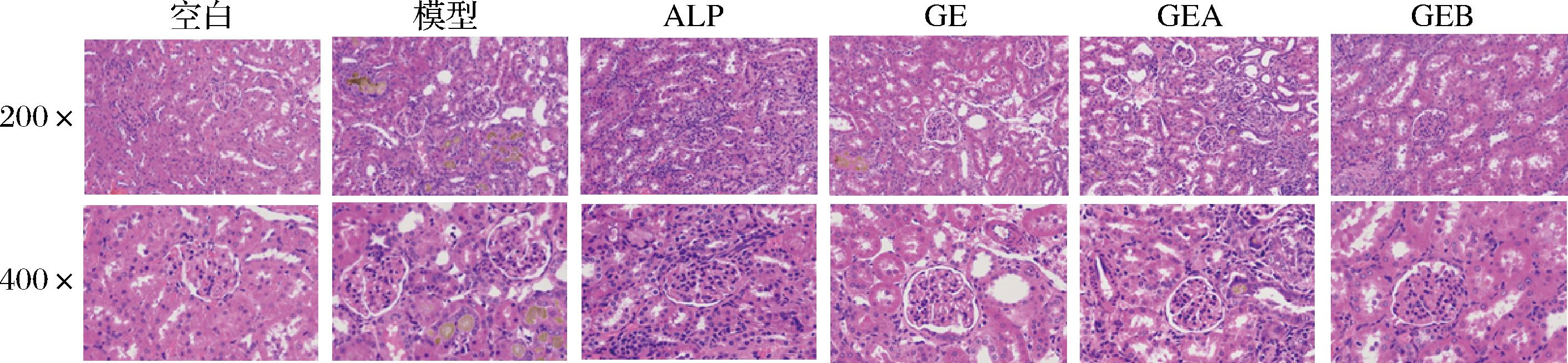
图4 小鼠肾脏镜检结果
Fig.4 Effect of Gynura procumbens (Lour.) Merr.extracted fractions on renal morphology
2.3.2.4 平卧菊三七提取物对模型小鼠炎症因子的影响
体内尿酸增多会激活NLRP3小体和TLR4/NF-κB信号通路促进炎症因子的表达,导致机体炎症。如图5所示,与空白组相比,模型组的血清促炎因子IL-6和TNF-α含量显著增加(P<0.01),抑炎因子IL-10含量显著降低(P<0.05),表明高尿酸的生成使细胞炎症因子水平出现异常,故2.3.2.3节中镜检观察到肾脏炎症。4组治疗组小鼠血清IL-6、TNF-α含量均显著下降,抑炎因子IL-10含量显著升高。平卧菊三七提取组分的干预调节了高血尿酸小鼠体内促炎因子与抑炎因子,对高尿酸水平导致的机体炎症的缓解效果好于别嘌呤醇,GEA和GEB效果好于GE,合理解释了2.3.2.3节中3个提取组分组肾脏炎症减轻的镜检结果。
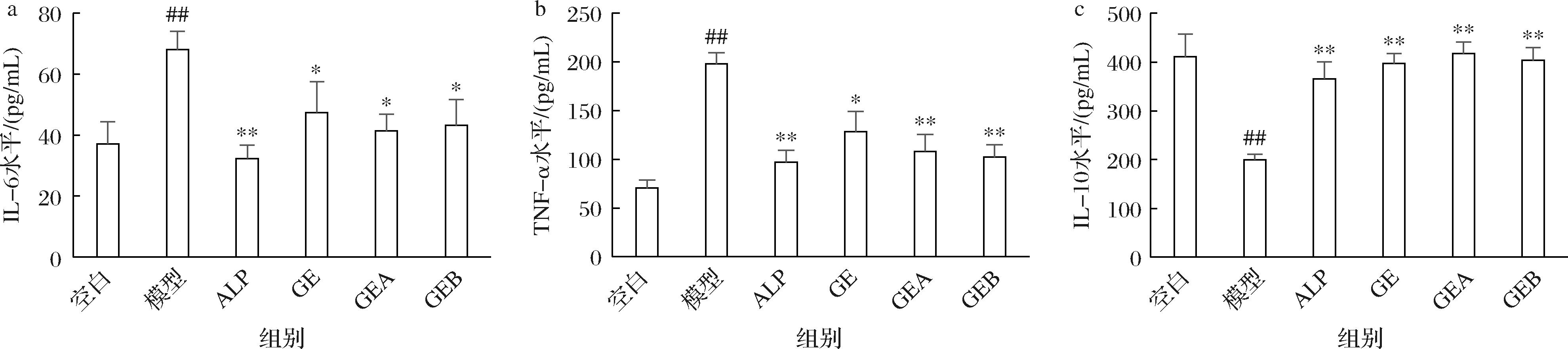
a-IL-6;b-TNF-α;c-IL-10
图5 平卧菊三七提取组分对炎症因子的影响
Fig.6 Effect of Gynura procumbens (Lour.) Merr.extracted fractions on the inflammatory factors
3 结论
本文以XOD活性抑制率为指标,采用单因素实验和响应曲面法优化了超声波提取平卧菊三七中降尿酸功能成分的工艺参数,在乙醇体积分数69%、提取时间51 min、液料比27∶1 (mL∶g)、提取温度45 ℃、超声波功率240 W的条件下,提取物体外XOD抑制率达58.6%。液质联用分析表明,平卧菊三七GE主要是咖啡酰基奎尼酸类和黄酮类物质。超声波提取法的提取温度低,提取时间短,对遇热不稳定、易水解或氧化的降尿酸成分具有良好的保护作用,是提取平卧菊三七降血尿酸成分的良好手段。高血尿酸动物模型实验证实了平卧菊三七GE及萃取物能有效降低小鼠血清尿酸水平和肝XOD活性,且对血CRE和BUN水平没有影响,并能改善肝脏抗氧化能力,减轻肾脏受损程度,是具有良好降血尿酸效果和肝肾保护作用的安全性天然植物提取物。
[1] 中国民族卫生协会重症代谢疾病分会, 高尿酸血症相关疾病诊疗多学科共识专家组.中国高尿酸血症相关疾病诊疗多学科专家共识(2023年版)[J].中国实用内科杂志, 2023, 43(6):461-480.Critical Metabolism Branch of China National Health Association,Multi- Disciplinary Expert Group on Diagnosis and Treatment of Hyperuricemia and Related Diseases. China multi-disciplinary expert consensus on diagnosis and treatment of hyperuricemia and related diseases (2023 edition)[J].Chinese Journal of Practical Internal Medicine, 2023, 43(6):461-480.
[2] LI Y, SHEN Z, ZHU B, et al.Demographic,regional and temporal trends of hyperuricemia epidemics in mainland China from 2000 to 2019:A systematic review and meta- analysis[J].Global Health Action, 2021, 14(1):1874652.
[3] ZHANG L, ZHANG C, ZHUANG Z N, et al.Bio-inspired nanoenzyme for metabolic reprogramming and anti-inflammatory treatment of hyperuricemia and gout[J].Science China Chemistry, 2021, 64(4):616-628.
[4] 王辉, 曾昊, 吴奇平, 等.痛风急性发作期高尿酸血症与尿酸水平正常的临床特点对比研究[J].临床内科杂志, 2023, 40(10):704-706.WANG H, ZENG H, WU Q P, et al.Comparative study on clinical characteristics of hyperuricemia and normal uric acid levels during acute gout attacks[J].Journal of Clinical Internal Medicine, 2023, 40(10):704-706.
[5] 翁天航, 王竟悟, 杨燕.非布司他、苯溴马隆和别嘌醇治疗高尿酸血症的效果对比分析[J].中国处方药, 2022, 20(12):109-111.WONG T H, WANG J W, YANG Y.Comparative analysis of the effects of febuxostat, benzbromarone, and allopurinol in the treatment of hyperuricemia[J].Journal of China Prescription Drug, 2022, 20(12):109-111.
[6] SAAD S A, SABKAR M M.The pattern of allopurinol prescription in a university hospital practice[J].Egyptian Rheumatology and Rehabilitation, 2020, 47:10.
[7] 吕露阳, 张志锋, 王庆颖, 等.全草类药食同源中药安全性评价研究进展[J].中草药, 2021, 52(15):4722-4730.LYU L Y, ZHANG Z F, WANG Q Y, et al.Research progress on safety evaluation of medicine and food homology of whole herb categories of Chinese materia medica[J].Chinese Traditional and Herbal Drugs, 2021, 52(15):4722-4730.
[8] PRATAMA N P, SARI K R P, MARLIANA R I.Acute toxicity study of the combination of Azadirachta indica A. Juss.and Gynura procumbens (Lour.) Merr.leave extracts[J].Journal of Fundamental and Applied Pharmaceutical Science, 2021, 1(2):56-64.
[9] 许溪, 何鹿玲, 王木兰, 等.平卧菊三七各提取物抗痛风作用的实验研究[J].江西中医药大学学报, 2018, 30(2):82-85;90.XU X, HE L L, WANG M L, et al.Experimental study of Gynura procumbens for gout in each extract[J].Journal of Jiangxi University of Chinese Medicine, 2018, 30(2):82-85;90.[10] 彭宝莹, 李欣, 黄俊明, 等.平卧菊三七固体饮料的抗高尿酸血症作用及机制研究[J].华南预防医学, 2021,47(12):1540-1544.PENG B Y, LI X, HUANG J M, et al.Anti-hyperuricemia effect and its mechanism of solid beverage of Gynura procumbens (Lour.) Merr.[J].South China Journal of Preventive Medicine, 2021, 47(12):1540-1544.
[11] 吴磊, 曹明原, 吴静, 等.平卧菊三七的化学成分及生物活性研究进展[J].现代食品科技, 2022, 38(8):334-351.WU L, CAO M Y, WU J, et al.Research progress on chemical constituents and biological activities of Gynura procumbens[J].Modern Food Science and Technology, 2022, 38(8):334-351.
[12] SATHIYASEELAN A, PARK S, SARAVANAKUMAR K, et al.Evaluation of phytochemicals, antioxidants, and antidiabetic efficacy of various solvent fractions of Gynura procumbens (Lour.) Merr[J].Process Biochemistry, 2021, 111:51-62.
[13] MURUGESU K, MURUGAIYAH V, SAGHIR S A M, et al.Caffeoylquinic acids rich versus poor fractions of Gynura procumbens:Their comparative antihyperlipidemic and antioxidant potential[J].Current Pharmaceutical Biotechnology, 2017, 18(14):1132-1140.
[14] 李云聪, 王艳芳, 李佳, 等.甜叶菊绿原酸类成分稳定性研究[J].中国食品添加剂, 2021,32(9):73-78.LI Y C, WANG Y F, LI J, et al.Study on the stability of chlorogenic acids in stevia[J].China Food Additives, 2021,32(9):73-78.
[15] 封可欣. 超声波辅助提取沙棘叶黄酮及其生物活性的研究[D].长春:吉林大学, 2023 FENG K X.Study on ultrasonic assisted extraction of flavonoids from Hippophae rhamnoides L.leaves and their biological activity[D].Changchun:Jilin University, 2023.
[16] 朱玉婷.平卧菊三七中绿原酸提取纯化及抗菌抗氧化性的研究[D].南昌:江西农业大学, 2012.ZHU Y T.Study on extraction and purification of chlorogenic acid from Gynura procumbens (Lour.) Merr and its antibacterial and antioxidant activities[D].Nanchang:Jiangxi Agricultural University, 2012.
[17] 谢栋栋, 刘文杰, 贾志鹏, 等.中药材黄嘌呤氧化酶抑制剂的筛选与评价[J].华西药学杂志, 2022, 37(4):384-390.XIE D D, LIU W J, JIA Z P, et al.Screening and activity evaluation of xanthine oxidase inhibitors from Chinese herbal extracts[J].West China Journal of Pharmaceutical Sciences, 2022, 37(4):384-390.
[18] ZHAO M M, ZHU D S, SUN-WATERHOUSE D, et al.In vitro and in vivo studies on adlay-derived seed extracts:Phenolic profiles, antioxidant activities, serum uric acid suppression, and xanthine oxidase inhibitory effects[J].Journal of Agricultural and Food Chemistry, 2014, 62(31):7771-7778.
[19] MENG X H, LI J W, LI M M, et al.Traditional uses, phytochemistry, pharmacology and toxicology of the genus Gynura (Compositae):A comprehensive review[J].Journal of Ethnopharmacology, 2021, 276:114145.
[20] WAN Y, QIAN J, LI Y Z, et al.Inhibitory mechanism of xanthine oxidase activity by caffeoylquinic acids in vitro[J].International Journal of Biological Macromolecules, 2021, 184:843-856.
[21] WAN Y, WANG D X, SHEN Y F, et al.Effect of Lactobacillus acidophilus fermentation on the composition of chlorogenic acids and anti-hyperuricemia activity of Artemisia selengensis Turcz[J].Food &Function, 2022, 13(22):11780-11793.
[22] 赵雪莲, 兰建龙, 杨正明, 等.基于响应面和G1-熵权法优选彝药痛风颗粒提取工艺及其药效评价[J].中草药, 2022, 53(12):3653-3661.ZHAO X L, LAN J L, YANG Z M, et al.Optimization extraction process of Yi Medicine Tongfeng Granules based on response surface methodology and G1-entropy weight method and its pharmacodynamic evaluation[J].Chinese Traditional and Herbal Drugs, 2022, 53(12):3653-3661.
[23] 胡居吾. 蔓三七提取物对酵母膏和氧嗪酸钾致小鼠急性高尿酸血症治疗效果的研究[J].生物化工, 2021, 7(6):18-21.HU J W.Study of Gynura procumbens extract on the treatment of acute hyperuricemia induced by yeast extract and potassium oxonate in mice[J].Biological Chemical Engineering, 2021, 7(6):18-21.
[24] WAHYUNINGTYAS A P, PUTRI D P, MAHARANI N, et al.Flavonoid fraction from chayote (Sechium edule (Jacq.) Sw) leaves reduced malondialdehyde (MDA) and tumor necrosis factor-α (TNF-α) in hyperuricemic rats[J].Nutrition &Food Science, 2022, 52(2):366-378.
[25] LIU L L, ZHANG L, REN L C, et al.Advances in structures required of polyphenols for xanthine oxidase inhibition[J].Food Frontiers, 2020, 1(2):152-167.
[26] 郝悦, 焦安妮, 于敏, 等.30种黄酮抑制黄嘌呤氧化酶活性的筛选[J].中成药, 2019, 41(1):55-59.HAO Y, JIAO A N, YU M, et al.Activity screening of thirty flavonoids on the inhibition of xanthine oxidase[J].Chinese Traditional Patent Medicine, 2019, 41(1):55-59.
[27] SHI Y L, WILLIAMSON G. Quercetin lowers plasma uric acid in pre-hyperuricaemic males: A randomised, double-blinded, placebo-controlled, cross-over trial[J]. British Journal of Nutrition, 2016, 115(5): 800-806.