重庆自2020年1月1日开始全面禁捕,随后一年启动了长江流域关键水域的“十年禁渔”计划,引发了重庆及西南地区的高端淡水鱼市场供应链调整。利用好山区丰富的优质水资源,因地制宜发展流水养殖,打造高端水产精品鱼养殖基地是重庆“十四五”渔业规划四个发展方面挖潜的举措之一。
草鱼(Ctenopharyngodon idellus)是我国主要的淡水养殖品种之一,因其产量高、个体大、味道鲜美,在重庆及西南地区的餐饮领域具有重要地位[1]。2011年,为应对长期低迷的鱼价现状,广东省清远市提出一种科学的常见淡水鱼增效提质养殖方法,即通过模拟自然环境,在30~45 d进行多级清水“瘦身”养殖,将体态肥盈的商品鱼转化为口感好、无泥味、无药残、高价值的成品鱼(瘦身鱼)[2]。为了填补市场供应缺口,提供高品质鱼类,同时解决长江捕捞渔民的产业转型问题,重庆近年来依托水资源优势,也在推广和发展瘦身鱼养殖模式。与广东模式不同,重庆的瘦身鱼养殖引用高山流出的山泉水、矿泉水、溶洞水为水源,或利用无污染、水质优良的江河、湖泊水源构建水池,进行饥饿养成,养殖时间长达8~12个月,旨在提高鱼肉品质[3]。
但瘦身鱼发展历史较短,养殖周期缺乏统一、合理的科学依据,且其在养殖过程中品质变化规律和机制不清,目前相关的研究报道较少。曹英楠[4]研究发现通过适当时间的瘦身养殖处理可有效提升草鱼鱼肉的营养和风味品质;瘦身养殖8个月后,草鱼体重继续降低但气味特征逐渐趋于稳定。鱼肉质构是评价鱼肉食用品质的关键指标[5],直接影响鱼肉烹饪产品和后续深加工产品的感官品质,通过深入研究质构特征和变化机理,可以帮助改进食品的口感、提高产品的整体品质[6],开发出更具创新性和差异化的食品产品,增强消费者满意度和品牌竞争力。本研究拟观察草鱼瘦身养殖过程中质构品质变化,并探究其变化机制,为重庆市开展生态瘦身鱼养殖提供理论指导。
1 材料与方法
1.1 材料与试剂
1.1.1 实验样品与采集
参照曹英楠[4]的方法进行样品养殖和采集。按照瘦身养殖时间进行分组,M0、M1、M2、M3、M4、M5、M6、M7、M8、M9、M10、M11、M12、M24分别代表养殖0、1、2、3、4、5、6、7、8、9、10、11、12、24个月。
1.1.2 主要试剂
十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、β-巯基乙醇、30%丙烯酰胺(质量分数),北京索莱宝科技有限公司;氯胺T,成都市科隆化学品有限公司;L-羟脯氨酸,合肥博美生物科技有限责任公司。
1.2 仪器与设备
JA3003B电子天平,上海精天电子仪器有限公司;Multifuge X3R台式高速冷冻离心机,美国赛默飞世尔科技公司;PHS-25数显酸度计,杭州雷磁分析仪器厂;Synergy HTX多功能酶标仪、Mini型电泳仪,美国Bio-Rad公司;TU-1950双光束紫外可见分光光度计,北京普析通用仪器有限公司;MesoMR23-060H-1核磁共振成像分析仪,苏州纽迈分析仪器有限公司;TA.TOUCH物性测定仪,上海保圣实业发展有限公司。
1.3 实验方法
1.3.1 全质构的测定
取鱼的背部肌肉,尽量保证取肉的部位一致,切成1.5 cm×1.5 cm×1.5 cm规格进行测定。质构仪采用TA36扁平圆柱探头,测试前速度为2 mm/s,测试后速度为1 mm/s,测试速度为1 mm/s,2次压缩的时间间隔为5 s,压缩比为30%,返回位置20 mm。每个样品至少做14次平行实验。
1.3.2 十二烷基硫酸钠-丙烯酰胺凝胶电泳(SDS-PAGE)
参考XIA等[7]和TANG等[8]的测定方法并作适当修改。取0.2 g鱼肉与4 mL 2%的SDS溶液(质量分数,下同)混合,在8 000 r/min下均质10 s后于50 ℃水浴锅中加热20 min,5 000 r/min 4 ℃离心10 min。调整上清液浓度并与样品缓冲液以1∶3的比例混合,于沸水中加热5 min后快速冷却上样。电泳分离胶和浓缩胶质量分数分别为6%和5%。
1.3.3 胶原蛋白含量的测定
鱼肉中羟脯氨酸的测定方法参照GB/T 9695.23—2008《肉与肉制品 羟脯氨酸含量测定》。
1.3.4 Masson染色分析
参照邵婷[9]的方法对鱼肉背部肌肉切片进行显微镜观察并拍照(×40)。
1.3.5 肌纤维直径的测量
由1.3.4节中获得的图片用Image J软件测定肌纤维的直径,在每块肌肉组织中,取600~800条肌纤维用于计算肌纤维的直径(μm)。
1.3.6 低场核磁共振横向弛豫信号的采集
参考CARR等[10]和MEIBOOM等[11]的测定方法并稍作修改。将不同养殖时间下的瘦身鱼肉沿纤维切成0.6 cm×0.6 cm×0.6 cm大小后装入1.5 mL的EP管中,将其放入仪器中开始测试,使用具有测试参数的CPMG序列测量T2,具体条件如下:SW(KHz)=200,SF(MHz)=21,RFD(ms)=0.020,RG1(db)=10.0,P1(us)=5.00,DRG1=3,TW(ms)=3 000,NS=8,P2(us)=11.04,TE(ms)=0.3,NECH=8 000。每个样品重复测试3次取平均值,最后通过Multi ExpInv Analysis软件进行多指数拟合得到横向弛豫图谱。
1.3.7 拉曼光谱分析
参照唐密[12]的方法测定不同养殖时间下瘦身鱼肉蛋白的结构变化。取相同部位的鱼背部肌肉平铺在载玻片上,测定参数为:激光:785 nm,光栅:400 刻线/mm,光阑:50 μm狭缝,激光能量:7.5 mW,曝光时间:2.00 s,曝光次数:30。使用Omnic软件(9.2版)对光谱进行基线校正和平滑,使用Peakfit软件计算蛋白质的二级结构含量[13]。
1.3.8 化学作用力的测定
参考孙艺[14]的方法测定不同养殖时间下瘦身鱼肉的化学作用力。称取2 g鱼的背部肌肉与10 mL 4种不同的溶液混合,4种溶液分别为:0.05 mol/L NaCl(SA),0.6 mol/L NaCl(SB),0.6 mol/L NaCl+1.5 mol/L尿素(SC),0.6 mol/L NaCl+8 mol/L尿素(SD)。在12 000 r/min的速度下均质1 min(每均质20 s暂停10 s),于4 ℃下静置1 h后10 000 r/min离心20 min取上清液。通过Bradford法测定上清液的蛋白质浓度,氢键、疏水相互作用的贡献分别通过SC-SB、SD-SC的浓度差来表示。
1.4 统计分析
每组样品重复测定3次,采用SPSS 25.0进行ANOVA单因素方差分析及Duncan检验(P<0.05),以平均值±标准偏差表示。图表绘制采用Origin 2021软件。
2 结果与分析
2.1 养殖时间对草鱼背部肌肉质构特性的影响
鱼肉的质构特性主要包括硬度、弹性、胶黏性及咀嚼性等,是评价水产品品质的重要物理特性之一[15]。由表1可知,随养殖时间延长,鱼肉硬度总体呈升高趋势,在养殖时间为8个月时,其硬度达到最大值,比普通草鱼的硬度高约37.83%。鱼肉的弹性和黏聚性在M1时显著升高,此后随养殖时间的延长总体呈波动性变化,但组间并无显著性差异。鱼肉的咀嚼性随时间的延长呈稳步上升趋势,并在M8时达到最大值,比普通草鱼的高56.09%。总体而言,通过瘦身养殖处理使草鱼的品质得以显著提高,但瘦身养殖8个月后,质构品质不再发生明显变化。
表1 瘦身养殖时间对鱼肉质构特性的影响
Table 1 Effects of starvation time on texture characteristics of grass carp
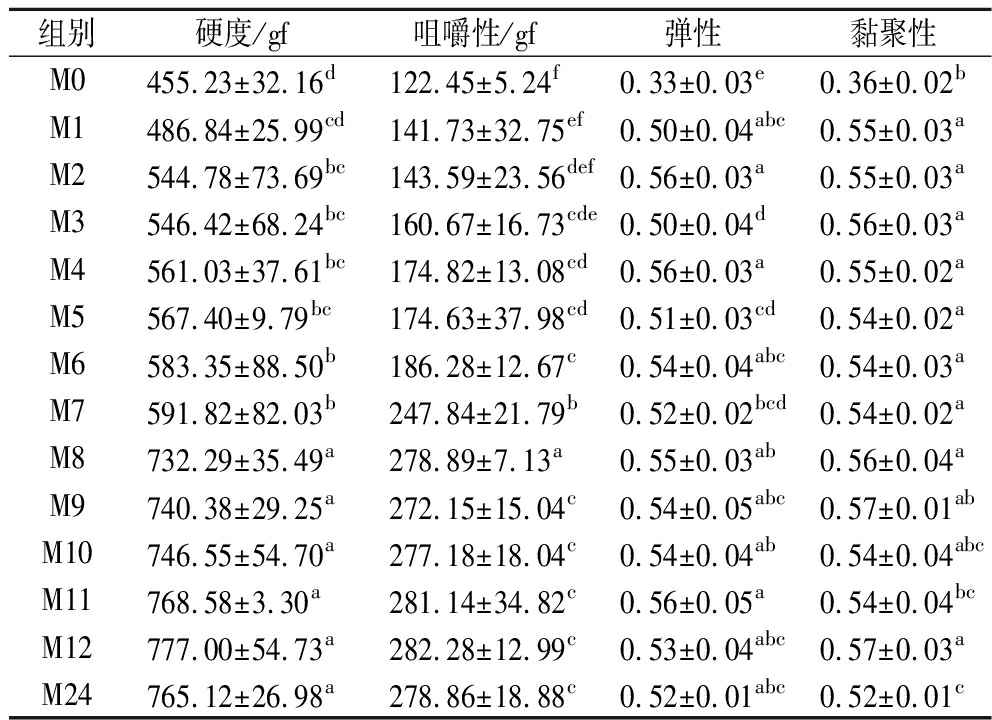
组别硬度/gf咀嚼性/gf弹性黏聚性M0455.23±32.16d122.45±5.24f0.33±0.03e0.36±0.02bM1486.84±25.99cd141.73±32.75ef0.50±0.04abc0.55±0.03aM2544.78±73.69bc143.59±23.56def0.56±0.03a0.55±0.03aM3546.42±68.24bc160.67±16.73cde0.50±0.04d0.56±0.03aM4561.03±37.61bc174.82±13.08cd0.56±0.03a0.55±0.02aM5567.40±9.79bc174.63±37.98cd0.51±0.03cd0.54±0.02aM6583.35±88.50b186.28±12.67c0.54±0.04abc0.54±0.03aM7591.82±82.03b247.84±21.79b0.52±0.02bcd0.54±0.02aM8732.29±35.49a278.89±7.13a0.55±0.03ab0.56±0.04aM9740.38±29.25a272.15±15.04c0.54±0.05abc0.57±0.01abM10746.55±54.70a277.18±18.04c0.54±0.04ab0.54±0.04abcM11768.58±3.30a281.14±34.82c0.56±0.05a0.54±0.04bcM12777.00±54.73a282.28±12.99c0.53±0.04abc0.57±0.03aM24765.12±26.98a278.86±18.88c0.52±0.01abc0.52±0.01c
注:不同小写字母表示差异显著(P<0.05),下同。
2.2 SDS-PAGE电泳和胶原蛋白含量
由图2中的蛋白条带数量可知,瘦身鱼肉在不同养殖时间下的蛋白质组成未发生明显改变,均主要包括分子质量为200 kDa的肌球蛋白重链(myosin heavy chain,MHC)和分子质量为40 kDa的肌动球蛋白。添加β-巯基乙醇后,不同养殖时间下的样品之间胶顶端的聚合物条带分离无显著差异,表明瘦身鱼肉质构的改善不是共价交联引起的。然而,分子质量为100 kDa左右的条带颜色加深,说明养殖时间的延长可能增加草鱼肌肉中胶原蛋白的含量,这与图3中胶原蛋白含量结果相符。胶原蛋白是肌肉中结缔组织的关键成分,含量与鱼肉的硬度和咀嚼性相关。胶原蛋白含量在M8时显著增加(P<0.05)并取得最大值,此时相比于M1其含量增长了约38.66%,可能导致鱼肉硬度增加[16]。胶原蛋白还有助于肌纤维束之间的黏合,提高肌肉持水力[17]。因此,瘦身养殖后鱼肉硬度的增加可能与胶原蛋白含量的增加有关。
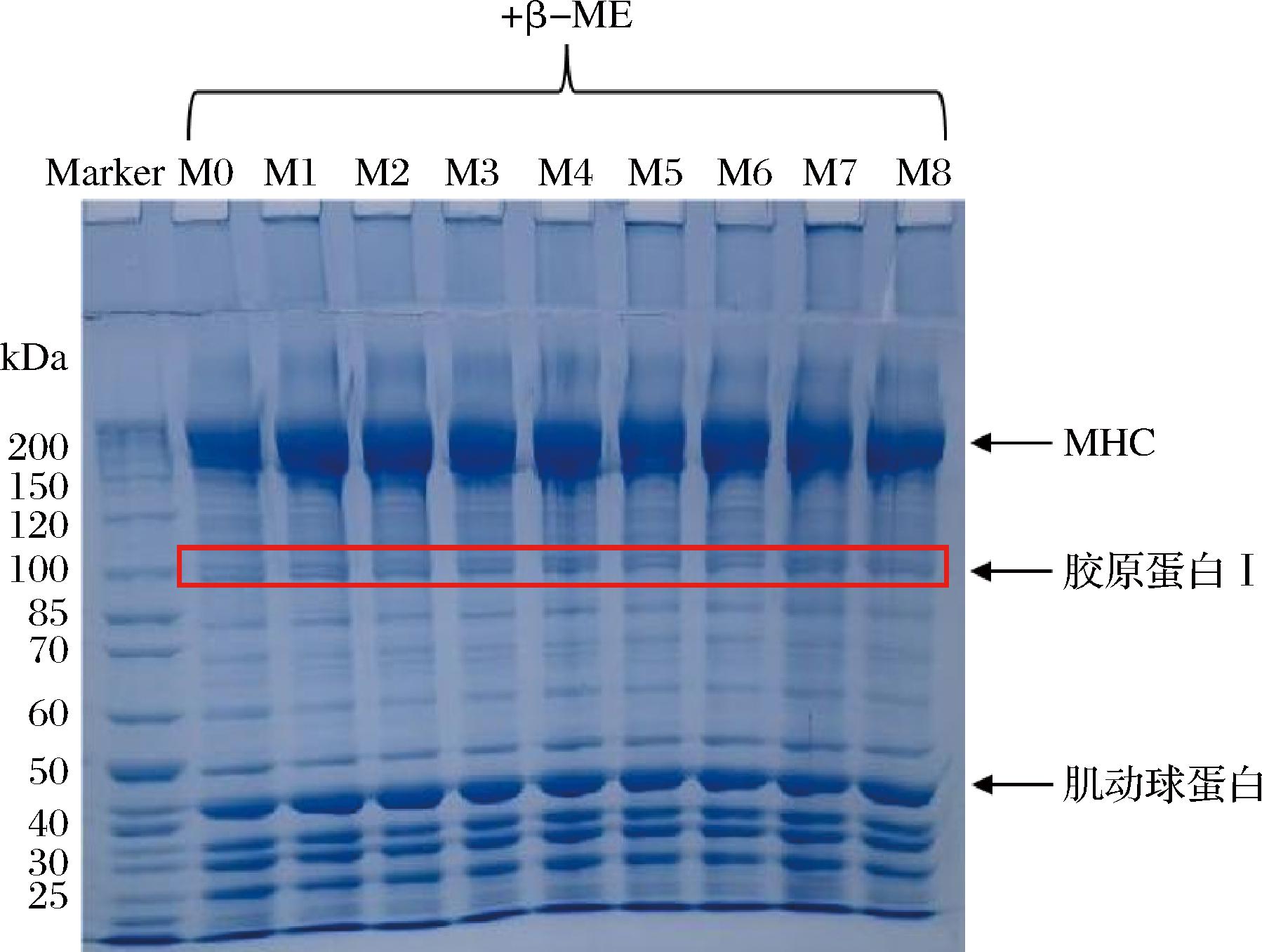
图2 不同养殖时间下鱼肉蛋白质SDS-PAGE凝胶电泳图
Fig.2 SDS-PAGE of grass carp muscle during at different starvation time
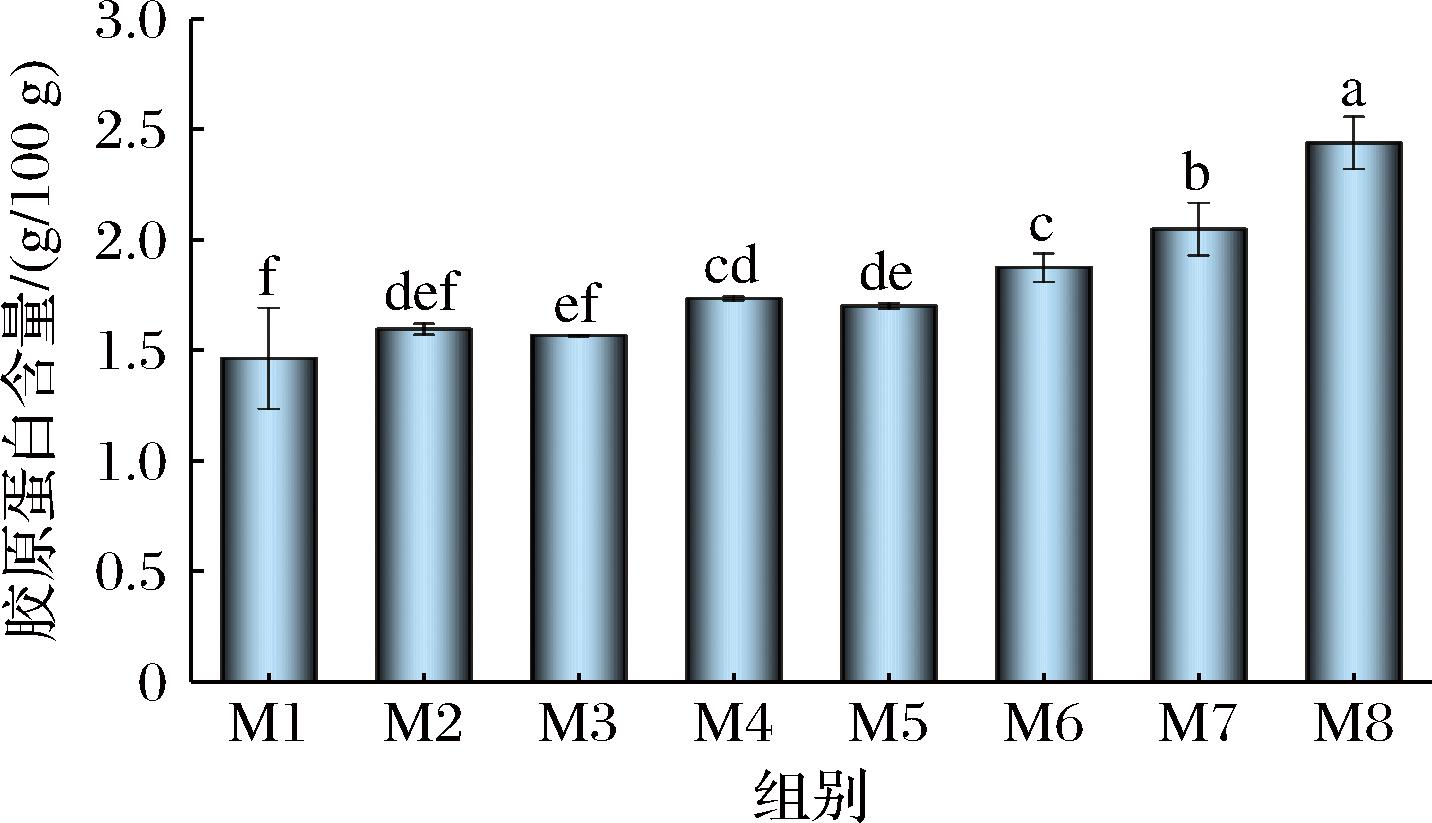
图3 不同养殖时间下鱼肉胶原蛋白含量的变化
Fig.3 Effect of starvation time on collagen from grass carp muscle
注:不同小写字母表示差异显著(P<0.05),下同。
2.3 Masson染色分析
由图4可知,胶原蛋白主要在肌束膜中分布,随着瘦身养殖时间的延长,蓝色胶原纤维逐渐增多且颜色加深,与图3的胶原蛋白含量变化一致。此外,肌纤维和肌隔膜的间隙增大,特别是在M7和M8,有利于胶原填充。甘承露[18]研究发现胶原蛋白在肌隔膜中的增加与鱼肉口感改变有关。这与电泳图和胶原蛋白含量的变化结果相符,表明胶原蛋白含量增加是草鱼瘦身养殖后质构特性改善的原因之一。
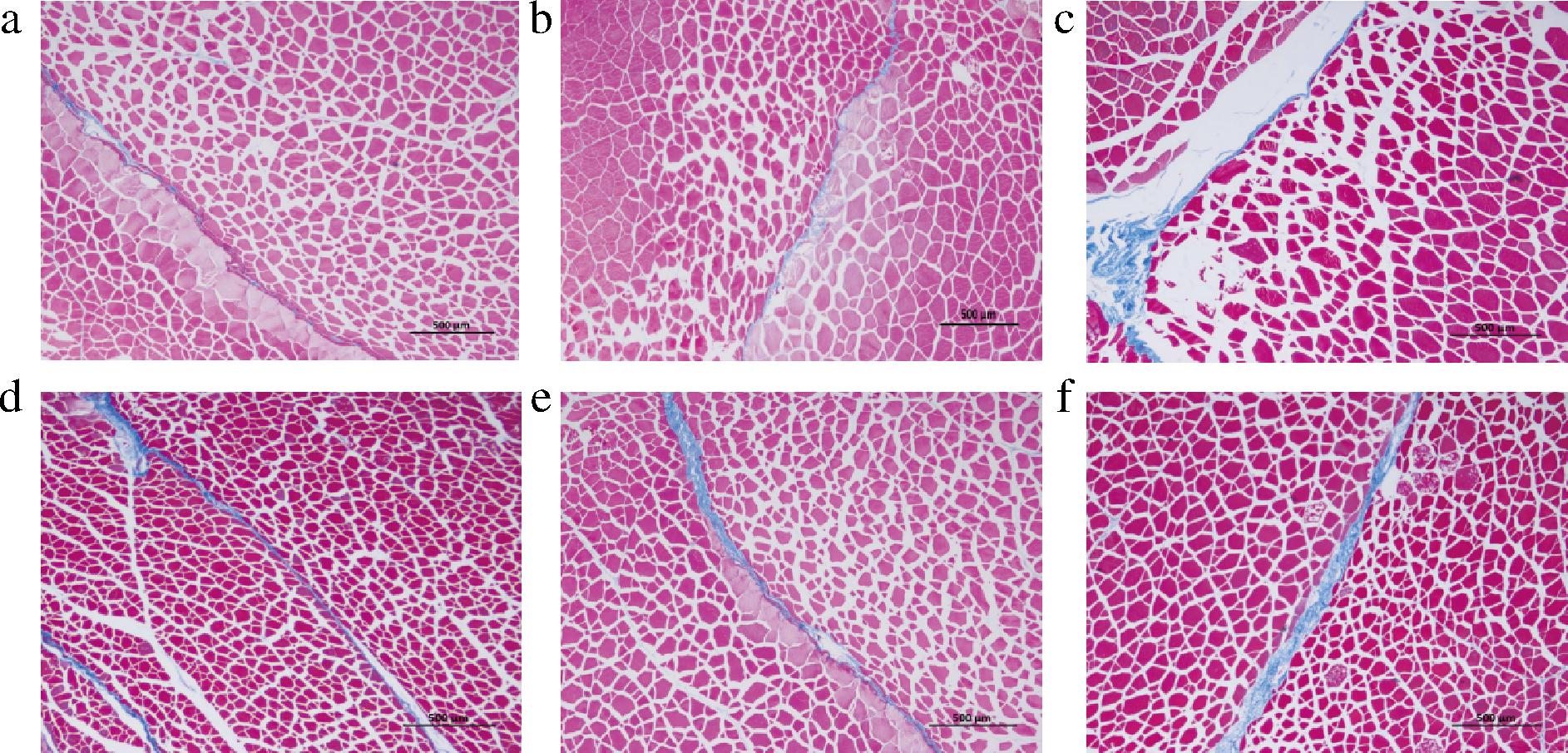
a-M1;b-M2;c-M3;d-M5;e-M7;f-M8
图4 瘦身养殖过程中草鱼肌肉组织的Masson染色(×40)
Fig.4 Masson staining of grass carp muscle during starvation time(×40)
2.4 肌纤维直径分析
由图5可知,随着养殖时间延长,瘦身鱼肌纤维直径逐渐减小,特别是在养殖5个月时明显,由M1的219.86 μm减小到M5的156.19 μm,降低了约28.96%。此后不再发生明显变化。肌纤维直径与鱼肉质构相关,尤其影响鱼肉硬度,直径越小,肌肉硬度越大[19]。Masson染色结果(图4)也显示随着瘦身养殖时间延长,肌纤维直径减小,肌束变细且排列更紧密。因此,瘦身鱼肉质构品质改善与肌纤维直径大小有关。
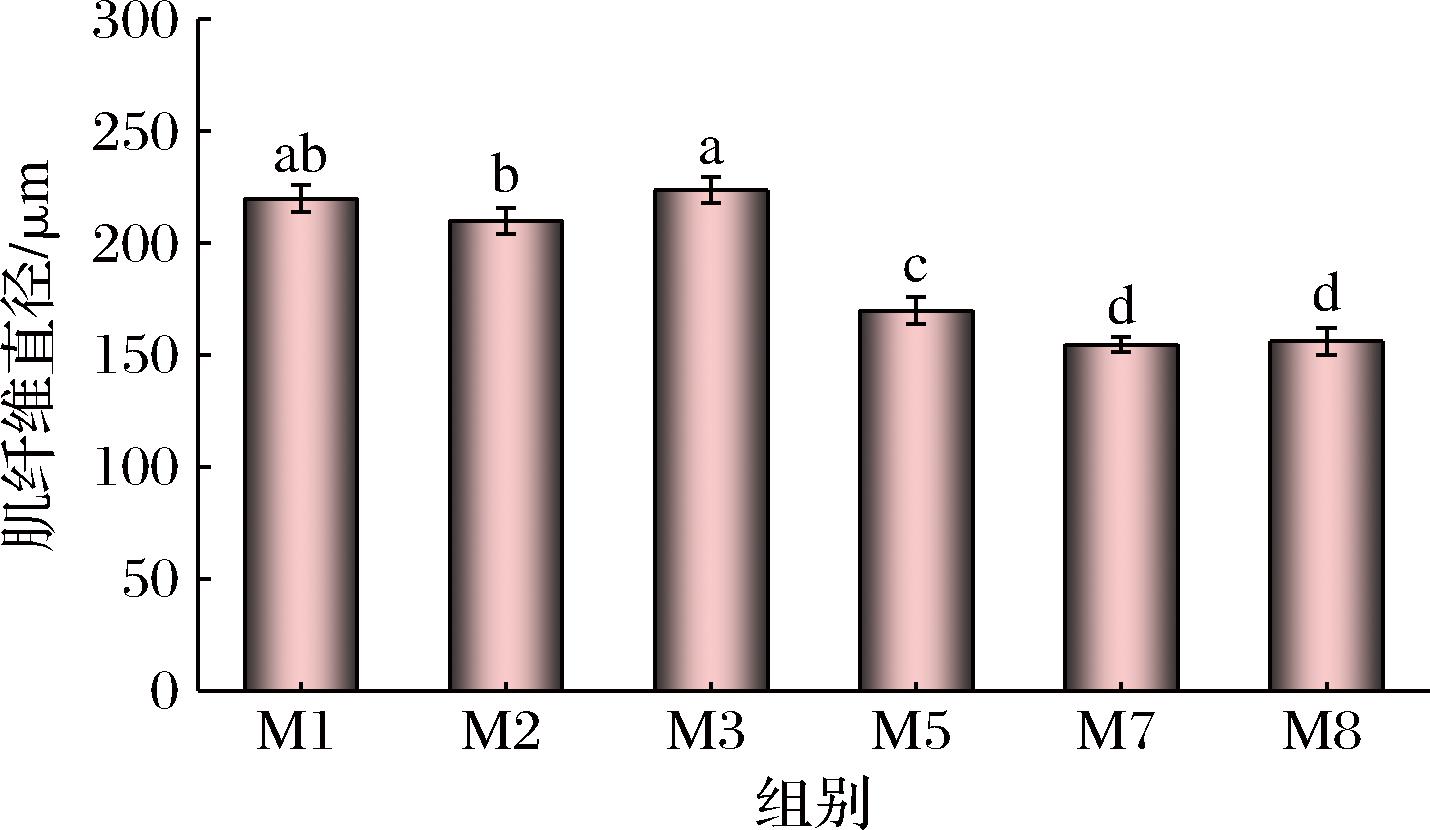
图5 瘦身养殖过程中草鱼背部肌肉肌纤维直径的变化
Fig.5 Changes in the diameter of grass carp muscle during starvation time
2.5 养殖时间对瘦身鱼肉水分分布的影响
图6是不同瘦身养殖时间下鱼肉样品T2横向弛豫的三维分布。T2的变化可以表示水的自由度,当T2向快弛豫方向移动时表明水分的流动性降低。T21(<10 ms)、T22(10~100 ms)、T23(>100 ms)分别代表结合水、不易流动水和自由水。用A21、A22、A23分别代表T21、T22、T23的弛豫峰面积百分比,当其下降时则代表水分含量的减少[20]。表2呈现了不同养殖时间下鱼肉弛豫时间和相应面积(百分比)的变化。对于结合水来说,不同养殖时间下鱼肉弛豫时间及其峰面积没有显著变化。但随时间延长,在M5时T22和T23显著上升,同时A22显著降低而A23显著增加。说明此时鱼肉中的水分流动性增强,不易流动水向自由水转化,自由水在肌肉中仅靠毛细血管作用力保持而极易流失,从而形成可见的汁液损失[21]。这可能是因为此时疏水基团逐渐暴露,鱼肉蛋白疏水性增强,从而使其与水分子间的相互作用减弱。此后随养殖时间进一步延长,不易流动水的含量显著增加,自由水含量显著降低,同时T23向快弛豫方向移动,说明自由水的流动性减弱,结合性增强,使鱼肉具有良好的持水性[22]。这可能与酪氨酸的暴露程度有关,随瘦身时间延长,酪氨酸的暴露程度增加,更有利于鱼肉蛋白与水分子的氢键结合。
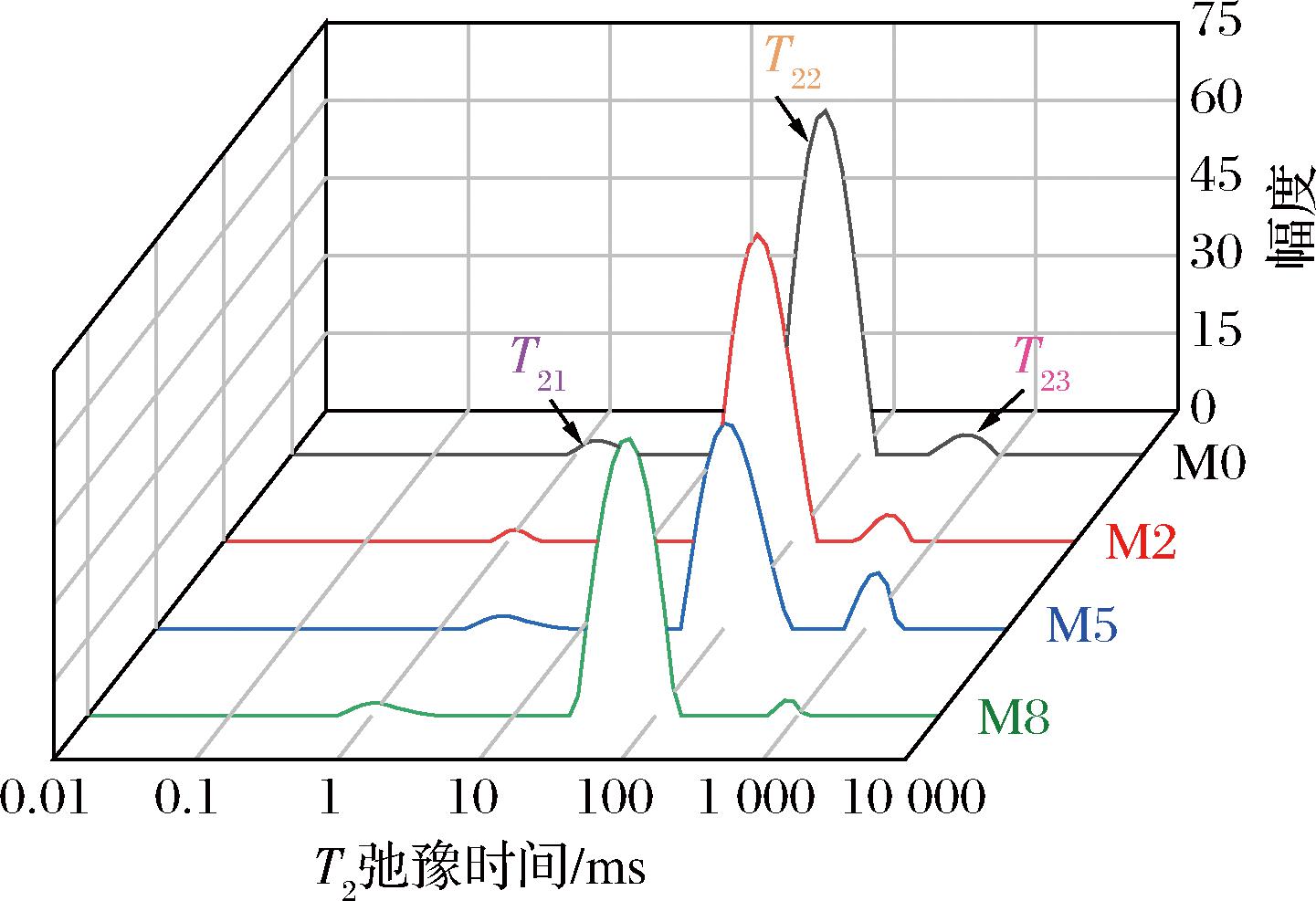
图6 不同养殖时间下鱼肉T2横向弛豫三维图谱的变化
Fig.6 Changes of the T2 relaxation spectra of fish muscle during starvation time
表2 不同养殖时间下鱼肉弛豫时间及对应面积(百分比)的变化
Table 2 Effect of NMR parameters of fish muscle during starvation time
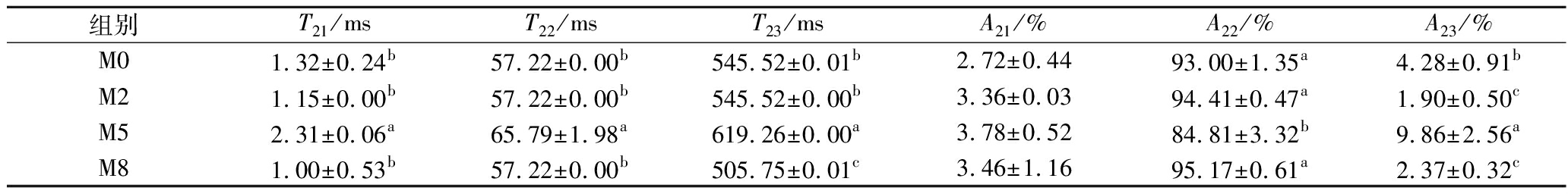
组别T21/msT22/msT23/msA21/%A22/%A23/%M01.32±0.24b57.22±0.00b545.52±0.01b2.72±0.4493.00±1.35a4.28±0.91bM21.15±0.00b57.22±0.00b545.52±0.00b3.36±0.0394.41±0.47a1.90±0.50cM52.31±0.06a65.79±1.98a619.26±0.00a3.78±0.5284.81±3.32b9.86±2.56aM81.00±0.53b57.22±0.00b505.75±0.01c3.46±1.1695.17±0.61a2.37±0.32c
2.6 拉曼光谱分析
2.6.1 芳香族氨基酸微环境变化
由图7可知,不同鱼肉样品的拉曼光谱变化基本一致。芳香族氨基酸侧链残基的谱带变化可以表征蛋白微环境的改变。其中760 cm-1附近的条带信息反映的是色氨酸环的伸缩振动[23],反映疏水性的变化,当其峰值下降时表明色氨酸由包埋状态暴露在了极性环境中。由表3可知,随养殖时间延长,760 cm-1处的归一化强度先呈下降趋势,此后又从0.55(M5)增加到0.64(M8),该结果说明在养殖初期鱼肉蛋白内部的色氨酸逐渐暴露,但随养殖时间延长,已暴露在极性环境中的色氨酸可能因蛋白分子间的聚合反应而被重新包埋进疏水环境内部[24],从而导致体系的疏水性下降。

图7 不同养殖时间下鱼肉拉曼光谱的变化
Fig.7 Changes in Raman spectra of fish muscle during starvation time
表3 不同养殖时间下鱼肉拉曼光谱条带归一化强度的变化
Table 3 Changes in normalized intensity of Raman spectral bands of fish muscle
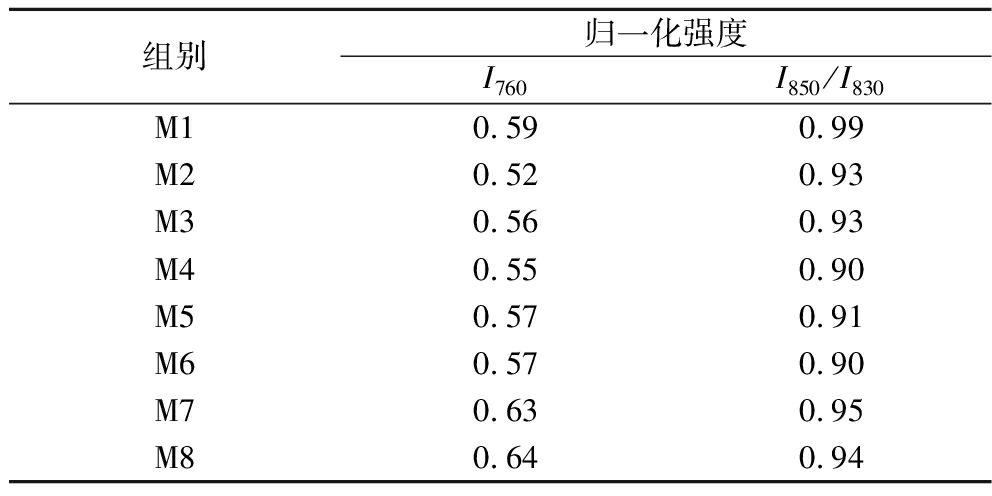
组别归一化强度I760I850/I830M10.590.99M20.520.93M30.560.93M40.550.90M50.570.91M60.570.90M70.630.95M80.640.94
此外,位于830 cm-1和850 cm-1附近的费米共振双峰的比值(I850/I830)大小可反映酚羟基氢键结合及酪氨酸残基的暴露或掩埋情况[25]。当比值介于0.9~2.5时表示酪氨酸残基暴露在极性环境中,可作为氢键供体或受体与水分子相互作用[26],当比值小于0.9时,则表明酪氨酸残基处于蛋白质内部的疏水性环境中,主要作为氧键供体[27]。由表3可知,总体而言,不同瘦身养殖时间下的鱼肉蛋白在I850/I830的归一化强度均大于0.9,这表明酪氨酸残基在蛋白表面均呈暴露状态。具体来说,双峰强度在M1~M4先呈下降趋势,但随养殖时间延长,I850/I830的下降程度减缓,此后其强度又从0.90(M4)增加至0.94(M8)。这表明瘦身养殖处理可促进酪氨酸残基暴露在亲水环境中,进而抑制了蛋白疏水性增加,且随时间延长,酪氨酸残基的暴露程度逐渐增强,更有利于鱼肉蛋白与水分子的氢键结合,从而使更多的水分子被包裹,赋予瘦身鱼肉更好的质构特性和持水性。
2.6.2 蛋白质二级结构变化
1 650 cm-1附近的条带信息反映的是酰胺Ⅰ带的振动模式,主要来源于C![]() O和一部分C—N的伸缩振动[28]。现有研究表明其振动频率与蛋白质的二级结构含量间存在一定的相关性[29],因此对酰胺Ⅰ带进行高斯去卷积、二阶求导后可分析样品间蛋白质的二级结构变化。蛋白质的二级结构主要包括α-螺旋、β-折叠、β-转角和无规则卷曲,其中α-螺旋和β-折叠分别通过分子内部和分子间的氢键作用来维持蛋白质结构的稳定,与蛋白质的弹性和韧性密切相关[30]。由图8可知,不同养殖时间下瘦身鱼的蛋白二级结构以α-螺旋和β-折叠为主要成分。随瘦身养殖时间延长,α-螺旋含量总体变化不明显,无规则卷曲含量显著降低,β-折叠则呈逐渐升高的趋势,整体表现为螺旋结构增多无序结构减少。综合拉曼光谱的结果分析,这可能是由于瘦身养殖处理促进鱼肉体系形成了新的氢键,鱼肉蛋白分子内的氢键作用增强,从而形成了更多的有序结构[31],有利于笼络更多的水分子。
O和一部分C—N的伸缩振动[28]。现有研究表明其振动频率与蛋白质的二级结构含量间存在一定的相关性[29],因此对酰胺Ⅰ带进行高斯去卷积、二阶求导后可分析样品间蛋白质的二级结构变化。蛋白质的二级结构主要包括α-螺旋、β-折叠、β-转角和无规则卷曲,其中α-螺旋和β-折叠分别通过分子内部和分子间的氢键作用来维持蛋白质结构的稳定,与蛋白质的弹性和韧性密切相关[30]。由图8可知,不同养殖时间下瘦身鱼的蛋白二级结构以α-螺旋和β-折叠为主要成分。随瘦身养殖时间延长,α-螺旋含量总体变化不明显,无规则卷曲含量显著降低,β-折叠则呈逐渐升高的趋势,整体表现为螺旋结构增多无序结构减少。综合拉曼光谱的结果分析,这可能是由于瘦身养殖处理促进鱼肉体系形成了新的氢键,鱼肉蛋白分子内的氢键作用增强,从而形成了更多的有序结构[31],有利于笼络更多的水分子。
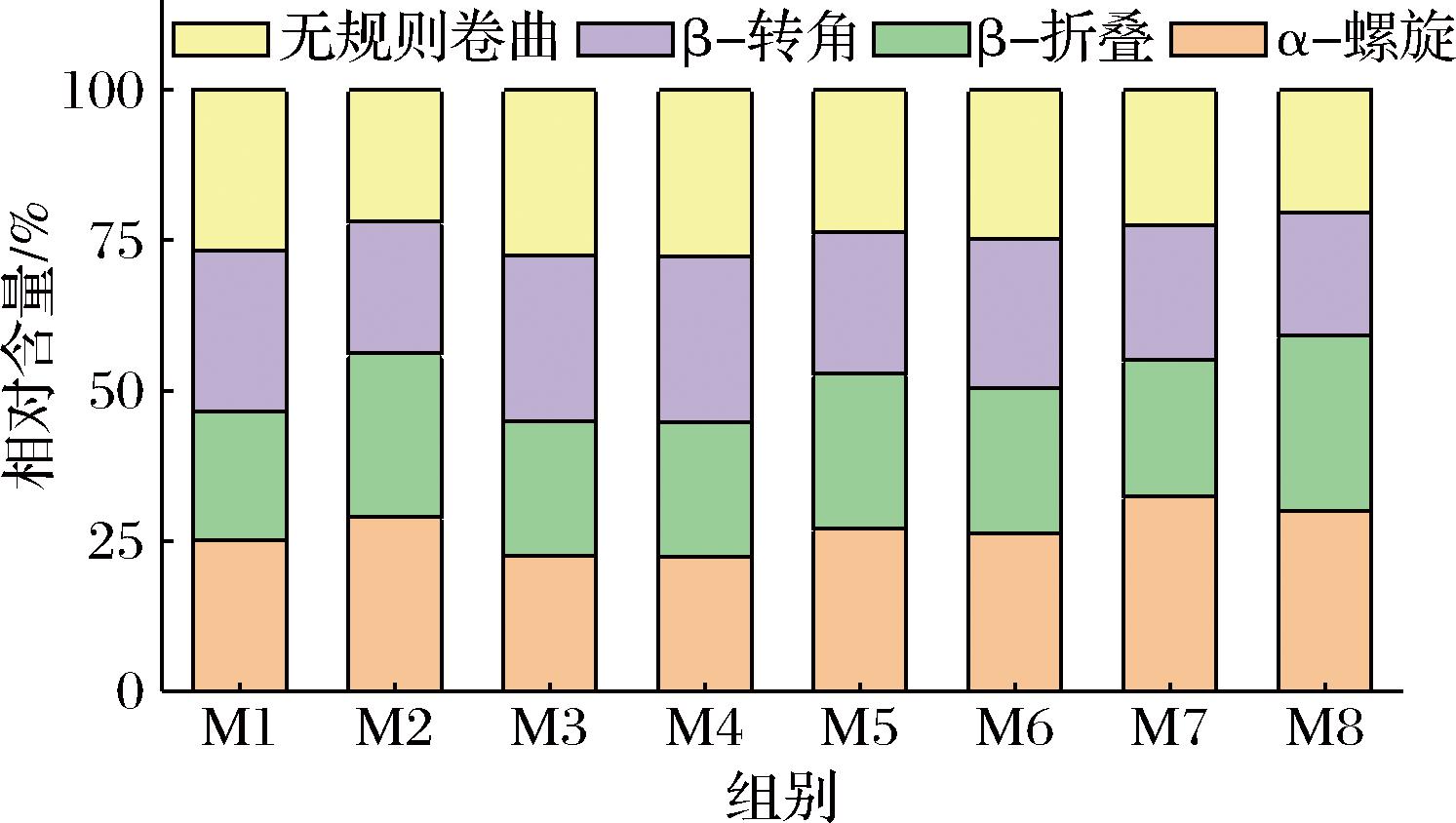
图8 不同养殖时间下鱼肉二级结构的变化
Fig.8 Changes in the secondary structure of protein of fish muscle during starvation time
2.7 化学作用力分析
由图9可知,随瘦身养殖时间延长,氢键整体呈升高趋势而疏水相互作用则呈逐渐下降趋势。这可能是因为随时间延长,蛋白质分子结构进一步展开,其内部疏水结合被打破,暴露出更多的亲水和疏水性基团,从而使氢键增加而蛋白内部的疏水相互作用减弱。氢键是稳定蛋白质二级结构中α-螺旋的主要作用力[32],其含量增加更有利于稳定蛋白质的二级结构,这与拉曼光谱的结果相一致。
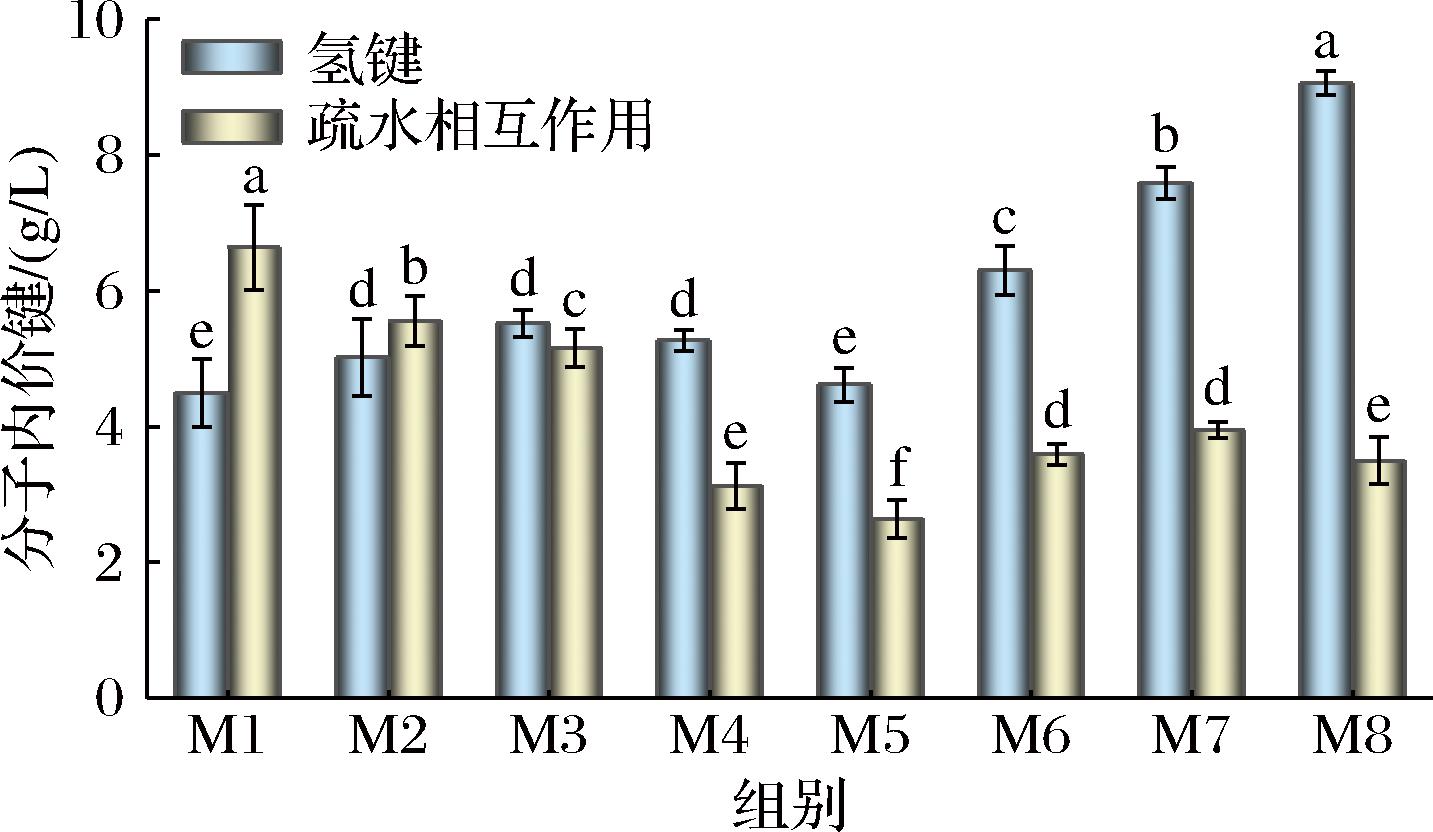
图9 不同养殖时间下鱼肉氢键和疏水相互作用的变化
Fig.9 Changes in hydrogen bond and hydrophobic interaction of fish muscle during starvation
3 结论与讨论
在瘦身养殖过程中,草鱼背部肌肉硬度、咀嚼性显著提升,弹性增加。但瘦身养殖8个月后,质构品质不再发生明显变化。随养殖时间的延长,鱼肉中胶原蛋白的含量增加,肌纤维直径显著减小肌束变细且排列更紧密,鱼肉中氢键作用增强,蛋白结构整体向有序性转变,结合水的能力提高,自由水含量降低,鱼肉具有良好的持水性。综上所述,适当时间瘦身养殖能够增加胶原蛋白含量,改变蛋白质结构,最终提升草鱼质构品质。本研究对草鱼瘦身养殖期间肌肉品质变化进行评价,对瘦身鱼肌肉品质变化机制进行研究,为瘦身鱼的推广养殖提供了基础依据。然而,本研究对于瘦身鱼的热加工相关特性的探索尚属有限,需要进一步研究不同加热处理方式对瘦身鱼的质构特征和蛋白质结构的影响。后续的研究可以深入探究热加工后瘦身鱼的质构感官变化和机理,为瘦身鱼产品的开发和改进提供更具体的指导,以满足消费者的需求,提升市场竞争力。
[1] 丁庆秋, 王进国.池塘大草鱼养殖模式及经济效益分析[J].当代水产, 2023, 48(4):82-83.DING Q Q, WANG J G.Cultivation mode and economic benefit analysis of grass carp in pond[J].Current Fisheries, 2023, 48(4):82-83.
[2] 王超, 罗远芬, 郭庆华, 等.清远市“瘦身鱼” 产业发展现状及对策[J].渔业致富指南, 2018(16):22-25.WANG C, LUO Y F, GUO Q H, et al.Development status and countermeasures of slimming fish industry in Qingyuan city[J].Fishery Guide to Be Rich, 2018(16):22-25.
[3] 周彬. 重庆地区草鱼不同养殖模式及其对肌肉品质的影响[D].重庆:西南大学, 2020.ZHOU B.Different culture models of grass carp in Chongqing area and their effects on muscle quality[D].Chongqing:Southwest University, 2020.
[4] 曹英楠. 瘦身鱼养殖过程中品质变化规律及鱼鳞高值化利用研究[D].重庆:西南大学, 2023.CAO Y N.Quality changes of grass carp (Ctenopharyngodon idellus) and high-value utilization of fish scales during lean culture[D].Chongqing:Southwest University, 2023.
[5] 刘婧懿, 赵前程, 程少峰, 等.鱼肉质构的影响因素及测定方法研究进展[J].食品安全质量检测学报, 2020, 11(9):3035-3043.LIU J Y, ZHAO Q C, CHENG S F, et al.Research progress on the influencing factors and determination methods of fish muscle texture[J].Journal of Food Safety &Quality, 2020, 11(9):3035-3043.
[6] 鸿巢章二. 水产利用化学[M].北京:中国农业出版社, 1994.HONG-CHAO Z E.Aquatic Utilization Chemistry[M].Beijing:China Agriculture Press, 1994.
[7] XIA W Y, MA L, CHEN X K, et al.Physicochemical and structural properties of composite gels prepared with myofibrillar protein and lecithin at various ionic strengths[J].Food Hydrocolloids, 2018, 82:135-143.
[8] TANG M, DAI H J, MA L, et al.Degradation of structural proteins and their relationship with the quality of Mandarin fish (Siniperca chuatsi) during post-mortem storage and cooking[J].International Journal of Food Science &Technology, 2020, 55(4):1617-1628.
[9] 邵婷. 脆肉鲩脆化过程中品质变化规律与机制[D].重庆:西南大学, 2022.SHAO T.Quality changes and mechanism of crisp grass carp (Ctenopharyngodon idellus C.et V) during crispness formation process[D].Chongqing:Southwest University, 2022.[10] CARR H Y, PURCELL E M.Effects of diffusion on free precession in nuclear magnetic resonance experiments[J].Physical Review, 1954, 94(3):630-638.
[11] MEIBOOM S, GILL D.Modified spin-echo method for measuring nuclear relaxation times[J].Review of Scientific Instruments, 1958, 29(8):688-691.
[12] 唐密. 冷藏调制鱼货架期内贮藏过程导致熟化后质构劣变的机理[D].重庆:西南大学, 2020.TANG M.The mechanism on deterioration of texture quality of cooked fish caused by stored time extension of refrigerated prepared fish[D].Chongqing:Southwest University, 2020.
[13] WANG Z M, HE Z F, GAN X, et al.Interrelationship among ferrous myoglobin, lipid and protein oxidations in rabbit meat during refrigerated and superchilled storage[J].Meat Science, 2018, 146:131-139.
[14] 孙艺. 货架期贮藏对冷藏调制鱼质构品质影响研究[D].重庆:西南大学, 2018.SUN Y.Study on the effect of shelf life storage on quality of chilled modulated fish[D].Chongqing:Southwest University, 2018.
[15] CHENG J H, SUN D W, HAN Z, et al.Texture and structure measurements and analyses for evaluation of fish and fillet freshness quality:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2014, 13(1):52-61.
[16] HATAE K, YOSHIMATSU F, MATSUMOTO J J.Role of muscle fibers in contributing firmness of cooked fish[J].Journal of Food Science, 1990, 55(3):693-696.
[17] JIANG W D, WEN H L, LIU Y, et al.Enhanced muscle nutrient content and flesh quality, resulting from tryptophan, is associated with anti-oxidative damage referred to the Nrf2 and TOR signalling factors in young grass carp (Ctenopharyngodon idella):Avoid tryptophan deficiency or excess[J].Food Chemistry, 2016, 199:210-219.
[18] 甘承露. 脆肉鲩肌肉特性及其贮藏稳定性的研究[D].武汉:华中农业大学, 2010.GAN C L.Studies on the properties and storage stability of crisp grass carp muscle[D].Wuhan:Huazhong Agricultural University, 2010.
[19] 林婉玲, 关熔, 曾庆孝, 等.影响脆肉鲩鱼背肌质构特性的因素[J].华南理工大学学报(自然科学版), 2009, 37(4):134-137.LIN W L, GUAN R, ZENG Q X, et al.Factors affecting textural characteristics of dorsal muscle of crisp grass carp[J].Journal of South China University of Technology (Natural Science Edition), 2009, 37(4):134-137.
[20] TORNBERG E, WAHLGREN M, BRØNDUM J, et al.Pre-rigor conditions in beef under varying temperature- and pH-falls studied with rigometer, NMR and NIR[J].Food Chemistry, 2000, 69(4):407-418.
[21] S NCHEZ-ALONSO I, MORENO P, CARECHE M.Low field nuclear magnetic resonance (LF-NMR) relaxometry in Hake (Merluccius merluccius, L.) muscle after different freezing and storage conditions[J].Food Chemistry, 2014, 153:250-257.
NCHEZ-ALONSO I, MORENO P, CARECHE M.Low field nuclear magnetic resonance (LF-NMR) relaxometry in Hake (Merluccius merluccius, L.) muscle after different freezing and storage conditions[J].Food Chemistry, 2014, 153:250-257.
[22] ZHU J Y, LI S S, YANG L, et al.Effect of multiple freeze-thaw cycles on water migration, protein conformation and quality attributes of beef longissimus dorsi muscle by real-time low field nuclear magnetic resonance and Raman spectroscopy[J].Food Research International, 2023, 166:112644.
[23] XU X L, HAN M Y, FEI Y, et al.Raman spectroscopic study of heat-induced gelation of pork myofibrillar proteins and its relationship with textural characteristic[J].Meat Science, 2011, 87(3):159-164.
[24] LORD R C, YU N T.Laser-excited Raman spectroscopy of biomolecules.I.Native lysozyme and its constituent amino acids[J].Journal of Molecular Biology, 1970, 50(2):509-524.
[25] JR T G J.New structural insights from Raman spectroscopy of proteins and their assemblies[J].Biopolymers, 2002, 67(4-5):214-225.
[26] BADII F, HOWELL N.Fish gelatin:Structure, gelling properties and interaction with egg albumen proteins[J].Food Hydrocolloids, 2006, 20(5):630-640.
[27] DOS SANTOS C A A S S, CARVALHO J O, DA SILVA FILHO J G, et al.High-pressure Raman spectra and DFT calculations of l-tyrosine hydrochloride crystal[J].Physica B:Condensed Matter, 2018, 531:35-44.
[28] AN H, WEERASINGHE V, SEYMOUR T A, et al.Cathepsin degradation of Pacific whiting surimi proteins[J].Journal of Food Science, 1994, 59(5):1013-1017.
[29] OSHOKOYA O.Development of advanced chemometric methods for analysis of deep-ultraviolet resonance Raman and circular dichroism spectroscopic data for protein secondary structure determination[D].Columbia:University of Missouri-Columbia, 2015.
[30] YANG R, LIU Y Q, MENG D M, et al.Effect of atmospheric cold plasma on structure, activity, and reversible assembly of the phytoferritin[J].Food Chemistry, 2018, 264:41-48.
[31] SHAO J H, ZOU Y F, XU X L, et al.Evaluation of structural changes in raw and heated meat batters prepared with different lipids using Raman spectroscopy[J].Food Research International, 2011, 44(9):2955-2961.
[32] SUN X D, ARNTFIELD S D.Molecular forces involved in heat-induced pea protein gelation:Effects of various reagents on the rheological properties of salt-extracted pea protein gels[J].Food Hydrocolloids, 2012, 28(2):325-332.