抑郁症是全球最普遍的精神障碍之一,全球超过3.2亿人受到影响[1]。其主要的特征是情绪低落、快感缺失、睡眠障碍、食欲不振等。抑郁症发病与遗传、社会生活环境等诸多因素密切相关,是一种极为常见但发病机制又知之甚少的疾病之一。现有的发病机制主要包括下丘脑-垂体-肾上腺轴亢进学说、单胺类神经递质失调学说、微生物-肠-脑轴学说等[2]。单胺类药物是目前治疗抑郁症的主要临床用药,但具有强烈的副作用[3],所以迫切的需要开发一种新型、温和的方法抑制抑郁症状的发生发展。
近年来诸多研究表明,肠道微生物通过微生物-肠-脑轴来影响大脑的活动和行为,与抑郁症、精神分裂症等精神疾病的发生发展密切相关[4]。与健康受试者相比,抑郁症患者的肠道微生物组成存在显著差异[5]。抑郁症患者肠道中的乳杆菌和双歧杆菌的丰度较低,且将抑郁症患者的粪便移植到无菌小鼠体内后,小鼠肠道中厚壁菌、放线菌和拟杆菌的丰度发生显著变化,且表现出抑郁样行为[6]。
抑郁症患者的肠道微生物及其代谢物发生变化导致肠道稳态被破坏,影响肠道上皮的功能,引起肠屏障功能损伤发生“肠漏”的现象,进而使肠道代谢物、微生物细胞成分等通过肠屏障进入体液循环,增加了与抑郁症发病机制有关的炎症反应的发生率[7]。益生菌是对宿主有益的一类活菌[8],在诸多临床研究中已证实益生菌对受试者的抑郁症状具有明显的缓解作用[9],有望成为抑郁症治疗的新兴选择。
在本团队前期的研究中发现,复合乳酸菌制剂(短双歧杆菌CCFM1025、长双歧杆菌CCFM687和乳酸片球菌CCFM6432)在动物实验以及临床评估中均展现出抗抑郁和焦虑的功能。为了进一步探究其情绪调节的作用机制,本研究通过构建慢性不可预知温和刺激(chronic unpredictable mild stress,CUMS)小鼠模型,探究CCFM6432单菌干预对小鼠肠道菌群及其代谢物的调节机制,为缓解抑郁症状的益生菌筛选和机制研究提供参考。
1 材料与方法
1.1 实验试剂
L-乳酸标准品,美国Sigma公司;小鼠脂多糖试剂盒,南京森贝伽生物科技有限公司;粪便DNA快速提取试剂盒,美国MP Biomedicals公司;实时荧光定量PCR预混液,美国Bio-Rad公司;引物,生工生物工程(上海)股份有限公司;Toll样受体4(toll-like receptor 4,TRL4)受体蛋白、核因子κB(Nuclear Factor Kappa-B,NF-κB)抗体,碧云天生物技术有限公司;DNA胶回收试剂盒、细胞/组织总RNA快速提取试剂盒、逆转录试剂盒,诺维赞生物科技股份有限公司。
1.2 实验设备
气相色谱-质谱联用仪,美国Thermo Scientific公司;实时定量基因扩增仪,美国Bio-Rad公司;落地式离心机,美国Thermo Fisher Scientific公司;恒温恒湿培养箱,上海森信实验仪器有限公司;加热磁力搅拌器,德国IKA公司;SCIENTZ-48高通量组织研磨器,宁波新芝生物科技股份有限公司。
1.3 实验菌株
本实验使用的2株乳酸片球菌(Pediococcus acidilactici)CCFM6432、FXJKS25M4分离自健康成人的粪便样品,均来自于江南大学食品学院生物技术中心菌种保藏库。在MRS(man rogosa sharpe)固体培养基上划线活化2次后(37 ℃,培养36~48 h),挑取单菌落接种至MRS液体培养基中,37 ℃培养18 h后,在同样的条件下以1%的接种量进行扩培以增大菌量,将所得的扩培液在4 ℃,8 000×g离心15 min弃去上清液并收集菌体,用无菌的生理盐水重复以上操作洗涤2次后,加入10%(体积分数)脱脂乳充分混匀,置于-80 ℃下保存备用。
1.4 动物实验方案
实验动物选择SPF级的4周龄C57BL/6 J雄性小鼠32只,购自南京维通利华实验动物技术有限公司。本实验全程严格遵守国家标准中实验动物福利伦理学的要求(伦理编号:JN.No20220615c0721025[238]),小鼠饲养在江南大学实验动物屏障系统中,饲养环境温度为21~25 ℃,相对湿度40%~60%,以12 h光照-12 h黑夜进行的昼夜交替光照模式。经过1周的适应性饲养后,将小鼠随机分为4组:空白组(Control组)、模型组(CUMS组)、CCFM6432干预组(CCFM6432组)、对照菌FXJKS25M4干预组(FXJKS25M4组)。除空白组外,进行持续4周的CUMS造模[10]。并在干预期间进行益生菌灌胃(1×108 CFU/d),Control和CUMS组使用100 g/L脱脂乳代替,动物实验设计方案如图1所示。

图1 动物实验设计方案
Fig.1 Design for animal experiments
1.5 行为学实验
1.5.1 旷场实验(open field test, OFT)
参考 MURRAY等[1]的实验方法,并在此基础上做进一步调整,将小鼠放置在旷场中心,并用摄像机实时记录小鼠在8 min内的运动轨迹,计算出实验鼠在中心区域内停留的时间占比。
1.5.2 高架十字迷宫实验(elevated plus maze test, EPM)
将实验鼠放置高架十字迷宫的中心区域并面向开放臂,并用摄像机记录实验鼠在6 min内的运动轨迹,计算出实验鼠在开放臂和闭合臂停留的时间及占比[11]。
1.5.3 悬尾实验(tail suspension test, TST)
将实验鼠的尾部1/3处用黑色胶带悬挂固定在白色背景的隔间内,保证实验鼠头部朝下的同时防止其掉落以及向上攀爬,并用摄像机记录实验鼠在6 min内的运动情况,分析实验鼠在6 min内静止、活跃和狂躁的时间及其占比[11]。
1.5.4 首粒黑便时间测定
在实验鼠禁食12 h后,每只鼠灌胃0.2 mL的“墨汁”(卡拉胶和活性炭混合配制而成),并记录每只小鼠从灌胃开始至排出第一粒黑色粪便为止的时间,即为首粒黑便时间。
1.6 肠道菌群16S rRNA测序分析
使用粪便DNA快速提取试剂盒提取小鼠粪便总基因组,利用引物(341F:5′-CCTAYGGGRBGCASCAG-3′;806R:5′-GGACTACNNGGGTATCTAAT-3′)对细菌模板DNA进行16s rDNA的V3~V4区扩增。使用琼脂糖凝胶电泳对PCR产物进行纯化,并使用DNA胶回收试剂盒进行回收。样本测序在Illumina Miseq PE300平台进行,获得文库初始数据后,采用QIIME软件对下级数据进行质控、拼接、注释等分析[12]。
1.7 肠道非靶向代谢物的检测
称取20 mg的盲肠内容物样品,加入200 μL H2O涡旋30 s后,在70 Hz下匀浆3次,每次30 s;再加入800 μL甲醇∶乙腈=(1∶1,体积比)(提前-20 ℃预冷)沉淀蛋白,在4 ℃下,12 000×g离心15 min,取上清液真空浓缩后,加入200 μL乙腈∶水(1∶1)复溶,再次离心后取上清液使用GC-MS上机检测。
1.8 实时定量qPCR
通过实时定量qPCR检测结肠组织中闭合小环蛋白(ZO-1)、咬合蛋白(Occludin)、闭合蛋白(Claudins-1),海马中的TLR4受体蛋白、NF-κB、肿瘤坏死因子α(tumor necrosis factor,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、IL-6、IL-17以及小胶质细胞标志物Iba1的基因表达情况。由生工生物工程(上海)股份有限公司进行引物合成,引物信息如表1所示。
表1 引物序列
Table 1 Primer Sequence
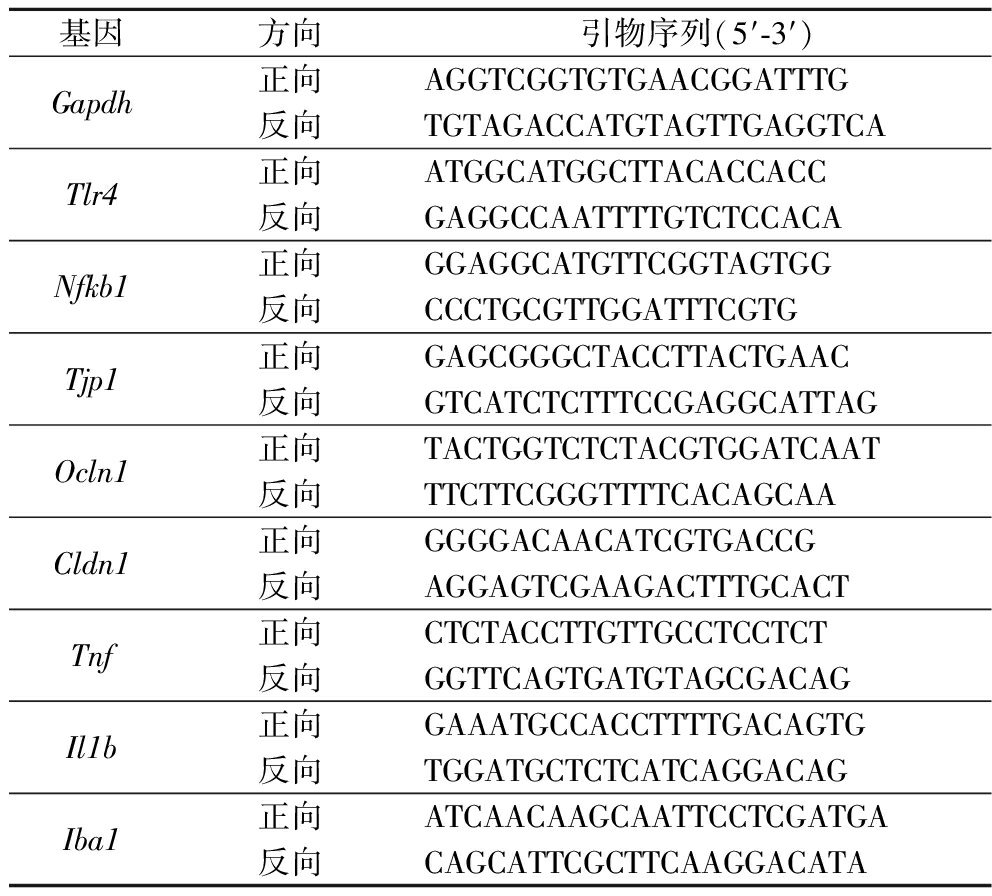
基因方向引物序列(5′-3′)Gapdh正向AGGTCGGTGTGAACGGATTTG反向TGTAGACCATGTAGTTGAGGTCATlr4正向ATGGCATGGCTTACACCACC反向GAGGCCAATTTTGTCTCCACANfkb1正向GGAGGCATGTTCGGTAGTGG反向CCCTGCGTTGGATTTCGTGTjp1正向GAGCGGGCTACCTTACTGAAC反向GTCATCTCTTTCCGAGGCATTAGOcln1正向TACTGGTCTCTACGTGGATCAAT反向TTCTTCGGGTTTTCACAGCAACldn1正向GGGGACAACATCGTGACCG反向AGGAGTCGAAGACTTTGCACT Tnf正向CTCTACCTTGTTGCCTCCTCT反向GGTTCAGTGATGTAGCGACAGIl1b正向GAAATGCCACCTTTTGACAGTG反向TGGATGCTCTCATCAGGACAGIba1正向ATCAACAAGCAATTCCTCGATGA反向CAGCATTCGCTTCAAGGACATA
取结肠组织20 mg,按照细胞/组织总RNA快速提取试剂盒说明书提取小鼠结肠组织中的总RNA,并检测其浓度和纯度(A260/A280应大于2.0)。采用反转录试剂盒得到cDNA,在荧光定量扩增仪器上进行检测,海马组织使用相同的方法进行处理。每个样本设置3个平行孔,反应结束后,采用2-ΔΔCt阈值循环法对结果进行分析,计算不同组间各基因的表达情况。
1.9 血清中脂多糖(lipopolysaccharide,LPS)的测定
血清样本于冰上化冻后,室温下平衡30 min,随后严格按照小鼠脂多糖试剂盒的说明书进行样本中LPS含量的检测。
1.10 数据分析
数值表示为平均值±标准差,采用Prism 9.0进行统计分析和图形绘制。模型组与空白组、干预组采用单因素方差分析(one-way ANOVA)。*代表空白组、干预组与模型组之间有显著差异。显著性标准设为P<0.05;以符号数目区分显著性等级,其中*P<0.05,**P<0.01,***P<0.001,****P<0.000 1。
2 结果与分析
2.1 乳酸片球菌CCFM6432缓解慢性应激导致小鼠行为异常
为了探究CCFM6432是否具有缓解抑郁的作用,本研究对小鼠进行了4周CUMS干预,在造模期间给予口服益生菌干预,随后进行了行为学测试。相对于Control组,CUMS组出现了显著的焦虑(图2-a,图2-b)与抑郁样(图2-c)行为,表现为小鼠在旷场实验中的中心区域停留时间占比和在开放臂停留的时间显著下降,在悬尾实验中的静止时间(绝望时间)占比增加。相比低产乳酸的同种对照菌株乳酸片球菌FXJKS25M4,CCFM6432干预显著提升了小鼠在旷场实验中的中心区域和高架十字开放臂的探索时间,减少小鼠在悬尾实验中的绝望时间,这表明CCFM6432干预能缓解小鼠的抑郁情绪。
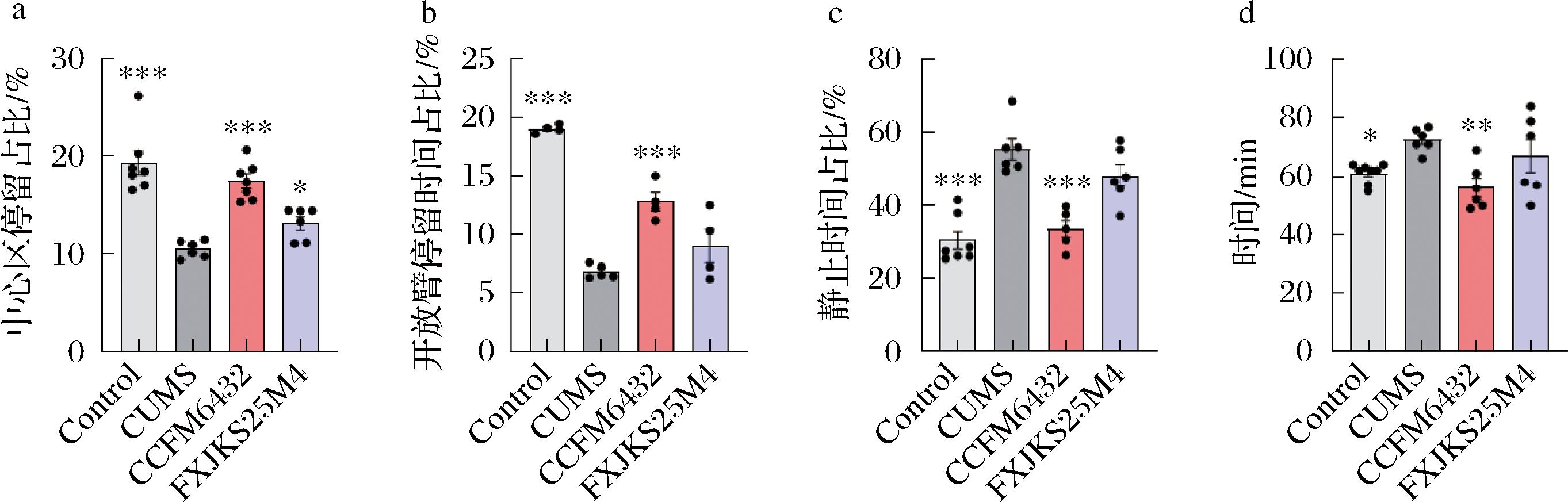
a-旷场实验;b-高架十字迷宫实验;c-悬尾实验;d-首粒黑便时间测试
图2 行为学实验结果
Fig.2 Results of behavioral tests
临床抑郁症患者往往伴随着腹胀、排便不畅等胃肠道疾病,许多抗抑郁药物也会导致肠道蠕动减慢[13-14]。益生菌干预被证实可以促进小鼠的胃肠道蠕动[15]。在本研究中,CUMS造模会延长小鼠排出首粒黑便的平均时间,但是CCFM6432干预具有显著的缓解作用(P<0.01)。
2.2 乳酸片球菌CCFM6432改善肠道微生态失调
肠道微生物是人体最大、最复杂的微生态系统[16],肠道微生态失衡会促进局部或全身病理,越来越多的研究指出肠道微生物群失调与抑郁症的发病机制相关。并且肠道微生物通过参与胃肠道和大脑之间的双向通信系统,可能是抑郁症诊断和治疗的重要参与者。因此,肠道微生物调节可能是一种合理有效治疗抑郁症的方法[6]。
为了深入解析CCFM6432缓解抑郁和焦虑行为的机制,本研究使用16S rRNA测序技术对小鼠肠道菌群的多样性及丰度进行探究。肠道微生物的多样性包括α多样性和β多样性,本研究通过Chao1和Shannon指数表征α多样性,如图3-a所示,CUMS造模导致肠道微生物的多样性显著降低,而在CCFM6432干预后Chao1指数(P=0.002)和Shannon指数均上调(P=0.009),说明服用CCFM6432能显著恢复CUMS导致的菌群多样性异常降低。同时,通过β多样性的可视化结果可以看出,不可预知慢性应激小鼠的肠道菌群结构和正常小鼠存在显著差异(P=0.002),虽然CCFM6432干预能显著调节小鼠的肠道菌群的结构,但是不能完全逆转造模对肠道菌群造成的影响。

a-Chao1指数α多样性;b-Shannon指数α多样性;c-β多样性
图3 小鼠粪便菌群多样性分析
Fig.3 Diversity analysis of mouse fecal microbiota
根据测序结果,我们对肠道菌群进行进一步的注释,图4显示了4个组在门和属水平上的微生物群的总体组成和平均相对丰度。CUMS小鼠肠道菌群在门水平上失衡,拟杆菌的丰度显著升高,而CCFM6432与对照菌株均可以恢复厚壁菌门与拟杆菌门的比例。
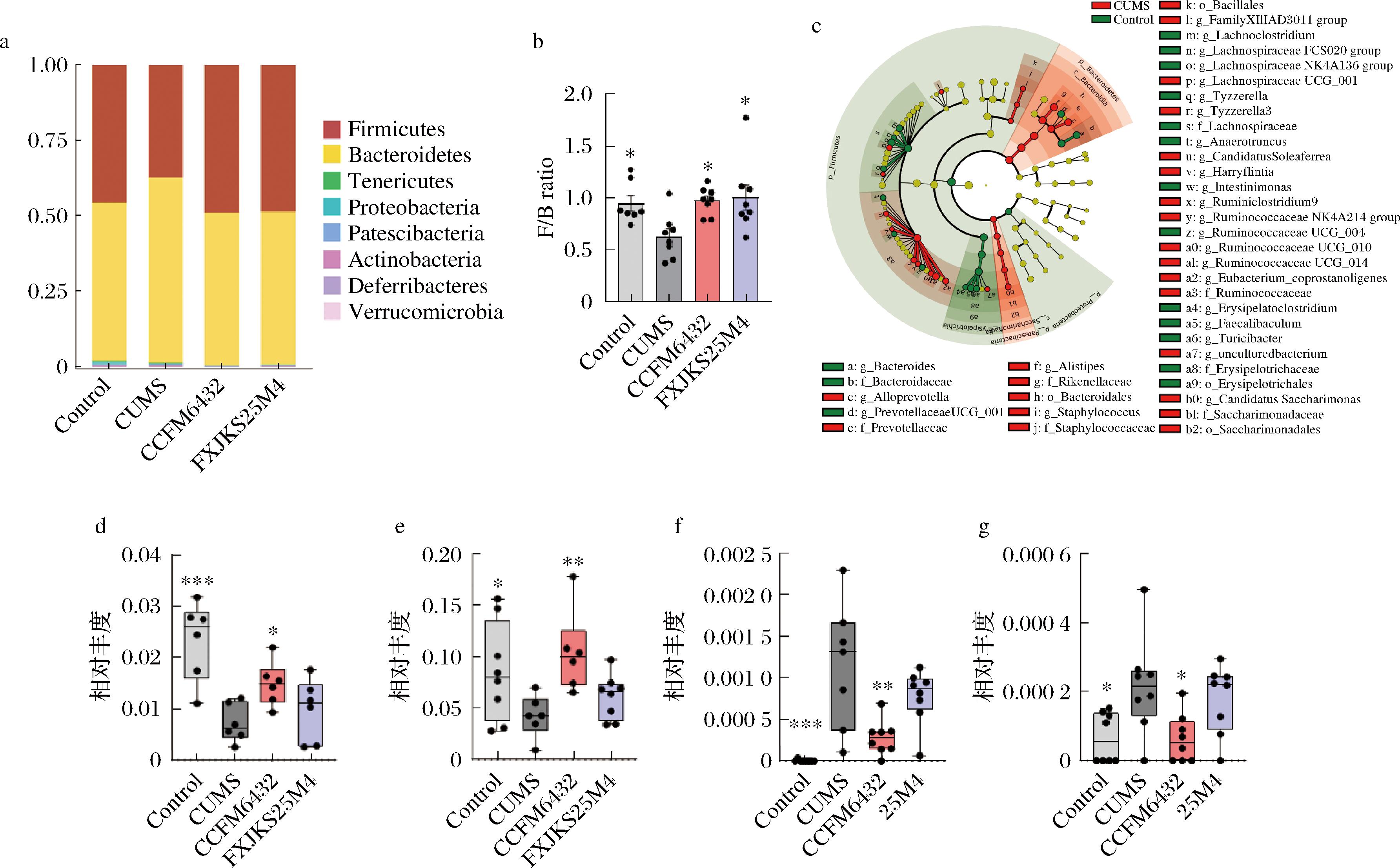
a-门水平相对丰度;b-拟杆菌门∶厚壁菌门;c-属水平LEfSe分析;d-Lachnoclostridium属相对丰度;e-Lachnospiraceae NK4A136 group属相对丰度;f-Staphylococcus属相对丰度;g-Escherichia属相对丰度
图4 小鼠粪便菌群门属水平分析
Fig.4 Analysis of the phylum and genus level of mouse fecal microbiota
基于LEfSe分析筛查出了空白组和CUMS模型组肠道菌群的标志菌属(LDA>2,P<0.05),并比较了CCFM6432和对照菌株25M4干预对这些菌属的调节作用。与对照菌株相比,CCFM6432可以特异性提升Lachnospiraceae NK4A136 group和Lachnoclostridium属的丰度。这2个属在合成短链脂肪酸(short chain fatty acids, SCFAs)和色氨酸代谢中发挥重要作用[17],SCFAs可以降低促炎细胞因子水平,抑制全身炎症。同时,我们发现相对于空白组,CUMS会导致小鼠肠道中葡萄球菌(Staphylococcus)和大肠杆菌(Escherichia)等致病菌属的丰度显著提升,相比于对照菌株,CCFM6432干预可以有效地缓解这一现象。这些结果显示,CCFM6432可能通过调节肠道菌群及其代谢物,发挥降低机体炎症的作用。
2.3 乳酸片球菌CCFM6432对慢性应激后肠道代谢物的影响
为了寻找CCFM6432抗抑郁的关键代谢物质,我们基于非靶向代谢组学分析对小鼠粪便进行差异物质筛选,基于空白组与对照组的差异代谢物(fold change≥2,P<0.05)的分层聚类热图(hierarchical clustering heatmaps)分析结果显示(图5-a),CCFM6432干预可以抑制CUMS导致小鼠肠道12-羟基十二烷酸、5-羟基吲哚-3-乳酸等4个代谢物含量显著升高,恢复由CUMS导致的2-脱氧鸟苷、DL-乳酸等4个代谢物含量的异常降低。但是,根据主成成分分析(principal component analysis, PCA)的结果显示(图5-b),虽然益生菌干预不会使肠道代谢物恢复到正常小鼠的水平,但是和CUMS造模组相比存在显著差异,这可能是益生菌干预使得肠道微环境进入一个新的平衡状态。
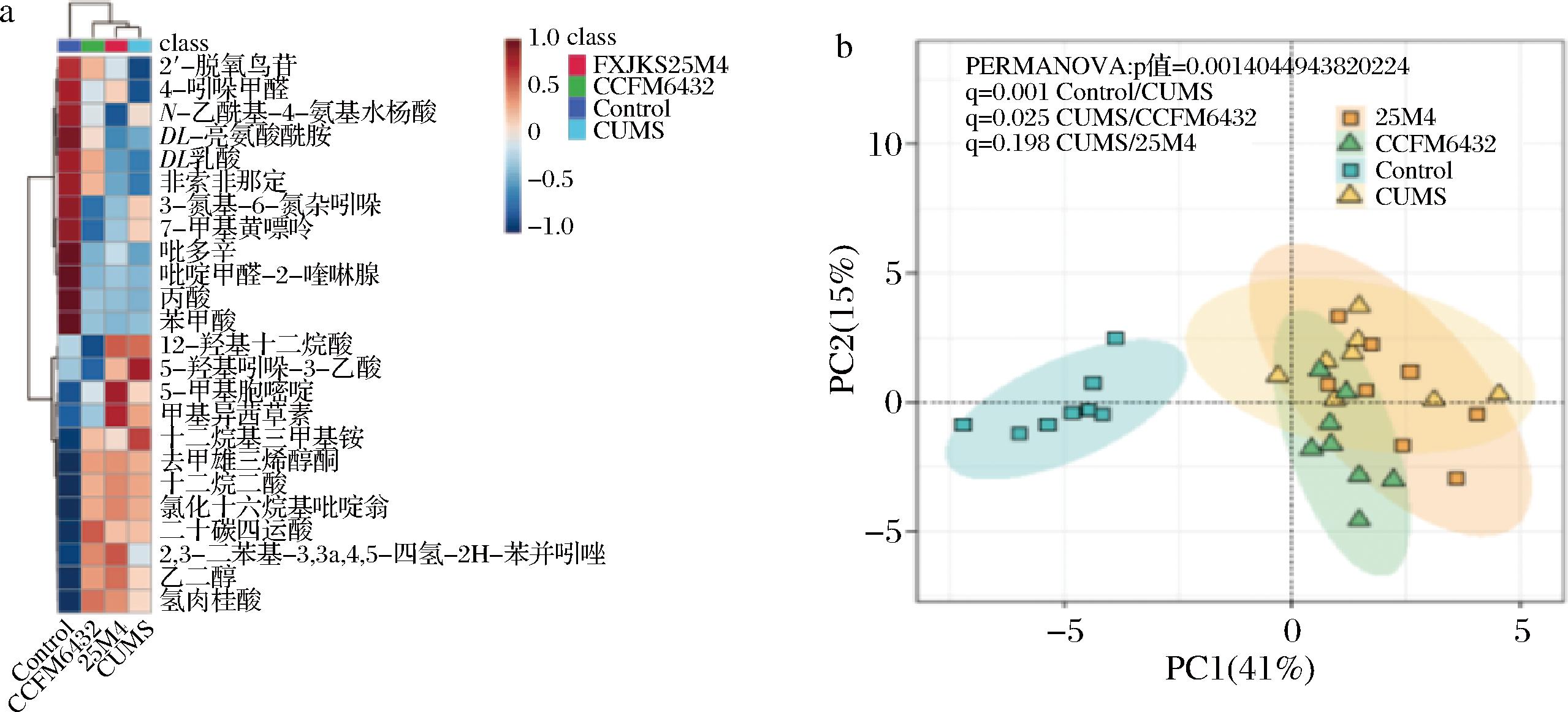
a-分层聚类热图;b-主成分分析
图5 小鼠盲肠内容物代谢组分析
Fig.5 Metabolomic analysis of cecal contents
我们基于KEGG通路数据库进行代谢物的富集分析,筛查了CCFM6432和Control组与CUMS组间共同的差异代谢通路(图6-a~图6-c),最后锁定到了2条关键代谢通路:丙酮酸代谢(乳酸,图6-c)、嘌呤代谢(鸟嘌呤、腺嘌呤,图6-d~图6-e)。这提示CCFM6432可能通过产生大量乳酸抑制致病菌的过度生长,进而维持肠道环境处于稳定状态。在本团队前期研究中发现,CCFM6432的基因组和质粒中均不存在乳酸片球菌素ped-A基因,并通过体外抑菌圈实验证实,CCFM6432的发酵上清液和乳酸标准品都具有抗菌活性,这与本研究的结果相吻合[18]。
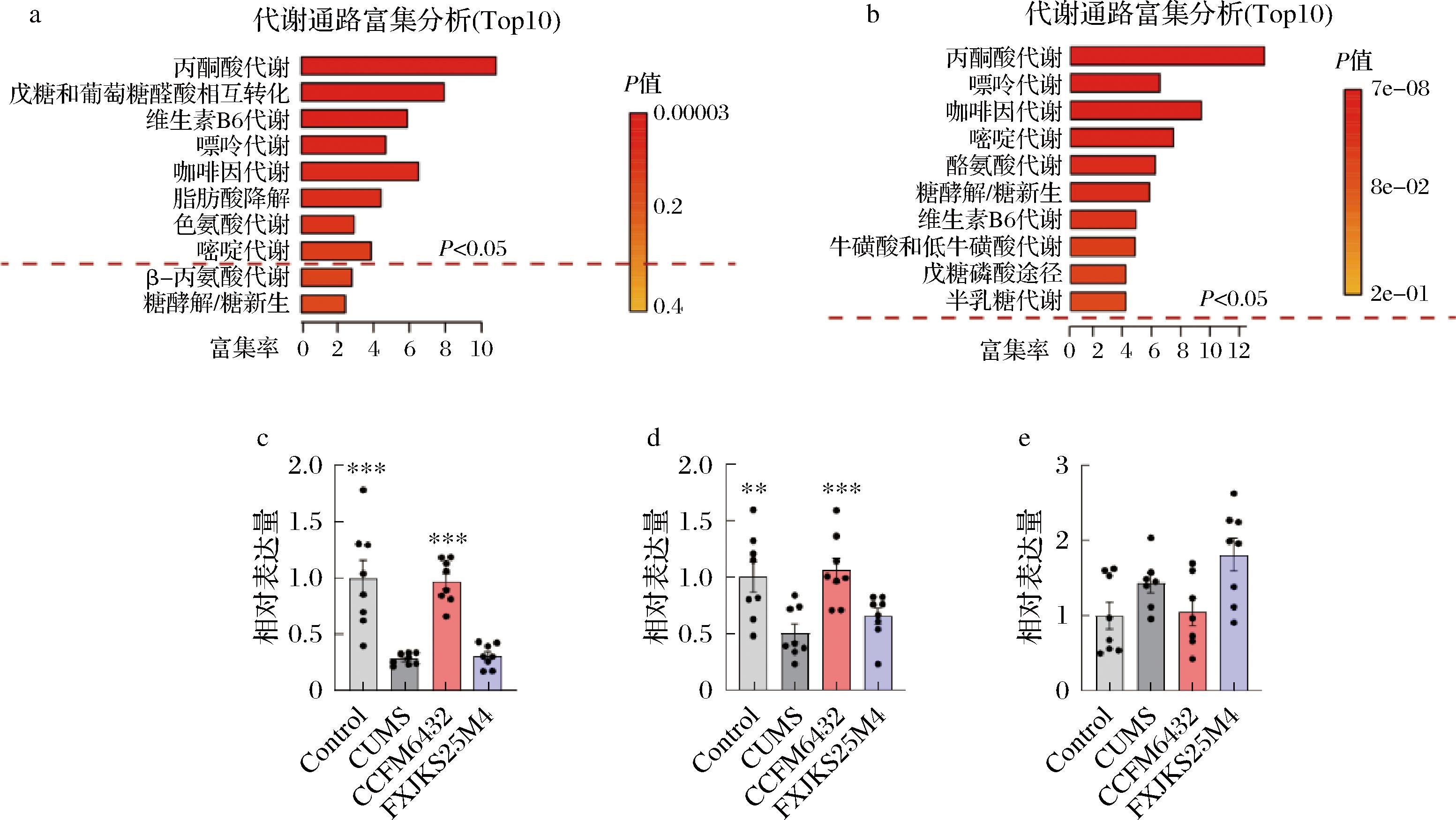
a-代谢通路富集分析(Control vs CUMS); b-代谢通路富集分析(CCFM6432 vs CUMS);c-乳酸相对含量;d-鸟嘌呤相对含量;e-腺嘌呤相对含量
图6 差异代谢物分析
Fig.6 Differential metabolite analysis
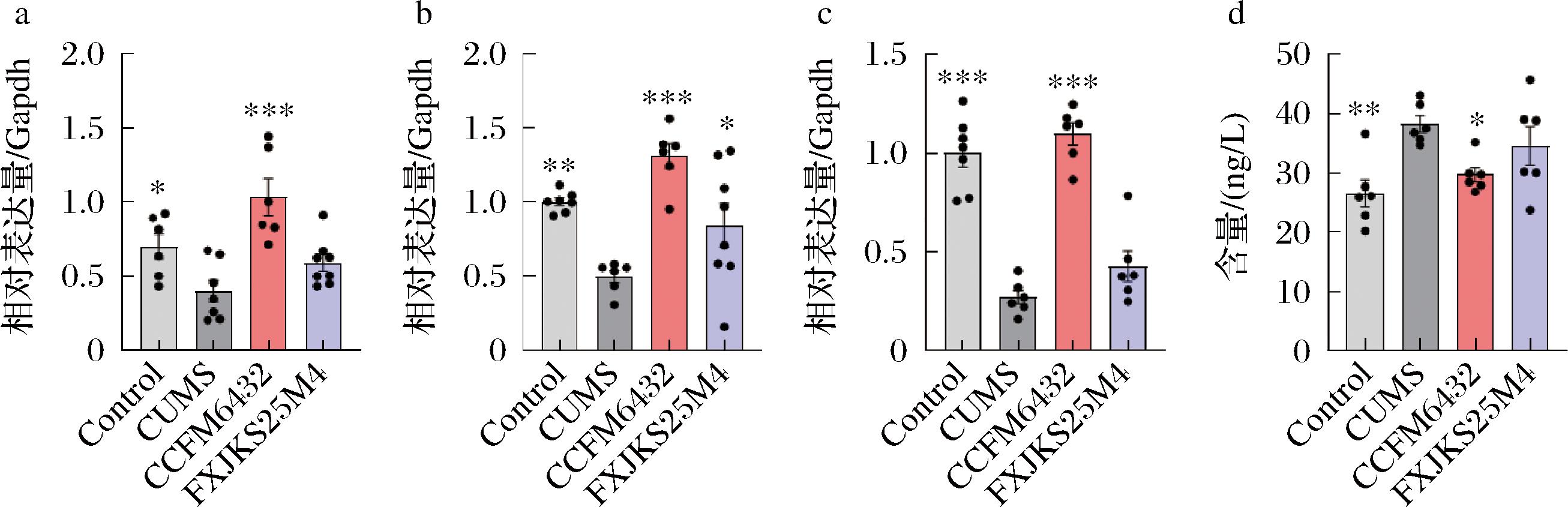
a-ZO-1基因表达;b-Claudins-1基因表达;c-Occludin基因表达;d-LPS含量
图7 小鼠血清中LPS含量以及肠道屏障相关蛋白基因表达情况
Fig.7 LPS content in mouse serum and expression of intestinal barrier related protein genes
2.4 乳酸片球菌CCFM6432可以修复由脂多糖导致的胃肠道屏障受损
肠道屏障保护肠道细胞免受腔内微生物和抗原的侵害,但是肠道微生物群、肠道免疫系统和新陈代谢的变化也可能导致肠道屏障破坏[19],出现“肠漏”的现象,它是指管腔内容物与肠黏膜免疫系统的异常相互作用。这个过程在个体中持续存在时,会导致免疫反应的局部失调,最终导致自身慢性炎症状态,进一步引发各种靶器官的全身炎症,导致炎症性肠病、结肠炎、中枢神经系统疾病等疾病[20]。本研究中,模型组小鼠结肠组织中紧密连接蛋白ZO-1、Claudins-1和Occludin的基因表达显著降低(图7-a~图7-c),而在CCFM6432干预后可以恢复这些蛋白相关基因的正常表达。
与此同时,我们使用ELISA试剂盒,进一步检测了小鼠血清中LPS的含量,LPS是革兰氏阴性菌细菌被膜的主要组成成分,可以通过激活TLR4通路促进炎症反应[21]。越来越多的研究证明,低剂量LPS作用于小鼠会诱导的中枢炎症反应,导致认知功能障碍和抑郁样行为的发生[1]。本研究结果与前人一致,通过检测血清中LPS的结果(图7-d),CUMS导致小鼠血清中的LPS异常升高。
基于以上结果推测,CUMS可能造成小鼠肠道中致病菌丰度水平异常升高、肠道微生态失衡、破坏胃肠道屏障,从而导致血清中LPS含量异常。血清中的LPS进入脑部造成神经炎症并造成抑郁症状的发生和发展,而CCFM6432干预则可以通过在小鼠肠道合成乳酸抑制致病菌的生长,从而阻断该通路。
2.5 乳酸片球菌CCFM6432对LPS导致的脑部神经炎症具有缓解作用
在脑部免疫调节系统中小胶质细胞发挥重要作用,是大脑先天免疫反应的关键调节因子之一[22],它起源于卵黄囊中的原始巨噬细胞、充当大脑中的原代吞噬细胞。小胶质细胞通过表达模式识别受体检测危险相关分子模式和病原体相关分子模式,检测到后,活化的小胶质细胞产生并释放一系列细胞因子和趋化因子,以引发免疫反应并在受伤或病理事件后对微环境做出反应[23]。因此,我们接下来探究了CCFM6432是否是通过抑制TLR4/NF-kB信号通路来发挥抗抑郁的作用。结果如图8所示,CUMS导致小鼠海马中TLR4(P<0.001)和NF-κB(P<0.01)的基因上调表达,并促进了下游的促炎因子TNF-α(P<0.001)、IL-1β(P<0.01)和小胶质细胞标志物Iba1(P<0.01)的基因表达。相比对照菌株,高产乳酸的CCFM6432能下调TLR4、NF-κB以及下游炎症因子的表达,并抑制小胶质细胞的活化。以上证据进一步表明,降低小鼠体内LPS含量可能是CCFM6432缓解小鼠神经炎症及抑郁症状的关键机制。
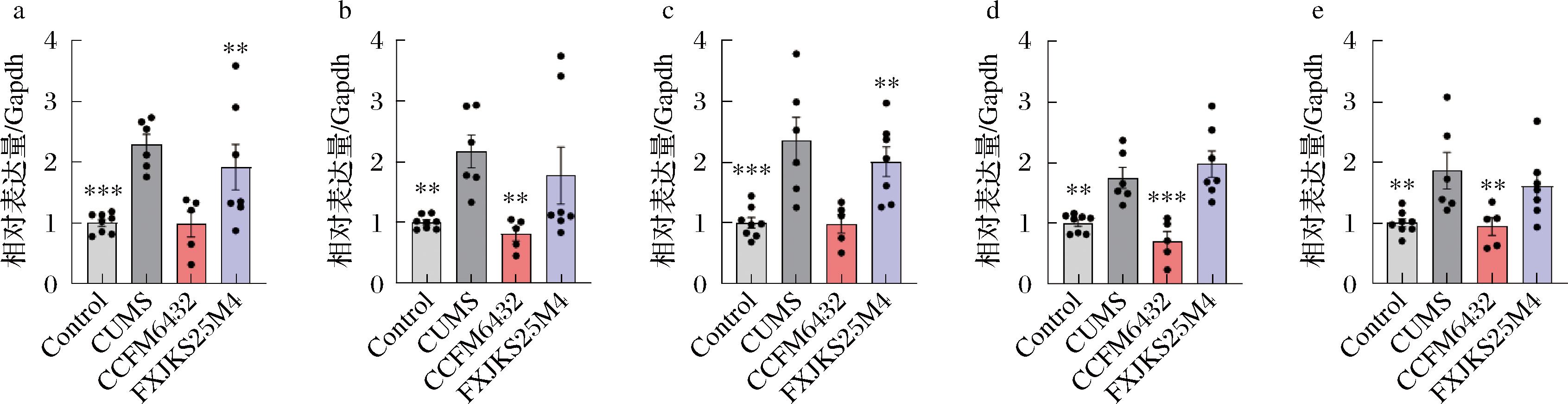
a-TLR4基因表达;b-NF-κB基因表达;c-TNF-α基因表达;d-IL-1β基因表达;e-Iba1基因表达
图8 小鼠海马组织脑部神经炎症通路相关基因表达情况
Fig.8 Expression of genes related to neuroinflammatory pathways in the hippocampus of mice
3 结论
本研究使用经典的CUMS小鼠抑郁模型,对乳酸片球菌CCFM6432缓解抑郁的功效及作用机制进行探究。结果表明,CCFM6432是一种有潜力的“精神益生菌”,可减轻抑郁症及其伴随的肠道蠕动降低。它通过调节肠道菌群及其代谢物,抑制CUMS导致的肠道致病菌丰度异常增加,减轻肠道屏障损伤。进而降低血清中LPS的含量,抑制LPS通过体液循环对脑部免疫系统的刺激造成的神经炎症,进而发挥抗抑郁和焦虑的作用。本研究为抑郁症膳食干预疗法开发和“肠道菌群-大脑”互作机制提供了新的见解。
[1] MURRAY E, SHARMA R, SMITH K B, et al.Probiotic consumption during puberty mitigates LPS-induced immune responses and protects against stress-induced depression- and anxiety-like behaviors in adulthood in a sex-specific manner[J].Brain, Behavior, and Immunity, 2019, 81:198-212.
[2] LIU L X, WANG H Y, CHEN X Y, et al.Gut microbiota and its metabolites in depression:From pathogenesis to treatment[J].EBioMedicine, 2023, 90:104527.
[3] 田培郡. 具有缓解抑郁功能的短双歧杆菌CCFM1025的研究[D].无锡:江南大学, 2021.TIAN P J.Research on Bifidobacterium breve CCFM1025 with the antidepressant-like effect[D].Wuxi:Jiangnan University, 2021.
[4] CRYAN J F, DINAN T G.Mind-altering microorganisms:The impact of the gut microbiota on brain and behaviour[J].Nature Reviews.Neuroscience, 2012, 13(10):701-712.
[5] BARANDOUZI Z A, STARKWEATHER A R, HENDERSON W A, et al.Altered composition of gut microbiota in depression:A systematic review[J].Frontiers in Psychiatry, 2020, 11:541.
[6] ZHENG P, ZENG B, ZHOU C, et al.Gut microbiome remodeling induces depressive-like behaviors through a pathway mediated by the host’s metabolism[J].Molecular Psychiatry, 2016, 21(6):786-796.
[7] NIKOLOVA V L, CLEARE A J, YOUNG A H, et al.Acceptability, tolerability, and estimates of putative treatment effects of probiotics as adjunctive treatment in patients with depression:A randomized clinical trial[J].JAMA Psychiatry, 2023, 80(8):842-847.
[8] 邹仁英, 朱慧越, 许梦舒, 等.“精神益生菌” 对慢性应激诱导的抑郁和便秘症状的缓解及机制研究[J].食品与发酵工业, 2021, 47(3):1-9.ZOU R Y, ZHU H Y, XU M S, et al.Effect and mechanism of psychobiotics in regulating chronic stress induced depression and constipation[J].Food and Fermentation Industries, 2021, 47(3):1-9.
[9] HUANG Y, WU J, ZHANG H P, et al.The gut microbiome modulates the transformation of microglial subtypes[J].Molecular Psychiatry, 2023, 28(4):1611-1621.[10] LOGAN R W, EDGAR N, GILLMAN A G, et al.Chronic stress induces brain region-specific alterations of molecular rhythms that correlate with depression-like behavior in mice[J].Biological Psychiatry, 2015, 78(4):249-258.
[11] TIAN P J, O’RIORDAN K J, LEE Y K, et al.Towards a psychobiotic therapy for depression:Bifidobacterium breve CCFM1025 reverses chronic stress-induced depressive symptoms and gut microbial abnormalities in mice[J].Neurobiology of Stress, 2020, 12:100216.
[12] YU Z L, CHEN W J, ZHANG L B, et al.Gut-derived bacterial LPS attenuates incubation of methamphetamine craving via modulating microglia[J].Brain, Behavior, and Immunity, 2023, 111:101-115.
[13] LIANG J J, ZHAO Y M, XI Y, et al.Association between depression, anxiety symptoms and gut microbiota in Chinese elderly with functional constipation[J].Nutrients, 2022, 14(23):5013.
[14] BALLOU S, KATON J, SINGH P, et al.Chronic diarrhea and constipation are more common in depressed individuals[J].Clinical Gastroenterology and Hepatology:the Official Clinical Practice Journal of the American Gastroenterological Association, 2019, 17(13):2696-2703.
[15] 邹仁英. 复合益生菌缓解抑郁的功效评价及机制探究[D].无锡:江南大学, 2021.ZOU R Y.Founction evaluation and mechanism investigation of compound probiotics on alleviating depression[D].Wuxi:Jiangnan University, 2021.
[16] LIU L X, WANG H Y, ZHANG H P, et al.Toward a deeper understanding of gut microbiome in depression:The promise of clinical applicability[J].Advanced Science, 2022, 9(35):2203707.
[17] GUO H, CHOU W C, LAI Y J, et al.Multi-omics analyses of radiation survivors identify radioprotective microbes and metabolites[J].Science, 2020, 370(6516):eaay9097.
[18] TIAN P J, CHEN Y, QIAN X, et al.Pediococcus acidilactici CCFM6432 mitigates chronic stress-induced anxiety and gut microbial abnormalities[J].Food &Function, 2021, 12(22):11241-11249.
[19] GROSHEVA I, ZHENG D P, LEVY M, et al.High-throughput screen identifies host and microbiota regulators of intestinal barrier function[J].Gastroenterology, 2020, 159(5):1807-1823.
[20] KÖHLER C A, MAES M, SLYEPCHENKO A, et al.The gut-brain axis, including the microbiome, leaky gut and bacterial translocation:Mechanisms and pathophysiological role in Alzheimer’s disease[J].Current Pharmaceutical Design, 2016, 22(40):6152-6166.
[21] CIESIELSKA A, MATYJEK M, KWIATKOWSKA K.TLR4 and CD14 trafficking and its influence on LPS-induced pro-inflammatory signaling[J].Cellular and Molecular Life Sciences:CMLS, 2021, 78(4):1233-1261.
[22] LONG H Z, ZHOU Z W, CHENG Y, et al.The role of microglia in Alzheimer’s disease from the perspective of immune inflammation and iron metabolism[J].Frontiers in Aging Neuroscience, 2022, 14:888989.
[23] MA C M, LI S, HU Y C, et al.AIM2 controls microglial inflammation to prevent experimental autoimmune encephalomyelitis[J].The Journal of Experimental Medicine, 2021, 218(5):e20201796.