花生芽,又名长寿芽,是花生种子经过较短时间萌发生长为可食用的一种芽类蔬菜。其清新爽口,富含多种维生素与微量元素,以及易于被人体吸收的脂肪、植物蛋白质等有益成分,加之还含有丰富的多酚类物质白藜芦醇, 具有了抗氧化、抗肿瘤、抗癌等作用,这些都使花生芽越来越被消费者喜爱[1]。然而花生芽含水量高,组织娇嫩,在采后保鲜、运输、销售过程中,易出现机械损伤、失水皱缩、微生物侵染进而引发花生芽褐变、病害、异味等问题,导致花生芽品质劣变,严重制约了花生芽的销售运输及产业发展。而目前花生芽的销售主要采用普通聚乙烯袋包装,无法有效调节其采后生理生化反应。因此,在物流运输中开发安全高效的花生芽贮藏保鲜方法对于花生芽产业的发展具有重要意义。
果蔬褐变可分为酶促褐变和非酶促褐变两种类型。其中,果蔬采后贮藏、加工过程中发生的褐变类型主要是酶促褐变,酶促褐变是指在有氧条件下,果蔬自身的酚酶催化酚类物质形成醌类,随后醌类进一步氧化聚合形成褐色或黑色物质,同时造成营养流失[2]。在双孢菇[3]、鲜切马铃薯[4]等园艺类产品中的研究表明,多酚氧化酶活性增高,则果实采后褐变程度加深。GANTNER等[5]采用气调保鲜技术结合聚乙烯薄膜贮藏白蘑菇,结果表明可以显著降低白蘑菇的褐变,维持商品品质。可以说酶促褐变与果蔬所处气体环境,特别是O2与CO2含量有着密切的关系,能否控制好气体环境对褐变抑制至关重要。
超低氧(ultra-low oxygen, ULO)技术一般被认为是在含氧量低于1%的气体环境中贮藏果蔬产品的一种气调手段[6]。作为绿色保鲜技术,超低氧贮藏可对果实的呼吸进行调控以及控制采后生理病害,有利于延长果蔬的贮藏期和货架期,同时具有绿色环保、使用成本低等优点。超低氧环境能够在果蔬采后贮藏期间诱导无氧代谢产物乙醛、乙醇的生成,从而促进果实风味的形成,而高浓度则会产生异味[7]。杜艳民等[8]发现,低氧气调推迟了鸭梨乙烯释放高峰并显著降低了乙烯释放量,有效维持了鸭梨采后营养物质的含量,其中超低氧胁迫对抑制鸭梨贮藏及货架期间虎皮病的发生效果显著。超低氧处理在菠萝采后的研究发现,常温环境下,超低氧处理有效减弱了果实贮藏期间的呼吸速率,并延缓水分的流失,抑制了多酚氧化酶活性进而保持了菠萝果肉良好色泽[9]。除此之外,在荔枝[10]、双孢菇[11]、西兰花[12]等产品采后的呼吸抑制、延缓衰老、品质维持等方面,超低氧处理均具有显著效果。然而,目前关于超低氧协同微孔技术对花生芽采后物流中保鲜效果的研究未见报道,因此,本试验采用不同超低氧时间处理花生芽,研究超低氧技术对常温物流过程中花生芽品质及褐变的影响,以期为芽苗菜类园艺产品物流保鲜包装提供参考方案。
1 材料与方法
1.1 材料与试剂
花生芽,要求同一批次、色泽大小均匀、无开瓣、无机械损伤、无明显褐变的新鲜花生芽,天生农贸市场,在采购商从种植农户手中收购后立即送到实验室。
PET12/PE68包装袋[氧气透过率:112 cm3/(m2·24 h·0.1 MPa),透湿率:15 g/(m2·24 h),23 ℃],东光县双林塑业有限公司。所用化学试剂均为分析纯。
1.2 仪器与设备
KM100-3MEM德国WITT气体混合系统,德国WITT公司;CheckMate3.0顶空分析仪,丹麦膜康公司;H1650R台式高速冷冻离心机,湖南湘仪公司;HHWS-Ⅲ-300恒温恒湿培养箱,上海跃进医疗器械有限公司;UV-2450PC紫外可见分光光度计,日本岛津公司;GC2010气相色谱仪,日本岛津公司;DDS-307A电导率仪,上海雷磁公司;UltraScan® PRO色差仪,上海一恒科学仪器有限公司。
1.3 试验方法
1.3.1 样品处理
将挑选好的花生芽清洗干净,晾干后使用PET12/PE68(聚酯12 μm厚/聚乙烯68 μm厚)包装袋充100%N2后进行封装,每袋约(100±10) g。将花生芽随机分为4组处理:a)直接微孔组:将花生芽放入袋中封装,密封好后马上在包装表面均匀打9个微孔;b)超低氧4 h微孔组:将花生芽放入袋中且通入100% N2后封装,在封装第4 h后在包装袋表面均匀打9个微孔;c)超低氧8 h微孔组:将花生芽放入袋中且通入100%N2后封装,在封装第8 h后在包装袋表面均匀打9个微孔;d)超低氧12 h微孔组:将花生芽放入袋中且通入100% N2后封装,在封装第12 h后在包装袋表面均匀打9个微孔,以上打孔孔径均为0.3 mm。各超低氧处理组在封装后立即对包装袋进行顶空气体检测确保O2含量均<1%。然后将所有包装袋置于23 ℃、RH70%的恒温恒湿箱中,试验周期设置5 d,每个处理设置3个重复。每天随机取样1次,测定各项指标。
1.3.2 指标检测
1.3.2.1 感官评价
参考付欣等[13]的方法,并稍作修改。感官评定标准见表1。每项指标最高分为30分,最低分为1分,最终用比例加权法计算总分,根据总分评定花生芽的品质。结果取平均,本试验中以60分及以上为具有商品性。
表1 花生芽感官指标评价标准
Table 1 Evaluation criteria for sensory indexes of peanut bud
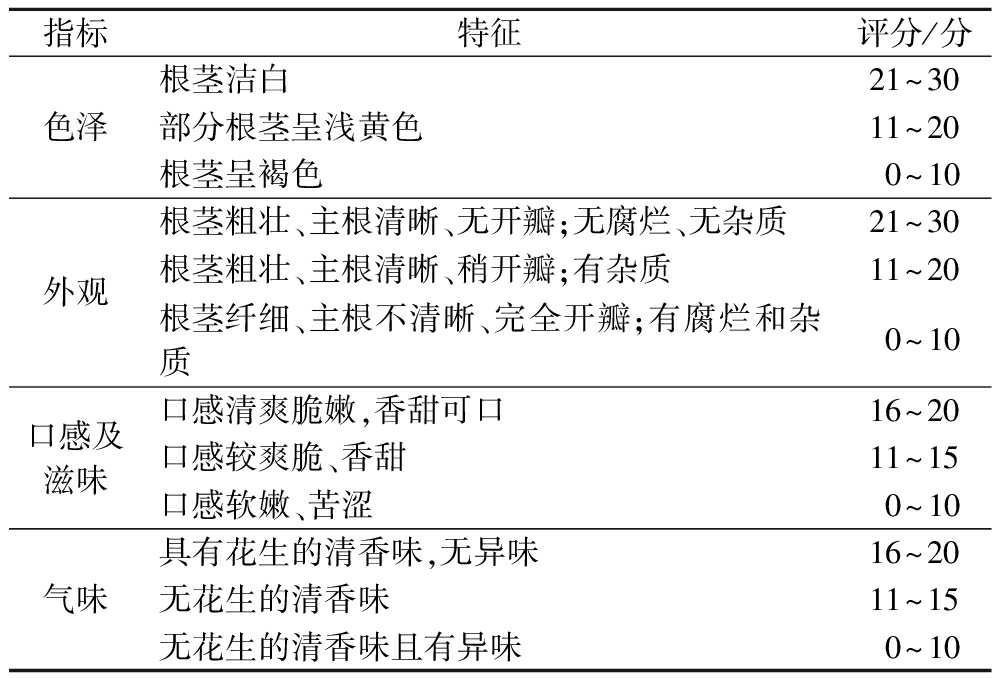
指标特征评分/分色泽根茎洁白21~30部分根茎呈浅黄色11~20根茎呈褐色0~10外观根茎粗壮、主根清晰、无开瓣;无腐烂、无杂质21~30根茎粗壮、主根清晰、稍开瓣;有杂质11~20根茎纤细、主根不清晰、完全开瓣;有腐烂和杂质0~10口感及滋味口感清爽脆嫩,香甜可口16~20口感较爽脆、香甜11~15口感软嫩、苦涩0~10气味具有花生的清香味,无异味16~20无花生的清香味11~15无花生的清香味且有异味0~10
1.3.2.2 顶空气体比例
采用顶空气体分析仪进行检测。测定前先用顶空气体分析仪检测大气中的O2和CO2浓度,进行仪器校准核查。然后将检测针头通过防雾膜上的硅胶片插入包装中,直接检测包装内的 O2和 CO2浓度,每个样品平行重复测定3次,测试过程中注意避免针头与花生芽的接触。
1.3.2.3 呼吸强度
参考程曦[14]的方法,测定花生芽的呼吸速率,结果以mg/(kg·h)表示。
1.3.2.4 超氧阴离子(·O2-)产生速率
参考曹建康等[15]的方法,测定花生芽·O2-产生速率,结果以nmol/(min·g)表示。
1.3.2.5 超氧化物歧化酶(superoxide dismutase,SOD)活性
参照曹建康等[15]的方法,测定花生芽SOD活性,结果以U/g表示。
1.3.2.6 过氧化氢酶(catalase,CAT)活性
参照曹建康等[15]的方法,测定花生芽CAT活性,结果以U/g表示。
1.3.2.7 相对电导率
参照曹建康等[15]的方法,测定花生芽的相对电导率,计算见公式(1)。
(1)
式中:γe,相对电导率,%;γ1,煮沸前电导率,μS/cm;γ0,煮沸后电导率,μS/cm。
1.3.2.8 丙二醛(malondialdehyde,MDA)含量
参照曹建康等[15]的方法,取2.0 g花生芽,采用硫代巴比妥酸(thiobarbituric acid,TBA)法进行测定,含量用μmol/g表示。
1.3.2.9 多酚氧化酶(polyphenol oxidase,PPO)活性
参照曹建康等[15]的方法,测定花生芽PPO活性,结果以U/g表示。
1.3.2.10 过氧化物酶(peroxidase,POD)活性
参照曹建康等[15]的方法,测定花生芽POD活性,结果以U/g表示。
1.3.2.11 色差
采用色度仪测试花生芽胚轴部分色泽,分别记录 L*、a*和b*值,贮藏后与贮藏前的颜色变化用ΔE表示,按式(2)计算。
(2)
式中:![]() 果实在测定和第0天时的亮度;
果实在测定和第0天时的亮度;![]() 果实在测定和第0天时的红绿偏向;
果实在测定和第0天时的红绿偏向;![]() 果实在测定和第0天时的黄蓝偏向。
果实在测定和第0天时的黄蓝偏向。
1.3.2.12 乙醇、乙醛含量
使用气相色谱仪分析乙醇和乙醛含量[16]。称取1.0 g花生芽加入2 mL蒸馏水研磨,后转入顶空瓶中,并加入5 mL饱和NaCl溶液,于60 ℃水浴加热30 min。顶空取l mL气体用于检测。
条件参数:进样口温度180 ℃;FID检测器温度220 ℃,H2流速60 mL/min,空气流速450 mL/min,N2流速45 mL/min;色谱柱初始温度为35 ℃,保持2 min,以1 ℃/min上升到50 ℃,然后以50 ℃/min上升到100 ℃。重复测定3次。单位为mg/kg。
1.3.3 数据统计分析
使用Excel 2018对实验数据进行数据计算;用SPSS 25对实验数据进行显著性分析,P<0.05表示有显著差异,P<0.01 表示有极显著差异,P>0.05 表示差异不显著;最后Origin Pro 8.6制图。
2 结果与分析
2.1 常温下不同超低氧处理时间对花生芽感官评价的影响
感官评价不仅体现出果蔬从表观层面的商品价值,也是直接反映消费者对食品的感官需求。如图1所示,各组的感官评分均随着贮藏时间的增加而有不同程度的下降。其中,直接微孔组(以下简称微孔组)的感官评分下降最快,其次是超低氧12 h微孔组(以下简称12 h组),2组均在第3天丧失商品性,感官评分分别为58分、59.9分且无显著性差异(P>0.05)。分析是由于12 h组超低氧处理时间较长增大了无氧呼吸比例,加速品质劣变。超低氧4 h微孔组(以下简称4 h组)在贮藏前4 d感官评分维持较好, 但在第5天仅为53.4分;而超低氧8 h微孔组(以下简称8 h组)直至贮藏结束仍有61.4分,并且从第2天开始与微孔组呈显著性差异(P<0.05),说明适宜的超低氧处理时间有利于刺激花生芽抗逆性,同时贮藏后期袋内维持低氧环境,减弱了呼吸代谢反应,使得花生芽采后生理生化反应减弱,从而有效保持花生芽常温物流中良好的感官品质,这与张锶苑等[17]的结论一致。
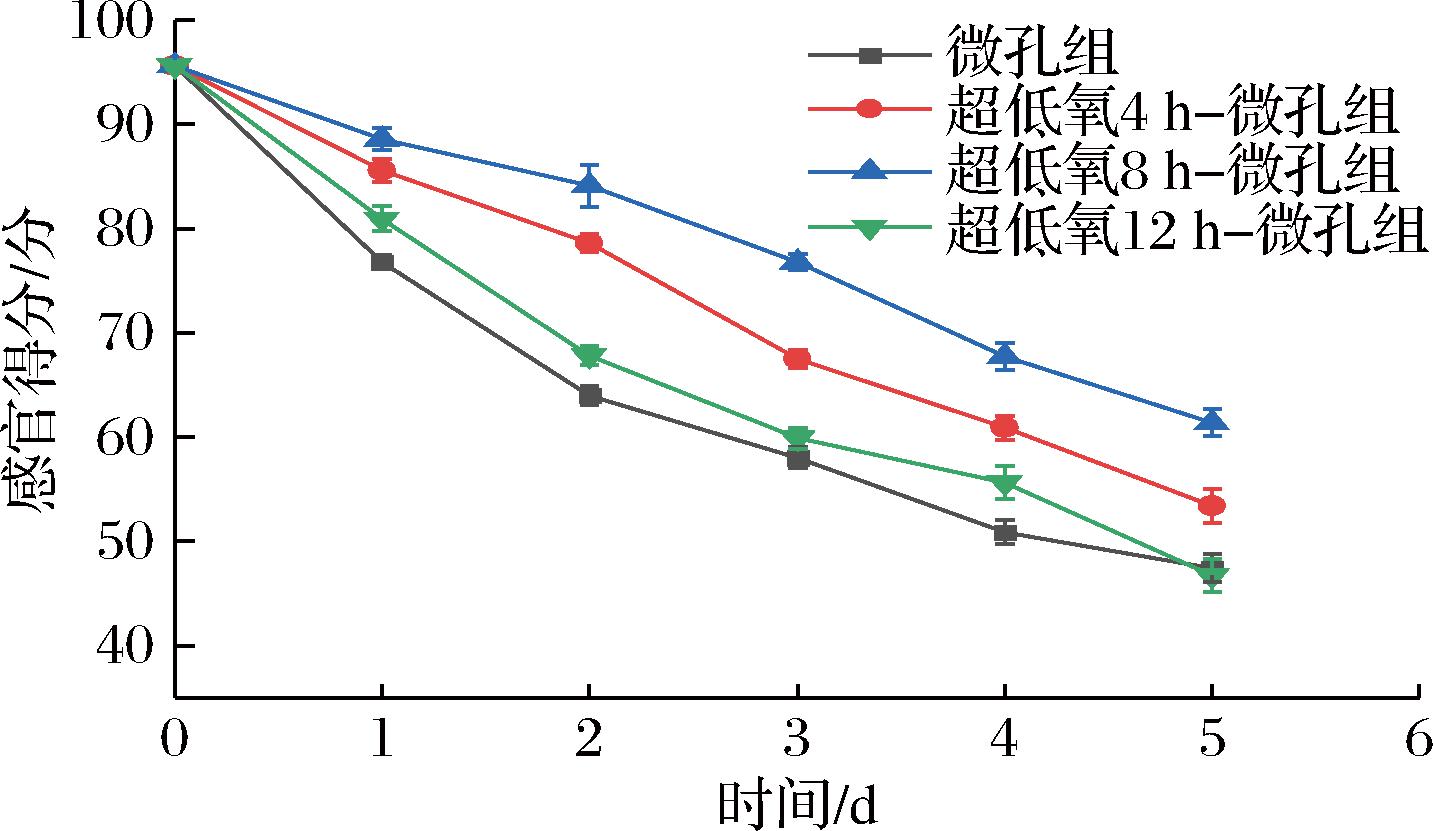
图1 常温下不同超低氧处理时间对花生芽感官评价的影响
Fig.1 Effects of different ultra-low oxygen treatment time on sensory evaluation of peanut bud at room temperature
2.2 常温下不同超低氧处理时间对花生芽包装内顶空气体比例的影响
2.2.1 常温下不同超低氧处理时间对花生芽O2含量的影响
果蔬呼吸是将有机化合物在体内结合O2转化为能量,并释放出H2O和CO2的过程[18]。如图2所示,在第1天微孔组的O2含量从21%急剧下降至9.95%,其余各超低氧处理组O2含量则逐渐上升,4组均于第2天后稳定在一定范围内。微孔组O2含量维持在7%~10%,各超低氧处理组均维持在5%~8%,表明微孔可以通过调节包装内外气体透过率与果实呼吸达到动态平衡,起到维持包装内气体含量恒定的效果,使花生芽包装内气体组成处于动态平衡。
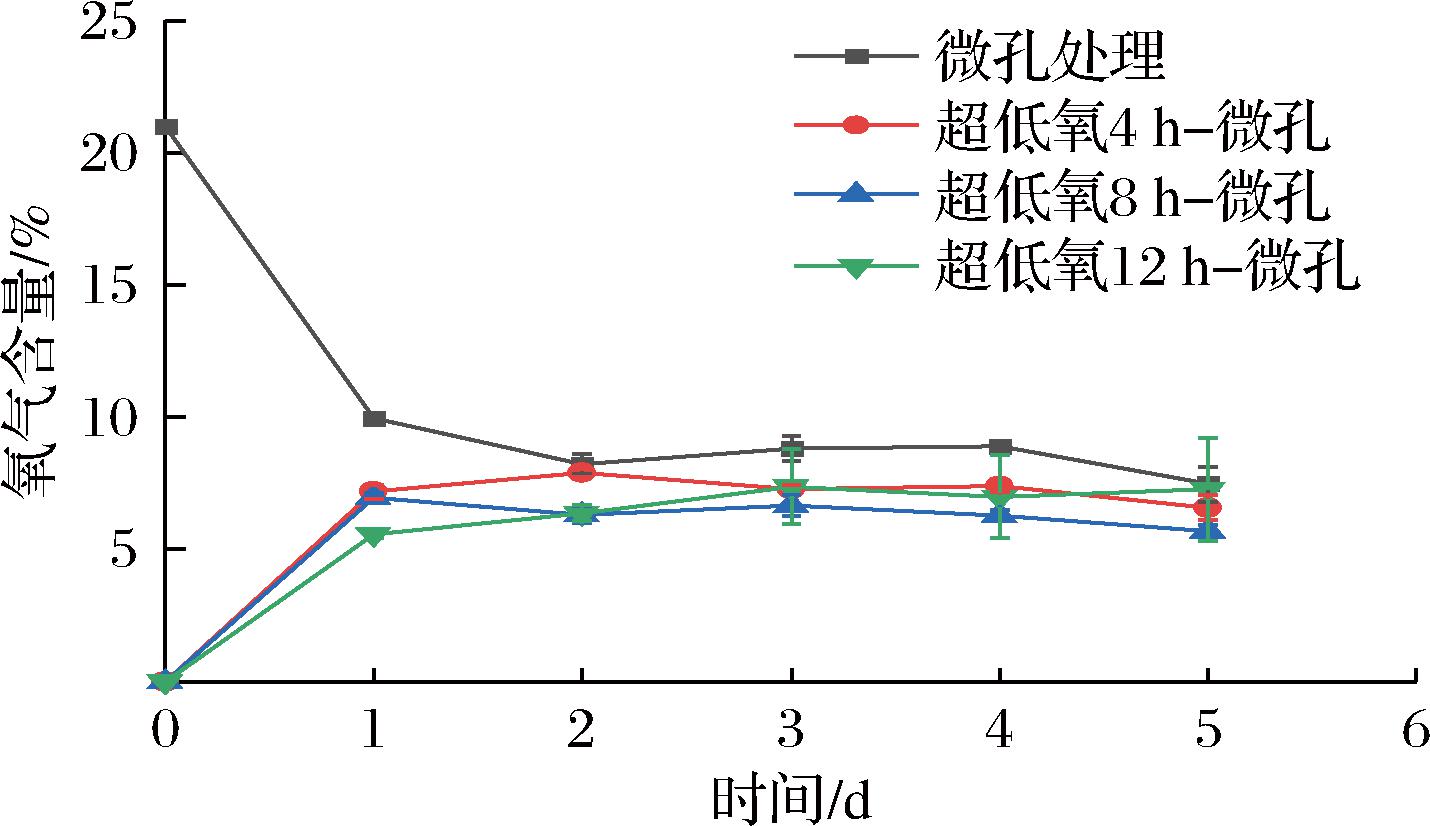
图2 常温下不同超低氧处理时间对花生芽O2含量的影响
Fig.2 Effects of different ultra-low oxygen treatment time on O2 content of peanut bud at room temperature
2.2.2 常温下不同超低氧处理时间对花生芽CO2含量的影响
花生芽采后始终进行呼吸作用,包装内CO2不断积累。如图3所示,各组CO2含量呈现上升趋势且在包装作用下稳定在一定范围内。12 h组的CO2含量在贮藏前3 d大幅上升至13.71%,并高于其余各组,分析可能是由于长时间超低氧处理引起花生芽的无氧呼吸,形成并积累大量的厌氧代谢产物,毒害组织细胞,导致花生芽采后生理代谢紊乱,使得该组CO2含量不断上升。而4 h组和8 h组包装内CO2含量均较低,其中8 h组在贮藏后期与微孔组和12 h组均呈极显著性差异(P<0.01),结合图2的O2含量分析可以说明,超低氧结合微孔处理能有效调节常温物流过程中包装内的气体环境,不易造成贮藏后期O2含量过低或CO2含量过高的情况,使得短期超低氧包装达到有利于抑制花生芽采后呼吸代谢的低O2高CO2的环境,更好地延长花生芽的保鲜期。
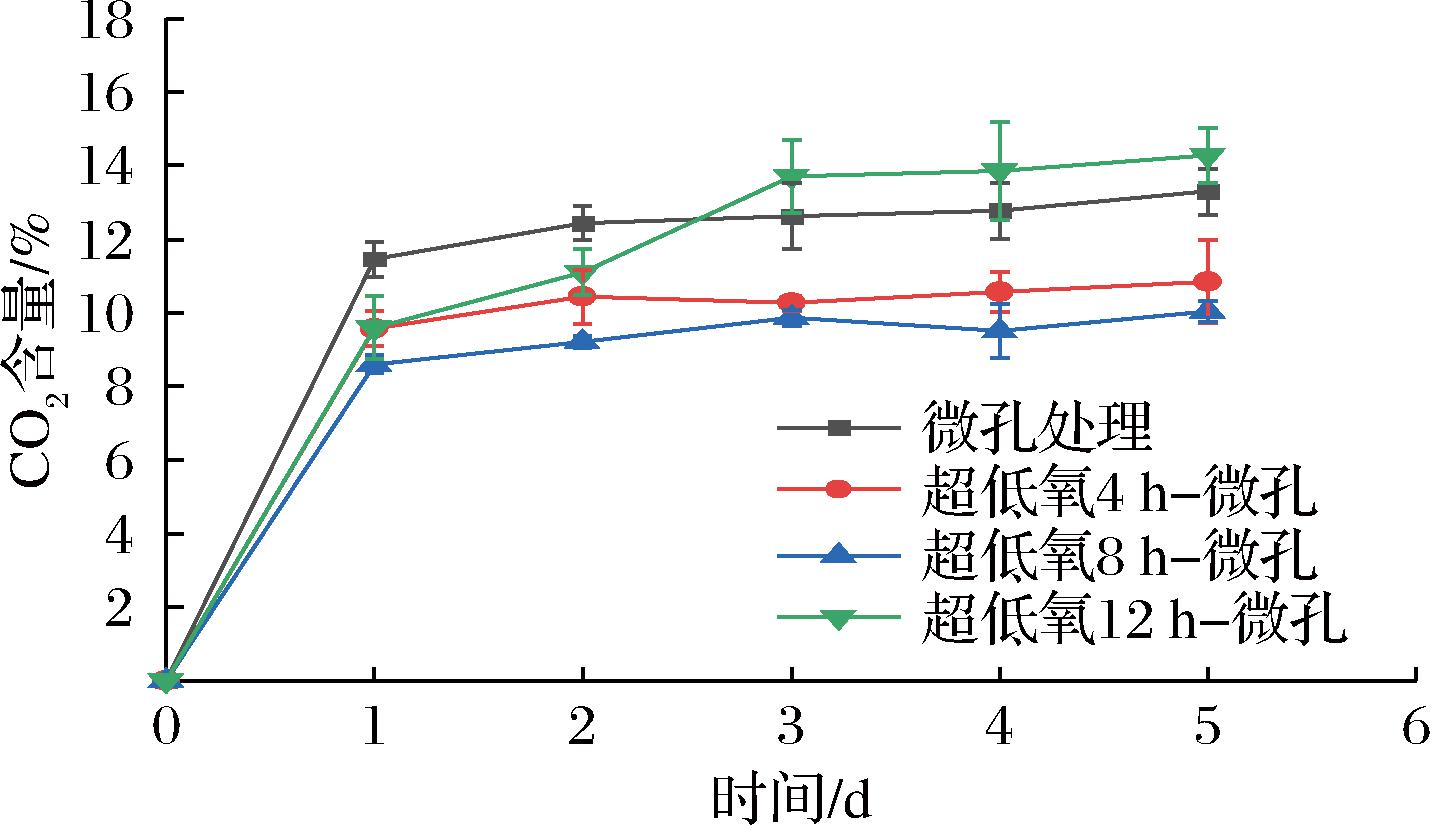
图3 常温下不同超低氧处理时间对花生芽CO2含量的影响
Fig.3 Effects of different ultra-low oxygen treatment time on CO2 content of peanut bud at room temperature
2.3 常温下不同超低氧处理时间对花生芽呼吸强度的影响
呼吸代谢是果蔬采后最主要的代谢途径,随着呼吸强度的增加,果蔬通过呼吸作用消耗营养物质的速率增强,从而使果蔬成熟过程加快,贮藏性降低。由图4所示,在贮藏期间各组呼吸强度呈现先升后降的趋势。在第1天时,微孔组、4 h组、8 h组的呼吸强度均达到最大值,分别为245.88、195.47、172.26 mg/(kg·h);而12 h组在第2天才达到最大值189.48 mg/(kg·h),分析可能是由于花生芽受到无氧胁迫引起生理代谢紊乱,使得呼吸强度进一步加大,这与顶空气体比例的结果一致。在第2天后,各组呼吸强度均有不同程度地减弱,分析可能是由于包装内达到了相对稳定的低氧环境,且同时内部较高浓度的CO2对花生芽采后呼吸代谢起到抑制作用。在整个贮藏过程中,微孔组呼吸强度始终大于各超低氧处理组,且在贮藏前2 d,微孔组呼吸强度与4、8 h组均呈极显著差异(P<0.01);而8 h组全程呼吸强度维持较低水平,说明短期超低氧处理在贮藏前期能有效抑制花生芽的呼吸强度,与任浩[19]的结论一致,适度的厌氧处理可以降低蔬菜有氧呼吸的强度。
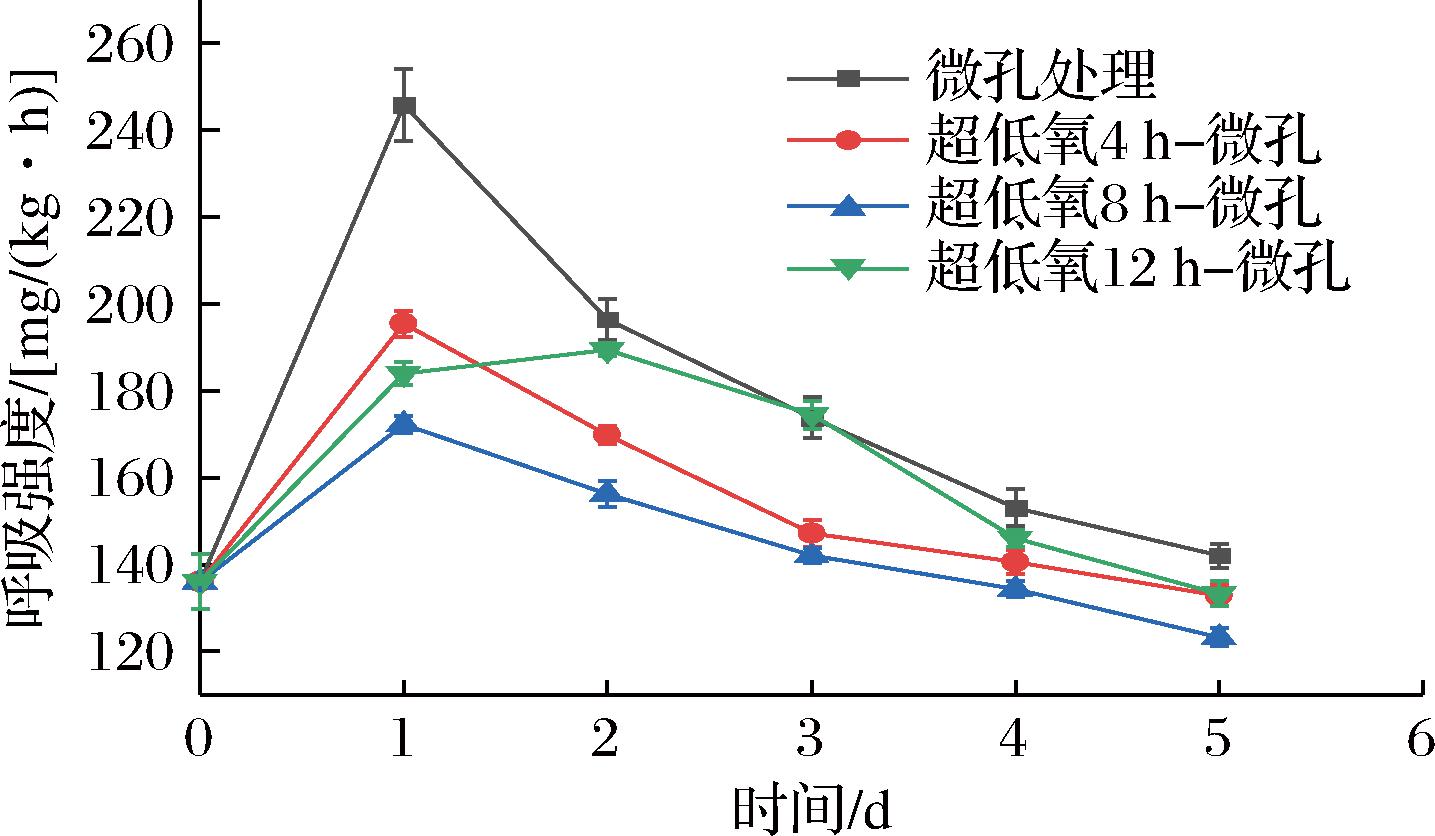
图4 常温下不同超低氧处理时间对花生芽呼吸强度的影响
Fig.4 Effects of different ultra-low oxygen treatment time on respiratory intensity of peanut bud at room temperature
2.4 常温下不同超低氧处理时间对花生芽·O2-产生速率的影响
·O2-在果蔬中累积能加剧细胞膜脂过氧化反应,加速果蔬衰老和褐变的发生,且其过度积累会对细胞造成不可逆转的伤害[20]。如图5所示,各组·O2-产生速率均呈上升趋势。微孔组与12 h组的·O2-产生速率始终较高,且在第1、2天二者间差异不显著(P>0.05)。微孔组分析可能是袋内O2含量较高,呼吸作用导致·O2-产生速率加快;而12 h组可能是由于花生芽在超低氧环境中时间较长导致厌氧胁迫,加剧了细胞膜的膜脂过氧化反应,进而使·O2-的产生速率加快。而4 h组和8 h组的·O2-产生速率增加较为缓慢,其中8 h组增加最缓慢,与微孔组和12 h组均形成极显著差异(P<0.01),说明超低氧8 h处理对抑制花生芽·O2-产生的效果最显著,从而减少活性氧积累对细胞造成的损伤。
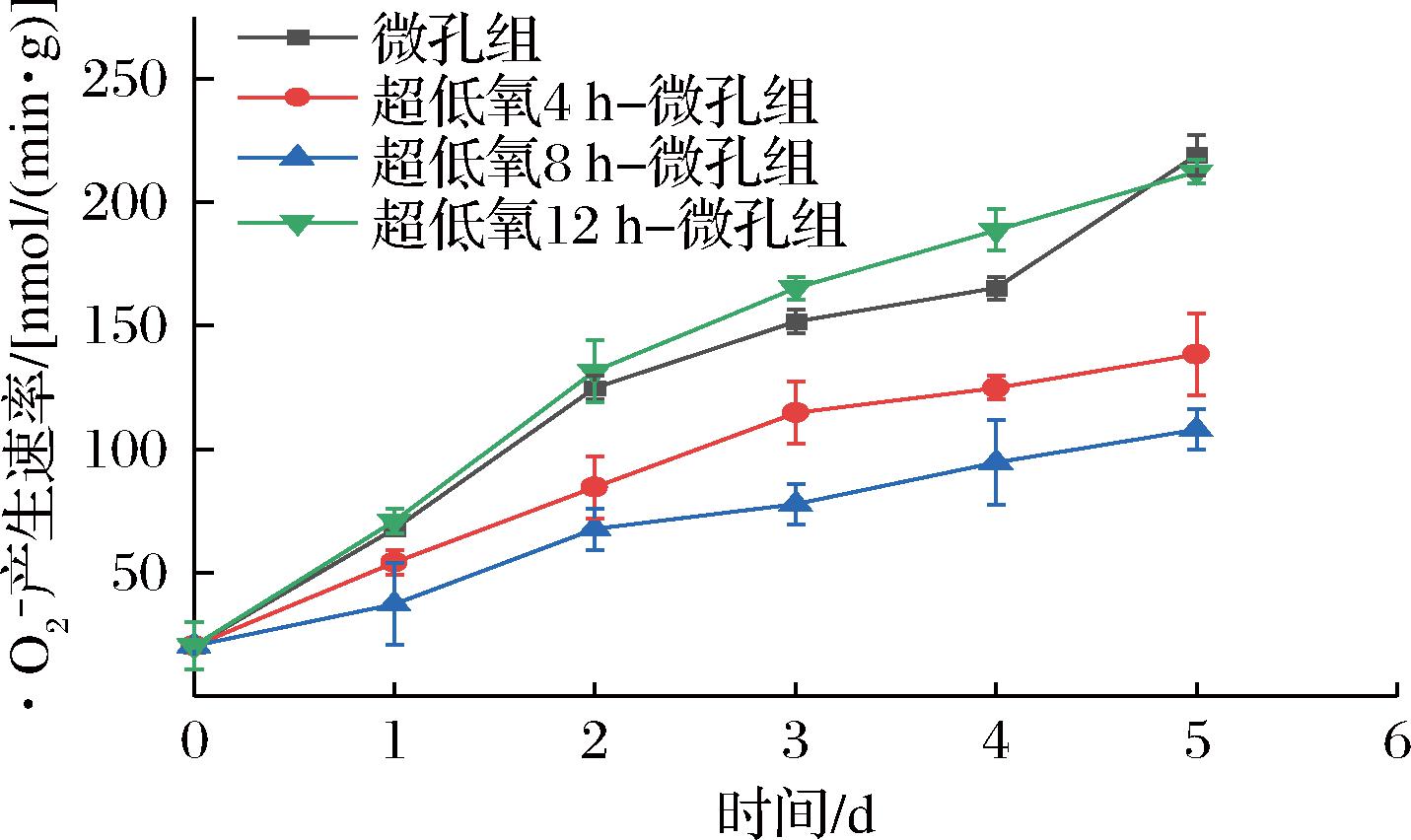
图5 常温下不同超低氧处理时间对花生芽·O2-
产生速率的影响
Fig.5 Effects of different ultra-low oxygen treatment time on ·O2- production rate of peanut bud at room temperature
2.5 常温下不同超低氧处理时间对花生芽SOD活性的影响
SOD在保护细胞免受氧化损伤过程中具有十分重要的作用,其活性变化能有效反应果蔬遭受氧化胁迫的程度[21]。如图6所示,各组SOD活性呈现先升高后降低的趋势。在整个贮藏期间,微孔组的SOD活性始终低于各超低氧处理组,且在第5天时下降至1.89 U/g,与4 h组、8 h组、12 h组形成显著性差异(P<0.05),说明超低氧处理可有效提高SOD活性。在第1天时,8 h组和12 h组SOD活性上升速度较快,分别达到2.55、2.75 U/g,随后12 h组大幅下降,分析可能是由于长时间的超低氧处理胁迫导致活性氧代谢失衡,引发较高的SOD活性,随后快速反应消耗,即便后期通过微孔处理使包装袋复氧,但其伤害不可逆,由此加速了花生芽的品质劣变;而8 h组从第2天起直至贮藏结束,SOD活性均高于其余各组,并在第5天达到2.28 U/g,提高了15.15%,说明合适的超低氧处理时间能有效激活体内抗氧化防御系统[22],增强抗氧化能力,有效维持常温下花生芽细胞内活性氧稳态,对保鲜品质具有积极影响。
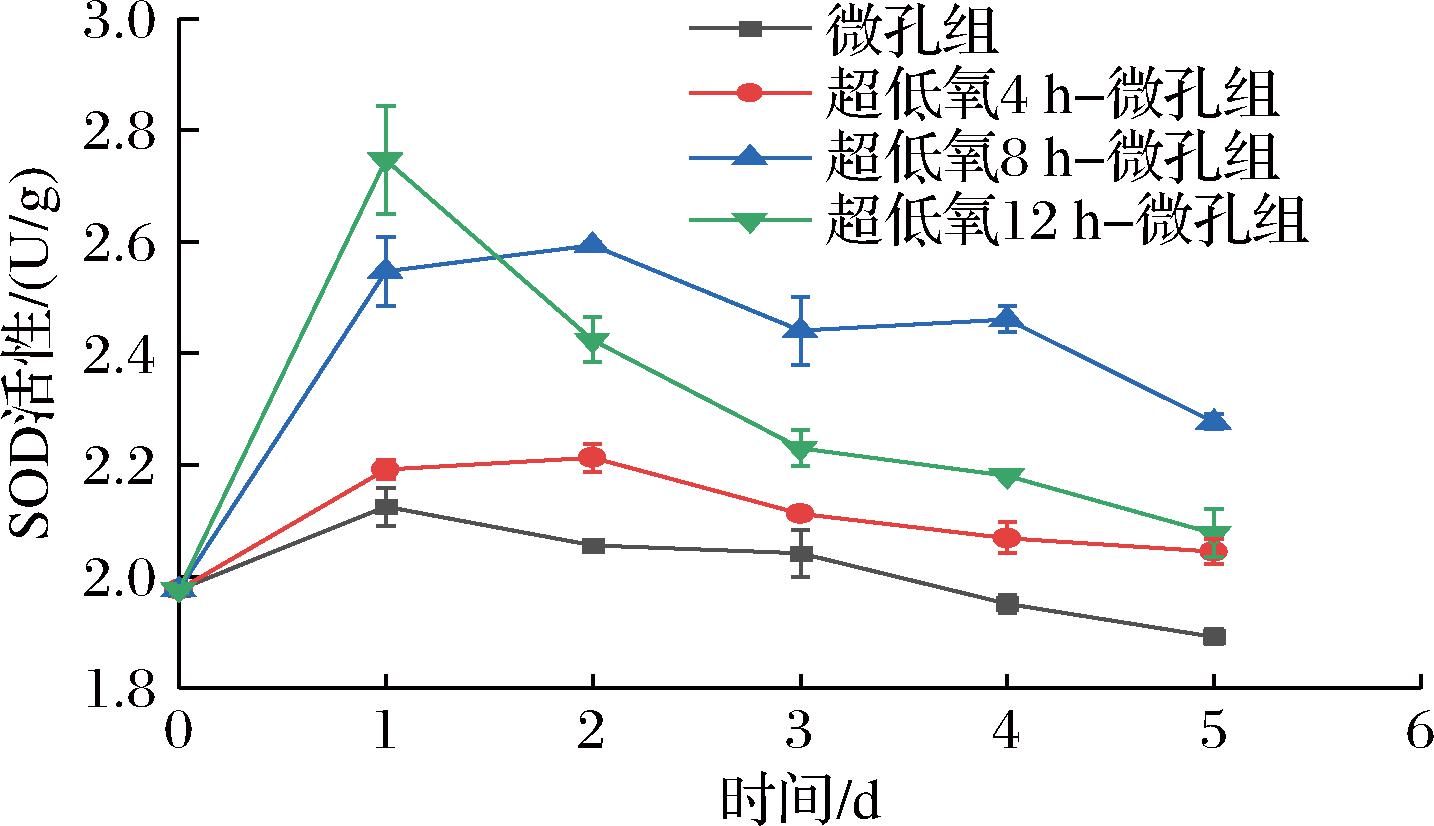
图6 常温下不同超低氧处理时间对花生芽
SOD活性的影响
Fig.6 Effects of different ultra-low oxygen treatment time on SOD activity of peanut bud at room temperature
2.6 常温下不同超低氧处理时间对花生芽CAT活性的影响
CAT可以在果蔬遭受胁迫时催化植物体内积累的H2O2转变成水和O2,以减少对果蔬造成的氧化损伤,其活性变化在一定程度上可反映细胞清除体内活性氧自由基的能力[23]。如图7所示,各组的CAT活性整体呈现先升后降趋势。在第2天时,4组的CAT活性达到了最大值,CAT活性大小依次为8 h组>12 h组>4 h组>微孔组,其中微孔组、4 h组、8 h组、12 h组的CAT活性分别为19.68、23.82、31.98、28.87 U/g,微孔组与各超低氧处理组均形成显著性差异(P<0.05),说明超低氧处理可在贮藏前期提高CAT活性,提升花生芽清除体内自由基的能力。第2天后,各组CAT活性呈现下降趋势,至贮藏结束时各组CAT活性分别为初始值的0.94倍、1.01倍、1.27倍、0.94倍,说明8 h组的抗氧化系统活力较高,由于·O2-的产生速率被有效抑制,使得细胞膜过氧化程度降低,从而有利于细胞膜的完整性[24]。刘红艳等[25]也认为通过气调处理营造低氧环境可以显著维持CAT活性,抑制了芦笋根部的腐烂,保持绿芦笋采后较好的品质,与上述研究结果一致。
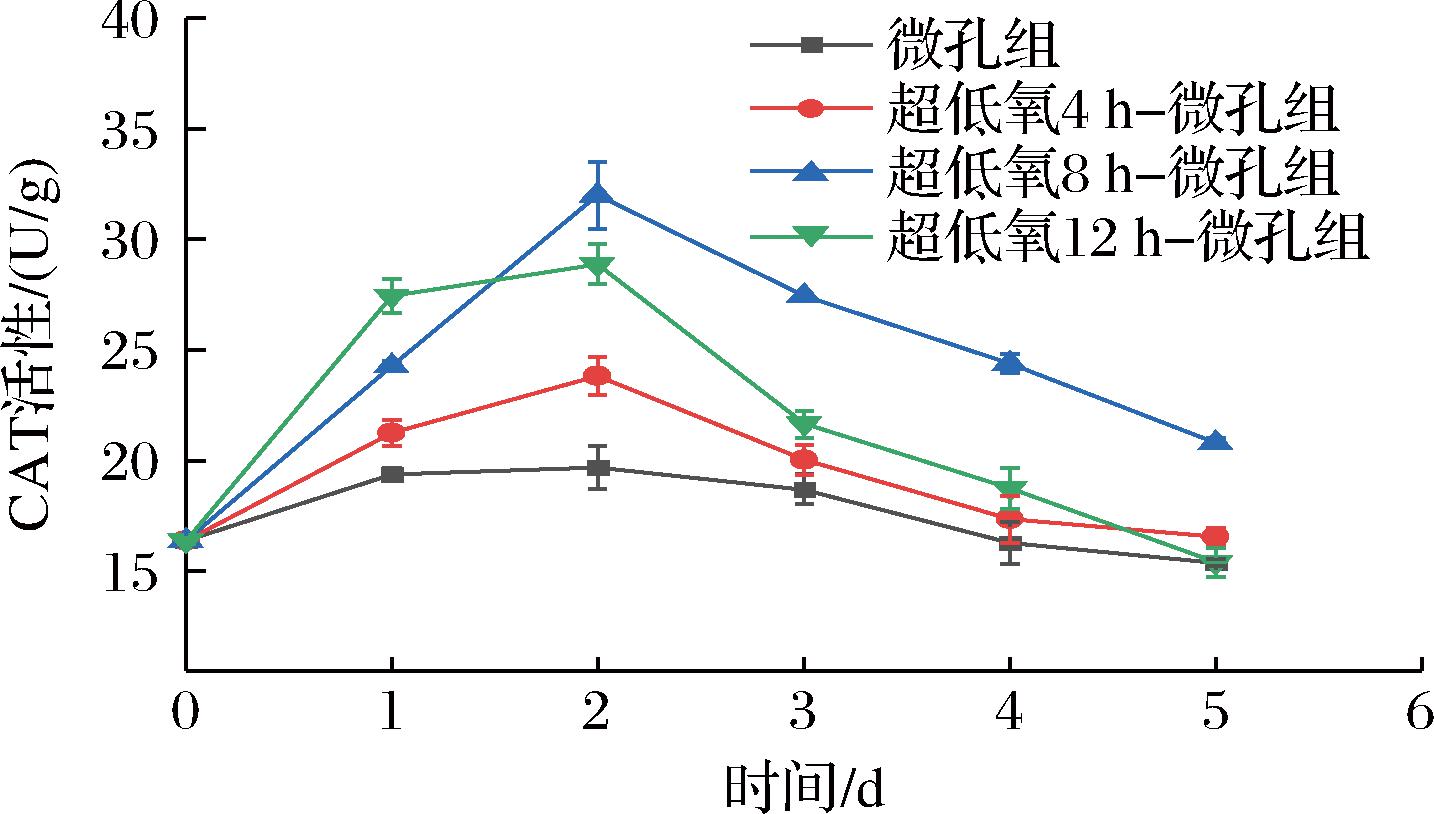
图7 常温下不同超低氧处理时间对花生芽CAT活性的影响
Fig.7 Effects of different ultra-low oxygen treatment time on CAT activity of peanut bud at room temperature
2.7 常温下不同超低氧处理时间对花生芽相对电导率的影响
果蔬细胞在后熟衰老或是受到不良环境胁迫时,细胞膜完整性和功能性会受不同程度的损伤,出现胞内电解质向外渗漏,相对电导率可反映细胞膜受损害的程度[26]。如图8所示,各组的相对电导率随着贮藏时间的增加而逐渐增加,其中微孔组相对电导率上升最快,在第5天达到35.98%,分别是4 h组的1.29倍、8 h组的1.45倍、12 h组的1.12倍,可能是由于微孔组一直处于O2浓度较高的贮藏环境中,花生芽采后呼吸代谢消耗有机物的同时不断产生自由基,细胞氧化损伤加剧,进而相对电导率不断升高。在超低氧处理各组中,12 h组的上升速度较快,分析可能是因为无氧呼吸形成并积累大量的乙醛、乙醇等厌氧代谢产物,组织细胞受损,导致采后生理代谢紊乱,加大了膜流动性和电解质的泄漏,导致电导率的上升[17];而8 h组在第1天时,相对电导率有下降趋势随后逐渐上升,且贮藏前3 d电导率维持在较低水平,与微孔组、4 h组和12 h组差异显著(P<0.05)。综上所述,说明合适的超低氧处理时间可有效诱导产品对环境胁迫的应答反应,提高抗氧化性,抑制MDA的上升,降低膜脂受损程度,较好地保持细胞膜的完整性,以维持商品品质[27]。
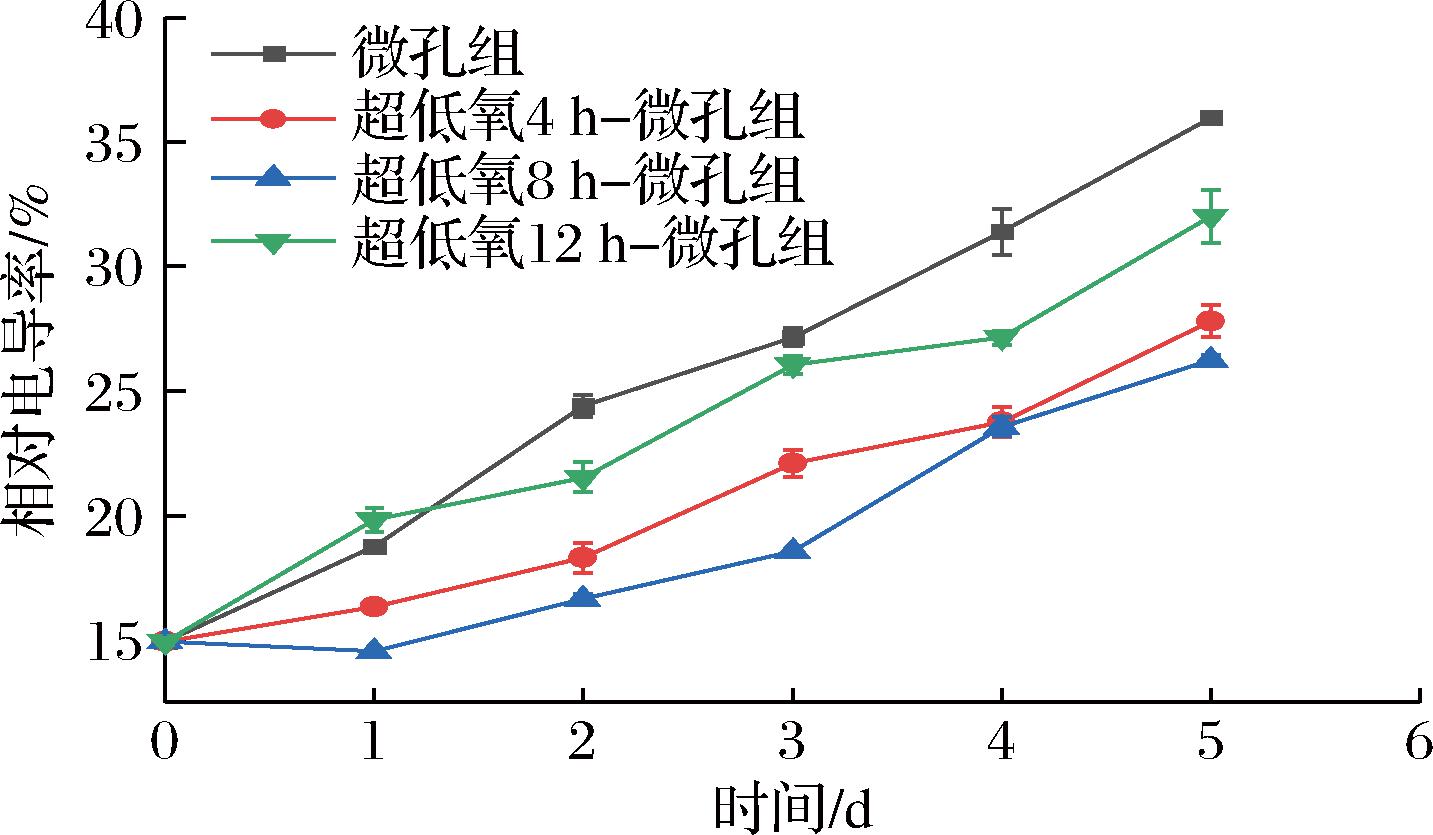
图8 常温下不同超低氧处理时间对花生芽相对电导率的影响
Fig.8 Effects of different ultra-low oxygen treatment time on relative electrical conductivity of peanut buds at room temperature
2.8 常温下不同超低氧处理时间对花生芽MDA含量的影响
MDA是膜脂过氧化作用的特征产物,可以作为定量分析细胞膜氧化损伤的指标,其含量的积累会对果蔬细胞造成氧化损伤[28]。如图9所示,各组MDA含量均呈上升趋势,且积累速度存在差距,微孔组与12 h组的MDA含量呈快速上升趋势,而4 h组与8 h组呈缓慢上升趋势。微孔组与12 h组MDA含量由最初0.36 μmol/g到第5天分别上升至1.32、1.25 μmol/g,分别为初始值的3.67倍、3.47倍,且差异不显著(P>0.05),分析微孔组在贮藏过程中包装内含氧量相对较高,花生芽进行呼吸代谢积累大量活性氧,导致该组的细胞膜损伤严重,使得MDA含量增加;12 h组因长时间厌氧处理对细胞结构和功能造成不可逆转的损伤,复氧后的有氧呼吸会造成更多的活性氧泄露,加剧脂质过氧化程度,MDA含量上升, 4 h组与8 h组的MDA含量在第5天分别上升至0.92、0.84 μmol/g,分别为初始值的2.55倍、2.33倍,二者MDA的合成速度明显减缓,说明适度超低氧处理可以显著抑制花生芽MDA含量的上升。类似研究也表明厌氧处理可以通过抑制蘑菇有氧呼吸,降低细胞脂质过氧化程度,从而延缓MDA含量的上升[19]。
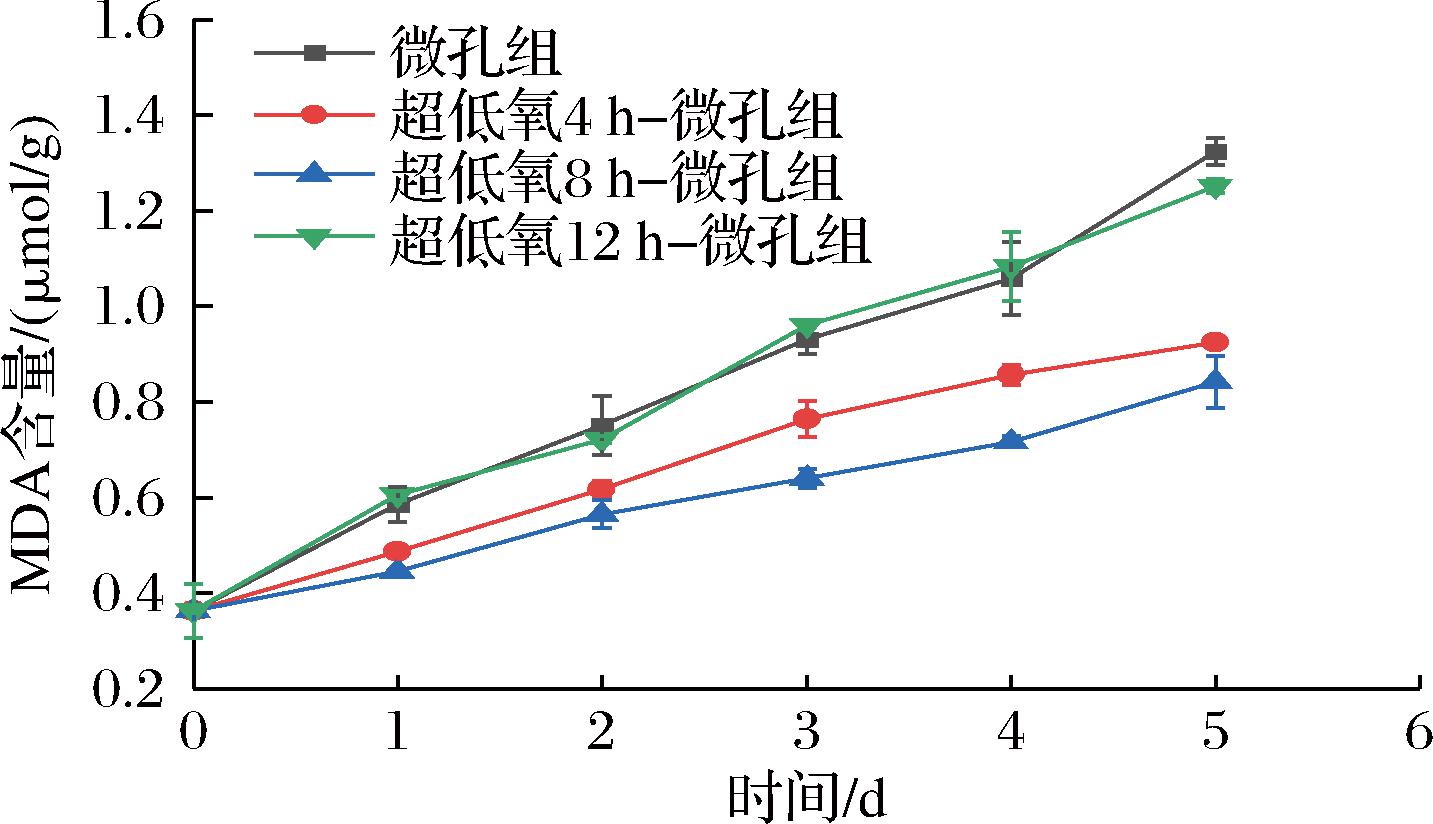
图9 常温下不同超低氧处理时间对花生芽
MDA含量的影响
Fig.9 Effects of different ultra-low oxygen treatment time on MDA content of peanut buds at room temperature
2.9 常温下不同超低氧处理时间对花生芽PPO活性的影响
PPO是果蔬体内酶促褐变的反应物之一,在O2的参与下将酚类化合物氧化形成深褐色的醌,从而引起果蔬褐变,降低商品价值[29]。如图10所示,各组花生芽PPO活性随着时间的延长而不断上升。微孔组的PPO活性在贮藏前期增长较快,后期趋势缓慢,到第5天达到0.64 U/g,是4 h组的1.37倍、8 h组的1.73倍、12 h组的1.08倍,分析可能是微孔组初期包装内O2含量相对较高,对呼吸的抑制效果有限,进而加速了采后衰老进程,导致细胞氧化损伤加剧,因此结合态多酚氧化酶转化为游离态,性质更活泼[30],使得PPO活性增强。在第1、2天时,12 h组与微孔组无显著性差异(P>0.05),可能是无氧代谢发酵产物乙醇、乙醛对花生芽造成细胞毒性,使得PPO活性大幅上升,花生芽褐变加重。而8 h组PPO活性增长趋势较为缓慢,与微孔组、4 h组、12 h组形成极显著差异(P<0.01),到第5天达到0.37 U/g,仅上升了32.14%,说明8 h超低氧处理可以有效抑制PPO活性的增大,从而延缓花生芽常温条件下的褐变。陈兆璇等[31]研究也表明,短期厌氧处理可以一定程度上抑制香菇在贮藏期间PPO活性的上升。
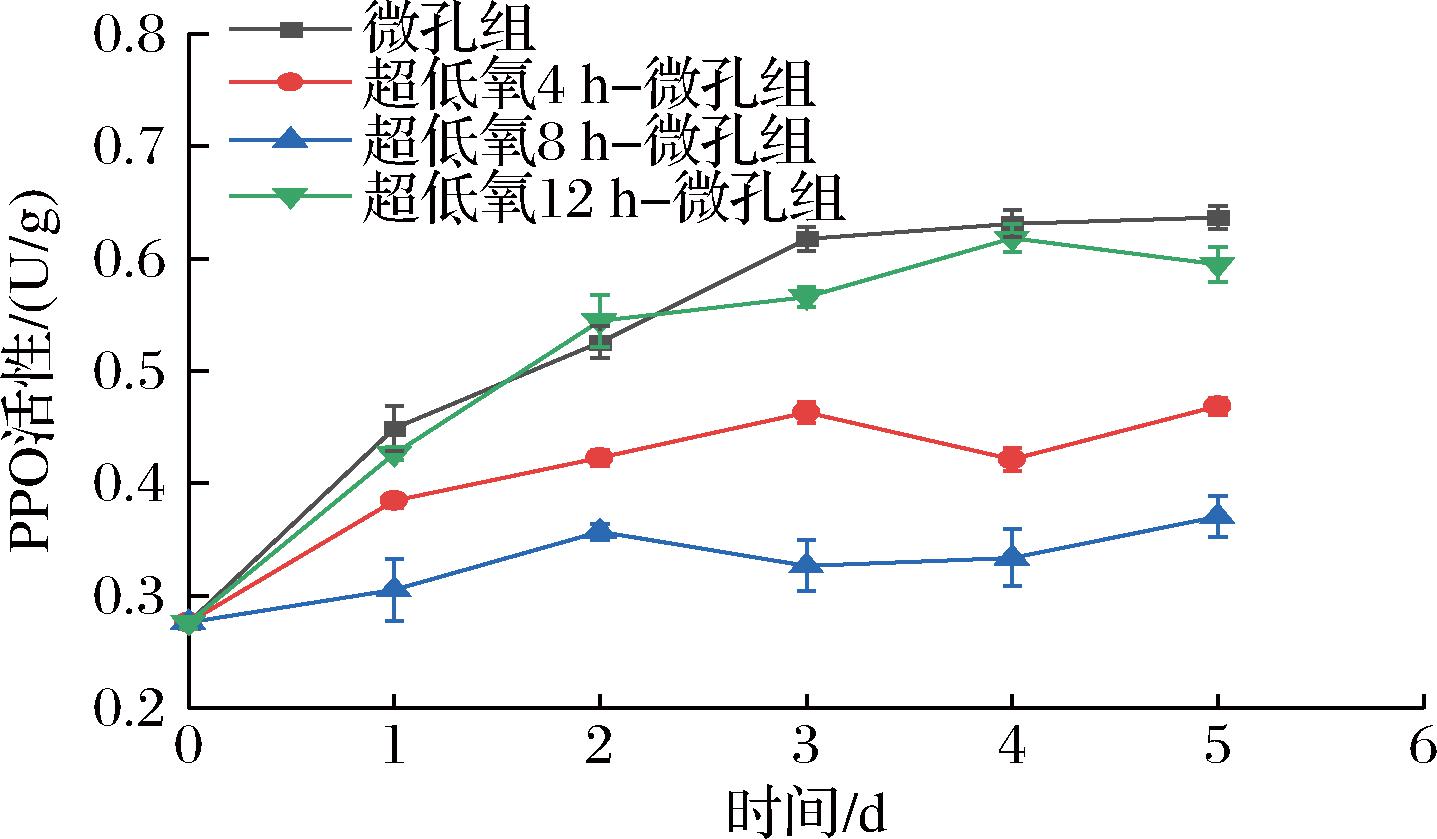
图10 常温下不同超低氧处理时间对花生芽
PPO活性的影响
Fig.10 Effects of different ultra-low oxygen treatment time on PPO activity of peanut bud at room temperature
2.10 常温下不同超低氧处理时间对花生芽POD活性的影响
POD在H2O2存在的条件下,通过催化果蔬中的类黄酮及酚类的聚合和氧化,导致果蔬褐变[32]。如图11所示,各组POD活性呈先升后降的趋势。在第2天时,各组的POD活性达到了最大值,POD活性大小依次为:微孔组>12 h组>4 h组>8 h组,其中微孔组、4 h组、8 h组、12 h组的POD活性分别为1.05、0.77、0.68、0.94 U/g,说明在贮藏前期保持低氧环境有利于抑制POD活性的增加。第2天后,各组POD活性均呈不同程度的降低,其中微孔组与12 h组的POD活性下降最明显,数值分别下降至0.85、0.76 U/g,可能是这2组花生芽受到较重的氧化损伤,加快了底物与酶的氧化聚合,导致花生芽褐变程度加重,商品性大幅下降。而8 h组整体POD活性保持最低,由初始值0.55 U/g上升至0.64 U/g,仅上升了16.36%,说明合适的超低氧处理时间能有效抑制花生芽POD活性的上升,从而延缓花生芽采后褐变进程。
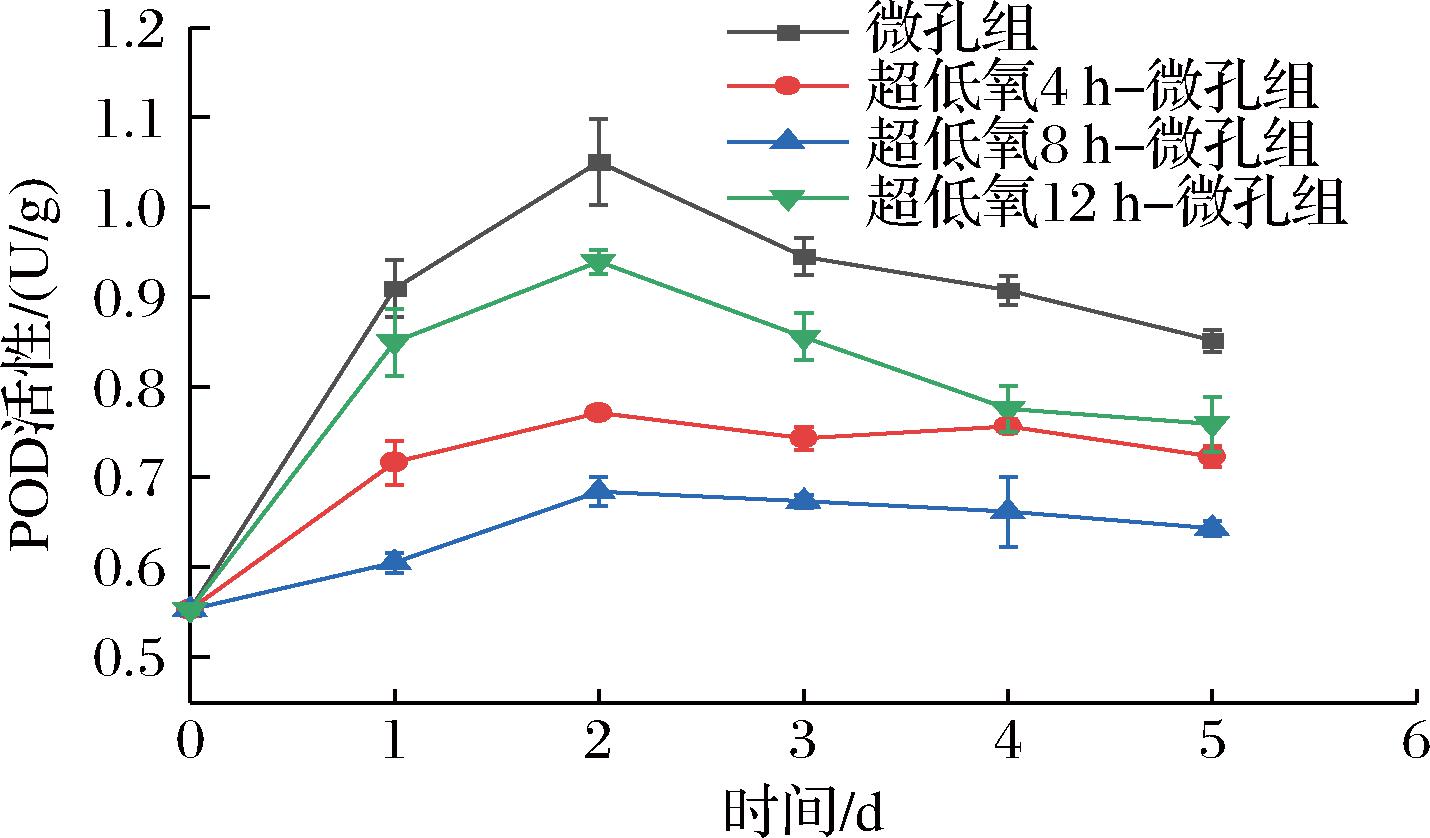
图11 常温下不同超低氧处理时间对花生芽
POD活性的影响
Fig.11 Effects of different ultra-low oxygen treatment time on POD activity of peanut bud at room temperature
2.11 常温下不同超低氧处理时间对花生芽色差的影响
作为衡量果蔬商品性的重要指标,色差值ΔE越小,说明对果蔬护色效果越好。由图12可知,各组ΔE值在贮藏期间均呈上升趋势。在整个贮藏期间,微孔组和12 h组ΔE值上升速度均较快,其中微孔组到第5天达到17.50,分别是4 h组的1.47倍、8 h组的1.79倍、12 h组的1.12倍,分析是由于微孔组贮藏期间呼吸强度较大,同时结合图10、图11中PPO、POD活性不断增大,导致酚类物质氧化加重,花生芽褐变明显;12 h组可能是由于前期超低氧状态维持时间过长,能量供应不足,同时膜质过氧化程度加剧,导致色泽加深[11]。8 h组ΔE值仅上升至9.81,与微孔组和12 h组均呈极显著差异(P<0.01),与4 h组无显著性差异(P>0.05),说明超低氧处理能有效延缓花生芽的褐变速率,维持良好的色泽。
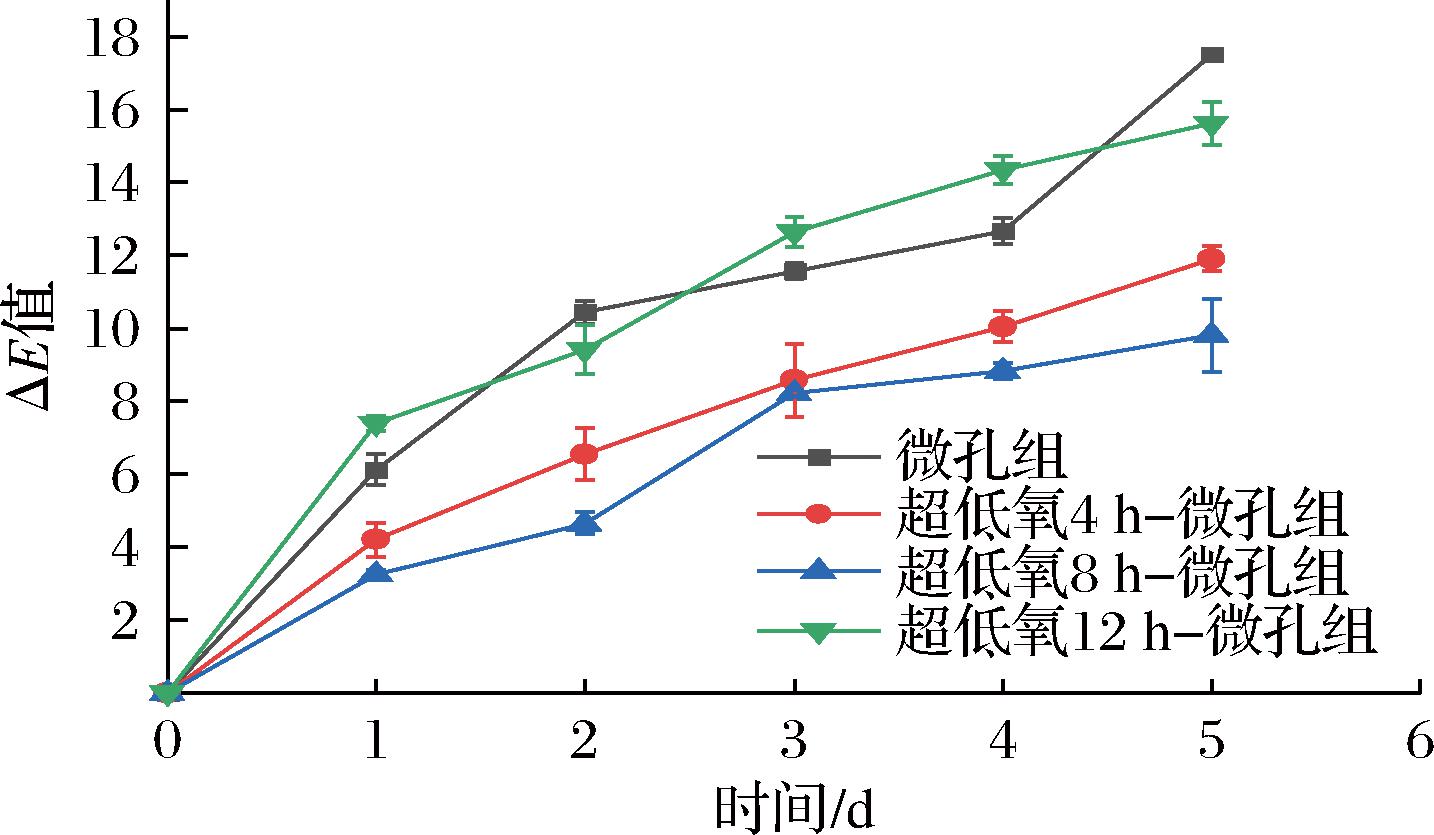
图12 常温下不同超低氧处理时间对花生芽色差的影响
Fig.12 Effects of different ultra-low oxygen treatment time on peanut bud color difference at room temperature
2.12 常温下不同超低氧处理时间对花生芽乙醇、乙醛含量的影响
乙醛与乙醇是果蔬中的一种天然香气成分,在果蔬成熟与贮藏期间产生和积累。较低浓度的乙醛和乙醇可以促进果蔬风味形成并维持品质,但高浓度时则使果蔬产生异味[33]。
如图13所示,各组常温下花生芽乙醇含量随着贮藏时间的延长而呈先升后降的趋势。微孔组乙醇含量在整个贮藏期间始终是最低的,与各超低氧组均呈显著性差异(P<0.05),并在第5天降至5.74 mg/kg,说明微孔组未出现无氧呼吸。各超低氧组乙醇含量均在第1天达到峰值,4 h组、8 h组、12 h组分别是29.63、42.40、68.84 mg/kg,随后逐渐降低,且在整个贮藏期,乙醇含量顺序以12 h组、8 h组、4 h组依次递减,这说明花生芽乙醇含量的高低与超低氧处理时间呈正相关。而造成各超低氧处理组乙醇含量差异的原因可能是长时间的厌氧处理对细胞组织产生一定的代谢损伤,复氧后,乙醇的可逆转化受阻,延缓了乙醇的回收进程,造成乙醇的大量积累[34]。
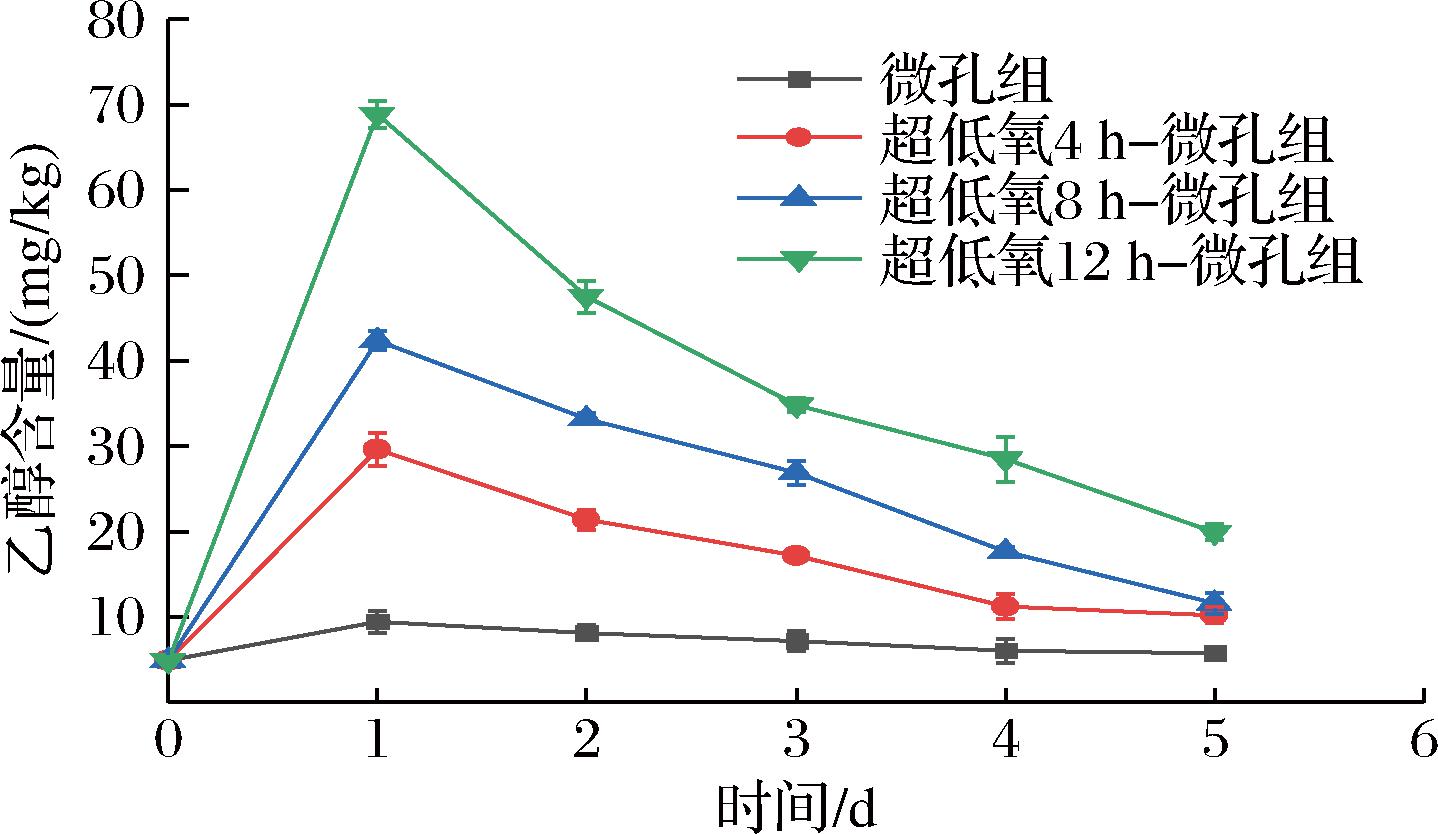
图13 常温下不同超低氧处理时间对花生芽乙醇含量的影响
Fig.13 Effects of different ultra-low oxygen treatment time on the contents of ethanol in peanut bud at room temperature
如图14所示,各组乙醛含量呈先升再降趋势,与乙醇变化趋势保持一致。微孔组在0~2 d时,乙醛含量与8 h组、12 h组形成极显著差异(P<0.01),并且在整个贮藏过程中变化不大,仅上升0.29 mg/kg。而各超低氧处理组乙醛含量变化走势相似,且4 h组与8 h组在贮藏后期乙醛含量均降至较低水平,在第5天分别达到5.27、5.19 mg/kg,且无显著性差异(P>0.05),分析原因可能是超低氧处理会在前期短时间内产生大量乙醛,到达一定含量后又被消耗合成其他物质[35]。
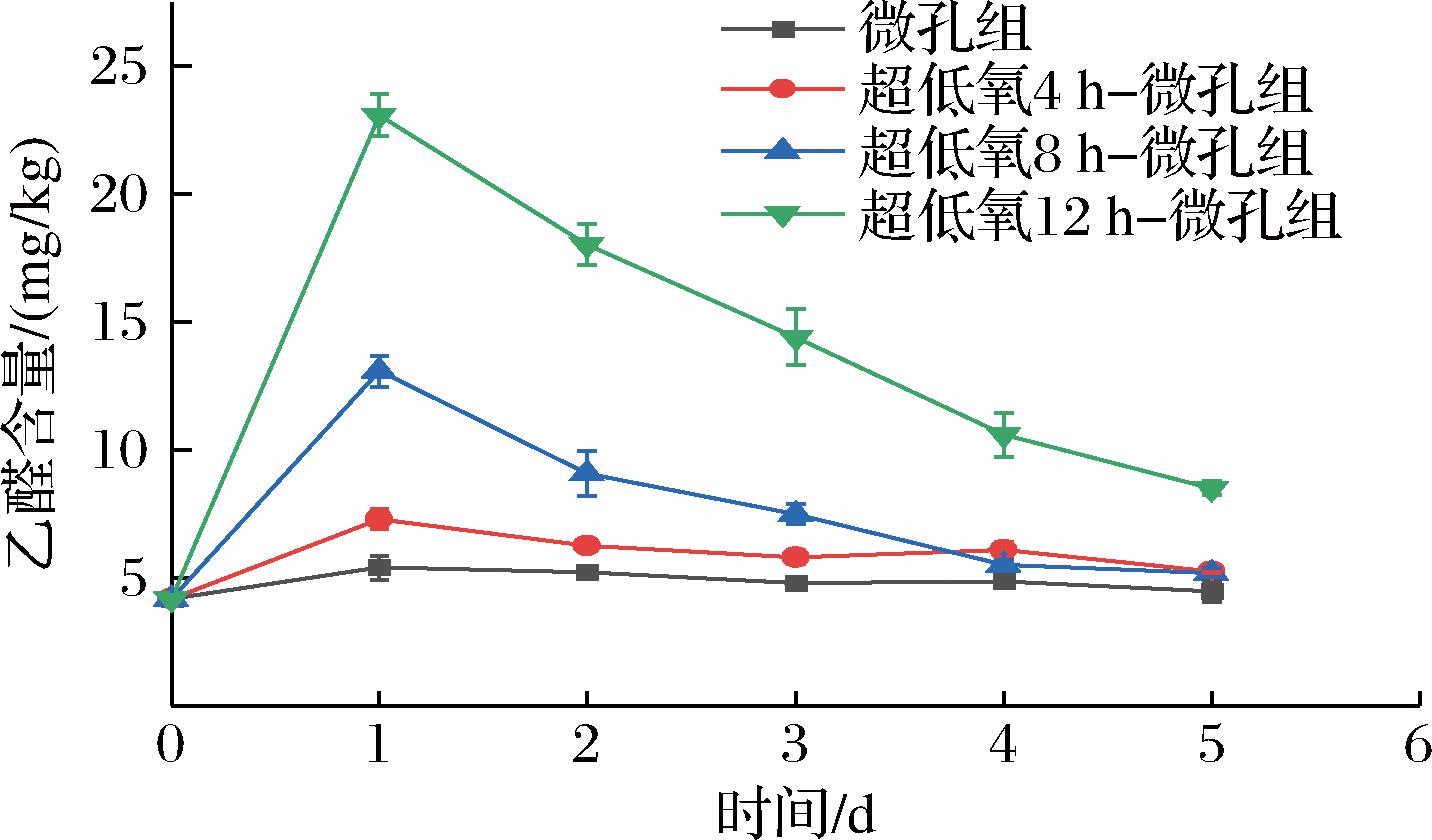
图14 常温下不同超低氧处理时间对花生芽乙醛含量的影响
Fig.14 Effects of different ultra-low oxygen treatment time on the contents of acetaldehyde in peanut bud at room temperature
3 结论
本研究通过采用不同超低氧处理时间(4 h、8 h、12 h)对花生芽进行贮藏,探究超低氧处理对常温物流中花生芽褐变的抑制效果及其作用机制。结果表明,微孔处理因包装内含氧量相对较高对常温下花生芽采后褐变抑制无法起到积极作用;而不同时间超低氧处理对花生芽保鲜效果存在差异,其中短期超低氧处理8 h对常温下花生芽褐变抑制效果最好,可在贮藏初期有效刺激花生芽产生抗逆性,同时包装内低氧环境可抑制花生芽采后呼吸,减缓·O2-产生速率,并且抗氧化酶活性的提高增强了花生芽的自由基清除能力,使得相对电导率和MDA的上升受到抑制,从而减少氧化损伤,保护细胞膜结构免遭破坏,有效延缓常温下花生芽采后衰老;并且还抑制PPO、POD活性增长,减缓了酶促反应速率,延缓花生芽褐变,保持良好色泽,维持商品价值。而超低氧处理过程中产生的乙醇、乙醛会对花生芽造成一定影响,超低氧12 h导致花生芽产生过量的乙醇、乙醛会对细胞造成毒害作用,加重采后生理代谢紊乱,进而加速花生芽采后褐变。
综上所述,超低氧处理能有效减缓花生芽褐变,保持花生芽品质,延长保质期。但果蔬不宜在超低氧状态下处理时间过长,否则容易导致无氧胁迫,加剧花生芽品质劣变。且短期超低氧处理是非常有效、成本低廉且操作简便的处理方式,具有较高的推广应用价值。本研究结果不仅为短期超低氧处理对花生芽常温物流中褐变的影响及其机理提供了依据,而且为常温物流运输中将超低氧技术应用于其他芽菜的贮藏保鲜提供了参考。
[1] 胡晶晶. NaCl/MeJA及其联合Ca2+调控花生发芽期间生理代谢及白藜芦醇富集研究[D].扬州:扬州大学, 2023.HU J J.Effects of NaCl/MeJA and its combination with Ca2+ on physiological metabolism and resveratrol enrichment during peanut germination[D].Yangzhou:Yangzhou University, 2023.
[2] PUNIA BANGAR S, TRIF M, OZOGUL F, et al.Recent developments in cold plasma-based enzyme activity (browning, cell wall degradation, and antioxidant) in fruits and vegetables[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(2):1958-1978.
[3] 伍新龄. 短波紫外线对双孢蘑菇采后褐变调控机理研究[D].天津:天津商业大学, 2016.WU X L.Study on the regulation mechanism of short-wave ultraviolet on postharvest browning of Agaricus bisporus[D].Tianjin:Tianjin University of Commerce, 2016.
[4] 王婷婷. 酶活性和细胞结构对两种鲜切马铃薯褐变的影响研究[D].泰安:山东农业大学, 2022.WANG T T.Effects of enzyme activity and cell structure on the browning of two fresh-cut potato cultivars[D].Taian:Shandong Agricultural University, 2022.
[5] GANTNER M, GUZEK D, POGORZELSKA E, et al.The effect of film type and modified atmosphere packaging with different initial GAS composition on the shelf life of white mushrooms (Agaricus bisporus L.)[J].Journal of Food Processing and Preservation, 2017, 41(1):e13083.
[6] LIU Y B.Ultralow oxygen treatment for postharvest control of western flower thrips, Frankliniella occidentalis (Thysanoptera:Thripidae), on iceberg lettuce[J].Postharvest Biology and Technology, 2008, 49(1):135-139.
[7] 陈敬鑫, 张德梅, 李永新, 等.低氧贮藏对采后果实风味的影响研究进展[J].食品科学, 2021, 42(13):273-280.CHEN J X, ZHANG D M, LI Y X, et al.Progress toward understanding the effect of low-oxygen storage on the flavor of postharvest fruits[J].Food Science, 2021, 42(13):273-280.
[8] 杜艳民, 王文辉, 贾晓辉, 等.前期低氧处理对梨虎皮病的防控及乙烯释放的影响[J].园艺学报, 2021, 48(1):15-25.DU Y M, WANG W H, JIA X H, et al.Effects of initial low oxygen treatments on superficial scald prevention and ethylene release in pear[J].Acta Horticulturae Sinica, 2021, 48(1):15-25.
[9] TECHAVUTHIPORN C, BOONYARITTHONGCHAI P, SUPABVANICH S.Physicochemical changes of ‘Phulae’ pineapple fruit treated with short-term anoxia during ambient storage[J].Food Chemistry, 2017, 228:388-393.[10] TECHAVUTHIPORN C, JARERAT A, NIMITKEATKAI H.Short-term anoxic treatment of Litchi fruit (Litchi chinensis sonn.cv.Hong huey) delays pericarp browning and maintains physicochemical quality during storage[J].The Horticulture Journal, 2023, 92(3):207-215.
[11] TANG J X, REN H, CHEN X, et al.Effects of short-term N2 anaerobic treatment on respiratory metabolism and oxidation status of Agaricus bisporus[J].Postharvest Biology and Technology, 2021, 181:111692.
[12] TECHAVUTHIPORN C, THAMMAWONG M, NAKANO K.Effect of short-term anoxia treatment on endogenous ethanol and postharvest responses of broccoli florets during storage at ambient temperature[J].Scientia Horticulturae, 2021, 277:109813.
[13] 付欣, 渠皓琳, 孙剑, 等.脉冲强光处理对花生芽理化指标及白藜芦醇富集的影响[J].食品研究与开发, 2022, 43(7):24-29.FU X, QU H L, SUN J, et al.Effect of intense pulsed light on physicochemical indexes and resveratrol enrichment of peanut sprout[J].Food Research and Development, 2022, 43(7):24-29.
[14] 程曦. 控温包装在莴笋尖常温物流过程中的保鲜机理及优化研究[D].重庆:西南大学, 2017.CHENG X.Study on the preservation mechanism and optimization of insulating package in course of normal temperature-logistics of lettuce tip[D].Chongqing:Southwest University, 2017.
[15] 曹建康, 姜微波, 赵玉梅.蔬菜采后生理生化实验指导[M].北京:中国轻工业出版社, 2017.CAO J K, JIANG M W, ZHAO Y M.Postharvest Physiological and Biochemical Experimental Guidance for Fruits and Vegetables[M].Beijing:China Light Industry Press, 2017.
[16] 陈勇. O2/CO2主动自发气调对西兰花保鲜效果及后续效应的影响[D].淄博:山东理工大学, 2019.CHEN Y.Influences of O2/CO2 Active modified atmosphere packaging on storage quality and residual effects of broccoli[D].Zibo:Shandong University of Technology, 2019.
[17] 张锶苑, 代慧, 肖徐, 等.高阻隔包装材料构建的超低氧短期处理对仔姜贮藏品质的影响[J].食品与发酵工业, 2023, 49(20):250-258.ZHANG S Y, DAI H, XIAO X, et al.Effect of short-term ultra-low oxygen treatment constructed by high barrier packaging materials on storage quality of baby ginger[J].Food and Fermentation Industries, 2023, 49(20):250-258.
[18] TAN X L, FAN Z Q, ZENG Z X, et al.Exogenous melatonin maintains leaf quality of postharvest Chinese flowering cabbage by modulating respiratory metabolism and energy status[J].Postharvest Biology and Technology, 2021, 177:111524.
[19] 任浩. 短期厌氧气调对双孢蘑菇采后生理及品质的影响[D].沈阳:沈阳农业大学, 2021.REN H.Effects of short-term anaerobic treatment combined with modified atmosphere packaging on the postharvest physiology and the quality of Agaricus bisporus[D].Shenyang:Shenyang Agricultural University, 2021.
[20] 李秋雨, 曾凯芳, 姚世响.活性氧在果实成熟和衰老中的作用及调控机制[J].食品与发酵工业, 2020, 46(17):271-276.LI Q Y, ZENG K F, YAO S X.Effect of reactive oxygen species on fruit ripening and senescence and the relevant mechanism[J].Food and Fermentation Industries, 2020, 46(17):271-276.
[21] XU F X, LIU S Y, LIU Y F, et al.Effect of mechanical vibration on postharvest quality and volatile compounds of blueberry fruit[J].Food Chemistry, 2021, 349:129216.
[22] ZHANG W L, JIANG W B.UV treatment improved the quality of postharvest fruits and vegetables by inducing resistance[J].Trends in Food Science &Technology, 2019, 92:71-80.
[23] 林少华, 张晓军, 张慧杰, 等.果蔬氧化还原防御系统研究进展[J].中国果菜, 2021, 41(4):33-39.LIN S H, ZHANG X J, ZHANG H J, et al.Research progress on redox defense system of fruits and vegetables[J].China Fruit &Vegetable, 2021, 41(4):33-39.
[24] 盖晓阳, 张敏, 胡均如, 等.不同湿度对热处理西葫芦传热过程及低温贮藏品质和抗氧化系统的影响[J].食品与发酵工业, 2022, 48(2):94-102.GAI X Y, ZHANG M, HU J R, et al.Effects of heat treatments with different humidity on heat transfer process, low temperature storage quality and antioxidant system of zucchini[J].Food and Fermentation Industries, 2022, 48(2):94-102.
[25] 刘红艳, 张雷刚, 胡花丽, 等.气调处理对绿芦笋抗氧化及抗病酶活性的影响[J].核农学报, 2017, 31(6):1119-1127.LIU H Y, ZHANG L G, HU H L, et al.Effects of controlled atmosphere treatment on the activities of antioxidant and disease resistance-related enzymes in green Asparagus[J].Journal of Nuclear Agricultural Sciences, 2017, 31(6):1119-1127.
[26] 李静, 李霞, 陈翠松, 等.GABA处理对双孢蘑菇活性氧代谢和膜脂过氧化的影响[J].食品工业科技, 2019, 40(3):275-280.LI J, LI X, CHEN C S, et al.Effects of GABA treatment on activate oxygen metabolism and membrane lipid peroxidation of Agaricus bisporus[J].Science and Technology of Food Industry, 2019, 40(3):275-280.
[27] TANG J X, CHEN X, ZHANG Y H, et al.The ultra-low O2 environment after anaerobic treatment enhanced the antioxidant properties of Agaricus bisporus mushroom[J].Scientia Horticulturae, 2022, 303:111192.
[28] 朱丽娟, 侯佳迪, 王军萍, 等.NO延缓新鲜果蔬成熟衰老和提高抗性效果及作用机制研究进展[J].食品工业科技, 2021, 42(22):398-405.ZHU L J, HOU J D, WANG J P, et al.Research progress on effect and mechanism of NO delaying ripening and senescence and improving resistance of fresh fruits and vegetables[J].Science and Technology of Food Industry, 2021, 42(22):398-405.
[29] 周亨乐, 王富海, 易俊洁, 等.化学抑制剂对果蔬食品多酚氧化酶性质影响的研究进展[J].食品与发酵工业, 2021, 47(4):253-260.ZHOU H L, WANG F H, YI J J, et al.Research progress on the effect of chemical inhibitors on the properties of polyphenol oxidase in fruits and vegetables[J].Food and Fermentation Industries, 2021, 47(4):253-260.
[30] 韩倩云, 王坤立, 温馨, 等.多酚氧化酶的分离纯化及生理功能的研究进展[J].食品工业, 2020, 41(5):261-267.HAN Q Y, WANG K L, WEN X, et al.Purification and physicochemical properties of plant polyphenol oxidase:A review[J].The Food Industry, 2020, 41(5):261-267.
[31] 陈兆璇, 殷诚, 高晓煜, 等.短期厌氧结合开孔调湿包装对香菇保鲜效果的影响[J/OL].食品与发酵工业, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.037713.CHEN Z X, YIN C, GAO X Y, et al.Effect of short-term anaerobic combination with open hole humidifying package on the fresh-keeping effect of mushroom[J/OL].Food and Fermentation Industries, 2024.https://doi.org/10.13995/j.cnki.11-1802/ts.037713.
[32] LI L, WU M M, WANG R F, et al.Peroxidase properties of fresh-cut potato browning[J].IOP Conference Series:Materials Science and Engineering, 2018, 397:012115.
[33] 黄小榕. 杨梅果实成熟与贮运期间乙醛和乙醇积累及PDC和ADH基因表达研究[D].杭州:浙江大学, 2022.HUANG X R.Studies on accumulation of acetaldehyde and ethanol and expression of PDC and ADH in ripening and storage processes of Chinese bayberry fruit[D].Hangzhou:Zhejiang University, 2022.
[34] 李娟, 魏珊珊, 刘贵珊, 等.果实采后贮藏过程乙醇代谢的研究进展[J].中国果树, 2022(9):1-6.LI J, WEI S S, LIU G S, et al.Advances on ethanol metabolism of fruits during postharvest storage[J].China Fruits, 2022(9):1-6.
[35] 张艳艳, 陈恺, 于宁, 等.不同浓度CO2及O2处理对哈密大枣无氧呼吸代谢的影响[J].食品工业科技, 2013, 34(9):315-318;323.ZHANG Y Y, CHEN K, YU N, et al.Influence of different concentrations of CO2 and O2 treatments on anaerobic respiration metabolism from Hami jujube[J].Science and Technology of Food Industry, 2013, 34(9):315-318;323.