皇冠梨是我国消费量最大的水果之一,果肉呈白色,酸甜可口。在进行鲜切加工时切割会对梨果肉造成机械损伤,导致果肉营养物质流失、非酶促和酶促褐变加剧,同时增加了病原体传播的风险[1]。切割面的果肉极易被空气中细菌和霉菌污染,导致果肉腐烂变质。低温环境下,以大肠杆菌为代表的部分致病菌仍能够大量繁殖,发生食品安全问题;此外,切割伤害引起的果肉表面褐变是鲜切梨品质下降的主要因素[2],影响产品外观,降低商品价值。
目前,针对鲜切梨的保鲜多采用化学、气调、低温等方法[3],但一种方法的效果较为单一,所以采用两种、三种方法复合来实现保鲜,也因此产生了新的食品安全问题;疫情过后消费者对于即食果蔬有更高的食用安全要求,也更青睐使用绿色天然添加剂的高质量产品。所以需要开发一种新的鲜切梨保鲜方法,可高效控制微生物滋生以延长鲜切产品的保质期,而且能够减缓酶促褐变,从而比常规方法更好地保持鲜切梨的感官和营养品质。
光动力技术(photodynamic technology,PDT)具有光敏剂浓度低、微生物灭活速度快、适用于冷藏等优点,已广泛应用于医疗领域;所用的光敏剂包括姜黄素类、核黄素类、三联噻吩和醌类化合物[4];核黄素是一种天然的营养强化剂、光敏剂以及抗氧化剂,参与生物体内多种代谢反应,是人体不可缺少的营养物质;过量食用也会随尿液排出,是非常安全的天然添加剂;在光照条件下,核黄素会发生光敏化反应产生大量活性氧,这些活性氧可以对核酸、脂质膜和蛋白质造成氧化损伤,最终导致细菌细胞死亡[5]。
目前针对光动力技术在果蔬保鲜上的应用鲜有研究,且集中于姜黄素介导下PDT技术的保鲜效果, ZOU等[6]研究发现用100 μmol/L的姜黄素结合LED蓝光灯有效减轻了鲜切菠萝的褐变;TAO等[7]采用PDT处理鲜切苹果时,发现姜黄素浓度为0.5 μmol/L时就能表现出较强的抗褐变作用,浓度为10 μmol/L时也能表现出较强的抗菌作用,浓度为50 μmol/L时会导致鲜切苹果染色。针对核黄素的研究较少,ZHA等[8]探究PDT对鲜切苹果褐变的影响,发现核黄素浓度越高,延缓褐变的效果越差,HYUN等[9]发现用200 μmol/L核黄素结合LED蓝光灯处理加深了鲜切苹果的褐变程度,所以,针对鲜切梨等果肉呈白色且易褐变的果蔬,需要减少光敏剂溶液颜色对果肉的影响同时也能兼顾抗褐变和抗菌效果。
本研究以核黄素为光敏剂,探究PDT处理不同光照时长和浓度对于大肠杆菌的杀菌效果,找出最佳灭菌时长;然后探讨不同核黄素浓度PDT处理对鲜切梨的褐变、酚类物质和微生物灭活等的影响。
1 材料与方法
1.1 光源和光敏剂
以最大发射波长为(460±5) nm的LED蓝光灯板作为光源进行光动力处理。在低温箱上下面装上灯板,将样品放置在离光源6 cm处。制备2 mmol/L核黄素的溶液,并在0 ℃下避自然光保存;实验时,将核黄素溶液用去离子水分别稀释至10、20、30 mmol/L,现用现配。
1.2 细菌菌株和培养条件
实验所使用的菌株为大肠杆菌O157∶H7(E.coli,ATCC 31350),是最常见的食源性致病菌。所用菌株在20%甘油中-20 ℃下保存,通过在37 ℃下Luria-Bertani培养基(50 mL)中振荡培养12 h来制备大肠杆菌悬浮液,直到细菌密度达到约108 CFU/mL,用无菌生理盐水稀释到106 CFU/mL并立即用于实验。
1.3 鲜切梨的制备
“皇冠梨”,于2023年3月购于无锡市滨湖区天惠超市,随机选取大小均一、无病虫害、无缺陷和机械伤的梨果实,在冰箱中5 ℃预冷24 h。以下处理均在无菌操作台上进行,将预冷的梨果实在去离子水中洗涤后用灭菌纱布擦干水分;采用手摇式水果削皮机和水果切分器将梨果实去皮去核切成楔形,每个质量约为(20±2) g;切好的梨块,立刻用于实验。
1.4 试剂
核黄素、浓盐酸、硫代巴比妥酸、三氯乙酸、邻苯二酚、磷酸、红菲咯啉、三氯化铁、冰醋酸、培养基平板计数琼脂,国药集团化学试剂有限公司;无水甲醇、L-抗坏血酸、无水乙醇、愈创木酚,上海泰坦科技股份有限公司。
1.5 仪器与设备
LED蓝光灯板(12 W),徐州爱佳电子科技有限公司;V-320多功能气调包装一体机,苏州工业区德森包装机械有限公司;UV-1800紫外分光光度计,日本岛津国际贸易公司;PAL-BX/ACIDF糖酸度一体机,日本ATAGO公司;CR-400色差计,日本Konica Minolta公司;C650B顶空气体分析仪,济南兰光机电技术有限公司;LC-LX-HR165A高速冷冻离心机,上海一恒科学仪器有限公司;AP-08植物组织研磨仪,上海安普实验科技有限公司;DK-S26电热恒温水浴锅,上海精宏实验设备有限公司;D-118包装盒(尺寸183 mm×133 mm×80 mm)、PET/PP复合膜(厚度70 μm),苏州和好环保科技股份有限公司。
1.6 实验方法
1.6.1 鲜切梨表面大肠杆菌接种及核黄素介导的PDT处理
将切好的梨块浸泡在大肠杆菌悬液(106 CFU/mL),处理时间为30 min,使大肠杆菌附着于梨块表面;于5 ℃下保存1 d后,将处理好的梨块分别进行核黄素溶液浸泡结合LED蓝光灯处理,光照处理时间设定为5、10、15、20 min,处理浓度设定为0、10、20、30 μmol/L;所有样品在室温下超净台中干燥10 min,用于后续实验。
1.6.2 核黄素介导的PDT处理鲜切梨
另外挑选鲜切的梨块随机分成4组,进行核黄素溶液结合LED蓝光灯处理。根据本文2.1节结论可知,最佳光照处理时间为15 min;核黄素处理浓度为0、10、20、30 μmol/L;将样品在室温下超净台中干燥10 min;采用包装盒,每盒装入(80±2)g鲜切梨后以PET/PP复合膜进行封装;将处理好的4组样品分别标记为CK、L+R10、L+R20、L+R30组,置于(5±0.5)℃环境下贮藏8 d。分别在梨块处理后第0、2、4、6、8天取样,每次取样时从不同处理的各个重复组中随机各取3个盒的鲜切梨进行理化指标检测。
1.6.3 菌落总数的测定
参考GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》略作修改,取15 g样品,加入135 mL无菌生理盐水在无菌均质袋中,用拍击式均质器拍打5 min,制成1∶10的样品匀浆。制备系列稀释液并接种在对应培养基上,将其在37 ℃下孵育24 h以测定大肠杆菌数量和菌落总数,微生物数量表示为lg CFU/g。
1.6.4 鲜切梨品质指标的测定
1.6.4.1 色差、褐变指数
梨色泽用总色差(ΔE)来表征,梨的褐变程度用褐变指数(browning index,BI)来表征,利用色差仪对样品果肉的颜色进行测定,每个处理随意取3个梨块,每个楔形梨果肉的同一水平线上测3个点,结果取平均值。利用L*、a*、b*值来表示明亮程度。ΔE[10]和BI[11]的计算方式如公式(1)、公式(2)所示:
(1)
(2)
式中:L*、a*和b*值分别是测定样品的色泽值;L0*、a0*和b0*值分别是新鲜样品色泽值。
1.6.4.2 可溶性固形物(total soluble solids,TSS)和抗坏血酸含量(ascorbic,ASA)
TSS的含量使用糖酸度一体机测量,将10 g梨样品在研磨仪中研磨,经离心(4 000 r/min,10 min)后取汁液进行测定。
ASA含量测定参考曹建康等[12]的方法,略作修改。称取1 g样品和9 mL三氯乙酸溶液,于组织研磨仪中研磨100 s,转速为2 000 r/min,提取10 min过滤;取1 mL上清液,加入1 mL三氯乙酸溶液、1 mL无水乙醇、0.5 mL体积分数为0.4%的磷酸-乙醇溶液、1 mL 5 g/L BP-乙醇溶液和0.5 mL 0.3 g/L FeCl3-乙醇溶液,混合摇匀;将混合液置于30 ℃下反应60 min,于在534 nm处测量吸光度。并以抗坏血酸质量为横坐标,吸光度值为纵坐标绘制标准曲线方程:y=0.039 03x+0.089 27(R2=0.998 9),单位为mg/100 g。
1.6.4.3 抗氧化物质含量测定
总酚和类黄酮的含量按照曹建康等[12]的方法进行测定, 单位为U/g。
1.6.5 鲜切梨褐变相关酶活性的测定
多酚氧化酶(superoxide dismutase,PPO)和过氧化物酶(peroxidase,POD)活性的测定参考文献[12]。以反应液每分钟在420 nm 波长处下吸光度变化0.01为1个PPO酶活力单位,以反应液每分钟在470 nm 波长处下吸光度变化0.001为1个POD酶活力单位,单位为U/g。
1.6.6 鲜切梨丙二醛含量的测定
参考WANG等[13]的方法,单位为μmol/kg。
1.7 数据统计分析
所有实验均为3次重复随机实验,数据采用SPSS 26软件进行显著性分析,P<0.05表示差异显著,曲线拟合采用MATLAB完成,绘图采用Origin 2022。
2 结果与分析
2.1 核黄素介导的PDT处理时间和浓度对鲜切梨上大肠杆菌灭活效果的影响
PDT是一种有效的抗菌技术,该技术的有效性取决于光敏剂的浓度和光照时长[14]等因素。如图1所示,在没有光敏剂和光照的情况下,去离子水浸泡没有显著减少大肠杆菌的总数;在核黄素溶液中浸泡的情况下;当使用光照时长为5 min时,PDT处理组的大肠杆菌数量分别比CK组减少了0.14、0.18和0.24 lg CFU/g,这可能是由于处理时间较短导致PDT灭菌效果不佳;当光照时长为10 min,随着核黄素浓度的增加,PDT处理组的抑菌效果逐渐增强(P<0.05);当核黄素溶液浓度为30 μmol/L,光照时长为15 min时,鲜切梨上的大肠杆菌数量减少了0.68 lg CFU/g。因此,核黄素介导的PDT对鲜切梨上大肠杆菌的灭活效果与核黄素浓度和光照时长呈正相关关系,蓝彩娟等[15]在研究姜黄素PDT对圣女果的灭菌效果时也发现了类似规律。
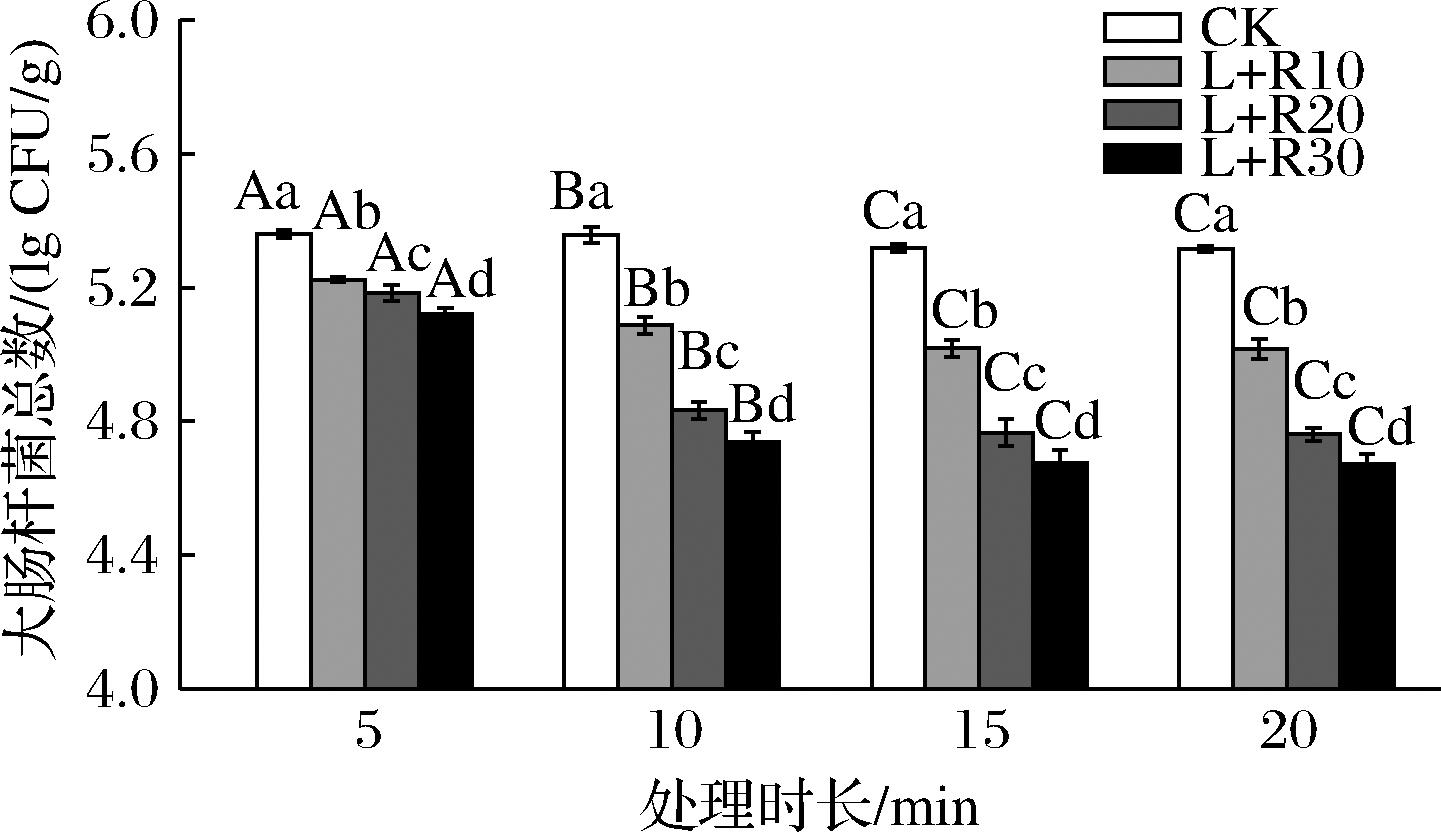
图1 核黄素介导的PDT处理对鲜切梨上大肠杆菌灭活的效果
Fig.1 Effect of riboflavin-based photodynamic treatment on inactivation of E.coli of fresh-cut pears
注:图中的不同字母(A~C或a~c)表示差异显著(P<0.05),下同。
当光照时长在5~15 min时,大肠杆菌数量迅速下降(P<0.05),光照时长为15 min时,PDT处理组的大肠杆菌数量分别降低了0.34、0.59和0.68 lg CFU/g;当光照时长超过15 min后,光照时长对PDT处理的抑菌效果影响不显著。这些结果表明PDT处理在15 min内对微生物的灭活效果最佳,可以短时间内达到灭活效果,不影响鲜切果蔬的加工效率。
2.2 核黄素介导的PDT处理对鲜切梨贮藏期间褐变的影响
如图2-a所示,鲜切梨经过PDT处理后贮藏初期呈亮白色,可以看出浓度低于30 μmol/L的核黄素溶液对鲜切梨的外观无不良影响;随着贮藏时间增加,梨表面褐变加深,在贮藏第8天时,核黄素PDT处理组视觉效果均显著优于对照组,其中L+R20处理组的效果最佳。
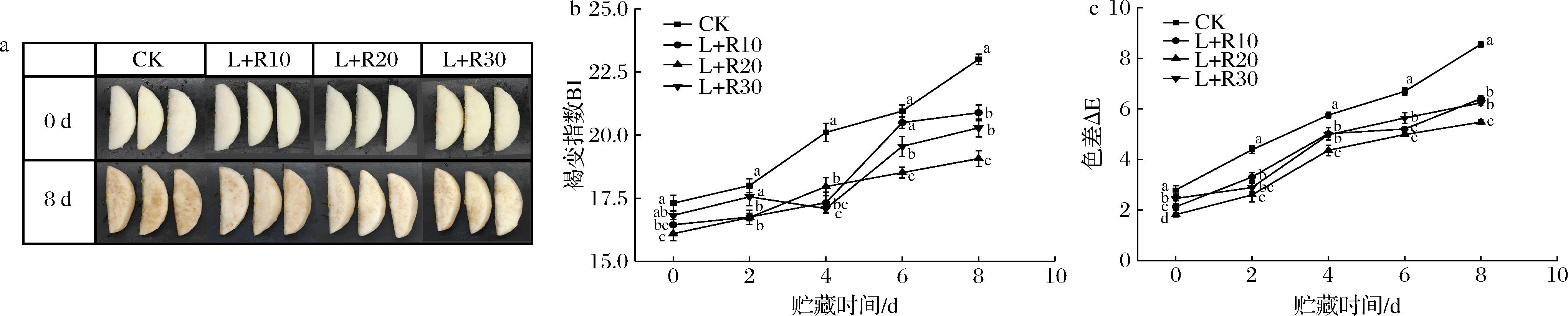
a-外观图;b-BI;c-ΔE
图2 PDT处理对鲜切梨在5 ℃贮藏期间外观、BI和ΔE的影响
Fig.2 Effect of PDT treatment on exterior quality, BI and ΔE of fresh-cut pears stored at 5 ℃
鲜切梨的BI可以直观反应其褐变程度。如图2-b所示,在贮藏期间,PDT处理的鲜切梨的BI值均低于CK组(P<0.05),在第8天后,其中L+R10、L+R20和L+R30处理组的BI值与CK处理组相比,分别下降9.20%、17.10%和11.80%。结果表明,核黄素介导的PDT处理可以减轻鲜切梨的褐变现象。
色泽是评价鲜切梨品质的重要指标,ΔE可以直接反应出贮藏期间鲜切梨色泽的变化程度。由图2-c可知,PDT处理对鲜切梨的ΔE值均小于CK组。贮藏第8天时,L+R20处理组与其他组相比产生了显著差异(P<0.05);与CK组相比,L+R20处理组的鲜切梨的ΔE下降约35.9%。表明20 μmol/L的核黄素介导的PDT处理对鲜切梨色泽的维持效果最佳。
贮藏初期,L+R30处理组的BI值和ΔE值相较于其他两组处理组较大,这可能由于被处理过的鲜切梨表面会沾上核黄素溶液所致。HYUN等[9]用0.2 mmol/L的姜黄素溶液处理鲜切苹果后,鲜切苹果表面出现了不良的颜色和外观变化。而CORR A等[16]的研究表明,在40 μmol/L或80 μmol/L的姜黄素溶液处理下,苹果没有表现出不良的视觉外观。因此,进行PDT处理时,核黄素的浓度较高会影响鲜切果蔬的色泽;所以需要采用低浓度的光敏剂来减少对鲜切果蔬色泽的不良影响。
A等[16]的研究表明,在40 μmol/L或80 μmol/L的姜黄素溶液处理下,苹果没有表现出不良的视觉外观。因此,进行PDT处理时,核黄素的浓度较高会影响鲜切果蔬的色泽;所以需要采用低浓度的光敏剂来减少对鲜切果蔬色泽的不良影响。
2.3 核黄素介导的PDT处理对鲜切梨贮藏期间菌落总数的影响
梨果实受到机械切割后,由于其保护系统被破坏,抵御外界微生物的能力减弱,很容易受到细菌侵扰,从而导致品质下降。PDT处理对鲜切梨贮藏期间菌落总数的影响如图3所示。
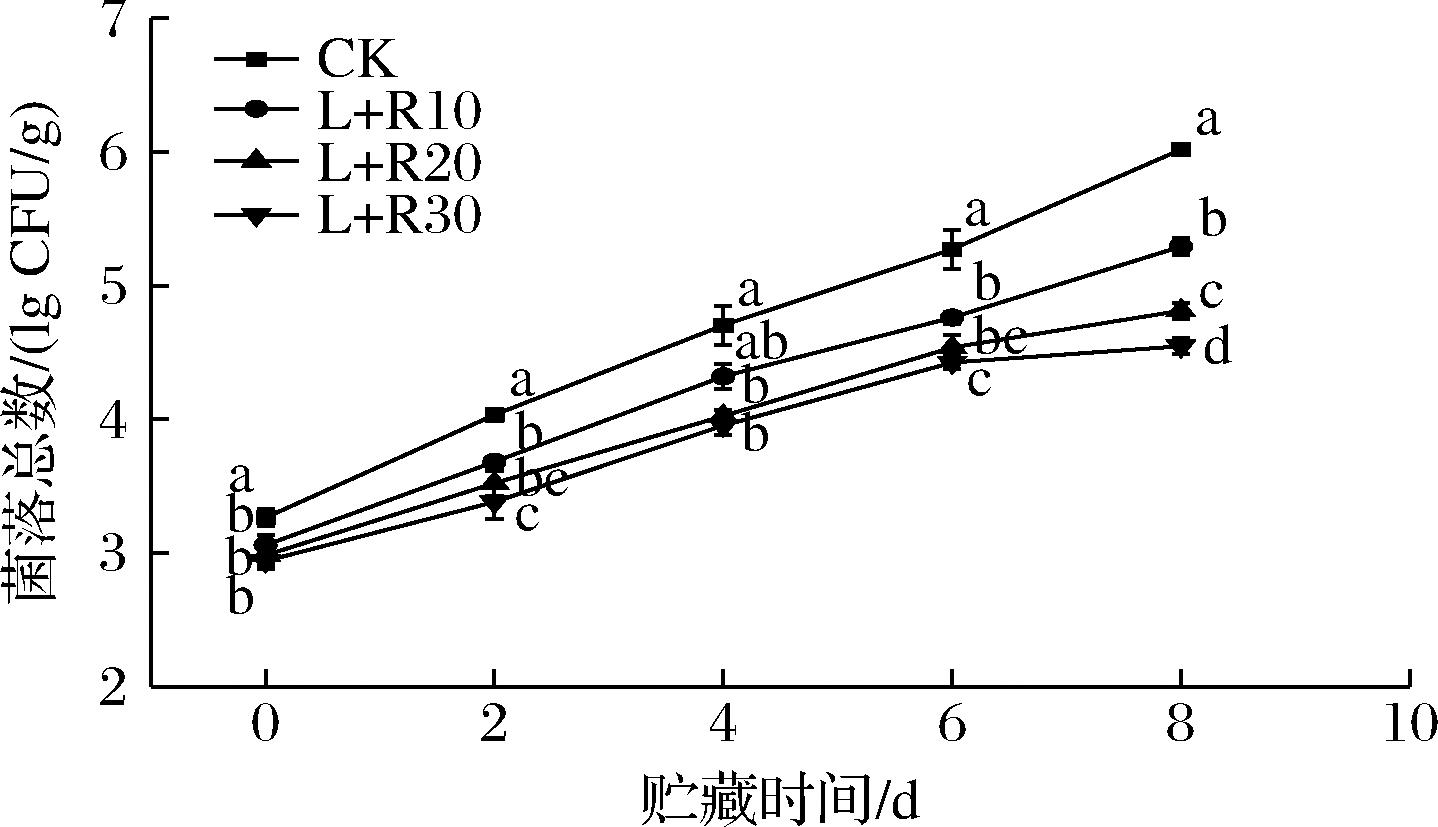
图3 PDT处理对鲜切梨在5 ℃贮藏期间菌落总数的影响
Fig.3 Effect of PDT treatment on total bacteria of fresh-cut pears stored at 5 ℃
从图3中可以看出,PDT处理组在贮藏期间菌落总数显著低于CK组(P<0.05),这表明核黄素介导下的PDT处理对鲜切梨有明显的抑菌作用,PDT处理组菌落总数比CK组处理低0.69、1.17和1.43 lg CFU/g。类似的结果在其他研究中也有发现,APONIENE等[17]的研究发现金丝桃素介导的PDT处理分别使花椰菜、李子和杏上的细菌种群数量减少0.60、0.63和0.72 lg CFU/g。在贮藏第8天时,CK组的菌落总数超过106 lg CFU/g,超过了鲜切果蔬可食用的微生物限度[18],而L+R20和L+R30处理组均低于105 lg CFU/g。此外,随着核黄素处理的浓度升高,其抑菌效果越明显。但是有研究中发现高浓度的光敏剂会对果实本身造成损伤,所以需要结合鲜切梨其他生理生化指标进行综合评价,择出最佳核黄素处理浓度。
2.4 核黄素介导的PDT处理对鲜切梨贮藏期间TSS和ASA含量的影响
TSS的含量是鲜切梨品质的重要指标,同时影响果实成熟和衰老。由图4-a可知,随着贮藏时间的延长,鲜切梨的可溶性固形物含量逐渐下降,这表明鲜切梨在逐渐衰老。在贮藏前期,L+R20和L+R30处理组的可溶性固形物含量比CK组高,表明适宜浓度的核黄素处理对贮藏期间的鲜切梨的TSS含量有积极的影响;在贮藏后期,与CK组相比,PDT处理组很好的维持了鲜切梨可溶性固形物含量(P<0.05)。ZHAN等[19]的研究发现在贮藏过程中,鲜切芹菜的TSS含量逐渐下降,而光照明显延缓了TSS含量下降。因此,PDT处理能够延缓贮藏后期果实中TSS的含量下降,从而延缓果实衰老。
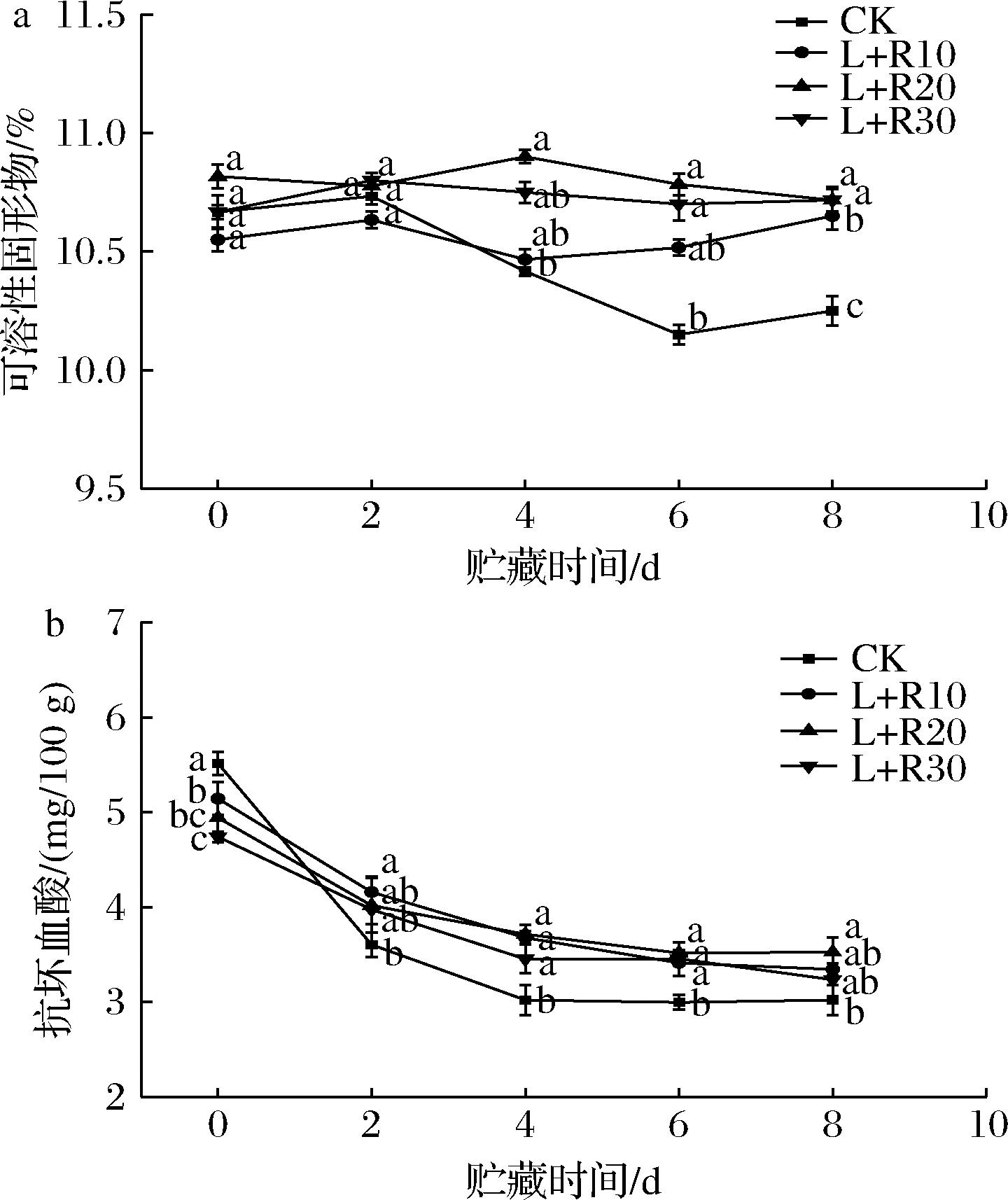
a-TSS含量;b-ASA含量
图4 PDT处理对鲜切梨在5 ℃贮藏期间的TSS和
ASA含量的影响
Fig.4 Effect of PDT treatment on TSS and ASA of fresh-cut pears stored at 5 ℃
PDT处理对鲜切梨抗坏血酸含量的影响如图4-b所示。ASA含量在前6 d逐渐下降。这种变化是由于梨果实细胞膜结构的破坏所致,酚类物质被迅速氧化,抗坏血酸作为抗氧化剂,可以减轻果肉褐变[20]。同时可以看出,在贮藏初期PDT处理会对鲜切梨的ASA含量产生负面影响(P<0.05),这可能是由于在PDT过程中产生活性氧,抗坏血酸作为非酶抗氧化剂在清除鲜切梨中活性氧,导致抗坏血酸含量迅速下降[21]。但随着贮藏时间的增加,PDT处理组延缓了ASA含量的降低,其中L+R20处理的效果最为明显,ASA含量比CK组高约14.35%;因此,PDT处理在后期的贮藏中会减少鲜切梨营养成分的消耗,延缓果实腐败变质。
2.5 核黄素介导的PDT处理对鲜切梨贮藏期间总酚、类黄酮的影响
酚类物质等一些具有抗氧化活性的化合物对人体健康有益。研究表明,酚类物质的含量与梨果实的酶促褐变有关。如图5-a所示,PDT处理的鲜切梨的总酚含量增加了(P<0.05),这可能是因为贮藏初期PDT处理产生大量的活性氧,刺激总酚迅速积累;到贮藏后期,CK组和PDT处理的鲜切梨果实总酚含量呈逐渐下降趋势,PDT处理后第4~8天鲜切梨果实中总酚含量显著高于对照组(P<0.05)。这表明PDT处理缓解了鲜切梨中总酚含量的下降,其中L+R20处理组的总酚含量最高。ZOU等[6]的研究也证实了PDT处理能够促进鲜切菠萝总酚的积累。
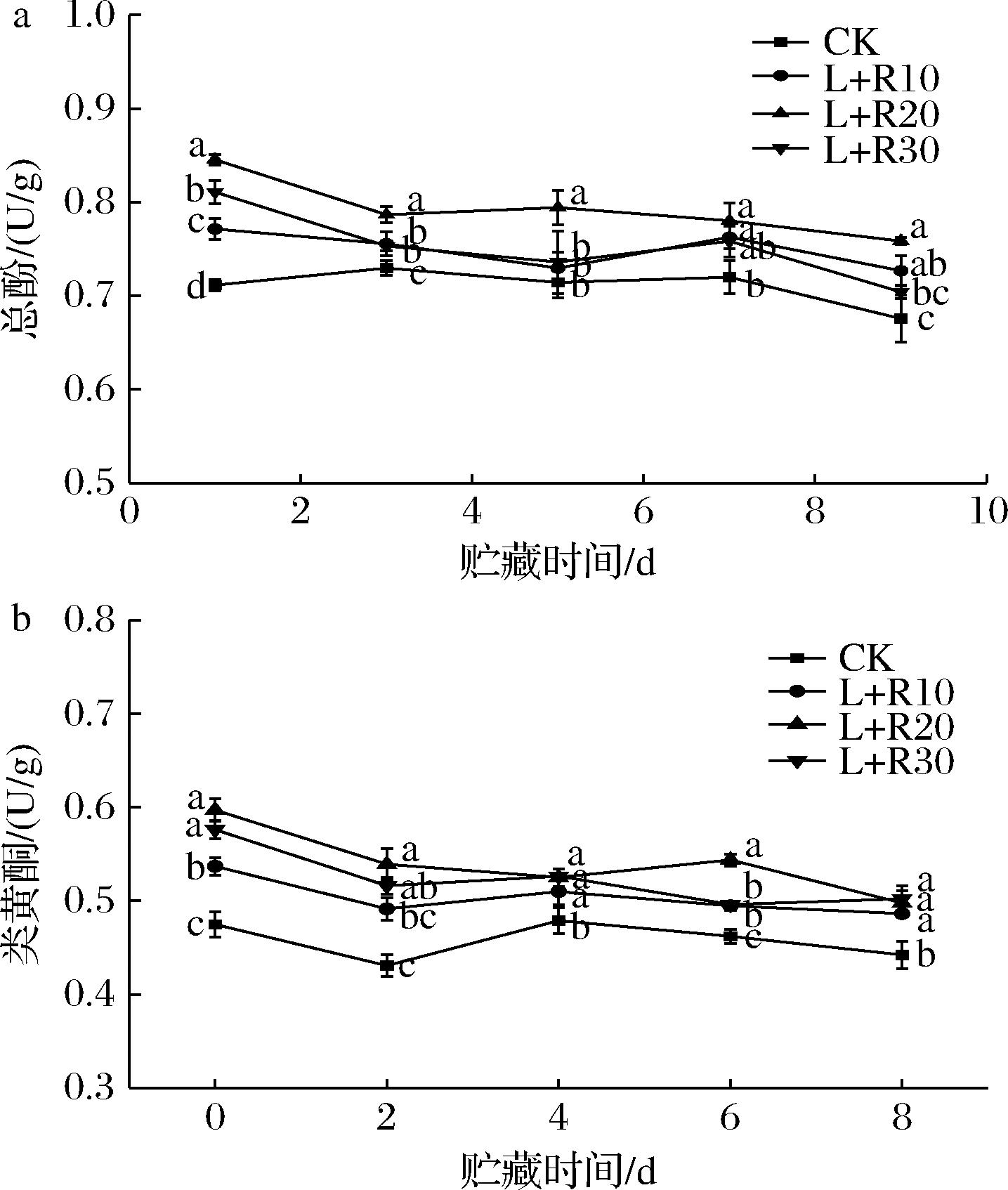
a-总酚含量;b-类黄酮含量
图5 PDT处理对鲜切梨在5 ℃贮藏期间的总酚和类黄酮含量的影响
Fig.5 Effect of PDT treatment on the contents of total phenols and flavonoids of fresh-cut pears stored at 5 ℃
类黄酮和酚类物质是植物体内的非酶类抗氧化物质,参与自由基的清除。PDT处理组对类黄酮含量的影响如图5-b所示。类黄酮含量变化与总酚的变化基本一致,结果表明,PDT处理组的鲜切梨的类黄酮含量显著高于CK组(P<0.05),贮藏前4 d,L+R20处理组的类黄酮含量最高;贮藏后4 d,类黄酮含量均有所降低,PDT处理组的类黄酮含量维持在较高的水平。PDT处理对果实总酚和类黄酮积累的积极影响可能归因于光对初级和次级代谢物产生的刺激作用,研究表明这些初级和次级代谢物参与防御PDT处理期间产生的活性氧[22]。
2.6 核黄素介导的PDT处理对鲜切梨贮藏期间PPO和POD活性的影响
PPO对酚类化合物的氧化一直被认为是鲜切梨表面褐变的主要原因,PPO活性的升高以及PPO基因表达的上调与鲜切梨的褐变密切相关[23];因此抑制PPO的活性可以抑制酚类代谢反应,进而提高果实抗褐变能力,同时有助于酚类物质的积累。如图6-a所示,在贮藏过程中,PPO活性呈现先升高后下降的趋势,CK组和L+R10处理组在贮藏第2天PPO活性达到峰值,而L+R20和L+R30处理使得PPO活性峰值延后到第4天,表明PDT处理可以延缓PPO活性达到峰值的时间,有效抑制了鲜切梨的褐变。同时,L+R10、L+R20、L+R30组PPO活性峰值,相比CK组,降低了6.60%、29.00%、13.14%,其中L+R20处理组的效果最佳。
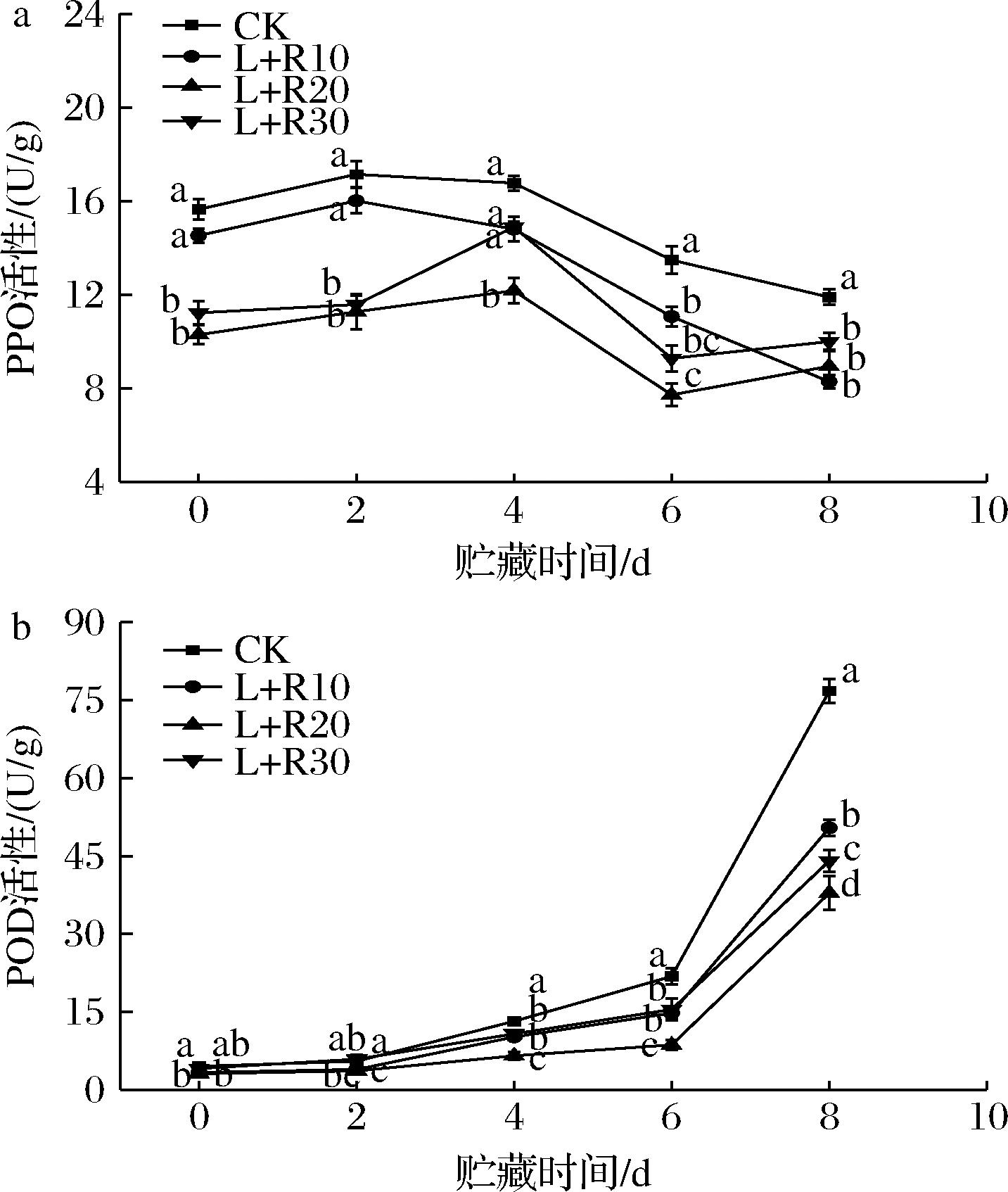
a-PPO活性;b-POD活性
图6 PDT处理对鲜切梨在5 ℃贮藏期间PPO和
POD活性的影响
Fig.6 Effect of PDT treatment on thr activities of PPO and POD of fresh-cut pears stored at 5 ℃
POD与植物的酶促褐变相关,POD可以催化过氧化氢氧化酚类物质产生醌类化合物,由PPO催化的某些酚类化合物氧化生成的H2O2可以诱导PPO和POD之间的协同作用[24]。图6-b所示,鲜切梨POD活性随贮藏时间呈现升高的趋势。与CK组相比,PDT处理组很好的抑制了POD活性。其中贮藏第8 天时,L+R10、L+R20、L+R30组的POD活性与CK组相比降低了34.34%、50.71%、42.65%。结果表明,核黄素介导的PDT处理对PPO和POD的活性有抑制作用,在贮藏期间延缓了鲜切梨的褐变,且L+R20处理组的抑制效果最佳。由此可知,褐变相关酶活性的降低可能是PDT处理后酚类物质含量增加的原因之一。
2.7 核黄素介导的PDT处理对鲜切梨贮藏期间丙二醛含量的影响
脂质过氧化是膜系统损伤和细胞代谢恶化的重要指标。MDA是植物细胞膜中脂质过氧化的产物,MDA的积累可以破坏细胞膜的组成,促进了褐色物质的积累,导致果实褐变[25]。如图7所示,在贮藏的前4 d内,对照组和PDT处理组的鲜切梨果实中MDA含量逐渐升高,在贮藏后期逐渐下降。表明随着贮藏时间的增加,鲜切梨的细胞膜脂过氧化程度不断加深,所以MDA 的含量也逐渐升高;在贮藏后期可能由于与蛋白发生交联反应,因而其含量逐渐下降。与CK组相比,PDT处理组的鲜切梨果实MDA含量显著降低(P<0.05)。说明PDT处理能够减少MDA的积累,其中20 μmol/L的核黄素介导下PDT的处理效果最佳。这可能是由于适宜浓度的光敏剂介导下的PDT处理可以提高鲜切梨对于活性氧的代谢能力,减轻膜脂过氧化程度,从而减少了MDA的积累,进而控制鲜切梨的褐变程度。
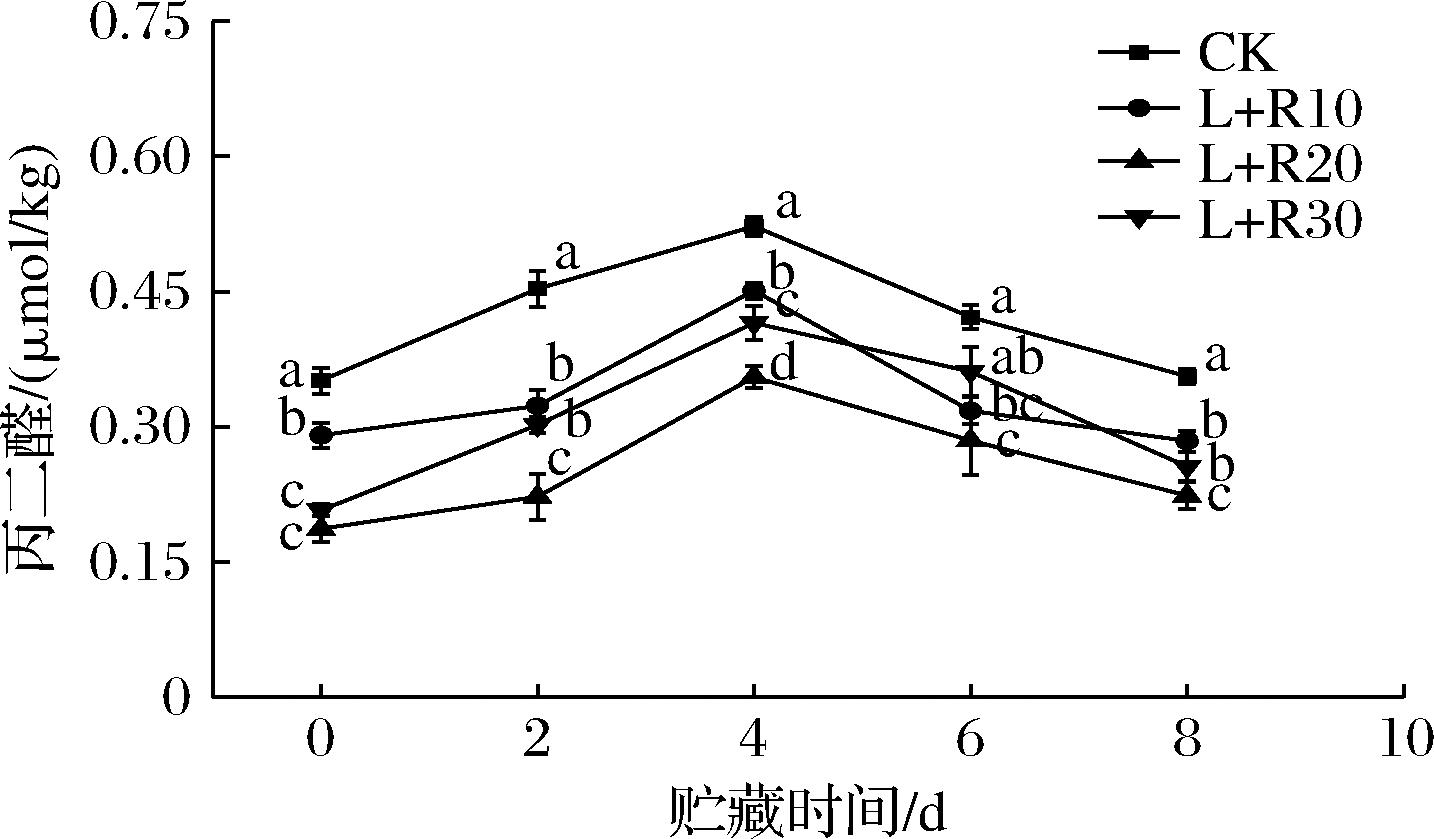
图7 PDT处理对鲜切梨在5 ℃贮藏期间丙二醛含量的影响
Fig.7 Effect of PDT treatment on the contents of MDA of fresh-cut pears stored at 5 ℃
3 结论与讨论
近年来,光动力技术因其在食品工业中非热处理灭活微生物的优势受到广泛关注。本研究旨在探究核黄素介导下的PDT在提高鲜切梨在5 ℃下微生物安全性和鲜切梨品质的效果。结果表明,核黄素介导下PDT处理可以在15 min内对鲜切梨上的大肠杆菌达到最佳灭活效果,在一定浓度范围内,核黄素浓度越高,光照时间越长,灭活效果越好;研究发现低浓度核黄素介导下的PDT对鲜切梨有明显的生理调节作用,浓度为20 μmol/L的核黄素溶液介导的PDT处理有效抑制了微生物滋生,刺激了酚类物质的产生,显著降低了褐变相关酶的活性,从而延缓鲜切梨的氧化褐变;通过提高鲜切梨对于活性氧的代谢能力,减轻膜脂过氧化程度来维持膜的稳定性,提高了鲜切梨的品质。本研究中PDT处理所用的LED蓝光灯是绿色环保、耗电低的冷光源;光敏剂核黄素为天然的抗氧化剂和营养剂。因此,核黄素介导下的光动力技术在果蔬采后保鲜领域具有广阔的应用前景。
[1] 胡晓敏, 黄彭, 刘雯欣, 等.非热物理技术在鲜切果蔬保鲜中的应用研究进展[J].食品与发酵工业, 2021, 47(10):278-284.HU X M, HUANG P, LIU W X, et al.Application of non-thermal physical technologies in fresh-cut fruits and vegetables preservation[J].Food and Fermentation Industries, 2021, 47(10):278-284.
[2] BOBO-GARC A G, ARROQUI C, MERINO G, et al.Antibrowning compounds for minimally processed potatoes:A review[J].Food Reviews International, 2020, 36(5):529-546.
A G, ARROQUI C, MERINO G, et al.Antibrowning compounds for minimally processed potatoes:A review[J].Food Reviews International, 2020, 36(5):529-546.
[3] 胡叶静, 李保国, 张敏, 等.鲜切果蔬保鲜技术及方法研究进展[J].食品与发酵工业, 2020, 46(22):276-281.HU Y J, LI B G, ZHANG M, et al.Progresses on fresh-keeping techniques and methods of fresh-cut fruits and vegetables[J].Food and Fermentation Industries, 2020, 46(22):276-281.
[4] 郑双芝, 王晓迪, 张蕾, 等.光动力杀菌技术及其杀灭食源性有害微生物的研究进展[J].食品与发酵工业, 2023, 49(21):321-328.ZHENG S Z, WANG X D, ZHANG L, et al.Photodynamic anti-microbial technology and its research progress in killing foodborne harmful microorganisms[J].Food and Fermentation Industries, 2023, 49(21):321-328.
[5] CARDOSO D R, LIBARDI S H, SKIBSTED L H.Riboflavin as a photosensitizer.Effects on human health and food quality[J].Food &Function, 2012, 3(5):487-502.
[6] ZOU Y, YU Y S, CHENG L N, et al.Effects of curcumin-based photodynamic treatment on quality attributes of fresh-cut pineapple[J].LWT, 2021, 141:110902.
[7] TAO R, ZHANG F, TANG Q J, et al.Effects of curcumin-based photodynamic treatment on the storage quality of fresh-cut apples[J].Food Chemistry, 2019, 274:415-421.
[8] ZHA Z P, TANG R, WANG C, et al.Riboflavin inhibits browning of fresh-cut apples by repressing phenolic metabolism and enhancing antioxidant system[J].Postharvest Biology and Technology, 2022, 187:111867.
[9] HYUN J E, MOON S K, LEE S Y.Application of blue light-emitting diode in combination with antimicrobials or photosensitizers to inactivate Escherichia coli O157:H7 on fresh-cut apples and cherry tomatoes[J].Food Control, 2022, 131:108453.[10] LANTE A, TINELLO F, NICOLETTO M.UV-a light treatment for controlling enzymatic browning of fresh-cut fruits[J].Innovative Food Science &Emerging Technologies, 2016, 34:141-147.
[11] PALOU E, L PEZ-MALO A, BARBOSA-C
PEZ-MALO A, BARBOSA-C NOVAS G V, et al.Polyphenoloxidase activity and color of blanched and high hydrostatic pressure treated banana puree[J].Journal of Food Science, 1999, 64(1):42-45.
NOVAS G V, et al.Polyphenoloxidase activity and color of blanched and high hydrostatic pressure treated banana puree[J].Journal of Food Science, 1999, 64(1):42-45.
[12] 曹建康, 姜微波, 赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社, 2007.CAO J K, JIANG W B, ZHAO Y M.Physiological and Biochemical Experiment Guidance of Postharvest Fruits and Vegetables[M].Beijing:China Light Industry Press, 2007.
[13] WANG D, LI L, XU Y Q, et al.Effect of exogenous nitro oxide on chilling tolerance, polyamine, proline, and γ-Aminobutyric acid in bamboo shoots (Phyllostachys praecox f.prevernalis)[J].Journal of Agricultural and Food Chemistry, 2017, 65(28):5607-5613.
[14] 范宇航, 周雅菲, 刘昊天, 等.光动力灭活在食品杀菌保鲜中的研究进展[J].食品科学, 2023, 44(17):373-381.FAN Y H, ZHOU Y F, LIU H T, et al.Research progress on photodynamic inactivation in food sterilization and preservation[J].Food Science, 2023, 44(17):373-381.
[15] 蓝彩娟, 陈洁怡, 何雨薇, 等.壳聚糖-姜黄素光动力协同作用对圣女果的食源性致病菌的灭活效果[J/OL].食品科学, 2023.http://kns.cnki.net/kcms/detail/11.2206.TS.20230511.1119.032.html.LAN C J, CHEN J Y, HE Y W, et al.Photodynamic Synergistic effect of chitosan-curcumin on the inactivation of food-borne pathogens on cherry tomatoes[J/OL].Food Science, 2023.http://kns.cnki.net/kcms/detail/11.2206.TS.20230511.1119.032.html.
[16] CORR A T Q, BLANCO K C, GARCIA É B, et al.Effects of ultraviolet light and curcumin-mediated photodynamic inactivation on microbiological food safety:A study in meat and fruit[J].Photodiagnosis and Photodynamic Therapy, 2020, 30:101678.
A T Q, BLANCO K C, GARCIA É B, et al.Effects of ultraviolet light and curcumin-mediated photodynamic inactivation on microbiological food safety:A study in meat and fruit[J].Photodiagnosis and Photodynamic Therapy, 2020, 30:101678.
[17] APONIENE K, PASKEVICIUTE E, REKLAITIS I, et al.Reduction of microbial contamination of fruits and vegetables by hypericin-based photosensitization:Comparison with other emerging antimicrobial treatments[J].Journal of Food Engineering, 2015, 144:29-35.
[18] CHONG J X, LAI S J, YANG H S.Chitosan combined with calcium chloride impacts fresh-cut honeydew melon by stabilising nanostructures of sodium-carbonate-soluble pectin[J].Food Control, 2015, 53:195-205.
[19] ZHAN L J, HU J Q, PANG L Y, et al.Effects of light exposure on chlorophyll, sugars and vitamin C content of fresh-cut celery (Apium graveolens var.dulce) petioles[J].International Journal of Food Science &Technology, 2014, 49(2):347-353.
[20] ZHENG H H, LIU W, LIU S, et al.Effects of melatonin treatment on the enzymatic browning and nutritional quality of fresh-cut pear fruit[J].Food Chemistry, 2019, 299:125116.
[21] CHEN C, LIU C H, JIANG A L, et al.The effects of cold plasma-activated water treatment on the microbial growth and antioxidant properties of fresh-cut pears[J].Food and Bioprocess Technology, 2019, 12(11):1842-1851.
[22] DARKO E, HEYDARIZADEH P, SCHOEFS B, et al.Photosynthesis under artificial light:The shift in primary and secondary metabolism[J].Philosophical Transactions of the Royal Society of London.Series B, Biological Sciences, 2014, 369(1640):20130243.
[23] 何近刚, 冯云霄, 程玉豆, 等.采前氨基乙氧基乙烯甘氨酸处理对‘黄冠’梨长期冷藏后果实品质和果心褐变的影响[J/OL].食品科学, 2023.http://kns.cnki.net/kcms/detail/11.2206.TS.20230308.1108.014.html.HE J G, FENG Y X, CHENG Y D, et al.Effects of preharvest aminoethoxyvinylglycine treatment on fruit quality and core browning after long term cold storage in ‘Huangguan’ pear[J/OL].Food Science, 2023.http://kns.cnki.net/kcms/detail/11.2206.TS.20230308.1108.014.html.
[24] 王迪. 高二氧化碳处理调控鲜切梨果实品质机制的研究[D].杭州:浙江大学, 2020.WANG D.Study on the mechanism of controlling fruit quality of fresh-cut pear by high carbon dioxide treatment[D].Hangzhou:Zhejiang University, 2020.
[25] LIN Y F, LIN H T, LIN Y X, et al.The roles of metabolism of membrane lipids and phenolics in hydrogen peroxide-induced pericarp browning of harvested Longan fruit[J].Postharvest Biology and Technology, 2016, 111:53-61.