杏(Prunus armeniaca L.),蔷薇科(Rosaceae)果树,其果实着色鲜艳、风味独特,具有很高的营养价值[1-2]。新疆具有十分丰富的杏种质资源,是我国乃至世界杏的主产区,是世界杏的起源中心和主要栽培区域[3-4]。轮台白杏(P.armeniaca cv.)原产于新疆南疆地区轮台县的优良杏品种(新S-SV-PA-017-2009),其因肉质细腻、多汁,含糖量高,风味独特、浓郁而享誉全国[5]。悠久的栽培历史和品牌资源优势,使轮台白杏在脱贫攻坚和乡村振兴战略中发挥着举足轻重的作用,杏产业已成为当地的支柱产业和农民收入的主要来源之一。目前,轮台白杏在鲜杏生产销售中仍存在着较明显的问题,尤其是采收时间不科学、不合理,极大地影响了轮台白杏的贮藏期和特有风味品质。研究表明,采收成熟度是水果贮藏寿命和果实品质的决定因素[6]。不同采收期对桃[7-8]、猕猴桃[9-10]、柑橘[11]、葡萄[12]、核桃[13]等果实的品质及贮藏性的影响均有报道。
成熟是果实发育的一个重要过程,涉及各类初生、次生代谢物的变化,其中各类代谢物是影响水果独特品质和风味的重要成分[14]。果实代谢物因收获时成熟度不同而存在差异,FANG等[15]利用非靶向代谢组学技术对木瓜4个不同成熟期果实中的代谢物进行检测,共检测到896种代谢物,包括糖、有机酸、氨基酸、类黄酮等,从而针对果实不同用途提出了适宜的采收期。XUE等[16]利用代谢组学技术对不同采收期的红枣和酸枣果实中的黄酮类代谢物进行了研究,从不同采收期的枣果实中鉴定出了123种黄酮物质,发现不同采收期枣果实中的类黄酮代谢物有很大的差异,为确定适宜的采收期提供了理论依据。然而,不同成熟度对杏果实代谢物的影响仍未被揭示。
基于超高效液相色谱和串联质谱(ultra performance liquid chromatography tandem mass spectrometr,UPLC-MS/MS)的广泛靶向代谢组学是一种常用的识别和分析代谢物的技术,具有定性准确、灵敏度高、重复性好的特点[17],在营养科学[18]、植物代谢[19]、抗性鉴定[20]等方面被广泛应用。本研究以6个不同采收期的轮台白杏果实为试验材料,研究不同采收期果实品质的差异,同时采用广泛靶向代谢组学技术对不同采收期果实中代谢物进行测定,分析关键代谢物的积累规律及差异情况,有助于为轮台白杏确定适宜的采收期,为杏果实品质的调控奠定理论基础。
1 材料与方法
1.1 试验材料
以新疆维吾尔自治区巴音郭楞蒙古自治州轮台县哈尔巴克乡2015年生的轮台白杏(P.armeniaca cv.)为材料,果园采用常规管理。采收时期根据进入转色期为第一次取样时间,共设6个不同采收期:S1(盛花后60 d)、S2(盛花后65 d)、S3(盛花后70 d)、S4(盛花后75 d)、S5(盛花后80 d)和S6(盛花后85 d),不同采收期果实性状见图1。从每个单株的东、西、南、北4个方向各采集30个果实立即带回资源圃实验室进行取样,每个时期设置3次生物学重复,用手术刀取每个果实相同部位的果肉,在液氮中速冻后分别装进冻存管中,置于-80 ℃超低温冰箱中保存。

图1 不同采收期的轮台白杏果实性状
Fig.1 Fruit characters of ‘Luntaibaixing’ apricot at different harvest periods
甲醇、乙腈、乙醇、标准品(均为色谱纯),德国Merck公司。
1.2 试验仪器
MM400研磨仪,德国Retsch公司;7754070冷冻干燥机,美国Labconco公司;5430R台式高速冷冻离心机,德国Eppendorf公司;SHIMADZU Nexera X2超高效液相色谱,日本岛津公司;4500 Q TRAP串联质谱仪,美国赛默飞世尔公司;N1糖度计,日本爱拓公司;GY-4硬度计,青岛拓科仪器有限公司;JZ-350便携式色差仪,深圳市三恩时科技有限公司。
1.3 试验方法
1.3.1 果实品质的测定
对不同采收期的轮台白杏随机选取30个果实。采用电子秤测定不同采收期果实的单果重。使用数显游标卡尺测定不同采收期果实的纵径、横径及侧径测定。使用糖度计测定果实的可溶性固形物;维生素C含量使用2, 6-二氯靛酚滴定法测定,可滴定总酸和可溶性总糖分别用NaOH滴定法、菲林滴定法测定[7]。使用硬度计测定不同采收期的果实硬度。使用便携式色差仪测定果皮和果肉的色泽指标,色泽指数(color contribution index,CCI)计算见公式(1)。
(1)
式中:a*,代表物体的红绿色;L*,物体的亮度因子;b*,物体的黄蓝色。
1.3.2 果实代谢物的测定
1.3.2.1 样品制备与提取
步骤如下:①研磨:对超低温冷冻保存的18组供试杏果实样品进行真空冷冻干燥处理,随后用研磨仪研磨(30 Hz、1.5 min)至粉末状。②提取:称取100 mg的样品粉末置于离心管,加入1.2 mL体积分数为70%的甲醇提取液进行溶解,每隔30 min进行涡旋,共涡旋(6次×30 s),随后将样本置于4 ℃冰箱中保存过夜;③离心、过滤:在转速为12 000 r/min的条件下离心10 min后,吸取上清液,用微孔滤膜(0.22 μm)过滤样品,并保存在进样瓶中,用于UPLC-MS/MS分析。
1.3.2.2 色谱质谱采集条件
数据采集仪器系统主要包括超高效液相色谱(UPLC,SHIMADZU Nexera X2)和串联质谱(MS/MS,4500 QTRAP)。液相条件为色谱柱:Agilent SB-C18(1.8 μm,2.1 mm×100 mm);流动相:A相为超纯水(加入0.1%的甲酸),B相为乙腈(加入0.1%的甲酸溶液);洗脱梯度:0.0 min B相比例为5%,9.0 min内B相增加到95%,并在B相比例线性为95%时维持1 min,10.00~11.10 min,B相比例降为5%,并以5%平衡至14 min;流速为0.35 mL/min;柱温为40 ℃;进样量为4 μL。质谱条件为样品质谱扫描采用配备ESI Turbo离子喷雾接口的三重四极杆线性离子阱质谱仪(Q TRAP),AB4500 Q TRAP UPLC/MS/MS系统进行,由Analyst 1.6.3软件(AB Sciex)控制运行正负两种离子模式[21]。
1.3.2.3 代谢物定性与定量
基于迈维(武汉)生物技术有限公司自建MVDB V2.0数据库及代谢物信息公共数据库,根据二级谱信息进行物质定性。利用三重四级杆质谱的多反应监测模式(multiple reaction monitoring,MRM)进行代谢物的相对定量。
1.4 数据分析
本研究使用SPSS 16.0进行方差分析;利用软件Analyst 1.6.3处理质谱数据。采用多元统计分析,对18组样本进行主成分分析、聚类分析。利用多维统计变量重要性投影(variable importance in project,VIP)值、单维统计P-value值及差异倍数(fold change)筛选不同样品中的差异代谢物。通过R软件Complex Heatmap包绘制聚类层次热图,对关键代谢物在不同样本间的积累模式进行层次聚类分析。
2 结果与分析
2.1 轮台白杏不同采收期果实品质分析
不同采收期对轮台白杏果实单果重有一定的影响。由表1可知,不同采收期轮台白杏单果重范围为14.57~16.11 g,轮台白杏单果重随着果实成熟逐渐升高,之后趋于平缓,采收期S1时果实单果重最小,为14.58 g,显著低于其余5个采收期(P<0.05),从采收期S2开始,单果重虽有所增加,但这5个采收期之间的果实单果重无明显差异(P>0.05)。
表1 不同采收期对轮台白杏果实品质的影响
Table 1 The effect of different harvesting dates on the fruit quality of ‘Luntaibaixing’ apricot
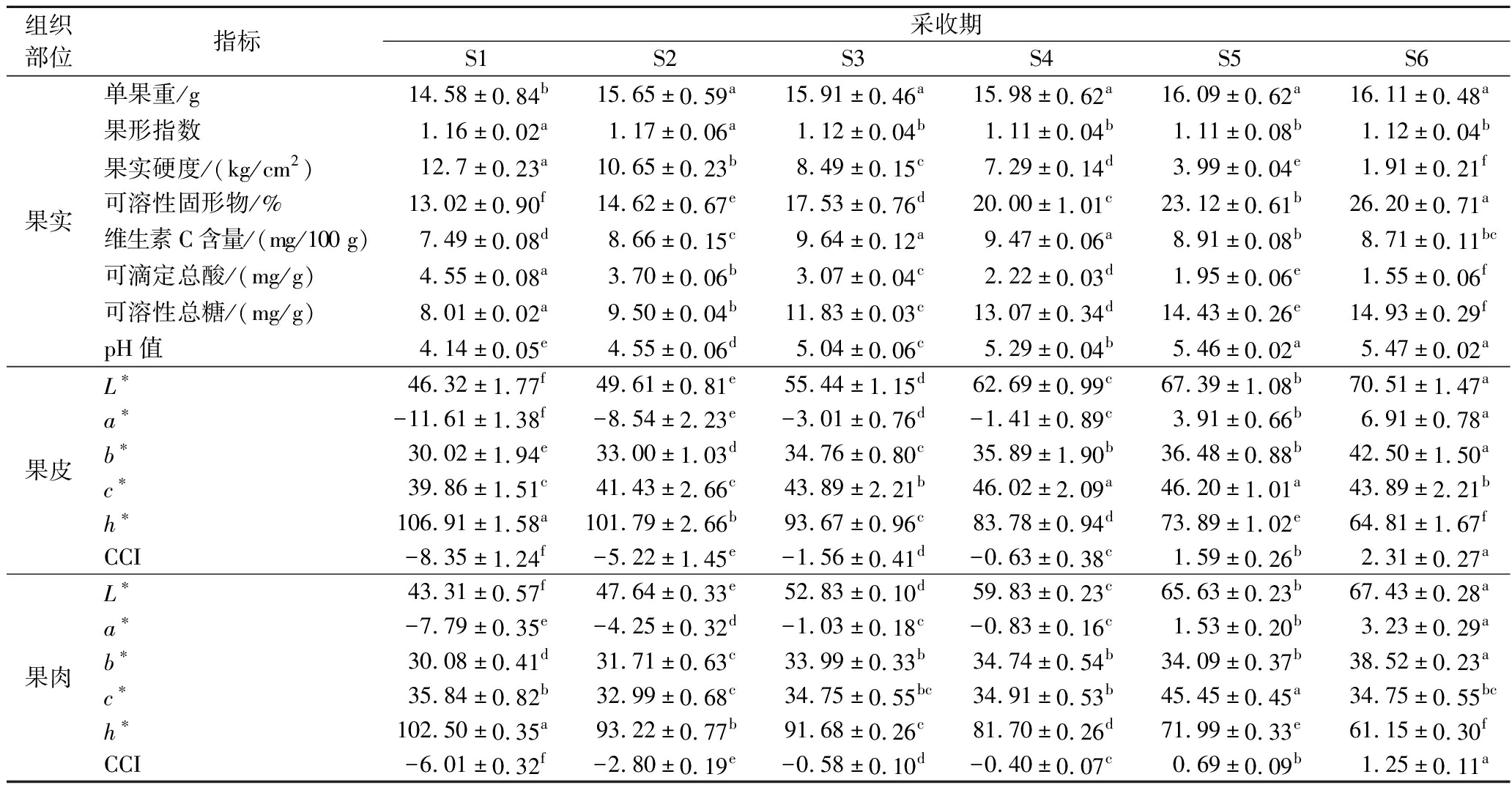
组织部位指标采收期S1S2S3S4S5S6果实单果重/g14.58±0.84b15.65±0.59a15.91±0.46a15.98±0.62a16.09±0.62a16.11±0.48a果形指数1.16±0.02a1.17±0.06a1.12±0.04b1.11±0.04b1.11±0.08b1.12±0.04b果实硬度/(kg/cm2)12.7±0.23a10.65±0.23b8.49±0.15c7.29±0.14d3.99±0.04e1.91±0.21f可溶性固形物/%13.02±0.90f14.62±0.67e17.53±0.76d20.00±1.01c23.12±0.61b26.20±0.71a维生素C含量/(mg/100 g)7.49±0.08d8.66±0.15c9.64±0.12a9.47±0.06a8.91±0.08b8.71±0.11bc可滴定总酸/(mg/g)4.55±0.08a3.70±0.06b3.07±0.04c2.22±0.03d1.95±0.06e1.55±0.06f可溶性总糖/(mg/g)8.01±0.02a9.50±0.04b11.83±0.03c13.07±0.34d14.43±0.26e14.93±0.29fpH值4.14±0.05e4.55±0.06d5.04±0.06c5.29±0.04b5.46±0.02a5.47±0.02a果皮L∗46.32±1.77f49.61±0.81e55.44±1.15d62.69±0.99c67.39±1.08b70.51±1.47aa∗-11.61±1.38f-8.54±2.23e-3.01±0.76d-1.41±0.89c3.91±0.66b6.91±0.78ab∗30.02±1.94e33.00±1.03d34.76±0.80c35.89±1.90b36.48±0.88b42.50±1.50ac∗39.86±1.51c41.43±2.66c43.89±2.21b46.02±2.09a46.20±1.01a43.89±2.21bh∗106.91±1.58a101.79±2.66b93.67±0.96c83.78±0.94d73.89±1.02e64.81±1.67fCCI-8.35±1.24f-5.22±1.45e-1.56±0.41d-0.63±0.38c1.59±0.26b2.31±0.27a果肉L∗43.31±0.57f47.64±0.33e52.83±0.10d59.83±0.23c65.63±0.23b67.43±0.28aa∗-7.79±0.35e-4.25±0.32d-1.03±0.18c-0.83±0.16c1.53±0.20b3.23±0.29ab∗30.08±0.41d31.71±0.63c33.99±0.33b34.74±0.54b34.09±0.37b38.52±0.23ac∗35.84±0.82b32.99±0.68c34.75±0.55bc34.91±0.53b45.45±0.45a34.75±0.55bch∗102.50±0.35a93.22±0.77b91.68±0.26c81.70±0.26d71.99±0.33e61.15±0.30fCCI-6.01±0.32f-2.80±0.19e-0.58±0.10d-0.40±0.07c0.69±0.09b1.25±0.11a
注:表中同行的不同小写字母,表示在0.05水平上差异显著。
随着采收时间的推迟,轮台白杏果实的硬度逐渐降低。在轮台白杏的生长发育过程6个时期中,果实硬度的差异存在显著差异。在采收期S1时,轮台白杏的果实硬度最大,为12.7 kg/cm2,均显著大于其他几个采收期(P<0.05);在采收期S6时,轮台白杏的果实硬度最低,为1.91 kg/cm2,显著低于其他采收期。硬度与果实的贮藏性的关系非常密切,果实的硬度越低,耐储性越差。
轮台白杏6个采收期果实中的可溶性固形物含量变化范围为13.02%~26.20%,在S6采收期时果实的可溶性固形物达到最高,为26.20%,显著高于其他5个采收期(P<0.05)。果实的维生素C含量随着果实的成熟呈现出先上升-再下降的变化趋势,S3和S4时期时的含量最高;可溶性总糖含量随着果实的成熟,呈现出上升的变化趋势,在S6时期时达到最大。不同采收期对轮台白杏果实果皮和果肉的色差指标有一定的影响。随着果实的成熟,果皮和果肉的L*、a*、b*、c*、CCI呈现上升的变化趋势,而h*值随着果实的成熟逐渐减小。
2.2 轮台白杏不同采收期代谢物质总体分析
对6个不同采收期的样品进行广泛靶向代谢组分析,共鉴定出867种代谢物,根据代谢物的结构分为12大类(表2)。
表2 轮台白杏果实代谢物种类及数量统计
Table 2 Metabolite types and quantity statistics of ‘Luntaibaixing’ apricot fruit
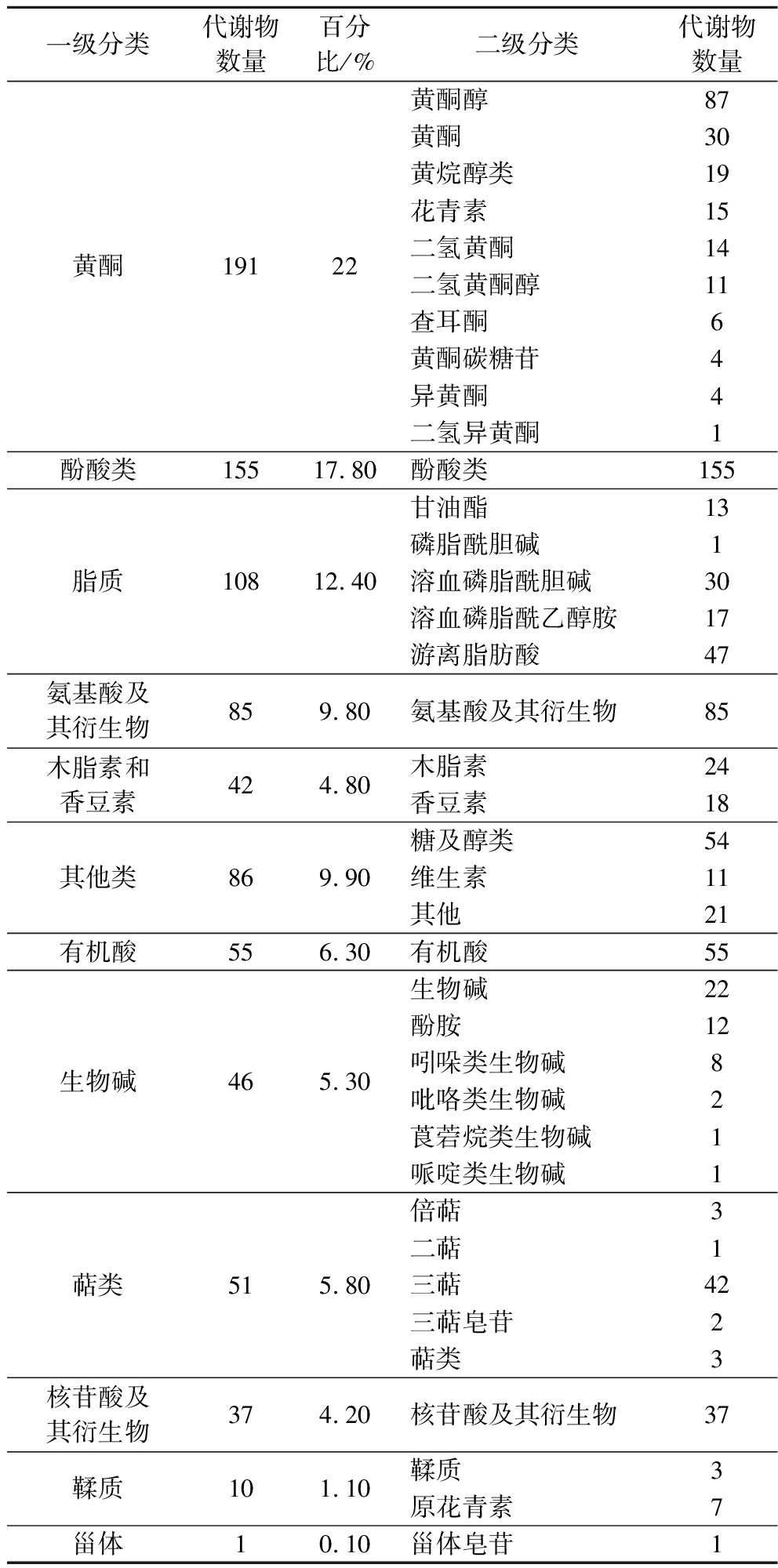
一级分类代谢物数量百分比/%二级分类代谢物数量黄酮19122黄酮醇87黄酮30黄烷醇类19花青素15二氢黄酮14二氢黄酮醇11查耳酮6黄酮碳糖苷4异黄酮4二氢异黄酮1酚酸类15517.80酚酸类155脂质10812.40甘油酯13磷脂酰胆碱1溶血磷脂酰胆碱30溶血磷脂酰乙醇胺17游离脂肪酸47氨基酸及其衍生物859.80氨基酸及其衍生物85木脂素和香豆素424.80木脂素24香豆素18其他类869.90糖及醇类54维生素11其他21有机酸556.30有机酸55生物碱465.30生物碱22酚胺12吲哚类生物碱8吡咯类生物碱2莨菪烷类生物碱1哌啶类生物碱1萜类515.80倍萜3二萜1三萜42三萜皂苷2萜类3核苷酸及其衍生物374.20核苷酸及其衍生物37鞣质101.10鞣质3原花青素7甾体10.10甾体皂苷1
黄酮类物质共有191种(22%),主要包括87种黄酮醇、30种黄酮、19种黄烷醇类及15种花青素等10类黄酮物质;脂质类物质108种(12.40%),主要包括47种游离脂肪酸、30种溶血磷脂酰胆碱、17种溶血磷脂酰乙醇胺、13种甘油酯及1种磷脂酰胆碱;木脂素和香豆素类有42种(4.80%),包括24种木脂素和18种香豆素;生物碱类46种(5.30%),主要包括22种生物碱、12种酚胺、8种吲哚类生物碱以及其他3类物质;萜类物质51种(5.80%),主要包括42种三萜和其他9种萜类物质;鞣质类10种(1.10%),主要包括7种原花青素和3种鞣质;其他类86种(9.9%),主要包括54种糖及醇类、11种维生素和21种其他类物质;酚酸类物质共有155种(17.80%)、氨基酸及其衍生物有85种(9.80%)、有机酸类55种(6.30%)、核苷酸及其衍生物有37种(4.20%)、甾体有1种(0.10%)。
2.3 主成分分析(principal component analysis,PCA)
通过对试验中的所有样本进行PCA,能够了解各组样品间总体代谢和组内样品之间的变异大小。本研究中,将6组样品的代谢物进行PCA,从图2-a中可发现,轮台白杏6个不同采收期之间的代谢物呈分离趋势,组间呈聚集趋势,第一主成分(PC1)的贡献率为49.71%,第二主成分(PC2)的贡献率为10.54%。由图2-b(PCA 3D)可以看出,主要成分PC1、PC2、PC3对差异的贡献率分别是49.71%、10.54%、7.87%,这表明不同采收期对轮台白杏果实的各类代谢物存在明显差异。
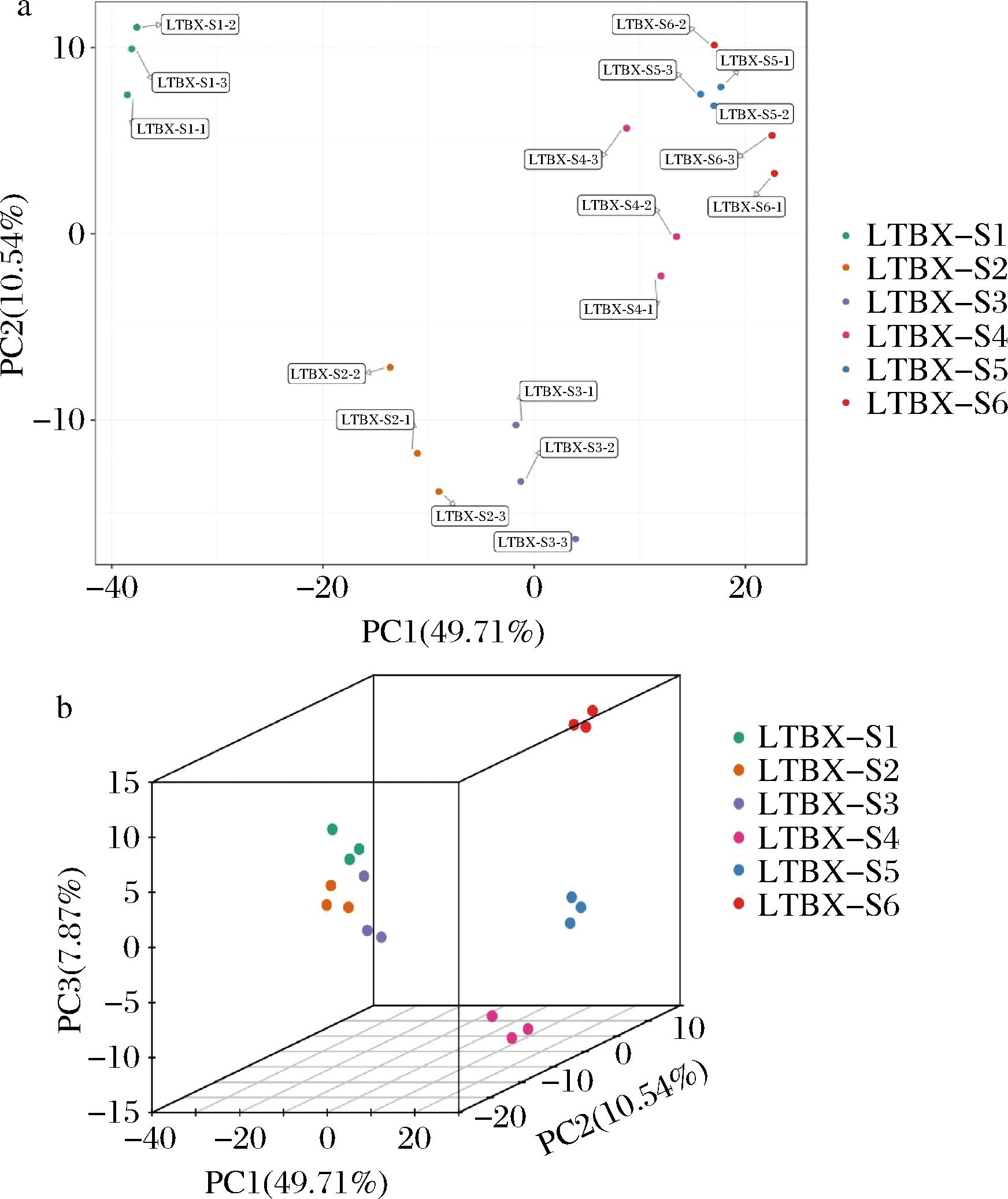
a-二维PCA;b-三维PCA
图2 轮台白杏不同采收期果实代谢物PCA结果
Fig.2 PCA result of fruit metabolites of ‘Luntaibaixing’ apricot in different harvest periods
2.4 代谢物热图分析
为了方便观察不同采收期轮台白杏果实代谢物的变化规律,对差异显著的代谢物进行归一化处理,并绘制热图。图中颜色表示含量,红色表示含量高表达,绿色表示含量低表达。由图3可以看出,不同种类的代谢物在轮台白杏6个采收期表现出不同的变化趋势。
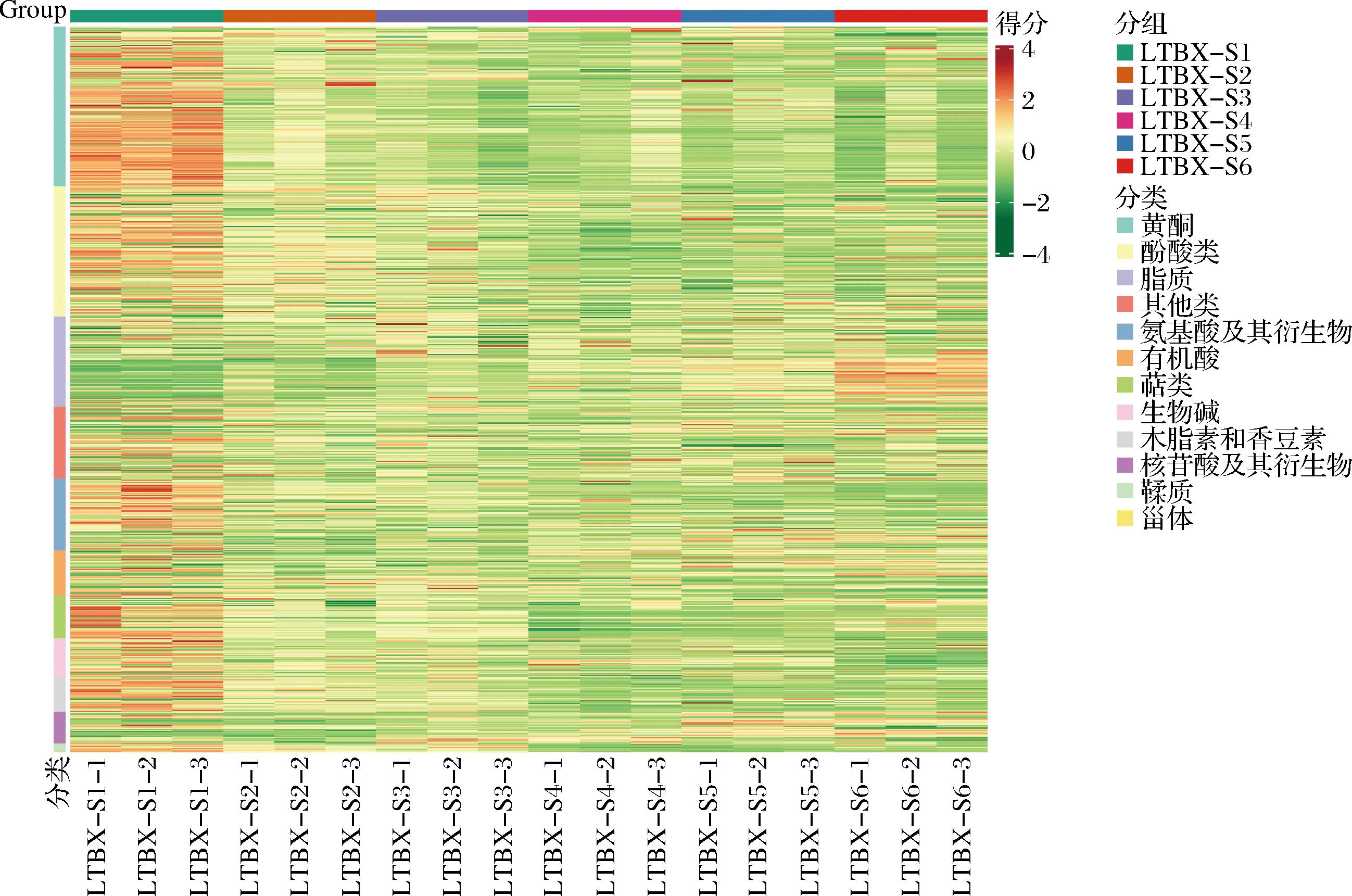
图3 轮台白杏不同采收期果实的代谢物热图
Fig.3 Metabolite heatmap of ‘Luntaibaixing’ apricot fruits at different harvest periods
2.5 关键风味物质变化分析
2.5.1 糖类和醇类
杏果实中的糖类和醇类直接影响果实的内在品质和风味,在轮台白杏6个采收期共鉴定到糖类和醇类物质54种,其中糖类42种,醇类物质12种。通过Fold Change、正交偏最小二乘法判别分析(orthogonal partialleast squares-discriminant analysis,OPLS-DA)模型的VIP值相结合的方法进行轮台白杏不同采收期差异代谢物的筛选,对D-果糖、D-葡萄糖、D-(-)-苏阿糖、植物糖、D-甘露醇和D-山梨糖醇在不同采收期的含量进行了分析(图4),随着果实的成熟,D-果糖的含量总体呈现出上升的变化趋势,在采收期S5时达到最大,均明显高于S1、S2和S3时期(P<0.05),S6时期略微下降,但差异不显著(P>0.05)。不同采收期轮台白杏果实中D-葡萄糖的含量呈现出先上升后下降的变化趋势,在采收期S5时达到最大,S6时明显下降。随着果实的成熟,D-(-)-苏阿糖的含量呈现下降的变化趋势。植物糖的含量在不同采收期呈现先上升再下降的变化趋势,S5时含量达到最大值。随着果实的成熟,果实中D-甘露醇的含量逐渐增加,在采收期S6时达到最大值,且与其余5个时期差异显著(P<0.05);果实中D-山梨糖醇的含量也呈现出逐渐增加的变化趋势,在采收期S5时达到最大,采收期S6时稍有降低,但与S5相比差异不显著(P>0.05)。
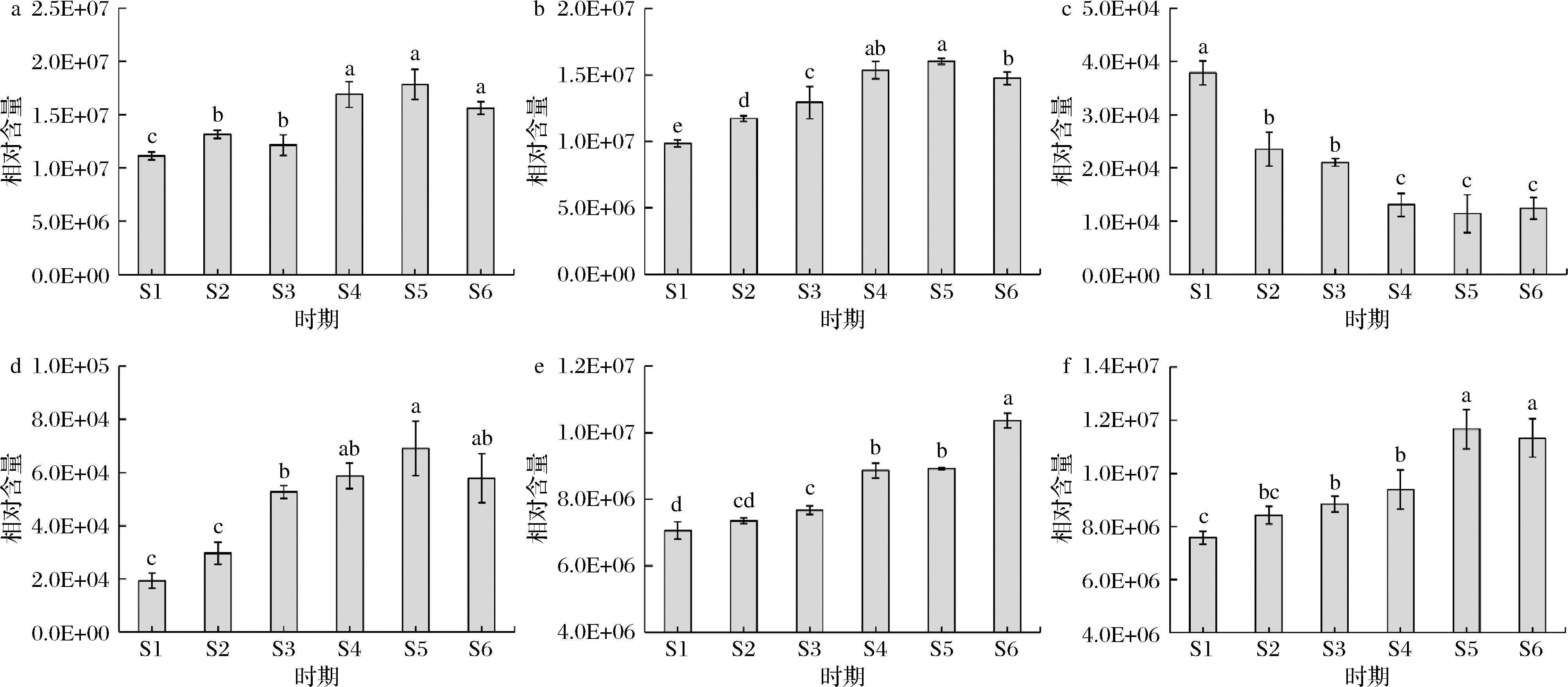
a-D-果糖;b-D-葡萄糖;c-D-(-)-苏阿糖;d-植物糖;e-D-甘露醇;f-D-山梨糖醇
图4 不同采收期轮台白杏果实中主要糖和醇类物质动态变化
Fig.4 Dynamic changes of main sugars and alcohols in fruits of ‘Luntaibaixing’ apricot at different harvest times
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.5.2 有机酸
杏果实中的有机酸组分及含量也直接影响果实的内在品质和风味,在轮台白杏6个采收期共鉴定到有机酸55种。对果实不同采收期果实的6-氨基己酸、α-酮戊二酸、L-酒石酸、茉莉酸、奎宁酸和柠檬酸含量进行了分析(图5),随着果实的成熟,6种有机酸的含量均呈现出下降的变化趋势,在采收期S1时最大,分别在S5或S6时含量最低。
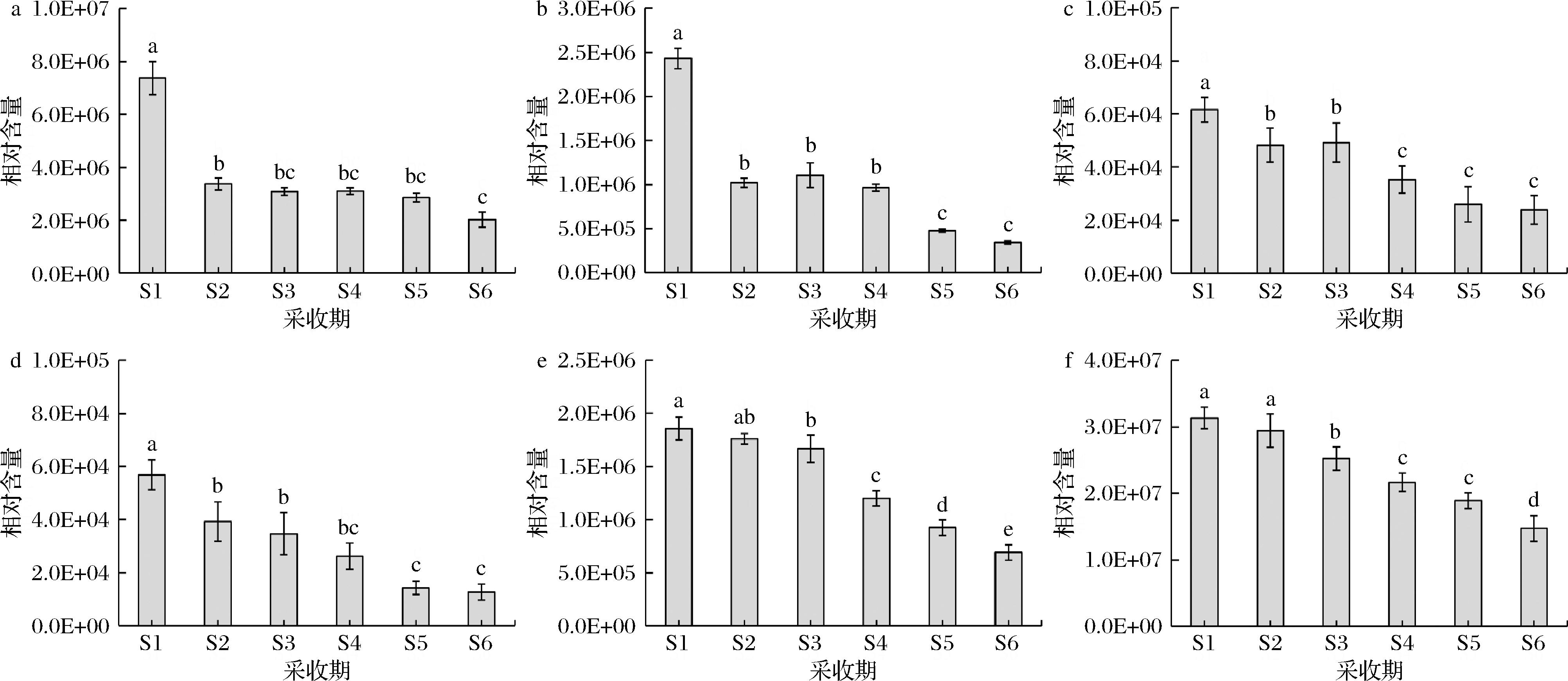
a-6-氨基己酸;b-α-酮戊二酸;c-L-酒石酸;d-茉莉酸;e-奎宁酸;f-柠檬酸
图5 不同采收期轮台白杏果实中主要有机酸动态变化
Fig.5 Dynamic changes of main organic acids in fruits of ‘Luntaibaixing’ apricot at different harvest periods
2.5.3 氨基酸及衍生物
氨基酸及衍生物是近年来人们对于果实代谢物研究和关注的热点,是影响果实风味品质的关键指标之一。在轮台白杏6个采收期共鉴定到氨基酸及衍生物85种。对L-丝氨酸、L-酪氨酸、L-脯氨酸、L-谷氨酰胺、L-天冬酰胺和L-苏氨酸这6种氨基酸在轮台白杏不同采收期的含量进行了分析(图6),随着果实的成熟,L-丝氨酸、L-天冬酰胺和L-苏氨酸均呈现出下降的变化趋势,采收期S1时含量最高,且与其他5个采收期的含量差异显著(P<0.05)。L-酪氨酸和L-谷氨酰胺在不同采收期表现出先下降后上升再下降的变化趋势,在采收期S4时含量均达到最大值。随着果实的逐渐成熟,L-脯氨酸在不同采收期呈现出上升的变化趋势,采收期S1时含量最低,在采收期S5时达到峰值,且与采收期S1、S2、S3和S4之间呈现显著差异(P<0.05)。
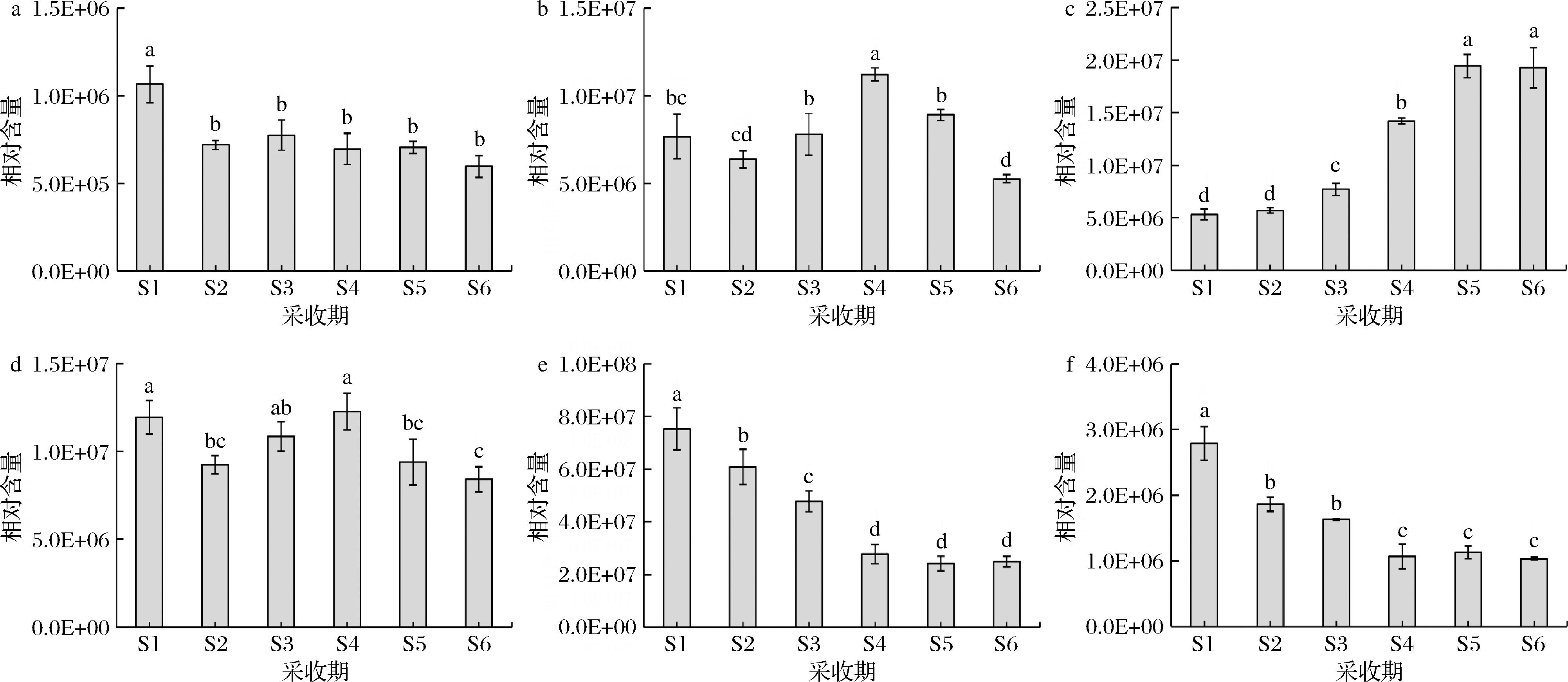
a-L-丝氨酸;b-L-酪氨酸;c-L-脯氨酸;d-L-谷氨酰胺;e-L-天冬酰胺;f-L-苏氨酸
图6 不同采收期轮台白杏果实中主要氨基酸及衍生物动态变化
Fig.6 Dynamic changes of main amino acids and derivatives in fruits of ‘Luntaibaixing’ apricot at different harvest periods
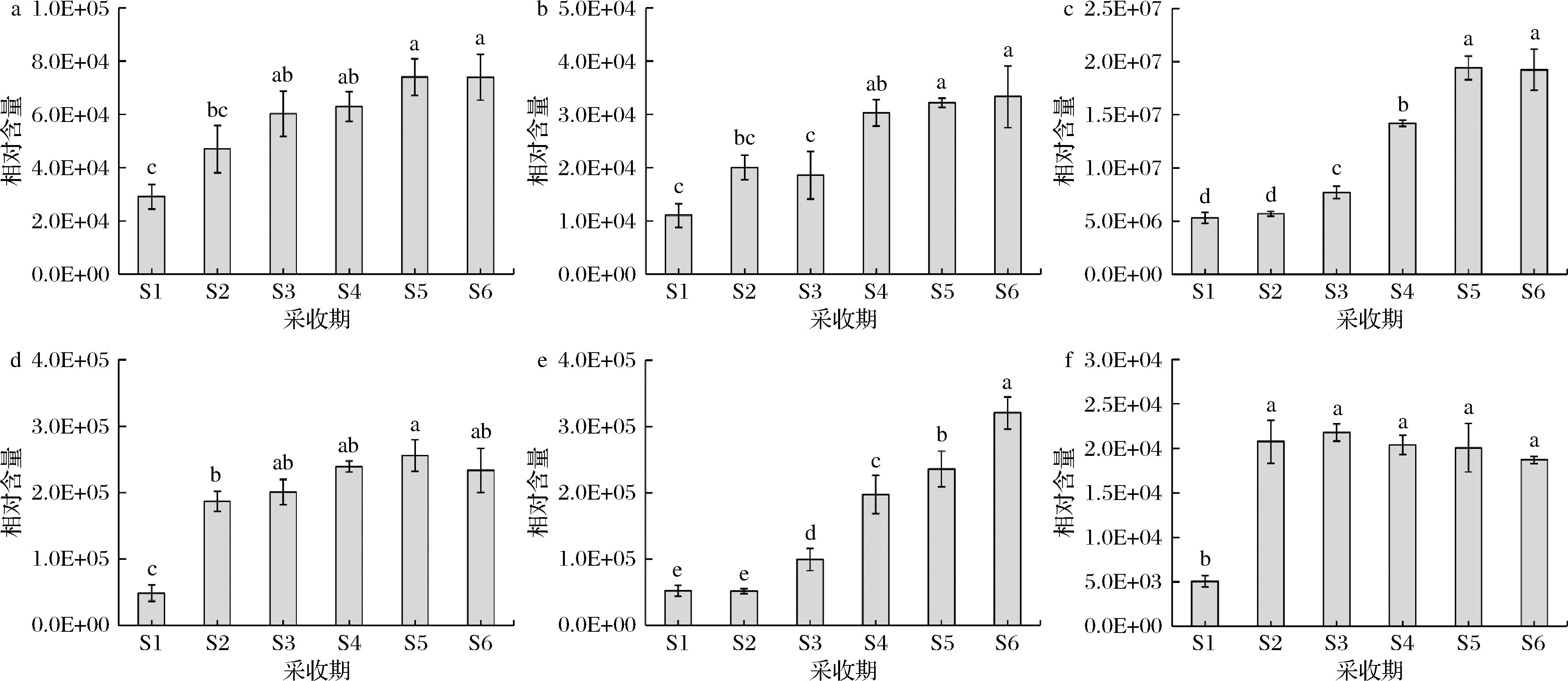
a-圣草素-7-O-β-D-吡喃葡萄糖苷;b-锦葵色素-3-O-半乳糖苷;c-锦葵色素-3-O-葡萄糖苷;d-黄柏环合苷;e-矢车菊素-3-O-芸香糖苷;f-根皮素-4′-O-(6″-咖啡酰)葡萄糖苷
图7 不同采收期轮台白杏果实中主要黄酮物质动态变化
Fig.7 Dynamic changes of main flavonoids in fruits of ‘Luntaibaixing’ apricot at different harvest periods
2.5.4 黄酮类物质
黄酮类物质是杏果实中主要的成分之一,也是影响其果实风味的关键代谢物。在轮台白杏6个采收期共鉴定到黄酮类物质191种,主要包括87种黄酮醇、30种黄酮、19种黄烷醇类及15种花青素等10类黄酮物质。对圣草素-7-O-β-D-吡喃葡萄糖苷、锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-葡萄糖苷、黄柏环合苷、矢车菊素-3-O-芸香糖苷和根皮素-4′-O-(6″-咖啡酰)葡萄糖苷这6种物质在轮台白杏果实不同采收期的含量进行了分析(图7)。随着果实的成熟,圣草素-7-O-β-D-吡喃葡萄糖苷、锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-葡萄糖苷、黄柏环合苷在不同采收期呈现出上升的变化趋势,采收期S1时含量最低,随着果实的逐渐成熟,其含量逐渐增加,在采收期S5和S6时达到最大,且差异显著(P<0.05)。
3 讨论与结论
基于MS/MS数据的广泛靶向代谢学技术已经被广泛应用于植物的代谢分析研究[18-19,22]。以往对于杏果实代谢物的研究主要集中在特定时期、特定种类的代谢物上,如类胡萝卜素、糖、酸等[2,23]。然而,对杏果实成熟过程中的代谢特征的全面了解仍未见报道。为了更好地了解不同采收期轮台白杏果实的风味差异,本研究采用广泛靶向代谢组技术对轮台白杏6个不同采收期果实的代谢物进行了研究,共鉴定出867种代谢物,包括了糖类、有机酸、黄酮类、氨基酸及其衍生物及萜类物质等12大类代谢物,本研究为揭示不同采收期对轮台白杏风味影响的差异机制提供了新的证据。
果实中糖和有机酸是果实风味的重要因子,在果实风味的评价中起着基础性作用,糖决定了水果的甜度,如蔗糖、果糖、葡萄糖、木糖和山梨醇等,而有机酸决定了水果的酸度,如柠檬酸、苹果酸、奎宁酸等[23]。本研究对轮台白杏不同采收期差异显著的6种糖类物质进行了分析,发现D-果糖、D-葡萄糖、植物糖、D-甘露醇和D-山梨糖醇随着果实的逐渐成熟,呈现出上升的变化趋势。本研究对轮台白杏不同采收期差异显著的6种有机酸进行了分析,随着果实的成熟,6种有机酸的含量均呈现出下降的变化趋势。这与郑惠文[23]、陈美霞[24]的研究结果一致,杏果实成熟过程中糖类物质和有机酸积累变化在其风味决定中有重要作用。
氨基酸的组成和丰度是营养质量的关键指标,在决定口味方面也很重要,HEGAZI等[25]对埃及杏果实中的氨基酸进行了研究,发现杏果实中含有丰富的氨基酸,且与杏果实的营养和独特的风味有很大关系。本研究在轮台白杏6个采收期共鉴定到氨基酸及衍生物共85种。对6种差异较大的氨基酸在轮台白杏不同采收期的含量进行了分析,随着果实的成熟,L-丝氨酸、L-天冬酰胺和L-苏氨酸均呈现出下降的变化趋势,L-脯氨酸在不同采收期呈现出上升的变化趋势,采收期S1时含量最低,在采收期S5时达到峰值。因此,我们推测,氨基酸在轮台白杏的不同采收期的差异性会导致果实风味的不同。除了糖类物质、有机酸及氨基酸等代谢物,黄酮类物质也是影响果实风味的关键代谢物[16]。本研究在轮台白杏6个采收期共鉴定到黄酮类物质共有191种,随着果实的成熟,圣草素-7-O-β-D-吡喃葡萄糖苷、锦葵色素-3-O-半乳糖苷、锦葵色素-3-O-葡萄糖苷、黄柏环合苷在不同采收期呈现出上升的变化趋势,在采收期S5、S6时达到峰值,黄酮类物质对轮台白杏不同采收期果实的风味有着重要的影响。
本研究采用广泛靶向代谢组学技术对不同采收期果实中代谢物进行测定,系统地比较了轮台白杏果实不同采收期果实品质及代谢物的差异。结果推断,糖类物质、有机酸、氨基酸及黄酮类代谢物组分和含量的差异可能是造成不同采收期轮台白杏果实口感、风味差异的根本原因,采收期S3和S4为轮台白杏的最佳采收期。
[1] 章秋平, 刘威生.杏种质资源收集、评价与创新利用进展[J].园艺学报, 2018, 45(9):1642-1660.ZHANG Q P, LIU W S.Advances of the apricot resources collection, evaluation and germplasm enhancement[J].Acta Horticulturae Sinica, 2018, 45(9):1642-1660.
[2] ZHOU W Q, NIU Y Y, DING X, et al.Analysis of carotenoid content and diversity in apricots (Prunus armeniaca L.) grown in China[J].Food Chemistry, 2020, 330:127223.
[3] XI W P, FENG J, LIU Y, et al.The R2R3-MYB transcription factor PaMYB10 is involved in anthocyanin biosynthesis in apricots and determines red blushed skin[J].BMC Plant Biology, 2019, 19(1):287.
[4] 廖康. 新疆杏资源研究进展[M].乌鲁木齐:新疆科学技术出版社, 2014:1-2.LIAO K.Research Progress of Apricot Resources in Xinjiang[M].Urumqi:Xinjiang Science and Technology Press, 2014:1-2.
[5] 胡珍珠, 潘存德, 王世伟, 等.‘轮台白杏’叶片铜锌浓度光谱估算模型[J].果树学报, 2014, 31(4):722-729.HU Z Z, PAN C D, WANG S W, et al.Models for estimating foliar Cu and Zn concentration of Armeniaca vulgaris ‘Luntaibaixing’ using spectral reflectance[J].Journal of Fruit Science, 2014, 31(4):722-729.
[6] KADER A A.Fruit maturity, ripening, and quality relationships[J].Acta Horticulturae, 1999(485):203-208.
[7] 酆炳森, 刘凌霄, 孙杰, 等.不同采收成熟度黄金蜜桃果实的品质分析[J].食品与发酵工业, 2023, 49(21):175-182.FENG B S, LIU L X, SUN J, et al.Quality analysis of golden peach fruits with different harvest maturity[J].Food and Fermentation Industries, 2023, 49(21):175-182.
[8] 张群, 舒楠, 张维, 等.不同采收期黄桃的品质特性和微观结构变化[J].保鲜与加工, 2021, 21(4):29-34.ZHANG Q, SHU N, ZHANG W, et al.Changes of quality characteristics and microstructures of yellow peaches in different harvest periods[J].Storage and Process, 2021, 21(4):29-34.
[9] 张承, 王秋萍, 冉飞, 等.猕猴桃适宜采摘期确定及其贮藏性能[J].农业工程学报, 2018, 34(17):266-275.ZHANG C, WANG Q P, RAN F, et al.Determination of suitable harvest period of kiwifruit and its storage performance[J].Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(17):266-275.[10] 陈双双, 贺艳群, 徐小彪, 等.不同采收期对‘奉黄1号’猕猴桃果实品质的影响[J].江西农业大学学报, 2021, 43(6):1259-1268.CHEN S S, HE Y Q, XU X B, et al.Effect of different harvest time on fruit quality of ‘Fenghuang No.1’kiwi fruit[J].Acta Agriculturae Universitatis Jiangxiensis, 2021, 43(6):1259-1268.
[11] 杨蕾, 洪林, 杨海健, 等.不同采收期及贮藏方式对杂柑爱媛28果实品质的影响[J].南方农业学报, 2022, 53(4):1088-1101.YANG L, HONG L, YANG H J, et al.Effects of different harvesting period and storage methods on Aiyuan 28 citrus fruit quality[J].Journal of Southern Agriculture, 2022, 53(4):1088-1101.
[12] 彭媛媛, 高展, 董凯向, 等.不同采收期对新疆焉耆盆地酿酒葡萄及葡萄酒品质的影响[J].新疆农业科学, 2018, 55(7):1252-1263.PENG Y Y, GAO Z, DONG K X, et al.Effects of the suitable harvest time for main wine grapes and wine quality in Xinjiang Yanqi Basin[J].Xinjiang Agricultural Sciences, 2018, 55(7):1252-1263.
[13] 郝金莲, 杨钰琪, 王茹, 等.不同采收期对温185和新新2核桃品质的影响[J].浙江农业学报, 2022, 34(10):2188-2198.HAO J L, YANG Y Q, WANG R, et al.Effects of different harvest time on quality of walnut varieties Wen 185 and Xinxin 2[J].Acta Agriculturae Zhejiangensis, 2022, 34(10):2188-2198.
[14] CRUZ-HERN NDEZ A, PAREDES-L
NDEZ A, PAREDES-L PEZ O.Fruit quality:New insights for biotechnology[J].Critical Reviews in Food Science and Nutrition, 2012, 52(3):272-289.
PEZ O.Fruit quality:New insights for biotechnology[J].Critical Reviews in Food Science and Nutrition, 2012, 52(3):272-289.
[15] FANG Q Y, ZHENG H, FU G S, et al.Integrated untargeted metabolome, full-length sequencing, and transcriptome analyses reveal insights into the fruit quality at different harvest times of Chaenomeles speciosa[J].Food Research International, 2023, 164:112314.
[16] XUE X F, ZHAO A L, WANG Y K, et al.Metabolomics-based analysis of flavonoid metabolites in Chinese jujube and sour jujube fruits from different harvest periods[J].Journal of Food Science, 2022, 87(9):3752-3765.
[17] WANG D D, ZHANG L X, HUANG X R, et al.Identification of nutritional components in black sesame determined by widely targeted metabolomics and traditional Chinese medicines[J].Molecules, 2018, 23(5):1180.
[18] 蒋侬辉, 朱慧莉, 刘伟, 等.基于广泛代谢组学的荔枝果肉营养代谢物综合解析[J].食品科学, 2022, 43(16):269-278.JIANG N H, ZHU H L, LIU W, et al.Widely targeted metabolomics analysis of the nutritional profile of Litchi pulp[J].Food Science, 2022, 43(16):269-278.
[19] 闫乐乐, 卜璐璐, 牛良, 等.广泛靶向代谢组学解析桃蚜危害对桃树次生代谢产物的影响[J].中国农业科学, 2022, 55(6):1149-1158.YAN L L, BU L L, NIU L, et al.Widely targeted metabolomics analysis of the effects of Myzus persicae feeding on Prunus persica secondary metabolites[J].Scientia Agricultura Sinica, 2022, 55(6):1149-1158.
[20] 刘苏宁, 王力荣, 方伟超, 等.基于广泛靶向代谢组学的桃芽抗寒代谢物的筛选与鉴定[J].果树学报, 2023, 40(1):1-12.LIU S N, WANG L R, FANG W C, et al.Screening and identification of several metabolites associated with cold resistance in peach buds based on widely targeted metabolomics[J].Journal of Fruit Science, 2023, 40(1):1-12.
[21] CHEN W, GONG L, GUO Z L, et al.A novel integrated method for large-scale detection, identification, and quantification of widely targeted metabolites:Application in the study of rice metabolomics[J].Molecular Plant, 2013, 6(6):1769-1780.
[22] ZOU S C, WU J C, SHAHID M Q, et al.Identification of key taste components in loquat using widely targeted metabolomics[J].Food Chemistry, 2020, 323:126822.
[23] 郑惠文, 张秋云, 李文慧, 等.新疆杏果实发育过程中可溶性糖和有机酸的变化[J].中国农业科学, 2016, 49(20):3981-3992.ZHENG H W, ZHANG Q Y, LI W H, et al.Changes in soluble sugars and organic acids of Xinjiang apricot during fruit development and ripening[J].Scientia Agricultura Sinica, 2016, 49(20):3981-3992.
[24] 陈美霞, 赵从凯, 陈学森, 等.杏果实发育过程中有机酸积累与相关代谢酶的关系[J].果树学报, 2009, 26(4):471-474.CHEN M X, ZHAO C K, CHEN X S, et al.Relationship between accumulation of organic acid and organic acid-metabolizing enzymes during apricot fruit development[J].Journal of Fruit Science, 2009, 26(4):471-474.
[25] HEGAZI S M, SALEM S A.Amino acid pattern of the Egyptian apricot fruits (Hamawy)[J].Journal of the Science of Food and Agriculture, 1972, 23(4):497-499.