目前对于羊尾脂肪的研究主要集中在手工皂、唇膏等化妆品方面,多数人因其羊膻味不愿接受,因此大部分羊尾脂肪都被丢弃,用于食品的开发利用率较低。在中药中脂肪常与补肾壮阳的淫羊藿一同使用,经羊尾油脂炮制后可增强淫羊藿抗骨质疏松以及温肾壮阳的作用[1-2],羊尾油炮制后的淫羊藿提高淫羊藿中微量元素的溶出,且将淫羊藿中所含有效成分多糖苷黄酮成分转化为更易吸收的低糖苷从而增强药效。羊尾脂肪含有棕榈酸(C16∶0)和硬脂酸(C18∶0)等饱和脂肪酸,以及油酸(C18∶1)等单不饱和脂肪酸。此外还含有C15∶0、C17∶0等反刍动物才有的奇数链饱和脂肪酸[3],以及少量的支链脂肪酸、共轭亚油酸、花生四烯酸及二十二碳六烯酸(docosahexaenoic acid,DHA)[4]。而冷榨亚麻籽油含有丰富的α-亚麻酸(alpha-linolenic acid,ALA),被誉为“高原深海鱼油”[5],而ALA为n-3系多不饱和脂肪酸,n-3系多不饱和脂肪酸在抗炎症及抑制心血管疾病发生中具有重要作用[6],WILLIAMS等[7]的研究结果表明,亚麻籽油的摄取可降低雄性大鼠由氧化偶氮甲烷引发的结肠癌发生率。
近年来,均衡摄入脂肪酸受到广泛关注,WHO提出亚油酸(n-6)和ALA(n-3)的摄入比例应为4∶1,中国营养学会提出n-6和n-3摄入比例为4∶1~6∶1[8],而现在中国居民膳食中n-6/n-3多不饱和脂肪酸比值的平均值达到8.6,在某些地区人群中甚至更高[9],因此,中国人的亚油酸摄入过量,ALA严重不足,比例严重失衡,是目前急需补充的营养素之一。ALA是人体最重要的必需脂肪酸,在人体内可以转化成二十碳五烯酸(eicosapentaenoic acid,EPA)和DHA。
酶法酯交换法制备油脂具有安全性高、专一性强、易于与产物分离、脂肪酶可多次重复利用、提高产物抗氧化性以及改变酯交换产物中的油脂结晶晶型等诸多优点。通过酶法酯交换技术制备ALA含量高的二元油是解决目前人群急需的瓶颈问题。
在全球范围内,大约有15%的夫妻受不孕不育的困扰。世界卫生组织估计,在发展中国家这一比例高达25%。尽管原因多种多样,但20%~30%的问题仍要归因于男性因素。男性低精子数量与慢性疾病、癌症和短寿风险增加有相关关系,人类生存将受到威胁。性激素的分泌主要由下丘脑-垂体-性腺(hypothalamo-pituitary-gonadal,HPG)轴调控,性激素主要由动物的肾上腺皮质网状袋、性腺等组织所合成的甾体激素,其本质为脂质,具有维持性功能、促进性腺发育等作用。雄性动物主要分泌睾酮,睾酮基本上都由睾丸间质细胞产生,主要通过下丘脑-垂体-黄体生成激素驱动来调节[10]。油脂对类固醇激素分泌起着重要的作用,比例平衡的油脂的健康效应研究具有极为重要的社会意义。因此,本研究利用草原蒙古羊尾油脂和亚麻籽油作为原料通过酶法酯交换法制备的富含sn-2位ALA的二元油,探索分析其通过改善自发性高血压大鼠(spontaneously hypertensive rat,SHR)的血脂和肝机能,促进类固醇激素代谢,提高睾酮分泌能力的机理作用,为二元油的生理功效评价提供基础数据。
1 材料与方法
1.1 材料与试剂
苏尼特羊尾油脂,内蒙古苏尼特左旗苏尼特羯羊尾脂肪炼制;菜籽油,加拿大市售;亚麻籽油(亚麻公社),内蒙古格琳诺尔生物股份有限公司;二元油脂,苏尼特羊尾油脂与亚麻籽油通过酶法酯交换制得;脂肪酶Lipozyme RM IM,丹麦诺维信公司;含油脂特殊饲料,小黍有泰(北京)生物科技有限公司;SHR,许可证号:SYXK(蒙)2020-0002,北京维通利华有限公司。
总睾酮、促黄体生成素(luteotropic hormone,LH)、雌二醇(estradiol,E2)、促卵泡激素、促性腺激素释放激素试剂盒,武汉新启迪生物科技有限公司;氯仿、异丙醇、无水乙醇、无水乙酸钠、丙三醇、NaCl、甲醇、三氯甲烷,国药集团化学试剂有限公司;总胆固醇(total cholesterol,T-CHO)、甘油三酯(triglyceride,TG),高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、谷草转氨酶(glutamic oxaloacetic transaminase,GOT)、谷丙转氨酶(glutamic pyruvic transaminase,GPT)、γ-谷氨酰基转移酶(γ-glutamyl transpeptadase,γ-GT)检测试剂盒,南京建成生物工程研究所;总RNA提取试剂盒,天根生化科技(北京)有限公司;第一链反转录(1 st Strand cDNA Synthesis Kit),TB Green Premix Ex Taq II(2X)(Tli RNaseH Plus)试剂盒,宝日医生物技术(北京)有限公司;胆固醇侧链裂解酶(CYP11A1)、细胞色素P450 17A(CYP17A1)、类固醇激素合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)、内参蛋白(GAPDH)一抗抗体,江苏亲科生物研究中心有限公司;全自动WB配套试剂盒及羊抗兔二抗,北京拓普百奥科技有限公司;普通RIPA裂解液,北京索莱宝科技有限公司。
1.2 仪器与设备
LightCycler 480荧光定量PCR仪,瑞士ROCHE公司;T20型PCR仪,杭州郎基科学仪器有限公司;SHZ-D循环水式多用真空泵,狮鼎公司;R-100旋转蒸发仪,北京Buchi公司;FlexStation3多功能酶标仪,美国Molecular Devices公司;WS-3305全自动定量Western系统,美国ProteinSimple公司。
1.3 实验方法
1.3.1 二元油脂制备
利用微波光控专利技术(专利公开号CN109207246A,发明名称:微波制取高品质动物油脂的方法)制备羊尾油脂,使用酶法酯交换在前期探索所得的最佳制备条件下[反应时间3.3 h,酶添加量为两种油脂总质量的6.8%,反应温度57 ℃,底物:m(苏尼特羊尾油脂)∶m(亚麻籽油)=5.6∶4.4],使用旋转蒸发仪在抽真空条件下制得富含sn-2位ALA的二元油。
1.3.2 SHR大鼠分组和饲喂条件
购买7周龄SHR雄性大鼠,共30只,于温度(23±3) ℃、相对湿度为40%~50%、在12 h/12 h的光照和暗循环动物房中饲养。结束应激反应1周后,根据体重平均分为空白、试验、3个对照等5组,每组6只。空白组大鼠饲喂标准饲料,试验组和3个对照组大鼠分别饲喂添加10%的二元油脂、羊尾油脂、亚麻籽油和菜籽油的特殊饲料,自由饮用质量分数1%的盐水。每周测定大鼠的摄食量、体重,每日观察大鼠是否有毛色变化、眼球突出、过敏反应、易怒、运动障碍、反应迟缓、瘫痪或猝死等体征情况。
大鼠饲喂3个月后利用戊巴比妥钠麻醉解剖。下大静脉采血,血液于3 000 r/min离心10 min分离血清与血浆摘取肝脏和睾丸等各脏器,称重后置于-80 ℃冰箱保存直至测试分析。大鼠尸体进行无害化处理。
试验动物饲养遵守国际标准动物福利和道德伦理,遵循程序符合内蒙古农业大学实验动物福利与伦理委员会所制定的伦理学标准,动物伦理审批件编号:NND2022071。
1.3.3 SHR大鼠血脂、肝激酶和性激素指标的测定
利用酶标仪及相关ELISA试剂盒检测SHR大鼠血脂、肝激酶和性激素指标,根据试剂盒说明书将读数处理为上述指标浓度。
1.3.4 荧光实时定量PCR方法测定基因表达
引物设计:StAR、CYP11A1和CYP17A1基因参考文献[11-13]的引物序列,GAPDH参照YOO等[14]的内参引物序列,引物由生工生物工程(上海)股份有限公司合成,使用无菌无酶水溶解,-20 ℃保存备用。引物序列如表1所示。
表1 PCR扩增引物
Table 1 PCR amplification primers
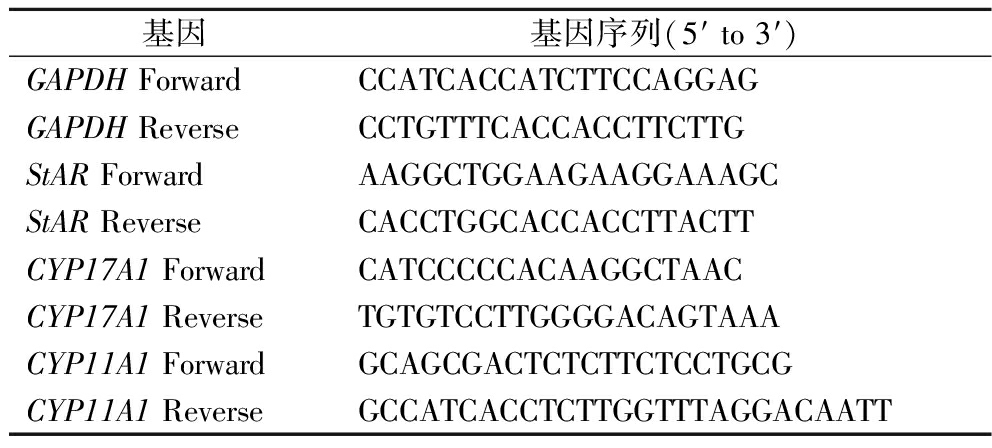
基因基因序列(5′ to 3′)GAPDH ForwardCCATCACCATCTTCCAGGAGGAPDH ReverseCCTGTTTCACCACCTTCTTGStAR ForwardAAGGCTGGAAGAAGGAAAGCStAR ReverseCACCTGGCACCACCTTACTTCYP17A1 ForwardCATCCCCCACAAGGCTAACCYP17A1 ReverseTGTGTCCTTGGGGACAGTAAACYP11A1 ForwardGCAGCGACTCTCTTCTCCTGCGCYP11A1 ReverseGCCATCACCTCTTGGTTTAGGACAATT
使用试剂盒提取大鼠睾丸组织中的总RNA并转为cDNA后使用RT-PCR仪器检测对应基因的表达量,并使用2-△△Ct法计算目的基因相对表达量,计算StAR、CYP11A1和CYP17A1基因在样品中的相对表达量。
1.3.5 全自动Western测定蛋白表达
样品准备:使用普通RIPA裂解液裂解,吸取上清液使用BCA试剂盒检测蛋白质量浓度,上机终浓度需调整至3 μg/μL。
抗体准备:检查使用的一抗是否在ProteinSimple抗体数据库,如不在数据库,需比推荐浓度提高10~20倍浓度,全自动Western试剂盒提供配套羊抗兔二抗。
按试剂盒说明书进行操作,使用板式离心机在室温2 500 r/min(~1 000×g)离心5 min后上机,使用系统软件Compass for SW对数据及图片结果进行分析和导出。
1.3.6 数据处理方法
使用Excel 2021软件来整理和计算数据,Powerpoint 2023,Compass for SW绘制相关图表。采用SPSS 25.0软件进行ANOVA方差分析及Tukey进行事后检验,P<0.05为显著性差异,检验数据结果以平均值±标准差的形式表示。
2 结果与分析
2.1 SHR大鼠血脂结果与分析
由图1可知,摄取二元油组SHR大鼠血中HDL-C高于空白、羊尾油脂和菜籽油组,无显著性差异(P>0.05),低于亚麻籽油组,亦无显著差异(P>0.05),而亚麻籽油组SHR大鼠血中HDL-C则显著高于菜籽油组(P<0.05)。各组SHR大鼠的LDL-C、T-CHO、TG含量均未有显著性差异,但是二元油组SHR大鼠血中的LDL-C和TG含量要比菜籽油、亚麻籽油组与羊尾脂组低。以上结果显示,二元油和羊尾油脂可有效控制心脑血管疾病的发生,改善各项血脂指标。含丰富ALA的亚麻籽油即提升SHR大鼠血中HDL-C水平,也提高血中LDL-C和T-CHO含量。
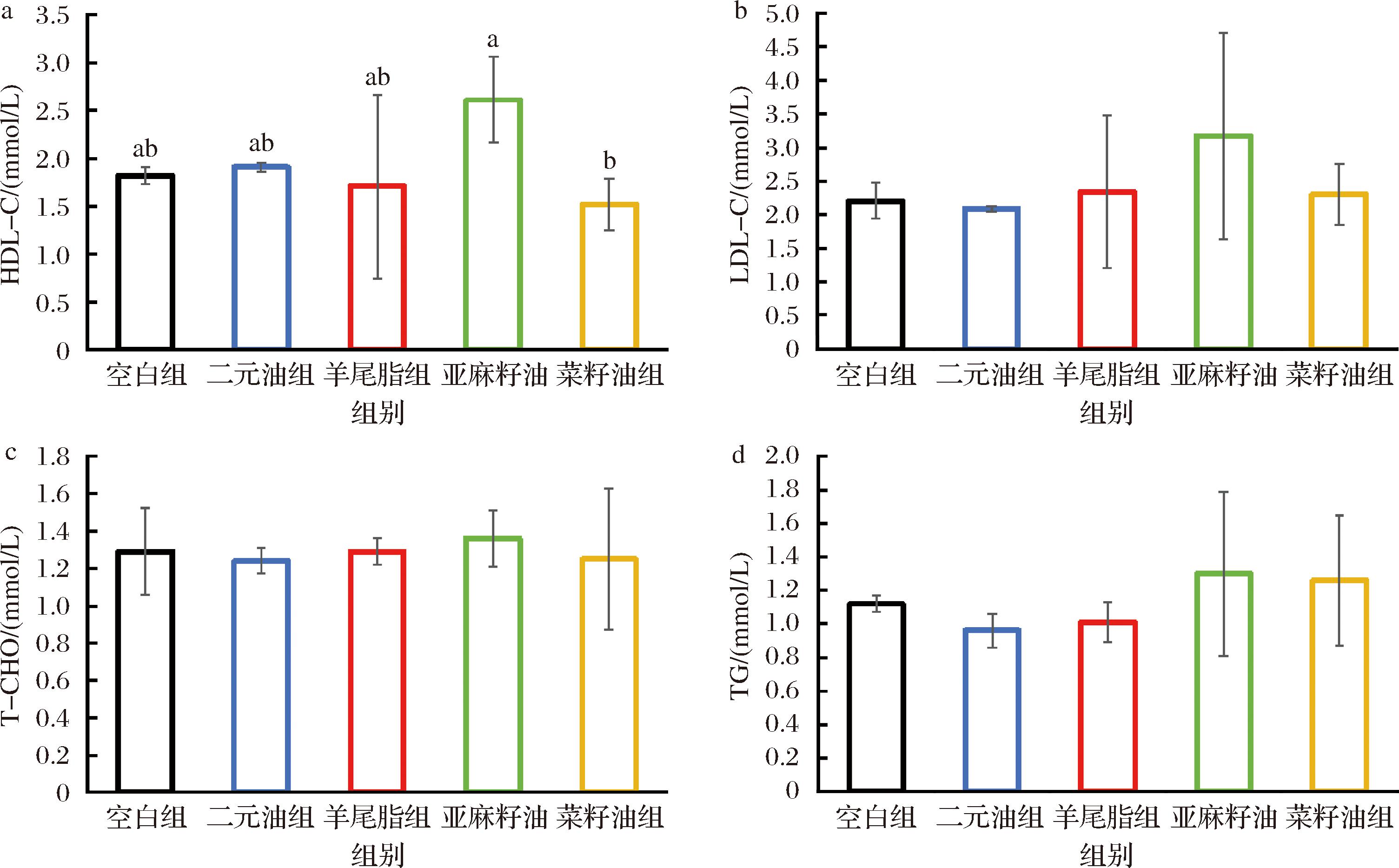
a-HDL-C;b-LDL-C;c-T-CHO;d-TG
图1 各组SHR血脂水平比较(n=6)
Fig.1 Comparison of blood lipid levels in various groups of SHR (n=6)
注:不同字母表明组间有显著性差异(P<0.05),未标注表示差异不显著(P>0.05)(下同)。
2.2 SHR大鼠肝机能测定结果与分析
γ-GT、GOT和GPT三项肝脏机能指标可以反映肝脏受损的程度。如图2-a所示,摄取羊尾油脂SHR大鼠显示比空白组还低的γ-GT值,分别为(2.23±1.75)和(3.28±1.92) U/L,显著低于菜籽油组(P<0.05)。亚麻籽油组γ-GT为(7.22±3.22) U/L,用羊尾油脂和亚麻籽油进行酶法酯交换制得的二元油γ-GT值达(8.15±2.87) U/L,但低于菜籽油组(10.53±3.58) U/L。如图2-c所示,二元油组、羊尾油脂组和亚麻籽油组GOT显著低于菜籽油组(P<0.05),但与空白组无显著性差异(P>0.05)。如图2-b所示,摄取菜籽油组SHR大鼠GPT水平显著高于除空白组以外的二元油、羊尾油脂和亚麻籽油3组(P<0.05),其中亚麻籽油组GPT水平最低,差异显著(P<0.05)。以上数据显示,菜籽油组SHR大鼠3项肝激酶指标均升高,表明其肝脏细胞受损,而二元油以及作为其原料油脂的羊尾油脂与亚麻籽油则表现出对于肝脏组织的保护作用,能够改善因高血压引起的心血管病变和肝脏机能损伤。
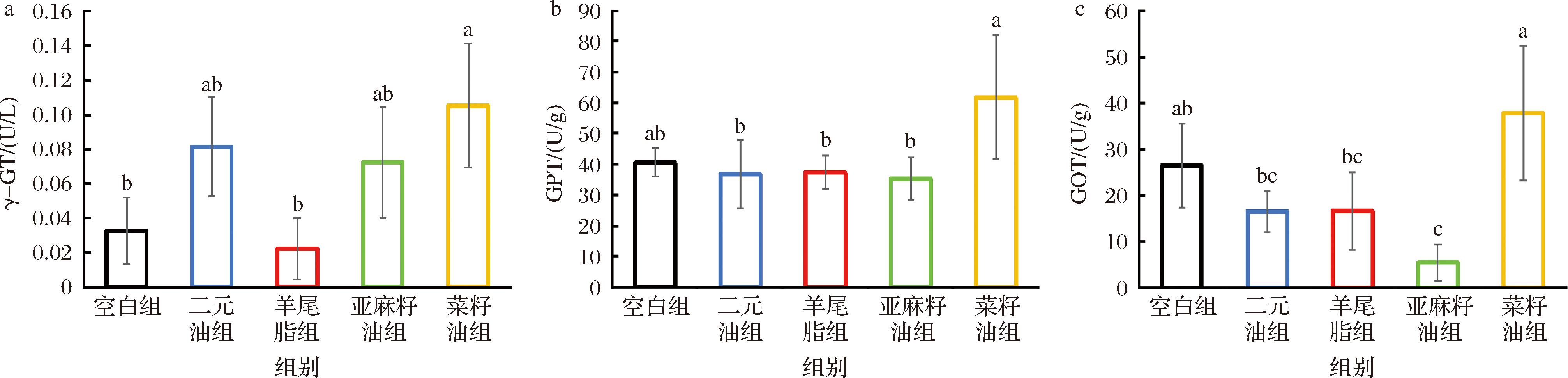
a-γ-GT;b-GPT;c-GOT
图2 各组SHR的肝机能相关激素测定结果(n=6)
Fig.2 Hormone level related to liver function in various groups of SHR (n=6)
2.3 SHR大鼠性激素表达结果与分析
如图3-a和图3-b所示,由下丘脑所分泌的促性腺激素释放激素和由垂体分泌的促卵泡激素在各组SHR大鼠间无显著性差异。LH可促进睾丸间质细胞合成睾酮,如图3-c所示,二元油组LH显著高于空白、亚麻籽油和羊尾油组(P<0.05),与菜籽油组无显著性差异(P>0.05),因此,二元油可通过提高LH促进睾酮的形成。二元油的由睾丸分泌的E2与亚麻籽油组间有显著性差异(P<0.05),但与空白、菜籽油和羊尾油脂组间无显著性差异(图3-d)。睾酮含量在二元油、空白、亚麻籽油和羊尾油脂组中较高分别达到(753.33±96.87)、(627.53±131.64)、(851.25±9.21)和(644.41±140.03) pg/mL,但组间无显著性差异,在菜籽油组中含量最低,仅达到(574.47±39.62) pg/mL,与亚麻籽油组具有显著性差异(P<0.05)。有研究结果显示,油菜籽对于卒中易感型自发性高血压(stroke-prone spontaneously hypertensive rats, SHRSP)大鼠具有靶向侵害睾丸组织,降低睾酮分泌的活性,精子质量下降的危害作用[15]。本研究也显示了摄取菜籽油的SHR大鼠睾酮分泌量低下的结果。一项针对衰老大鼠的研究中显示[16],睾酮分泌量降低会产生负反馈调节,导致垂体释放的LH提高。在本研究中二元油组和菜籽油组的LH差异不显著,但是二元油组睾酮含量比菜籽油高31%,由此可知,二元油并非通过HPG轴的负反馈调节,具有靶向保护睾丸组织并促进睾酮分泌作用。

a-促性腺激素释放激素;b-促卵泡激素;c-LH;d-E2;e-睾酮
图3 各组SHR的性激素含量(n=6)
Fig.3 Levels of sex hormones in various groups of SHR(n=6)
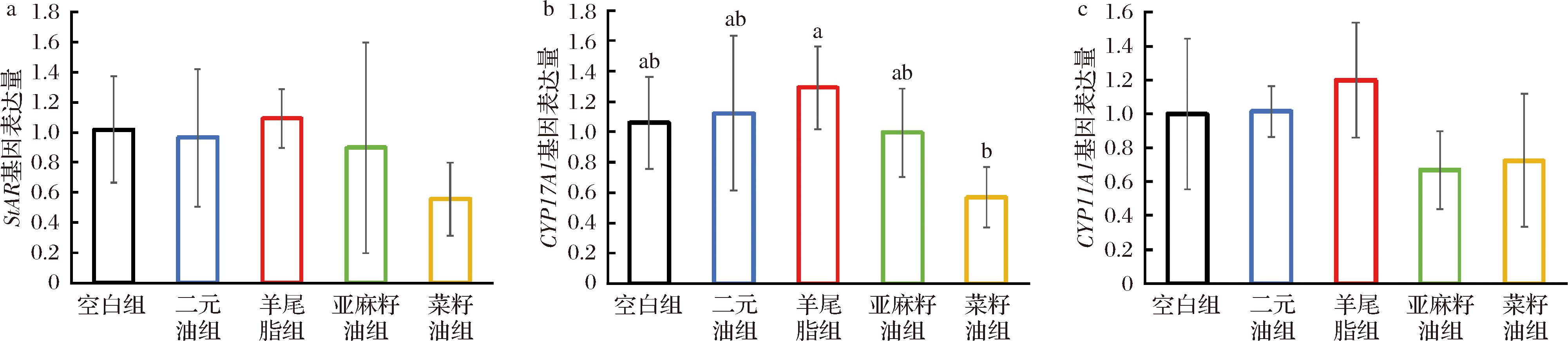
a-StAR基因表达量;b-CYP17A1基因表达量;c-CYP11A1基因表达量
图4 各组SHR类固醇激素相关基因表达水平 (n=6)
Fig.4 Expression levels of steroid hormone-related genes in various groups of SHR(n=6)
2.4 SHR大鼠类固醇激素相关基因表达结果与分析
为了探索不同油脂对SHR大鼠性激素的影响机理,本研究测定了与类固醇激素相关基因的表达量。如图4所示,各组SHR大鼠睾丸组织中StAR与CYP11A1基因均未出现显著性差异(P>0.05),羊尾油脂组CYP17A1基因表达量显著高于菜籽油组(P<0.05)。比较菜籽油、二元油和羊尾油脂3组的上述3个基因均显示高值。因此,二元油和羊尾油脂可通过提高StAR、CYP11A1和CYP17A1基因的表达,靶向促进睾酮分泌。有研究表明,部分StAR存在于肝脏中,对于肝脏的胆固醇代谢有一定作用[17]。性激素是胆固醇代谢的重要产物,二元油和羊尾油脂通过提高肝机能,改善了胆固醇代谢,所以,提高了类固醇激素代谢,促进了睾酮分泌。
2.5 大鼠类固醇激素相关蛋白表达
由图5可知,各组SHR大鼠类固醇激素相关蛋白表达水平均无显著性差异,羊尾油脂组SHR大鼠的StAR表达水平最高,且其表达量几乎为菜籽油组表达量的3倍,菜籽油组的StAR表达水平最低;二元油组CYP11A1表达量和亚麻籽油组CYP17A1表达水平最高,其余4组CYP11A1和CYP17A1表达水平相差较小。5组SHR大鼠类固醇激素相关蛋白水平与其对应基因水平表现出了一致性,从中可以了解到二元油、羊尾油脂及亚麻籽油可以上调性激素相关蛋白StAR、CYP11A1和CYP17A1表达量,从而提高SHR大鼠睾酮分泌水平。

图5 各组SHR类固醇激素相关蛋白表达水平 (n=3)
Fig.5 Expression levels of steroid hormone-related proteins in various groups of SHR (n=3)
3 结论
本研究通过比较菜籽油,探索了酶法酯交换二元油及其原料油脂的羊尾油脂和亚麻籽油对SHR大鼠类固醇激素影响机理。富含sn-2位上ALA的二元油显示改善血脂,提高肝机能的良好作用。二元油及其原料油脂的羊尾油脂和亚麻籽油能够提高HDL-C水平,降低LDL-C含量,有效降低肝激酶,提高肝脏机能。随着血脂改善和肝机能的提高,类固醇激素相关的StAR、CYP11A1及CYP17A1的基因和蛋白表达量提高,促进了睾酮分泌。
本研究结果发现,二元油和羊尾油脂提高类固醇激素代谢作用并非通过HPG轴,而是通过保护睾丸组织,靶向促进了睾酮分泌。而菜籽油可靶向侵害睾丸组织,降低睾酮分泌,这是一项重要的研究结果。NISHIKAWA等[18]研究发现,富含植物甾醇的菜籽油,恶化了SHRSP大鼠的病症,醛固酮上升,电解质异常,使得该种大鼠的肾脏出现障碍,睾丸组织受到破坏,靶向降低睾酮的分泌,从而大鼠寿命缩短。从本研究结果可以得出,富含易于吸收的sn-2位上ALA的酶法酯交换二元油对SHR大鼠肝脏及血脂具有良好作用,通过提高肝脏机能、改善血脂代谢,降低了心血管病症,其含有的动物性来源胆固醇有效提高了类固代谢相关基因和蛋白质表达,从而靶向促进睾酮分泌的结论。本研究结果为评价羊尾油脂和亚麻籽油来源的酶法酯交换二元油提供了重要的科学数据,为二元油的开发利用奠定了有效的数据基础。
[1] 蒋俊.基于体内自组装胶束形成机制的羊脂油对淫羊藿黄酮苷元抗骨质疏松增效机理研究[D].南京:南京中医药大学, 2015.JIANG J.Study on the synergistic mechanism of sheep fat oil on epimedium flavonoid aglycone against osteoporosis based on the formation mechanism of self-assembled micelles in vivo[D].Nanjing:Nanjing University of Chinese Medicine, 2015.
[2] 陈玲玲, 贾晓斌, 贾东升.淫羊藿炮制机制研究进展[J].中草药, 2010, 41(12):2108-2111.CHEN L L, JIA X B, JIA D S.Advances in studies on processing mechanism of Epimedii Folium[J].Chinese Traditional and Herbal Drugs, 2010, 41(12):2108-2111.
[3] AKSU M I.Fatty acid composition of beef intermuscular, sheep tail, beef kidney fats and its effects on shelf life and quality properties of Kavurma[J].Journal of Food Science, 2009, 74(2):S65-S72.
[4] 刘丹, 何鑫, 李涛, 等.不同品种脂臀羊尾脂品质的比较分析[J].现代食品科技, 2019, 35(4):244-249;300.LIU D, HE X, LI T, et al.Comparative analysis of the quality of different varieties of fat buttocks[J].Modern Food Science and Technology, 2019, 35(4):244-249;300.
[5] 李雅珊, 孙华.亚麻成分提取方法及功效研究综述[J].天津科技, 2018, 45(4):53-56;61.LI Y S, SUN H.A review of studies about function and method of flax extraction[J].Tianjin Science and Technology, 2018, 45(4):53-56;61.
[6] PUNIA S, SANDHU K S, SIROHA A K, et al.Omega 3-metabolism, absorption, bioavailability and health benefits:A review[J].Pharma Nutrition, 2019, 10:100162.
[7] WILLIAMS D, VERGHESE M, WALKER L T, et al.Flax seed oil and flax seed meal reduce the formation of aberrant crypt foci (ACF) in azoxymethane-induced colon cancer in Fisher 344 male rats[J].Food and Chemical Toxicology, 2007, 45(1):153-159.
[8] 中国营养学会.中国居民膳食指南(2022)[M].北京:人民卫生出版社,2022.Chinese Nutrition Society.Dietary Guidelines for Chinese Residents (2022)[M].Beijing:People’s Medical Publishing House, 2022.
[9] 庞邵杰,贾珊珊,张 坚 新时期国民膳食脂质摄入推荐的几点建议[J] 粮油食品科技, 2022, 30(3):1-6.PANG S J, ZHANG J, JIA S S.Suggestions for Chinese dietary lipids reference intakes in the new period[J].Science and Technology of Cereals, Oils and Foods, 2022, 30(3):1-6.
[10] PALMER N O, BAKOS H W, FULLSTON T, et al.Impact of obesity on male fertility, sperm function and molecular composition[J].Spermatogenesis, 2012, 2(4):253-263.
[11] POGRMIC-MAJKIC K, FA S, SAMARDZIJA D, et al.Atrazine activates multiple signaling pathways enhancing the rapid hCG-induced androgenesis in rat Leydig cells[J].Toxicology, 2016, 368:37-45.
[12] VAN DEN DRIESCHE S, WALKER M, MCKINNELL C, et al.Proposed role for COUP-TFII in regulating fetal Leydig cell steroidogenesis, perturbation of which leads to masculinization disorders in rodents[J].PLoS One, 2012, 7(5):e37064.
[13] BAKHTYUKOV A A, DERKACH K V, DAR’IN D V, et al.Decrease in the basal and luteinizing hormone receptor agonist-stimulated testosterone production in aging male rats[J].Advances in Gerontology, 2019, 9(2):179-185.
[14] YOO D K, LEE S H.Effect of lipopolysaccharide (LPS) exposure on the reproductive organs of immature female rats[J].Development &Reproduction, 2016, 20(2):113-121.
[15] OKUYAMA H, OHARA N, TATEMATSU K, et al.Testosterone-lowering activity of canola and hydrogenated soybean oil in the stroke-prone spontaneously hypertensive rat[J].The Journal of Toxicological Sciences, 2010, 35(5):743-747.
[16] 马渊, 张永祥.下丘脑-垂体-性腺轴与衰老[J].军事医学科学院院刊, 2002, 26(4):311-313.MA Y, ZHANG Y X.Hypothalamus-pituitary-gonad axis and senescence[J].Military Medical Sciences, 2002, 26(4):311-313.
[17] 许雅丽, 殷莲华.类固醇激素合成急性调节蛋白(StAR)与胆固醇代谢[J].国际病理科学与临床杂志, 2008, 28(4):358-361.XU Y L, YIN L H.Steroidogenic acute regulatory protein(StAR)and cholesterol metabolism[J].Journal of Clinical and Pathological Research, 2008, 28(4):358-361.
[18] NISHIKAWA M, OHARA N, NAITO Y, et al.Rapeseed (canola) oil aggravates metabolic syndrome-like conditions in male but not in female stroke-prone spontaneously hypertensive rats (SHRSP)[J].Toxicology Reports, 2022, 9:256-268.