多糖是维持生命机体正常生长代谢的基本物质之一,是由10种以上α-或β-糖苷键键合单糖而形成的高分子聚合物,又被称为多聚糖[1]。多糖具有多种生物活性,如抗氧化、抗菌、抗炎、降血糖血脂、抗肿瘤、抗疲劳及调节免疫系统、调节肠道菌群等,对于人类机体健康有着重要作用,被广泛运用到食品加工、医药、农业生产、化妆品等行业领域[2-3]。尽管多糖对机体生长代谢有益,但因其分子质量过大,存在黏度大、溶解性低等理化特性,严重影响了生物利用率。多糖结构中的单糖组成、化学键、官能团种类及数量、支链分子质量、高聚合度、立体结构等空间特征,不仅限制了多糖结构特征与生物活性之间的构效关系研究,而且阻碍了利用结构特征来设计、构建、筛选、生产功能性多糖的途径[4-5]。
多糖的适度降解解决了因分子质量过大导致的溶解度低及生物利用率低等问题,实现了生物机体对于多糖物质的有效利用等方式多糖的降解途径主要分为三类:1)生物降解法:常见的是酶解法和微生物发酵法,酶法降解虽然是最有效、直接的方法,但是酶的高度特异性、专一性以及高成本限制了其在生产中的运用[6-8];2)物理降解法:包括超声波、微波、电离、辐射等,虽然其高效、无污染及简便易行,但存在反应不充分、降解不彻底、生产成本高及会破坏多糖结构等问题[9-10];3)化学降解法:包含酸降解法、氧化降解法及自由基降解法等,虽然操作便捷、降解效率高以及生产成本低,但存在降解产物成分难以控制、污染环境等问题[9];自由基介导的多糖降解由于其降解程度的可控性、适用性广、污染性低以及生产成本低等特点,逐渐成为了降解多糖的当下研究趋势。
自由基最常见的来源即H2O2,通过添加某些物质(过氧化物酶、金属离子或抗坏血酸等)或者经过某种加工处理(超声波或辐射),可激活H2O2并生成氧源性自由基,作为多糖降解反应中的活性物质[11]。运用H2O2降解多糖的方法被广泛研究,虽然对多糖降解的研究较多,但由于多糖复杂的高级结构以及自由基对于糖苷键的非选择攻击性等问题,其降解机理及降解产物的构效关系并未被系统分析。因此本文综述了自由基降解多糖的作用机制,降解速率的影响因素等,最后对多糖降解产物的结构特征与生物活性的构效关系进行系统的阐述。
1 H2O2生成自由基降解多糖的作用机制
1.1 自由基的形成
H2O2是氧源性自由基生成的最常见的来源之一,但是H2O2自身的自由基生成能力有限,使得多糖的降解程度也极为有限,为了解决这些不足,大量的研究致力于促使H2O2产生充足的自由基进行降解反应。Fenton首次发现H2O2可以被Fe2+催化活化,且可以氧化酒石酸[12]。此后,研究人员陆续通过添加抗坏血酸、半导体、Cu2+、富电子材料和等离子材料以及利用物理加工处理(电、微波、超声波及辐射)等方法激活H2O2生成自由基[13],这些方式虽然都可以降解有机物,然而并非所有方式都可以应用于多糖的降解处理。目前,通常采用结合抗坏血酸、酶(H2O2酶)、等离子体、金属离子(Fe2+、Cu2+等)或辐照、微波等处理激活H2O2生成自由基降解多糖。
1.1.1 金属离子诱导自由基形成
通常使用Fe2+、Cu2+来激活H2O2促使其产生自由基。Fe2+和过量的H2O2使得有机物质在自由基强氧化作用下完全转化为CO2和H2O,但过量的Fe2+和H2O2会导致羟基自由基(·OH)的消耗,抑制多糖的降解[14]。Cu2+在酸性条件下被O2严重抑制·OH的生成,Fe2+在酸性溶液中几乎不被O2影响[15]。虽然金属离子诱导的自由基生成速率较快,但是由于自由基的活性较高,生成自由基的反应通常伴随较多的副反应。这些副反应可能导致产物纯度下降,使得降解体系中引入杂质。
1.1.2 抗坏血酸诱导自由基形成
抗坏血酸是一种还原剂,极易发生氧化反应,可以生产抗坏血酸自由基(·AH)和脱氢抗坏血酸,·AH是一类有效的生物抗氧化剂[16]。抗坏血酸不仅可作为抗氧化剂,而且在抗坏血酸浓度较低且存在过渡金属时会表现为促氧化剂作用[17]。近些年研究发现,抗坏血酸联合H2O2可共同作用于降解多糖方面,如蓝金银花多糖的降解[17]、低分子海参糖胺聚糖的制备[18]、以及源自浒苔的羧甲基化降解多糖[19]或枸杞叶多糖的降解[20]等。除此之外,混合金属离子也能使抗坏血酸-H2O2体系更好地降解多糖,如银耳多糖的自由基降解[21]。虽然抗坏血酸诱导的自由基生成速率较慢,但是纯化降解多糖产物中不易带进杂质,适合获取高纯度的多糖降解产物。
1.1.3 超声波诱导自由基形成
超声波对于多糖降解的研究已经进行很长时间,其降解机制包含机械振动、空化以及热效应[22-23]。研究发现,某些多糖不能单独被超声波处理降解,如岩藻糖基硫酸软骨素等[23]。因此,研究方向更多关注于超声波结合化学试剂以此来达到降解多糖的目的,包括但不限于添加H2O2、盐酸、NaOH等[23-25]。超声-Fe2+-H2O2的体系中,自由基在多糖降解过程中自发连续性的产生,促使降解过程有序进行,游离的Fe2+与H2O2反应可以生成更多的羟基自由基[26]。超声辅助自由基降解多糖的速率能够更快,但是特殊的反应条件,增加实验的难度和成本,会限制该方法的适用范围。
1.1.4 紫外线(ultroviolet,UV)辐射诱导自由基形成
UV的辐射可以加速H2O2形成羟基自由基的速度,故UV-H2O2体系是高效的羟基自由基产生剂[27-28]。UV-H2O2体系可以有效降低柑橘果胶和梭形马尾藻多糖的分子质量[29-30]。在UV辐射或H2O2单独作用下2 h,梭形马尾藻多糖几乎无变化,但在UV-H2O2体系中2 h后,其多糖分子质量由289 kDa下降到12.6 kDa[30]。紫外辐射辅助自由基降解多糖的过程与超声波辅助相似,特殊的反应条件会导致生产的成本过高,同时紫外辐射对人体的危害性也要引起重视。
1.1.5 酶-H2O2体系诱导自由基的形成
酶在自由基降解多糖的过程中能够发挥重要作用,如溶菌多糖单加氧酶(lytic polysaccharide monooxygenases,LPMOs)-H2O2体系可以促进顽固性多糖的降解(淀粉纤维素、甲壳素等)[31]。LPMOs-H2O2体系中,LPMO-Cu(II)经单电子还原活化生成LPMOs-Cu(I)后,H2O2可能与Cu(I)中心发生反应,断键裂解生成羟基自由基。
除此之外,辣根过氧化物酶-NADH-H2O2体系还能降解植物细胞壁中存在的多糖(如果胶、葡聚糖、木聚糖等)[32]。辣根过氧化物酶与LPMOs作用途径不同,其受到适当的还原剂(如NADH)作用下,会催化启动以超氧自由基(·O2-)和H2O2为中间体的复杂反应循环,促进·OH的生成[33]。虽然酶法结合自由基降解多糖能够提高速率且无污染,但酶-H2O2体系对不同多糖的降解存在高度特异性、专一性以及高成本等问题,限制了其在生产中的运用。
1.1.6 其他方法诱导自由基的形成
除上述方法外,利用微波、电子束、辐射及等离子体等处理H2O2同样能够促进自由基的产生,使得多糖的降解。这些方法体系中形成自由基的机制较为相似[34-36]。一方面,等离子体、微波或电子束及辐射能够直接分解H2O2为·OH;另一方面,不仅H2O2可以与·H反应,还能够通过水的辐射分解生成e-,诱导的·OH生成[35]。综上所述,这类方法生成自由基具有广泛应用、高效迅速和可控性强等优势,但也存在不可逆性、反应条件苛刻和难以控制副反应等劣势。在实际应用中,需要综合考虑这些因素,并选择合适的方法和条件来实现理想的反应结果。
1.2 自由基降解多糖的机理
自由基降解多糖的机理是自由基对多糖糖苷键的氢原子结合从而断键,达到多糖裂解的目的[37]。·OH可以从醛糖、糖醛酸及多糖链的其他位点(含有的碳氢环键)上提取氢原子,碳氢中心自由基由这类氢原子促进生成,并且这些碳氢中心自由基通过断裂β-键从而引起多糖链的裂解。
如图1所示,·OH从β-D-木聚糖的糖环中的C—H基团中提取氢原子。·OH在糖环中不同位置的碳原子中提氢,若存在氧,H2O2自由基则会消除。从C1或C4中(图中所示)提取氢原子会直接导致糖苷键断裂,多糖会降解形成还原性端多糖片段以及非还原性端多糖片段;从C5中提取氢原子不会立即导致多糖发生降解,但是会导致糖苷键转化形成不稳定的酯键;从C3或C2(己糖残基C6)中提取氢非但不能破裂糖苷键,反而会引进相对稳定的羰基,形成糖基化酶残基[37]。·OH提取氢原子位置的概率是值得研究关注的,·OH对于葡萄糖不同位点的碳表征出的活跃度不同[38]。
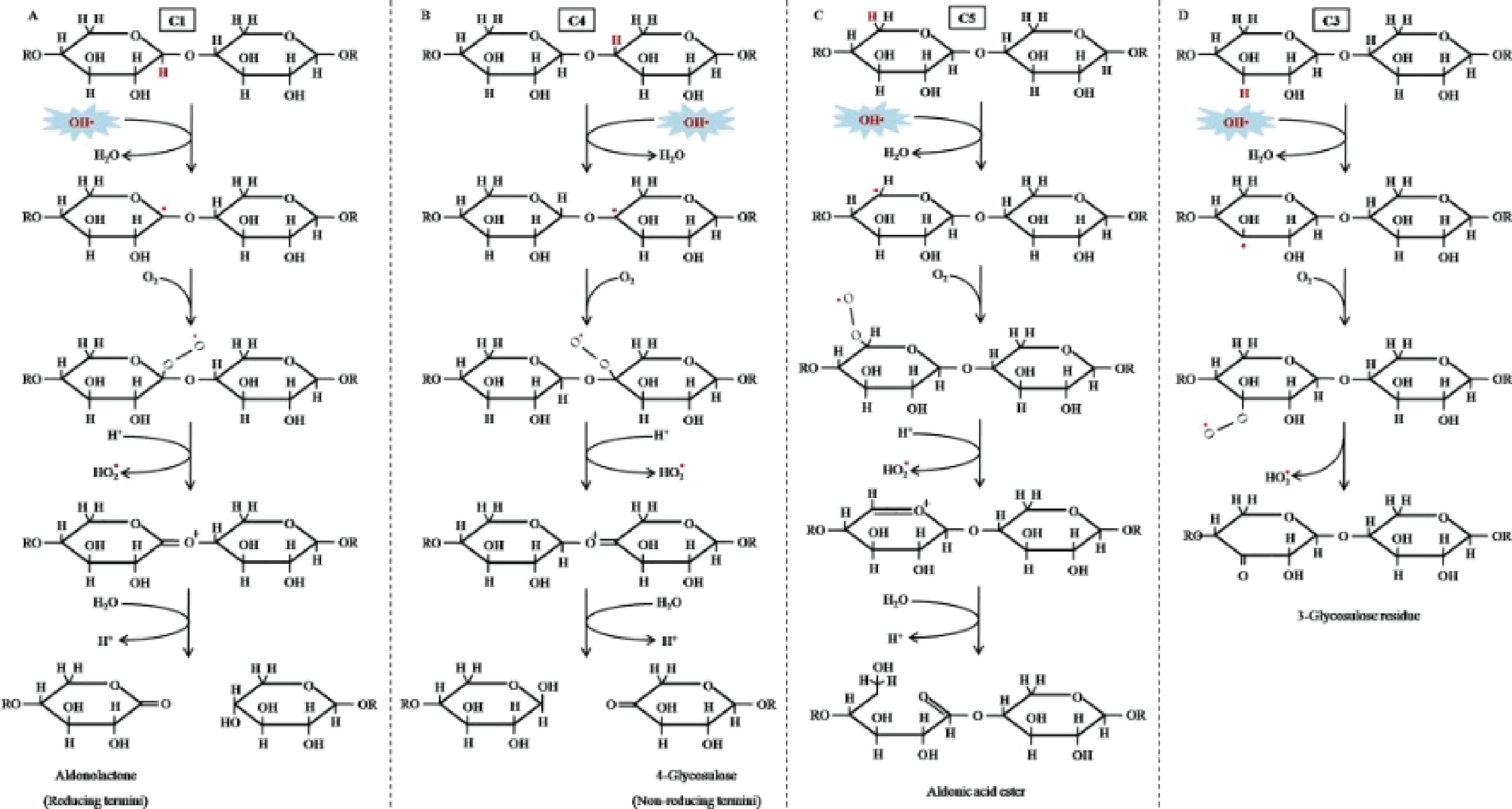
图1 羟基自由基降解β-D-木聚糖的机制
Fig.1 Mechanism of hydroxyl radical degradation of β-D-xylan
在研究糖胺聚糖的降解过程中,Cu2+-H2O2体系产生的羟基自由基从N-乙酰半乳糖胺的碳1或糖醛酸残基位点上提取氢原子,而从N-乙酰基半乳糖胺或糖醛酸环上的碳2和碳3生成的·OH会出现β-断裂,导致双键形成,糖苷键断裂。降解柑橘果胶多糖的过程中,自由基首先会断裂分子间的氢键,让其失去氢键的作用力,从而破坏果胶分子的聚集;然后自由基会从半乳糖醛酸聚糖结构域的糖苷键和半乳糖醛酸残基上提取氢原子,裂解形成低分子质量的半乳糖醛酸和鼠李糖半乳糖醛酸聚糖-Ⅰ;最后,自由基进一步破坏了半乳糖醛酸聚糖、鼠李糖半乳糖醛酸聚糖或者中性糖分支的连接末端[29,39]。
对于杂多糖而言,结构比之β-D-木聚糖及糖胺聚糖更为复杂,导致杂多糖的降解机理更难阐明。在现有研究背景下,自由基降解杂多糖的研究较多集中于比较降解前后杂多糖结构变化及性质检测,以此来分析可能的降解机理。总的来说,自由基降解多糖的机理涉及自由基引发的链反应、分子的氧化和断裂,以及进一步的化学反应。这些过程导致多糖分子逐渐降解为较小的分子和产物。
2 影响多糖降解速率的因素
2.1 多糖的浓度
研究表明降解速率会随着多糖的初始浓度下降而提升,这是由于低浓度的多糖降解对自由基的需求量较低,且多糖的黏结程度会随着浓度下降而降低,因此,自由基降解多糖的效率得到提升。在UV-H2O2体系中,将柑橘果胶的浓度从1 mg/mL 提升到10 mg/mL,会观察到降解效率显著下降,这是因为低浓度的柑橘果胶的分子质量也更低[29]。
由自然界中直接获取的多糖成分不纯,往往含有非多糖成分(色素、类胡萝卜素、多酚类、黄酮类物质等),在提高多糖浓度的同时,杂质成分质量也在增加。自由基降解多糖的过程中,由于部分非多糖组分会因为自由基具有非选择特异性而消耗自由基降解,从而减少了作用于多糖的自由基数量,导致自由基降解多糖效率的下降[40]。
2.2 反应温度
自由基降解多糖的过程中影响多糖降解速率的决定性因素是反应温度。高温状态提供充足的能量激活降解反应,会对自由基降解多糖的反应产生积极影响,但是由于H2O2在高温下会自发降解,自由基的降解效率会在温度超过适宜范围后呈下降趋势。Cu2+-H2O2体系中将温度从20 ℃提升至50 ℃时,透明质酸的降解速率会随之增加,但温度>50 ℃时,透明质酸的分子质量未出现显著变化[41-42]。
2.3 初始pH
pH对于自由基降解多糖速率影响的相关研究较少。尽管如此,仍能发现自由基的生成会受到pH的影响,同时H2O2的稳定性以及多糖的性质与pH有着密切关系[42]。在Fe2+-H2O2体系中,羟丙基瓜尔胶的降解速率会随着pH的升高而下降,Fe2+-H2O2体系的pH<3时,H+清除自由基的效果会更加明显, 在pH>3时,自由基的生成速率以及Fe(OH)2的析出速率均会减缓,故此Fe2+-H2O2体系降解多糖最佳pH值为3左右。当反应体系pH值为3.0时,H2O2与OH-发生反应时会抑制自由基产生,导致多糖的降解速率偏低[43]。通过其他研究发现,在UV-H2O2体系中,柑橘果胶的降解速率在pH值为4和12时相似。说明pH对于自由基降解多糖的影响机制是较为复杂的,且反应体系的性质也会导致pH对于多糖降解影响有所改变。UV-H2O2体系中pH偏高可能与·OH较高的生成率有关[29]。
2.4 降解剂
自由基介导的多糖降解过程中能够参与的物质很多,在研究中最为常见的物质通常为H2O2、抗坏血酸及金属离子等。金属离子之所以能够影响自由基解聚多糖,部分原因是过渡金属的催化活性起促进自由基生成的作用。这些物质浓度越高,则反应体系中生成的自由基越多,降解效率越高,但是降解速率实际上是有一定限度的,当物质浓度过高时,降解速率不能无休止的提升。
UV-H2O2体系中,可以依靠浓度依赖性的方式促进马尾藻多糖的降解速度,当体系内H2O2的浓度高于75 mmol/L时,降解效率的提高可能不太显著[43]。当H2O2的浓度为10~40 mmol/L,海参多糖的降解速率能够显著提高,但是当H2O2的浓度超过40 mmol/L时,降解速率下降,这是由于H2O2过量导致了·OH的还原(H2O2+OH·→HO·2+H2O)。
在相同体系中,糖胺聚糖的降解速率会随着抗坏血酸的浓度从2~10 mmol/L增加而提升,但是当抗坏血酸浓度高于10 mmol/L时,降解速率会明显降低,这是由于过量的抗坏血酸消耗了体系中生成的自由基[18,44]。因此,采用的降解剂浓度以及降解剂之间的配比都是影响多糖降解的关键因素。
2.5 其他因素
多糖降解过程中的影响因素还有反应时间以及对于反应体系的处理强度等。研究表明,反应时间对于多糖降解的影响只在一定时间范围内,这种现象产生的原因可能是超过一定的时间,自由基的消耗完毕,降解反应已经终止,不再影响降解体系[35,45]。
不仅如此,对于多糖的处理强度也会影响自由基介导的多糖降解速率(主要是利用超声波、γ辐射、等离子体、微波或紫外线等照射的强度影响自由基的形成)。
多糖降解速率会受到多种因素的影响:1)底物浓度:多糖本身的浓度。当底物浓度低于饱和点时,降解速率随底物浓度增加而提高;而当底物浓度超过某一阈值时,降解速率不再提升。2)温度:与大多数化学反应类似,温度的升高通常能增加分子间的运动能量,从而加速反应速率,直到达到最适反应温度。3)pH值:不同体系对环境pH的要求不同,只有在特定的pH范围内,反应速率才能达到最高,进而促进多糖的有效降解。4)降解剂:多糖降解常常是通过酶(如淀粉酶、纤维素酶)或化学试剂、金属离子等的作用进行的,降解剂的种类、活性以及与多糖的相互作用都会直接影响降解速率。酶促反应通常比非酶促反应更加高效、特异性强。
综合以上因素,多糖降解速率受到酶活性、温度、pH值、底物浓度、水分含量以及反应环境等多种外界条件的影响。在实际应用中,如工业生产或生物材料的降解处理,通常需要通过优化这些条件来提高多糖降解的效率。合理控制这些因素不仅能够加快降解速率,还能提升降解产品的品质和产量,具有重要的经济和环保价值[39]。
3 自由基降解对多糖结构及生物活性的影响
由于多糖的理化性质、生物活性与结构特征之间密切相关,降解多糖过程引起结构特征的改变,对改变多糖的理化性质方面起着重要作用,多糖的理化性质对于生物活性的表现存在重要的影响作用。研究表明,利用H2O2生成的·OH降解多糖,可降低多糖黏度及分子质量,还可改变活性官能团数量、单糖摩尔比及浓度,但其单糖种类并未发生改变,提高多糖的水溶性及热稳定性[39]。多糖进行降解时,其分子结构会随着降解程度而改变,理化性质伴随结构特征的改变而变化,如水溶性、热稳定性等;理化性质的变化导致机体细胞对降解产物的吸收利用率也发生了显著改变,多糖降解产物生物活性的表征程度也有所不同。降解后得到的多糖产物多数具有良好的生物活性,如抗氧化性、抗肿瘤性及抗凝血活性等。
3.1 多糖降解产物的分子质量与生物活性关系
具备生物活性多糖的分子质量具有一定限度范围,分子质量过大会导致跨越细胞膜过程中出现障碍,无法进入细胞发挥生物活性。目前研究结论指出,多糖生物活性的改变与多糖分子质量的改变密切相关。多糖降解降低分子质量,使得多糖降解产物被细胞更好地吸收利用,生物活性的表征程度被影响,但多糖降解并非总是优化多糖的生物活性。
研究表明在抑制A549肺癌细胞的伤口愈合过程中,降解肝素抗转化特性以及抑制作用会随抗坏血酸-H2O2体系处理后细胞多糖吸收利用率的提高得到增强[46]。刺参多糖降解产物的APTT(APTT:体外评估凝血途径整体完整性的指标)效果经过自由基降解更佳[47]。枸杞叶多糖的PT(PT:血浆中加入过量组织因子后,血浆凝固所需时间)虽然经过抗坏血酸-H2O2体系降解处理后未能延长,但降解程度足够高时,活化的部分APTT可能会得到提升[48]。岩藻糖基化硫酸软骨素在对A549肺癌细胞作用时也会由于超声波-H2O2-抗坏血酸体系处理导致的分子质量的降低,被细胞更好的吸收利用,使抗肿瘤活性提升[49]。
同时有研究表明,茯苓多糖与未经过抗坏血酸-H2O2体系处理过之前相比,APTT、PT以及TT(TT:血浆中加入过量凝血酶后,血浆凝固所需时间)虽然被延长,但作用程度被降低,表明自由基降解多糖对于生物活性的影响作用并非都是正向的[50]。
3.2 多糖降解产物的单糖组成与生物活性关系
多糖的单糖组成与其生物活性密切相关。单糖组成影响多糖的一级结构与高级结构。自由基降解多糖并未改变单糖组成,仅仅是使多糖分子的官能团更多地暴露,表征生物活性得到提升。降解对枸杞多糖的单糖组成没有显著影响。两种不同降解程度的枸杞多糖均由6种单糖组成:甘露糖、核糖、葡萄糖醛酸、葡萄糖、木糖和半乳糖[51]。但不同降解程度的枸杞多糖表现出的抗氧化性有显著差异。果胶中半乳糖醛酸的摩尔百分比经过超声波- NaHCO3- H2O2处理降低[48]。马尾藻多糖中导致岩藻糖和木糖的摩尔百分比在UV-H2O2体系处理降低,但是单糖类型并未改变[39]。
3.3 多糖降解产物的高级结构与生物活性关系
多糖特定的分子空间构象对于其生物活性的影响起关键作用。研究表明,多糖的生物活性随着多糖的有序空间结构转化为无序结构时会立刻消失。
自由基介导降解多糖会导致某些独特的空间结构特征发生改变。梭状马尾藻多糖的三螺旋分子结构在UV-H2O2体系降解处理后消失,多糖的空间构型发生改变,多糖的抗氧化活性也随之提高[30]。枸杞多糖粗糙多孔的外观、紧凑球状的空间构象会随着抗坏血酸-H2O2体系处理变为光滑均匀的外观及不规则松散拉伸链状的空间构象,生物活性也随之改变[20]。柑橘果胶的半乳糖醛酸区域的主链在超声波-NaHCO3-H2O2体系降解过程当中,会被生成的自由基优先作用上,破坏糖苷键及氢键等作用力,使得降解产物的半乳糖含量及抗癌活性得到提升[39]。
黑加仑多糖对α-淀粉酶以及α-葡萄糖苷酶的活性经过Fe2+-H2O2体系降解处理后具有明显抑制作用[52];仙人掌多糖抗糖基化活性经过Cu2+-H2O2降解得到显著提升[53]。梭形马尾藻多糖的抗酪氨酸酶作用经过抗坏血酸-H2O2体系降解后表现出来[54]。这类研究表明多糖降解的过程在断开支链片段后,可能达到生物活性提升或未表征的生物活性重新表征的效果。因此,针对多糖降解产物的结构特征和生物活性之间的构效关系仍需深入研究[18]。
3.4 多糖降解产物的官能团与生物活性关系
当多糖碳链上的官能团数量处于一定范围内时,多糖的生物活性才能表征,当自由基介导的多糖降解后,得到的产物分子质量不仅更小,其暴露的活性点位(官能团)也更多。已有研究证明,某些多糖被自由基降解之后的抗氧化性得到显著提升。
浒苔多糖相比于未进行抗坏血酸-H2O2体系降解的多糖,表现出的总抗氧化性以及对DPPH、·OH和超氧阴离子自由基的清除活性更强[19]。黑木耳多糖相比于未进行等离子体辐射-H2O2体系降解的多糖,其抗氧化性、还原性和自由基清除能力均提高[35]。
岩藻糖基化硫酸软骨素分子内氢键以及电荷分布之间的差异经过超声波-H2O2-抗坏血酸体系降解延伸趋势更大,暴露更多的活性位点,从而增强其抗肿瘤活性。2,4-二氧-硫酸岩藻糖单元是岩藻糖基化硫酸软骨素表现抗凝血作用的重要来源,当暴露出的主要官能团更多时,其抗凝血效果也会得以提升[49]。
多糖当中硫酸基的负电荷可以中和凝血酶当中氨基酸残基的正电荷,当降解多糖之后暴露更多的活性位点,使多糖的抗凝血活性得到提升。研究表明多糖降解过程中暴露的糖醛酸可能对其抗凝血活性的提高有重要作用[55]。
4 结论与未来展望
本文综述了H2O2生成自由基降解多糖的机理,H2O2添加金属离子、抗坏血酸、酶等以及利用光、电、微波、超声波、等离子体等复合方式可促进羟基自由基的产生,有效促进了多糖的降解,自由基破坏多糖分子碳链上糖苷键结构,诱导多糖产生结构变化及暴露出更多的官能团/活性位点。自由基降解效率受到多种因素的影响,如多糖原浓度、降解剂浓度、加工处理强度、初始pH、反应温度及反应时间等。
此外,自由基介导的多糖降解对多糖生物活性的改变有重要作用。多糖的原料成本较低,便于产业化,但由于多糖的大分子结构导致表征的生物活性较差,所以利用自由基降解多糖获取降解产物的研发前景非常广阔。多糖降解产物可以根据其特殊的生物活性加工成饮品或作为营养成分直接加入食品当中,作为抗衰老、抗氧化、增强免疫力等的特殊医学用途配方食品;还可作为药物的缓冲剂、稳定剂或悬浮剂等;利用其抗肿瘤性、抗病毒作用及抗氧化性等特殊的生物活性制备成疫苗等。
目前存在的问题主要包括:1)自由基降解多糖的大规模工业生产的应用问题(如每次产物分子链大小存在差异等);2)复杂多糖的降解机理尚不清楚,其复杂的分子结构及多样性导致不同多糖的降解机理有所不同;3)需要进一步研究多糖降解产物的分子结构和生物活性,是为了更好的阐述多糖降解产物的结构特征与生理活性之间的构效关系。
[1] KAKAR M U, NAVEED M, SAEED M, et al.A review on structure, extraction, and biological activities of polysaccharides isolated from Cyclocarya paliurus (Batalin) Iljinskaja[J].International Journal of Biological Macromolecules, 2020, 156:420-429.
[2] 李艳, 宁厚齐, 李迎秋.海藻渣中岩藻聚糖硫酸酯提取工艺优化[J].轻工学报, 2020, 35(6):9-15.LI Y, NING H Q, LI Y Q.Optimization of extraction process of fucoidan sulfate from seaweed residue[J].Journal of Light Industry, 2020, 35(6):9-15.
[3] 冀晓龙, 尹明松, 侯春彦, 等.红枣多糖提取、分离纯化及生物活性研究进展[J].食品工业科技, 2020, 41(23):346-353;358.JI X L, YIN M S, HOU C Y, et al.Recent advances in jujube (Zizyphus jujuba mill.) polysaccharides:Extraction, isolation and purification and bioactivities[J].Science and Technology of Food Industry, 2020, 41(23):346-353;358.
[4] XU S Y, HUANG X S, CHEONG K L.Recent advances in marine algae polysaccharides:Isolation, structure, and activities[J].Marine Drugs, 2017, 15(12):388.
[5] YUAN S W, WANG J H, LI X, et al.Study on the structure, antioxidant activity and degradation pattern of polysaccharides isolated from lotus seedpod[J].Carbohydrate Polymers, 2023, 316:121065.
[6] LIU X P, REN Z, YU R H, et al.Structural characterization of enzymatic modification of Hericium erinaceus polysaccharide and its immune-enhancement activity[J].International Journal of Biological Macromolecules, 2021, 166:1396-1408.
[7] LI X J, CHEN Y N, SONG L H, et al.Partial enzymolysis affects the digestion of tamarind seed polysaccharides in vitro:Degradation accelerates and gut microbiota regulates[J].International Journal of Biological Macromolecules, 2023, 237:124175.
[8] SU Y, LI H X, HU Z Y, et al.Research on degradation of polysaccharides during Hericium erinaceus fermentation[J].LWT, 2023, 173:114276.
[9] YANG H H, BAI J W, MA C L, et al.Degradation models, structure, rheological properties and protective effects on erythrocyte hemolysis of the polysaccharides from Ribes nigrum L[J].International Journal of Biological Macromolecules, 2020, 165:738-746.[10] WANG Z C, ZHOU X Y, SHENG L L, et al.Effect of ultrasonic degradation on the structural feature, physicochemical property and bioactivity of plant and microbial polysaccharides:A review[J].International Journal of Biological Macromolecules, 2023, 236:123924.
[11] CHEN X Y, SUN-WATERHOUSE D, YAO W Z, et al.Free radical-mediated degradation of polysaccharides:Mechanism of free radical formation and degradation, influence factors and product properties[J].Food Chemistry, 2021, 365:130524.
[12] FENTON H J H.Oxidation of tartaric acid in presence of iron[J].Journal of Chilean Chemical Society, 1894, 65:899-910.
[13] ZHU Y P, ZHU R L, XI Y F, et al.Strategies for enhancing the heterogeneous Fenton catalytic reactivity:A review[J].Applied Catalysis B:Environmental, 2019, 255:117739.
[14] BOKARE A D, CHOI W.Review of iron-free Fenton-like systems for activating H2O2 in advanced oxidation processes[J].Journal of Hazardous Materials, 2014, 275:121-135.
[15] FLORENCE T M.The production of hydroxyl radical from hydrogen peroxide[J].Journal of Inorganic Biochemistry, 1984, 22(4):221-230.
[16] NAPPI A J, VASS E.Hydroxyl radical production by ascorbate and hydrogen peroxide[J].Neurotoxicity Research, 2000, 2(4):343-355.
[17] MA C L, BAI J W, SHAO C T, et al.Degradation of blue honeysuckle polysaccharides, structural characteristics and antiglycation and hypoglycemic activities of degraded products[J].Food Research International, 2021, 143:110281.
[18] MOU J J, WANG C, LI Q, et al.Preparation and antioxidant properties of low molecular holothurian glycosaminoglycans by H2O2/ascorbic acid degradation[J].International Journal of Biological Macromolecules, 2018, 107(Pt A):1339-1347.
[19] SHI M J, WEI X Y, XU J, et al.Carboxymethylated degraded polysaccharides from Enteromorpha prolifera: Preparation and in vitro antioxidant activity[J].Food Chemistry, 2017, 215:76-83.
[20] WANG M Z, WANG J, FU L L, et al.Degradation of polysaccharides from Lycium barbarum L.leaves improves bioaccessibility and gastrointestinal transport of endogenous minerals[J].International Journal of Biological Macromolecules, 2020, 143:76-84.
[21] ZHANG Z S, WANG X M, ZHAO M X, et al.Free-radical degradation by Fe2+/Vc/H2O2 and antioxidant activity of polysaccharide from Tremella fuciformis[J].Carbohydrate Polymers, 2014, 112:578-582.
[22] QIU J Q, ZHANG H, WANG Z Y.Ultrasonic degradation of Polysaccharides from Auricularia auricula and the antioxidant activity of their degradation products[J].LWT, 2019, 113:108266.
[23] CHEUNG Y C, YIN J Y, WU J Y.Effect of polysaccharide chain conformation on ultrasonic degradation of curdlan in alkaline solution[J].Carbohydrate Polymers, 2018, 195:298-302.
[24] LI J H, LI S, LIU S S, et al.Pectic oligosaccharides hydrolyzed from citrus canning processing water by Fenton reaction and their antiproliferation potentials[J].International Journal of Biological Macromolecules, 2019, 124:1025-1032.
[25] XIONG F, LI X, ZHENG L H, et al.Characterization and antioxidant activities of polysaccharides from Passiflora edulis Sims peel under different degradation methods[J].Carbohydrate Polymers, 2019, 218:46-52.
[26] RAHDAR S, IGWEGBE C A, GHASEMI M, et al.Degradation of aniline by the combined process of ultrasound and hydrogen peroxide (US/H2O2)[J].MethodsX, 2019, 6:492-499.
[27] CHEN L W, CAI T M, CHENG C, et al.Degradation of acetamiprid in UV/H2O2 and UV/persulfate systems:A comparative study[J].Chemical Engineering Journal, 2018, 351:1137-1146.
[28] YAO W Z, LIU M Y, CHEN X Y, et al.Effects of UV/H2O2 degradation and step gradient ethanol precipitation on Sargassum fusiforme polysaccharides:Physicochemical characterization and protective effects against intestinal epithelial injury[J].Food Research International, 2022, 155:111093.
[29] CAO J, YANG J, YUE K T, et al.Preparation of modified citrus pectin (MCP) using an advanced oxidation process with hydroxyl radicals generated by UV-H2O2[J].Food Hydrocolloids, 2020, 102:105587.
[30] CHEN S J, LIU H, YANG X Q, et al.Degradation of sulphated polysaccharides from Grateloupia livida and antioxidant activity of the degraded components[J].International Journal of Biological Macromolecules, 2020, 156:660-668.
[31] MEIER K K, JONES S M, KAPER T, et al.Oxygen activation by Cu LPMOs in recalcitrant carbohydrate polysaccharide conversion to monomer sugars[J].Chemical Reviews, 2018, 118(5):2593-2635.
[32] SCHWEIKERT C, LISZKAY A, SCHOPFER P.Polysaccharide degradation by Fenton reaction- or peroxidase-generated hydroxyl radicals in isolated plant cell walls[J].Phytochemistry, 2002, 61(1):31-35.
[33] MISHIN V, HECK D E, LASKIN D L, et al.The amplex red/horseradish peroxidase assay requires superoxide dismutase to measure hydrogen peroxide in the presence of NAD(P)H[J].Free Radical Research, 2020, 54(8-9):620-628.
[34] WEI R, WANG P, ZHANG G S, et al.Microwave-responsive catalysts for wastewater treatment:A review[J].Chemical Engineering Journal, 2020, 382:122781.
[35] WU J W, LI P, TAO D B, et al.Effect of solution plasma process with hydrogen peroxide on the degradation and antioxidant activity of polysaccharide from Auricularia auricula[J].International Journal of Biological Macromolecules, 2018, 117:1299-1304.
[36] CHEN S K, WANG X, GUO Y Q, et al.Exploring the partial degradation of polysaccharides:Structure, mechanism, bioactivities, and perspectives[J].Comprehensive Reviews in Food Science and Food Safety, 2023, 22(6):4831-4870.
[37] DAI Y J, SHAO C F, PIAO Y G, et al.The mechanism for cleavage of three typical glucosidic bonds induced by hydroxyl free radical[J].Carbohydrate Polymers, 2017, 178:34-40.
[38] LINDSAY S E, FRY S C.Redox and Wall-restructuring[M]//The Expanding Cell. Berlin Heidelberg Springer, 2006:159-190.
[39] HU W W, CHEN S G, WU D M, et al.Ultrasonic-assisted citrus pectin modification in the bicarbonate-activated hydrogen peroxide system:Chemical and microstructural analysis[J].Ultrasonics Sonochemistry, 2019, 58:104576.
[40] WANG W X, FANG S P, XIONG Z X.Protective effect of polysaccharide from Ligusticum chuanxiong hort against H2O2-induced toxicity in zebrafish embryo[J].Carbohydrate Polymers, 2019, 221:73-83.
[41] CHEN H Y, QIN J, HU Y.Efficient degradation of high-molecular-weight hyaluronic acid by a combination of ultrasound, hydrogen peroxide, and copper ion[J].Molecules, 2019, 24(3):617.
[42] BOUTITI A, ZOUAGHI R, BENDJABEUR S E, et al.Photodegradation of 1-hexyl-3-methylimidazolium by UV/H2O2 and UV/TiO2:Influence of pH and chloride[J].Journal of Photochemistry and Photobiology A:Chemistry, 2017, 336:164-169.
[43] TANG Y, LIU H, ZHOU L, et al.Enhanced Fenton-like oxidation of hydroxypropyl guar gum catalyzed by EDTA-metal complexes in a wide pH range[J].Water Science and Technology:a Journal of the International Association on Water Pollution Research, 2019, 79(9):1667-1674.
[44] LONG X S, HU X, XIANG H, et al.Structural characterization and hypolipidemic activity of Gracilaria lemaneiformis polysaccharide and its degradation products[J].Food Chemistry:X, 2022, 14:100314.
[45] LIANG S, LIAO W Z, MA X, et al.H2O2 oxidative preparation, characterization and antiradical activity of a novel oligosaccharide derived from flaxseed gum[J].Food Chemistry, 2017, 230:135-144.
[46] SHEN X M, LIU Z F, LI J H, et al.Development of low molecular weight heparin by H2O2/ascorbic acid with ultrasonic power and its anti-metastasis property[J].International Journal of Biological Macromolecules, 2019, 133:101-109.
[47] LIN S Z, AL-WRAIKAT M, NIU L R, et al.Degradation enhances the anticoagulant and antiplatelet activities of polysaccharides from Lycium barbarum L.leaves[J].International Journal of Biological Macromolecules, 2019, 133:674-682.
[48] CHANG S C, HSU B Y, CHEN B H.Structural characterization of polysaccharides from Zizyphus jujuba and evaluation of antioxidant activity[J].International Journal of Biological Macromolecules, 2010, 47(4):445-453.
[49] YANG J, WANG Y H, JIANG T F, et al.Depolymerized glycosaminoglycan and its anticoagulant activities from sea cucumber Apostichopus japonicus[J].International Journal of Biological Macromolecules, 2015, 72:699-705.
[50] LI J H, LI S, WU L M, et al.Ultrasound-assisted fast preparation of low molecular weight fucosylated chondroitin sulfate with antitumor activity[J].Carbohydrate Polymers, 2019, 209:82-91.
[51] AL-WRAIKAT M, LIU Y, WU L M, et al.Structural characterization of degraded Lycium barbarum L.leaves’ polysaccharide using ascorbic acid and hydrogen peroxide[J].Polymers, 2022, 14(7):1404.
[52] HOU N N, ZHANG M, XU Y J, et al.Polysaccharides and their depolymerized fragments from Costaria costata:Molecular weight and sulfation-dependent anticoagulant and FGF/FGFR signal activating activities[J].International Journal of Biological Macromolecules, 2017, 105:1511-1518.
[53] XU Y Q, NIU X J, LIU N Y, et al.Characterization, antioxidant and hypoglycemic activities of degraded polysaccharides from blackcurrant (Ribes nigrum L.) fruits[J].Food Chemistry, 2018, 243:26-35.
[54] CHAOUCH M A, HAFSA J, RIHOUEY C, et al.Depolymerization of polysaccharides from Opuntia ficus indica:Antioxidant and antiglycated activities[J].International Journal of Biological Macromolecules, 2015, 79:779-786.
[55] CHEN B J, SHI M J, CUI S, et al.Improved antioxidant and anti-tyrosinase activity of polysaccharide from Sargassum fusiforme by degradation[J].International Journal of Biological Macromolecules, 2016, 92:715-722.