目前有机硒因其较低的毒性和较高的生物利用度在天然食品补充剂和癌症治疗中发挥着重要作用。而硒与功能大分子物质如蛋白质、多糖等的结合是有机硒的重要存在形式并已经成为充分发挥其生理活性的重要途径[1],其中硒多糖成为了食品、医药和化妆品领域的一个重要研究热点。
硒多糖包括天然和人工合成两种,天然硒多糖主要从富硒材料中提取分离制备,因其原料来源有限、结构复杂、含量较少、分离纯化较难等问题导致其应用开发难度较大[2],因此人工合成硒多糖备受关注。人工制备硒多糖主要有三种方式[3](见图1所示),一是生物转化法,利用聚硒生物(通常为植物或微生物)进行富硒培养,通过生物代谢将外源无机硒转化为生物体内有机硒,而后按照天然硒多糖的分离纯化方式进行制备[4]。二是纳米硒多糖,无机硒如亚硒酸钠被抗坏血酸等还原为单质硒原子,多糖中有羟基、氨基和羧基等极性基团形成的长链或支链结构为单质硒原子簇的生长提供有利微环境,使单质硒沿链吸附和包裹形成纳米硒多糖,此种形式的硒为零价[5]。三是天然多糖的硒化修饰,即通过化学反应使无机硒原子接枝到多糖分子中,此种形式的硒常为四价态,保留了典型的氧化还原性质[4]。硒化修饰因其操作步骤简单、易控制、成本低等优点[6]在人工合成硒多糖中应用比较广泛,因此本文主要围绕天然多糖硒化修饰特点、影响因素以及硒化修饰对多糖物理性质、生理功能的影响进行综述,旨在为硒化修饰天然多糖构效关系的深度研究提供参考。
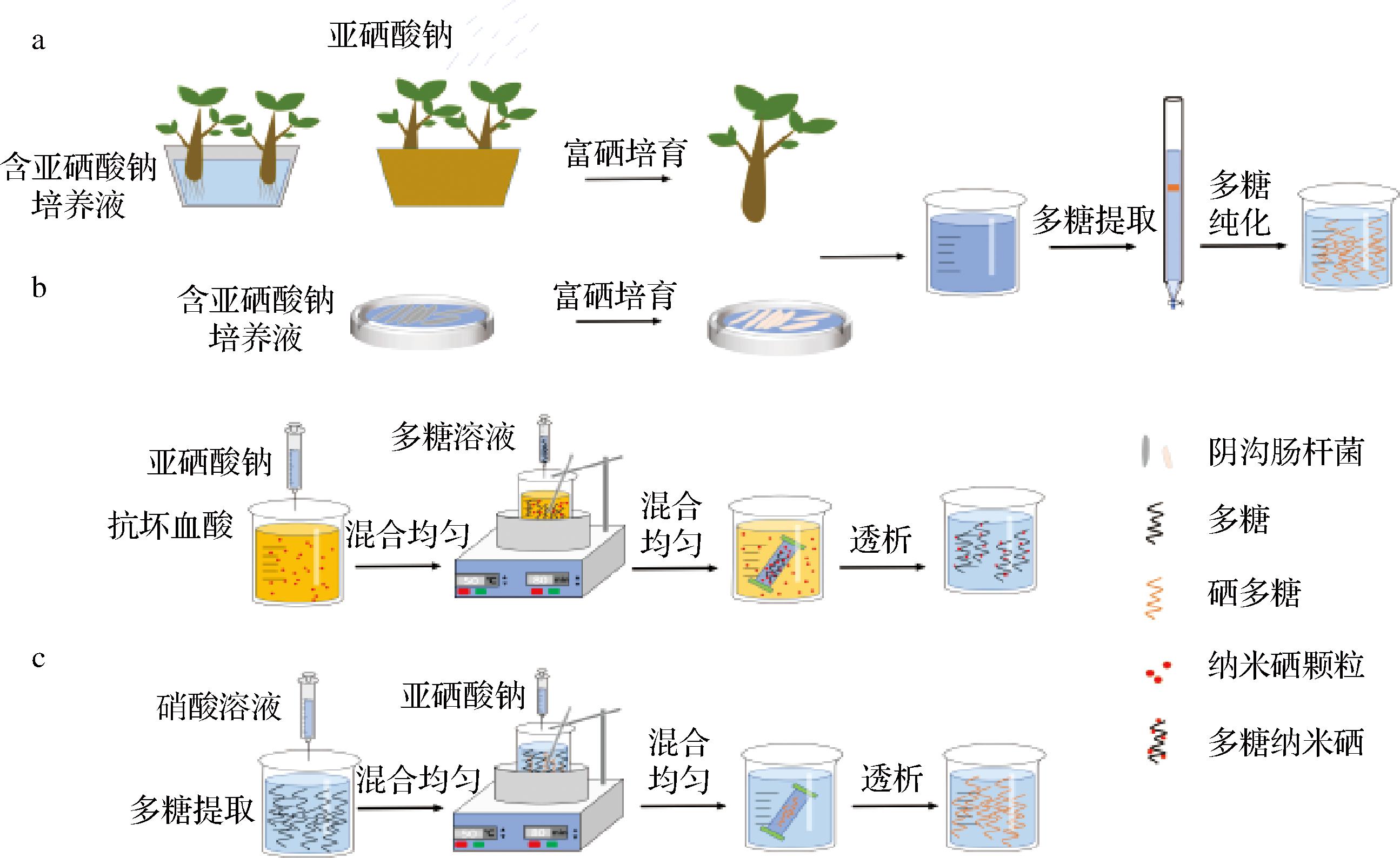
a-生物转化法;b-纳米硒多糖;c-天然多糖的硒化修饰
图1 人工合成硒多糖的3种方式
Fig.1 Three ways of artificial synthesis of selenium polysaccharides
1 天然多糖硒化修饰机理
利用天然多糖链上的—OH、—NH4、—CHO等活性基团与硒化试剂反应,以一定的化学键将无机硒结合到多糖链上。根据硒化试剂的不同可分为3种硒化修饰方法,一是主要以亚硒酸钠、硝酸-亚硒酸钠(nitric acid-sodium selenite, NA-SS)、冰醋酸-亚硒酸(glacial acetic-selenite aacid, GA-SA)、冰醋酸-亚硒酸钠(glacial acetic-sodium selenite, GA-SS)等为硒化试剂[6],NA-SS法由于硒化效率高成为了常用的多糖硒化修饰方法,机理是在酸性条件下,亚硒酸基主要与多糖链中单糖上C6羟基形成新的亚硒酸酯键,有时也可通过—HSe形式连接C2位置,此法的反应位置通常是单糖中一个碳原子上的基团,为单一反应。二是以二氯氧化硒(SeOCl2)为硒化试剂,此法硒化机理有两种,一是SeOCl2与构成多糖的单糖C6的OH反应形成O—SeOCl键;二是SeOCl2中的两个氯原子分别与单糖上具有顺式关系的相邻2个碳原子的羟基的H原子反应,进而生成五元环形的亚硒酸酯,反应位置一般在单糖的C1和C2,此法与NA-SS法等的区别是SeOCl2与单糖中的碳原子的羟基反应位点增多。三是以有机硒化合物为硒化试剂,利用有机硒化合物如硒醚、硒羧酸等对多糖支链进行修饰[7]。根据有机硒的种类不同其硒化机理存在差异,硒化反应后形成的基团与NA-SS法等不同,如采用有机硒化合物对麒麟多糖进行硒化,有机硒化合物中的羧基与多糖中的羟基形成酯,生成含C—Se—C结构的新型硒多糖,发生的反应可能是乙酰化等。三种硒化修饰方法的对比具体见表1和图2。
表1 不同硒化试剂硒化多糖比较
Table 1 Comparison of selenide polysaccharides with different selenide reagents

硒化试剂硒化位点化学键常用方法的硒化步骤特点亚硒酸盐、硒酸盐C6、C2SeO、SeHNA-SS法:将多糖溶于硝酸溶液中,与Na2SeO3和BaCl2反应,硒化结束后沉淀透析除去剩余离子,浓缩、冷冻干燥硒化效率高,但硒化过程涉及强酸条件氯氧化硒C1和C2、C6SeO将NaHSeO3、SeOCl2在氮气、冰盐浴等条件下制备硒酰氯化合物(selenium oxychloride,SOC),而后将多糖溶于无水吡啶中,加入SOC溶液进行硒化反应后透析、醇沉、冷冻干燥SeOCl2不易制备、性质不稳定、空气中易分解且硒化反应易产生H2Se等有毒气体有机硒化合物C6C—Se—C有机硒化合物根据自身特点会有不同的硒化过程,如乙酸硒醚硒化麒麟菜多糖,将多糖溶于N,N-二甲基甲酰胺(N,N-dimeth-ylformamide,DMF)中,加吡啶,而后逐滴加入乙酸硒醚的DMF溶液反应,醇沉干燥即可有机硒化试剂制备比较危险,合成方法难度大,且硒化试剂的化学性质相对活泼
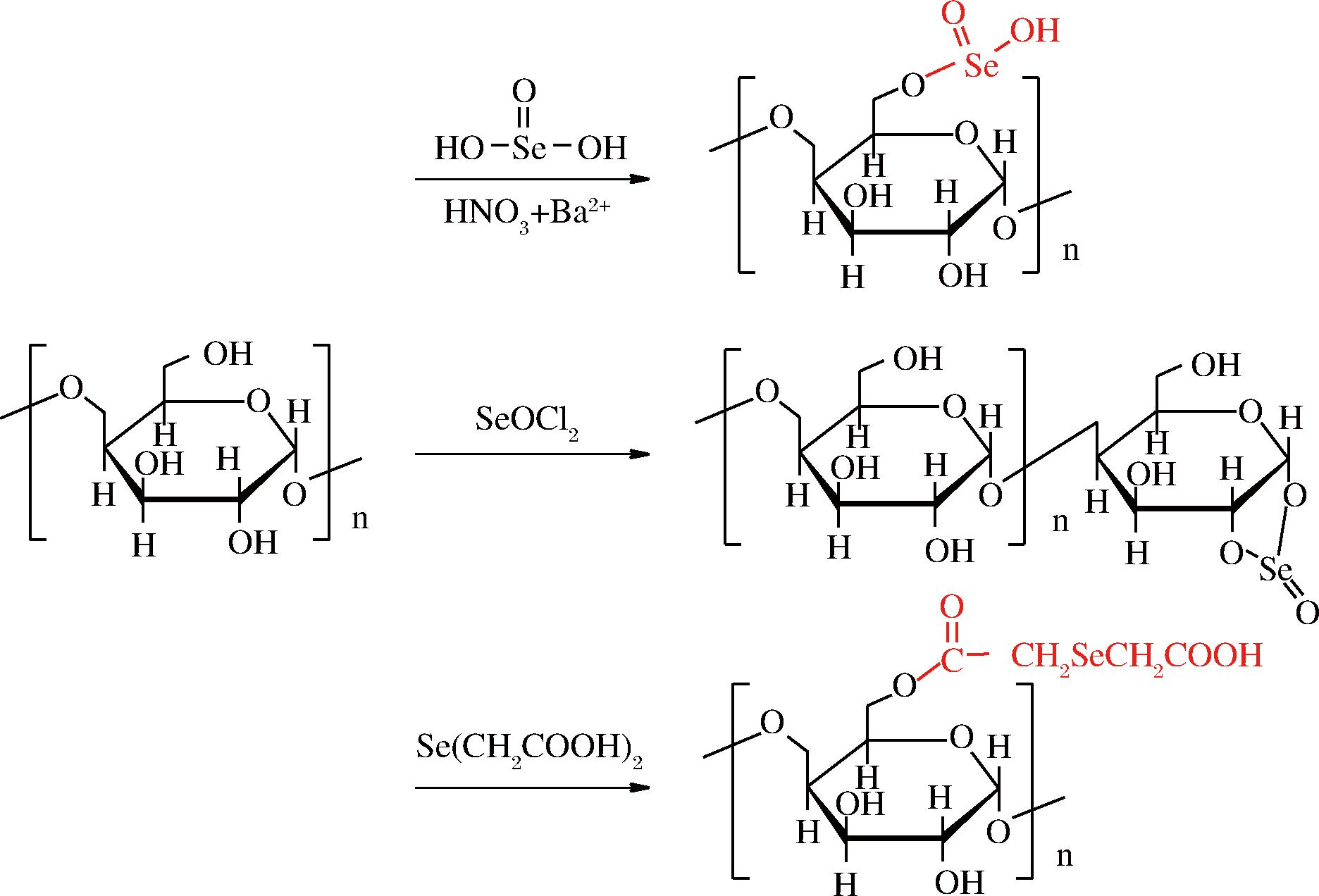
图2 不同硒化试剂硒化多糖的原理[4]
Fig.2 Principle of selenide polysaccharides with different selenide reagents
2 影响多糖硒化修饰效果的因素
2.1 硒化方法和硒化条件对天然多糖硒化修饰效果的影响
2.1.1 硒化方法对多糖的硒化修饰效果的影响
不同硒化方法对多糖的硒化效果不同,如采用NA-SS法和SOC法分别硒化白沙蒿多糖,SOC法硒化后多糖硒含量为22 400 μg/g,远高于NA-SS法[3]。但GAO等[8]采用NA-SS法、GA-SA法、GA-SS法、SOC法硒化大蒜多糖,多糖硒含量分别为29 400、26 300、30 500、9 200 μg/g,GA-SS法硒化效果最好。以离子液对葫芦巴、刺槐豆、圆头蒿多糖进行硒化,发现离子液体可有效提高亚硒酸活性,促使亚硒酸与不同类型多糖结合,三种多糖硒含量分别由常规反应中的4 060、4 428和5 612 μg/g提高到31 317、28 821和33 933 μg/g[9-10]。由此可见硒化方法对硒化效果的影响因天然多糖种类而异,可能是不同多糖的物理性质、单糖组成、分支结构、活性基团不同导致的。
2.1.2 硒化条件对多糖硒化修饰效果的影响
同种硒化方法,不同硒化条件多糖硒化效果不同。首先在SeOCl2法中,影响多糖硒化效果的主要因素包括多糖和SeOCl2的用量、硒化温度、硒化时间,一般随SeOCl2的用量增加、硒化温度的升高、硒化时间的延长硒化效果越好,但当硒化位点饱和后,硒化效果反而会下降。如通过实验优化发现大蒜多糖:SeOCl2=1∶1.2,反应温度90 ℃,时间8 min时,大蒜多糖的硒化效果最好,达到9 200 μg/g[8]。
其次在有机硒化合物方法中,影响多糖硒化效果的主要因素是有机硒化合物的种类。林晓芝等[7]比较乙酸硒醚、丙酸硒醚、对甲基苯甲酸硒醚、乙酸硒醚邻氨基苯甲酸酰胺、乙酸硒醚水杨酸酯、丙酸二硒醚及对甲基苯甲酸二硒醚7种有机硒化化合物的硒化效果,其中对甲基苯甲酸二硒醚的硒化效果最佳,在硒化试剂0.2 g,温度为60 ℃,反应时间为3 h时,硒含量高达126.2 mg/g。
最后在NA-SS法中,影响多糖硒化效果的主要因素是多糖、亚硒酸盐和硝酸用量、硒化温度、硒化时间。一般地HNO3质量分数对多糖硒化修饰起重要作用,如蕨麻多糖硒化效果随HNO3质量分数增加而增加,当HNO3质量分数为0.8%时,硒化蕨麻多糖硒含量达峰值1 224 μg/g,当HNO3质量分数>0.8%时,硒含量反而降低,可能是由于高酸性环境导致硒多糖酯的水解[11]。多糖可为硒化提供硒结合位点,因此用量越高硒化效果越好,但多糖用量过高会使硒结合位点之间发生竞争,导致其不能被充分地利用,从而使硒化效果下降。如香菇多糖硒结合率随多糖用量增加而增加,但当多糖用量>1.00 g时反而下降[12]。亚硒酸盐用量与多糖硒化效果成正比,但当亚硒酸盐用量增加到一定量时硒化位点被饱和,多糖硒化效果下降。如榆树果胶多糖与亚硒酸钠质量比为1∶0.8时硒化效果最好,硒含量达106 700 μg/g,当二者比例增加到1∶1时,硒化效果显著下降,硒含量仅为13 200 μg/g[13]。梭柄松苞菇多糖∶Na2SeO3从1∶0.4增加到1∶1时,硒含量从1 220 μg/g显著增至1 860 μg/g;当多糖∶Na2SeO3为1∶1.2时,硒含量下降至1 830 μg/g[14],大蒜、枸杞多糖硒化出现同样的变化[9,15]。硒化温度越高硒化效果越好,因为较高的硒化温度可以激活硒结合位点促进硒化,但过高温度可能会通过增强分子运动、破坏多糖结构阻碍硒化反应。如在50~70 ℃间梭柄松苞菇多糖硒含量随温度升高而增加并达到最大值1 540 μg/g,但在80~90 ℃间硒含量随温度升高显著下降至1 420 μg/g[14],香菇多糖硒化也呈现同样变化[12]。此外硒化时间越长硒化效果越好,梭柄松苞菇多糖硒含量随硒化时间延长而增加,在8 h时达到最大值1 650 μg/g,超过8 h后硒含量无明显变化,可能是由于多糖硒化在反应初始阶段接近完成,随反应时间增加而趋于稳定。综合以上影响因素可以看出,NA-SS法硒化多糖的条件一般多糖∶Na2SeO3为1∶0.8~1∶1,硒化温度50~70 ℃,硒化时间5~8 h。如当枸杞多糖∶Na2SeO3为1∶0.8,70 ℃,反应6 h时硒含量最高为13 660 μg/g[15]。党参果胶多糖在60 ℃,反应5 h,多糖∶Na2SeO3为1∶1时硒化效果最好,硒含量达478.17 μg/g[16]。
2.2 天然多糖分子结构对硒化修饰效果的影响
多糖的分子结构主要包括单糖组成、分子质量、分子构象等,其中多糖分子质量会影响其硒化效果,但分子质量对硒化修饰效果的影响有分歧,有报道分子质量越大多糖硒化后含硒量越高,可能是由于分子质量越大多糖的结构片段越多,从而具有更多的硒化位点,因此硒化效果越好。如LIU等[17]分别硒化11.2 kDa和18.6 kDa的苜蓿多糖,发现其硒含量分别为1 050 μg/g和2 570 μg/g。但 WANG 等[18]发现硒化修饰效果与分子质量并不是完全正相关,如硒化48.6、20.2和11.8 kDa平菇多糖,其硒含量分别为1 990、7 890、6 060 μg/g,分子质量居中的20.2 kDa含硒量最高。因此多糖分子质量对硒化修饰效果的影响不是孤立的,可能还受控于多糖的单糖组成等因素,如ZHAO 等[19]发现糖醛酸含量高的黑加仑多糖硒化后硒含量显著增加,达480 μg/g。可能是因为糖醛酸化学键反应需要的键能更低,更易与硒酸根反应生成新的化学键。此外半乳糖含量相对较高的多糖硒化后硒含量相对较高,如榆树果胶多糖[13]、黄芪多糖[20]、猴头菇多糖[21]等。
由表2可以看出,不同来源的多糖的硒化修饰效果差异非常大,由于多糖结构解析难度比较大,因此目前未见精确解析多糖分子结构对硒化修饰效果影响的报道,这也是硒化多糖后期研究的一大挑战。
表2 不同多糖NA-SS法硒化效果比较
Table 2 Comparison of selenization effect of different polysaccharides by NA-SS method

多糖硒化条件硒化前后单糖组成及摩尔比分子质量变化/kDa硒含量/ (μg/g)文献蒲公英根多糖0.5 mg多糖∶Na2SeO3=1∶1, 50 mL 5%(质量分数)硝酸, 0.7 g BaCl2, 40 ℃,4 h半乳糖醛酸∶鼠李糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=1.09∶1.00∶4.78∶0.30∶3.41∶3.69→1.59∶1.00∶5.79∶0.56∶5.40∶3.938.7→7.9170±1.130.5 g多糖∶Na2SeO3=1∶1, 50 mL 5%(质量分数)硝酸, 0.7 g BaCl2, 60 ℃,8 h半乳糖醛酸∶鼠李糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=1.09∶1.00∶4.78∶0.30∶3.41∶3.69→0.97∶1.00∶4.18∶0.36∶1.05∶5.448.7→5.6710±4[22]黑加仑多糖0.5 g多糖∶Na2SeO3=1∶1, 250 mL 0.5%(质量分数)硝酸, 2.5 g BaCl2, 800 W, 50 ℃, 5 h半乳糖醛酸∶鼠李糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=26.69∶25.94∶41.84∶3.36∶4.18∶17.99→26.67∶21.33∶33.33∶7.67∶9.00∶22.0020 400→15 500170±120.5 g多糖∶Na2SeO3=1∶1, 250 mL 0.5%(质量分数)硝酸, 2.5 g BaCl2, 800 W, 50 ℃, 7 h半乳糖醛酸∶鼠李糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=26.69∶25.94∶41.84∶3.36∶4.18∶17.99→29.09∶21.59∶37.89∶4.54∶4.92∶21.9720 400→12 900320±100.5 g多糖∶Na2SeO3=1∶1, 250 mL 0.5%(质量分数)硝酸, 2.5 g BaCl2, 500 W, 80 ℃, 3 h半乳糖醛酸∶鼠李糖∶阿拉伯糖∶甘露糖∶葡萄糖∶半乳糖=26.69∶25.94∶41.84∶3.36∶4.18∶17.99→30.86∶22.47∶37.45∶4.49∶4.12∶20.6120 400→9 090480±8[19]榆树果胶多糖1.0 g多糖∶Na2SeO3=1∶0.2, 50 mL 5%(质量分数)硝酸, 24 h1.0 g多糖∶Na2SeO3=1∶0.4, 50 mL 5%(质量分数)硝酸, 24 h1.0 g多糖∶Na2SeO3=1∶0.6, 50 mL 5%(质量分数)硝酸, 24 h1.0 g多糖∶Na2SeO3=1∶0.8, 50 mL 5%(质量分数)硝酸, 24 h1.0 g多糖∶Na2SeO3=1∶1, 50 mL 5%(质量分数)硝酸, 24 h-2.69→3.97×1093 2402.69→4.33×1095 1402.69→4.68×1099 0402.69→5.22×109106 7002.69→6.52×10913 200[13]党参果胶多糖0.1 g多糖∶Na2SeO3=1∶1, 20 mL 1%(质量分数)硝酸, 0.1 g BaCl2, 60 ℃, 5 h-145→195478.17[16]黄芪多糖0.5 g多糖∶Na2SeO3=1∶0.8, 50 mL 5%(质量分数)硝酸, 1 g BaCl2, 70 ℃, 6 h-12.31→10.041 750[20]紫花苜蓿多糖0.1 g多糖∶Na2SeO3=1∶0.7, 10 mL 0.6%(质量分数)硝酸, 70 ℃, 10 h鼠李糖∶阿拉伯糖∶果糖∶甘露糖∶半乳糖=0.56∶0.19∶0.18∶0.05∶0.0218.6→10.22 570[17]慈姑多糖0.5 g多糖∶Na2SeO3=1∶1, 50 mL 0.6%(质量分数)硝酸, 0.5 g BaCl2, 75 ℃, 8 h鼠李糖∶阿拉伯糖∶木糖∶甘露糖∶葡萄糖∶半乳糖=1.77∶1.14∶14.35∶14.86∶55.82∶12.07→12.99∶12.06∶18.76∶11.55∶26.49∶18.1447.12→16.822.89[23]猴头菇多糖0.5 g多糖∶Na2SeO3=1∶0.8, 90 ℃, 8 h-16.15→22.3713980[19]红芪多糖0.4 g多糖∶Na2SeO3=1∶1, 40 mL 0.6%(质量分数)硝酸, BaCl2, 65 ℃, 8 h-84.7→29.63 290[24]黄牛肝菌伞多糖0.2 g多糖∶Na2SeO3=1∶1, 100 mL 0.5%(质量分数)硝酸, 1.0 g BaCl2, 70 ℃, 7 h-9.4→8.31 620[25]低分子果胶1 g多糖∶Na2SeO3=1∶1, 100 mL 0.5%(质量分数)硝酸, 240 W, 75 ℃, 6 h鼠李糖∶阿拉伯糖∶半乳糖∶葡萄糖∶木糖∶半乳糖醛酸=2.92∶0.46∶5.16∶0.97∶3.71∶67.39→1.49∶0.55∶9.59∶2.60∶3.1∶75.345.16→8.91105.44[26]冬凌草多糖0.2 g多糖∶Na2SeO3=1∶1, 20 mL 0.5%(质量分数)硝酸, 100 mg BaCl2, 70 ℃, 6 h甘露糖∶葡萄糖∶半乳糖∶木糖∶阿拉伯糖=2.27∶4.65∶2.57∶1.00∶1.85→2.41∶4.24∶2.90∶1.00∶1.93-1 350[27]南瓜多糖5 g多糖∶Na2SeO3=1∶0.8, 250 mL 0.8%(质量分数)硝酸, 7 g BaCl2, 70 ℃, 8 h--215.7[28]金樱子多糖0.5 g多糖∶Na2SeO3=1∶0.8, 0.5%(质量分数)稀硝酸, 70 ℃, 8 h-137.1→82.2862[29]灰树花多糖0.03 g多糖∶Na2SeO3=1∶0.8, 0.7%(质量分数)稀硝酸, 40 mg BaCl2, 70 ℃, 6 h--445.39[30]
续表2
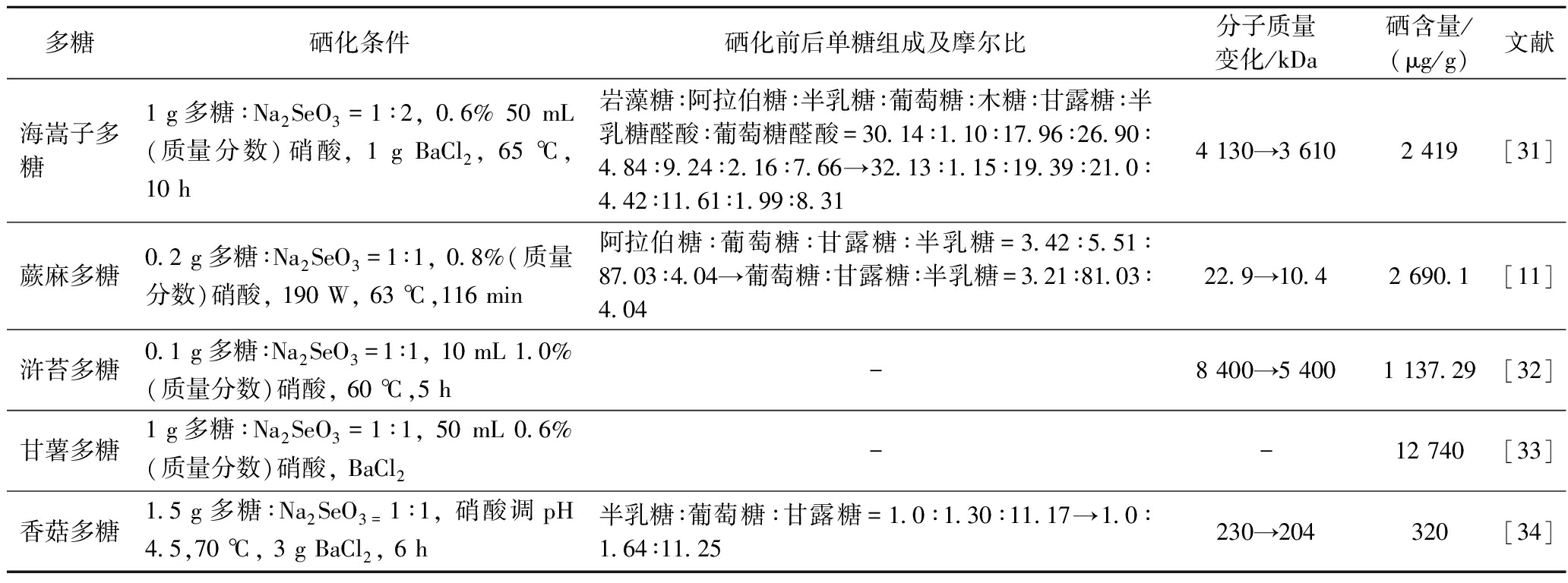
多糖硒化条件硒化前后单糖组成及摩尔比分子质量变化/kDa硒含量/ (μg/g)文献海嵩子多糖1 g多糖∶Na2SeO3=1∶2, 0.6% 50 mL(质量分数)硝酸, 1 g BaCl2, 65 ℃,10 h岩藻糖∶阿拉伯糖∶半乳糖∶葡萄糖∶木糖∶甘露糖∶半乳糖醛酸∶葡萄糖醛酸=30.14∶1.10∶17.96∶26.90∶4.84∶9.24∶2.16∶7.66→32.13∶1.15∶19.39∶21.0∶4.42∶11.61∶1.99∶8.314 130→3 6102 419[31]蕨麻多糖0.2 g多糖∶Na2SeO3=1∶1, 0.8%(质量分数)硝酸, 190 W, 63 ℃,116 min阿拉伯糖∶葡萄糖∶甘露糖∶半乳糖=3.42∶5.51∶87.03∶4.04→葡萄糖∶甘露糖∶半乳糖=3.21∶81.03∶4.0422.9→10.42 690.1[11]浒苔多糖0.1 g多糖∶Na2SeO3=1∶1, 10 mL 1.0%(质量分数)硝酸, 60 ℃,5 h-8 400→5 4001 137.29[32]甘薯多糖1 g多糖∶Na2SeO3=1∶1, 50 mL 0.6%(质量分数)硝酸, BaCl2--12 740[33]香菇多糖1.5 g多糖∶Na2SeO3=1∶1, 硝酸调pH 4.5,70 ℃, 3 g BaCl2, 6 h半乳糖∶葡萄糖∶甘露糖=1.0∶1.30∶11.17→1.0∶1.64∶11.25230→204320[34]
注:-:未检测到。
3 硒化对多糖结构、物理性质和生理功能的影响
3.1 硒化修饰对天然多糖结构的影响
3.1.1 硒化修饰对天然多糖分子质量的影响
不同硒化修饰方法对多糖分子质量影响不同,如SOC法硒化多糖分子质量降低程度小于NA-SS法,因为NA-SS法中大量使用HNO3,反应体系为强酸性环境,导致硒化天然多糖的分子质量急剧下降,而SOC法反应条件相对温和,能有效地避免分子质量急剧下降。如SOC法硒化白沙蒿多糖的分子质量比HNO3/Na2SeO3法降幅要小[3]。但SOC法在极端反应条件如长时间高温反应也会导致天然多糖链降解从而使分子质量降低,如白沙蒿多糖随硒化时间从2 h延长至3 h,硒化多糖分子质量从86.9 kDa降至29.1 kDa,降幅66.51%,且分子质量降低程度与反应温度呈正相关。
相同的硒化方法对不同来源多糖分子质量的影响有差异,如目前使用较多NA-SS法,一般硒化温度越高、时间越长,分子质量降幅越大,但不同来源的天然多糖,硒化后分子质量降幅不同。如慈姑多糖硒化后相对分子质量由47.12 kDa降至16.82 kDa[23],降幅为64.3%;苜蓿多糖硒化后分子质量由15.8降到11.0 kDa[17],降幅为29.4%;黄牛肝菌伞多糖硒化后分子质量从9.4 kDa降为8.2 kDa[25],降幅为12.77%。马尾藻多糖、甘草多糖硒化前后分子质量分别由4 130降至1 630 kDa[31]、38降至5.8 kDa[35],分别降低了60.53%、84.74%。但由表1可以看出果胶类多糖硒化后分子质量会增加,如榆树果胶多糖,随多糖与亚硒酸钠质量比的增加,硒化后分子质量增加;党参果胶多糖硒化后分子质量由145 kDa增至195 kDa,分子质量增幅为34.48%。玉米芯多糖在温和条件下硒化后分子质量由78.9 kDa增至90.2 kDa,增幅为14.32%[36]。
硒化对天然多糖分子质量的影响受多种因素的影响,据报道相同硒化条件下, 48.6、20.2和11.8 kDa 平菇多糖硒化后分子质量分别为19.6、37.7、14.5 kDa[18]。由此可见,同种植物来源的不同分子质量的多糖硒化后分子质量有上升也有下降,且变幅随天然多糖分子质量的变化而异。此外硒化时的加热方式,同种硒化方法不同的加热方式会影响多糖分子质量的变化,如采用微波加热硒化白沙蒿多糖,分子质量呈逐级递增趋势,10~60 min内硒化白沙蒿多糖的分子质量从113.9 kDa递增到331.3 kDa[3]。同样当用微波辅助硒化冬虫夏草多糖时,分子质量从10 kDa增到10 000 kDa,尤其当微波功率700 W、微波处理25 min时硒化冬虫夏草多糖分子质量最高可达54 500 kDa[37]。微波辅助硒化黄芪多糖也发现,多糖分子质量从7.65 kDa增至51.36 kDa[38]。可能是微波效应引起的电场与极性分子相互作用的结果,微波辐射时能量与分子之间的相互作用速率非常快,通过选择性吸收导致分子直接耦合。GALEMA[39]的研究也证实了这一结果,即微波效应导致极性极化键(如C—O—C糖苷键),增加分子反应性。
3.1.2 硒化修饰对天然多糖的单糖组成的影响
硒化会影响多糖中糖醛酸含量,但变幅差异很大。如ZHU等[40]发现酸性条件下硒化糖醛酸几乎全部被破坏,如茶多糖硒化后糖醛酸由11.27%降至0.02%。但慈姑多糖硒化后糖醛酸含量由(1.13±0.31)%增至(1.78±0.15)%[23],而党参果胶多糖硒化前后糖醛酸含量分别为78%和77%,这与海蒿子多糖硒化过程中糖醛酸含量变化不一致[32]。
硒化对多糖单糖组成的影响比较复杂,一般硒化不会改变单糖种类,但会改变单糖比例,如蒲公英根多糖经硒化后半乳糖含量升高,葡萄糖含量降低[22],海蒿子多糖硒化后半乳糖由17.96%增至19.39%,而葡萄糖由26.90%降至21.00%。长根菇多糖经硒化后半乳糖含量反而降低,葡萄糖含量升高[41-42],小麦麸皮水溶性多糖硒化后葡萄糖和半乳糖的变化同长根菇多糖,但小麦麸皮碱溶性多糖硒化后葡萄糖和半乳糖含量同时显著上升[43]。硒化除了会影响半乳糖和葡萄糖含量外,也会影响到其它单糖,如慈姑多糖硒化显著降低了葡萄糖、木糖和甘露糖含量,但鼠李糖、阿拉伯糖、半乳糖摩尔比增加[23]。此外香菇多糖硒化后半乳糖含量变化不大,而甘露糖、葡萄糖含量均上升[12]。除此之外硒化有时改变单糖种类及其比例,如黄牛肝菌伞多糖硒化后单糖组成为半乳糖(51.30%)、葡萄糖(34.22%)和甘露糖(13.48%),天然多糖中阿拉伯糖在硒化修饰过程中丢失,可能是因为较强的酸性环境破坏了多糖的结构,部分支链被降解成单糖或者寡糖,后续透析过程中被除去,从而导致单糖组成减少。
3.1.3 硒化对多糖的分子构象的影响
多糖的分子链构象包括单糖构象、单糖的相对位置、柔顺性和空间结构,多糖的高分子链模型包括棒状链、球状链、无规线团及蠕虫状链,其中蠕虫状链包括单螺旋、双螺旋,三螺旋链、半刚性及刚性链[44],具体见图3。硒化可能会破坏多糖的分子内和分子间氢键,从而影响多糖的分子构象。如小麦麸皮多糖为三螺旋结构且多分支,硒化时的酸性环境会使小麦麸皮多糖的部分三股螺旋结构展开,导致其三股螺旋结构减弱[43],同时硒化红芪多糖也破坏了天然多糖的有序螺旋结构[24]。但LIU等[14]发现低程度硒化会使多糖三股螺旋结构更加稳定,硒化程度高的将导致多糖三股螺旋结构消失,如低硒(1 180±30) μg/g、中硒含量(1 480±130) μg/g的梭柄松苞菇多糖可保持天然多糖的三螺旋结构,而硒化程度高的硒含量为(1 830±40) μg/g则丧失了三螺旋结构,因此一定数量的硒酸基团可能会导致高度有序的链构象,过度硒化可能破坏梭柄松苞菇多糖的三螺旋结构。
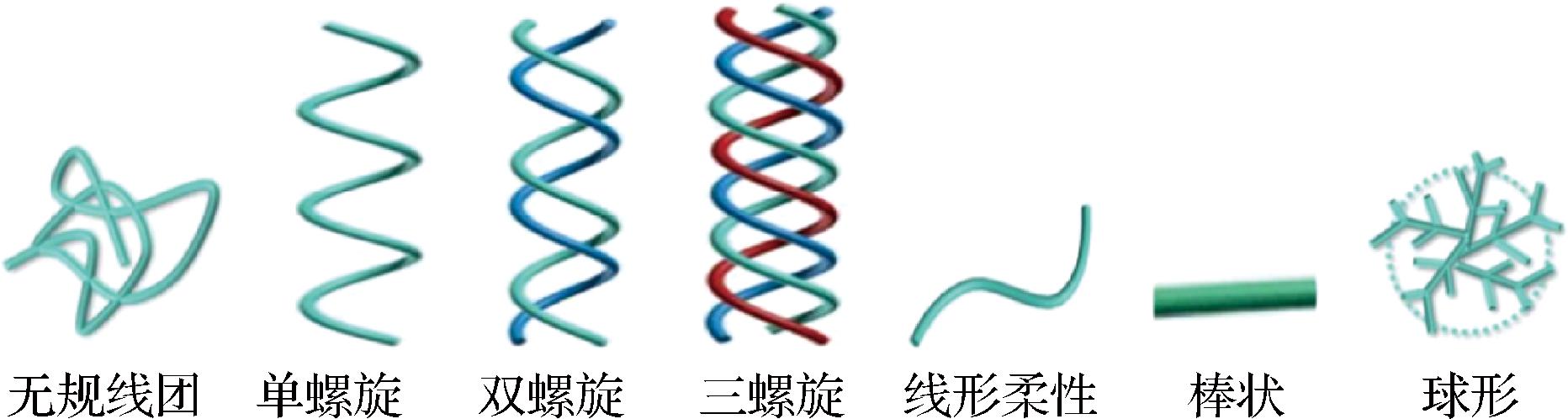
图3 多糖的高分子链模型[44]
Fig.3 The polymer chain model of polysaccharides
3.2 硒化修饰对多糖物理性质的影响
LYU等[32]通过扫描电镜发现天然多糖表面呈现许多粗糙的片状结构,硒化后则呈现出许多不规则的小孔隙,可能是酸水解所致,HUANG等[20]也观察到了此变化。因此硒化修饰可使多糖表面结构更为破碎、粗糙,这些变化对硒化多糖的溶解性、结晶度和热特性等会带来系列影响。
天然多糖及其硒化修饰多糖均为半结晶物质,硒化使多糖的结晶度降低,且降低程度与硒化效果成正相关。硒化红芪多糖与天然多糖均是一种半晶物质,在2θ=22.5 °处有晶体衍射,但硒化使衍射峰的2θ向更大值偏移[24],具体见图4-a。大蒜多糖的XRD曲线也表明,硒化大蒜多糖更倾向于单晶形态,但衍射吸收峰较弱,表明它们大部分仍为多晶和无定形[8],且由图4-b可以看出,随着多糖硒化程度的增加,XRD的衍生峰强度逐渐减弱,说明其结晶度逐渐下降。硒化多糖表面形态和结晶度的改变导致其溶解度、溶胀能力、柔韧性和抗拉强度等理化性质随之变化[24]。WANG等[45]发现随着硒化黑加仑多糖硒含量增加,溶解度由13.09 mg/mL增至(19.66±0.28)、(20.83±0.56)和(26.77±0.53) mg/mL[19],元蘑多糖硒化后溶解度也得到了提高。
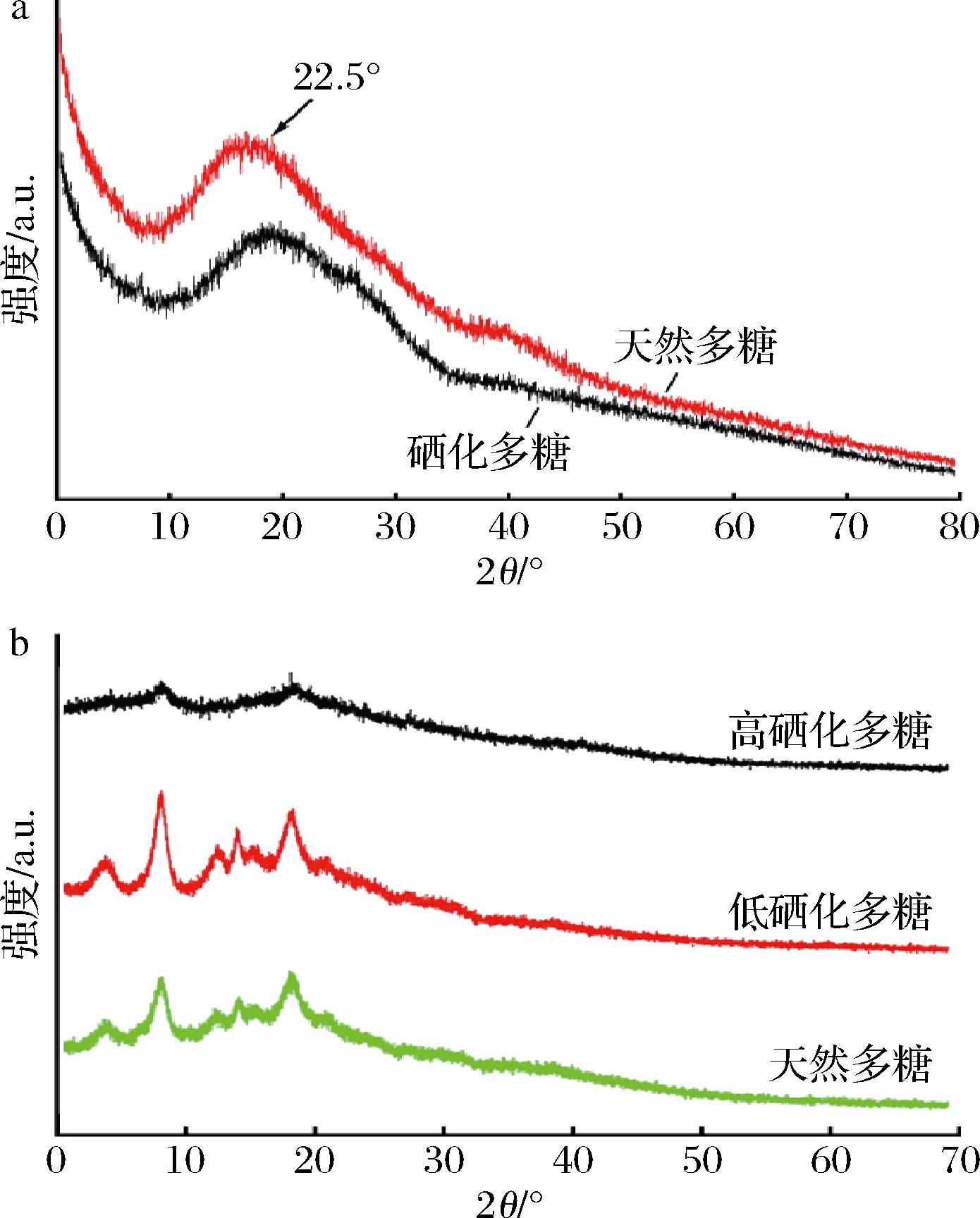
a-天然红芪多糖及其硒化多糖的XRD;b-天然大蒜多糖及不同硒化度大蒜多糖的XRD
图4 天然多糖及其硒化多糖的XRD[24,46]
Fig.4 XRD of natural polysaccharides and their selenide polysaccharides
一般地多糖硒化修饰程度越高热稳定性越低,天然多糖及其硒化多糖表现为三步热分解模式,第一阶段(Ⅰ区)100 ℃左右,减重约10%,第二阶段(Ⅱ区)200~300 ℃,为主要减重阶段,由图5的TGA曲线可以看出,此阶段多糖重量急剧下降,同时伴随着吸热反应;第三阶段(Ⅲ区)450~600 ℃,减重约5%。由图5的DSC曲线可以看出,在Ⅰ区和Ⅱ区,硒化程度越高降解所需的热流强度越小,即多糖越易分解。如黑加仑多糖的TGA曲线显示硒化黑加仑多糖较天然多糖质量减少7.81%~10.22%,且随着含硒量增加,重量随温度损失越多;天然黑加仑多糖的热流强度较硒化多糖多0.5~0.93 μV/mg[19]。硒化大蒜多糖的3次分解温度比天然多糖低30~50 ℃,说明硒化大蒜多糖更易分解。GAO等[8]也发现硒化多糖比多糖更易分解,水分蒸发较早;在450 ℃时,硒含量最多的多糖比不含硒多糖质量减少10.11%。芡实、紫花苜蓿茎硒化多糖较多糖热稳定性同样有所降低[46-47],GAO等[48]和LYU等[49]实验结果与此一致。硒化多糖热稳定性下降的原因主要有以下3个方面:一硒化修饰破坏多糖结构和表面形貌,使其结晶度降低,导致热稳定性变差;二是C—O键与多糖的—OH亚硒酸化后,使C—O键稳定性降低;三硒化多糖—OH与H2SeO3形成硒基,相对较高的温度会使硒基偏离,导致硒化多糖更快降解。
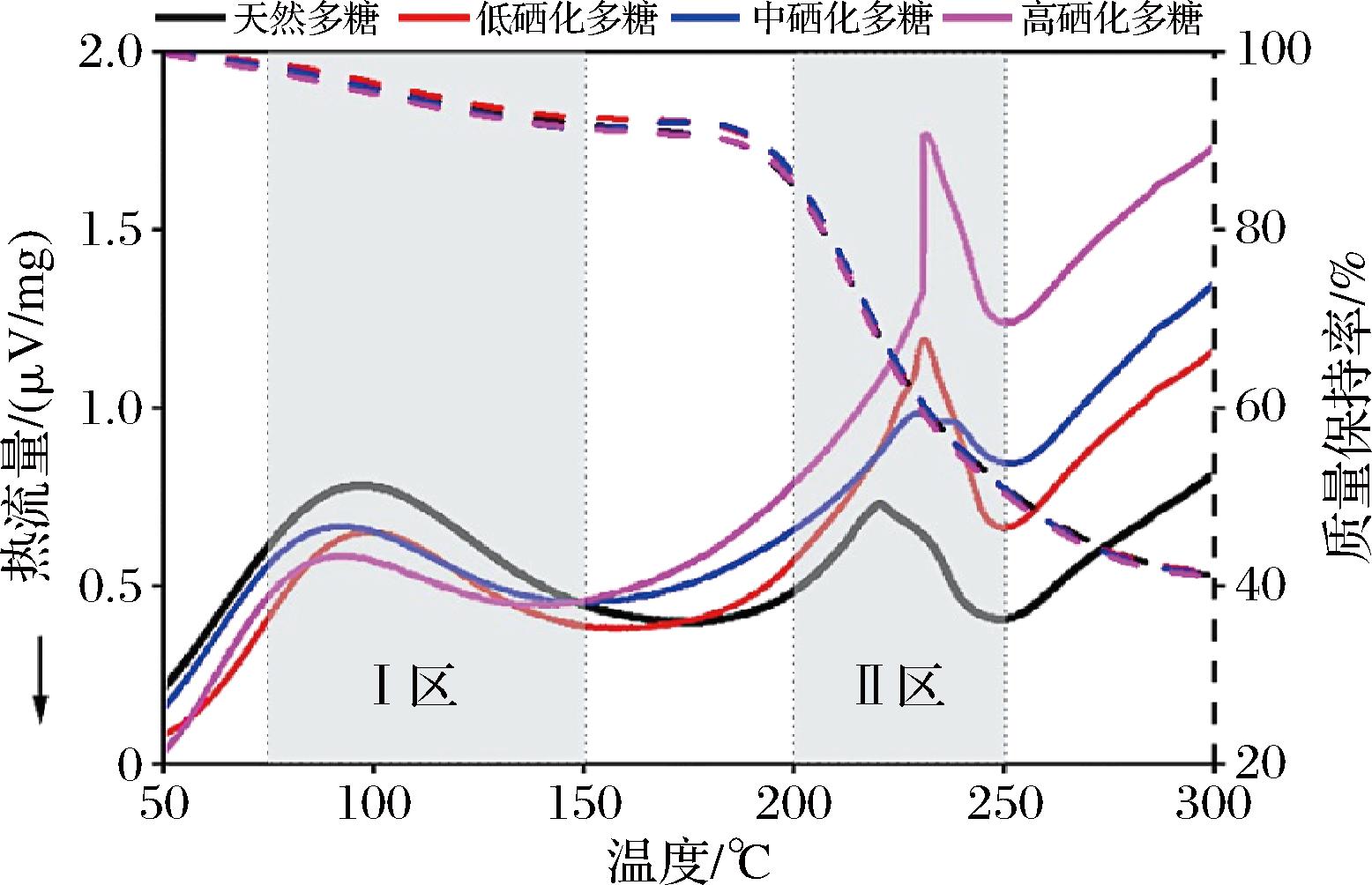
图5 天然多糖及其硒化多糖的TGA和DSC曲线[19]
Fig.5 The TGA and DSC of natural polysaccharides and their selenide polysaccharides
3.3 硒化修饰对天然多糖生理活性的影响
天然多糖本身具有一定的抗氧化、抗癌、提高免疫力等生理活性,而硒化修饰可使其生理活性明显提高[50-52]。XIAO 等研究发现5 mg/mL的海蒿子多糖硒化后对ABTS自由基的清除率由90.9%增至93.4%[33]。0.2 mg/mL的白沙篙多糖硒化后对O2-·清除率由46.37%增至71.95%[3]。2.5 mg/mL的蒲公英根多糖、低硒化(170±1.13)μg/g、高硒化(710±4.00)μg/g多糖对DPPH自由基清除率为(26.20±1.15)%、(33.08±1.24)%、(56.03±1.46)%,对·OH清除率为(36.53±1.28)%、(66.35±1.25)%、(86.20±1.23)%[22]。硒化枸杞多糖对·OH和O2-·清除率最高可达62.01%和59.78%,均高于枸杞多糖的42.69%和38.40%[15],平菇、香菇、芡实、冬凌草、枸杞多糖硒化后的抗氧化能力均有相似报道。以上结果说明硒化多糖比天然多糖具有更高的自由基清除能力,硒含量高的多糖显示较高的抗氧化能力,可能是硒以硒基或硒酸酯基的形式存在于硒化多糖中,新基团的加入降低了氢键的解离能提高了供氢能力,而供氢能力越强抗氧化活性越强;此外硒化多糖中—OSeO2H基团可以激活异头碳氢原子,从而提高清除自由基的能力[53]。
FENG等[53]发现川明参多糖硒化后可显著提高脾细胞增殖和IL-4和IFN-γ的产生,且硒化多糖更显著(IL-4达到250 pg/mL、IFN-γ达到800 pg/mL以上),CD4+IL-4、CD4+IL-2、CD8+ IFN-γ刺激因子分别增加0.19%、0.10%、0.54%。LI等[54-55]将淫羊藿和板蓝根硒化多糖注射到患病鸡体内,发现硒化多糖更能提高血清抗体水平。
此外,硒化多糖的抑癌效果普遍由于天然多糖的,如100.00 μm/mL的苜蓿多糖硒化前后对人结肠癌细胞(HT-29)抑制率由19.81%增至38.70%[56,13]。400 μg/mL党参果胶多糖硒化前后对A549抑制率分别为59.1%和79.6%,对胃腺癌细胞(BGC-823)抑制率分别为50.7%和63.2%,对HeLa细胞抑制率分别为49.4%和60.6%[49]。此外31.25 μg/mL的蒲公英根多糖、低硒化、高硒化多糖显著提高了H2O2诱导的RAW264.7细胞的存活率,细胞活力分别为(67.45±4.32)%、(71.71±2.70)%、(90.21±5.91)%。硒化枇杷多糖对HepG2、A549有明显抑制作用,在斑马鱼异种移植模型中,硒化多糖较对照组癌细胞增殖较慢[56]。此外在50~400 μg/mL时,天然白沙蒿多糖未表现出明显的癌细胞抗增殖活性和剂量依赖特征,但硒化修饰后抑制H1975和A549细胞的IC50值分别为654.69和326.60 μg/mL。由此可见,硒化修饰可显著提高天然多糖的抗癌活性。
3.4 硒化多糖构效关系机制研究
近年科学家们相继发现多糖及其衍生物的结构、分子尺寸和链构象对其抗氧化、抗癌等具有非常重要的影响,而硒化修饰多糖生理活性改变的机制也引起了众多关注。
首先,就硒化多糖的分子构象而言,如具有三螺旋结构的梭柄松苞菇多糖,增加硒含量可增强小鼠抗糖尿病活性,但随着硒化温度增加、时间延长和硒化用酸的增加导致天然多糖三螺旋结构损伤反而削弱了其抗糖尿病活性,这说明硒化多糖的三螺旋结构对其生理活性可能起主导作用[14]。
其次,硒化多糖分子质量能显著影响其生理活性,据报道由于分子质量较小的多糖支链可能更多,暴露的还原端相对较多,更适合与自由基结合[57-58],因此抗氧化能力相对较强。GAO等发现,硒含量相近时,11.00 kDa的比15.80 kDa的硒化多糖具有更好的抗氧化活性。48.6、20.2和11.8 kDa的平菇多糖及硒化多糖清除·OH的IC50分别为0.69、5.70、0.12和0.33、3.62和0.19 mg/mL,硒化后抗氧化能力分别提高了52.17%、36.49%、-58.33%[18],11.8 kDa的平菇多糖硒化后对·OH的清除能力反而减弱,可能是因为硒化修饰后其分子质量由11.8 kDa增至14.5 kDa。
另外,硒化多糖的硒含量可能是影响其生理活性的关键因素之一,YUAN等[33]在体外实验中发现,硒化甘薯多糖的抗肿瘤活性随硒含量的增加而增加。蒲公英根多糖、低硒化(170±1.13) μg/g和高硒化(710±4) μg/g的分子质量分别为8.70、7.90和5.60 kDa,天然多糖和硒化多糖分子质量差异不大,唯一显著差异的是硒含量,高硒比低硒化的具有更好的抗氧化活性和免疫增强活性,2.5 mg/mL三种多糖对DPPH自由基清除率为(26.20±1.15)%、(33.08±1.24)%、(56.03±1.46)%,对·OH清除率为(36.53±1.28)%、(66.35±1.25)%、(86.20±1.23)%。说明硒在提高硒化多糖的生物活性方面起着更为关键的作用。
硒化多糖的硒含量与分子质量对其生理功能具有协同作用,如制备硒含量18 671 μg/g、分子质量29.5 kDa和4 879 μg/g、分子质量331.3 kDa的两种硒化白沙蒿多糖,二者对HepG2细胞48 h后抑制率分别为76.81%和67.50%,IC50分别为24.35、78.97 μg/mL,表明高Se、低分子质量的硒化多糖抑制效果要优于低硒高分子质量的[3]。
硒化多糖的分支度过低或过高都会导致活性降低[59],如3种不同分子质量的蛹虫草硒多糖具有相似的单糖组成、硒含量,其中分支高的多糖硒化效果好,且硒含量较高的多糖对肿瘤细胞的抑制效果更佳[60]。
4 总结
多糖的硒化修饰不仅在硒与多糖之间形成了一定的化学键,而且改变了天然多糖的部分结构和本身的性质,包括单糖组成、分子质量、分子构象,且改变程度因硒化方法、硒化条件和天然多糖种类而异。因为硒化修饰对天然多糖结构影响的复杂性,导致其生理活性提高的机制研究并不深入。硒化多糖的分子构象、硒含量、分子质量、分支度等因素对其生理活性的影响机制虽有一些相关报告,但是这些因素的协同影响尚需进一步研究。此外影响硒化多糖的抗氧化、抗癌和免疫增强活性的主导因素尚不明确,仍需进一步探索。
[1] AHMAD M M.Recent trends in chemical modification and antioxidant activities of plants-based polysaccharides:A review[J].Carbohydrate Polymer Technologies and Applications, 2021, 2:100045.
[2] YANG W J, HUANG G L, HUANG H L.Preparation and structure of polysaccharide selenide[J].Industrial Crops and Products, 2020, 154:112630.
[3] ZHU S Y, HU J H, LIU S, et al.Synthesis of Se-polysaccharide mediated by selenium oxychloride:Structure features and antiproliferative activity[J].Carbohydrate Polymers, 2020, 246:116545.
[4] 景永帅, 张钰炜, 李佳瑛, 等.硒多糖的合成方法、结构特征和生物活性研究进展[J].食品工业科技, 2021, 42(7):374-381.JING Y S, ZHANG Y W, LI J Y, et al.Research progress of synthesis methods, structural characteristics and biological activities of selenium polysaccharides[J].Science and Technology of Food Industry, 2021, 42(7):374-381.
[5] 钟泽梁, 洪碧红, 肖美添, 等.多糖纳米硒的制备、功能和在食品领域应用的研究进展[J].食品科学, 2023, 44(19):308-319.ZHONG Z L, HONG B H, XIAO M T, et al.Preparation, functions and food application of polysaccharide-selenium nanoparticles:A review[J].Food Science, 2023, 44(19):308-319.
[6] BO R N, JI X, YANG H F, et al.The characterization of optimal selenized garlic polysaccharides and its immune and antioxidant activity in chickens[J].International Journal of Biological Macromolecules, 2021, 182:136-143.
[7] 林晓芝, 黎永铭, 唐渝.羧酸硒醚、二硒醚及相应硒多糖的合成[J].化学世界, 2009, 50(1):40-43;53.LIN X Z, LI Y M, TANG Y.Syntheses of carboxylic selenides, diselenides and their seleno-polysaccharides[J].Chemical World, 2009, 50(1):40-43;53.
[8] GAO Z Z, CHEN J, QIU S L, et al.Optimization of selenylation modification for garlic polysaccharide based on immune-enhancing activity[J].Carbohydrate Polymers, 2016, 136:560-569.
[9] 杨文. 三种多糖的硒化修饰、结构表征及体外抑制肿瘤细胞的研究[D].兰州:西北师范大学, 2017.YANG W.Study on Selenium Modification, Structural Characterization and Inhibition of Tumor Cells in Vitro of Three Polysaccharides[D].Lanzhou:Northwest Normal University, 2017.[10] LI R, QIN X J, LIU S, et al.[HNMP]HSO4 catalyzed synthesis of selenized polysaccharide and its immunomodulatory effect on RAW264.7 cells via MAPKs pathway[J].International Journal of Biological Macromolecules, 2020, 160:1066-1077.
[11] ZHAO B T, ZHANG J, YAO J, et al.Selenylation modification can enhance antioxidant activity of Potentilla anserina L.polysaccharide[J].International Journal of Biological Macromolecules, 2013, 58:320-328.
[12] 任广明. 香菇多糖的硒化及其对慢性胰腺炎小鼠肠道菌群的影响[D].哈尔滨:东北农业大学, 2016.REN G M.Selenium of lentinan and its effect on intestinal flora in mice with chronic pancreatitis[D].Harbin:Northeast Agricultural University, 2016.
[13] LEE J H, LEE Y K, CHANG Y H.Effects of selenylation modification on structural and antioxidant properties of pectic polysaccharides extracted from Ulmus pumila L[J].International Journal of Biological Macromolecules, 2017, 104:1124-1132.
[14] LIU Y T, YOU Y X, LI Y W, et al.The characterization, selenylation and antidiabetic activity of mycelial polysaccharides from Catathelasma ventricosum[J].Carbohydrate Polymers, 2017, 174:72-81.
[15] QIU S L, CHEN J, CHEN X, et al.Optimization of selenylation conditions for lycium barbarum polysaccharide based on antioxidant activity[J].Carbohydrate Polymers, 2014, 103:148-153.
[16] CHEN W X, CHEN J Y, WU H M, et al.Optimization of selenylation conditions for a pectic polysaccharide and its structural characteristic[J].International Journal of Biological Macromolecules, 2014, 69:244-251.
[17] LIU X G, XU S S, DING X D, et al.Structural characteristics of Medicago Sativa L.Polysaccharides and Se-modified polysaccharides as well as their antioxidant and neuroprotective activities[J].International Journal of Biological Macromolecules, 2020, 147:1099-1106.
[18] WANG L, ZHANG P Z, SHEN J W, et al.Physicochemical properties and bioactivities of original and Se-enriched polysaccharides with different molecular weights extracted from Pleurotus ostreatus[J].International Journal of Biological Macromolecules, 2019, 141:150-160.
[19] ZHAO M M, BAI J W, BU X Y, et al.Characterization of selenized polysaccharides from Ribes nigrum L.and its inhibitory effects on α-amylase and α-glucosidase[J].Carbohydrate Polymers, 2021, 259:117729.
[20] HUANG F, SUN X Y, OUYANG J M.Preparation and characterization of selenized Astragalus polysaccharide and its inhibitory effect on kidney stones[J].Materials Science and Engineering:C, 2020, 110:110732.
[21] QIN T, REN Z, HUANG Y F, et al.Selenizing Hericium erinaceus polysaccharides induces dendritic cells maturation through MAPK and NF-κB signaling pathways[J].International Journal of Biological Macromolecules, 2017, 97:287-298.
[22] WANG L B, LI L Y, GAO J Y, et al.Characterization, antioxidant and immunomodulatory effects of selenized polysaccharides from dandelion roots[J].Carbohydrate Polymers, 2021, 260:117796.
[23] FENG Y Q, QIU Y J, DUAN Y Q, et al.Characterization, antioxidant, antineoplastic and immune activities of selenium modified Sagittaria sagittifolia L.polysaccharides[J].Food Research International, 2022, 153:110913.
[24] WEI D F, CHEN T, YAN M F, et al.Synthesis, characterization, antioxidant activity and neuroprotective effects of selenium polysaccharide from Radix hedysari[J].Carbohydrate Polymers, 2015, 125:161-168.
[25] 刘韫滔, 李林键, 李诚, 等.两种富硒黄牛肝菌伞多糖的制备、表征及其抗氧化活性[J].食品科学, 2022, 43(7):31-37.LIU Y T, LI L J, LI C, et al.Preparation, characterization and antioxidant activity of two selenium-enriched polysaccharides from Suillellus luridus[J].Food Science, 2022, 43(7):31-37.
[26] 陶雯, 张瑞, 杨宁, 等.硒化低分子果胶的制备与结构表征及抗氧化活性[J].食品科学, 2022, 43(12):66-73.TAO W, ZHANG R, YANG N, et al.Preparation, structure characterization and antioxidant activity of selenylated low-molecular-mass pectin[J].Food Science, 2022, 43(12):66-73.
[27] 程爽, 贺斐, 付龙洋, 等.冬凌草硒多糖的制备及其抗氧化活性分析[J].精细化工, 2021, 38(10):2064-2071.CHENG S, HE F, FU L Y, et al.Preparation of selenium polysaccharide from Rabdosia rubescens and analysis of its antioxidant activity[J].Fine Chemicals, 2021, 38(10):2064-2071.
[28] 商龙臣, 吴少魏, 张驰, 等.南瓜硒多糖的制备表征及活性分析[J].食品科学, 2016, 37(19):48-53.SHANG L C, WU S W, ZHANG C, et al.Preparation, characterization and activity analysis of selenium-containing pumpkin polysaccharide[J].Food Science, 2016, 37(19):48-53.
[29] ZHAN Q P, CHEN Y, GUO Y F, et al.Effects of selenylation modification on the antioxidative and immunoregulatory activities of polysaccharides from the pulp of Rose laevigata Michx fruit[J].International Journal of Biological Macromolecules, 2022, 206:242-254.
[30] LI Q, ZHU L F, QI X P, et al.Immunostimulatory and antioxidant activities of the selenized polysaccharide from edible Grifola frondosa[J].Food Science &Nutrition, 2022, 10(4):1289-1298.
[31] XIAO H, CHEN C, LI C, et al.Physicochemical characterization, antioxidant and hypoglycemic activities of selenized polysaccharides from Sargassum pallidum[J].International Journal of Biological Macromolecules, 2019, 132:308-315.
[32] LYU H T, DUAN K, SHAN H.Selenylation modification of degraded polysaccharide from Enteromorpha prolifera and its biological activities[J].Journal of Ocean University of China, 2018, 17(2):445-450.
[33] YUAN B, YANG X Q, KOU M, et al.Selenylation of polysaccharide from the sweet potato and evaluation of antioxidant, antitumor, and antidiabetic activities[J].Journal of Agricultural and Food Chemistry, 2017, 65(3):605-617.
[34] REN G M, LI K K, HU Y, et al.Optimization of selenizing conditions for Seleno-Lentinan and its characteristics[J].International Journal of Biological Macromolecules, 2015, 81:249-258.
[35] LIAN K X, ZHU X Q, CHEN J, et al.Selenylation modification:Enhancement of the antioxidant activity of a Glycyrrhiza uralensis polysaccharide[J].Glycoconjugate Journal, 2018, 35(2):243-253.
[36] WANG Z L, WANG X, XIU W Y, et al.Characteristics of selenium polysaccharide from sweet corncob and its effects on non-enzymatic glycosylation in vivo[J].Applied Biological Chemistry, 2022, 65(1):10.
[37] CHEONG K L, WANG L Y, WU D T, et al.Microwave-assisted extraction, chemical structures, and chain conformation of polysaccharides from a novel Cordyceps sinensis fungus UM01[J].Journal of Food Science, 2016, 81(9):C2167-C2174.
[38] YUE L Q, SONG X X, CUI X, et al.Synthesis, characterization, and evaluation of microwave-assisted fabricated selenylation Astragalus polysaccharides[J].International Journal of Biological Macromolecules, 2022, 221:8-15.
[39] GALEMA S A.Microwave chemistry[J].Chemical Society Reviews, 1997, 26(3):233.
[40] ZHU J X, YU C, HAN Z, et al.Comparative analysis of existence form for selenium and structural characteristics in artificial selenium-enriched and synthetic selenized green tea polysaccharides[J].International Journal of Biological Macromolecules, 2020, 154:1408-1418.
[41] GAO Z, LI J, SONG X L, et al.Antioxidative, anti-inflammation and lung-protective effects of mycelia selenium polysaccharides from Oudemansiella radicata[J].International Journal of Biological Macromolecules, 2017, 104:1158-1164.
[42] GAO Z, ZHANG C, TIAN C Y, et al.Characterization, antioxidation, anti-inflammation and renoprotection effects of selenized mycelia polysaccharides from Oudemansiella radicata[J].Carbohydrate Polymers, 2018, 181:1224-1234.
[43] 吕青青. 小麦麸皮多糖的结构表征、硒化改性及生理活性研究[D].合肥:合肥工业大学, 2020.LYU Q Q.Structural characterization, selenium modification and physiological activity of wheat bran polysaccharide[D].Hefei:Hefei University of Technology, 2020.
[44] 张继贤. 亚临界水萃取温度对香菇多糖化学结构、链构象转变及生物活性的影响研究[D].镇江:江苏大学, 2020.ZHANG J X.Effect of subcritical water extraction temperature on chemical structure, chain conformation transition and biological activity of lentinan[D].Zhenjiang:Jiangsu University, 2020.
[45] WANG L, LI X Y, WANG B B.Synthesis, characterization and antioxidant activity of selenium modified polysaccharides from Hohenbuehelia serotina[J].International Journal of Biological Macromolecules, 2018, 120:1362-1368.
[46] DONG F, ZHENG H Z, JEONG W S, et al.Synthesis, characterization, and antioxidant activity in vitro of selenium-Euryale ferox Salisb.polysaccharide[J].Applied Biological Chemistry, 2021, 64(1):59.
[47] CHEN L, LIU J, ZHANG Y Q, et al.Structural, thermal, and anti-inflammatory properties of a novel pectic polysaccharide from alfalfa (Medicago sativa L.) stem[J].Journal of Agricultural and Food Chemistry, 2015, 63(12):3219-3228.
[48] GAO P Y, BIAN J, XU S S, et al.Structural features, selenization modification, antioxidant and anti-tumor effects of polysaccharides from alfalfa roots[J].International Journal of Biological Macromolecules, 2020, 149:207-214.
[49] LYU H T, GAO Y J, SHAN H, et al.Preparation and antibacterial activity studies of degraded polysaccharide selenide from Enteromorpha prolifera[J].Carbohydrate Polymers, 2014, 107:98-102.
[50] LI J, SHEN B X, NIE S L, et al.A combination of selenium and polysaccharides:Promising therapeutic potential[J].Carbohydrate Polymers, 2019, 206:163-173.
[51] DUAN W X, YANG X H, ZHANG H F, et al.Chemical structure, hypoglycemic activity, and mechanism of action of selenium polysaccharides[J].Biological Trace Element Research, 2022, 200(10):4404-4418.
[52] ZHOU N, LONG H R, WANG C H, et al.Research progress on the biological activities of selenium polysaccharides[J].Food &Function, 2020, 11(6):4834-4852.
[53] FENG H B, FAN J, BO H Q, et al.Selenylation modification can enhance immune-enhancing activity of Chuanminshen violaceum polysaccharide[J].Carbohydrate Polymers, 2016, 153:302-311.
[54] LI X P, HOU R R, YUE C J, et al.The selenylation modification of Epimedium polysaccharide and Isatis root polysaccharide and the immune-enhancing activity comparison of their modifiers[J].Biological Trace Element Research, 2016, 171(1):224-234.
[55] 李秀萍. 硒化淫羊藿多糖和硒化板蓝根多糖增强免疫和抗氧化活性的研究[D].南京:南京农业大学, 2015.LI X P.Study on the immune and antioxidant activities of selenium-enriched epimedium polysaccharide and selenium-enriched radix isatidis polysaccharide[D].Nanjing:Nanjing Agricultural University, 2015.
[56] ZHANG S J, ZHANG H, SHI L J, et al.Structure features, selenylation modification, and improved anti-tumor activity of a polysaccharide from Eriobotrya japonica[J].Carbohydrate Polymers, 2021, 273:118496.
[57] CHENG L Z, WANG Y F, HE X X, et al.Preparation, structural characterization and bioactivities of Se-containing polysaccharide:A review[J].International Journal of Biological Macromolecules, 2018, 120:82-92.
[58] WANG J L, ZHAO B T, WANG X F, et al.Synthesis of selenium-containing polysaccharides and evaluation of antioxidant activity in vitro[J].International Journal of Biological Macromolecules, 2012, 51(5):987-991.
[59] G RSKA S, MAKSYMIUK A, TUR
RSKA S, MAKSYMIUK A, TUR O J.Selenium-containing polysaccharides—Structural diversity, biosynthesis, chemical modifications and biological activity[J].Applied Sciences, 2021, 11(8):3717.
O J.Selenium-containing polysaccharides—Structural diversity, biosynthesis, chemical modifications and biological activity[J].Applied Sciences, 2021, 11(8):3717.
[60] LIU F, ZHU Z Y, SUN X L, et al.The preparation of three selenium-containing Cordyceps militaris polysaccharides:Characterization and anti-tumor activities[J].International Journal of Biological Macromolecules, 2017, 99:196-204.