食品安全问题是一个巨大并不断扩大的世界性公共卫生问题。食品安全问题一直以来都受到世界人们广泛重视,与人们生命健康息息相关。微生物污染(病毒、细菌、寄生虫、真菌以及真菌毒素)、重金属污染、农药残留污染、兽药残留污染以及其他有毒物质污染而导致的食品安全事故层出不穷,而食品安全快速检测技术的兴起与发展为减少食品安全事故的发生做出了重大贡献[1-3]。
生物传感器是一类特殊的化学传感器,以生物活性剂(如酶、微生物、抗原、抗体、动植物组织等)作为生物敏感元件,再与适当的物理或化学信号换能器件组成生物电化学分析系统[4]。生物传感器因其高灵敏性和高度选择性在食品安全快速检测领域中被广泛研究应用[5]。一般来说,根据生物传感器换能器件的类型不同可分为三大类:光学生物传感器、质量或质量敏感型生物传感器和电化学生物传感器[6-7]。这些传统的生物传感器各有其独特的优点,但也存在一些缺点,如价格成本高,机器庞大不便挪动,精度和准确性还有待提高等。近年来,磁弹性生物传感器(magnetoelastic biosensor,ME biosensor)因其具有无线便携、无毒、高灵敏度、高稳定性、价格低廉、与无线网络兼容等特点,在生物识别、化学检测、医学诊断等方面有着广泛的应用前景,并在食品检测领域也开始大量研究。
1 磁弹性生物传感器原理概述
1.1 磁致伸缩效应
磁致伸缩是铁磁材料的一种特性,是所有铁磁材料共有的现象。磁致伸缩效应是指当外部磁场发生变化或其他因素(如温度、扭转或应力)变化时,铁磁材料就会发生磁化状态变化的效应,该效应可使它们在磁化过程中可逆地改变其长度、体积或形状[8-9]。磁致伸缩效应,其中长度的变化最早由James Joule于1842年在镍中发现,又叫做焦耳效应[10]。
磁致伸缩效应的内在原因,主要源于自旋与轨道耦合能和物质的弹性能之间的平衡过程。一般来说,当铁磁或亚铁磁材料在居里点以下发生自发磁化时,会形成大量的磁畴。这些磁畴在外加磁场的作用下,其大小和方向会发生定向变化,并逐渐向外加磁场的方向转动,从而铁磁材料发生磁化。这种现象有3种表现形式[11]:如图1所示[12],沿着外磁场方向尺寸大小的相对变化,称为纵向磁致伸缩;垂直于外磁场方向尺寸大小的相对变化,称为横向磁致伸缩;以及材料体积大小的相对变化,称为体积磁致伸缩。然而,通过多方向的磁致伸缩效应会使得磁性材料产生扭转振动,利用磁致伸缩效应可将电磁能转化为机械能,这种扭转是由来自永磁体的轴向磁场与绕磁致伸缩线的磁场相互作用而产生的[13]。并且,当磁性材料在磁化过程中受到外加磁场的作用而使其方向、尺寸发生变化时,其内部的磁通量也会随之变化,这种变化会在线圈中产生感应电流,从而实现机械能与电磁能之间的转换。
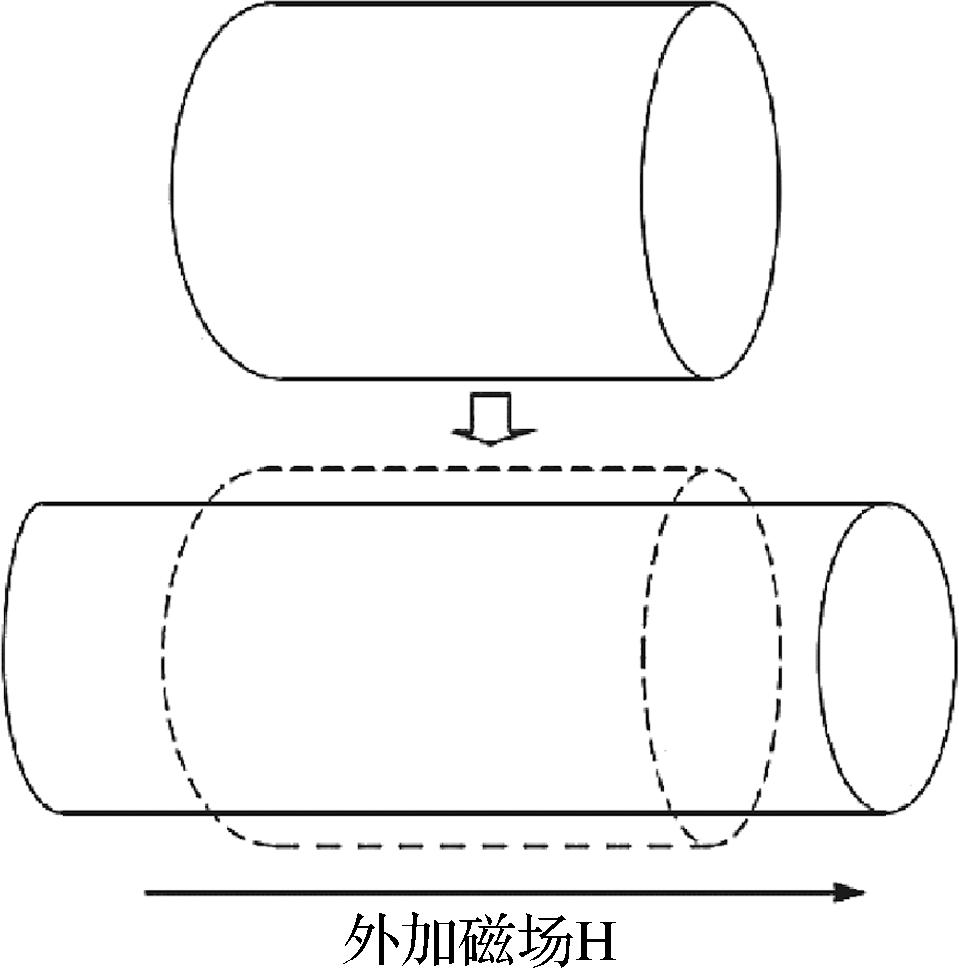
图1 磁致伸缩示意图
Fig.1 Magnetostrictive schematic diagram
1.2 磁弹性效应
磁弹性效应是指铁磁性材料在机械应力(应变)的作用下,材料磁性随之改变的现象。该效应与磁致伸缩效应相反,因此也被称为逆磁致伸缩效应,有时也被称为压磁效应。此外,由于该效应是Villari于1865年发现的,因此也称为Villari效应[14]。
磁弹性效应的产生是因为磁性材料内磁畴结构与其应力状态密切相关。在外部应力作用下,材料内的畴壁将发生位置偏移,并且随着畴壁结构的变化,材料的磁场性能也会随之改变。当弹性应力作用于铁磁材料时,铁磁体不但会产生弹性应变,还会产生磁致伸缩性质的应变,从而引起磁畴壁的位移,改变其自发磁化的方向。利用磁弹性效应可通过测量磁性材料的应力变化来测定由于磁性材料受到外部应力作用而导致磁场性能变化而引起的磁通量变化[15]。如BARANDIARAN等[16]因为带状高磁致伸缩富铁金属玻璃在纵向振动模式的频率上磁感应强度显示出急剧的最大值的特性,所以利用该频率和磁感应强度对外部(偏置)磁场的敏感性来设计了一类基于非晶态铁磁带的ME谐振器。通过由小型永磁体提供的不均匀偏置场的影响下检测磁弹性共振特性,发现了基于非晶铁磁带的ME谐振器对移动磁铁位置的响应特性,移动磁铁产生的磁场在很大程度上随磁带尺寸而变化。
近年来,随着人们对磁致伸缩效应和磁弹性效应的熟知,越来越多具有机械能/电磁能相互转换性能的材料渐渐被人们发现并开始研究,这些具有独特机械能/电磁能相互转换性能的材料被称为磁致伸缩材料。磁致伸缩材料,又叫磁弹性材料,是一种在外加磁场的作用下,自身的长度、体积或形状会随着磁场强度的变化而变化的材料。近年来,利用磁致伸缩材料特有的机械能/电磁能相互转换的性能,越来越多的磁致伸缩材料被应用于传感器的研究开发中。其中,利用该材料开发制备的磁弹性(magnetoelastic,ME)生物传感器现在正在生物医药[17-18]、食品安全检测[7, 19]等领域被陆续开发研究。磁致伸缩材料的分类及应用研究如表1所示。
表1 磁致伸缩材料的分类及应用研究
Table 1 Classification and Application Research of Magnetostrictive Materials

材料类型举例主要应用优缺点参考文献磁致伸缩金属与合金如镍基合金、铁基合金等低频大功率换能器优点:低饱和场下高磁致伸缩应变、低脆性、高强度、优良的机械加工性、成本低、电阻率低、饱和磁通密度高。缺点:居里温度较低、磁致伸缩系数较小。[20-21]铁氧体磁致伸缩材料如钴铁氧体纳米颗粒、Fe3O4薄膜等传感器、光电子学、生物医药等领域优点:磁性强、电阻率较高,可在高频条件下应用。缺点:磁致伸缩系数过小,不能承受较高功率。[22-24]稀土超磁致伸缩材料如钴铁氧体、铽镝铁合金(Tb1-xDyxFe2-y)等高频环境、磁力换能器、生物传感器等优点:体积小、居里温度高、具有良好的磁致伸缩性能和低磁晶各向异性,磁致伸缩时产生的推力很大。缺点:价格较高,脆性大,加工难度高。[25-27]非晶合金薄膜如铁基非晶合金薄膜材料(Fe40Ni38Mo4B18)、钴基非晶合金等电力和电子行业、微电子技术等领域优点:磁致伸缩系数高、具有强度高、耐腐蚀、优异的超塑性能和软磁性能的特点。缺点:化学结构单一,材料表面易形成钝化膜,在应用过程中存在腐蚀疲劳和应力腐蚀开裂会加剧材料腐蚀,降低材料使用寿命。[28-29]
1.3 磁弹性生物传感器的工作原理
磁弹性生物传感器由一个独立的换能器(ME谐振器)组成,该ME谐振器可用作信号换能器,并涂覆各种生物探针分子(如噬菌体、蛋白质以及抗体、抗原等)用于特异性捕获和结合待检测的目标物质,如图2所示。其基本工作原理为:基于焦耳磁致伸缩效应,ME生物传感器中的磁致伸缩材料在外加磁场的作用下会产生长度方向的收缩振动,当产生的固有频率与外部施加的交变磁场频率一致时就会产生共振现象,此时传感器的振幅最大,电磁能转化为机械能的效率最大[30]。而基于磁弹性效应,如图3所示[31],当检测的目标物质被生物探针有效捕获或结合时,ME生物传感器的负载质量会发生变化,进而会导致该传感器的共振频率偏移[32]。传感器负载质量的变化主要与待测物质的数量和浓度有关,当负载质量变化导致传感器共振频率偏移时,这时可通过电磁线圈测量生物传感器检测前后的共振频率偏移量得到被检测目标物质的数量或浓度[7]。
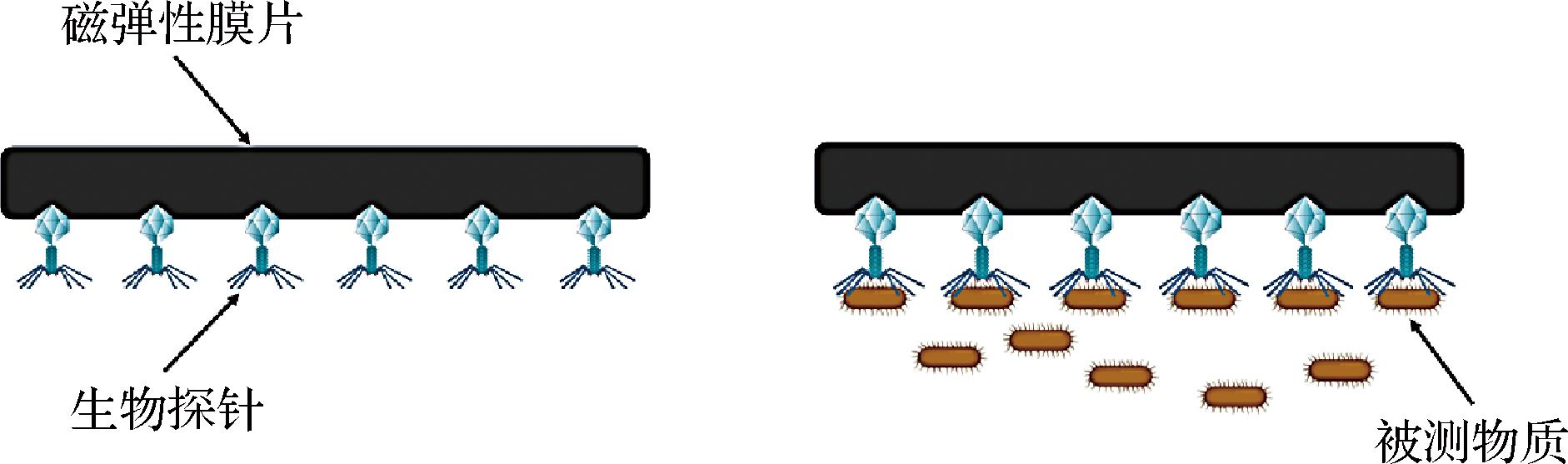
图2 ME生物传感器检测示意图
Fig.2 Schematic diagram of ME biosensor detection
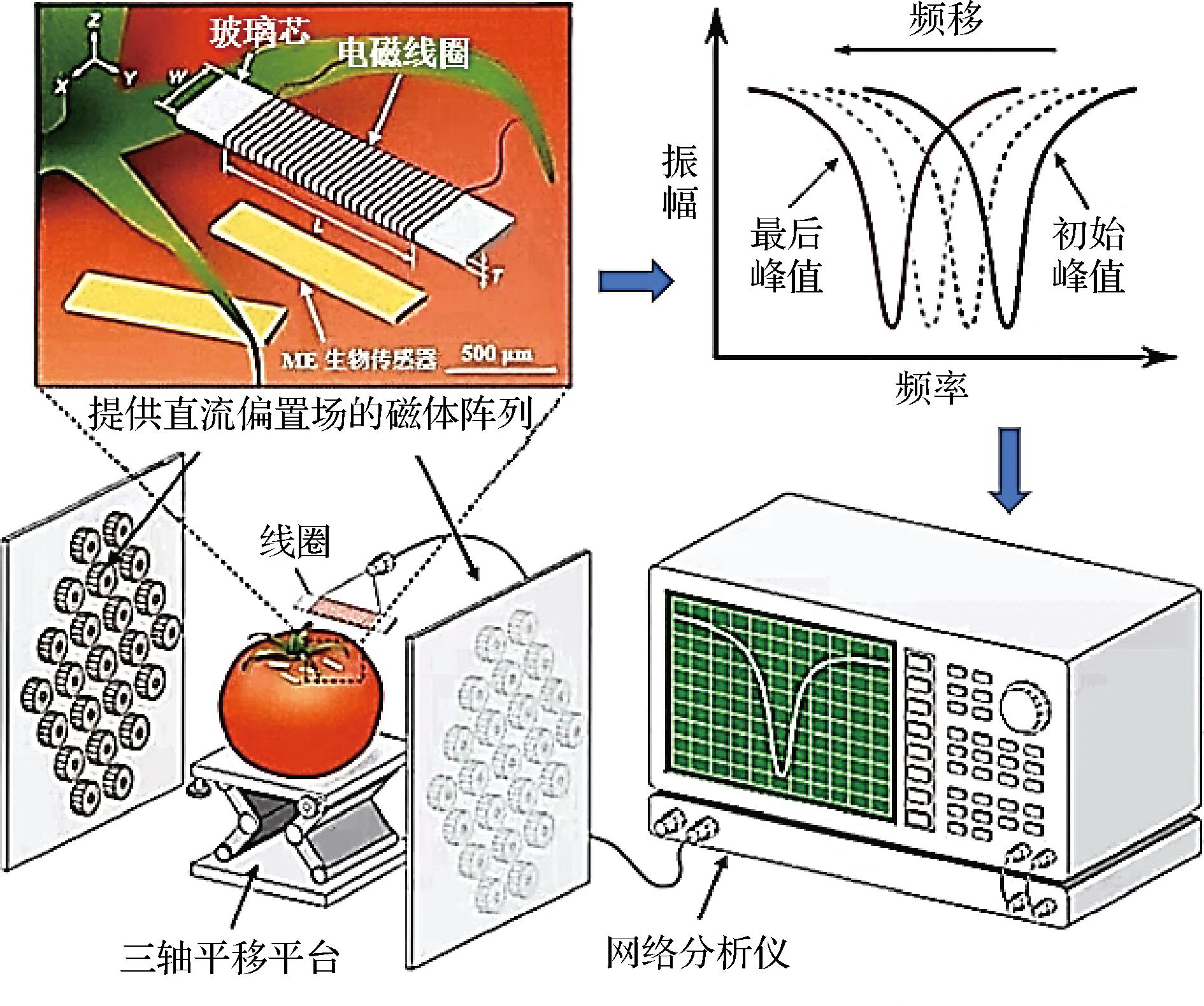
图3 ME生物传感器检测番茄表面的鼠伤寒沙门氏菌
Fig.3 ME biosensor detection of Salmonella typhimurium on tomato surface
例如,JOHNSON等[33]出于对铁硼的非晶态二元合金材料特性更适合高频传感器应用的考虑,用非晶态铁硼二元合金组成的磁弹性颗粒涂覆金层并在其表面上利用基因工程结合炭疽芽孢杆菌孢子的噬菌体作为检测探针开发了一种ME生物传感器。当目标孢子与生物传感器接触时,噬菌体将选择性地与该病原体结合,从而增加颗粒的质量并引起共振频率的偏移,这种谐振频移可以通过无线扫描设备远程检测从而得到与传感器结合的实际孢子数量与基于共振频移计算出的附着质量之间的良好相关性,这体现了传感器负载质量与待测物质数量(浓度)呈正相关的关系。但也会存在线性关系呈负相关的情况,如PANG等[34]介绍了一种在磁弹性带上浇铸一层pH值敏感聚合物而制成的磁弹性pH值敏感传感器测定体液酸度的方法。对外部施加的时变磁场做出响应时,该传感器以特征频率机械振动,该频率与pH值聚合物薄膜的质量成反比,薄膜随pH值的变化而膨胀和收缩。由于磁弹性传感器具有磁致伸缩性,因此该传感器的机械振动会产生磁通量,可使用拾取线圈进行远程检测。在进行检测时将电磁线圈与网络分析仪连接,通过网络分析仪进行检测数据的分析处理,检测过程迅速,并且可以快速得到检测结果。
磁弹性生物传感器是一种新型的传感器,通过特定的物理现象(磁致伸缩效应和磁弹性效应)实现对目标物质的高灵敏度、准确性和特异性的检测。目前,随着科技的发展,ME生物传感器开始成为研究热点,但近几年国内外所研究的ME生物传感器种类较少。其中,在现阶段和未来可应用于食品检测的ME生物传感器,根据其生物敏感元件的不同可分为:基于噬菌体的ME生物传感器、基于蛋白质的ME生物传感器和基于抗体抗原相互作用的ME生物传感器。ME生物传感器是一种有望实现原位实时检测食品表面致病菌的设备[31]。
1.4 磁弹性生物传感器的优缺点
与传统的生物化学分析检测方法相比,ME生物传感器具有以下优点:
(1)无毒、成本低:与光学生物传感器、酶联免疫传感器和基因芯片生物传感器等价格昂贵的传感器相比,ME生物传感器价格相对较低,具有较高成本效益,在大规模应用中会更具吸引力。
(2)体积小:在不严重影响ME生物传感器性能的前提下,采用非晶合金薄膜材料利用现代切割技术可制成体积微小的磁弹性谐振器平台,如有研究采用通过微切割技术制成的尺寸为0.028 mm×0.2 mm×1 mm 的矩形磁弹性谐振器平台进行了试验研究[35]。同时,也有其他体积微小的磁弹性谐振器平台被制备出来并用于科学研究[36-37]。
(3)便携性好:由于ME生物传感器主要依赖磁场感应来进行测量,所以它属于无线无源检测,并且微型小巧。与大型分析检测仪器相比,更便于携带。
(4)与无线网络连接可实现快速连续检测:ME生物传感器与无线网络相连接,使得数据可以迅速传输和分析,可实现快速连续检测,并适用于远程监控和及时反馈。
此外,ME生物传感器还具有高灵敏度、准确性和特异性的优点。并且,随着该传感器的研究发展,ME生物传感器未来不仅会在生物识别、化学检测、医学诊断等方面有广泛应用,还将非常有望应用于发酵工业、食品工业、环境监测等多个领域。
但同时也存在着一些缺点,比如由于大多数ME生物传感器将生物元件固定在其表面时采用的多是物理吸附的方式,这使得该传感器的表面特性存在稳定性较差的缺陷。如在CHAI等[31]的研究中发现E2噬菌体对环境相对湿度(relative humidity,RH)敏感,与95% RH相比,50% RH下的噬菌体结合亲和力降低了5倍,这可能是干燥的环境会使得吸附结合的噬菌体脱落而导致的。此外,开发具有新材料和新结构的新型ME生物传感器时仍然面临着一些科学技术挑战。
2 磁弹性生物传感器的应用进展
2.1 在食源性病原体检测中的应用
随着社会经济发展和人们消费水平的提高,消费者对健康生活方式愈发重视,在新鲜农产品中发现食源性病原体事件的报道也逐年增加[38-39],食品中的微生物污染对人们生命健康构成严重威胁。尽管基于微生物培养的方法是进行微生物鉴定的金标准[40],但是传统的微生物检测操作程序既复杂又耗时[41]。因此,亟需对食品中的有害物质进行快速、灵敏和特异性检测。最近有研究报道,将噬菌体整体、噬菌体衍生物和噬菌体受体结合蛋白作为生物敏感元件应用于食源性病原体的检测[42]。此外,基于噬菌体的ME生物传感器方法已成功用于沙门氏菌[43-44]、大肠杆菌[45]和猪瘟病毒[46]的现场检测。
例如,为进一步实现新鲜农产品快速、灵敏、经济高效和用户友好的检测,LEE等[47]新开发了一款表面扫描ME生物传感器,将对湿度稳定的野生尾噬菌体(wild tail phage, TST)和对湿度敏感的转基因丝状噬菌体(transgenic filamentous phage, FST)分别与带相反电荷的传感器结合进行鼠伤寒沙门氏菌(Salmonella typhimurium,ST)的检测,比较其两者性能。将两种噬菌体暴露于分别带负电荷和带正电荷的传感器中,研究 TST 和 FST 噬菌体的电荷相互作用,结果表明每个噬菌体与带正电荷的传感器之间有较强的电荷相互作用,于是选择带正电荷的传感器进一步研究这两种噬菌体固定化传感器的特异性和受环境湿度条件的影响。测定细菌浓度的工作原理是基于该传感器的细微质量变化,首先使用表面扫描线圈检测器测量传感器的初始谐振频率。在固定在传感器上的噬菌体与污染在食物上的S. typhimurium结合之后,再使用表面扫描线圈检测器测量传感器的第二谐振频率,通过计算就可得到细菌浓度。与FST噬菌体相比,尾噬菌体在带正电荷的传感器上显示出极好的结合相互作用和更高的湿度稳定性,并具有出色的特异性。对辣椒上的鼠伤寒沙门氏菌(S. typhimurium)进行模拟检测时,TST的灵敏度和检出限分别为880.80 Hz/(lg CFU/mL)、(1.31±0.27) lg CFU/mL,显著大于FST(P<0.05)。TST在传感器上表现出的极好的结合相互作用和高湿度稳定性促进了对细菌的均匀捕获,增强了表面扫描ME生物传感器的可靠性能。相对于FST噬菌体来说,TST噬菌体的这些优势将会进一步加快实用型ME生物传感器的开发,有望在未来实现对在其他新鲜农产品中传播的病原体进行实时快速检测。
除此之外,CHOI等[45]也出于对提高用户友好性和增强信号的考虑,设计了一款与耐湿噬菌体相结合的信号增强型ME生物传感器,由3个传感器(1个控制传感器和2个噬菌体固定传感器)、1个可移动的铅笔式平面螺旋线圈、1组手持式信号放大器和网络分析仪组成。优化条件后的传感器,改善了传感器的信号幅度,增强了其移动性和便携性。与检测时需要加湿器以确保噬菌体与所测细菌有效结合的ME生物传感器相比,此款信号增强型ME生物传感器由于固定的是耐湿噬菌体,所以检测时无需笨重的加湿器就能进行快速、高效地检测,可实现同时检测新鲜农产品上的鼠伤寒沙门氏菌和大肠杆菌。该生物传感器从同时接种在苹果表面上的鼠伤寒沙门氏菌和大肠杆菌混合物中检测其目标细菌,16 min就可检出,检出限为(1.7±0.4) lg CFU/25 mm2(鼠伤寒沙门氏菌)和(1.6±0.3) lg CFU/25 mm2(大肠杆菌)。
此外,为了节约成本和简化操作,GUO等[48]设计了一种检测经典猪瘟病毒(classical swine fever virus, CSFV)的ME传感系统,检测系统包括测量电路和试纸,该试纸主要由1个用于检测CSFV的ME生物传感器组成。基于阻抗分析技术,设计测量电路测量ME生物传感器的谐振频率。抗CSFV免疫球蛋白 G (immunoglobulin G, IgG)通过物理吸附方式固定在ME传感器表面,形成ME生物传感器。实验结果表明:由于CSFV和抗CSFV IgG在生物传感器表面的结合引起质量负载变化使得其共振频率发生变化。ME生物传感器共振频率的偏移与0~2.5 μg/mL浓度范围的CSFV成线性正比,随着浓度的增加,变为亚线性,这表明在低CSFV浓度下线性更好。然而,此方法中所制备的传感器尺寸相对较大,这可能是其灵敏度低的原因,后续可通过优化传感器尺寸来提高检测灵敏度。
在这里也比较了几种不同的生物传感器检测食源性病原体的特点,如表2所示。
表2 比较几种生物传感器检测食源性病原体的特点
Table 2 Compares the characteristics of several biosensors for detecting foodborne pathogens
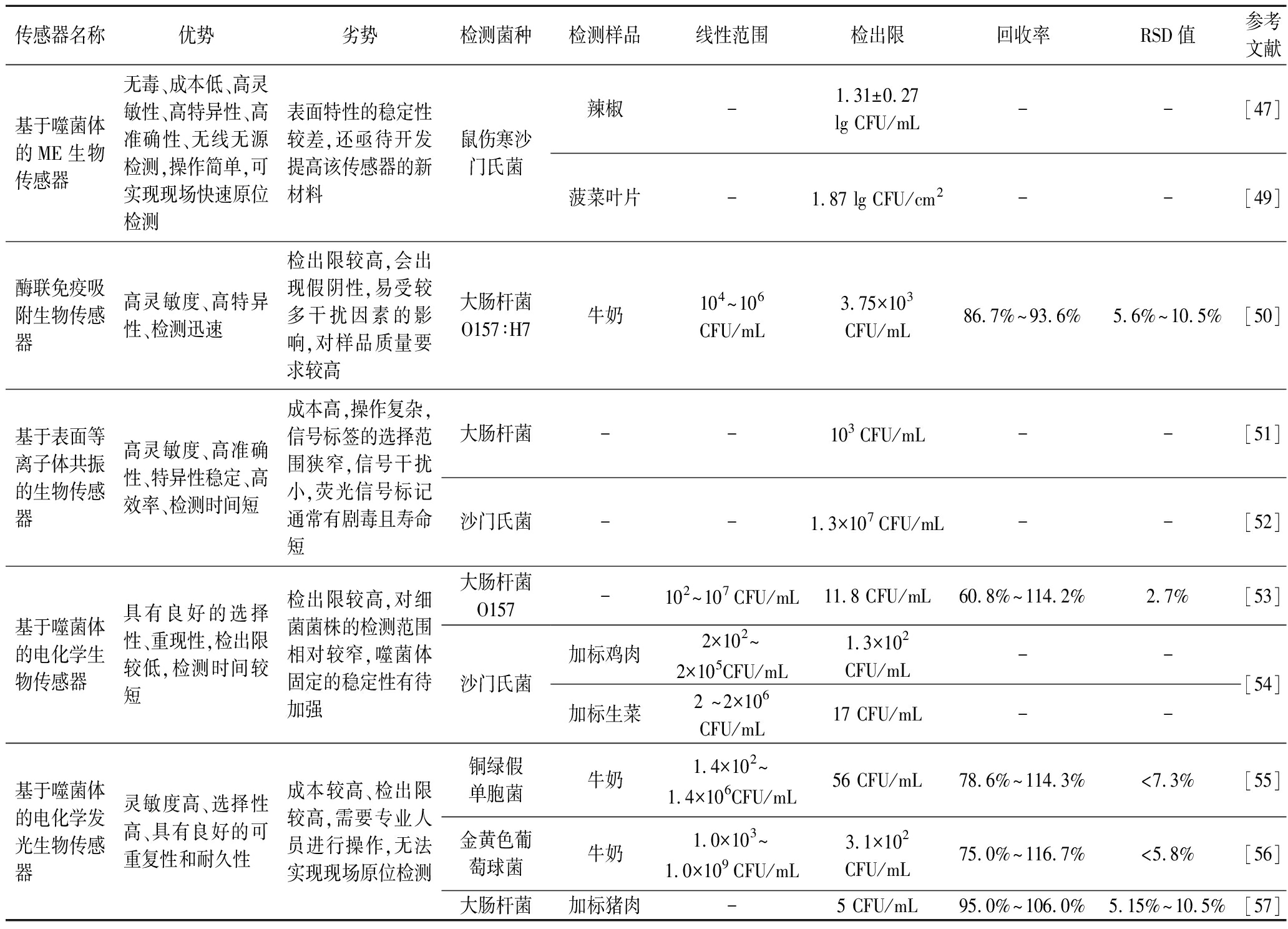
传感器名称优势劣势检测菌种检测样品线性范围检出限回收率RSD值参考文献基于噬菌体的ME生物传感器无毒、成本低、高灵敏性、高特异性、高准确性、无线无源检测,操作简单,可实现现场快速原位检测表面特性的稳定性较差,还亟待开发提高该传感器的新材料鼠伤寒沙门氏菌辣椒-1.31±0.27 lg CFU/mL--[47]菠菜叶片-1.87 lg CFU/cm2--[49]酶联免疫吸附生物传感器高灵敏度、高特异性、检测迅速检出限较高,会出现假阴性,易受较多干扰因素的影响,对样品质量要求较高大肠杆菌O157∶H7牛奶104~106CFU/mL3.75×103CFU/mL86.7%~93.6%5.6%~10.5%[50]基于表面等离子体共振的生物传感器高灵敏度、高准确性、特异性稳定、高效率、检测时间短成本高,操作复杂,信号标签的选择范围狭窄,信号干扰小,荧光信号标记通常有剧毒且寿命短大肠杆菌--103 CFU/mL--[51]沙门氏菌--1.3×107 CFU/mL--[52]基于噬菌体的电化学生物传感器具有良好的选择性、重现性,检出限较低,检测时间较短检出限较高,对细菌菌株的检测范围相对较窄,噬菌体固定的稳定性有待加强大肠杆菌O157沙门氏菌-102~107 CFU/mL11.8 CFU/mL60.8%~114.2%2.7%[53]加标鸡肉加标生菜2×102~2×105CFU/mL1.3×102CFU/mL--2 ~2×106CFU/mL17 CFU/mL--[54]基于噬菌体的电化学发光生物传感器灵敏度高、选择性高、具有良好的可重复性和耐久性成本较高、检出限较高,需要专业人员进行操作,无法实现现场原位检测铜绿假单胞菌牛奶1.4×102~1.4×106CFU/mL56 CFU/mL78.6%~114.3%<7.3%[55]金黄色葡萄球菌牛奶1.0×103~1.0×109 CFU/mL3.1×102CFU/mL75.0%~116.7%<5.8%[56]大肠杆菌加标猪肉-5 CFU/mL95.0%~106.0%5.15%~10.5%[57]
注:“-”表示文献中未提及。
2.2 有望应用于食品中其他物质的检测应用
2.2.1 在葡萄糖检测中的应用
葡萄糖的检测在医学、生物学和食品安全等领域都具有重要意义,主要体现在临床诊断、营养评估、药物研发、生物学研究和食品安全这几个方面。而在食品安全方面,因为食品中的葡萄糖含量与食品的品质和安全性密切相关,所以需要通过检测葡萄糖浓度来评估食品的新鲜度和质量,以此保障食品安全。
有研究发现,GAO等[58]以壳聚糖为支撑基底,将葡萄糖氧化酶(GOx)和过氧化氢酶共同固定在被pH敏感聚合物包被的ME传感器上,制备了一种无线ME葡萄糖生物传感器用于尿液中葡萄糖含量的检测。GOx催化的葡萄糖水解产生葡萄糖酸,导致pH响应聚合物的收缩和相应的质量下降,从而增加ME传感器的共振频率。将该葡萄糖生物传感器用于测量尿液样本中的葡萄糖浓度发现共振频率的偏移与葡萄糖浓度成正比。在试验过程中发现了抗坏血酸的干扰,但通过与pH响应的ME生物传感器的互相关联或通过将样品预调节至pH 7.0可消除其影响。研究中,通过对15份临床尿液样本的测定得出的葡萄糖水平与尿液分析仪的结果一致,表明所提出的传感器可用于尿液中的葡萄糖测定。由此可推断,将此ME生物传感器进行改进后能用于食品中葡萄糖的检测。但现有的此类生物传感器用于检测食品中葡萄糖的研究却非常少,常见的是利用葡萄糖在电极表面发生氧化还原反应以产生可测量的电流或电位差而制备电化学生物传感器用于食品中葡萄糖的检测[59-61]。导致此现象的原因可能是:在此前的时间段里,电化学生物传感器的研发成为热点以及ME生物传感器的制备和性能优化需要较高的技术水平和实验条件。而近年来,随着科学技术的不断发展进步,半导体微细加工技术得到很大发展以及纳米材料的广泛应用都使得ME生物传感器的制备和应用研究取得重大突破。通过后续对检测葡萄糖的ME生物传感器的不断优化及改进,非常有望将ME生物传感器广泛应用于食品中葡萄糖的检测。
2.2.2 在重金属检测中的应用
随着社会快速发展,环境污染问题日益严重,其中重金属污染是最为突出的问题之一。不仅对生态环境造成严重影响,还会对人类生命健康造成威胁。在重金属离子检测方面有原子吸收光谱法[62]、荧光光谱法[63]、阳极剥离伏安法[64-65]。尽管这些方法已经很成熟,但对操作人员技术要求较高、耗时且昂贵。因此,亟待开发准确性好、灵敏度高、操作简便、成本更低的检测方法。近几年,ME生物传感器因其优点开始被制备并应用于重金属检测研究。通过后续科技高速发展,该生物传感器将会被广泛应用于食品中的重金属检测,比如饮用水、食品包装材料、粮食作物等中的重金属残留检测。
例如,为了优化SANG等[66]研究的一种基于置换反应机理检测Pb2+的ME传感器的检测限,GUO等[67]首次设计了一款以牛血清白蛋白(bovine serum albumin, BSA)为生物敏感元件涂层的ME生物传感器,用于无线检测溶液中的重金属离子。该生物传感器的谐振振荡和谐振频率可以通过磁场驱动并实现无线监控。BSA被固定在磁弹性平台表面,形成ME生物传感器以检测Cd2+、Pb2+和Cu2+。该磁弹性平台中间层溅射铬,形成铬层以增强金与传感器平台之间的附着力。重金属离子与BSA的有效结合产生了附着在该传感器表面的沉淀,导致生物传感器的质量负载增加,从而导致生物传感器的共振频率降低。浓度范围为0~4.8×10-6mol/L之间时,共振频率的偏移与重金属离子浓度成线性正比,然而,随着浓度的增加,这种关系变为亚线性,这表明线性度在低浓度下保持得更好。结果表明:该生物传感器可作为检测重金属离子的高灵敏度器件,对分子质量较大的重金属更敏感。对Pb2+、Cd2+和Cu2+的灵敏度分别约为9.4×107Hz/mol/L、7.1×107 Hz/mol/L和4.7×107Hz/mol/L。Pb2+和Cd2+的检出限低于国家标准限值(GB 8978—1996 《污水综合排放标准》)。此方法制得的ME生物传感器对分子质量较大的重金属更敏感,因此可能不适于测定分子质量较小的重金属离子。但其对任何特定的金属离子都不具有特异性,所以在几种重金属离子的批量检测中可能会更具优势。另外,高爽[68]也提出了一种基于置换反应的重金属离子检测方法,基于阻抗测量法,使用ME振动基质(Metglas 2826 MB)制备了一款ME传感器直接检测溶液中的重金属离子,而无需表面功能化。不用在传感器的表面进行特异性分子修饰,溶液中的重金属离子可被ME材料的金属单质置换出来并附着在传感器表面,从而使得ME传感器的共振频率产生偏移。通过监测ME振动基质的共振频率偏移量,反映待测溶液中重金属离子的浓度。该研究结果表明:ME振动基质的共振频率偏移量随溶液中Pb2+浓度的增加而增加。ME振动基质的物理尺寸越小,检测灵敏度越强,共振频率偏移量与溶液中Pb2+浓度呈线性关系,该传感器检测灵敏度为24 Hz/mg/mL。这种方法的操作简易,无需进行复杂的前期测量准备,但是其灵敏度仍然有待提高。
2.2.3 在蛋白质检测中的应用
蛋白质检测对于疾病诊断、药物研发和食品安全等方面都具有重大的应用价值。ME生物传感器因具有高灵敏度、高选择性和快速响应等优点,在近几年开始被开发制备并用于蛋白质检测研究,但是多偏向于医学领域。根据前人所研究制备的ME生物传感器的特点,可考虑经过适当的方法改进,将ME生物传感器用于食品中的某些蛋白质的分析检测。在不远的未来,随着科学技术的不断进步与发展,这种生物传感器将会在食品中蛋白质的检测中发挥重要作用。
比如,出于对人体内的血清白蛋白(human serum albumin, HSA)快速、灵敏和便携式检测的考虑,GUO等[69]首次开发了一种新型NiFeO/纸基ME生物传感器检测人体内的HSA。由于NiFeO纳米颗粒具有独特的磁弹性效应和纸张优异的机械性能,纸基ME生物传感器将HSA和修饰在纸张上的抗体特异性结合产生的表面应力信号转换为电磁信号,积累的结合复合物在ME生物传感器表面产生压应力,导致生物传感器的静态磁导率降低。在10~200 μg/mL浓度范围内,该传感器的磁导率与HSA浓度呈线性负相关关系。为了提高该生物传感器的灵敏度,对NiFeO纳米流体的浓度和NiFeO纳米流体浸渍纸的浸渍次数进行了优化。实验结果表明:该生物传感器对HSA浓度在10~200 μg/mL范围内呈线性响应,检出限为0.43 μg/mL,明显低于微量白蛋白尿的最小诊断限。该方法制备的ME生物传感器材料成本低且易于制造,可快速、高灵敏度、选择性地检测目标物质。
同样,为了提高检测HSA的便携性和可靠性,SANG等[70]设计并制备了一种无线基于抗体和抗原之间的快速偶联致使传感器表面发生负载质量变化而导致谐振频率降低的新型便携式ME生物传感器,该传感器可以实时监测HSA的不同分子状态。实验结果表明:该ME生物传感器可以准确测定0.1~100 μg/mL线性范围内的HSA浓度,线性关系呈负相关,线性度高达0.998,灵敏度为8.70 Hz/μg/mL,检出限低至0.039 μg/mL,说明该方法具有良好的可行性。该传感设备体积小、性价比高、性能稳定,能够快速特异性地检测HAS。此方法与上述GUO等[69]所开发的方法相比,成本可能较高一些,但其检出限却远低于前者,这可能是此法所制备的传感器尺寸小而导致其灵敏度高于前者所造成的,由此可推测采用此方法制备的ME生物传感器进行检测可能更具优势。
3 总结与展望
在早期,ME生物传感器由于其设计和制备的复杂性以及相关科学和技术挑战的存在并未得到大量研究。然而,近年来,由于科学技术的高速发展以及ME生物传感器具有高灵敏度、高选择性、快速响应、低成本、微型化、无线便携等优点,ME生物传感器在生物医学、环境检测和食品安全等领域开始被制备研究,并取得了一些重要的研究成果。未来,随着ME生物传感器技术的不断发展,其在食品领域的应用将会更加广泛。一方面,可以通过改进该传感器的性能,实现对食品中更多有害物质的检测,如重金属、农药残留、抗生素等。此外,ME生物传感器还可以用于检测食品中的微生物污染,如细菌、病毒等,为食品安全提供有力保障。另一方面,可以将ME生物传感器与其他技术相结合,如物联网、大数据等,用于实时监测原料的质量、加工工艺的稳定性以及产品的卫生状况等,实现对食品生产全过程的智能化管理。通过对加工过程中的关键参数进行实时监测,可以有效地避免质量问题的发生,提高生产效率。并且,随着人们对食品安全和营养健康关注度的不断提高,ME生物传感器在食品质量评价和营养功能研究方面的应用也将得到进一步发展。比如,用于实时监测食品生产过程中的关键参数,如温度、湿度、pH值等,以确保食品质量的稳定性以及检测食品中的营养成分,如蛋白质、脂肪、糖分等,为食品企业提供科学依据,提高产品质量。此外,ME生物传感器还可用于食品的溯源,通过对食品样品中特定成分的检测,可追踪食品的生产、加工、运输等环节,有助于提高食品的安全性和可追溯性。
但同时也面临着一些挑战:首先是灵敏度和特异性问题,ME生物传感器的灵敏度和特异性是影响其在食品领域应用的关键因素。目前,ME生物传感器的灵敏度和特异性还有待进一步提高,以满足食品领域对高灵敏度和高特异性的需求。同时还存在稳定性的问题,食品环境复杂多变,ME生物传感器在实际应用中需要具备良好的稳定性。然而,目前ME生物传感器在恶劣环境下的稳定性仍有待提高,如某些噬菌体对干燥环境敏感而会引起已吸附的噬菌体脱落,导致检测准确性下降。对此提出可能的解决方案主要是优化传感器结构和改进传感技术。通过优化ME生物传感器的结构设计,可提高其灵敏度和特异性。例如,通过改变磁性纳米颗粒的大小、形状和表面修饰来优化传感器的性能。同时,还可通过引入多功能纳米材料,实现多种生物分子的同时检测,提高检测效率。此外,通过改进传感技术,如引入光学信号、电化学信号等,提高ME生物传感器的稳定性和灵敏度。未来可以通过进一步研究和开发新型传感技术,以满足食品领域对ME生物传感器的需求。综上所述,ME生物传感器未来在食品领域具有广泛的应用前景,但同时也面临着一些挑战。通过优化传感器结构和改进传感技术等措施,有望解决这些挑战,推动ME生物传感器在食品领域的广泛应用。
[1] GALLO M, FERRARA L, CALOGERO A, et al.Relationships between food and diseases:What to know to ensure food safety[J].Food Research International, 2020, 137:109414.
[2] BACANL M, BA
M, BA ARAN N.Importance of antibiotic residues in animal food[J].Food and Chemical Toxicology:an International Journal Published for the British Industrial Biological Research Association, 2019, 125:462-466.
ARAN N.Importance of antibiotic residues in animal food[J].Food and Chemical Toxicology:an International Journal Published for the British Industrial Biological Research Association, 2019, 125:462-466.
[3] LIU S, ZHAO K X, HUANG M Y, et al.Research progress on detection techniques for point-of-care testing of foodborne pathogens[J].Frontiers in Bioengineering and Biotechnology, 2022, 10:958134.
[4] 王吉, 李慧慧, 朱文娟, 等.基于噬菌体的电化学生物传感器在检测食源性病原菌中的研究进展[J].食品科学, 2022, 43(7):254-262.WANG J, LI H H, ZHU W J, et al.Progress in the development and application of bacteriophage-based electrochemical biosensors for detection of foodborne pathogenic bacteria[J].Food Science, 2022, 43(7):254-262.
[5] BHALLA N, JOLLY P, FORMISANO N, et al.Introduction to biosensors[J].Essays in Biochemistry, 2016, 60(1):1-8.
[6] ALI A A, ALTEMIMI A B, ALHELFI N, et al.Application of biosensors for detection of pathogenic food bacteria:A review[J].Biosensors, 2020, 10(6):58.
[7] RUBAB M, SHAHBAZ H M, OLAIMAT A N, et al.Biosensors for rapid and sensitive detection of Staphylococcus aureus in food[J].Biosensors &Bioelectronics, 2018, 105:49-57.
[8] HUANG Y C, VOICULESCU I, ONO T.Joule magnetostriction and volume magnetostriction of Iron Gallium thin films[J].Journal of Magnetism and Magnetic Materials, 2023, 588:171419.
[9] BULAI G, CALTUN O F.Magnetostriction effects in ferrites[M]//Ferrite Nanostructured Magnetic Materials.Amsterdam:Elsevier, 2023:651-667.[10] LIU C, SHEN T, WU H B, et al.Applications of magneto-strictive, magneto-optical, magnetic fluid materials in optical fiber current sensors and optical fiber magnetic field sensors:A review[J].Optical Fiber Technology, 2021, 65:102634.
[11] KHOMENKO M R, PANKRATOV N Y, KARPENKOV A Y, et al.Structural and magnetostrictive properties of intermetallic (Tb, Ho)(Fe, Co)2 compounds[J].Physica B:Condensed Matter, 2023, 669:415198.
[12] 王华. 磁弹性生物传感器的仿真与实验研究[D].无锡:江南大学, 2019.WANG H.Simulation and experimental study on magnetoelastic biosensor[D].Wuxi:Jiangnan University, 2019.
[13] 郭星. 磁弹性传感器表面优化设计及其在生化检测中的应用研究[D].太原:太原理工大学, 2019.GUO X.Study on surface optimization design of magnetoelastic sensor and its application in biochemical detection[D].Taiyuan:Taiyuan University of Technology, 2019.
[14] TZANIS A, ZEIBEKIS M, PILIDI A, et al.Villari magnetomechanical coupling at hcp-Cobalt thin films on flexible substrates[J].Materials Science and Engineering:B, 2021, 264:114945.
[15] ZHOU Y H, ZHAO X, XU J, et al.Giant magnetoelastic effect in soft systems for bioelectronics[J].Nature Materials, 2021, 20(12):1670-1676.
[16] BARANDIARAN J M, GUTIERREZ J, G MEZ-POLO C.New sensors based on the magnetoelastic resonance of metallic glasses[J].Sensors and Actuators A:Physical, 2000, 81(1-3):154-157.
MEZ-POLO C.New sensors based on the magnetoelastic resonance of metallic glasses[J].Sensors and Actuators A:Physical, 2000, 81(1-3):154-157.
[17] GUO X, HOU J R, GE Y, et al.Highly sensitive magnetoelastic biosensor for Alpha2-macroglobulin detection based on MnFe2O4@chitosan/MWCNTs/PDMS composite[J].Micromachines, 2023, 14(2):401.
[18] SANG S B, GUO X, WANG J Z, et al.Real-time and label-free detection of VKORC1 genes based on a magnetoelastic biosensor for warfarin therapy[J].Journal of Materials Chemistry.B, 2020, 8(29):6271-6276.
[19] BELTRAMI L V R, BELTRAMI M, ROESCH-ELY M, et al.Magnetoelastic sensors with hybrid films for bacteria detection in milk[J].Journal of Food Engineering, 2017, 212:18-28.
[20] GAO C D, ZENG Z H, PENG S P, et al.Magnetostrictive alloys:Promising materials for biomedical applications[J].Bioactive Materials, 2021, 8:177-195.
[21] GANDOMZADEH D, ABBASPOUR-FARD M H.Numerical study of the effect of core geometry on the performance of a magnetostrictive transducer[J].Journal of Magnetism and Magnetic Materials, 2020, 513:166823.
[22] HRISTOFOROU E, KTENA A, ANGELOPOULOS S.Magnetostrictive materials for sensing applications[M]//Encyclopedia of Smart Materials.Amsterdam:Elsevier, 2022:355-365.
[23] SRINIVASAN S Y, PAKNIKAR K M, BODAS D, et al.Applications of cobalt ferrite nanoparticles in biomedical nanotechnology[J].Nanomedicine, 2018, 13(10):1221-1238.
[24] LIANG B, LI Z C, DIXON S, et al.Development of a magnetostrictive Fe3O4-film electromagnetic acoustic transducer[J].Sensors and Actuators A:Physical, 2023, 361:114593.
[25] YAN S P, WANG W, YAN X H, et al.Temperature characterization of magnetic and elastic parameters of TFD giant magnetostrictive materials[J].Journal of Magnetism and Magnetic Materials, 2022, 563:169979.
[26] ELHAJJAR R, LAW C T, PEGORETTI A.Magnetostrictive polymer composites:Recent advances in materials, structures and properties[J].Progress in Materials Science, 2018, 97:204-229.
[27] SANG S B, GE Y, JI J L, et al.Magneto-stress-electric-coupled biosensors originated in magnetostrictive effect for sensitization[J].Sensors and Actuators B:Chemical, 2023, 378:133209.
[28] 蒋君, 王政彬, 李毅.氧杂质对Zr基非晶合金腐蚀性能的影响[C].第九届海洋材料与腐蚀防护大会暨第三届钢筋混凝土耐久性与设施服役安全大会, 烟台, 2023:1.JIANG J, WANG Z B, LI Y.Effect of oxygen impurities on the corrosion performance of Zr-based amorphous alloys[C].The 9th Conference on Marine Materials and Corrosion Protection and the 3rd Conference on Reinforced Concrete Durability and Facility Service Safety, Yantai, 2023:1.
[29] ZHU Q K, ZHANG S L, GENG G H, et al.Effects of annealing on the structure and magnetic properties of Fe80B20 magnetostrictive fibers[J].Journal of Applied Biomaterials &Functional Materials, 2016, 14(Suppl 1):e56-e61.
[30] LAKSHMANAN R S, GUNTUPALLI R, HU J, et al.Detection of Salmonella typhimurium in fat free milk using a phage immobilized magnetoelastic sensor[J].Sensors &Actuators:B.Chemical, 2007, 126(2):544-550.
[31] CHAI Y T, HORIKAWA S, LI S Q, et al.A surface-scanning coil detector for real-time, in situ detection of bacteria on fresh food surfaces[J].Biosensors &Bioelectronics, 2013, 50:311-317.
[32] SHARMA R S, KARMAKAR S, KUMAR P, et al.Application of filamentous phages in environment:A tectonic shift in the science and practice of ecorestoration[J].Ecology and Evolution, 2019, 9(4):2263-2304.
[33] JOHNSON M L, WAN J H, HUANG S C, et al.A wireless biosensor using microfabricated phage-interfaced magnetoelastic particles[J].Sensors and Actuators A:Physical, 2008, 144(1):38-47.
[34] PANG P F, GAO X J, XIAO X L, et al.A wireless pH sensor using magnetoelasticity for measurement of body fluid acidity[J].Analytical Sciences:the International Journal of the Japan Society for Analytical Chemistry, 2007, 23(4):463-467.
[35] PARK M K, OH J H, CHIN B A.The effect of incubation temperature on the binding of Salmonella typhimurium to phage-based magnetoelastic biosensors[J].Sensors and Actuators B:Chemical, 2011, 160(1):1427-1433.
[36] ATALAY S, KOLAT V S, ATALAY F E, et al.Magnetoelastic sensor for magnetic nanoparticle detection[J].Journal of Magnetism and Magnetic Materials, 2018, 465:151-155.
[37] SAIZ P G, PORRO J M, LASHERAS A, et al.Influence of the magnetic domain structure in the mass sensitivity of magnetoelastic sensors with different geometries[J].Journal of Alloys and Compounds, 2021, 863:158555.
[38] SHENG L N, ZHU M J.Practical in-storage interventions to control foodborne pathogens on fresh produce[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(5):4584-4611.
[39] CARSTENS C K, SALAZAR J K, DARKOH C.Multistate outbreaks of foodborne illness in the United States associated with fresh produce from 2010 to 2017[J].Frontiers in Microbiology, 2019, 10:2667.
[40] CUNNINGHAM A, CAMPBELL K, MCAULIFFE O.Bacteriophages and rapid detection of bacterial pathogens:A novel approach[M]//Reference Module in Life Sciences.Amsterdam:Elsevier, 2018.
[41] FAROOQ U, YANG Q L, ULLAH M W, et al.Bacterial biosensing:Recent advances in phage-based bioassays and biosensors[J].Biosensors &Bioelectronics, 2018, 118:204-216.
[42] SINGH S, DHANJAL D S, SONALI, et al.An insight in bacteriophage based biosensors with focus on their detection methods and recent advancements[J].Environmental Technology &Innovation, 2020, 20:101081.
[43] CHEN I H, HORIKAWA S, BRYANT K, et al.Bacterial assessment of phage magnetoelastic sensors for Salmonella enterica Typhimurium detection in chicken meat[J].Food Control, 2017, 71:273-278.
[44] WANG F G, HORIKAWA S, HU J J, et al.Detection of Salmonella typhimurium on spinach using phage-based magnetoelastic biosensors[J].Sensors, 2017, 17(2):386.
[45] CHOI I Y, CHOE J, CHIN B A, et al.User-friendly, signal-enhanced planar spiral coil-based magnetoelastic biosensor combined with humidity-resistant phages for simultaneous detection of Salmonella Typhimurium and Escherichia coli O157:H7 on fresh produce[J].Sensors and Actuators B:Chemical, 2023, 393:134179.
[46] 李宇超. 便携式磁弹性传感器检测系统优化及应用研究[D].太原:太原理工大学, 2020.LI Y C.Research on optimization and application of portable magnetoelastic sensor detection system[D].Taiyuan:Taiyuan University of Technology, 2020.
[47] LEE H E, JEON Y B, CHIN B A, et al.Performance of wild, tailed, humidity-robust phage on a surface-scanning magnetoelastic biosensor for Salmonella Typhimurium detection[J].Food Chemistry, 2023, 409:135239.
[48] GUO X, GAO S, SANG S B, et al.Detection system based on magnetoelastic sensor for classical swine fever virus[J].Biosensors &Bioelectronics, 2016, 82:127-131.
[49] PARK M K, HIREMATHA N, WEERAKOON K A, et al.Effects of surface morphologies of fresh produce on the performance of phage-based magnetoelastic biosensors[J].Journal of the Electrochemical Society, 2012, 160(1):B6-B12.
[50] JING X D, SHAN S, XING K Y, et al.Sensitive fluorescence ELISA with streptavidin scaffolded DNA tetrads for the detection of Escherichia coli O157:H7[J].Journal of Dairy Science, 2023, 106(9):5930-5939.
[51] TAWIL N, SACHER E, MANDEVILLE R, et al.Surface plasmon resonance detection of E.coli and methicillin-resistant S.aureus using bacteriophages[J].Biosensors and Bioelectronics, 2012, 37(1):24-29.
[52] WU S, SHENG L N, LU X, et al.Screening of bio-recognition elements by phage display and their application in the detection of foodborne pathogens[J].TrAC Trends in Analytical Chemistry, 2024, 171:117481.
[53] ZHOU Y Q, LI Z Y, HUANG J J, et al.Development of a phage-based electrochemical biosensor for detection of Escherichia coli O157∶H7 GXEC-N07[J].Bioelectrochemistry, 2023, 150:108345.
[54] WANG J, LI H H, LI C B, et al.EIS biosensor based on a novel Myoviridae bacteriophage SEP37 for rapid and specific detection of Salmonella in food matrixes[J].Food Research International, 2022, 158:111479.
[55] YUE H, HE Y, FAN E C, et al.Label-free electrochemiluminescent biosensor for rapid and sensitive detection of pseudomonas aeruginosa using phage as highly specific recognition agent[J].Biosensors &Bioelectronics, 2017, 94:429-432.
[56] YUE H, ZHOU Y L, WANG P S, et al.A facile label-free electrochemiluminescent biosensor for specific detection of Staphylococcus aureus utilizing the binding between immunoglobulin G and protein A[J].Talanta, 2016, 153:401-406.
[57] WANG S, HU J H, YOU H, et al.Tesla valve-assisted biosensor for dual-mode and dual-target simultaneous determination of foodborne pathogens based on phage/DNAzyme co-modified zeolitic imidazolate framework-encoded probes[J].Analytica Chimica Acta, 2023, 1275:341591.
[58] GAO X J, YANG W Y, PANG P F, et al.A wireless magnetoelastic biosensor for rapid detection of glucose concentrations in urine samples[J].Sensors and Actuators B:Chemical, 2007, 128(1):161-167.
[59] KHARISMASARI C Y, IRKHAM, ZEIN M I H L, et al.CRISPR/Cas12-based electrochemical biosensors for clinical diagnostic and food monitoring[J].Bioelectrochemistry, 2024, 155:108600.
[60] AYENIMO J G, ADELOJU S B.Amperometric detection of glucose in fruit juices with polypyrrole-based biosensor with an integrated permselective layer for exclusion of interferences[J].Food Chemistry, 2017, 229:127-135.
[61] SMUTOK O, KAVETSKYY T, PROKOPIV T, et al.New micro/nanocomposite with peroxidase-like activity in construction of oxidases-based amperometric biosensors for ethanol and glucose analysis[J].Analytica Chimica Acta, 2021, 1143:201-209.
[62] SALEEM P H, MOINFAR S, MOHAMMED I A.Determination of Cr and Pb in edible vegetable oils by coupling of extraction induced by emulsion breaking with dispersive liquid-liquid microextraction followed by flame atomic absorption spectrometry detection[J].Journal of Food Composition and Analysis, 2023, 124:105683.
[63] LI K J, YANG H Y, YUAN X, et al.Recent developments of heavy metals detection in traditional Chinese medicine by atomic spectrometry[J].Microchemical Journal, 2021, 160:105726.
[64] SEREILAKHENA P, HUY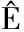 gN N, AVNI B, et al.In situ Bi/carboxyphenyl-modified glassy carbon electrode as a sensor platform for detection of Cd2+ and Pb2+ using square wave anodic stripping voltammetry[J].Sensing and Bio-Sensing Research, 2021, 34:100455.
gN N, AVNI B, et al.In situ Bi/carboxyphenyl-modified glassy carbon electrode as a sensor platform for detection of Cd2+ and Pb2+ using square wave anodic stripping voltammetry[J].Sensing and Bio-Sensing Research, 2021, 34:100455.
[65] DURAI L, BADHULIKA S.Stripping voltammetry and chemometrics assisted ultra-selective, simultaneous detection of trace amounts of heavy metal ions in aqua and blood serum samples[J].Sensors and Actuators Reports, 2022, 4:100097.
[66] SANG S B, GAO S, GUO X, et al.The detection of Pb2+ in solution using bare magnetoelastic resonator[J].Applied Physics Letters, 2016, 108(5):054102.1-054102.4.
[67] GUO X, SANG S B, JIAN A Q, et al.A bovine serum albumin-coated magnetoelastic biosensor for the wireless detection of heavy metal ions[J].Sensors and Actuators B:Chemical, 2018, 256:318-324.
[68] 高爽. 基于磁弹性传感器的重金属离子检测系统[D].太原:太原理工大学, 2016.GAO S.Heavy metal ion detection system based on magneto-elastic sensor[D].Taiyuan:Taiyuan University of Technology, 2016.
[69] GUO X, LIU R, LI H M, et al.A novel NiFe2O4/paper-based magnetoelastic biosensor to detect human serum albumin[J].Sensors, 2020, 20(18):5286.
[70] SANG S B, LI Y C, GUO X, et al.A portable device for rapid detection of human serum albumin using an immunoglobulin-coating-based magnetoelastic biosensor[J].Biosensors &Bioelectronics, 2019, 141:111399.