目前,从油料中提取油脂的方法主要有压榨法、浸出法和水酶法。其中,压榨法出油率低,成本高;溶剂浸出法存在易燃易爆隐患,且有机溶剂易残留,对人体健康不利。而水酶法是一种新型环保提油技术,其作用条件温和,所提油脂品质较高;酶解的同时脱除磷脂等胶体物质,简化油脂精炼工艺;且产生废水中的化学需氧量和生化耗氧量较低,废水易于处理[1]。因此,水酶法符合“安全、绿色、高效”的标准,具有良好的开发前景。但是,水酶法提油工艺的出油率仍低于溶剂浸出法。细胞破碎不完全、所用酶种类不适宜、酶解度不适宜、提取过程中形成乳状液等原因会导致水酶法出油率较低。为提高出油率,国内外学者从各个方向对水酶法提油展开了研究,比如粉碎度、原料预处理、酶种类、加酶量、pH值、酶解温度以及破乳方法等。但是,不同研究中所使用的水酶法提油工艺存在较大差异,使得后期研究人员无法从已有研究中获取提高出油率的关键技术要点和参数,导致实际应用效果不佳。因此,本文查阅了近年来国内外有关水酶法提油的最新研究文献,并从原料预处理、酶解和破乳3个层面对水酶法提油的关键技术进行分析和总结,以便后续研究人员了解水酶法及水酶法提油的关键技术要点,并为其在实际应用时选择合适的粉碎粒径、原料预处理方法、酶种类、酶解时间和温度及破乳方法等提供参考和建议。
1 水酶法提油—原料预处理
常见的油料细胞结构如图1所示,油脂体和蛋白质位于植物细胞内,并被含有纤维素、半纤维素、木质素和果胶的细胞壁包围[2]。油脂存在于种子的各个部分,包括胚轴、子叶、巨核细胞、胚乳及糊粉层[3]。在植物油料细胞内油脂被一层单层磷脂和结构蛋白包裹构成脂多糖、脂蛋白等复合体,油脂难以游离[4]。除此之外,细胞壁也是阻碍油脂从细胞中游离出来的屏障。细胞壁是一种很牢固的结构,且不溶于水,难于被降解。因此,水酶法提油工艺中需破坏原料的细胞壁及脂蛋白、脂多糖等复合物,将油脂释放出来。
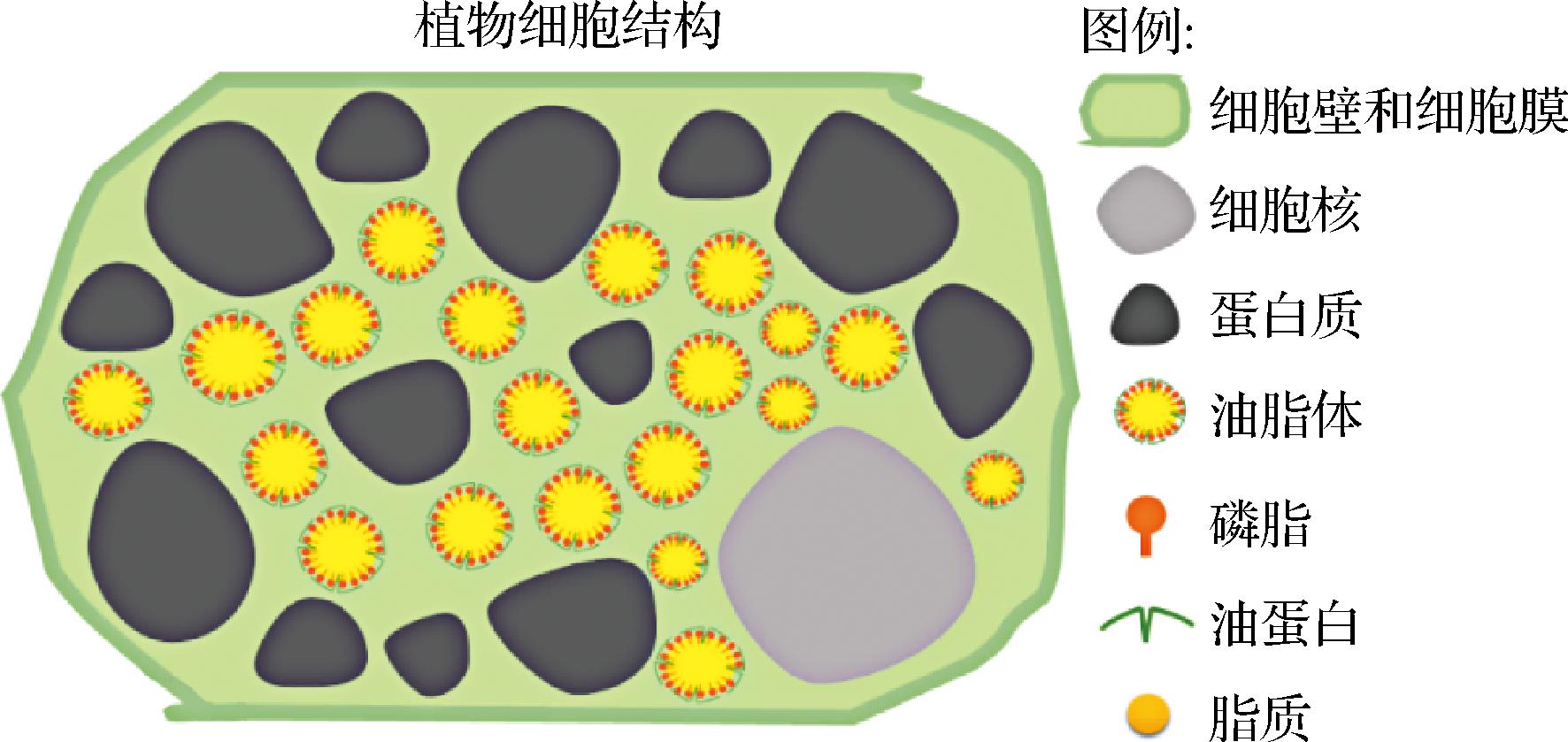
图1 油料细胞结构[2]
Fig.1 Cell structure of oil seeds[2]
原料预处理可以破坏油料的细胞壁和细胞晶体结构,暴露脂蛋白、糖酯等复合物的酶促作用位点,提高酶解效果,从而提高出油率及油脂品质。常见的水酶法提取油脂的工艺流程如图2所示。其中,粉碎是必不可少的。部分油料(如大豆、牡丹籽等)由于其自身硬度、组成成分等原因需使用其他处理方法与粉碎结合进一步破坏油料的细胞结构。可在粉碎之前对原料进行处理,例如蒸煮烘干后粉碎;也可在粉碎之后进行处理,如粉碎后按照一定料液比加水对原料进行超声处理。
图2 水酶法提油工艺流程图
Fig.2 Graphical representation of aqueous enzyme extraction of vegetable oil
油料预处理方式是影响出油率和油脂品质的重要因素,并且随着原料品种的不同,油料预处理方式也有所差异。为提高水酶法提油的得率,选择适宜的原料预处理方法显得尤为重要。目前,水酶法提油工艺中主要使用的原料预处理方法有机械破碎、超声波预处理、热处理(微波、高温蒸煮、蒸汽爆破等)、挤压膨化、乙醇预处理等。原料预处理方法及其优缺点如表1所示。在这些预处理方法中,机械破碎是必不可少的。机械破碎一方面破坏了油料细胞的内部结构,使更多的油脂游离释放出来;另一方面减小了油料粒径,暴露更多酶促位点,增加了油料与溶剂、酶制剂的接触,便于后续酶解。值得注意的是,在粉碎时,粉碎程度与出油率并不是正相关的。在一定范围内,油料的粉碎程度越大,出油率越高。但是,粉碎度过大,水相体系中可溶性蛋白质以共价交联或非共价交联的作用形成稳定的界面蛋白膜包裹油滴,阻碍油滴的释放[14]。热处理可以使原料中的天然酶失去活性。将油籽粉碎会导致油料中的甘油三酯和种子的天然酶系统之间产生一个接触界面,活性酶会将油脂水解或产生磷脂。热处理可以使油料中的天然酶失活,减少油脂的损失[15]。高温蒸煮后烘干可以在一定程度上破坏油料的细胞结构。细胞在蒸煮过程中细胞壁发生膨胀,烘干细胞后会出现剧烈的皱缩,破坏细胞结构,致使油脂体破裂,油滴聚集[10]。然而,长时间加热处理或过于剧烈的热处理条件会使油脂的色泽加深、酸价升高、过氧化值升高,使油脂品质降低[16]。乙醇预处理可以从源头上减少乳状液的形成。油料中含有的磷脂和蛋白质都是良好的乳化剂,另外小分子的糖类也会增加蛋白质的乳化性[17]。在粉碎后使用一定浓度的乙醇对原料进行萃取,可以有效去除原料中的磷脂、糖类、醇溶性蛋白等物质,从源头上减少后续酶解提油时出现的乳化作用[18],有效提高出油率。王慧娟等[13]使用体积分数为80%的乙醇,按照1∶8(g∶mL)的料液比与牡丹籽混合,提取牡丹籽中的磷脂、糖类等大分子物质,提取离心后渣相按照1∶3(g∶mL)的料液比混匀,碱提1 h(pH 10、35 ℃),使用碱性蛋白酶[加酶量15%(酶/底物·干基计)、酶解5 h]进行酶解,出油率可达90.31%。
表1 原料预处理方法及其优缺点
Table 1 Methods of raw material pretreatment and its advantages and disadvantages
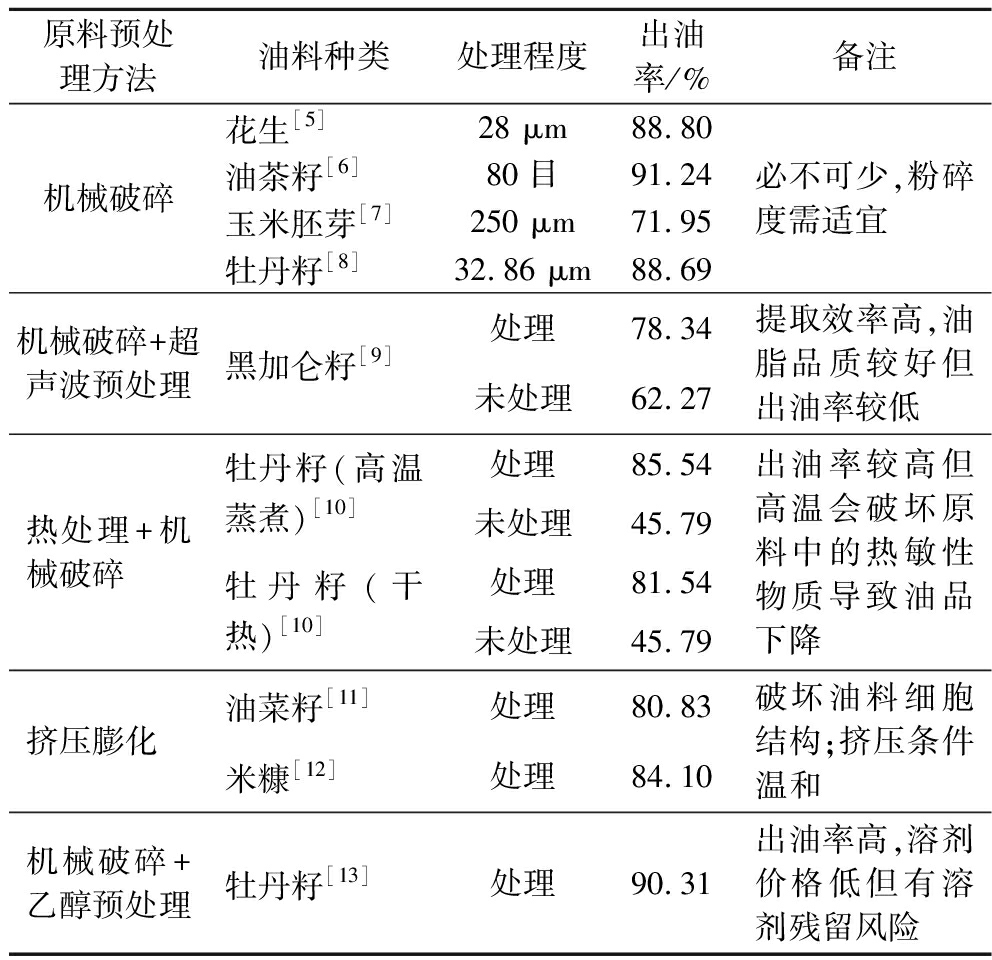
原料预处理方法油料种类处理程度出油率/%备注机械破碎花生[5]28 μm88.80油茶籽[6]80目91.24玉米胚芽[7]250 μm71.95牡丹籽[8]32.86 μm88.69必不可少,粉碎度需适宜机械破碎+超声波预处理黑加仑籽[9]处理78.34未处理62.27提取效率高,油脂品质较好但出油率较低热处理+机械破碎牡丹籽(高温蒸煮)[10]牡丹籽(干热)[10]处理85.54未处理45.79处理81.54未处理45.79出油率较高但高温会破坏原料中的热敏性物质导致油品下降挤压膨化油菜籽[11]处理80.83米糠[12]处理84.10破坏油料细胞结构;挤压条件温和机械破碎+乙醇预处理牡丹籽[13]处理90.31出油率高,溶剂价格低但有溶剂残留风险
其中,部分原料含油率较低,硬度较大(如大豆、牡丹籽等),粉碎只能破坏部分油料细胞结构,导致后续酶解时酶与酶促位点不能充分接触,油脂仍存在于油料中,难以游离。因此在设计实验方案时还需选择一种或几种方法对原料进行预处理辅助机械破碎来提高细胞结构的破坏程度。在选择原料预处理方法时,不仅要考虑出油率的高低、油脂品质等问题,还需要考虑是否适用于工业化生产,尽量降低生产成本。
2 水酶法提油—酶解技术
酶解释油是指利用淀粉酶、蛋白酶或纤维素酶等对油料种子细胞壁、蛋白质、多糖等大分子物质进行破坏和降解,使油脂和大分子物质游离,再通过离心等操作使高品质油脂游离。目前,有关水酶法提油中酶解技术主要集中于酶种类、加酶量、酶解温度和时间、体系pH、料液比等。
2.1 酶种类
酶种类的使用与出油率的高低有着密切的关系。酶的选择取决于植物油料细胞结构组成以及油脂体周围的组成成分。研究中使用的酶主要有纤维素酶、半纤维素酶、果胶酶、碱性蛋白酶、中性蛋白酶、酸性蛋白酶、淀粉酶和复合酶等。
纤维素酶、半纤维素酶和果胶酶主要用于降解植物油料细胞的细胞壁。细胞壁是植物细胞特有的结构,阻止细胞内油脂和蛋白质等物质向外扩散的同时防止外界溶剂渗透到细胞内。细胞壁主要成分是纤维素、半纤维素和果胶,是一种很牢固的结构,且不溶于水,难于被降解[19]。纤维素酶、半纤维素酶、果胶酶等酶的使用,会破坏细胞壁的结构,利于油脂的释放。HU等[20]选取纤维素酶、果胶酶和半纤维素酶对虎果进行水酶法提油,3种酶比例为1∶1∶1,在加酶量2%、酶解3 h的条件下,出油率达到85.23%。D AZ-SU
AZ-SU REZ等[21]分别使用纤维素酶、果胶酶、半纤维素酶和糖酶复合酶(加酶量为2%、酶解4 h)对蓖麻籽进行酶解,与未添加酶的对照相比,这几种酶都可以提高蓖麻籽的出油率,其中糖酶复合酶(pH 4、50 ℃)酶解时出油率显著高于其他酶,提取率最高可达64%。
REZ等[21]分别使用纤维素酶、果胶酶、半纤维素酶和糖酶复合酶(加酶量为2%、酶解4 h)对蓖麻籽进行酶解,与未添加酶的对照相比,这几种酶都可以提高蓖麻籽的出油率,其中糖酶复合酶(pH 4、50 ℃)酶解时出油率显著高于其他酶,提取率最高可达64%。
蛋白质是组成植物细胞壁和油脂体界面膜的结构大分子。如图3所示,TZEN等[4]提出了油脂体结构模型,油脂被一层单层磷脂覆盖,磷脂内嵌有结构蛋白。结构蛋白由深入油脂内部的长的疏水区域和伞状的亲水部分构成。蛋白酶可以将细胞壁和界面膜上的结构蛋白水解为多肽和氨基酸,破坏细胞壁的网状结构和脂蛋白复合物,从而释放细胞内的油脂。张敏等[12]考察酶的种类(Celluclast 1.5 L纤维素酶、Pectinex Ultra SP-L果胶酶、Viscozyme L糖酶复合酶、Alcalase 2.4 L碱性蛋白酶、Hemicellulase 半纤维素酶)(加酶量2%、酶解2 h)对米糠油提油率的影响,筛选出碱性蛋白酶是水酶法提取牡丹籽的最佳酶制剂,出油率达到50%左右。但是,蛋白酶将蛋白质水解导致在提油的同时无法提取油料中的蛋白质,从而影响到下游产业。
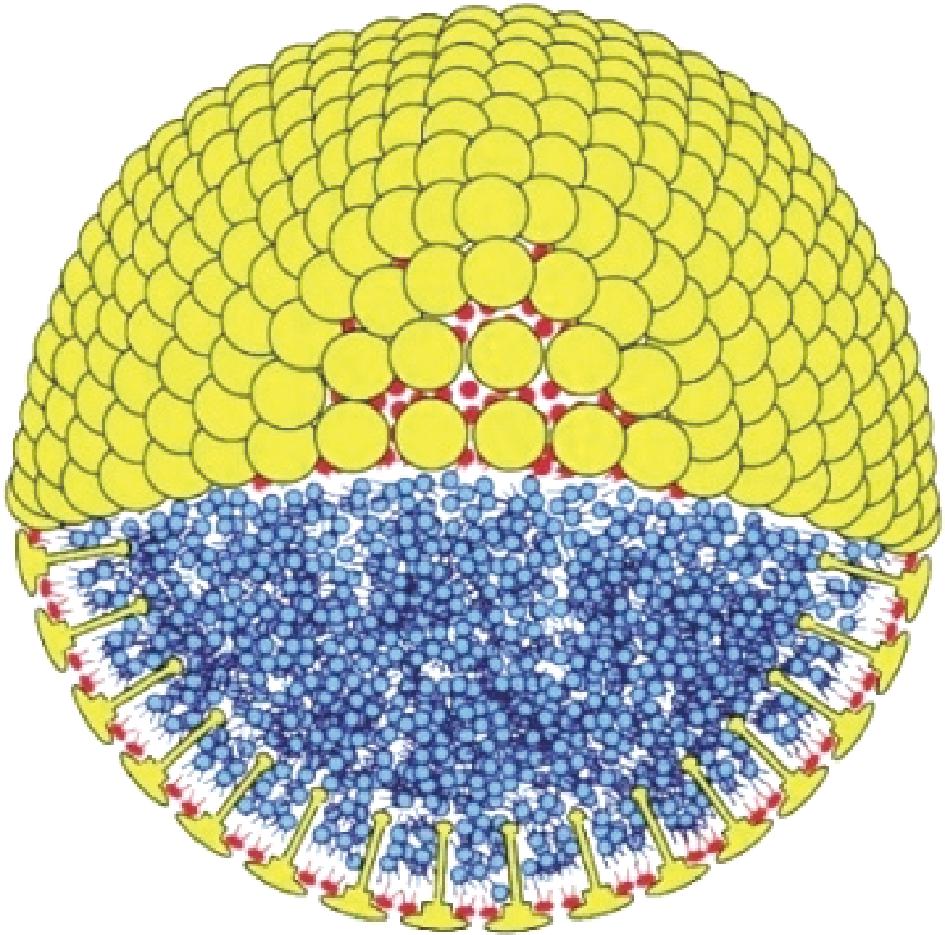
图3 油脂体结构模型
Fig.3 Models of oil body molecule
注:蓝色-油脂;红色-磷脂单分子层;黄色-蛋白质
淀粉酶主要作用于淀粉,防止淀粉糊化增大体系黏度,阻碍油脂的释放。α-淀粉酶将淀粉分子中的α-1, 4葡萄糖苷键切断,使其成为长短不一的短链糊精及少量的低分子糖类。宋媛媛等[22]使用中温α-淀粉酶(加酶量2 mL/100 g 原料、酶解1 h)和葡萄糖淀粉酶(加酶量3 mL/100 g 原料、酶解1 h)对牡丹籽进行水酶法提油,出油率达到90.08%。陶海英等[23]使用纤维素酶、半纤维素酶、复合纤维素酶、淀粉酶、果胶酶对小麦胚芽进行酶解,淀粉酶(10%)酶解时出油率最低,可能原因主要是细胞壁、脂蛋白、脂多糖和提取过程中形成的是界面蛋白膜,而不是淀粉。
由于植物油料细胞的成分和组织结构比较复杂,使用单一酶制剂可能会具有一定的局限性。因此有研究将不同的酶按照一定的比例进行复配来增强酶水解细胞壁和油脂体结构的作用,从而提高油脂和蛋白质得率。但是,研究发现复合酶并不一定会提高出油率。张敏等[12]在相同处理条件下,使用不同糖酶(Celluclast 1.5 L纤维素酶、Pectinex Ultra SP-L果胶酶、Viscozyme L糖酶复合酶)(加酶量1%、酶解1 h)和碱性蛋白酶(加酶量1%、酶解1 h)复配提取米糠油,与单独使用碱性蛋白酶(加酶量2%、酶解2 h)相比,纤维素酶、半纤维素酶、果胶酶和碱性蛋白酶复配对出油率影响不显著,糖酶复合酶与碱性蛋白酶复配反而使出油率降低。
由于油料含油量及其化学组分会受原料品种、产地、生长条件等因素的影响而不同,因此在探索水酶法提油工艺时,需要根据原料的细胞结构、化学组分、提取工艺和下游产业等综合选择酶的种类。
2.2 加酶量、酶解温度、酶解时间、体系pH和料液比
加酶量、酶解温度、酶解时间、体系pH和料液比需在实际研究中通过试验进行优化。加酶量过低导致酶解不完全,出油率较低;加酶量过高不仅增加成本,浪费资源,甚至还会导致出油率下降[10]。酶解时间会因原料和酶种类的不同而有差异,反应时间过短,酶解不充分;反应时间过长会导致油脂表面重新形成界面膜导致出游率下降。ZHENG等[24]研究表明,酶解破坏了蛋白质的一级、二级和三级结构,即对蛋白质的空间立体结构产生了重要影响,从而改变了蛋白质的乳化性能。适度的酶水解(1.5 h)可以有效地破坏由蛋白质形成的界面膜,有利于油脂的释放。相比之下,过度的酶解(3.0 h)可能导致蛋白质聚集体的形成,蛋白质聚集体吸附在界面处形成弹性界面膜,形成稳定的乳液[24]。料液比过低时,体系黏稠,酶与底物不能充分接触,酶解反应不彻底;料液比过高时,酶浓度降低,酶与底物分子的碰撞概率降低,酶解反应的效率也随之降低[25]。
在酶解过程中,酶解温度和体系的pH值也至关重要。酶解温度和体系pH值过高或过低都会影响酶的活性甚至会使酶失活,影响酶解的效果。酶解温度因原料及所用酶的种类不同有差异,一般在40~55 ℃以有利于酶解而不影响最终油品和蛋白质(副产品)的质量为目的[26]。pH既影响酶的活性,又影响油与蛋白的分离。且许多酶的最适pH在蛋白质的等电点范围内,蛋白质在这个pH范围内高度不溶,可能会抑制油脂的游离[27]。酶解温度和体系pH的确定需综合考虑酶活性、酶解工艺及原料种类等因素。
3 水酶法提油—破乳技术
水酶法提油是一种新型绿色环保的提油方法。水酶法提取结束后通过离心将体系分为4层,从上到下分别为油相、乳相、水相和渣相(图4)。研究表明,蛋白质是通过包封脂滴来维持乳状液稳定性的主要方式[28]。水酶法提油过程中,原料被粉碎后按照一定的料液比加入到溶液中,两亲性蛋白被释放进入水相体系,蛋白质慢速分散到油水界面(图5-a)。到达界面后,蛋白质的分子结构打开,内部的疏水氨基酸暴露(图5-b),由此产生的分子间的共价交联和(或)非共价相互作用导致油滴周围形成稳定的蛋白界面膜包裹油滴(图5-c),阻碍油滴的聚集。该膜有一定的厚度、强度、黏弹性,同时具有带电性(图5-d)和空间稳定性(图5-e)[14],维持乳状液的稳定性。因此,如何有效地破乳,提高出油率,是水酶法提油技术研究的重点之一。

图4 水酶法提取牡丹籽油离心后的各相分布
Fig.4 The distribution of different phase after centrifugation in the case of aqueous enzyme extraction of peony seed oil
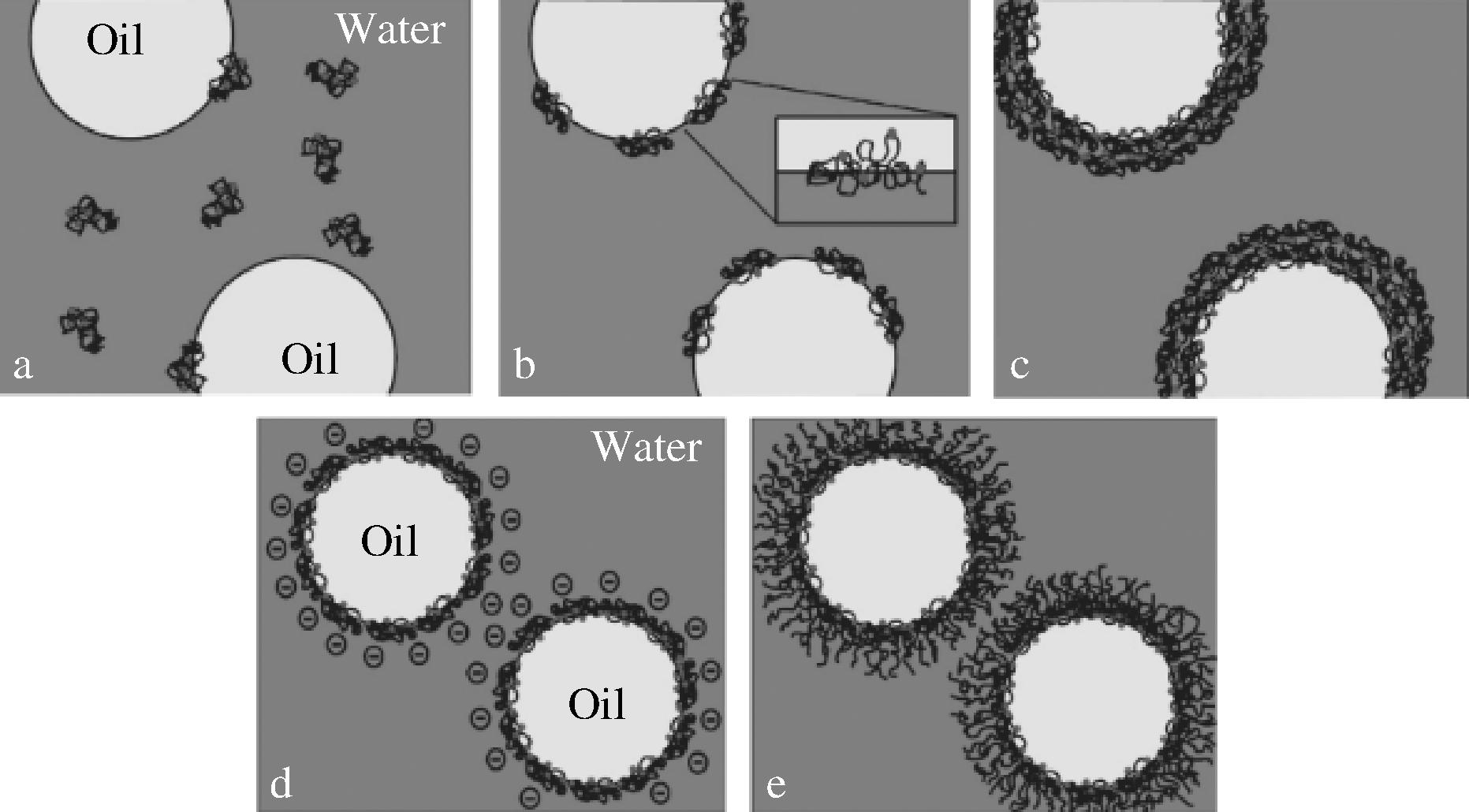
图5 蛋白质在油水界面的运动过程及乳状液的稳定机理[14]
Fig.5 The movement of protein at oil-water interface and the stability mechanism of emulsion[14]
破乳的核心是破坏影响乳状液稳定性的因素(如液滴尺寸、表面电荷、蛋白质水解度、表面疏水性等)。根据Stockes定律,乳状液的液滴尺寸越小,乳状液越稳定[29]。液滴的大小主要取决于所使用的乳化剂(蛋白质)和乳化过程中的剪切力。剪切力越大,粒径越小,乳状液越稳定[30]。通常用zeta电位对乳状液的表面电荷定量。有研究表明,当zeta电位的绝对值>30 mV时,体系的热力学稳定性较好,体系的zeta电位绝对值越高,液滴之间静电斥力越大,表明乳液体系的稳定性越好[31]。通过调节体系的pH值和离子浓度可以改变乳状液的zeta电位,降低乳状液的稳定性。蛋白质浓度越高,覆盖油滴的面积越大,油滴越难以聚集并形成较小的油滴。水酶法提油时蛋白酶的使用不仅可以破坏脂蛋白结构还可以减少体系中蛋白质浓度,从而降低乳液的稳定性。目前,使用的破乳技术主要集中在加热法、冷冻-解冻法、有机溶剂法、盐法破乳、调节pH法、酶法破乳等(见表2)。
表2 破乳方法及其优缺点
Table 2 Demulsification methods and its advantages and disadvantages
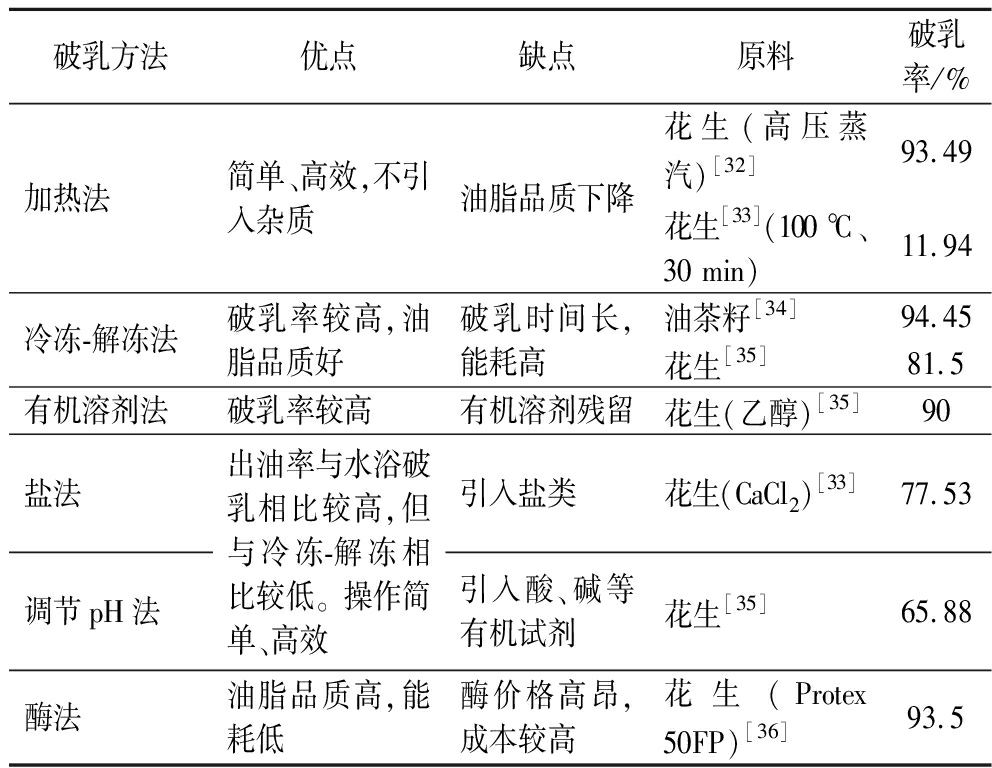
破乳方法优点缺点原料破乳率/%加热法简单、高效,不引入杂质油脂品质下降花生(高压蒸汽)[32]93.49花生[33](100 ℃、30 min)11.94冷冻-解冻法破乳率较高,油脂品质好破乳时间长,能耗高油茶籽[34]94.45花生[35]81.5有机溶剂法破乳率较高有机溶剂残留花生(乙醇)[35]90盐法调节pH法出油率与水浴破乳相比较高,但与冷冻-解冻相比较低。操作简单、高效引入盐类花生(CaCl2)[33]77.53引入酸、碱等有机试剂花生[35]65.88酶法油脂品质高,能耗低酶价格高昂,成本较高花生(Protex 50FP)[36]93.5
除表2所列方法外,还可将物理、化学、酶法破乳联合使用。张敏等[12]将加热法和调节pH值破乳法相结合,调节乳状液pH值至7.0, 60 ℃、300 r/min搅拌60 min,破乳率达到93.15%。LIU等[37]研究了盐辅助微波对花生油萃取的影响,在CaCl2浓度为10 mmol/L,微波功率390 W,微波时间2 min的条件下,破乳率高达92.3%。与常规微波加热(46.86%)相比,加入CaCl2破乳率显著提高。此外,微波破乳法与冻融法相比,在更短的时间内获得了相似的破乳率。并对破乳后花生油的氧化特性和脂肪酸组成进行了研究,在盐辅助微波、冻融和加热破乳的油中,脂肪酸组成没有显著差异,盐辅助微波破乳花生油的氧化性能优于常规加热破乳花生油。近年来,GENG等[38]研究盐和食品级表面活性剂(司盘和吐温系列)辅助水萃取提取核桃油的方法,在司盘20浓度为17 g/L核桃、反应温度85 ℃、反应时间1 h、NaCl浓度1.2 mol/L、料液比1∶5(g∶mL)的条件下出油率为91.2%。由于低分子量表面活性剂具有更强的表面活性,在合适的浓度下,低分子量表面活性剂可以有效地将部分蛋白质从水包油(O/W)界面上置换出来,从而降低了O/W界面的界面张力(与蛋白质相比),降低了乳状液的稳定性[39-40]。
4 结语
在水酶法提油过程中,原料预处理、酶解技术、破乳技术都非常重要,三者缺一不可,相辅相成。合适的原料预处理技术、酶解技术和破乳技术相结合才可以显著提高水酶法提油率。但是,目前不同研究人员在酶的选择及酶解条件上均存在较大差异,特别是出油率的计算依据也不相同,导致不同研究结果直接比较的意义不大。另外,现有研究中油料的品种和产地来源单一,缺乏对不同品种和不同产地油料的组织结构、淀粉含量、蛋白质含量、油脂含量及脂滴与非脂组分结合方式等重要基础数据的研究,尚未建立针对不同油料的差异化原料预处理技术方案,导致现有水酶法在实际应用中常出现油脂提取率不稳定的现象。为了解决实际应用中水酶法提油时间长、出油率不稳定和破乳困难等问题,当前亟需系统开展油料组分差异、原料前处理方式及粉碎粒径等与酶解工艺的关联性研究,以期针对不同原料采用差异化酶解条件,从而在降低酶用量、缩短提取时间、降低生产成本的同时,获得高的出油率。
[1] POLMANN G, BADIA V, FRENA M, et al.Enzyme-assisted aqueous extraction combined with experimental designs allow the obtaining of a high-quality and yield pecan nut oil[J].LWT, 2019, 113:108283.
[2] SORITA G D, FAVARO S P, AMBROSI A, et al.Aqueous extraction processing:An innovative and sustainable approach for recovery of unconventional oils[J].Trends in Food Science &Technology, 2023, 133:99-113.
[3] 李志远. 牡丹种子油体发育特点及其OLEs基因的表达特性研究[D].扬州:扬州大学, 2018.LI Z Y.Study on the development characteristics of peony seed oil body and the expression characteristics of OLEs gene[D].Yangzhou:Yangzhou University, 2018.
[4] TZEN J T, HUANG A H.Surface structure and properties of plant seed oil bodies[J].The Journal of Cell Biology, 1992, 117(2):327-335.
[5] 朱凯艳, 张文斌, 杨瑞金, 等.粉碎处理对花生水酶法提取油脂和蛋白质的影响[J].食品与机械, 2012, 28(2):119-122.ZHU K Y, ZHANG W B, YANG R J, et al.Influence of pulverization treatment on aqueous enzymatic extraction of peanut oil and protein hydrolysates[J].Food &Machinery, 2012, 28(2):119-122.
[6] 孙红, 费学谦, 方学智.油茶籽油水酶法制取工艺优化[J].中国油脂, 2011, 36(4):11-15.SUN H, FEI X Q, FANG X Z.Aqueous enzymatic extraction of oil-tea camellia seed oil[J].China Oils and Fats, 2011, 36(4):11-15.
[7] 赵华, 刘侃, 伍丹, 等.水酶法提取玉米胚芽油预处理工艺参数优化[J].食品研究与开发, 2008, 29(12):79-81.ZHAO H, LIU K, WU D, et al.Optimization of pre-treatment of extracting corn germ oil by aqueous enzymatic method[J].Food Research and Development, 2008, 29(12):79-81.
[8] 盖晴晴. 水酶法提取牡丹籽油工艺改进及水相蛋白特性研究[D].无锡:江南大学, 2020.GAI Q Q.Process improvement on aqueous enzymatic extraction of peony seed oil and investigation on protein properties[D].Wuxi:Jiangnan University, 2020.
[9] 王宇晗, 郭天赋, 边昊, 等.超声波辅助水酶法提取黑加仑籽油及其品质分析[J].食品工业科技, 2023, 44(6):267-274.WANG Y H, GUO T F, BIAN H, et al.Extraction of blackcurrant seed oil by ultrasound-assisted aqueous enzymatic method and its quality analysis[J].Science and Technology of Food Industry, 2023, 44(6):267-274.
[10] 宋媛媛. 乙醇辅助水酶法提取牡丹籽油工艺研究[D].无锡:江南大学, 2018.SONG Y Y.Ethanol-assisted aqueous enzymatic extraction of peony seed oil[D].Wuxi:Jiangnan University, 2018.
[11] 凌闽, 李琳何, 范方舒, 等.用于水酶法提油的油菜籽挤压预处理参数优化[J].中国粮油学报, 2022, 37(5):116-122.LING M, LI L H, FAN F S, et al.Extrusion pretreatment parameter optimization of rapeseed used as raw material of extracting oil by aqueous enzymatic method[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(5):116-122.
[12] 张敏, 许朵霞, 王振华, 等.水酶法提取米糠油的试验研究[J].粮油食品科技, 2021, 29(5):1-10.ZHANG M, XU D X, WANG Z H, et al.Research on the enzyme assisted extraction of rice bran oil[J].Science and Technology of Cereals, Oils and Foods, 2021, 29(5):1-10.
[13] 王慧娟, 吴正奇, 黄梦萍, 等.乙醇预处理水酶法提取牡丹籽油的工艺优化[J].食品研究与开发, 2020, 41(12):135-139.WANG H J, WU Z Q, HUANG M P, et al.Optimization of ethanol pretreatment of aqueous enzymatic extraction of peony seed oil[J].Food Research and Development, 2020, 41(12):135-139.
[14] 郝莉花, 陈复生, 殷丽君.水酶法乳状液的稳定性及其破乳方法研究进展[J].粮食与油脂, 2017, 30(3):13-16.HAO L H, CHEN F S, YIN L J.Advance on stabilization of emulsions and emulsification methods in aqueous enzymatic extraction of oil[J].Cereals &Oils, 2017, 30(3):13-16.
[15] VELDSINK J W, MUUSE B G, MEIJER M M T, et al.Heat pretreatment of oilseeds:Effect on oil quality[J].Lipid-Fett, 1999, 101(7):244-248.
[16] 王丹丽, 袁雅雯, 王淇, 等.非热加工技术辅助水酶法提取植物油脂的研究进展[J].核农学报, 2023, 37(8):1643-1650.WANG D L, YUAN Y W, WANG Q, et al.Research progress in non-thermal processing assisted aqueous enzymatic extraction of vegetable oil[J].Journal of Nuclear Agricultural Sciences, 2023, 37(8):1643-1650.
[17] 陈昀, 赵谋明, 孙哲浩.蛋白质与多糖类交互作用研究进展[J].食品科学, 2001, 22(4):90-93.CHEN Y, ZHAO M M, SUN Z H.Advances in interaction between proteins and polgsaccharides[J].Food Science, 2001, 22(4):90-93.[18] 王慧娟. 基于水酶法的化学改性提取牡丹籽油清洁生产工艺研究[D].武汉:湖北工业大学, 2020.WANG H J.Research on clean production process of extraction of peony seed oil by chemical modification based on aqueous enzymatic method[D].Wuhan:Hubei University of Technology, 2020.
[19] HU B, WANG H Y, HE L F, et al.A method for extracting oil from cherry seed by ultrasonic-microwave assisted aqueous enzymatic process and evaluation of its quality[J].Journal of Chromatography A, 2019, 1587:50-60.
[20] HU B, LI Y, SONG J X, et al.Oil extraction from tiger nut (Cyperus esculentus L.) using the combination of microwave-ultrasonic assisted aqueous enzymatic method - design, optimization and quality evaluation[J].Journal of Chromatography.A, 2020, 1627:461380.
[21] D AZ-SU
AZ-SU REZ P, ROSALES-QUINTERO A, FERNANDEZ-LAFUENTE R, et al.Aqueous enzymatic extraction of Ricinus communis seeds oil using Viscozyme L[J].Industrial Crops and Products, 2021, 170:113811.
REZ P, ROSALES-QUINTERO A, FERNANDEZ-LAFUENTE R, et al.Aqueous enzymatic extraction of Ricinus communis seeds oil using Viscozyme L[J].Industrial Crops and Products, 2021, 170:113811.
[22] 宋媛媛, 杨瑞金, 张文斌, 等.牡丹籽油乙醇辅助水酶法提取工艺优化及品质分析[J].食品与机械, 2018, 34(4):180-185.SONG Y Y, YANG R J, ZHANG W B, et al.Optimization of ethanol-assisted aqueous enzymatic extraction and quality analysis of peony seed oil[J].Food &Machinery, 2018, 34(4):180-185.
[23] 陶海英, 马娇, 徐同成, 等.不同酶处理对小麦胚芽油提取率的影响[J].食品研究与开发, 2014, 35(10):17-19;20.TAO H Y, MA J, XU T C, et al.The influence of different enzyme treatment for extraction rate of wheat germ oil[J].Food Research and Development, 2014, 35(10):17-19;20.
[24] ZHENG X, JUAN M, KOU X H, et al.Investigation on the emulsification mechanism in aqueous enzymatic extraction of edible oil from Schizochytrium sp[J].Journal of the Science of Food and Agriculture, 2023, 103(6):2904-2913.
[25] 王亚萍, 姚小华, 常君, 等.薄壳山核桃油水酶法提取工艺优化及品质分析[J].中国油脂, 2022, 47(5):1-6.WANG Y P, YAO X H, CHANG J, et al.Optimization of aqueous enzymatic extraction process of pecan oil and its quality analysis[J].China Oils and Fats, 2022, 47(5):1-6.
[26] 朱敏敏, 赵巧玲, 魏长庆.水酶法制油工艺研究进展[J].粮食与油脂, 2017, 30(11):12-13.ZHU M M, ZHAO Q L, WEI C Q.Research advance on aqueous enzymatic extraction technology of oil[J].Cereals &Oils, 2017, 30(11):12-13.
[27] NADAR S S, RAO P, RATHOD V K.Enzyme assisted extraction of biomolecules as an approach to novel extraction technology:A review[J].Food Research International, 2018, 108:309-330.
[28] QIU C Y, HE Y J, HUANG Z C, et al.Lipid extraction from wet Nannochloropsis biomass via enzyme-assisted three phase partitioning[J].Bioresource Technology, 2019, 284:381-390.
[29] MCCLEMENTS D J.Emulsion design to improve the delivery of functional lipophilic components[J].Annual Review of Food Science and Technology, 2010, 1:241-269.
[30] HOFFMANN H, REGER M.Emulsions with unique properties from proteins as emulsifiers[J].Advances in Colloid and Interface Science, 2014, 205:94-104.
[31] MANTOVANI R A, FATTORI J, MICHELON M, et al.Formation and pH-stability of whey protein fibrils in the presence of lecithin[J].Food Hydrocolloids, 2016, 60:288-298.
[32] 李杨, 齐宝坤, 隋晓楠, 等.水酶法提取花生油高压蒸汽破乳工艺研究[J].中国油脂, 2016, 41(7):6-9.LI Y, QI B K, SUI X N, et al.High-pressure vapor demulsification of aqueous enzymatic extraction of peanut oil[J].China Oils and Fats, 2016, 41(7):6-9.
[33] 肖冰, 刘伟.水酶法提取高油酸花生油的破乳及品质研究[J].河南工业大学学报(自然科学版), 2019, 40(5):7-12.XIAO B, LIU W.Demulsification and quality study of the high-oleic peanut oils obtained by aqueous enzymatic extraction method[J].Journal of Henan University of Technology (Natural Science Edition), 2019, 40(5):7-12.
[34] YANG J Y, LI J, WANG M, et al.A novel aqueous extraction for Camellia oil by emulsified oil:A frozen/thawed method[J].European Journal of Lipid Science and Technology, 2019, 121(4):1800431.
[35] 迟延娜, 张文斌, 杨瑞金, 等.顽固乳状液的破乳处理提高花生游离油提取率[J].农业工程学报, 2014, 30(8):257-264.CHI Y N, ZHANG W B, YANG R J, et al.Destabilization of stubborn emulsion formed during aqueous extraction improving extraction rate of total free oil from peanut[J].Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(8):257-264.
[36] LI P F, ZHANG W B, HAN X, et al.Demulsification of oil-rich emulsion and characterization of protein hydrolysates from peanut cream emulsion of aqueous extraction processing[J].Journal of Food Engineering, 2017, 204:64-72.
[37] LIU W, XIAO B, YANG G L, et al.Rapid salt-assisted microwave demulsification of oil-rich emulsion obtained by aqueous enzymatic extraction of peanut seeds[J].European Journal of Lipid Science and Technology, 2020, 122(2):1900120.
[38] GENG Q N, CHEN J, GUO R, et al.Salt-assisted aqueous extraction combined with Span 20 allow the obtaining of a high-quality and yield walnut oil[J].LWT, 2020, 121:108956.
[39] VAN AKEN G A.Competitive adsorption of protein and surfactants in highly concentrated emulsions:Effect on coalescence mechanisms[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2003, 213(2-3):209-219.
[40] YONGUEP E, KAPIAMBA K F, KABAMBA K J, et al.Formation, stabilization and chemical demulsification of crude oil-in-water emulsions:A review[J].Petroleum Research, 2022, 7(4):459-472.