慢传输型便秘(slow transit constipation,STC)是一种常见的功能性便秘类型,主要表现为排便不频繁、排便费力和粪便干硬[1]。虽然便秘不会危及生命,但严重影响了人们的生活质量,增加了高血压、缺血性脑卒中等心脑血管疾病的致死率[2],而且与大肠癌的发病率密切相关[3]。大量研究表明,STC可能与5-羟色胺(5-hydroxytryptamine,5-HT)信号传导障碍、肠道屏障受损、胃肠激素失调和Cajal间质细胞(interstitial cell of Cajal,ICC)功能障碍等相关[4-6]。临床上对于便秘主要采用刺激性泻剂、膨胀性泻剂、渗透性泻剂和促动力剂,但是长期服用西药可能产生依赖性,部分患者在停药后便秘症状更为严重[7]。因此,很多患者会在日常生活中选择具有润肠通便功能的食品,如火龙果、西梅等,这些均被证实具有良好的通便功效[8-11]。
桃胶是蔷薇科李属植物桃树(Prunus persica (L.) Batsch)自然分泌或为促进伤口而分泌的胶质半透明物质,含有丰富的多糖、氨基酸、膳食纤维等成分,具有清热止咳、润肠通便的功效[12]。2023年9月,国家卫生健康委正式批准桃胶成为“三新食品”,其主要成分是多糖。目前有文献报道桃胶多糖可改善复方地芬诺酯诱导的便秘,但桃胶多糖缓解便秘的作用有待进一步明确,且其作用机制也可深入研究[13]。因此本研究通过盐酸洛哌丁胺造模建立便秘模型小鼠,观察桃胶多糖对模型小鼠的影响,初步探讨其治疗便秘的作用机制,为后续开发桃胶功能性食品提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级ICR小鼠50只,雄性,11月龄;购自上海市计划生育科学研究所实验动物经营部,许可证号:SCXK(沪)2018-0006;合格证号20180006050417。动物实验经浙江中医药大学实验动物管理与伦理委员会批准(批准号ZSLL-2016-118)。
盐酸洛哌丁胺,西安杨森制药有限公司(货号10910085);枸橼酸莫沙比利片,鲁南贝特制药有限公司(货号26230210);苏木素-伊红染液套装,南京建成科技有限公司(货号20230703);小鼠5-HT酶联免疫吸附测定试剂盒,睿信生物科技有限公司(货号RXJ203223M);小鼠胃动素(motilin,MTL)、胃泌素(gastrin,GAS)ELISA试剂盒,江苏酶免生物科技有限公司(货号MM-0492M1、MM-44405M1);色氨酸羟化酶1(tryptophan hydroxylase 1,TPH-1)抗体,杭州华安生物技术有限公司(货号ET1610-37);闭合蛋白(Occludin)抗体、五羟色胺3受体(5-HT3R)抗体,武汉三鹰生物技术有限公司(货号66378-1-Ig、29685-1-AP);Goat anti-Rabbit IgG、Goat anti-Mouse IgG(贷号HA1001、HA1006),均购自杭州华安生物技术有限公司。
1.2 仪器与设备
Lambda 45紫外可见光分光光度计,美国PerkinElmer公司;MF43-N正置荧光显微镜,广州市明美光电技术有限公司。YLS-13A大小鼠抓力测定仪,济南益延科技有限公司;D-37520微量离心机,美国Thermo公司;Powerwave340酶标仪,美国BIO-TEK公司;Tissue-TekVIP5 Jr自动脱水机,日本樱花检验仪器株式会社;EC360包埋机,德国MEIKO公司;RM2245半自动切片机,德国Leica公司。
1.3 方法
1.3.1 桃胶多糖的制备
取桃胶适量,研磨过3号筛,加入体积20倍热水加热(80 ℃)搅拌4 h,冷却至室温后,3 500 r/min离心15 min,收集上清液,重复两次。合并后的上清液于50 ℃减压浓缩至1/5体积,边搅拌边加入浓缩液4倍体积的无水乙醇,4 ℃放置过夜。醇沉液3 500 r/min离心15 min,弃去上清液,沉淀加入体积分数为80%的乙醇冲洗,3 500 r/min离心10 min,再取沉淀加入体积分数80%乙醇冲洗,3 500 r/min离心10 min,弃去上清液,醇沉物冷冻干燥48 h,即得桃胶多糖。
1.3.2 桃胶多糖中总多糖含量测定
精密称取葡萄糖对照品1.02 mg加水溶解于10 mL容量瓶中,配置成浓度为0.102 mg/mL的对照品溶液。分别吸取0、0.1、0.3、0.5、0.7、0.9和1 mL的葡萄糖标准溶液至10 mL具塞试管中,再加水补至2 mL。精密加入新鲜配置的质量分数5%苯酚溶液1 mL,混匀,再置于冰浴中加入5 mL浓硫酸,摇匀,冷却5 min后,置沸水浴20 min,取出置冰浴中冷却5 min,提前半小时预热紫外光谱仪,以相应试剂为空白,测吸光度,绘制标准曲线方程。精密称取桃胶多糖3份,加水超声溶解,制备成浓度为0.1 mg/mL的供试品溶液,计算总多糖含量。
1.3.3 动物分组及给药
采用11月龄雄性ICR小鼠,按体重随机分为正常组(NC)、模型组(MC)、枸橼酸莫沙必利1.95 mg/kg组(PC)、桃胶多糖100 mg/kg组(PGP-L)、桃胶多糖300 mg/kg组(PGP-H)。除正常组,其余各组小鼠灌胃盐酸洛哌丁胺(10 mg/kg)连续14 d,第15天每天灌胃给予相应治疗药物连续3周,其余组别给予等体积蒸馏水。
1.3.4 抓力
给药第3周,抓住小鼠尾根处,待小鼠四肢抓住抓力板时及时后拉,适应3次,正式测3次,记录数值,取平均值。
1.3.5 自主活动
给药第3周,安静环境下,置小鼠于自主活动仪中适应5 min后,开始记录5 min内总活动次数。
1.3.6 十字迷宫
给药第3周,安静环境下,小鼠置于高架十字迷宫中,记录5 min内小鼠在迷宫中活动情况。
1.3.7 排便粒数、粪便含水率测定
给药第3周,将小鼠置于代谢笼中,记录5 h内排便粒数;收集小鼠新鲜粪便3~4粒,105 ℃干燥4 h,按照公式(1)计算粪便含水率:
粪便含水率![]()
(1)
1.3.8 首次黑便时间
墨汁制备:准确称取活性碳粉50 g、阿拉伯胶100 g,加入1 000 mL水中,煮沸3次冷却后放置冰箱4 ℃保存,用前摇匀。
给药第3周,小鼠给予墨汁灌胃,测定小鼠首次排出黑便时间。
1.3.9 肠推进率和胃排空率
末次给药后,小鼠进行禁食禁水24 h后,各组小鼠灌胃0.5 mL的墨汁溶液。20 min后脱颈处死,开腹取胃称重即为胃总重,然后剪开胃体洗去内容物擦干净称重为胃净重。按照公式(2)计算胃排空率:
胃排空率![]()
(2)
然后剖开小鼠腹部,取出小鼠自幽门至回肠部分,铺展测量长度,即为小肠全长,并测量幽门至墨汁前沿部分为墨汁推进部分。按照公式(3)计算小肠推进率:
小肠推进率![]()
(3)
1.3.10 胃肠激素
给药3周后,小鼠眼眶取血,4 ℃放置2 h,3 500 r/min离心10 min后取上清,再离心10 min,取上清即为血清。采用ELISA法测定血清中GAS、MTL、5-HT水平。
1.3.11 结肠组织形态学观察
小鼠处死后,取1 cm结肠组织在40 g/L多聚甲醛固定3 d后进行石蜡包埋、组织切片(4 um)。切片经过脱蜡、复水后使用苏木精-伊红染色(HE染色)、阿利新蓝-过碘酸-雪夫染色(alixin blue periodic acid schiff staining,AB-PAS),中性树脂封片干燥后于镜下观察结肠组织病理变化,并用Image J软件分析单位面积内杯状细胞相对占比。
1.3.12 免疫组化法测定结肠组织中5-HT3R表达
参考汪晨兴等[14]报道的方法,取小鼠结肠组织石蜡切片(4 μm),经过脱蜡、复水、抗原修复、避光消除内源性过氧化氢酶活性、封闭,滴加5-HT3R抗体,4 ℃孵育过夜;复温30 min滴加二抗,烘箱37 ℃孵育30 min;经DAB显色、苏木素染色、乙醇脱水及中性树脂封片干燥后,于镜下观察5-HT3R蛋白的表达情况。
1.3.13 免疫荧光法测定结肠组织中Occludin和Claudin-1表达
参考魏柯建等[15]报道的方法,取小鼠结肠组织石蜡切片(4 μm),经脱蜡、复水、抗原修复、避光消除内源性过氧化氢酶活性、封闭,滴加Occludin、Claudin-1抗体,4 ℃孵育过夜;复温30 min滴加二抗,37 ℃孵育30 min;经DAPI核染,滴加抗荧光猝灭剂后封片,于蔡司正置荧显微镜下观察结肠中蛋白的表达情况。
1.3.14 蛋白免疫印记(Western Blot)法测定结肠组织中Occludin、5-HT3R和TPH-1表达
蛋白提取:取各组小鼠结肠组织,加入RIPA裂解液和蛋白磷酸酶抑制剂,加入钢珠,组织研磨机60 Hz研磨30 s,重复5次,后至于冰上裂解30 min后,12 000 r/min离心15 min,小心吸取上清液提取组织蛋白。采用超微量分光光度计测定各样本的蛋白含量,用配制好的裂解液将蛋白浓度调整一致;加入蛋白上样缓冲液,95 ℃金属浴变性10 min,放入-20 ℃冰箱保存备用。
Western blot:制备80 g/L的SDS-PAGE凝胶,取出蛋白样本,上样10 μL。采用80 V的电压进行30 min电泳后,继续用120 V的电压电泳90 min。之后用湿法转膜,恒流400 mA,25 min。用快速封闭液浸没PVDF膜封闭15 min,PBST洗膜3次,分别滴加Occludin、5-HT3R、TPH-1抗体,4 ℃冰箱孵育过夜。12 h后,PBST洗膜3次,每次15 min,室温孵育二抗2 h后进行ECL发光。采用Image J软件进行灰度分析。
1.4 统计学分析
采用SPSS 26.0软件进行统计学分析,数据以均数±标准差![]() 表示,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
表示,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 桃胶多糖中总多糖含量测定
如图1所示,标准曲线方程为Y=0.068 19X+0.054 23,R2=0.999,说明葡萄糖在0.01~0.1 mg/mL浓度范围内线性关系良好。计算求得桃胶总多糖含量为(82.06±0.60)%。
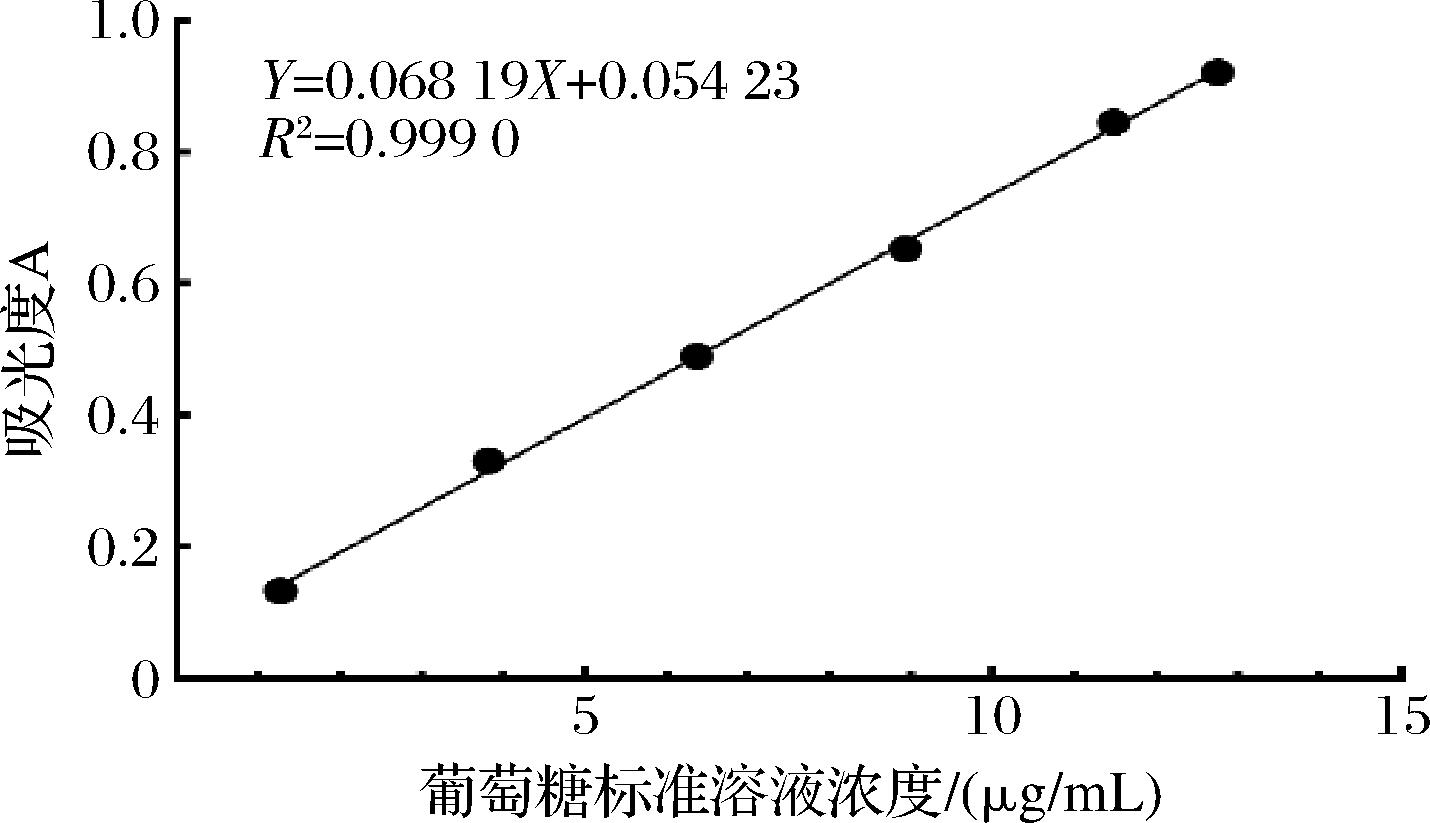
图1 苯酚浓硫酸法测定多糖标准曲线
Fig.1 Standard curve for the determination of polysaccharides by phenol concentrated sulfuric acid method
2.2 桃胶多糖对便秘模型小鼠行为学的影响
2.2.1 对抓力的影响
如图2所示,与正常组相比,模型组小鼠抓力显著降低(P<0.01);与模型组相比,桃胶多糖两个剂量组小鼠抓力均显著升高(P<0.01)。
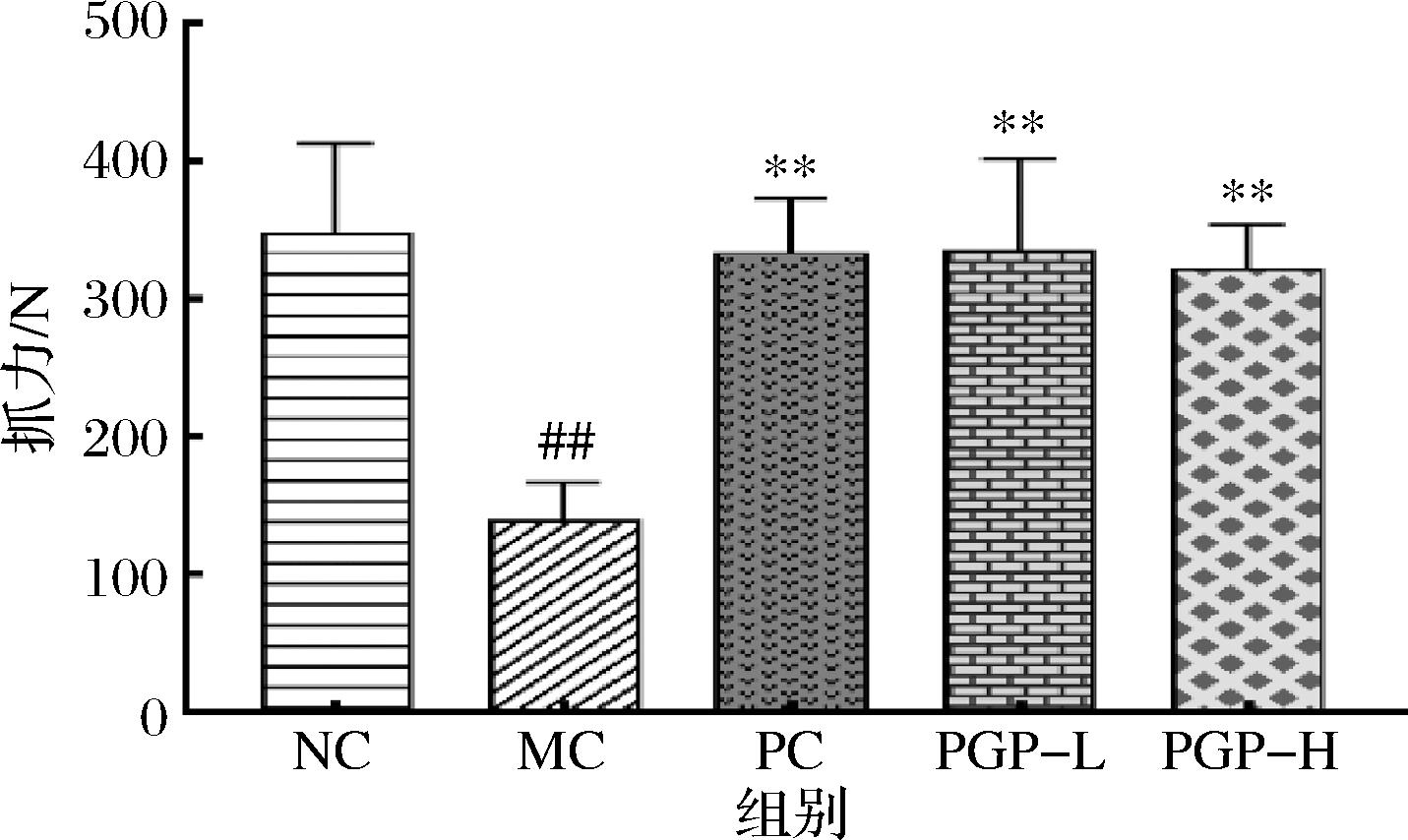
图2 桃胶多糖对便秘模型小鼠抓力的影响(n=8)
Fig.2 Effect of peach gum polysaccharide on the gripping power of mice model of constipation(n=8)
注:NC-正常组;MC-模型组;PC-枸橼酸莫沙必利1.95 mg/kg组;PGP-L-桃胶多糖100 mg/mL组;PGP-H-桃胶多糖300 mg/mL组。
与正常组相比#P<0.05,##P<0.01;与模型组相比*P<0.05,**P<0.01(图3~8、11同)。
2.2.2 对自主活动的影响
如图3所示,与正常组相比,模型组小鼠自主活动次数显著减少(P<0.01);与模型组相比,桃胶多糖两个剂量组小鼠自主活动次数均显著增加(P<0.01)。
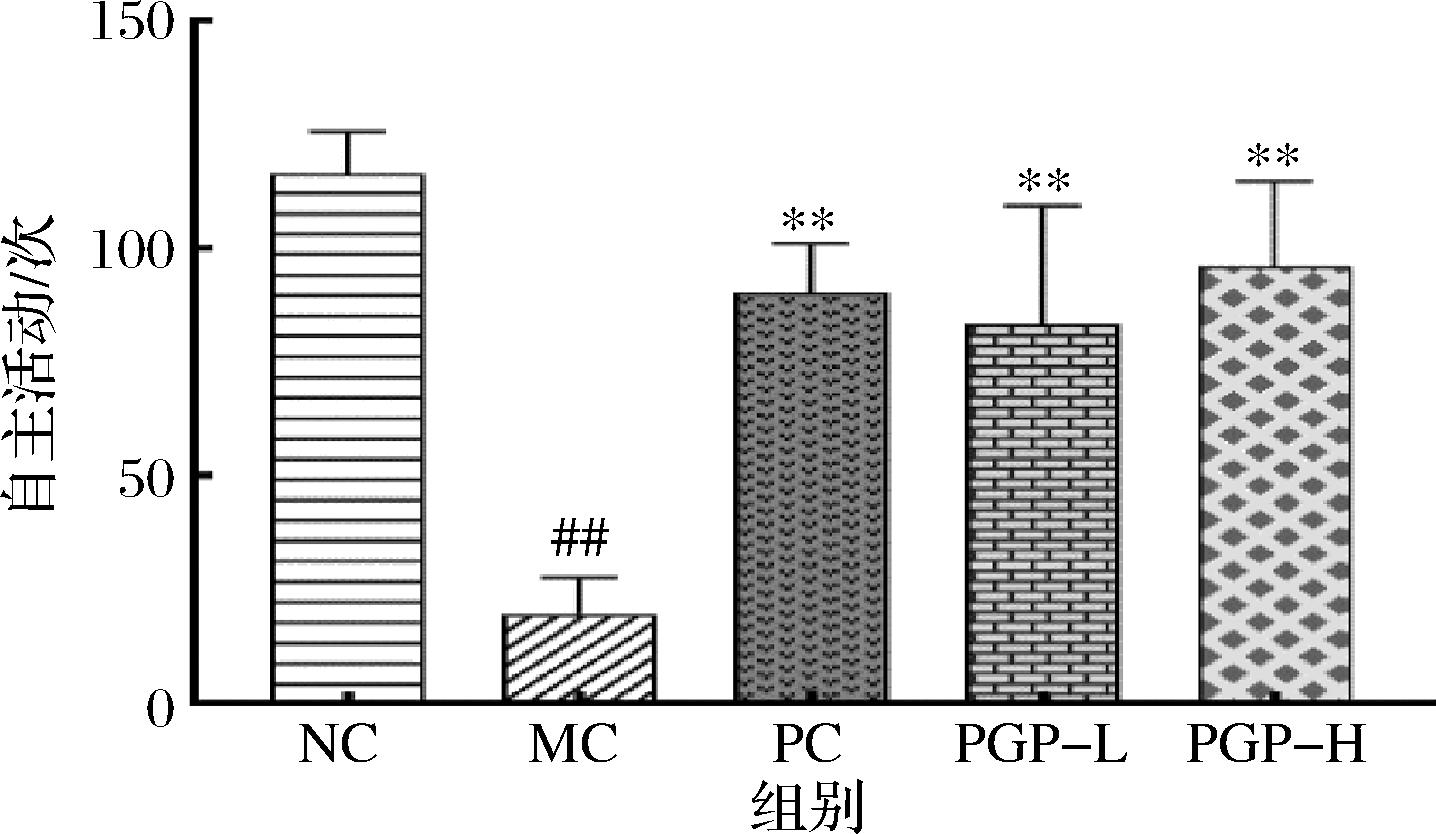
图3 桃胶多糖对便秘模型小鼠自主活动次数的影响(n=8)
Fig.3 Effect of peach gum polysaccharide on the number of autonomic activity in mice model of constipation(n=8)
2.2.3 对十字迷宫的影响
如图4所示,与正常组相比,模型组小鼠开放臂进入次数和开放臂停留时间显著减少(P<0.01);与模型组相比,桃胶多糖100 mg/kg组小鼠开放臂进入次数和开放臂停留时间显著增加(P<0.01),桃胶多糖300 mg/kg组小鼠开放臂进入次数显著增加(P<0.05)。
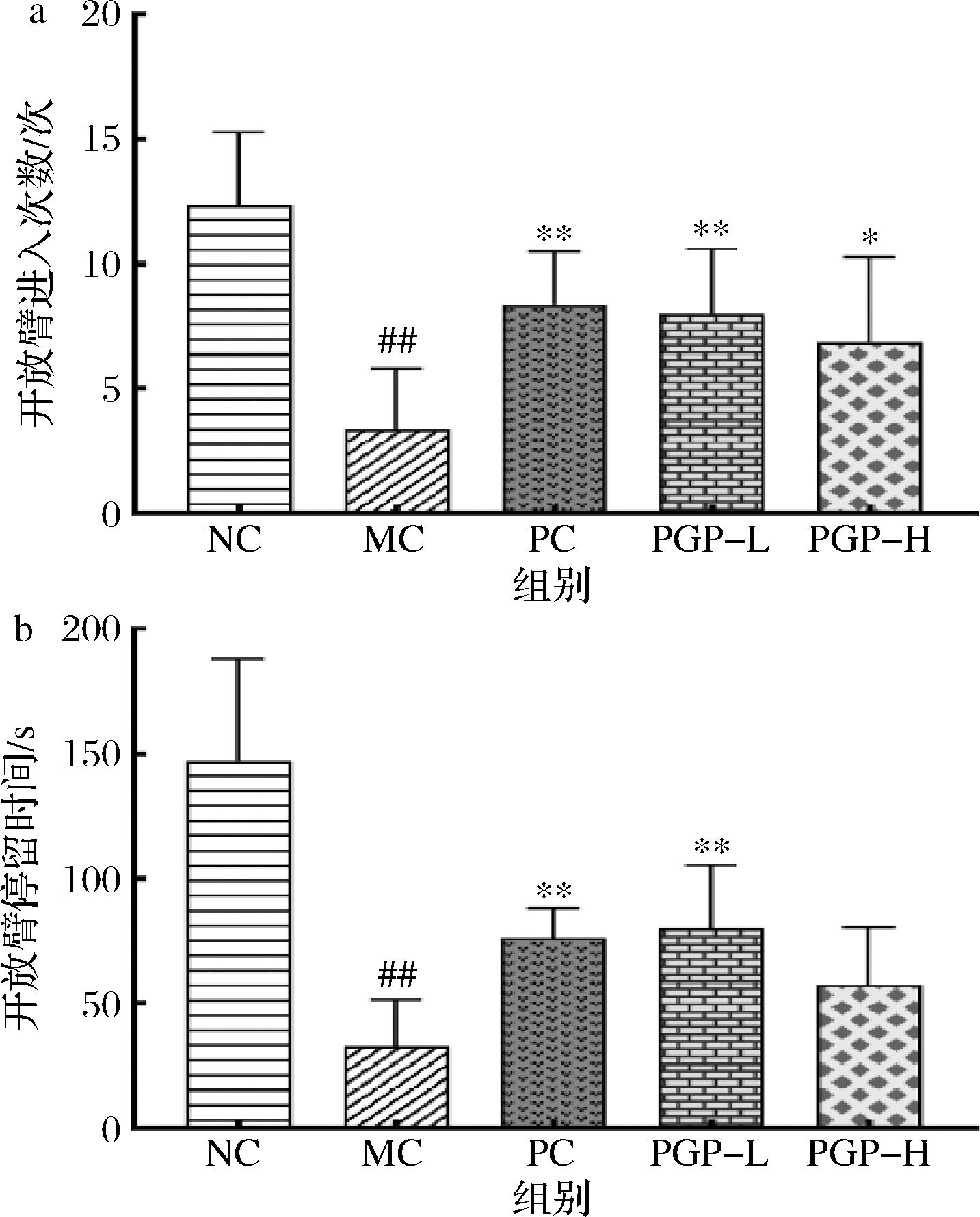
a-开放臂进入次数;b-开放臂停留时间
图4 桃胶多糖对便秘模型小鼠焦虑行为的影响(n=8)
Fig.4 Effect of peach gum polysaccharide on anxiety behavior in mice model of constipation(n=8)
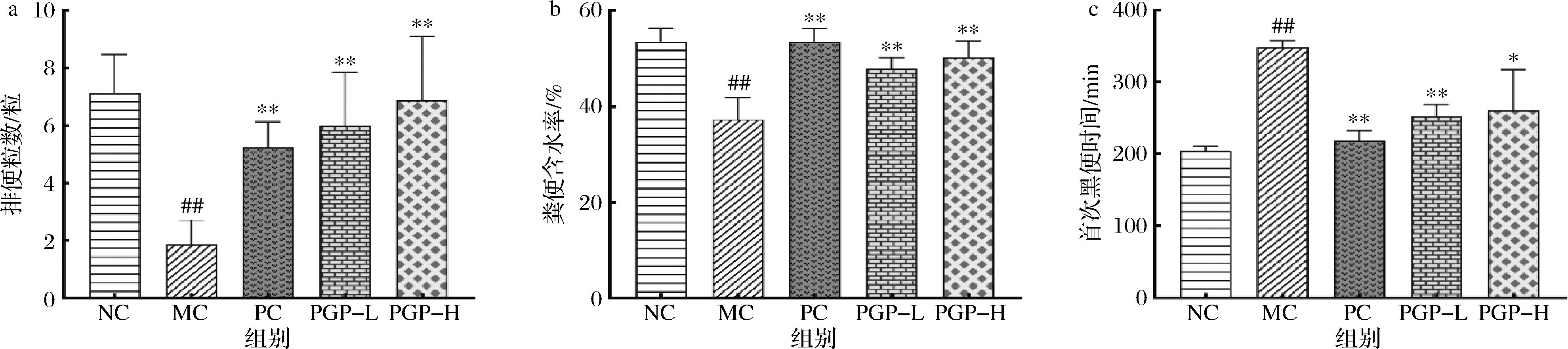
a-排便粒数;b-粪便含水率;c-首次黑便时间
图5 桃胶多糖对便秘模型小鼠排便功能的影响(n=8)
Fig.5 Effect of peach gum polysaccharide on defecation function in mice model of constipation(n=8)
2.3 桃胶多糖对便秘模型小鼠排便情况的影响
2.3.1 对排便粒数、粪便含水率和首次黑便时间的影响
如图5所示,与正常组相比,模型组小鼠5 h内排便粒数和粪便含水率均显著减少(P<0.01),首次黑便时间显著增加(P<0.01);与模型组相比,桃胶多糖两个剂量组小鼠排便粒数和粪便含水率显著增加(P<0.01),首次黑便时间显著减少(P<0.05、0.01)。
2.3.2 对胃排空率和小肠推进率的影响
如图6所示,与正常组相比,模型组小鼠胃排空率和小肠推进率显著降低(P<0.01);与模型组相比,桃胶多糖300 mg/kg组小鼠胃排空率显著增加(P<0.01),桃胶多糖两个剂量组小鼠小肠推进率均有增加的趋势。
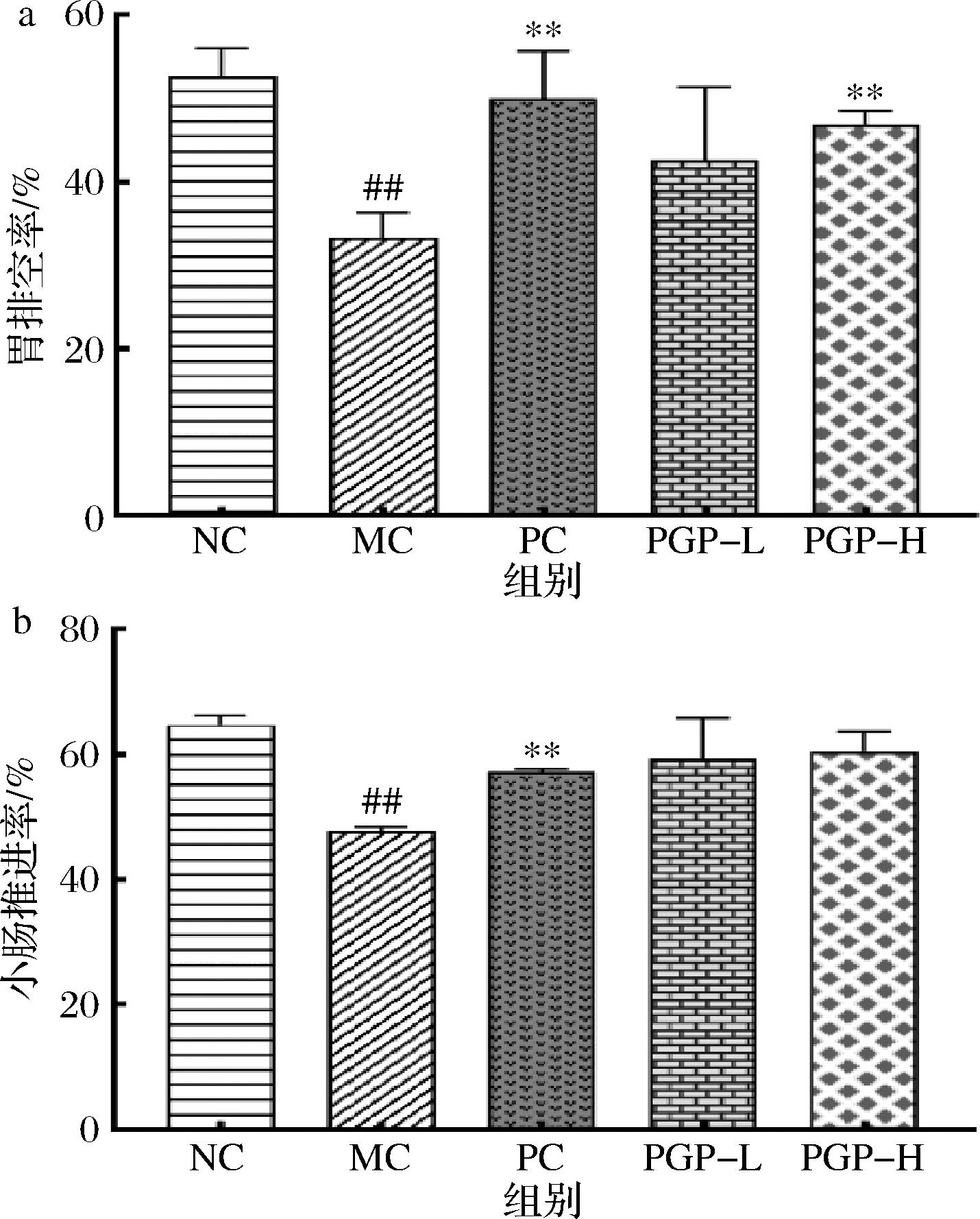
a-胃排空率;b-小肠推进率
图6 桃胶多糖对便秘模型小鼠胃排空率和小肠推进率的影响(n=3)
Fig.6 Effects of peach gum polysaccharide on gastric emptyand intestinal propulsion in mice with constipation(n=3)
2.4 桃胶多糖对便秘模型小鼠血清胃肠激素含量的影响
如图7所示,与正常组相比,模型组小鼠血清中MTL、GAS、5-HT含量均显著减少(P<0.01);与模型组相比,桃胶多糖两个剂量组小鼠血清中MTL、GAS、5-HT含量均显著增加(P<0.05、P<0.01)。
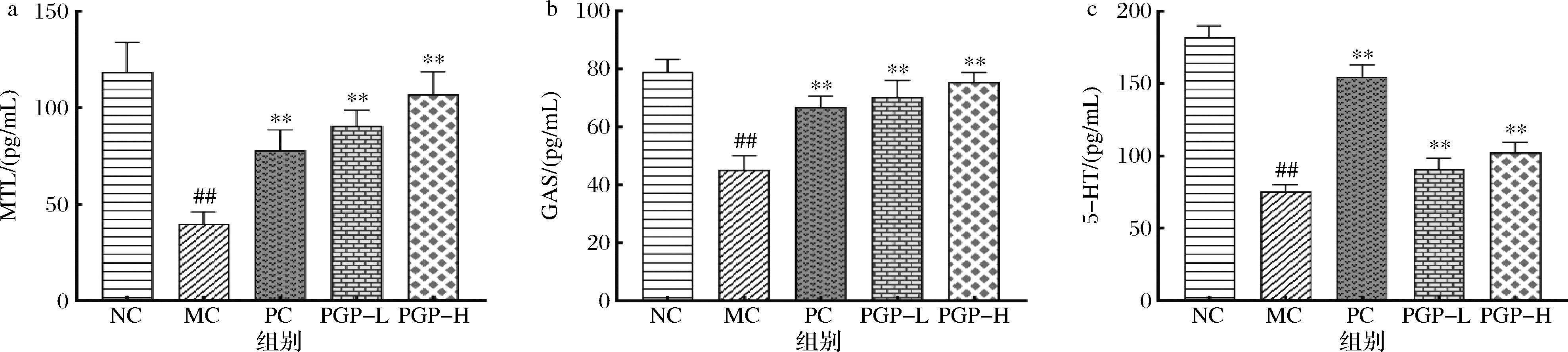
a-MTL;b-GAS;c-5-HT
图7 桃胶多糖对便秘模型小鼠胃肠激素的影响(n=8)
Fig.7 Effects of peach gum polysaccharide on gastrointestinal hormones in mice model of constipation(n=8)
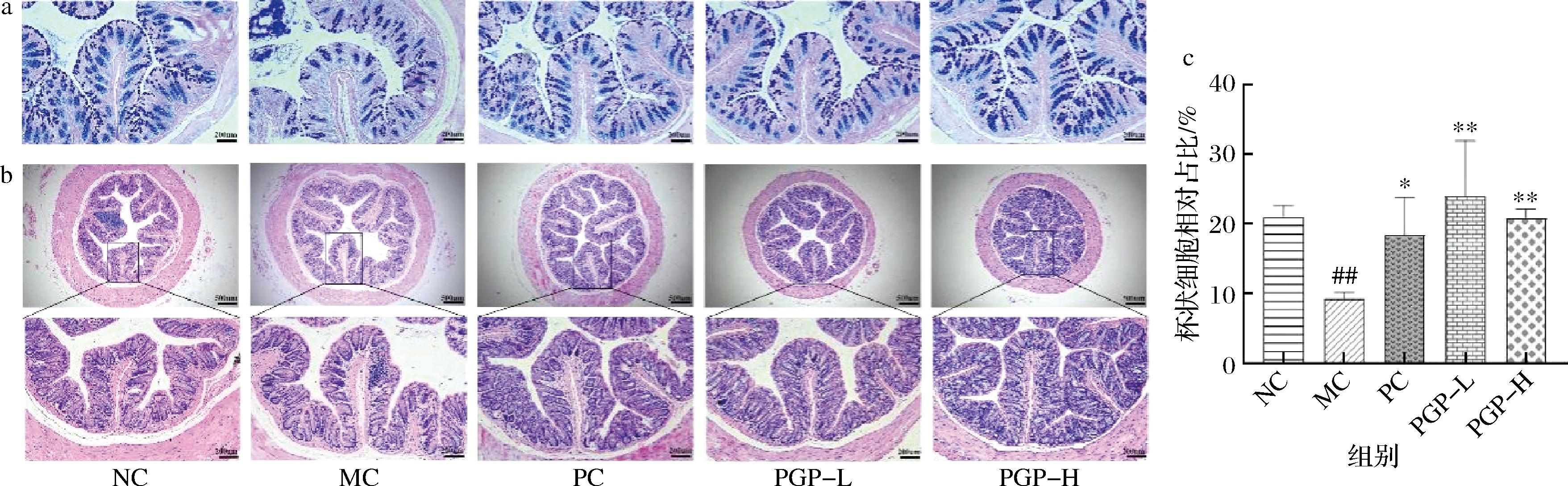
a-AB-PAS染色;b-H&E染色;c-杯状细胞相对占比
图8 桃胶多糖对便秘模型小鼠结肠组织形态学的影响(100×,n=3)
Fig.8 Effect of peach gum polysaccharide on colonic histomorphology in mice model of constipation(100×, n=3)
2.5 桃胶多糖对便秘模型小鼠结肠组织形态学的影响
AB-PAS染色观察发现,与正常组相比,模型组小鼠黏蛋白含量降低、杯状细胞数目显著减少(P<0.01),肠上皮粘膜组织被破坏;与模型组相比,桃胶多糖两个剂量组小鼠结肠组织中杯状细胞数目显著增加(P<0.01),黏蛋白含量丰富,且肠上皮黏膜较为完整,见图8-a、图8-c。
HE染色观察发现,与正常组相比,模型组小鼠结肠肠绒毛结构轻微破坏,且部分存在炎症细胞浸润;桃胶多糖两个剂量组小鼠结肠炎性细胞浸润情况得到明显改善,肠腺排列整齐,见图8-b。
2.6 桃胶多糖对便秘模型小鼠结肠组织中Occludin、Claudin-1、5-HT3R和TPH-1表达的影响
免疫荧光结果表明,与正常组相比,模型组小鼠结肠组织中Occludin和Claudin-1蛋白表达减少;与模型组相比,桃胶多糖两个剂量组小鼠结肠中Occludin和Claudin-1蛋白表达增加,见图9。
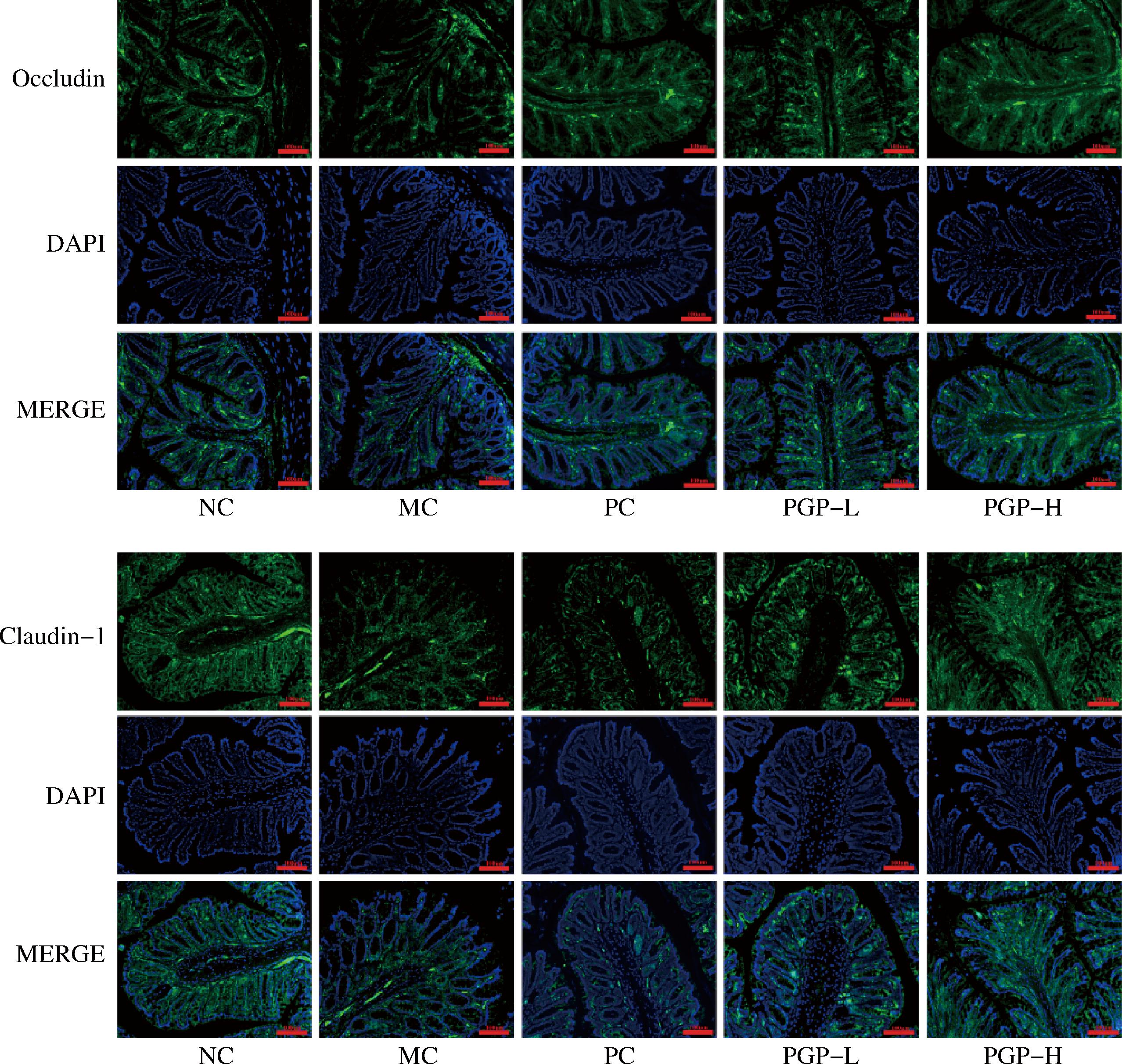
图9 桃胶多糖对便秘模型小鼠结肠组织中Occludin、Claudin-1表达的影响(免疫荧光,200×,n=3)
Fig.9 Effect of peach gum polysaccharide on the expression of Occludin and Claudin-1 in colon tissue of constipated mice
(immunofluorescence, 200×, n=3)
免疫组化结果表明,与正常组相比,模型组小鼠结肠组织中5-HT3R蛋白表达减少;与模型组相比,桃胶多糖两个剂量组小鼠结肠组织中5-HT3R蛋白表达增加,见图10。

图10 桃胶多糖对便秘模型小鼠结肠组织中5-HT3R表达的影响(免疫组化,200×,n=3)
Fig.10 Effect of peach gum polysaccharide on the expression of 5-HT3R in colonic tissue of constipation model mice
(immunohistochemistry, 200×, n=3)
Western blot结果表明,与正常组相比,模型组小鼠结肠组织中Occludin、5-HT3R和TPH-1表达显著降低(P<0.01);与模型组相比,桃胶多糖两个剂量组小鼠结肠组织中Occludin、5-HT3R和TPH-1蛋白表达显著增加(P<0.05、0.01),见图11。
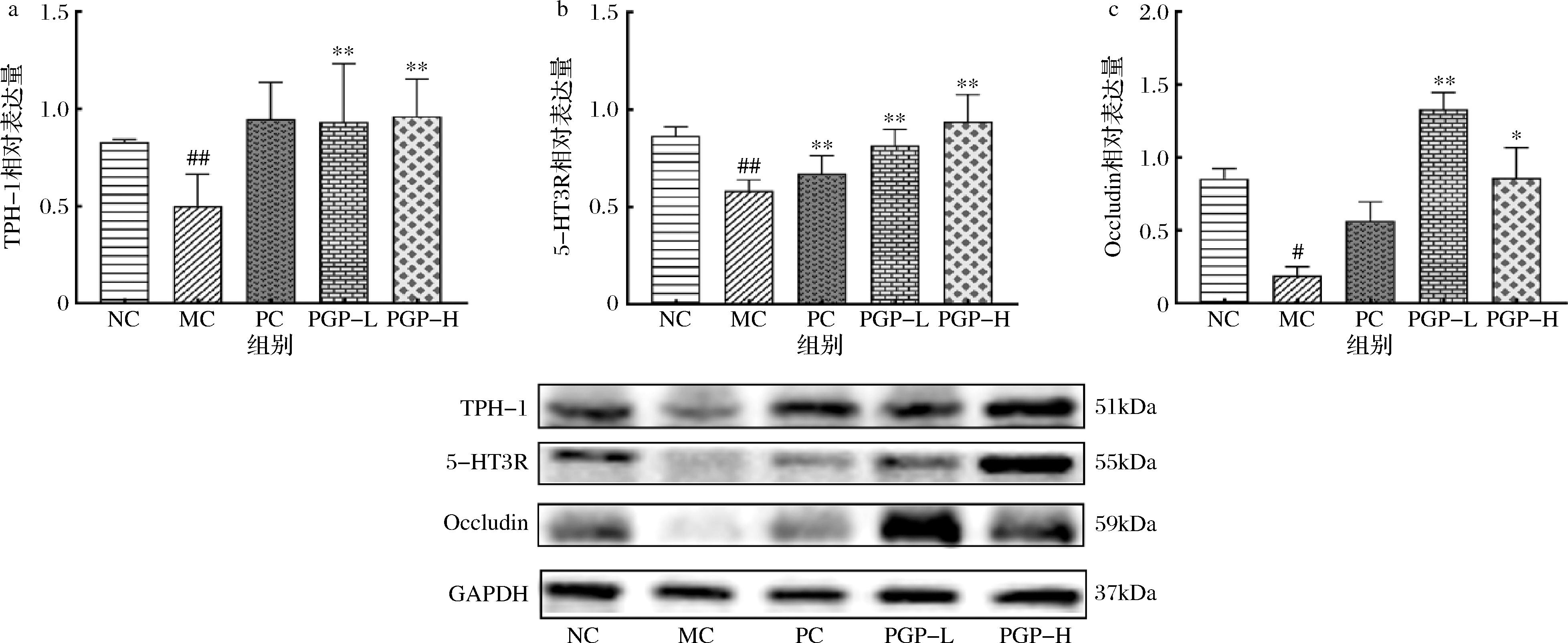
a-TPH-1;b-5-HT3R;c-Occludin
图11 桃胶多糖对便秘模型小鼠结肠组织中Occludin、5-HT3R和TPH-1表达的影响(n=4)
Fig.11 Effect of peach gum polysaccharide on the expression of Occludin, 5-HT3R and TPH-1 in colon tissue of constipated mice(n=4)
3 讨论与结论
慢传输型便秘(slow transit constipation,STC)作为当今社会发病率较高的一种疾病,其主要表现为结肠的运动无力,导致结肠转运粪便功能障碍,结肠内容物从近端结肠移行到远端结肠和直肠慢于正常水平[16]。这种现象主要是由于胃肠蠕动能力减弱和胃肠激素分泌紊乱所致[5,17]。并且粪便长时间停留在肠道中,为有害菌和细菌过度生长提供了机会,过度生长的细菌可能会产生毒素或引发炎症,进而损害肠道粘膜。临床上便秘患者的肠道损伤严重,会出现肠黏膜通透性增加、炎性水肿、上皮细胞脱落和杯状细胞凋亡增多,进一步加剧了便秘的发生发展[18-19]。因此本文测定便秘模型小鼠的胃肠动力和肠粘膜屏障考察桃胶多糖对便秘模型小鼠的改善作用。结果表明,桃胶多糖可以显著增加便秘模型小鼠5小时内排便粒数、粪便含水率、胃排空率,缩短首次黑便时间;增加便秘模型小鼠结肠组织中杯状细胞数量,提高结肠组织中紧密连接蛋白表达,保护肠道屏障,改善便秘。
胃肠激素作为一种小分子活性肽,通过不同的信号通路发挥生物学效应,调节消化系统的运动、分泌和吸收。MTL是调节胃肠运动的主要激素,主要在消化间期通过促使Ca2+内流,增加胃肠道的蠕动和排空动力;GAS是主要由分布于十二指肠近端和胃窦黏膜开放型G细胞分泌的一种活性肽,具有刺激胃酸、胃蛋白酶的分泌,使胃窦和幽门括约肌收缩、帮助消化、延缓胃排空的作用,还具有促进黏膜生长的作用即所谓营养作用[20-22]。研究表明采用盐酸洛哌丁胺诱导的便秘模型小鼠MTL和GAS含量显著降低[23],本实验结果与文献报道一致。而桃胶多糖可以增加模型小鼠血清MTL和GAS含量,以促进胃肠动力,缓解便秘症状。
现研究发现用于治疗功能性胃肠疾病的靶点和5-HT合成、释放和受体相关[24]。5-HT作为肠道重要的神经递质,在胃肠蠕动中起关键作用。人体大约95%的5-HT产生于肠道,在肠嗜铬细胞(enterochromaffin cell,EC)中合成,其中色氨酸作为合成原料通过限速酶色氨酸羟化酶1(tryptophan hydroxylase 1,TPH-1)转化为5-HT的前体5-羟色氨酸(5-hydroxytryptophan,5-HTP),然后代谢为5-HT。随后通过5-羟色胺转运蛋白(5-hydroxytryptamine transporter protein,SERT)转运到肠上皮细胞中,然后通过单胺氧化酶(monoamine oxidase,MAO)降解为5-羟基吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)[25-26]。5-HT主要通过相关受体参与调节胃肠道动力,5-HT受体有7个亚型,其中5-HT4R和5-HT3R与结肠动力障碍关系密切,两者的主要作用在于调控神经递质释放,从而引起肠道平滑肌收缩、使胃肠道蠕动[27-29]。因此两者的表达下降时会影响肠道蠕动,这是便秘发病的重要机制之一。本研究发现桃胶多糖能显著增加模型小鼠血清5-HT水平上升和结肠组织中TPH-1和5-HT3R蛋白表达水平,以促进肠道蠕动进而改善便秘。
综上所述,桃胶多糖能上调便秘模型小鼠结肠中TPH-1和5-HT3R的表达而激活5-HT信号通路,还能增加MTL和GAS等胃肠激素含量,从而促进肠蠕动改善便秘。桃胶作为一种天然的绿色食品,其多糖在改善便秘中展现出良好的发展前景,为未来研发用于治疗便秘的大健康产品提供了部分科学依据。
[1] CROCKETT S D, GREER K B, HEIDELBAUGH J J, et al.American gastroenterological association institute guideline on the medical management of opioid-induced constipation[J].Gastroenterology, 2019, 156(1):218-226.
[2] SUMIDA K, MOLNAR M Z, POTUKUCHI P K, et al.Constipation and risk of death and cardiovascular events[J].Atherosclerosis, 2019, 281:114-120.
[3] GUÉRIN A, MODY R, FOK B, et al.Risk of developing colorectal cancer and benign colorectal neoplasm in patients with chronic constipation[J].Alimentary Pharmacology &Therapeutics, 2014, 40(1):83-92.
[4] WANG L F, WU F, HONG Y L, et al.Research progress in the treatment of slow transit constipation by traditional Chinese medicine[J].Journal of Ethnopharmacology, 2022, 290:115075.
[5] 王君珂, 姚树坤.慢性便秘的肠黏膜屏障功能研究进展[J].医学综述, 2021, 27(20):4070-4075.WANG J K, YAO S K.Research progress of intestinal mucosal barrier function in chronic constipation[J].Medical Recapitulate, 2021, 27(20):4070-4075.
[6] ZHAN Y, WEN Y, DU L J, et al.Effects of Maren pills on the intestinal microflora and short-chain fatty acid profile in drug-induced slow transit constipation model rats[J].Frontiers in Pharmacology, 2022, 13:804723.
[7] 李军祥, 陈誩, 柯晓.功能性便秘中西医结合诊疗共识意见(2017年)[J].中国中西医结合消化杂志, 2018, 26(1):18-26.LI J X, CHEN J, KE X.Consensus on diagnosis and treatment of functional constipation with integrated traditional Chinese and western medicine (2017)[J].Chinese Journal of Integrated Traditional and Western Medicine on Digestion, 2018, 26(1):18-26.
[8] WANG Y J, JIANG H, WANG L J, et al.Luteolin ameliorates loperamide-induced functional constipation in mice[J].Brazilian Journal of Medical and Biological Research, 2023, 56:e12466.
[9] 徐小琴, 杨立琛, 邓桂龙, 等.菊粉与谷物粉润肠通便作用的初步研究[J].食品研究与开发, 2018, 39(12):183-186.XU X Q, YANG L C, DENG G L, et al.Preliminary study on action of inulin and cereal powder in relaxing bowel[J].Food Research and Development, 2018, 39(12):183-186.[10] 陈树鹏, 陈晓维, 余元善, 等.西梅的营养价值及加工研究进展[J].中国果菜, 2023, 43(6):15-21.CHEN S P, CHEN X W, YU Y S, et al.Research progress in nutritional value and processing of Prunus domestica L[J].China Fruit &Vegetable, 2023, 43(6):15-21.
[11] 陈洪雨, 马蕾, 杨建乔, 等.山楂膳食纤维改善功能性便秘及预防铅中毒作用[J].食品科学, 2013, 34(15):232-235.CHEN H Y, MA L, YANG J Q, et al.Maythorn dietary fiber ameliorates functional constipation and prevents lead poisoning[J].Food Science, 2013, 34(15):232-235.
[12] 郑依玲, 董鹏鹏, 梅全喜.桃胶特性化学成分药理作用及临床应用研究进展[J].时珍国医国药, 2017, 28(7):1728-1730.ZHENG Y L, DONG P P, MEI Q X.Research progress on pharmacological action and clinical application of peach gum characteristic chemical components [J].Chinese Medicine, 2017, 28(7):1728-1730.
[13] 刘晶, 李若兰, 文君.桃胶多糖润肠通便功能的实验研究[J].现代食品, 2020(19):194-197.LIU J, LI R L, WEN J.Experimental study on the effect of peach gum polysaccharide on bowel movement and defecation[J].Modern Food, 2020(19):194-197.
[14] 汪晨兴, 颜美秋, 苏洁, 等.孕康口服液对脾虚妊娠小鼠的作用研究[J].中国中药杂志, 2023, 48(20):5592-5602.WANG C X, YAN M Q, SU J, et al.Effect of Yunkang Oral Solution on pregnant mice with spleen deficiency syndrome[J].China Journal of Chinese Materia Medica, 2023, 48(20):5592-5602.
[15] 魏柯健, 俞静静, 苏洁, 等.探讨保元汤加减方通过AMPK/SIRT1/PGC-1α通路对小鼠的抗疲劳作用[J].北京中医药大学学报, 2023, 46(12):1716-1727.WEI K J, YU J J, SU J, et al.Study on the anti-fatigue effect of modified Baoyuan Decoction through the AMPK/SIRT1/PGC-1α pathway[J].Journal of Beijing University of Traditional Chinese Medicine, 2023, 46(12):1716-1727.
[16] TIAN H L, GE X L, NIE Y Z, et al.Fecal microbiota transplantation in patients with slow-transit constipation:A randomized, clinical trial[J].PLoS One, 2017, 12(2):e0171308.
[17] ZHANG J, CHEN B S, LIU B S, et al.Preventive effect of Lactobacillus fermentum CQPC03 on activated carbon-induced constipation in ICR mice[J].Medicina, 2018, 54(5):89.
[18] WANG X J, CARLSON P, CHEDID V, et al.Differential mRNA expression in ileal mucosal biopsies of patients with diarrhea- or constipation-predominant irritable bowel syndrome[J].Clinical and Translational Gastroenterology, 2021, 12(4):e00329.
[19] CHEN T, MA Y Y, XU L, et al.Soluble dietary fiber reduces feeding intolerance in severe acute pancreatitis:A randomized study[J].Journal of Parenteral and Enteral Nutrition, 2021, 45(1):125-135.
[20] 王欢, 黄永坤, 刘梅.胃肠激素与胃肠道功能及疾病的关系[J].医学综述, 2013, 19(15):2735-2738.WANG H, HUANG Y K, LIU M.Relationship between gastrointestinal hormones and gastrointestinal tract function and diseases[J].Medical Recapitulate, 2013, 19(15):2735-2738.
[21] 王朝晖, 吴国, 张兵.胃泌素水平在消化道疾病中的表达及临床价值[J].放射免疫学杂志, 2009, 22(6):609-610.WANG Z H, WU G, ZHANG B.Expression and clinical value of gastrin in digestive tract diseases[J].Journal of Radio-Immunology, 2009, 22(6):609-610.
[22] DOCKRAY G, DIMALINE R, VARRO A.Gastrin:Old hormone, new functions[J].Pflugers Archiv:European Journal of Physiology, 2005, 449(4):344-355.
[23] HUANG J Q, LIN B, ZHANG Y, et al.Bamboo shavings derived O-acetylated xylan alleviates loperamide-induced constipation in mice[J].Carbohydrate Polymers, 2022, 276:118761.
[24] SHAJIB M S, KHAN W I.The role of serotonin and its receptors in activation of immune responses and inflammation[J].Acta Physiologica, 2015, 213(3):561-574.
[25] YABUT J M, CRANE J D, GREEN A E, et al.Emerging roles for serotonin in regulating metabolism:New implications for an ancient molecule[J].Endocrine Reviews, 2019, 40(4):1092-1107.
[26] BAI J Z, CAI Y J, HUANG Z Y, et al.Shouhui Tongbian Capsule ameliorates constipation via gut microbiota-5-HT-intestinal motility axis[J].Biomedicine &Pharmacotherapy, 2022, 154:113627.
[27] 郝晓冬, 段志军.五羟色胺信号系统与胃肠道疾病的研究进展[J].世界华人消化杂志, 2017, 25(19):1697-1704.HAO X D, DUAN Z J.Serotonin signaling system and gastrointestinal diseases[J].World Chinese Journal of Digestology, 2017, 25(19):1697-1704.
[28] KATO S.Role of serotonin 5-HT3 receptors in intestinal inflammation[J].Biological &Pharmaceutical Bulletin, 2013, 36(9):1406-1409.
[29] SVESHNIKOV D S, TORSHIN V I, SMIRNOV V M, et al.The significance of different 5-HT-receptors in regulation of gastrointestinal motility[J].Patologicheskaia Fiziologiia i Eksperimental’naia Terapiia, 2014(3):45-51.