代谢综合征是由中枢性肥胖、葡萄糖调节受损、胰岛素抵抗和血脂异常引起的一种临床综合征,主要表现为体重增加、高血糖、高血脂等症状[1-2]。由于生活方式和饮食结构的变化,近年来全球代谢综合征患病率显著增加。虽然药物疗法是治疗代谢综合征的主要方法,但药物的使用易引起胀气、腹痛、胃肠痉挛、恶心等不良反应[3]。因此,目前迫切需要一种更加健康有效的方法来缓解代谢综合征。
益生菌被定义为对健康有益的微生物[4]。越来越多的研究表明,益生菌在治疗代谢综合征方面具有较大潜力。例如,乳酸菌可通过抑制α-淀粉酶和α-葡萄糖苷酶活性、缓解氧化应激等来调节血糖平衡[5];长双歧杆菌BL21可通过平衡肠道菌群和甘油磷脂代谢来改善肥胖[6];鼠李糖乳杆菌LRa05通过促进肝脏碳水化合物代谢、加速胆固醇逆向转运来改善脂质蓄积[7];干酪乳杆菌LC89通过调节2型糖尿病小鼠的肝胰高血糖素反应发挥抗糖尿病作用等[8]。根据已有研究,益生菌对缓解代谢类疾病具有良好的干预作用,但由于菌株的稳定性、菌株间的差异性等因素[9],可利用的品质优良、功能多元的菌株仍非常有限,且目前关于益生菌的研究多集中于单一菌株的功效评价,对复配益生菌相互作用、协同增效的研究较少。基于此,本研究通过比较8种常用益生菌的体外降糖活性、清除胆固醇能力、胃肠道耐受性等,筛选出综合能力较优的2种菌株进行复配,探究不同比例复配菌株的功效作用,以期得到改善代谢综合征的较佳益生菌组合,为益生菌的协同增效研究和功能食品的配方开发提供参考。
1 材料与方法
1.1 材料与试剂
本研究所用实验菌株植物乳杆菌CFFM1031、CFFM1036,短双歧杆菌CFFM2021,副乳酪杆菌CFFM1021,嗜酸乳杆菌CFFM1011,乳双歧杆菌CFFM2011,乳双歧杆菌CFFM2012,乳双歧杆菌CFFM2013均由深圳保时健生物工程有限公司提供。
α-葡萄糖苷酶、α-淀粉酶,上海源叶生物科技有限公司;胆固醇(分析纯)、4-硝基苯基-D-吡喃葡糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG)、3号胆盐、邻苯二甲醛(分析纯),上海麦克林生化科技有限公司;无水乙醇(分析纯)、吐温-80(化学纯)、蔗糖脂肪酸酯,北京索莱宝科技有限公司。
1.2 仪器与设备
Spectra Max i3酶标仪,美谷分子仪器(上海)有限公司;DL-CJ-2 NDI洁净工作台,北京东联哈尔仪器制造有限公司;Blue Pard隔水式培养箱,上海一恒科学仪器有限公司;AL204型电子天平,梅特勒-托利多仪器有限公司;恒温振荡摇床,江苏太仓市实验设备厂。
1.3 实验方法
1.3.1 培养基及配制方法
MRS-胆固醇培养基:根据贺珊珊等[10]的方法稍作改进,将胆固醇、胆盐及蔗糖脂肪酸酯按照1∶2∶1的质量比例称取,加入体积比1∶5的吐温-80及无水乙醇,振荡混匀,80 ℃水浴超声至完全溶解,加入MRS培养基中混匀,胆固醇终质量浓度为0.1 mg/mL。
胆盐水解酶筛选培养基:参考WANG等[11]的方法稍作改进,在MRS固体培养基中添加牛胆盐(终质量浓度2 g/L)、巯基乙酸钠(终质量浓度2 g/L)以及CaCl2(终质量浓度0.37 g/L)。
1.3.2 菌种活化及样品制备
称取0.1 g冻干粉接入10 mL MRS培养基中,37 ℃培养12 h,传代2次,活化菌种。
收集菌液8 000 r/min离心5 min后,去上清液,PBS洗3次,再加入PBS吹打混匀,将菌液浓度调为OD600=1,即为供试菌液。
1.3.3 体外降血糖能力分析
1.3.3.1 菌株发酵上清液的制备
将供试菌液以2%的比例接入MRS培养基中37 ℃培养24 h,随后8 000 r/min离心8 min,收集上清液,过0.22 μm微孔滤膜,即得发酵上清液。
1.3.3.2 菌株破碎物的制备
发酵后离心收集的菌体重悬于PBS中,调整浓度并超声破碎,随后12 000 r/min离心8 min,收集上清液,过0.22 μm微孔滤膜,即得菌株破碎物。
1.3.3.3 α-葡萄糖苷酶抑制实验
根据CHEN等[12]的方法并进行改进,吸取35 μL上清液或菌株破碎物,与165 μL PBS混合后加入50 μL α-葡萄糖苷酶溶液(1.5 U/mL),混匀后于37 ℃孵育5 min,之后加入75 μL pNPG(20 mmol/L)混和均匀,于37 ℃继续孵育15 min,最后加入400 μL Na2CO3(0.2 mol/L)终止反应。于酶标仪中测定波长405 nm处的OD值,计算抑制率。每个样品平行测试3次。抑制率的计算如公式(1)所示:
α-葡萄糖抑制率![]()
(1)
式中:A1,含有酶不含样品的吸光度;A2,不含酶及样品的吸光度;A3,含有酶和样品的吸光度;A4,含有样品不含酶的吸光度。
1.3.3.4 α-淀粉酶抑制实验
参考WON等[13]的方法,取200 μL发酵上清液或菌株破碎物与200 μL 10 g/L可溶性淀粉溶液混合后于37 ℃孵育10 min,之后加入200 μL α-淀粉酶工作液继续孵育10 min。随后加入400 μL 3,5-二硝基水杨酸,沸水浴5 min,冷却后加入4 mL去离子水,混匀后于酶标仪中测定540 nm处的OD值,抑制率的计算如公式(2)所示:
α-淀粉抑制率![]()
(2)
式中:A1,含有酶不含样品的吸光度;A2,不含酶及样品的吸光度;A3,含有酶和样品的吸光度;A4,含有样品不含酶的吸光度。
1.3.4 体外降胆固醇能力分析
1.3.4.1 胆盐水解酶活性测定
参考WANG等[11]的方法并进行改进,将无菌滤纸片放在胆盐水解酶筛选培养基上,吸取供试菌液10 μL缓慢加在无菌滤纸片上,37 ℃培养72 h,观察滤纸片周围是否有白色沉淀产生,有白色沉淀记录为“+”表示菌株有胆盐水解酶活性,没有白色沉淀记录为“-”,表示菌株无胆盐水解酶活性。
1.3.4.2 体外胆固醇清除实验
根据贺珊珊等[10]的方法并进行改进,将供试菌液接种于MRS-胆固醇培养基中,使初始菌落数为108 CFU/mL,37 ℃培养24 h,菌液于8 000 r/min离心10 min,收集上清液。邻苯二甲醛法测定上清液胆固醇含量,胆固醇清除率的计算如公式(3)所示:
胆固醇清除率![]()
(3)
式中:A,各实验菌株发酵后上清液中的胆固醇含量,μg;B,各实验菌株发酵前上清液中的胆固醇含量,μg。
1.3.5 菌株耐胃酸耐胆盐能力评价
参考DING等[14]的方法并进行改进,将供试菌液接入模拟胃液(0.35 g胃蛋白酶溶解于100 mL 2 g/L的生理盐水中,将pH值调至3)及模拟肠液(0.1 g胰酶溶于100 mL含有0.3 g 3号胆盐和1.1 g NaHCO3的2 g/L生理盐水中,将pH值调至8)中。37 ℃条件下在模拟胃液中消化1.5 h后转接至模拟肠液中继续消化3 h。计算活菌数,以存活率来评价益生菌耐受胃酸耐胆盐能力的高低,如公式(4)所示:
菌株存活率![]()
(4)
式中:C0,初始菌落数;C1,模拟胃液或模拟肠液消化后菌落数。
1.3.6 主成分分析
对菌株的α-葡萄糖苷酶抑制活性、α-淀粉酶抑制活性、体外胆固醇清除率等指标用SPSS进行主成分分析,筛选体外降糖降脂活性较优的菌株。
1.3.7 拮抗实验
参考KUERMAN等[15]的方法,在培养基中加入稀释到一定梯度的菌液200 μL,涂布均匀。将无菌滤纸片均匀放置在培养基上并加入另一种菌液。37 ℃下培养,有抑菌圈记录为 “+” 表示2种菌株相互拮抗,没有抑菌圈记录为 “-”,表示2种菌株无拮抗作用。
1.3.8 菌株复配实验
将主成分分析得到的综合能力较优的菌株以1∶1、1∶2、1∶3、2∶1和3∶1的比例复配,测定复配后菌株的体外降胆固醇活性。
1.3.9 菌株生长能力分析
将复配菌液以2%的接种量接入以不同益生元为唯一碳源的培养基中,于37 ℃振荡培养,并于接种0、6、12、24、36、48 h测定发酵液的吸光度值OD600及pH,以未加碳源的MRS培养基为阴性对照,葡萄糖为碳源的MRS培养基为阳性对照,不加菌液的MRS培养基为空白对照。
1.4 数据处理
所有实验平行重复3次,所得结果采用平均数±标准差表示,采用SPSS 17.0进行统计分析,利用GraphPad prism 9、Excel进行绘图分析。
2 结果与分析
2.1 益生菌体外降糖活性分析
益生菌可通过抑制α-葡萄糖苷酶和α-淀粉酶的活性进行血糖调节[16-18]。本研究检测了8种益生菌发酵上清液和菌株破碎物的酶抑制能力。由表1可知,在抑制α-葡萄糖苷酶活性方面,8种益生菌均有一定的抑制作用。与菌株破碎物组相比,发酵上清液组的酶抑制能力较好。植物乳杆菌CFFM1031和CFFM1036、嗜酸乳杆菌CFFM1011及短双歧杆菌CFFM2021酶抑制能力显著,均高于阳性对照阿卡波糖(5 μg/mL)的酶抑制能力(P<0.05),副乳酪杆菌CFFM1031酶抑制能力较差仅为24.72%。3种乳双歧杆菌的酶抑制能力差异较大,CFFM2011表现出较好的酶抑制率(>86%),CFFM2012和CFFM2013的酶抑制率较差,均在33%~35%左右。目前文献报道的益生菌体外抑制α-葡萄糖苷酶能力各异,且不同来源的同种菌株表现出较大差异,WON等[13]研究发现,不同来源的植物乳杆菌、发酵乳杆菌及副干酪乳杆菌的α-葡萄糖苷酶抑制率在30%~90%,其中分离自人体的植物乳杆菌抑制率为90.6%,本研究结果与其报道类似。
表1 菌株对α-葡萄糖苷酶和α-淀粉酶的抑制作用
Table 1 Inhibition of α-glucosidase and α-amylase by strains

菌株名称菌株编号α-葡萄糖苷酶抑制率/%α-淀粉酶抑制率/%发酵上清液菌株破碎物发酵上清液菌株破碎物阳性对照(阿卡波糖)80.88±0.25c87.34±0.736cd植物乳杆菌CFFM103199.68±0.18a26.01±0.28a87.42±1.01cdND植物乳杆菌CFFM103699.82±0.07a22.79±1.34ab85.88±3.23dND短双歧杆菌CFFM202199.70±0.03a16.07±1.99d89.59±2.04bcdND副乳酪杆菌CFFM102124.72±2.58f16.12±1.14b90.66±0.91bcdND嗜酸乳杆菌CFFM101199.33±0.02a13.44±0.95d88.16±1.32bcdND乳双歧杆菌CFFM201186.25±0.47b15.46±0.91d77.68±3.72eND乳双歧杆菌CFFM201235.42±0.18d19.72±1.36bc99.98±1.50aND乳双歧杆菌CFFM201333.95±0.07de21.19±2.46b92.57±5.85bcND
注:ND表示未检测到抑制活性,不同小写字母表示组间差异显著(P<0.05)(下同)。
在抑制α-淀粉酶活性方面,所选菌株的发酵上清液均有较好的抑制作用,抑制率均在77%以上,与其他组相比,乳双歧杆菌CFFM2012组表现出显著的α-淀粉酶抑制能力,其次是副乳酪杆菌CFFM1031组和乳双歧杆菌CFFM2013组,均强于阳性对照阿卡波糖(1 mg/mL)的酶抑制能力。然而,菌株破碎物中未检测到酶抑制活性,先前文献报道益生菌可通过代谢产物(如胞外多糖、短链脂肪酸等)调节糖代谢[19-20],推测本研究中发酵上清液酶抑制能力优于菌株破碎物的酶抑制能力主要与短链脂肪酸或胞外多糖等菌株胞外分泌物有关。
2.2 体外降血脂能力分析
代谢综合征患者常常伴随着肥胖、脂代谢异常的症状。人体血脂主要是由甘油三酯及胆固醇组成,益生菌具有降低人体血清胆固醇的作用。益生菌降低胆固醇的潜在机制很多,如通过胆盐水解酶水解胆汁盐,使胆汁盐不能与胆固醇、磷脂形成胶束,从而阻碍胆固醇在肠道中的吸收;或将胆固醇结合到细胞膜上,达到降低胆固醇的效果[21-22]。
2.2.1 菌株胆盐水解酶活性分析
益生菌所具有的胆盐水解酶可以解离肠道中的胆汁盐,导致氨基酸残基的释放和解偶联的胆汁酸形成,而解偶联的胆汁酸溶解性较低,能够与胆固醇发生共沉淀效应随粪便排出体外,从而降低体内胆固醇水平。具有胆盐水解酶活性的菌株耐胆盐能力较强,能够更好的定植在胃肠道环境中发挥益生效应[15]。胆汁酸在酸性条件下可以和培养基中的Ca2+反应生成白色沉淀,因此本研究通过观察培养基上是否形成白色沉淀来判断8种常用益生菌是否具有胆盐水解酶活性[23]。由表2可知,乳双歧杆菌CFFM2012与植物乳杆菌CFFM1031均具有胆盐水解酶活性,其他菌株胆盐水解酶活性不明显。
表2 胆固醇清除率及胆盐水解酶活性检测
Table 2 Cholesterol removal rates and bile salt hydrolase activity of the strains
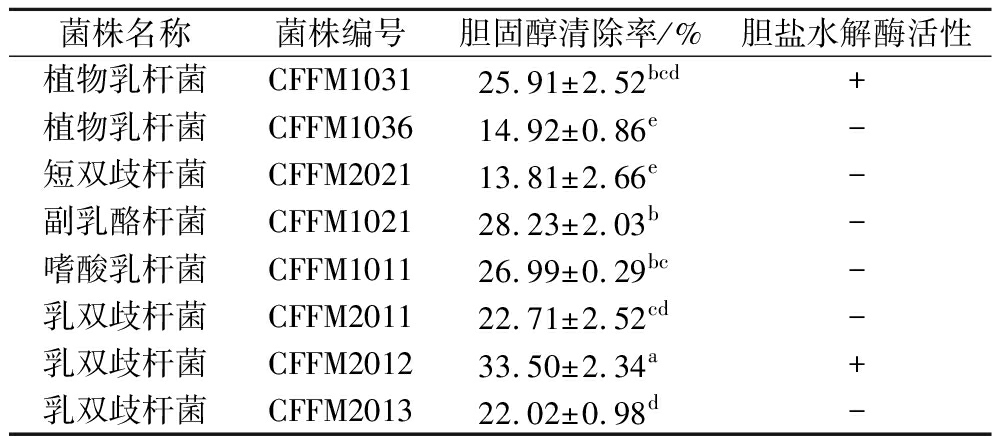
菌株名称菌株编号胆固醇清除率/%胆盐水解酶活性植物乳杆菌CFFM103125.91±2.52bcd+植物乳杆菌CFFM103614.92±0.86e-短双歧杆菌CFFM202113.81±2.66e-副乳酪杆菌CFFM102128.23±2.03b-嗜酸乳杆菌CFFM101126.99±0.29bc-乳双歧杆菌CFFM201122.71±2.52cd-乳双歧杆菌CFFM201233.50±2.34a+乳双歧杆菌CFFM201322.02±0.98d-
注:“+”表示生成白色沉淀;“-”表示未生成白色沉淀。
2.2.2 菌株体外胆固醇清除率
如表2所示,8种益生菌的体外胆固醇清除能力清除率在13%~34%,表明菌株均有一定的清除胆固醇能力,胆固醇清除能力由大到小依次为:乳双歧杆菌CFFM2012>副乳酪杆菌CFFM1021>嗜酸乳杆菌CFFM1011>植物乳杆菌CFFM1031>乳双歧杆菌CFFM2011>乳双歧杆菌CFFM2013>植物乳杆菌CFFM1036>短双歧杆菌CFFM2021,其中乳双歧杆菌CFFM2012清除作用最强,显著高于其他菌株(P<0.05)。韦云路等[24]通过体外胆固醇清除实验得出,动物双歧杆菌、长双歧杆菌、植物乳杆菌的体外胆固醇清除率在20.9%~24.5%,本实验结果与其相近。崔华玲[25]测定了分离自传统发酵食物中的乳酸菌,发现参与筛选的菌株胆固醇清除率在10%~50%,且不同来源、种属菌株之间胆固醇清除能力差异较大。KIM等[26]研究发现,不同种属益生菌的降胆固醇功效存在较大差异,一定程度上解释了本研究菌株体外胆固醇清除能力差别较大的现象。结合胆盐水解酶活性结果,乳双歧杆菌CFFM2012与植物乳杆菌CFFM1031可以通过与胆固醇共沉淀达到降低胆固醇的目的,胆固醇清除能力较好。
2.3 菌株耐酸与耐胆盐能力分析
益生菌只有顺利抵达结肠并大量存活才能在宿主肠道环境中发挥益生效应[27],因此益生菌对胃肠道低pH及高胆盐环境的耐受能力是评判其益生效果及体外活性的重要指标。如表3所示,8种益生菌在体外模拟胃液环境中均显示出较高的存活率(>70%),其中嗜酸乳杆菌CFFM1011在胃液中的存活率最高(98.14%)。在模拟肠液环境中,除乳双歧杆菌CFFM2011(0.97%)和短双歧杆菌CFFM2021(4.27%)之外,其余菌株均具有较好的耐胆盐能力(>66.72%),该结果表明菌株可以很好的抵达结肠环境发挥益生效应。王芬等[28]在对3株潜在降糖菌株的胃肠模拟耐受中发现,干酪乳杆菌及植物乳杆菌在模拟胃液中的存活率均大于95%,而在模拟肠液中存活率在75%左右,与之相比,本实验菌株CFFM2011、CFFM2021的肠液存活率较低,推测可能是益生菌的不同来源、种属差异对其耐受胆盐能力影响较大。
表3 菌株耐酸耐胆盐能力分析
Table 3 Analysis of acid and bile salt tolerance of strain
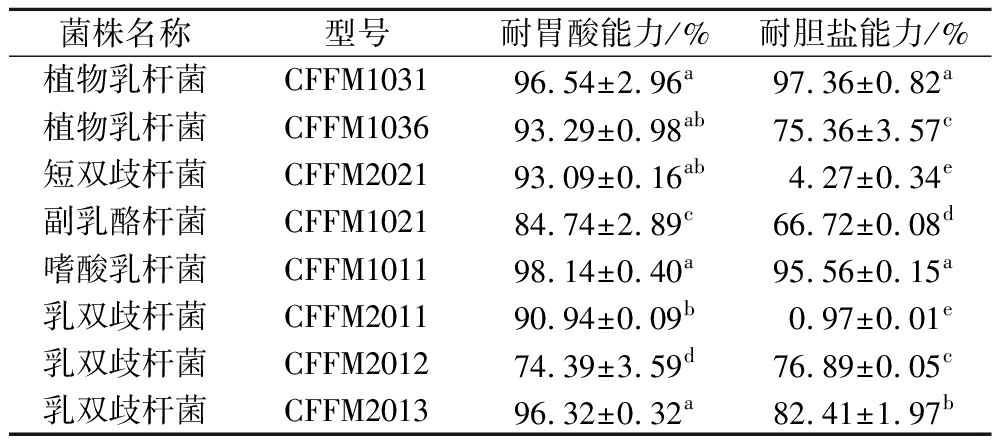
菌株名称型号耐胃酸能力/%耐胆盐能力/%植物乳杆菌CFFM103196.54±2.96a97.36±0.82a植物乳杆菌CFFM103693.29±0.98ab75.36±3.57c短双歧杆菌CFFM202193.09±0.16ab4.27±0.34e副乳酪杆菌CFFM102184.74±2.89c66.72±0.08d嗜酸乳杆菌CFFM101198.14±0.40a95.56±0.15a乳双歧杆菌CFFM201190.94±0.09b0.97±0.01e乳双歧杆菌CFFM201274.39±3.59d76.89±0.05c乳双歧杆菌CFFM201396.32±0.32a82.41±1.97b
2.4 主成分分析筛选菌株
将8种益生菌的酶抑制能力、体外胆固醇清除率及其他特性进行整理及标准化处理,筛选出降糖降脂能力较优的菌株。由图1得出,所选菌株的6个特征值中有2个数值大于1,因此可以将分析的特征指标简化为2个主成分。由表4总方差分析表得出,第1主成分与第2主成分累计贡献率为73.95%,即前2个主成分可以解释所有特性的73.95%。
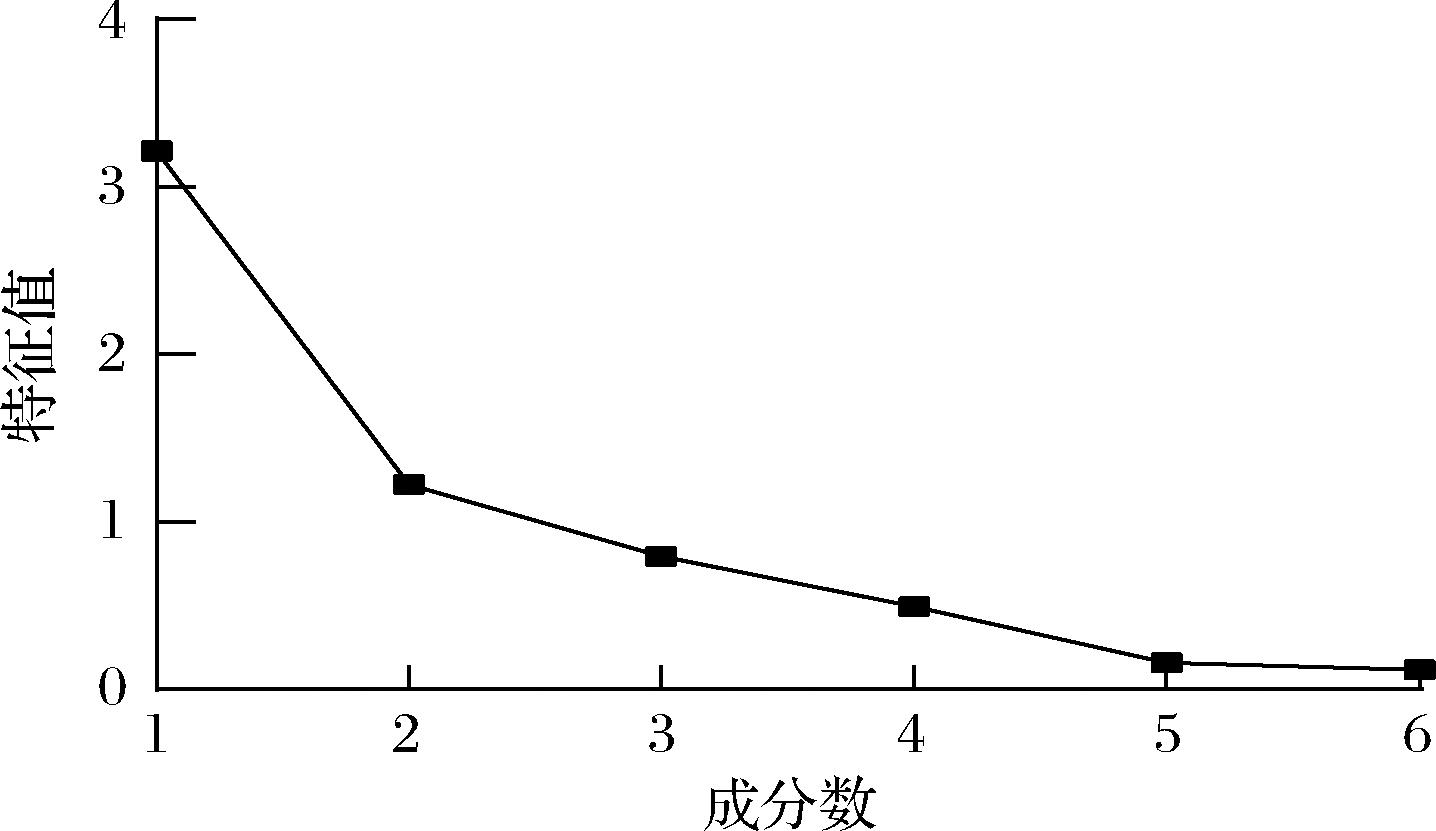
图1 碎石图
Fig.1 Scree plot
表4 总方差分析
Table 4 Total variance explained
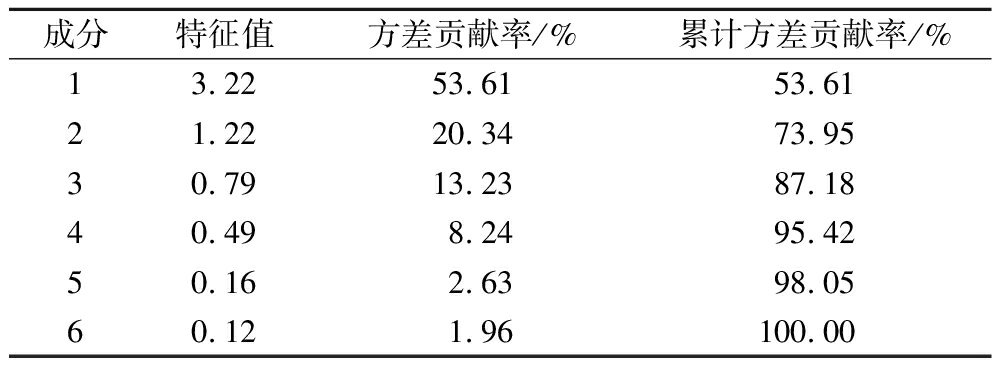
成分特征值方差贡献率/%累计方差贡献率/%13.2253.6153.6121.2220.3473.9530.7913.2387.1840.498.2495.4250.162.6398.0560.121.96100.00
由表5可知,每个主成分所在分析特性上的成分载荷,第1主成分可以解释3个特性:α-淀粉酶抑制能力0.846、清除胆固醇能力0.841、胆盐水解酶活力0.674;第2主成分可以解释3个特性:耐胃酸能力0.529、耐胆盐能力0.751及α-葡萄糖苷酶抑制能力0.447。
表5 成分矩阵
Table 5 Component matrix
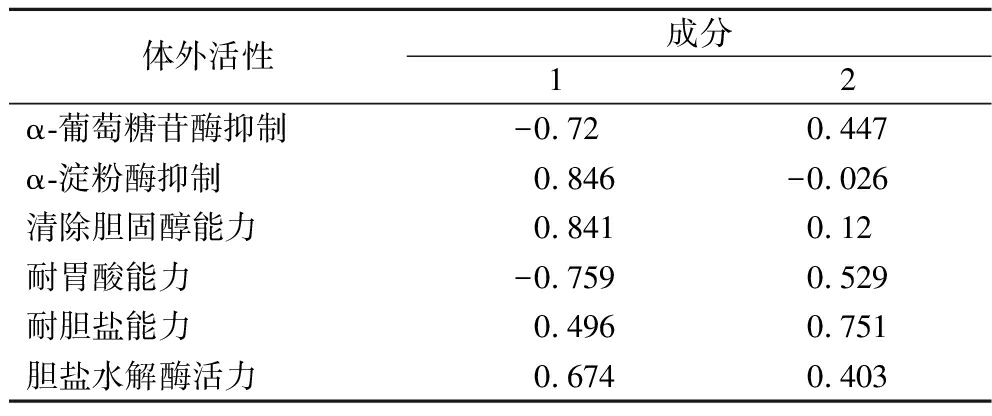
体外活性成分12α-葡萄糖苷酶抑制-0.720.447α-淀粉酶抑制0.846-0.026清除胆固醇能力0.8410.12耐胃酸能力-0.7590.529耐胆盐能力0.4960.751胆盐水解酶活力0.6740.403
由表6为最终因子得分表可知,乳双歧杆菌CFFM2012及植物乳杆菌CFFM1031得分较高,表明这2种菌株潜在降糖降脂活性较优,因此选择这2种菌株进行后续复配实验。
表6 因子得分结果
Table 6 Analysis of principal component scores
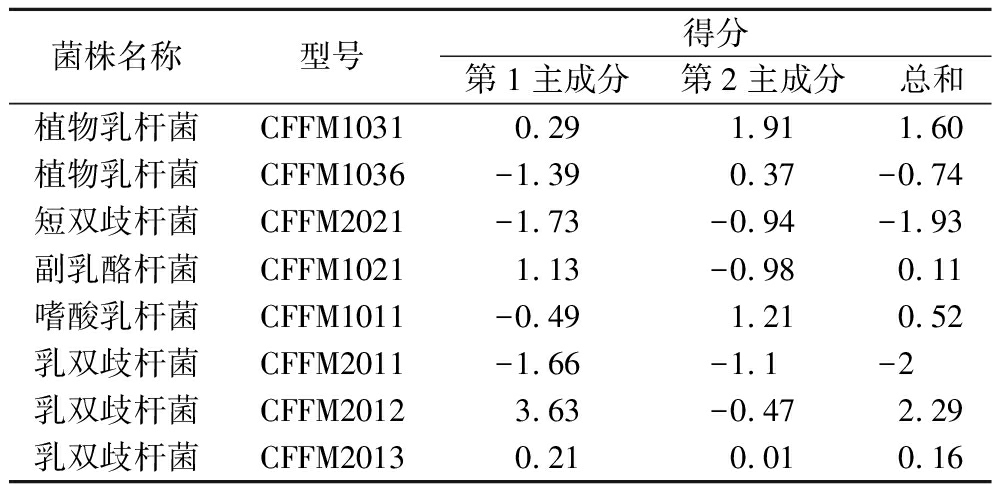
菌株名称型号得分第1主成分第2主成分总和植物乳杆菌CFFM10310.291.911.60植物乳杆菌CFFM1036-1.390.37-0.74短双歧杆菌CFFM2021-1.73-0.94-1.93副乳酪杆菌CFFM10211.13-0.980.11嗜酸乳杆菌CFFM1011-0.491.210.52乳双歧杆菌CFFM2011-1.66-1.1-2乳双歧杆菌CFFM20123.63-0.472.29乳双歧杆菌CFFM20130.210.010.16
2.5 菌株拮抗能力分析
如表7所示,由于菌株的来源、种类、特性的不同,菌株产生的胞外分泌物可能会有一定的抑制作用进而表现为菌株间的拮抗效应[29],但本次实验中根据主成分分析得出的所选菌株间无拮抗效应,为菌株复配提供基础。
表7 菌株间拮抗能力分析
Table 7 Analysis of antagonism between strains
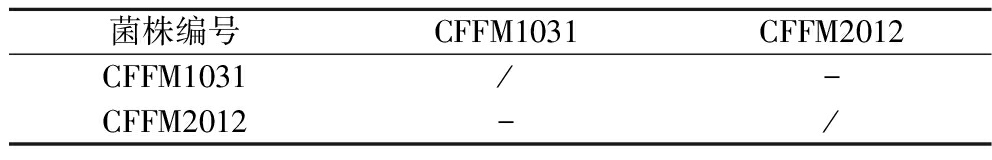
菌株编号CFFM1031CFFM2012CFFM1031/-CFFM2012-/
注:“+”表示有拮抗;“-”表示无拮抗;“/”表示菌株间未进行检测。
2.6 菌株复配实验
根据主成分分析结果,选取乳双歧杆菌CFFM2012和植物乳杆菌CFFM1031按1∶1、1∶2、1∶3、2∶1和3∶1比例进行复配,并测定复配菌株的胆固醇清除效果及以表征复配菌株的降糖降脂效果。
由图2可知,菌株以不同比例复配会显著影响其胆固醇清除能力,当2种菌株以1∶1复配时,胆固醇清除率为43.56%,显著高于单一菌株或以其他比例复配时的胆固醇清除率(P<0.05)。
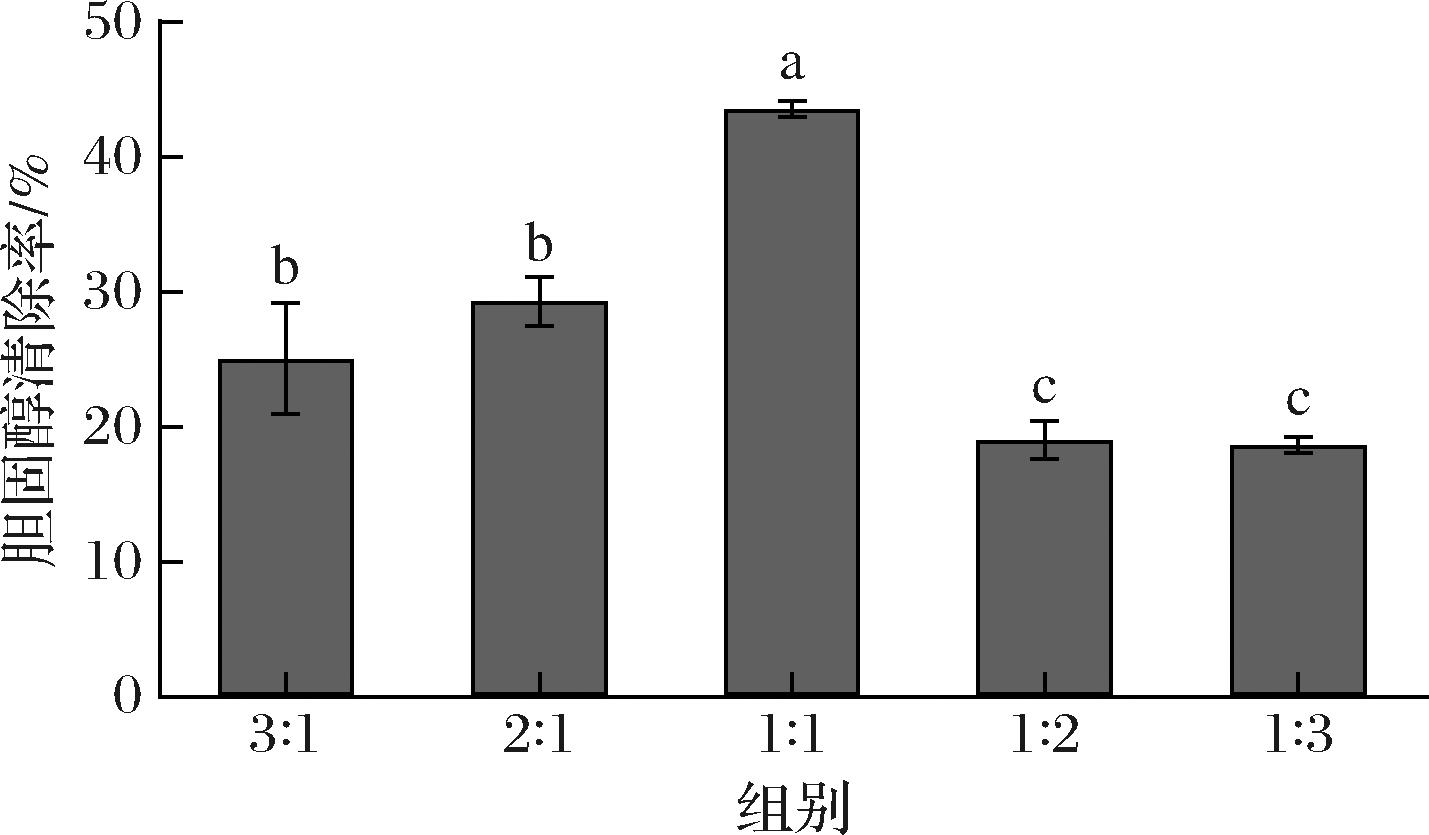
图2 复配益生菌体外胆固醇清除能力测定
Fig.2 Determination of cholesterol-clearing capacityin vitro of the compound probiotic
KUERMAN等[15]研究了不同复配比例益生菌的体外降胆固醇能力,发现副干酪乳杆菌S0904与嗜热链球菌GLD2以1∶2的比例复配时胆固醇清除率最佳,为34.7%,本研究结果与其报道类似,表明适当比例复配菌株有助于其发挥协同增效作用。
2.7 复配菌株的益生元嗜好性分析
益生菌和益生元之间的多重协同作用所提供的健康益处越来越得到认可[30]。乳酸菌发酵液在600 nm波长下的OD值是反映细菌生长状况的方法之一,而pH的变化可在一定程度上反映菌株的产酸能力。因此,本实验通过比较复配益生菌在不同益生元作为唯一碳源时的OD600及pH值,来检测复配益生菌的生长及产酸能力,从而确定复配菌株的益生元嗜好性。
如图3所示,复配益生菌在以不同益生元为唯一碳源时,均可显著增殖和产酸。在0~6 h培养期间,葡萄糖和低聚异麦芽糖能触发复配益生菌大量增殖;而在6~12 h培养期间,水苏糖促进菌株增殖能力较强,随着培养时间延长;在12~24 h阶段,低聚半乳糖和葡萄糖对菌株增殖能力增强;培养至24 h时菌株的生长趋于平缓,pH也呈现出先急速下降后逐渐平稳的趋势。对比不同益生元的OD600和pH结果发现,复配益生菌在低聚半乳糖中生长与产酸情况最佳,与葡萄糖相近,而在抗性糊精中增殖产酸效果最差。李雅丽等[31]发现植物乳杆菌与乳双歧杆菌可以在水苏糖及低聚半乳糖中能够很好的增殖与产酸,且培养30 h后的OD600变化值约为1,本研究结果与其报道类似。以上结果表明复配益生菌对低聚半乳糖、水苏糖具有嗜好性。
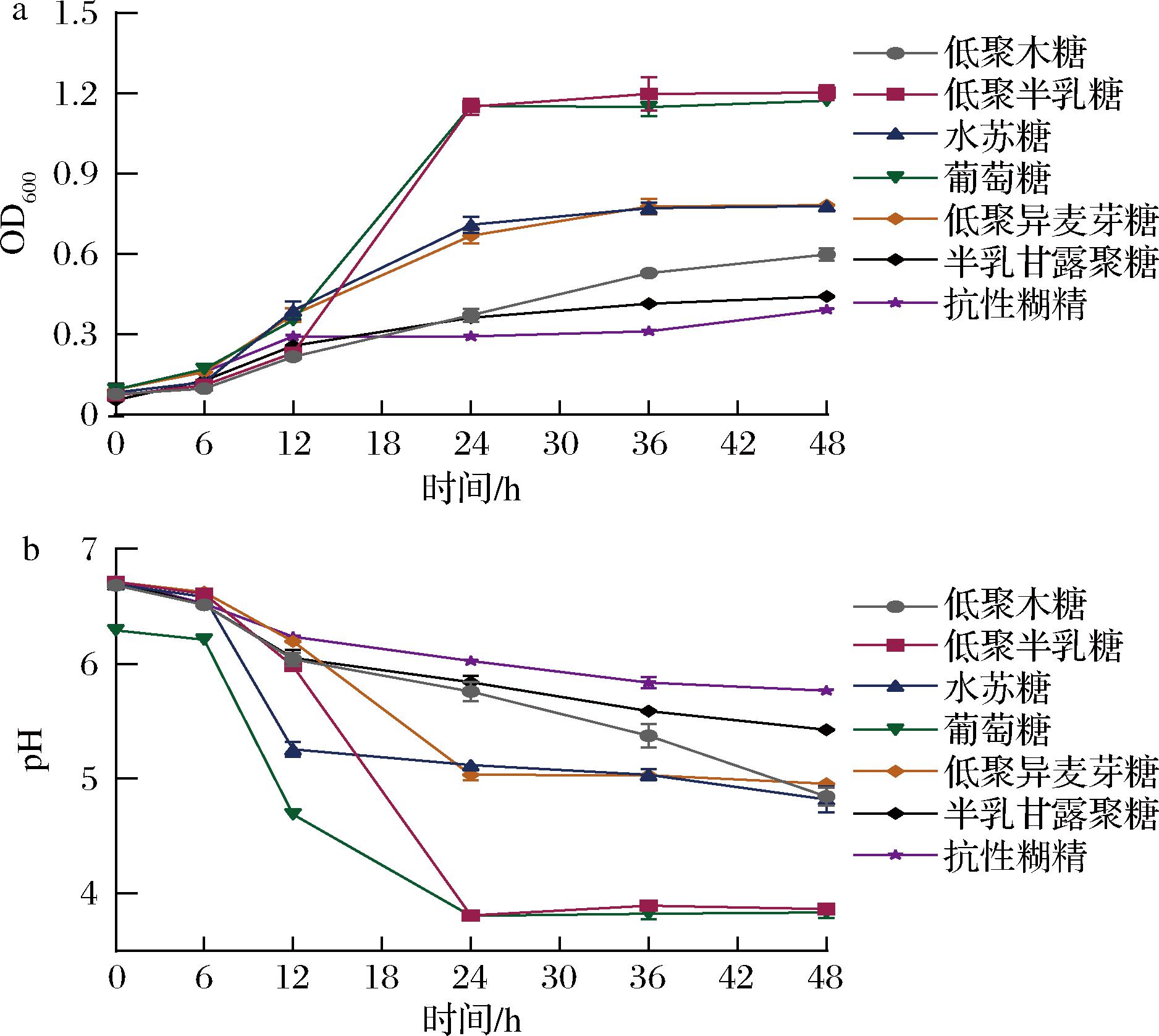
a-OD600;b-pH
图3 复配益生菌在不同碳源中的生长产酸情况
Fig.3 Growth and acid production of compound probiotics in different carbon sources
3 结论
本实验以8株常用益生菌为研究对象,探究了其体外降糖、降胆固醇、耐酸耐胆盐能力,并根据降维因子分析筛选出2株综合能力较优的菌株,即植物乳杆菌CFFM1031和乳双歧杆菌CFFM2012。对这2种菌株进行复配实验,得出菌株间较佳复配比例为1∶1。不同益生元体外发酵实验结果表明复配菌株对低聚半乳糖和水苏糖表现出嗜好性。综上,本次研究筛选出了功效较优的益生菌种类及配比,同时提供了相应益生元的选择,为相关降糖降脂功能产品配方开发提供理论基础。
[1] MIR F A, ULLAH E, MALL R, et al.Dysregulated metabolic pathways in subjects with obesity and metabolic syndrome[J].International Journal of Molecular Sciences, 2022, 23(17):9821.
[2] HOU C Y, TAIN Y L, YU H R, et al.The effects of resveratrol in the treatment of metabolic syndrome[J].International Journal of Molecular Sciences, 2019, 20(3):535.
[3] LAZAREVI S,
S,  ANI
ANI M, GOLO
M, GOLO ORBIN-KON S, et al.Semisynthetic bile acids:A new therapeutic option for metabolic syndrome[J].Pharmacological Research, 2019, 146:104333.
ORBIN-KON S, et al.Semisynthetic bile acids:A new therapeutic option for metabolic syndrome[J].Pharmacological Research, 2019, 146:104333.
[4] CREMON C, BARBARO M, VENTURA M, et al.Pre-and probiotic overview[J].Current Opinion in Pharmacology, 2018, 43:87-92.
[5] BEN-MILED H, BENOIT-BIANCAMANO M O, BEN-MAHREZ K, et al.Alpha-amylase and alpha-glucosidase inhibitory properties, beta-galactosidase activity, and probiotic potential of lactic acid bacteria and bifidobacteria from Apis mellifera intermissa and its products[J].World Journal of Microbiology &Biotechnology, 2023, 39(8):205.
[6] HAO J Y, ZHANG Y L, WU T, et al.The antidiabetic effects of Bifidobacterium longum subsp. longum BL21 through regulating gut microbiota structure in type 2 diabetic mice[J].Food &Function, 2022,13(19):9947-9958.
[7] SUN M Z, WU T, ZHANG G H, et al.Lactobacillus rhamnosus LRa05 improves lipid accumulation in mice fed with a high fat diet via regulating the intestinal microbiota, reducing glucose content and promoting liver carbohydrate metabolism[J].Food &Function, 2020, 11(11):9514-9525.
[8] ZHANG Y L, WU T, LI W, et al.Lactobacillus casei LC89 exerts antidiabetic effects through regulating hepatic glucagon response and gut microbiota in type 2 diabetic mice[J].Food &Function, 2021,12(18):8288-8299.
[9] LIANG T T, XIE X Q, WU L, et al.Comparative analysis of the efficacies of probiotic supplementation and glucose-lowering drugs for the treatment of type 2 diabetes:A systematic review and meta-analysis[J].Frontiers in Nutrition, 2022, 9:825897.[10] 贺珊珊, 鲍志宁, 林伟锋, 等.一种含有胆固醇胶束的培养基溶液的制备方法[P].中国:CN108795767A,2018-11-13.HE S S, BAO Z N, LIN W F, et al.A preparation method of medium solution containing cholesterol micelles[P].China:CN108795767A,2018-11-13.
[11] WANG J J, TANG H, ZHANG C H, et al.Modulation of gut microbiota during probiotic-mediated attenuation of metabolic syndrome in high fat diet-fed mice[J].The ISME Journal, 2015, 9(1):1-15.
[12] CHEN P, ZHANG Q X, DANG H, et al.Screening for potential new probiotic based on probiotic properties and α-glucosidase inhibitory activity[J].Food Control, 2014, 35(1):65-72.
[13] WON G, CHOI S I, PARK N, et al.In vitro antidiabetic, antioxidant activity, and probiotic activities of Lactiplantibacillus plantarum and Lacticaseibacillus paracasei strains[J].Current Microbiology, 2021, 78(8):3181-3191.
[14] DING W R, SHI C, CHEN M, et al.Screening for lactic acid bacteria in traditional fermented Tibetan yak milk and evaluating their probiotic and cholesterol-lowering potentials in rats fed a high-cholesterol diet[J].Journal of Functional Foods, 2017, 32:324-332.
[15] KUERMAN M, BAO Y H, GUO Y, et al.Effects of prebiotic carbohydrates on the growth promotion and cholesterol-lowering abilities of compound probiotics in vitro[J].LWT, 2020, 118:108703.
[16] HULIGERE S S, CHANDANA KUMARI V B, ALQADI T, et al.Isolation and characterization of lactic acid bacteria with potential probiotic activity and further investigation of their activity by α-amylase and α-glucosidase inhibitions of fermented batters[J].Frontiers in Microbiology, 2023, 13:1042263.
[17] AYYASH M, AL-NUAIMI A K, AL-MAHADIN S, et al.In vitro investigation of anticancer and ACE-inhibiting activity, α-amylase and α-glucosidase inhibition, and antioxidant activity of camel milk fermented with camel milk probiotic:A comparative study with fermented bovine milk[J].Food Chemistry, 2018, 239:588-597.
[18] SREEPATHI N, KUMARI V B C, HULIGERE S S, et al.Screening for potential novel probiotic Levilactobacillus brevis RAMULAB52 with antihyperglycemic property from fermented Carica papaya L[J].Frontiers in Microbiology, 2023, 14:1168102.
[19] MORRIS A.Microbial metabolite linked to T2DM[J].Nature Reviews.Endocrinology, 2018, 15(1):3.
[20] HERREMA H, NIESS J H.Intestinal microbial metabolites in human metabolism and type 2 diabetes[J].Diabetologia, 2020, 63(12):2533-2547.
[21] ROMERO-LUNA H E, PEREDO-LOVILLO A G, JIMÉNEZ-FERN NDEZ M.Probiotic and potentially probiotic bacteria with hypocholesterolemic properties[J].Food Reviews International, 2023, 39(2):689-707.
NDEZ M.Probiotic and potentially probiotic bacteria with hypocholesterolemic properties[J].Food Reviews International, 2023, 39(2):689-707.
[22] ISHIMWE N, DALIRI E B, LEE B H, et al.The perspective on cholesterol-lowering mechanisms of probiotics[J].Molecular Nutrition &Food Research, 2015, 59(1):94-105.
[23] GREGOR A, AUERNIGG-HASELMAIER S, MALLEIER M, et al.Fiber consumption stimulates the activity of microbial bile salt hydrolases[J].Journal of Functional Foods, 2023, 107:105707.
[24] 韦云路, 刘义, 王瑶, 等.3株益生菌体外降胆固醇能力及体内降血脂效果评价[J].食品科学, 2017, 38(23):129-134.WEI Y L, LIU Y, WANG Y, et al.Cholesterol-lowering ability in vitro and hypolipidemic effect in vivo of three probiotic strains[J].Food Science, 2017, 38(23):129-134.
[25] 崔华玲. 降胆固醇乳酸菌的筛选及其微胶囊化应用研究[D].广州:华南理工大学, 2022.CUI H L.Screening of cholesterol-lowering lactic acid bacteria and its microencapsulation application[D].Guangzhou:South China University of Technology, 2022.
[26] KIM S J, PARK S H, SIN H S, et al.Hypocholesterolemic effects of probiotic mixture on diet-induced hypercholesterolemic rats[J].Nutrients, 2017, 9(3):293.
[27] LEI W P, LIU C G, PAN L N, et al.Screening of probiotic Lactobacilli with potential anti-allergic activity based on hyaluronidase inhibition and degranulation of RBL-2H3 cells in vitro[J].LWT, 2021,140:110707.
[28] 王芬, 刘鹭, 李函彤, 等.具有α-葡萄糖苷酶抑制作用益生菌的筛选及特性分析[J].食品科学, 2018, 39(16):192-200.WANG F, LIU L, LI H T, et al.Screening for potential probiotics based on high α-glucosidase inhibitory activity[J].Food Science, 2018, 39(16):192-200.
[29] RAZA W, YUAN J, LING N, et al.Production of volatile organic compounds by an antagonistic strain Paenibacillus polymyxa WR-2 in the presence of root exudates and organic fertilizer and their antifungal activity against Fusarium oxysporum f.sp.niveum[J].Biological Control, 2015, 80:89-95.
[30] MOHANTY D, MISRA S, MOHAPATRA S, et al.Prebiotics and synbiotics:Recent concepts in nutrition[J].Food Bioscience, 2018, 26:152-160.
[31] 李雅丽, 王默涵, 周志桥.6种低聚糖对肠道益生菌生长情况的影响及代谢产物分析[J].食品科技, 2021, 46(3):7-13.LI Y L, WANG M H, ZHOU Z Q.Effects of six oligosaccharides on the growth of intestinal probiotics and analysis of metabolites[J].Food Science and Technology, 2021, 46(3):7-13.