金黄色葡萄球菌(Staphylococcus aureus)作为一种常见的食源性致病菌,可引起食物变质以及人类和动物的食物性中毒[1]。化学防腐剂虽能够有效抑制食源性致病菌的生长,但它同时也对人体健康和环境造成一定威胁。如食用大量含苯甲酸和苯甲酸钠的食物将会影响肝脏酶对脂肪酸的作用,其次苯甲酸钠中过量的钠对人体血压、心脏、肾功能也会造成一定的影响[2],因此,植物源天然防腐剂的开发和应用成为当下研究的热点之一。
水飞蓟素是从水飞蓟果实和种子中提取并与苯丙素类衍生物缩合的一种黄酮类木脂素,可促进肝细胞再生,因此作为治疗肝病的有效药用成分而受到广泛关注[3]。同时有研究表明,水飞蓟素具有良好的抗氧化活性,可通过诱导超氧化物歧化酶增加细胞内谷胱甘肽的含量,抑制脂质过氧化,从而表现出较强的抗氧化和自由基清除能力[4],水飞蓟素还具有良好的抗炎、抗癌、抗心血管疾病和免疫调节等生物活性[5]。
当前关于水飞蓟素抑菌方面的研究进展主要是针对其对不同致病菌的抑菌活性的探究,如DE等[6]测定了水飞蓟素对一些常见菌株的最小抑菌浓度(minimum inhibitory concentration,MIC)以及其与抗菌药物联合使用时表现出的协同作用,结果表明水飞蓟素对大肠杆菌的MIC值为64 μg/mL,并且当水飞蓟素与抗生素阿米卡星联合使用时对金黄色葡萄球菌的MIC为1.22 μg/mL,与庆大霉素联合使用时其MIC为9.76 μg/mL。EVREN等[7]的研究中评估了水飞蓟素对几种革兰氏阳性标准菌株和革兰氏阴性标准菌株的抗菌作用,其MIC均在60~241 μg/mL,且水飞蓟素对革兰氏阴性菌的抑制作用要小于革兰氏阳性菌,但关于其抑菌稳定性及其机制的内容却鲜有报道,这极大地限制了水飞蓟素的应用。针对这种不足,本研究旨在从S.aureus ATCC25923表面特征、细胞形态、葡萄糖利用程度、对生物被膜的影响等方面评价水飞蓟素对S.aureus的抗菌活性和作用方式,初步探讨水飞蓟素抑菌活性的理化稳定性,为其作为食品保鲜涂膜的进一步开发应用提供理论依据。
1 材料与方法
1.1 材料与仪器
水飞蓟素(纯度80%,CAS:84604-20-6),西安云悦生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)(分析纯)、胰酪大豆胨琼脂(tryptose soya agar,TSA)培养基、胰蛋白胨大豆肉汤(tryptose soya broth, TSB)培养基,北京奥博星生物技术有限责任公司;DAPI染液、罗丹明B(rhodamine B,RhB),Aladdin公司;2.5%戊二醛溶液(质量浓度,下同),Solarbio公司;S.aureus,购自中国普通微生物菌种保藏管理中心。
UV2400紫外-可见分光光度计,上海舜宇恒平科学仪器有限公司;TDZ5-WS型离心机,湖南湘仪实验室仪器开发有限公司;Nano-ZS纳米粒度电位仪,英国马尔文仪器有限公司;BI-90Plus激光粒径分布测定仪,美国BROOKHAVEN仪器设备公司;JY92-2D型超声细胞粉碎仪,宁波新芝生物科技股份有限公司;ALPHA 1-2 LD plus真空冷冻干燥机,德国 Christ公司;Axio Observer荧光显微镜,德国ZEISS公司;JSM-7800F扫描电镜,日本电子公司。
1.2 MIC的测定
采用FEI等[8]的方法,并稍做修改。准备足够的TSA平板培养基,加入不同质量浓度(1% DMSO溶解)的水飞蓟素(0.1~1 mg/mL,间隔为0.1),对照组只加入等量溶剂而未经水飞蓟素处理。培养基凝固后,接种浓度为1×108 CFU/mL的4种不同菌种的菌悬液,在37 ℃下培养24 h后观察细菌生长情况,MIC值为肉眼看不见细菌菌落生长的最低浓度,所有实验平行3次。
1.3 细菌生长曲线的测定
依照钟灵[9]的方法,并稍做修改。向含有水飞蓟素的TSB培养基中加入25 μL菌悬液(同1.2节),并调整终体积为30 mL,使水飞蓟素质量浓度分别为1/4 MIC、1/2 MIC、1 MIC和2 MIC,只加入等体积溶剂未添加水飞蓟素的菌液作为对照。在37 ℃下培养24 h,每隔2 h取出菌液,使用紫外分光光度计检测其吸光度。
1.4 稳定性研究
1.4.1 温度对水飞蓟素抑菌活性影响
将1/2 MIC的水飞蓟素分别在30、50、70、90 ℃的水浴中处理30 min,然后与菌悬液一起加入液体培养基中,以未加入水飞蓟素组作为阴性对照,加入相同质量浓度的水飞蓟素但未做处理作为阳性对照,以S.aureus为指示菌,测量20 h之后OD600值。每组实验设3个重复[10]。
1.4.2 pH值对水飞蓟素抑菌活性的影响
分别用1 mol/L的盐酸溶液和1 mol/L的NaOH溶液将含有1/2 MIC质量浓度的水飞蓟素的液体培养基pH值调为3、5、7、9、11作为处理组B。阳性对照与阴性对照同2.4.1节,同时设置只改变pH值不加入水飞蓟素的处理组A。以S.aureus为指示菌,测量20 h之后OD600值,每组实验设3个重复[11]。
1.4.3 超声处理对水飞蓟素抑菌活性的影响
将1/2 MIC的水飞蓟素分别放置在50、100、200、400 W功率的超声细胞粉碎仪下处理10 min,阳性对照与阴性对照同上,以S.aureus为指示菌,测量20 h之后OD600值,每组实验3个重复。
1.5 水飞蓟素对S.aureus表面特征的影响
1.5.1 表面疏水性测定
将生长到对数期菌液使用PBS缓冲液清洗后重悬,接种于含有MIC、1/2 MIC、1/4 MIC及不含药液的培养基中,使最终菌液浓度约为1×108 CFU/mL,并测定OD600值。加入1 mL正己烷,充分振荡涡旋30 s后,培养箱内静置培养15 min,吸取水层再次进行吸光值的测定,依照公式(1)计算细菌表面疏水率(cell surface hydrophobicity,CSH)[12],每组做3个平行。
(1)
式中:Aa,初始吸光度;Ab,培养15 min后吸光度;空白对照为不含药物的培养液。
1.5.2 zeta电位值的测定
参考宁亚维等[13]的方法,取过夜培养的菌液使用无菌水清洗后重悬,调整菌液浓度1×108 CFU/mL,加入水飞蓟素(质量浓度同上)及不含药物的无菌水为空白对照,分别在培养箱中37 ℃孵育2 h和4 h后取样,使用纳米粒度电位仪测定电位,每组做3个平行。
1.6 扫描电镜(scanning electron microscope,SEM)观察细胞形态
参照李远颂等[14]的方法。取水飞蓟素(质量浓度同上)培养后的菌悬液离心,菌体用PBS缓冲液洗涤3次后置于2.5%戊二醛溶液中4 ℃、4 h后,用PBS缓冲液冲洗,然后依次用体积分数为40%、70%、90%和100%的乙醇溶液脱水,每次 15 min,于-20 ℃预冻后再真空冷冻干燥 12 h, 取完全干燥的菌体上样、镀金, 用SEM观察细菌。
1.7 葡萄糖消耗的测定
向含有水飞蓟素的培养液中加入葡萄糖并使其质量浓度为1 mg/mL,接种过夜培养的新鲜菌液,使初始菌浓度为1×108 CFU/mL,放置培养箱中37 ℃培养。0、1、2、4 h时吸取菌液于试管中,4 000 r/min离心5 min,获得上清液之后稀释10倍,使用二硝基水杨酸法检测培养液中葡萄糖的含量,使用紫外分光光度计测定540 nm下的吸光度[15]。每组做3个平行。
1.8 水飞蓟素对S.aureus生物被膜的影响
1.8.1 细菌聚集程度的测定
参考王梓源等[16]的方法,取过夜培养的新鲜菌液,加入水飞蓟素溶液(质量浓度同上),分别在2 h和4 h取样,使用粒径分布仪测定菌体粒径。
1.8.2 对生物被膜形成的影响
参照徐云凤[17]的方法将盖玻片用蒸馏水清洗干净后,121 ℃灭菌 25 min。将含有不同质量浓度水飞蓟素的菌悬液分别加入预先放置有无菌小盖玻片的12孔板中,每孔2 mL,以不含水飞蓟素的培养液作为阳性对照,置于37 ℃培养箱中静置培养24 h。待盖玻片上生物膜成熟后,弃去培养基,分别用2 mL PBS缓冲液轻柔漂洗盖玻片3次,洗去浮游状态的细菌,之后盖玻片处理同1.6节。最后在盖玻片表面喷金镀膜,在扫描电镜下观察生物被膜的形态结构,并拍照记录。
1.8.3 对成熟生物被膜内细菌及其组分的影响
将无菌盖玻片放入装有液体培养基的6孔板,接种浓度为1×108 CFU/mL的菌悬液,37 ℃下培养24 h,待盖玻片上生物被膜成熟后移除菌悬液,用PBS溶液轻柔漂洗3次,加入含有不同质量浓度水飞蓟素的PBS溶液,37 ℃孵育8 h后向其中分别加入DAPI和RhB染色液,室温下避光孵育 30 min,置于荧光显微镜下观察[18]。
1.9 数据处理与统计分析
所有实验重复3次,实验结果使用SPSS 19.0统计软件分析和处理数据,采用Tukey法进行差异显著性检验,“*”为P<0.05表示差异显著,“**”为P<0.01表示差异极显著。
2 结果与分析
2.1 MIC
MIC是评价抑菌物质的抑菌活性强弱的一项重要指标,测定了水飞蓟素对S.aureus(ATCC25923、ATCC29213、ATCC6538)以及沙门氏菌等不同菌株的MIC,分别对应培养基上1、2、3、4四个区域,实验结果如图1所示,可以看到对照组均有菌落生长,但在水飞蓟素质量浓度为0.5~1 mg/mL的培养基上,S.aureus ATCC25923(区域1)均无菌落生长,证明水飞蓟素对ATCC25923的MIC为0.5 mg/mL。水飞蓟素质量浓度在0.8~1 mg/mL的培养基上,S.aureus ATCC29213以及ATCC6538(区域2、3)均无菌落生长,证明水飞蓟素对ATCC29213、ATCC6538的MIC为均为0.8 mg/mL,而区域4均有菌落生长,说明水飞蓟素对沙门氏菌的MIC>1 mg/mL。与二氢杨梅素(MIC=1.25 mg/mL)、藤茶提取物(MIC=6.3 mg/mL)以及大蒜水提物(MIC=24 mg/mL)对S.aureus的抑菌活性相比[19-20],水飞蓟素的抑菌能力具有明显优势。
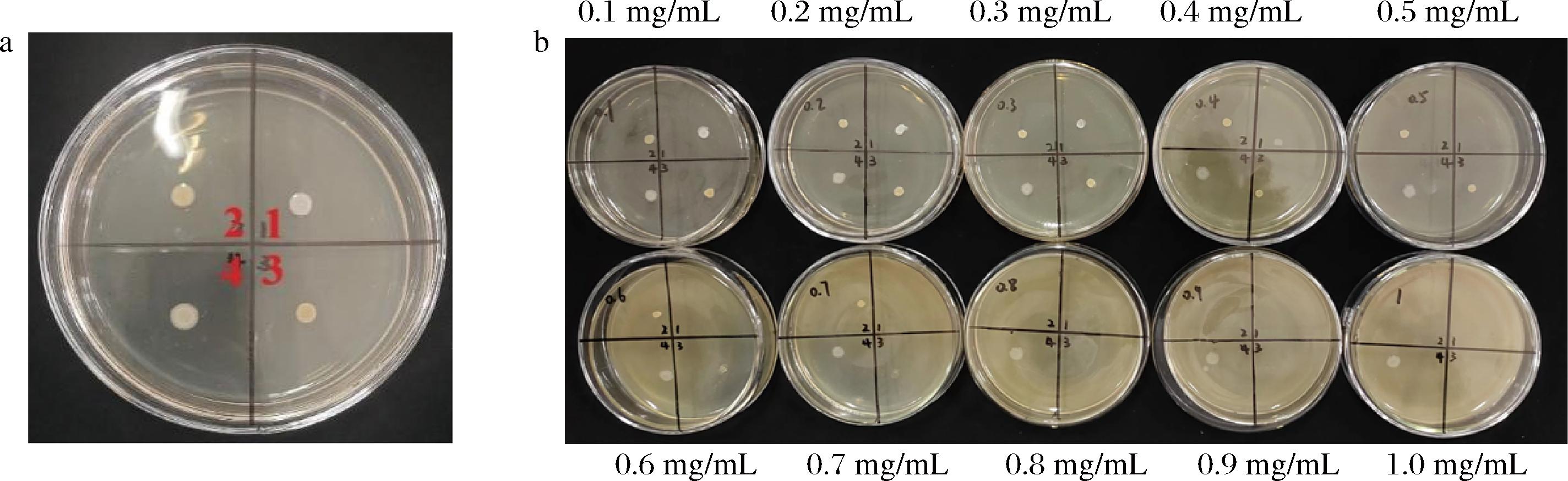
a-对照组;b-水飞蓟素处理组
图1 水飞蓟素对不同菌种的最小抑菌浓度
Fig.1 Minimum inhibitory concentration of silymarin to different bacteria
2.2 水飞蓟素对S.aureus(ATCC25923)生长曲线的影响
选取不同质量浓度的水飞蓟素研究其对ATCC25923生长曲线的影响,实验结果如图2所示。与对照组相比,可以看出在MIC、1/2 MIC浓度下,其吸光度显著降低,说明其中细菌含量较少,生长受到明显抑制。且在MIC和1/2 MIC浓度下,S.aureus的生长对数期在很大程度上被延迟。图中可以看出,对照组在细菌生长6 h后达到生长对数期,而MIC和1/2 MIC处理组在细菌生长10 h后达到生长对数期。且MIC处理组在达到生长对数期后其生长速度依旧较为平缓。特别是在2 MIC浓度下几乎没有细菌生长。综上所述,水飞蓟素可以显著抑制S.aureus的生长,并呈现一定的剂量依赖性。
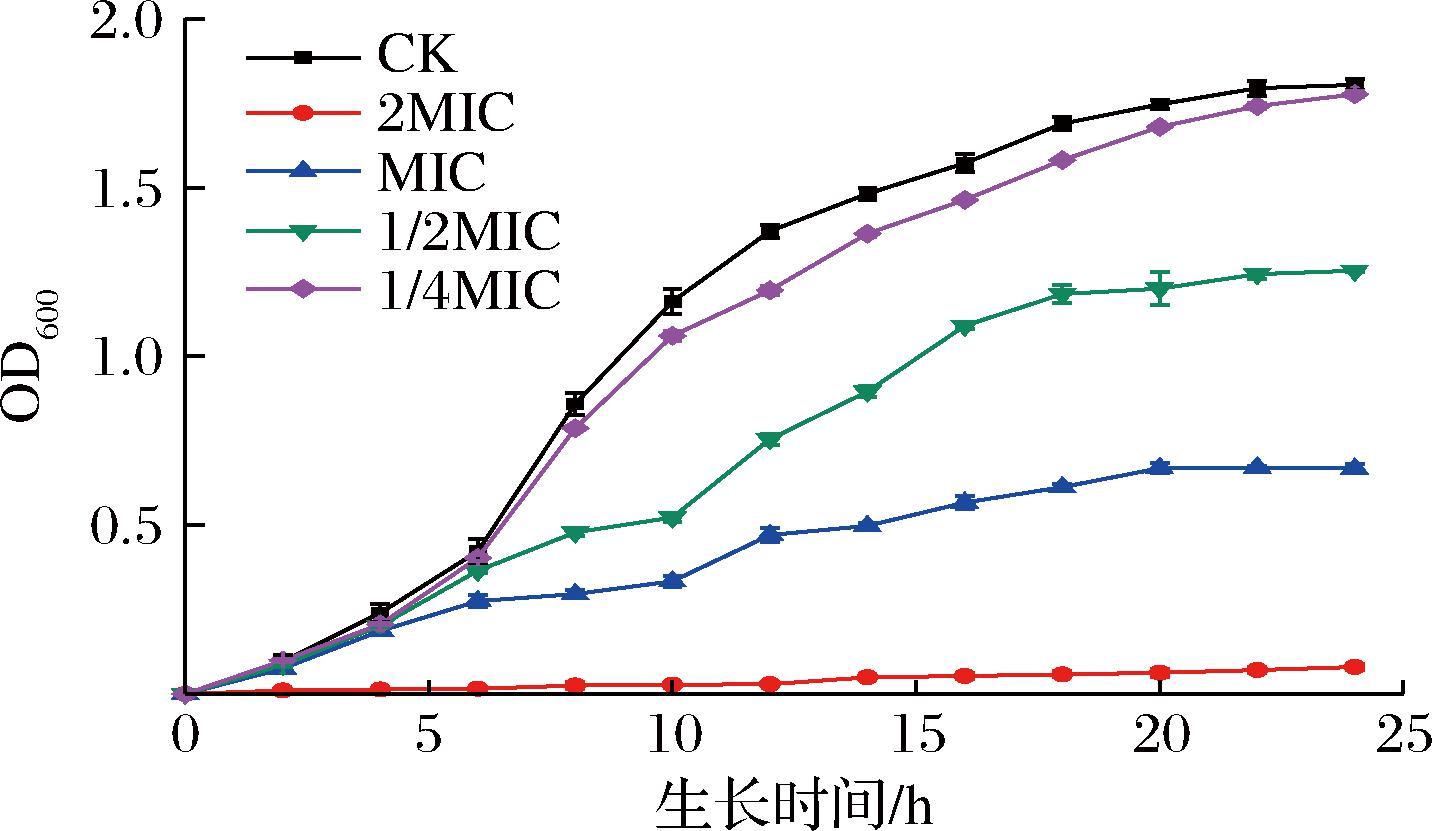
图2 ATCC25923在含有不同质量浓度的水飞蓟素的培养基中的生长曲线
Fig.2 Growth curve of ATCC 25923 in culture medium containing different concentrations of silymarin
2.3 理化因素对水飞蓟素抑菌活性的影响
2.3.1 温度对水飞蓟素抑菌活性影响
热处理是保证食品安全最常用的保存方法之一。但是,热处理过程中温度过低不一定能有效杀灭微生物,温度过高可能会影响天然添加剂的稳定性[21]。以S.aureus的OD600值为指标来研究温度对水飞蓟素抑菌活性的影响,实验结果如图3-a所示。在30~90 ℃温度处理下,与阳性对照组相比水飞蓟素的抑菌性没有明显变化,各实验组与阴性对照组相比都具有极显著的抑菌性(P<0.01)。表现出较为良好的热稳定性。SU等[22]对儿茶素和茶黄素混合物的稳定性研究表明,茶黄素在100 ℃处理3 h后降解严重,但降解速率与处理温度和热处理时间密切相关。而本研究加热时间只有30 min(远小于3 h),可能不会导致水飞蓟素中关键抗菌物质的降解,所以在“高温短时间”下水飞蓟素的抗菌活性仍然较好。
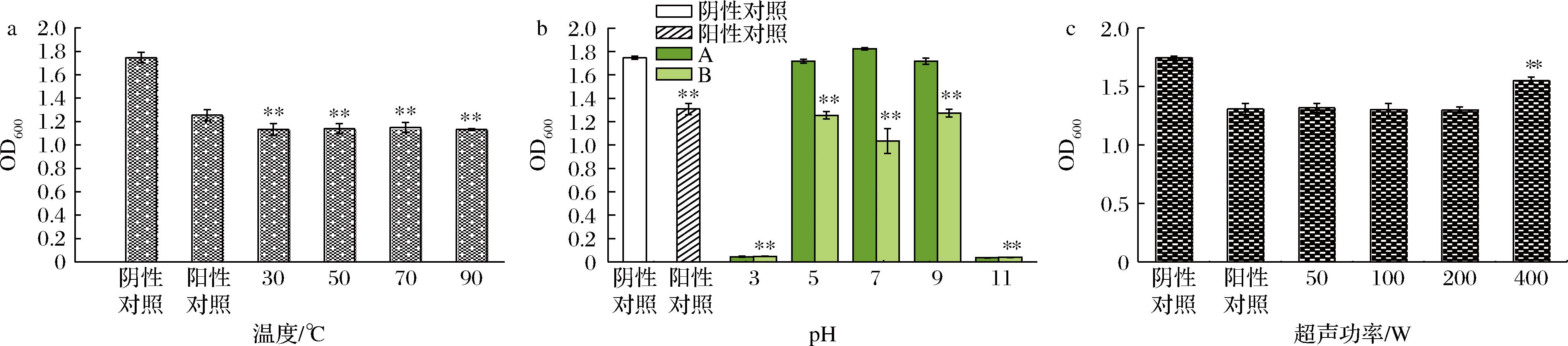
a-温度处理;b-pH处理;c-超声处理
图3 理化因素对水飞蓟素抑菌性的影响
Fig.3 Effect of physical and chemical factors on the bacteriostasis of silymarin
2.3.2 pH值对水飞蓟素抑菌活性的影响
同2.3.1节,以OD600值为指标研究pH对水飞蓟素抑菌活性的影响,实验结果如图3-b所示。由图3-b可知,与阳性对照组相比,pH值为5和9时其抑菌性没有明显变化(P>0.05),但在中性条件下水飞蓟素抑菌性与阳性对照组相比有显著提升(P<0.01)。在pH值为3和11的条件下可以看到处理组A和处理组B的OD600值基本保持一致,且未见明显的细菌生长。这可能是强酸或强碱环境造成了细菌的死亡。处理组B与阴性对照组相比,在pH值为5、7、9条件下均有极显著的抑菌性(P<0.01),说明水飞蓟素在中性至弱酸弱碱条件下具有良好的稳定性。LEE等[23]研究发现茶黄素在pH=6.5时非常稳定,在pH=7.0时缓慢降解,在pH=9.0时迅速降解。与茶黄素相比,水飞蓟素具有更好的酸碱稳定性。
2.3.3 超声对水飞蓟素抑菌活性的影响
使用超声细胞粉碎仪对水飞蓟素进行超声处理,以S.aureus的OD600值为指标来探究超声对水飞蓟素抑菌性的影响,实验结果如图3-c所示。与阳性对照组相比,处理功率在50~200 W时,水飞蓟素的抑菌活性几乎不受影响(P>0.05),但当功率达到400 W时,其抑菌活性与阳性对照相比显著降低(P<0.01)。这可能是较大功率的超声破坏了水飞蓟素中抑菌成分的结构[24]。
2.4 对S.aureus表面特征的影响
2.4.1 对表面疏水性的影响
细菌的表面疏水性是影响细菌黏附能力的主要因素之一,它与细菌黏附到生物或非生物表面的能力密切相关,同时也能够影响细菌吸收有机物质的能力[25],实验结果如图4-a所示。当水飞蓟素的质量浓度达到1/2 MIC和MIC时其疏水性分别为20.6%和12.8%,与对照组的40.2%之间的差异是极显著的(P<0.01)。与对照组相比水飞蓟素可以显著降低S.aureus疏水性,从而降低其黏附能力,使细菌的正常生长受到影响。ASHRAFUDOULLA等[26]发现丁香酚可以与细菌表面的蛋白质相互作用,使细菌表面疏水性降低32%~41%,在本实验中,MIC浓度的水飞蓟素使细菌表面疏水性降低了68%。
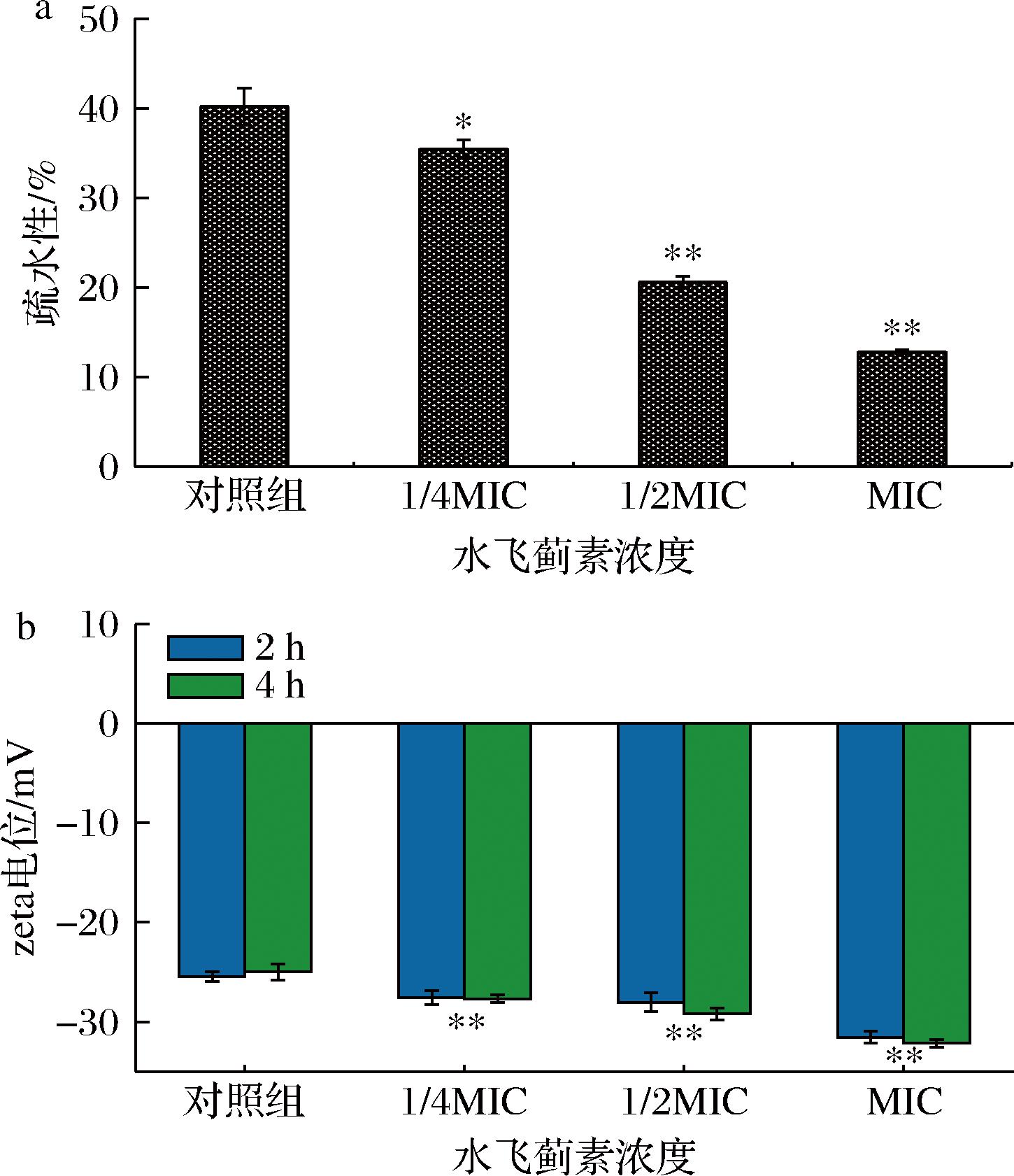
a-疏水性;b-zeta电位
图4 水飞蓟素对S.aureus zeta电位的影响
Fig.4 Effect of silymarin on zeta potential of S.aureus
2.4.2 zeta电位的测定
zeta电位与细菌的吸附作用密切相关,大多数细菌表面带负电荷,在静电引力的作用下细菌可以紧密地黏附在带正电的物体表面,有助于生物被膜的形成。一般来说细菌表面的zeta电位绝对值越高,菌落的稳定性越差[27],实验结果如图4-b所示。与对照组相比,不同质量浓度的水飞蓟素均可增大S.aureus表面zeta电位的绝对值(P<0.01),并且这种影响程度会随着水飞蓟素质量浓度的增加而增大。4 h处理组与2 h处理组相比,低浓度的水飞蓟素对细菌表面zeta电位的影响几乎没有变化(P>0.05),但高浓度的水飞蓟素对其影响略有提高。
2.5 对细胞形态的影响
通过扫描电镜对细菌细胞形态进行观察,可以更加直观地反映出水飞蓟素对S.aureus细胞形态的影响。由图5-a可以看到,未经水飞蓟素处理的S.aureus呈现正常的球状,结构完整且形态饱满。由图5-b、图5-c可以看出经1/2 MIC和1/4 MIC浓度的水飞蓟素处理后,部分细菌边界模糊,结构被破坏,发生细胞变形、表面粗糙以及黏连现象,且细胞表面附着大量的聚合物。由图5-d可以看到,经MIC浓度的水飞蓟素处理后,大量细菌的细胞结构遭到破坏,细胞畸变现象增加且大量堆叠到一起,几乎没有正常形态的细胞。由此可知,水飞蓟素可以破坏S.aureus细胞的正常形态,从而造成细胞的死亡。
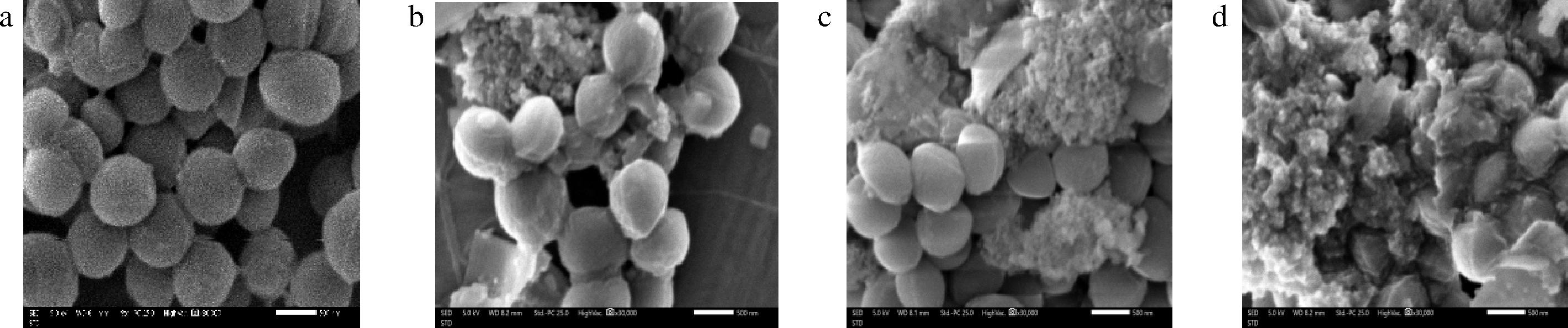
a-对照组;b-1/4MIC处理组;c-1/2MIC处理组;d-MIC处理组
图5 水飞蓟素对S.aureus细胞形态的影响
Fig.5 Effect of silymarin on cell morphology of S.aureus
2.6 还原糖消耗的测定
葡萄糖是生物体重要的能量来源之一,在同样的环境中提供等量的葡萄糖,然后通过测定剩余葡萄糖含量,能够在一定程度上反映出细菌的能量代谢是否受到抑制。以DNS法测定葡萄糖含量,实验结果如图6所示。对照组的葡萄糖浓度下降了54.8%(质量浓度,下同),1/4 MIC水飞蓟素处理组的葡萄糖浓度下降了38.9%,1/2 MIC与MIC处理组的葡萄糖浓度分别下降了20.8%和11.9%。与对照组相比,在水飞蓟素的作用下,S.aureus对葡萄糖的利用能力受到明显的抑制,且呈现一定的剂量依赖性,当水飞蓟素的质量浓度大于1/2 MIC时,这种抑制程度是极显著的(P<0.01),且MIC处理组对其葡萄糖利用能力的抑制程度达到了78.5%。
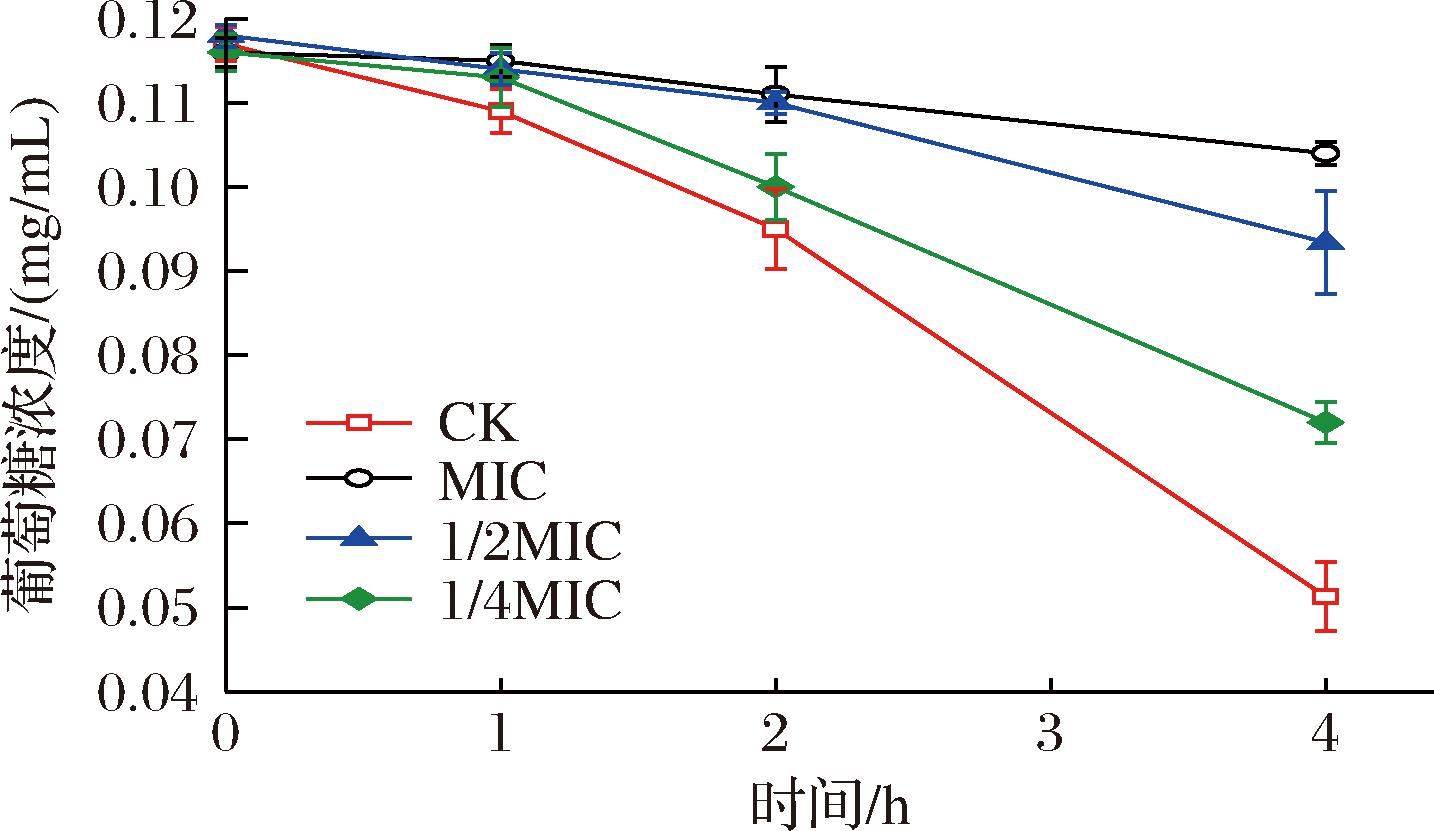
图6 还原糖消耗的测定
Fig.6 Determination of reducing sugar consumption
2.7 对S.aureus生物被膜的影响
2.7.1 水飞蓟素对S.aureus菌体聚集程度的影响
由图7-a可知,在不同质量浓度的水飞蓟素处理2 h后,S.aureus的菌团粒径的分布主要集中在0.95~3.5 μm之间。而对照组菌团粒径主要分布在100~180 μm之间。并且在此区间内的菌团粒径,MIC质量浓度水飞蓟素处理组的含量最低。由图7-b可知,经水飞蓟素处理4 h后,S.aureus菌团粒径最高峰分布在0.9~1 μm,而对照组菌团粒径最高峰分布在200~220 μm。且在0.9~1 μm处菌团粒径含量远高于2 h处理组。结果表明水飞激素可以在一定程度上阻碍S.aureus聚集以防止其形成生物被膜,且这种抑制作用呈现一定的剂量依赖性。
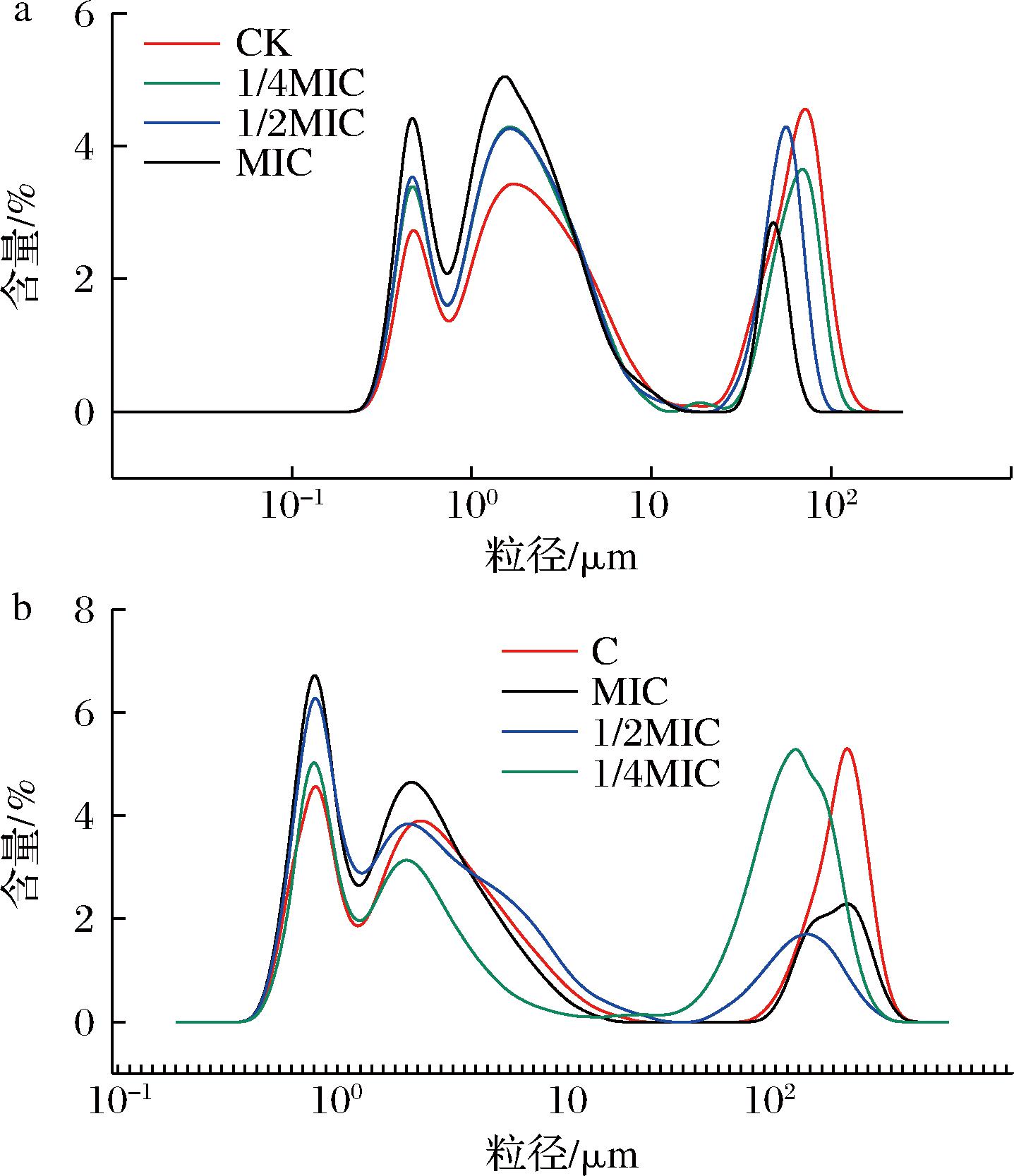
a-2 h;b-4 h
图7 水飞蓟素对S.aureus菌团粒径的影响
Fig.7 Effect of silymarin on the particle size ofS.aureus legion
2.7.2 SEM观察对生物被膜形成的影响
由图8-a可以看出,未经水飞蓟素处理的细菌,其菌体紧密堆积到一起,聚集成团,形成大片的生物被膜。而从图8-b~图8-d可以看出,经水飞蓟素处理后的细菌菌体密度降低,随着水飞蓟素浓度的增加,细菌菌体之间逐渐变得松散稀疏,且堆叠成团的现象逐渐减少,菌体厚度变薄。实验结果说明水飞蓟素可以在很大程度上抑制S.aureus生物被膜的形成。

a-对照组;b-1/4MIC处理组;c-1/2MIC处理组;d-MIC处理组
图8 水飞蓟素对S.aureus生物被膜的影响
Fig.8 Effect of silymarin on biofilm of S.aureus
2.7.3 荧光显微镜观察成熟生物被膜的影响
DAPI染液能够透过完整的细胞膜,与DNA结合在荧光显微镜下呈现蓝色荧光,常用于活细胞染色。胞外蛋白与胞外多糖结合共同维持细菌生物被膜的骨架[28],RhB染色液可与胞外蛋白结合,在荧光显微镜下呈现红色荧光。采用荧光显微镜观察水飞蓟素对S.aureus生物被膜的影响,实验结果如图9所示,图9-a呈现出大量蓝色荧光,表明未经水飞蓟素处理的S.aureus的生物被膜内含有大量活菌,由图9-b~图9-d可以看出,随着水飞蓟素浓度的增加,蓝色荧光逐渐减少,细菌数量逐渐下降。而图9-e呈现出大量红色荧光,表明正常状态下的成熟生物被膜内包含大量的胞外蛋白,随着水飞蓟素处理浓度的提高,图9-f~图9-h内的红色荧光逐渐减少,说明生物被膜内蛋白质含量逐渐减少。由此可以推测,水飞蓟素能够破坏清除S.aureus成熟的生物被膜,使其内的细菌暴露在外界环境中,进而杀死细菌。
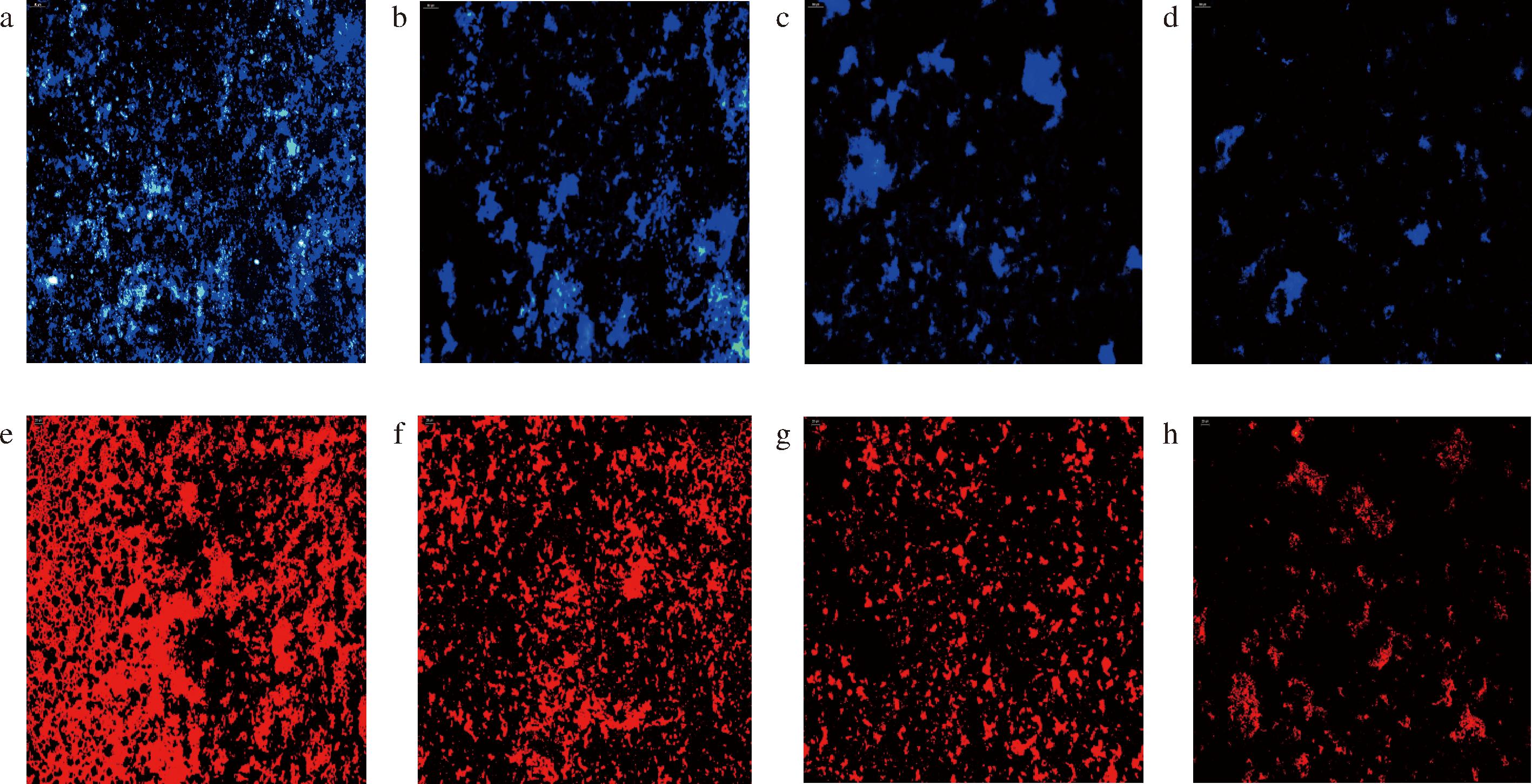
a-对照组(DAPI);b-1/4 MIC组(DAPI);c-1/2 MIC组(DAPI);d-MIC组(DAPI);e-对照组(RhB);f-1/4MIC组(RhB);g-1/2MIC组(RhB);h-MIC组(RhB)
图9 荧光显微镜观察
Fig.9 Fluorescence microscope observation
3 讨论与结论
本文选取S.aureus中3种典型的菌株测定了水飞蓟素对其最小抑菌浓度,并选取了最敏感菌株ATCC25923,从温度、pH、超声处理3个方面探究了理化因素对水飞蓟素抑菌稳定性的影响,90 ℃下处理其0.5 h后,水飞蓟素仍具有良好的抑菌稳定性,卢宁等[29]对苦菜提取液的抑菌稳定性进行测定,结果发现121 ℃高压湿热下处理0.5 h后,苦菜提取液的抑菌能力依旧较为稳定,而热稳定性对高温环境下食品运输过程中的防腐保鲜具有重要的应用价值,同时,在其研究酸碱环境对苦菜提取液抑菌稳定性的影响时发现,当pH<6或pH>7时,其抑菌活性有所下降,而水飞蓟素在pH=3和pH=5时抑菌能力仍较为稳定。因此,与苦菜提取液相比,水飞蓟素具有较好的酸碱稳定性。超声波由于高频的特性而被广泛应用于植物有效成分的提取,但是长时间的超声处理可能会对有效成分的结构造成破坏或分解,张媛媛等[24]在100 W超声功率下处理五味子提取物10 min后,发现其抑菌活性逐渐减弱,而本研究中使用400 W超声功率处理水飞蓟素10 min后发现其抑菌活性有所减弱,说明水飞蓟素具有良好的超声稳定性。为探究水飞蓟素在亚抑制浓度及最小抑菌浓度下对S.aureus的抗菌机制,选取了1/4 MIC至MIC等不同质量浓度的水飞蓟素进行研究,发现水飞蓟素可以降低细菌表面的疏水性和增加zeta电位的绝对值,在孙艺铭[30]关于鼠李糖脂对蜡样芽孢杆菌的抑制作用研究中发现,MIC浓度下的鼠李糖脂可以使蜡样芽孢杆菌的表面疏水性下降79.5%,而本研究中发现MIC浓度下的水飞蓟素可以使S.aureus的表面疏水性降低68%,二者研究结果相似。邢苏芳[31]在D-酪氨酸对大肠杆菌的抑菌机制研究中发现,随着D-酪氨酸浓度的变化,大肠杆菌表面zeta电位从-30 mV降到-43.65 mV,本文研究结果发现MIC浓度的水飞蓟素可以使S.aureus的表面zeta电位从-24.98 mV降到-31.26 mV,同样地使细菌表面zeta电位的绝对值增大。而细菌表面疏水性以及zeta电位与细菌的黏附能力、聚集程度以及生物被膜的形成密切相关,疏水性的增加会导致细菌黏附能力的减弱,zeta电位绝对值的增加会使菌落稳定性变差,进而使细菌聚集程度降低[27],生物被膜形成受到阻碍,之后的细菌聚集程度的测定以及扫面电镜观测细菌生物被膜形成的实验结果也印证了这一点。同时水飞蓟素还可以影响细菌的能量代谢来阻碍其生长繁殖,可以破坏细胞形态,使细胞发生畸变,内溶物泄漏导致细胞死亡。石素素[32]在关于月桂酸对S.aureus的抑菌机制研究中同样发现月桂酸可以使S.aureus的细胞形态发生明显改变,原本圆滑的球状形态呈不规则状,细胞边界变得模糊出现明显黏连,细胞表面呈现不同程度的皱缩和凹陷。之后为进一步探究水飞蓟素对S.aureus成熟生物被膜的影响,采用DAPI以及罗丹明B进行荧光显微镜观察,从DAPI荧光观察结果可知水飞蓟素可以使成熟生物被膜内的活菌数量大量减少,因此推断出水飞蓟素可能通过渗透或破坏成熟生物被膜的组分来杀死细菌,而从罗丹明B的荧光结果看出经水飞蓟素处理的成熟生物被膜内的蛋白质组分变得稀疏分散,这进一步验证了前面的推断。在杨雅慧[23]的研究中同样发现乳糖酸可以使S.aureus生物被膜内的蛋白质组分大量减少,与本实验研究结果一致。
综上,不同天然产物对不同食源性致病菌的抑菌机制不尽相同,水飞蓟素可以从多方面抑制细菌的生长繁殖,且具有良好的抑菌稳定性,这为其作为食品保鲜涂膜的进一步开发应用提供了理论依据。
[1] LI S X, WANG P P, ZHAO J L, et al.Characterization of toxin genes and antimicrobial susceptibility of Staphylococcus aureus from retail raw chicken meat[J].Journal of Food Protection, 2018, 81(4):528-533.
[2] 张舒涵, 梁海运, 孙佳慧, 等.甘草提取物对Staphylococcus aureus的抑菌活性及作用机理[J].食品与发酵工业, 2024, 50(10):259-265.ZHANG S H, LIANG H Y, SUN J H, et al.Antimicrobial activity of licorice extract against Staphylococcus aureus and its underlying mechanism of action[J].Food and Fermentation Industries, 2024, 50(10):259-265.
[3] LEE J S, HONG D Y, KIM E S, et al.Improving the water solubility and antimicrobial activity of silymarin by nanoencapsulation[J].Colloids and Surfaces.B, Biointerfaces, 2017, 154:171-177.
[4] ESMAEIL N, ANARAKI S B, GHARAGOZLOO M, et al.Silymarin impacts on immune system as an immunomodulator:One key for many locks[J].International Immunopharmacology, 2017, 50:194-201.
[5] 陈江丽, 邱智东, 金媛媛, 等.水飞蓟素脂质体的制备、质量评价及其对HaCaT细胞增殖和摄取的影响[J].中草药, 2022, 53(12):3614-3624.CHEN J L, QIU Z D, JIN Y Y, et al.Preparation and quality evaluation of silymarin liposomes and their effects on proliferation and uptake of HaCaT cells[J].Chinese Traditional and Herbal Drugs, 2022, 53(12):3614-3624.
[6] DE OLIVEIRA D R, TINTINO S R, BRAGA M F B M, et al.In vitro antimicrobial and modulatory activity of the natural products silymarin and silibinin[J].BioMed Research International, 2015, 2015:292797.
[7] EVREN E, YURTCU E.In vitro effects on biofilm viability and antibacterial and antiadherent activities of silymarin[J].Folia Microbiologica, 2015, 60(4):351-356.
[8] FEI P, FENG H X, WANG Y Y, et al.Amaranthus tricolor crude extract inhibits Cronobacter sakazakii isolated from powdered infant formula[J].Journal of Dairy Science, 2020, 103(11):9969-9979.
[9] 钟灵. 茶黄素与β-内酰胺类抗生素协同抗MRSA作用及机制的初步研究[D].长春:吉林大学, 2020.ZHONG L.Synergistic anti-bacterial effects and mechanism of Theaflavin with β-lactam Antibiotics against MRSA[D].Changchun:Jilin University, 2020.[10] MAO Y, ZHANG X J, XU Z H.Identification of antibacterial substances of Lactobacillus plantarum DY-6 for bacteriostatic action[J].Food Science &Nutrition, 2020, 8(6):2854-2863.
[11] ZANGENEH M, KHORRAMI S, KHALEGHI M.Bacteriostatic activity and partial characterization of the bacteriocin produced by L.plantarum sp.isolated from traditional sourdough[J].Food Science &Nutrition, 2020, 8(11):6023-6030.
[12] PRASATH K G, THARANI H, KUMAR M S, et al.Palmitic acid inhibits the virulence factors of Candida tropicalis:Biofilms, cell surface hydrophobicity, ergosterol biosynthesis, and enzymatic activity[J].Frontiers in Microbiology, 2020, 11:864.
[13] 宁亚维, 付浴男, 何建卓, 等.苯乳酸和醋酸联用对单核细胞增生李斯特菌的协同抑菌机理[J].食品科学, 2020, 41(23):70-76.NING Y W, FU Y N, HE J Z, et al.Synergistic antibacterial mechanism of phenyllactic acid combined with acetic acid against Listeria monocytogenes[J].Food Science, 2020, 41(23):70-76.
[14] 李远颂, 何荣荣, 蔡佳欣, 等.芳樟醇对莓实假单胞菌的抑菌活性及机制[J].食品科学技术学报, 2022, 40(4):55-63.LI Y S, HE R R, CAI J X, et al.Antibacterial activity and mechanism of linalool against Pseudomonas fragi[J].Journal of Food Science and Technology, 2022, 40(4):55-63.
[15] 徐婷婷. 皮寒药对S.aureus的抑制作用及其抑菌机制研究[D].重庆:西南大学, 2017.XU T T.Antibacterial effects and mechanism of a traditional Chinese herb drug Gueldenstaedtia delavayi franch on Staphylococcus aureus[D].Chongqing:Southwest University, 2017.
[16] 王梓源, 李欣颖, 吕俊阁, 等.ε-聚赖氨酸对大肠杆菌的抑菌机制[J].食品与发酵工业, 2020, 46(21):34-41.WANG Z Y, LI X Y, LYU J G, et al.The antimicrobial mechanism of ε-poly-L-lysine against Escherichia coli[J].Food and Fermentation Industries, 2020, 46(21):34-41.
[17] 徐云凤. 安石榴苷对S.aureus的抑菌作用及机制研究[D].杨凌:西北农林科技大学, 2017.XU Y F.Antimicrobial activities and mechanisms of punicalagin against Staphylococcus aureus[D].Yangling:Northwest A&F University, 2017.
[18] 闫昱文. D-亮氨酸增强氯己定对致龋变形链球菌生物膜分散作用的研究[D].沈阳:中国医科大学, 2021.YAN Y W.D-leucine enhances antibiofilm activity of chlorhexidine against caries-causing Streptococcus mutans biofilm[D].Shenyang:China Medical University, 2021.
[19] LIANG H Y, HE K K, LI T, et al.Mechanism and antibacterial activity of vine tea extract and dihydromyricetin against Staphylococcus aureus[J].Scientific Reports, 2020, 10(1):21416.
[20] LEE S Y, NAM S H, LEE H J, et al.Antibacterial activity of aqueous garlic extract against Escherichia coli O157:H7, Salmonella typhimurium and Staphylococcus aureus[J].Journal of Food Hygiene and Safety, 2015, 30(2):210-216.
[21] 杨志彩, 郭舒阳, 李素云, 等.不同环境因素和食品基质对Nisin抑制单增李斯特菌活性的影响[J].食品与发酵工业, 2022, 48(12):209-214.YANG Z C, GUO S Y, LI S Y, et al.Effects of environmental factors and food matrices on the inhibitory activity of Nisin against Listeria monocytogenes[J].Food and Fermentation Industries, 2022, 48(12):209-214.
[22] SU Y L, LEUNG L K, HUANG Y, et al.Stability of tea theaflavins and catechins[J].Food Chemistry, 2003, 83(2):189-195.
[23] LEE M J, LAMBERT J D, PRABHU S, et al.Delivery of tea polyphenols to the oral cavity by green tea leaves and black tea extract[J].Cancer Epidemiology, Biomarkers &Prevention, 2004, 13(1):132-137.
[24] 张媛媛, 冯亚净, 李书国.五味子乙醇提取物的抑菌稳定性及抑菌机理研究[J].粮油食品科技, 2016, 24(1):55-60.ZHANG Y Y, FENG Y J, LI S G.Study on the antimicrobial stability and antibacterial mechanism of ethanol extracts from Fructus Schisandrae chinensis[J].Science and Technology of Cereals, Oils and Foods, 2016, 24(1):55-60.
[25] LIU Y, TANG S X, FERNANDEZ-LOZANO C, et al.Experimental study and random forest prediction model of microbiome cell surface hydrophobicity[J].Expert Systems with Applications, 2017, 72:306-316.
[26] ASHRAFUDOULLA M, MIZAN M F R, HA A J W, et al.Antibacterial and antibiofilm mechanism of eugenol against antibiotic resistance Vibrio parahaemolyticus[J].Food Microbiology, 2020, 91:103500.
[27] 汤少勋, 党坦, 谭支良.界面物理化学特性在动物营养消化研究中的应用与展望[J].农业现代化研究, 2018, 39(6):977-985.TANG S X, DANG T, TAN Z L.Research progress and prospects on the interface physical chemistry properties in nutrient digestion[J].Research of Agricultural Modernization, 2018, 39(6):977-985.
[28] IDREES M, SAWANT S, KARODIA N, et al.Staphylococcus aureus biofilm:Morphology, genetics, pathogenesis and treatment strategies[J].International Journal of Environmental Research and Public Health, 2021, 18(14):7602.
[29] 卢宁, 侯金丽.不同环境因素对苦菜提取液抑菌稳定性的影响[J].中国调味品, 2023, 48(6):100-103.LU N, HOU J L.Effect of different environmental factors on the bacteriostatic stability of Patrinia villosa extract[J].China Condiment, 2023, 48(6):100-103.
[30] 孙艺铭. 鼠李糖脂对蜡样芽孢杆菌的抗菌活性及机理研究[D].郑州:河南工业大学, 2023.SUN Y M.Study on antibacterial activity and mechanism of rhamnolipid against Bacillus cereus[D].Zhengzhou:Henan University of Technology, 2023.
[31] 邢苏芳. D-氨基酸对生物膜形成过程的调控机理研究[D].济南:山东大学, 2014.XING S F.Study on the regulation mechanism of D- amino acid on biofilm formation[D].Jinan:Shandong University, 2014.
[32] 石素素. 月桂酸对S.aureus的抑菌机制及其在熟鸡肉中的应用研究[D].长春:吉林大学, 2023.SHI S S.Antibacterial mechanism of lauric acid against Staphylococcus aureus and its application in cooked chicken[D].Changchun:Jilin University, 2023.