松花粉是我国特有的药食同源花粉品种,是松科植物马尾松(Pinus massoniana Lamb.)、油松(Pinus tabuliformis Carr.)或同属数种植物的雄性生殖细胞。松花粉除了含有蛋白质、氨基酸、糖、脂肪、矿物元素等基本营养成分外,还含有多酚、黄酮、生育酚、植物甾醇等大量生物活性成分[1]。其中,以咖啡酸、表儿茶素、原儿茶酸等为代表的酚类物质通常具有较强的抗氧化能力[2],可以通过调控机体的氧化应激途径,在预防、缓解或治疗多种疾病方面具有显著的效果[3]。
在植物源食品原料中,大部分的酚类成分与蛋白质和纤维等大分子化合物以结合态存在。若采用不当的前处理方式提取酚类物质,其可利用程度较低,导致最终的功效不足[4]。为了尽可能提高酚类成分的利用度,可通过化学法、酶法或生物发酵法破坏酚类与大分子之间的连接,促进基质中酚类成分的释放[5],从而提高其生物利用性和功能性[6]。相较而言,化学法存在一定的安全性问题,而发酵法由于可通过菌种的选择获得多类酶系,比单纯酶法更加高效。此外,发酵法具有一定的生物转化功能[7],能赋予最终产品所用菌种相关的有益代谢产物特性,实现协同增效。发酵法还能在提供高质量和高活性提取物的同时,排除与有机溶剂相关的毒性问题[8]。因此,发酵法被大量用于提升天然食品原料中的生物活性成分含量,如通过酿酒酵母发酵肉桂增加其抗氧化和抗炎成分[9],通过乳酸克鲁维酵母发酵乳清饮料提高其多酚含量和抗氧化能力[10]。酵母代谢会产生分解植物细胞壁的酯酶、糖苷酶、多糖降解酶等解聚酶[11-12],将结合的酚类物质转化为易提取并可被机体吸收的游离酚,改变食物中酚类物质的含量、组成及抗氧化活性[9]。目前,发酵法多用于提升松花粉的营养成分及加工,如采用副干酪乳杆菌Lc-3发酵以提升其粗蛋白含量[13],采用植物乳杆菌和副干酪乳杆菌发酵以开发松花粉破壁新途径[14]等,而采用发酵法特别是食品中常用的酵母菌等微生物发酵以提升其功能活性及主要成分的研究很少。
本文选用酿酒酵母1002(Saccharomyces cerevisiae 1002)、乳酸克鲁维酵母1572(Kluyveromyces lactis 1572)、酿酒酵母1905(Saccharomyces cerevisiae 1905)发酵松花粉,对破壁松花粉发酵前后的体外抗氧化活性、总酚含量和总黄酮含量,以及酚类物质的种类和含量进行了研究,以期为提升松花粉产品的活性及功能食品的开发提供理论和实验依据。
1 材料与方法
1.1 材料与试剂
云南破壁松花粉,由烟台新时代健康产业有限公司提供;酿酒酵母Saccharomyces cerevisiae CICC®1002、乳酸克鲁维酵母Kluyveromyces lactis CICC®1572、酿酒酵母Saccharomyces cerevisiae CICC®1905,中国工业微生物菌种保藏管理中心。
没食子酸、原儿茶酸、4-羟基苯甲酸、咖啡酸、对香豆酸、花旗松素、柚皮素、芦丁标准品(均为纯度≥98%),百灵威科技有限公司;4-香豆酰奎宁酸、3-O-香豆酰奎宁酸(均为纯度≥98%),江苏永健医药科技有限公司;MEB肉汤培养基,青岛日水生物技术有限公司;Folin-Ciocalteu试剂、DPPH、ABTS、2,4,6-三吡啶基三嗪[2,4,6-tris(2-pyridy1)-S-tria-zine,TPTZ]、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox),美国Sigma-Aldrich公司;甲醇、乙腈(均为色谱级),美国TEDIA公司;其他溶剂和试剂均为分析级,国药集团化学试剂有限公司。
1.2 仪器与设备
ZQZY-78AV恒温摇床,上海知楚生物科技有限公司;GHP-9080恒温培养箱,中国上海毅恒技术有限公司;SB5200超声波清洗机,宁波新芝生物科技有限公司;WATERS MALDI SYNAPT超高效液相色谱四极杆飞行时间质谱联用仪(UPLC-QTOF-MS)、配有2998二极管阵列检测器(PDA)的Waters e2695高效液相色谱仪(HPLC-PDA),美国Waters公司;SpectraMax 190全波长酶标仪,美国Molecular Devices公司。
1.3 实验方法
1.3.1 菌种活化
分别取酿酒酵母1002、乳酸克鲁维酵母1572、酿酒酵母1905的甘油管菌液在MEB平板培养60 h,挑取单菌落至100 mL MEB培养基中30 ℃,200 r/min培养14 h,再取1 mL菌悬液到100 mL MEB培养基中,于30 ℃,200 r/min条件下培养至1×107CFU/mL。
1.3.2 发酵与样品制备
发酵松花粉组:取6.5 g破壁松花粉至250 mL锥形瓶中,添加2.6 g葡萄糖(20 g/L)和130 mL去离子水混匀后巴氏灭菌(中心温度85 ℃,保温30 min)作为发酵基质,冰浴冷却至室温后,以10%接种量接种,于30 ℃、200 r/min培养,分别于培养第1、3、5、7、9天取样用于指标检测。发酵结束后巴氏灭菌,然后以8 000 r/min离心5 min,过滤,取上清液,-20 ℃保存用于指标检测。
松花粉水提物组(WE组):向100 g破壁松花粉中加入2 000 mL去离子水,45 ℃超声搅拌提取3 h(重复3次),以8 000 r/min离心5 min,过滤,取上清液,-20 ℃保存用于指标检测。
未发酵松花粉组(PP组):不添加酵母,其余操作步骤同发酵松花粉组。
纯酵母菌组:不添加松花粉,其余操作步骤同发酵松花粉组,分为酿酒酵母1002空白组(K1002组)、乳酸克鲁维酵母1572空白组(K1572组)、酿酒酵母1905空白组(K1905组)。
1.3.3 抗氧化活性测定
1.3.3.1 DPPH自由基清除能力
参考SARIKURKCU等[15]的方法,取100 μL松花粉发酵液(适当稀释)和等体积0.2 mmol/L DPPH溶液室温下避光反应30 min后在517 nm处测定吸光值,以微摩尔Trolox当量计。
1.3.3.2 ABTS阳离子自由基清除能力
参考QUAN等[16]的方法,取10 μL松花粉发酵液(适当稀释)和190 μL ABTS工作液室温下避光反应10 min后在734 nm处测定吸光值,以微摩尔Trolox当量计。
1.3.3.3 铁离子还原能力(ferric-reducing/antioxidant power,FRAP)
参考QIE等[17]的方法,取10 μL松花粉发酵液(适当稀释)和190 μL FRAP工作液于室温下避光反应30 min后在593 nm处测定吸光值,以微摩尔Trolox当量计。
1.3.4 总酚含量测定
参考CHENG等[18]的Folin-Ciocalteu法,取适量松花粉发酵液与1 mL Folin-Ciocalteu试剂充分混合,再加入3 mL 75 g/L Na2CO3溶液后定容至10 mL后避光反应2 h,在765 nm处测定吸光值,以毫克没食子酸当量计。
1.3.5 总黄酮含量测定
参考FU等[19]的氯化铝比色法,取适量松花粉发酵液定容至4 mL,先加0.3 mL质量分数为5%的NaNO2溶液静置5 min,再加入0.3 mL质量分数为10%的AlCl3溶液静置6 min,最后加入2 mL 1 mol/L NaOH溶液,用去离子水定容至10 mL并显色10 min后在510 nm处测定吸光值,以毫克芦丁当量计。
1.3.6 酚类物质的定性与定量
1.3.6.1 酚类物质的鉴定
参考CHENG等[18]的方法,取1 mL松花粉发酵液,过0.22 μm滤膜后使用UPLC-QTOF-MS进行分析。色谱柱:BEH C18(100 mm×2.1 mm,1.7 μm),流动相:A-乙腈;B-0.1%甲酸水溶液(体积分数),洗脱条件:0~5 min,5%~10% A;5~10 min,10%~25% A;10~15 min,25%~50% A;15~20 min,50%~80% A;20~25 min,80%~100% A,流速0.3 mL/min,进样量5 μL,柱温45 ℃,检测波长为200~800 nm。
在MassLynx V4.2软件中得到样品溶液的质谱图,确定母离子、碎片离子的精确质量数及各离子对应响应值,用MSFINDER综合误差、得分、结构式、碎片等信息,结合文献,初步推测物质种类,再通过比较样品溶液与标准溶液中的目标化合物的色谱峰保留时间及二级质谱中碎片离子的精确质量数完成化合物的定性。
1.3.6.2 酚类物质的定量分析
取1 mL松花粉发酵液,过0.22 μm滤膜后使用HPLC-PDA分析。色谱柱:X-Bridge C18(250 mm×4.6 mm,5 μm),流动相:A-乙腈;B-0.1%甲酸水溶液,洗脱条件:0~5 min,10%~28%A;5~10 min,28%~80%A;10~13 min,80%~100%A,流速为1.0 mL/min,进样量10 μL,柱温30 ℃,检测波长为284 nm,采用外标法进行定量。
1.4 数据处理与分析
所有实验均重复3次,结果均以平均值±标准偏差表示,数据采用Statistix 9软件进行统计学分析,各变量之间相关性采用Spearman相关性分析,采用SIMCA 14.1进行主成分分析,用Origin 2023软件作图。
2 结果与分析
2.1 不同酵母菌发酵松花粉前后抗氧化能力的变化
从图1-a可知,未发酵松花粉组的DPPH自由基清除能力显著低于水提物组(P<0.05),而发酵松花粉的DPPH自由基清除能力与水提物组相比显著上升(P<0.05),且随着发酵时间的延长而升高,说明发酵能显著提升松花粉的DPPH自由基清除能力。发酵后样品的DPPH自由基清除能力提高了106.88%~229.20%,其中酿酒酵母1905发酵5 d的提升效果最好,DPPH自由基清除能力达7.30 μmol/(L·g),比水提物组的2.21 μmol/(L·g)提高了2.3倍。陈江魁等[20]的研究发现采用德尔布有孢圆酵母发酵皇冠梨酒时其DPPH自由基清除率可从发酵前的62.6%提升至77.1%,与本文中酿酒酵母对松花粉DPPH自由基清除能力提升效果的差异可能是由于不同酵母菌的发酵特性及原材料的差异所致。
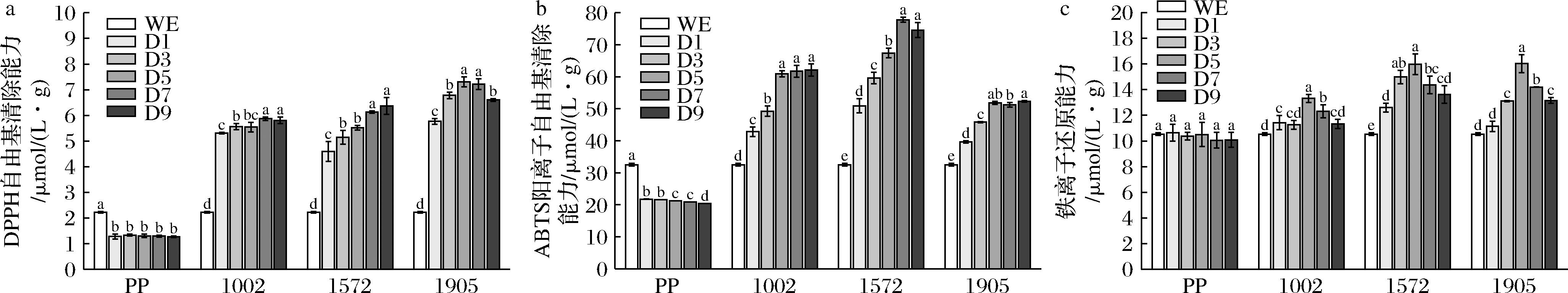
a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力;c-铁离子还原能力
图1 3种酵母菌发酵对松花粉抗氧化能力的影响
Fig.1 Effects of fermentation by three yeast species on the antioxidant capacity of pine pollen
注:D表示发酵时间,如D1表示发酵第1天,下同;同一菌株不同发酵时间不同字母表示差异显著(P<0.05)(下同)。
从图1-b可知,未发酵松花粉组的ABTS阳离子自由基清除能力显著低于水提物组(P<0.05),且随时间增加不断降低,发酵松花粉的ABTS阳离子自由基清除能力与水提物组相比显著升高(P<0.05),说明发酵能显著提升松花粉的ABTS阳离子自由基清除能力。随着发酵时间的延长,ABTS阳离子自由基清除能力逐渐上升后趋于稳定,这与吴静等[21]采用酿酒酵母发酵霍山石斛的ABTS阳离子自由基清除率变化趋势相似。本文中采用乳酸克鲁维酵母1572发酵7 d的ABTS阳离子自由基清除能力提升效果最为显著,其ABTS阳离子自由基清除能力可达77.83 μmol/(L·g),比水提物组的32.55 μmol/(L·g)增加139.10%。
从图1-c可知,未发酵松花粉组的铁离子还原能力与水提物组无显著差异(P>0.05),发酵松花粉的铁离子还原能力与水提物组相比显著上升(P<0.05),且随发酵时间的延长呈现先上升后下降的趋势,说明发酵能显著提升松花粉的铁离子还原能力。周佳悦等[22]在采用高活性干葡萄酒酵母发酵蓝莓果酒时发现随着发酵时间的延长铁离子还原能力呈现先上升后下降的趋势,这与本文的结果相似。本研究中提升最明显的为酿酒酵母1905及乳酸克鲁维酵母1572发酵5 d的样品,铁离子还原能力分别为16.02和15.96 μmol/(L·g),与水提物组的10.53 μmol/(L·g)相比分别提升了52.12%及51.56%。
为了排除酵母菌本身的生长对松花粉发酵后抗氧化能力的影响,考察了不添加松花粉的情况下3种酵母菌不同发酵天数的抗氧化能力。由图2可知,纯酵母菌组本身的抗氧化能力显著(P<0.001)低于发酵松花粉组,3种酵母菌发酵后自身的抗氧化能力仅为松花粉发酵第一天抗氧化能力的0.95%~2.61%、11.97%~21.67%、3.02%~10.74%,表明发酵松花粉组抗氧化能力的显著提升是酵母菌发酵松花粉的结果,酵母菌本身相对于松花粉发酵后的抗氧化能力可忽略不计。
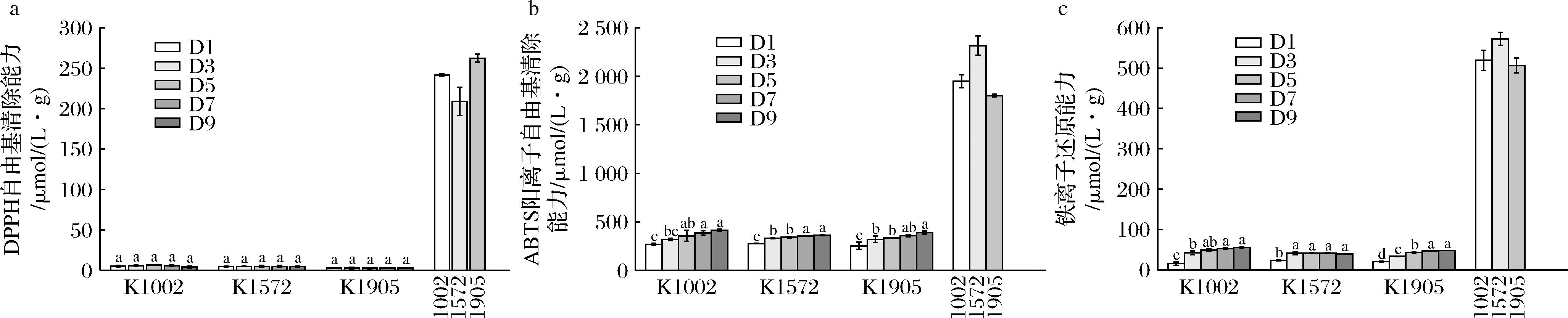
a-DPPH自由基清除能力;b-ABTS阳离子自由基清除能力;c-铁离子还原能力
图2 纯酵母菌组发酵不同时间的抗氧化能力变化
Fig.2 Changes in antioxidant capacity in pure yeast fermentation group with different durations
注:最右侧为发酵松花粉组,均选取3个菌种发酵第1天的结果。
2.2 不同酵母菌发酵对松花粉总酚和总黄酮含量的影响
由图3可知,纯酵母菌组的总酚含量(0.06~0.34 mg GAE/g)均显著低(P<0.001)于发酵松花粉组(3.28~5.29 mg GAE/g),松花粉水提物的总酚含量为2.17 mg GAE/g,未发酵松花粉组的总酚含量与水提物组接近,且在后期含量有所下降,而经过酵母发酵后总酚含量均显著升高(P<0.05)。不同酵母菌对总酚含量的提升程度从大到小依次为:乳酸克鲁维酵母1572>酿酒酵母1002>酿酒酵母1905,其中乳酸克鲁维酵母1572发酵7 d时提升最多,总酚含量达5.29 mg GAE/g,与水提物组相比提升了143.50%。
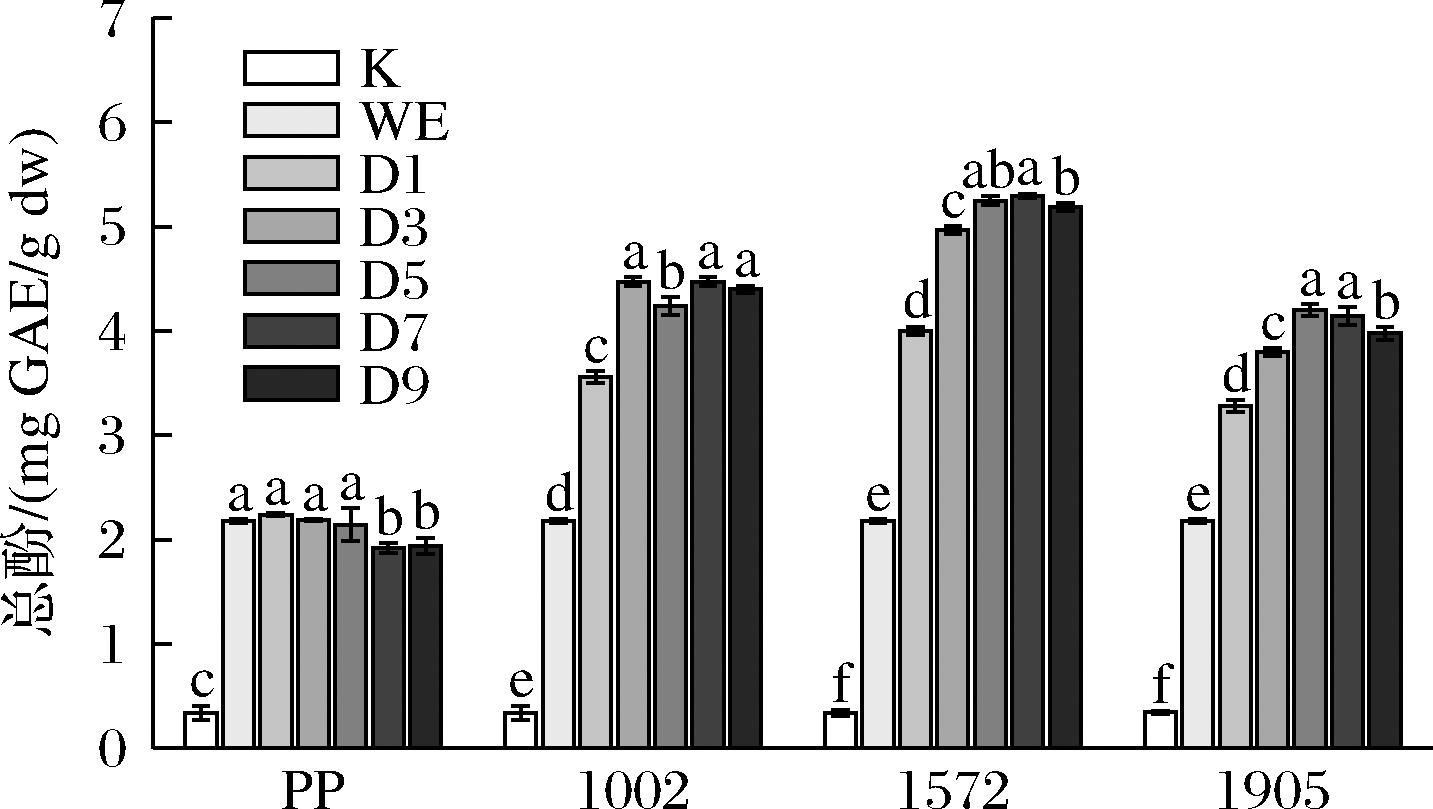
图3 三种酵母菌发酵对松花粉总酚含量的影响
Fig.3 Effects of fermentation by three yeast species on the total phenolic content of pine pollen
注:K表示对应纯酵母菌发酵第9天。
总酚含量随着发酵天数的增加呈现先上升后趋于稳定或稍微降低的趋势,这一结果与KATINA等[23]用商业面包酵母发酵麸皮后游离酚含量与发酵时间呈线性增加的趋势相似,可能是发酵前期发生了蛋白水解和细胞壁降解等使结合的酚类化合物从聚合物结构中释放出来增加了游离酚的含量,而在发酵后期一些酚则发生了非酶促反应并聚合,导致总酚含量有所降低[22]。
由图4可知,纯酵母菌组的总黄酮均未检出,松花粉水提物组的总黄酮为1.70 mg RE/g,未发酵松花粉组的总黄酮含量与水提物组接近。发酵后总黄酮含量整体呈现先上升后下降的趋势,与水提物相比大部分实验组总黄酮含量均有所降低。其中,乳酸克鲁维酵母1572发酵5 d时总黄酮为1.77 mg RE/g,提高了4.02%,但并不显著。ZHANG等[24]用酵母发酵葡萄的研究也显示了类似的结果,这可能是由于在整个发酵过程中部分不稳定的黄酮裂解成了更低分子质量的酚类成分。
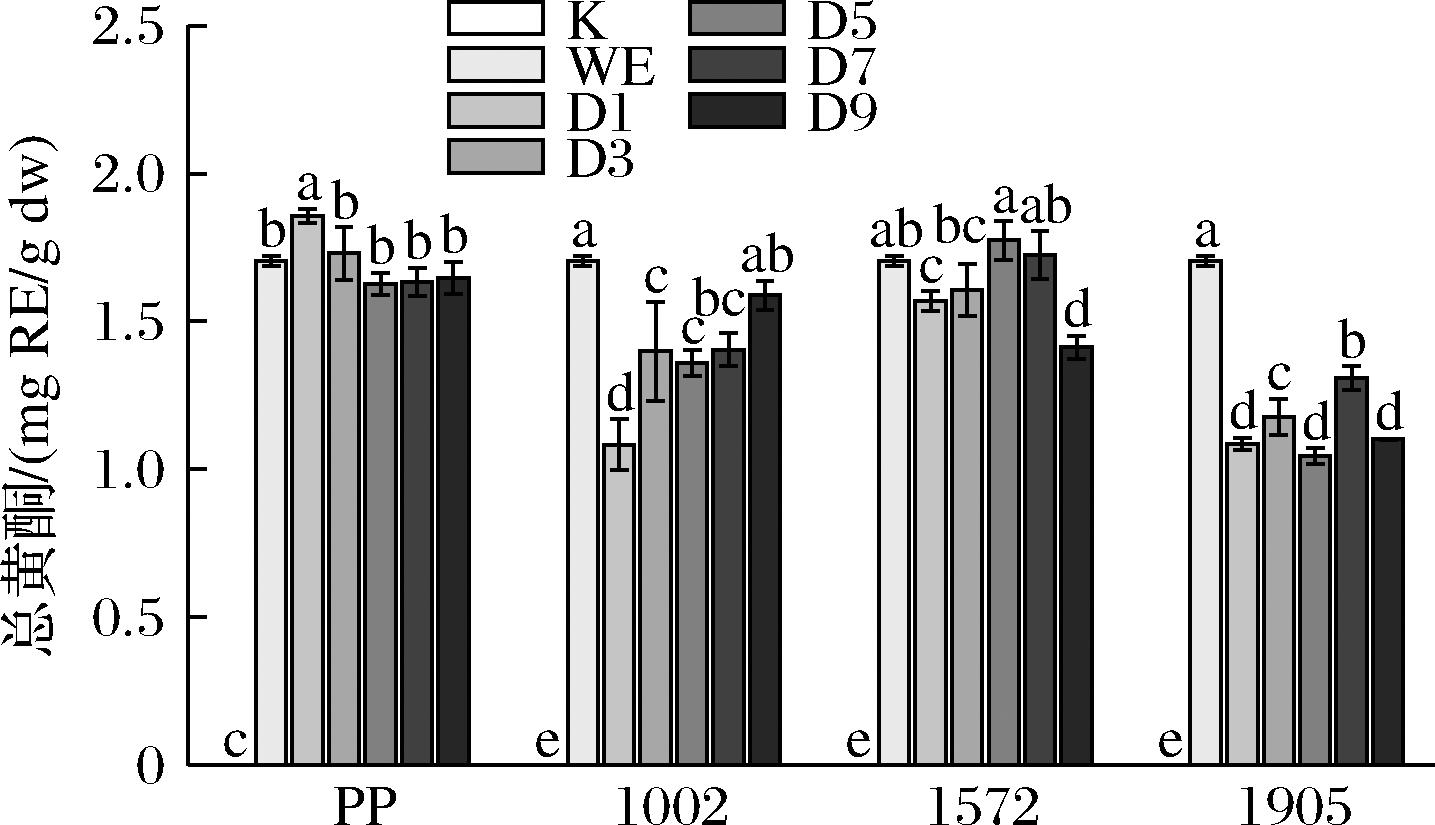
图4 三种酵母菌发酵对松花粉总黄酮含量的影响
Fig.4 Effects of fermentation by three species of yeast on the total flavonoid content of pine pollen
2.3 不同酵母菌发酵对松花粉单体酚类物质的影响
采用UPLC-QTOF-MS鉴定了发酵松花粉中所含的单体酚类化合物,使用MassLynx质谱数据分析软件将得到的酚类化合物碎片信息和MS数据与参考文献进行比较,用 ChemSpider数据库确认化合物鉴定结果,如图5、图6所示,最终在发酵松花粉中鉴定出了10种酚类化合物,分别为没食子酸、原儿茶酸、咖啡酰奎宁酸、4-羟基苯甲酸、4-香豆酰奎宁酸、咖啡酸、香豆酰奎宁酸、对香豆酸、花旗松素、柚皮素。其中,没食子酸、4-羟基苯甲酸、对香豆酸、花旗松素和柚皮素为新生成物质,这很可能是在发酵过程中葡萄糖通过莽草酸途径先生成3-脱氢莽草酸,再经脱氢、烯醇化反应合成没食子酸[25],苯丙氨酸通过苯丙烷途径转化为对香豆酸[26],有机酸则生物转化为4-羟基苯甲酸[27]。唐富豪等[28]通过非靶向代谢组学也发现了莽草酸途径、苯丙烷代谢途径均是发酵生成酚类化合物的重要途径。花旗松素和柚皮素的生成则可能是由其结合状态在酵母产生的酯酶、糖苷酶、多糖降解酶等解聚酶的作用下转变为游离态所致[29]。
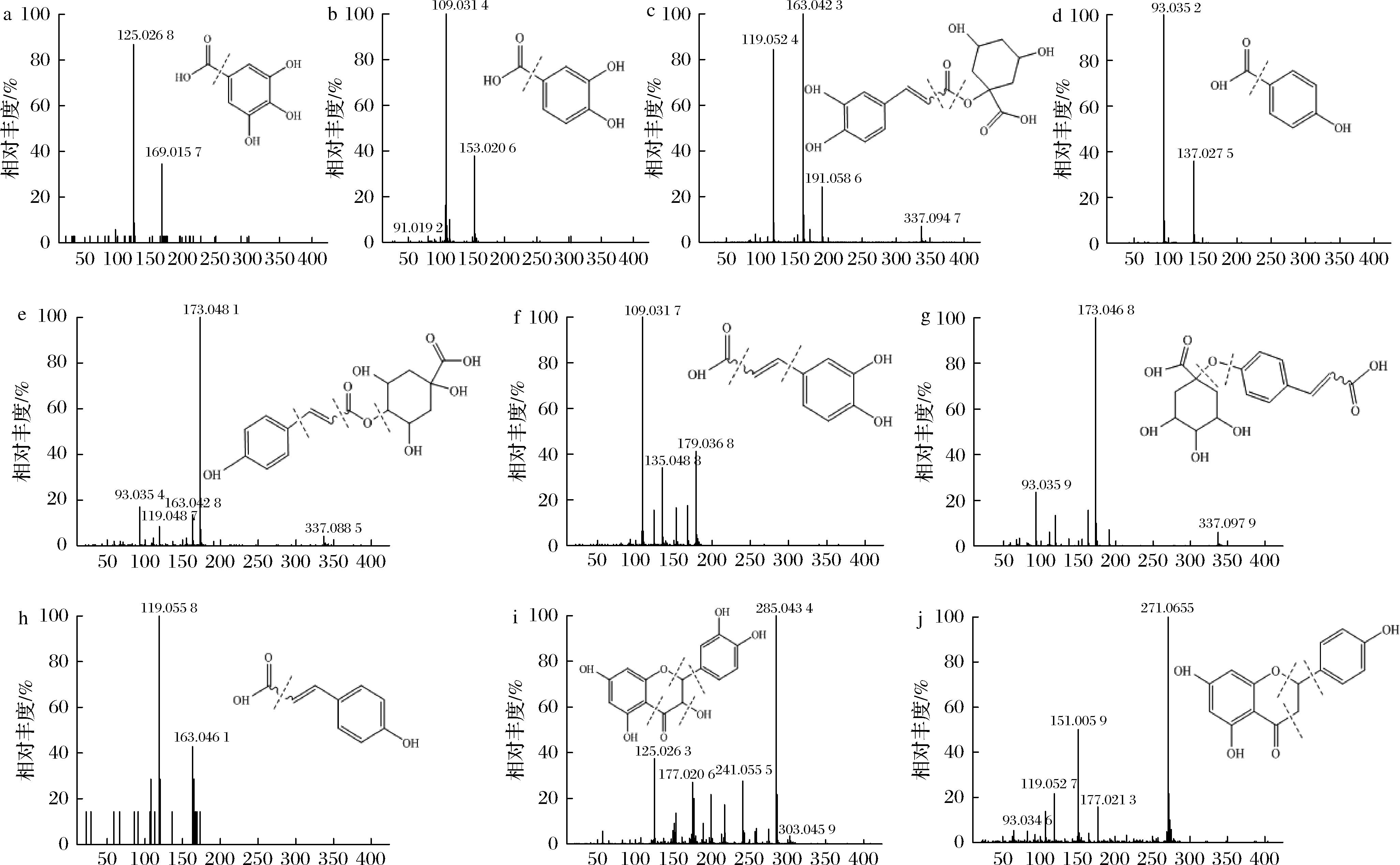
a-没食子酸;b-原儿茶酸;c-咖啡酰奎宁;d-4-羟基苯甲酸;e-4-香豆酰奎宁酸;f-咖啡酸;g-香豆酰奎宁酸;h-对香豆酸;i-花旗松素;j-柚皮素
图5 发酵松花粉中鉴定出的酚类物质的二级质谱图
Fig.5 MS/MS fragmentation patterns of phenolics identified in fermented pine pollen
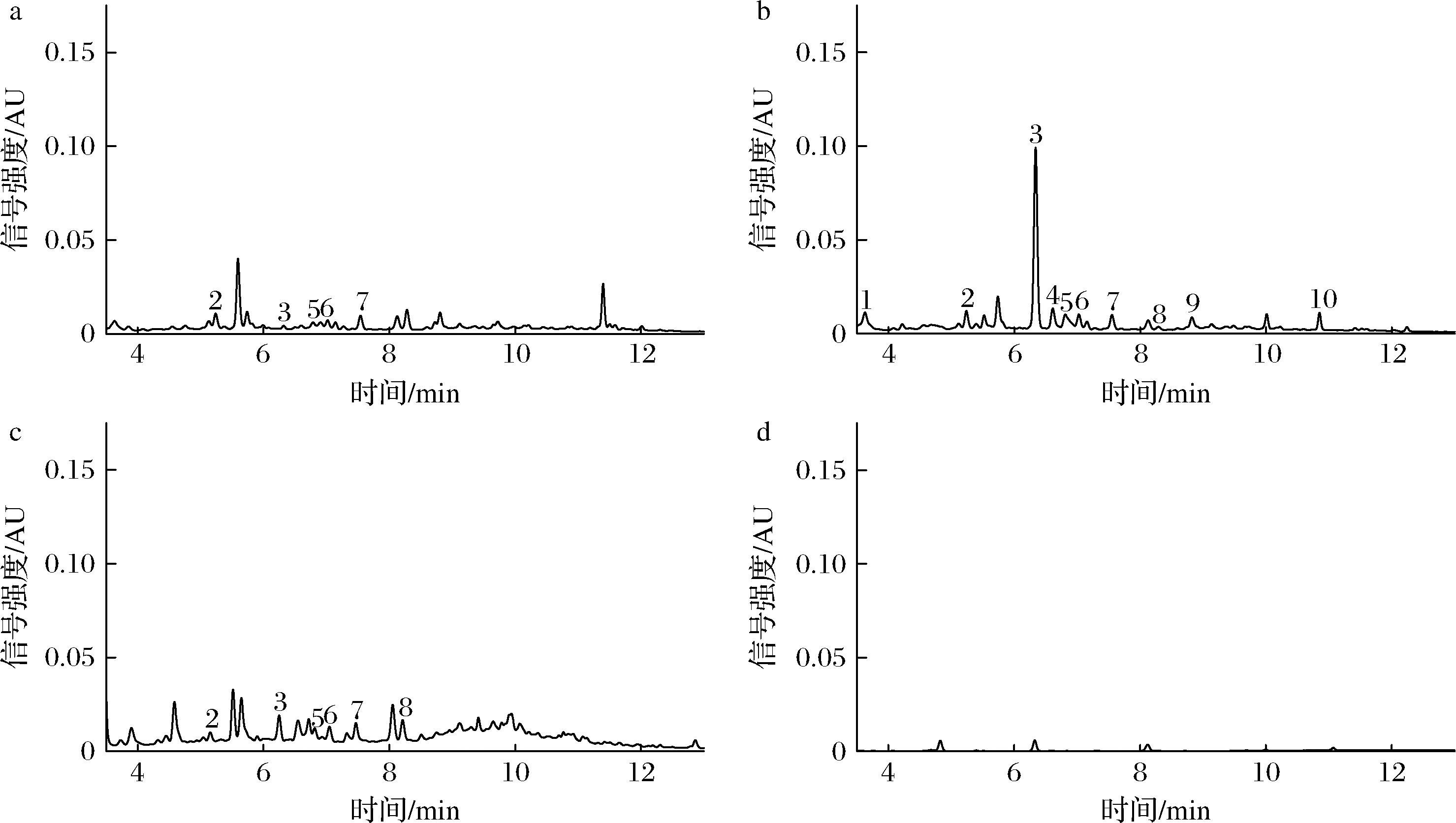
a-松花粉水提物;b-乳酸克鲁维酵母1572发酵松花粉第7天;c-未发酵松花粉第7天;d-乳酸克鲁维酵母1572未添加松花粉第7天
图6 酚类物质的高效液相色谱图
Fig.6 HPLC chromatograms of polyphenols
发酵前后各组松花粉样品中10种单体酚及总量的结果见电子版增强出版附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.037691),水提物组酚类化合物总量为76.55 μg/g,纯菌中未检出酚类成分,未发酵松花粉组中部分酚类化合物含量升高可能是杀菌过程中温度升高及长时间水浸提会使松花粉中酚类成分溶出,同时在后期由于受氧化反应等影响,酚类化合物含量不断降低[22, 24]。所有发酵组的酚类化合物总含量和单体酚含量均显著高于水提物组,其中乳酸克鲁维酵母1572发酵后酚类化合物总量最高,为1 002.55 μg/g,比发酵前提高了12倍。不同发酵组间各单体酚的含量均有所不同,表明不同菌株在发酵时对物质的消耗与释放有差异。在酿酒酵母1002和乳酸克鲁维酵母1572发酵体系中,原儿茶酸、咖啡酰奎宁酸、4-羟基苯甲酸的变化均共占比60%以上,主导了总酚含量的变化,而在酿酒酵母1905体系中,则是原儿茶酸、4-羟基苯甲酸、香豆酰奎宁酸占比最高,达50%以上。各单体酚及酚类化合物总量整体呈现先上升后下降的趋势。可能的原因是在发酵前期,酵母产生的糖苷酶、纤维素酶等可能将结合态酚转变为游离态酚[29],同时在酶的作用下有机酸、苯丙氨酸、葡萄糖等不断转化为酚类[26-27],使样品中各酚类组分的含量不断增加。在发酵后期,受非酶促反应以及氧化反应等的影响[22, 24],部分酚类成分含量开始降低,进而导致酚类化合物总量的降低。
表1 发酵松花粉中酚类物质的鉴定
Table 1 Identification of phenolic compounds from fermented pine pollen
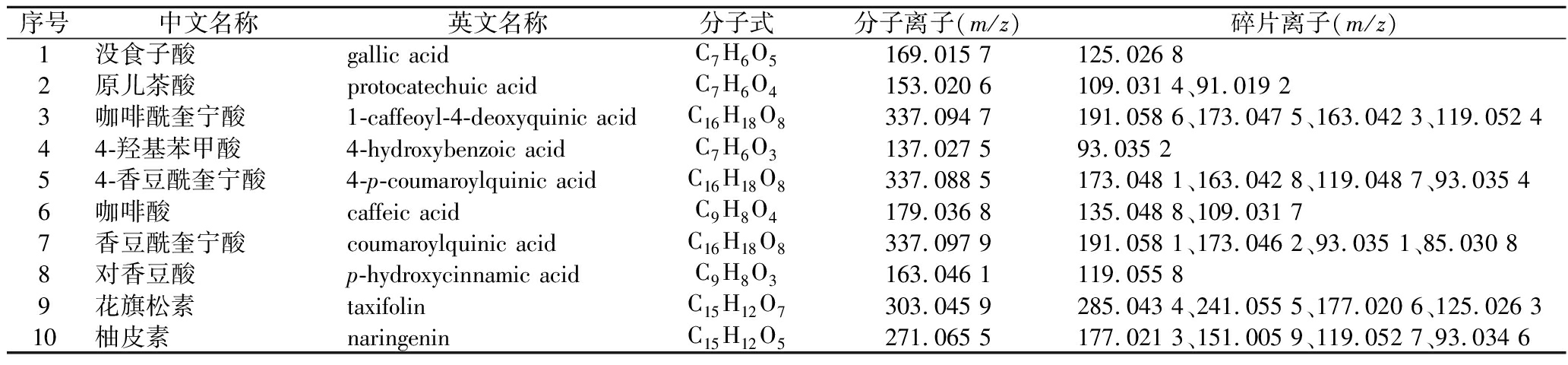
序号中文名称英文名称分子式分子离子(m/z)碎片离子(m/z)1没食子酸gallic acidC7H6O5169.015 7125.026 82原儿茶酸protocatechuic acidC7H6O4153.020 6109.031 4、91.019 23咖啡酰奎宁酸1-caffeoyl-4-deoxyquinic acidC16H18O8337.094 7191.058 6、173.047 5、163.042 3、119.052 444-羟基苯甲酸4-hydroxybenzoic acidC7H6O3137.027 593.035 254-香豆酰奎宁酸4-p-coumaroylquinic acidC16H18O8337.088 5173.048 1、163.042 8、119.048 7、93.035 46咖啡酸caffeic acidC9H8O4179.036 8135.048 8、109.031 77香豆酰奎宁酸coumaroylquinic acidC16H18O8337.097 9191.058 1、173.046 2、93.035 1、85.030 88对香豆酸p-hydroxycinnamic acidC9H8O3163.046 1119.055 89花旗松素taxifolinC15H12O7303.045 9285.043 4、241.055 5、177.020 6、125.026 310柚皮素naringeninC15H12O5271.065 5177.021 3、151.005 9、119.052 7、93.034 6
2.4 不同处理组松花粉抗氧化能力及活性成分的主成分分析
对发酵松花粉组、松花粉水提物组、未发酵松花粉组和纯酵母菌组的抗氧化能力、总酚、总黄酮、单体酚的含量进行了主成分分析,图7-a为4组样本点的得分图,图7-b为3种不同酵母菌发酵组的得分图。图7-a和图7-b中PC1和PC2分别解释了总方差的91.72%和65.90%。从图7-a中可知,在PC1方向上,纯酵母菌组样本点在得分图的最左边,说明该组样本的抗氧化能力及活性成分含量最低,松花粉水提物组和未发酵松花粉组的样本点在纯酵母组右边,表明这两者抗氧化能力及活性成分含量显著高于纯酵母菌组,3种酵母发酵的松花粉组的样本点在得分图的最右边,说明经过发酵后,松花粉发酵液的抗氧化能力及活性成分含量远高于未发酵松花粉。其中,未发酵松花粉组与松花粉水提物组的样本点距离较近,表明它们的抗氧化能力及活性成分含量差别不大。从图7-b中可知,在PC1方向上,乳酸克鲁维酵母1572发酵第7天的样本组在最右边,表明其抗氧化能力及活性成分含量最高。
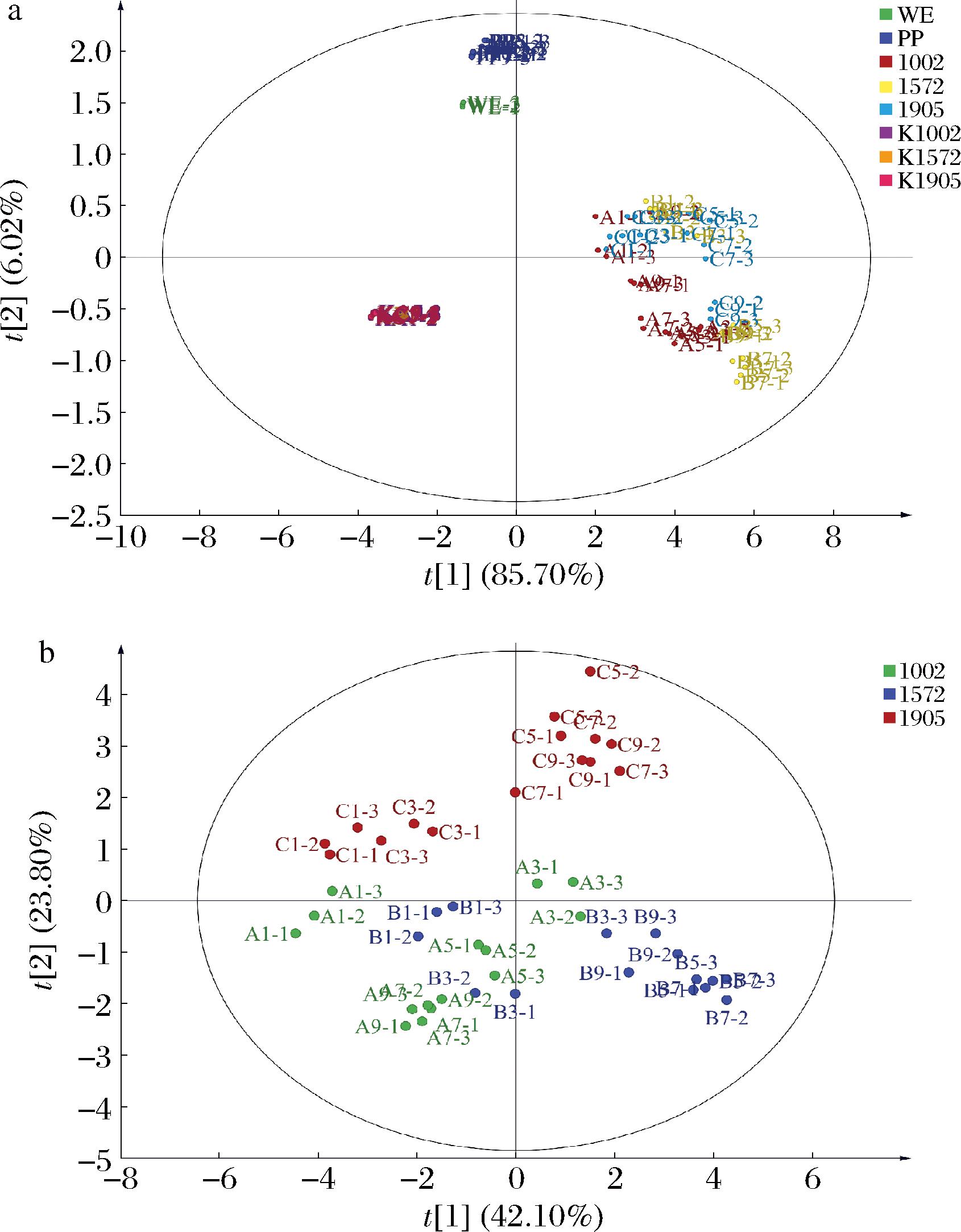
a-发酵松花粉组、水提物组、未发酵松花粉组和纯酵母菌组;b-3种酵母发酵松花粉组
图7 抗氧化能力、总酚、总黄酮和单体酚含量的PCA得分图
Fig.7 PCA score plot of antioxidant capacity, total phenols, total flavonoids, and contents of individual phenolics
2.5 发酵松花粉抗氧化能力与酚类成分的相关性分析
采用Spearman法对3种酵母菌发酵过程中抗氧化能力与酚类成分进行相关性分析,结果如表2所示。DPPH自由基清除能力与花旗松素(P<0.01)、原儿茶酸和4-香豆酰奎宁酸呈显著正相关(P<0.05)。ABTS阳离子自由基清除能力与总酚(P<0.001,r=0.853)和总黄酮(P<0.01)、咖啡酰奎宁酸(P<0.001,r=0.886)、花旗松素(P<0.05)和酚类化合物总量(P<0.01)呈显著正相关,而与对香豆酸呈现显著负相关(P<0.05,r=-0.579),表明发酵过程可能会导致对香豆酸向咖啡酰奎宁酸等转化[30],进而提升了发酵体系整体的自由基清除能力。铁离子还原能力与原儿茶酸(P<0.01)、4-香豆酰奎宁酸、柚皮素及酚类化合物总量显著正相关(P<0.05)。结果表明,松花粉发酵后抗氧化能力的提升可能来自于其中原有酚类以及新生成酚类物质含量的升高,而对香豆酸可能由松花粉或酵母中的相关物质经过生物转化生成,LI等[31]采用嗜热链球菌发酵红枣泥也发现其抗氧化能力与红景天苷、焦石酚等含量相关,即可通过生物转化生成多酚以提升原料的抗氧化能力。
表2 松花粉发酵过程中的活性成分与抗氧化能力的相关性分析
Table 2 Correlation analysis between active ingredients and antioxidant capacity during fermentation process of pine pollen
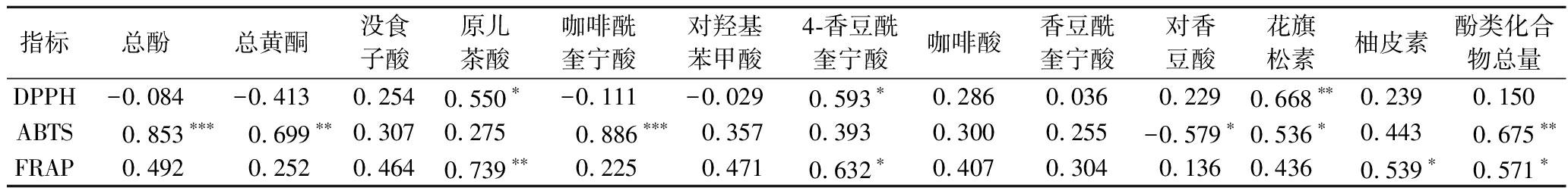
指标总酚总黄酮没食子酸原儿茶酸咖啡酰奎宁酸对羟基苯甲酸4-香豆酰奎宁酸咖啡酸香豆酰奎宁酸对香豆酸花旗松素柚皮素酚类化合物总量DPPH-0.084-0.4130.2540.550∗-0.111-0.0290.593∗0.2860.0360.2290.668∗∗0.2390.150ABTS0.853∗∗∗0.699∗∗0.3070.2750.886∗∗∗0.3570.3930.3000.255-0.579∗0.536∗0.4430.675∗∗FRAP0.4920.2520.4640.739∗∗0.2250.4710.632∗0.4070.3040.1360.4360.539∗0.571∗
注:*,P<0.05;**,P<0.01;***,P<0.001。
3 结论
利用3种酵母菌发酵破壁松花粉均能显著提高总酚含量、单体酚的种类及含量,进而提高DPPH自由基、ABTS阳离子自由基清除能力和铁离子还原能力。然而,不同菌株对发酵松花粉的影响差异较大,酿酒酵母1905发酵后的DPPH自由基清除能力较强,而乳酸克鲁维酵母1572发酵则对ABTS阳离子自由基清除能力和铁离子还原能力以及总酚含量提升较多。除了提升松花粉中一些已有的酚类物质外,酵母还能以相关物质为原料转化生成没食子酸、4-羟基苯甲酸、对香豆酸、花旗松素和柚皮素,其中乳酸克鲁维酵母1572发酵7 d后酚类化合物总量最高。综上所述,采用乳酸克鲁维酵母1572发酵松花粉可显著提升其抗氧化活性及主要成分,本研究为松花粉抗氧化功能产品的开发提供了理论和实验依据。
[1] 程勇. 前处理对松花粉营养活性成分及贮藏稳定性的影响[D].无锡:江南大学, 2021.CHENG Y.Effects of pretreatment on nutrients, bioactive components and storage stability of pine pollen[D].Wuxi:Jiangnan University, 2021.
[2] CAROCHO M, FERREIRA I C F R.A review on antioxidants, prooxidants and related controversy:Natural and synthetic compounds, screening and analysis methodologies and future perspectives[J].Food and Chemical Toxicology, 2013, 51:15-25.
[3] TRUONG V L, JEONG W S.Cellular defensive mechanisms of tea polyphenols:Structure-activity relationship[J].International Journal of Molecular Sciences, 2021, 22(17):9109.
[4] WANG Z Y, LI S Y, GE S H, et al.Review of distribution, extraction methods, and health benefits of bound phenolics in food plants[J].Journal of Agricultural and Food Chemistry, 2020, 68(11):3330-3343.
[5] XIAO J B, MUZASHVILI T S, GEORGIEV M I.Advances in the biotechnological glycosylation of valuable flavonoids[J].Biotechnology Advances, 2014, 32(6):1145-1156.
[6] RIBAS-AGUST A, MART
A, MART N-BELLOSO O, SOLIVA-FORTUNY R, et al.Food processing strategies to enhance phenolic compounds bioaccessibility and bioavailability in plant-based foods[J].Critical Reviews in Food Science and Nutrition, 2018, 58(15):2531-2548.
N-BELLOSO O, SOLIVA-FORTUNY R, et al.Food processing strategies to enhance phenolic compounds bioaccessibility and bioavailability in plant-based foods[J].Critical Reviews in Food Science and Nutrition, 2018, 58(15):2531-2548.
[7] MEHMOOD T, SALEEM F, JAVED S, et al.Biotransformation of agricultural by-products into biovanillin through solid-state fermentation (SSF) and optimization of different parameters using response surface methodology (RSM)[J].Fermentation, 2022, 8(5):206.
[8] MARTINS S, MUSSATTO S I, MART NEZ-AVILA G, et al.Bioactive phenolic compounds:Production and extraction by solid-state fermentation.A review[J].Biotechnology Advances, 2011, 29(3):365-373.
NEZ-AVILA G, et al.Bioactive phenolic compounds:Production and extraction by solid-state fermentation.A review[J].Biotechnology Advances, 2011, 29(3):365-373.
[9] DARWESH O M, EWEYS A S, ZHAO Y S, et al.Application of environmental-safe fermentation with Saccharomyces cerevisiae for increasing the cinnamon biological activities[J].Bioresources and Bioprocessing, 2023, 10(1):12.[10] OLIVEIRA D R, LOPES A C A, PEREIRA R A, et al.Selection of potentially probiotic Kluyveromyces lactis for the fermentation of cheese whey-based beverage[J].Annals of Microbiology, 2019, 69(13):1361-1372.
[11] WANG L, LUO Y, WU Y N, et al.Fermentation and complex enzyme hydrolysis for improving the total soluble phenolic contents, flavonoid aglycones contents and bio-activities of guava leaves tea[J].Food Chemistry, 2018, 264:189-198.
[12] CIAFARDINI G, ZULLO B A.Effect of lipolytic activity of Candida adriatica, Candida diddensiae and Yamadazyma terventina on the acidity of extra-virgin olive oil with a different polyphenol and water content[J].Food Microbiology, 2015, 47:12-20.
[13] YANG S Y, LI H L.Optimization of pine pollen fermentation conditions using Lactobacillus paracasei[J].Food Science and Biotechnology, 2015, 24(1):155-160.
[14] 杨善岩, 狄志鸿, 李海龙.一种利用益生菌进行松花粉发酵的新工艺:中国, CN103141732B[P].2014-08-06.YANG S Y, DI Z H, LI H L.A new process of pine pollen fermentation using probiotics:China, CN103141732B[P].2014-08-06.
[15] SARIKURKCU C, KIRKAN B, OZER M S, et al.Chemical characterization and biological activity of Onosma gigantea extracts[J].Industrial Crops and Products, 2018, 115:323-329.
[16] QUAN W, QIE X J, CHEN Y, et al.Effect of milk addition and processing on the antioxidant capacity and phenolic bioaccessibility of coffee by using an in vitro gastrointestinal digestion model[J].Food Chemistry, 2020, 308:125598.
[17] QIE X J, CHEN Y, QUAN W, et al.Analysis of β-lactoglobulin-epigallocatechin gallate interactions:The antioxidant capacity and effects of polyphenols under different heating conditions in polyphenolic-protein interactions[J].Food &Function, 2020, 11(5):3867-3878.
[18] CHENG Y, QUAN W, QU T, et al.Effects of 60Co-irradiation and superfine grinding wall disruption pretreatment on phenolic compounds in pine (Pinus yunnanensis) pollen and its antioxidant and α-glucosidase-inhibiting activities[J].Food Chemistry, 2021, 345:128808.
[19] FU M Q,XU Y J,CHEN Y L,et al. Evaluation of bioactive flavonoids and antioxidant activity in Pericarpium Citri Reticulatae (Citrus reticulata ‘Chachi’) during storage[J]. Food Chemistry,2017,230: 649-656.
[20] 陈江魁, 殷春燕, 张献忠, 等.混合酵母发酵对皇冠梨酒酚类、抗氧化性和风味物质的影响[J].食品科学, 2023, 44(20):343-349.CHEN J K, YIN C Y, ZHANG X Z, et al.Effect of yeast co-culture on phenols, antioxidant activity and flavor volatiles of crown pear wine[J].Food Science, 2023, 44(20):343-349.
[21] 吴静, 王珍珍, 王晓宇, 等.酿酒酵母发酵与自然发酵过程中霍山石斛酵素的代谢物及抗氧化变化[J].中国生物工程杂志, 2022, 42(11):73-87.WU J, WANG Z Z, WANG X Y, et al.Changes of metabolites and antioxidant activity of Dendrobium huoshanense jiaosu by spontaneous fermentation and Saccharomyces cerevisiae fermentation[J].China Biotechnology, 2022, 42(11):73-87.
[22] 周佳悦, 夏晓雨, 候艳丽, 等.不同发酵方式蓝莓果酒发酵过程中理化指标和抗氧化能力的动态变化[J].中国酿造, 2023, 42(5):132-138.ZHOU J Y, XIA X Y, HOU Y L, et al.Dynamic changes of physiochemical indexes and antioxidant capacity of blueberry wine during fermentation with different fermentation methods[J].China Brewing, 2023, 42(5):132-138.
[23] KATINA K, LAITILA A, JUVONEN R, et al.Bran fermentation as a means to enhance technological properties and bioactivity of rye[J].Food Microbiology, 2007, 24(2):175-186.
[24] ZHANG Y, CHANG S K C, STRINGER S J, et al.Characterization of titratable acids, phenolic compounds, and antioxidant activities of wines made from eight Mississippi-grown muscadine varieties during fermentation[J].LWT, 2017, 86:302-311.
[25] 江晶洁, 刘涛, 林双君.基于莽草酸途径微生物合成芳香族化合物及其衍生物的研究进展[J].生命科学, 2019, 31(5):430-448.JIANG J J, LIU T, LIN S J.Research progress on the biosynthesis of aromatic compounds by microorganisms[J].Chinese Bulletin of Life Sciences, 2019, 31(5):430-448.
[26] LYU X M, LEE J, CHEN W N.Potential natural food preservatives and their sustainable production in yeast:Terpenoids and polyphenols[J].Journal of Agricultural and Food Chemistry, 2019, 67(16):4397-4417.
[27] LI S J, TAO Y, LI D D, et al.Fermentation of blueberry juices using autochthonous lactic acid bacteria isolated from fruit environment:Fermentation characteristics and evolution of phenolic profiles[J].Chemosphere, 2021, 276:130090.
[28] 唐富豪, 滕建文, 韦保耀, 等.基于非靶向代谢组学评价传统发酵对客家酸芥菜酚类化合物组成的影响[J].食品与发酵工业, 2021, 47(8):128-133.TANG F H, TENG J W, WEI B Y, et al.Evaluation of the influence of traditional fermentation on the composition of phenolic compounds in Hakka pickled mustard greens based on non-targeted metabolomics[J].Food and Fermentation Industries, 2021, 47(8):128-133.
[29] PAZ-ARTEAGA S L, ASCACIO-VALDÉS J A, AGUILAR C N, et al.Bioprocessing of pineapple waste for sustainable production of bioactive compounds using solid-state fermentation[J].Innovative Food Science &Emerging Technologies, 2023, 85:103313.
[30] 包伊凡, 沈新春, 汪芳.咖啡酸及其主要衍生物的研究进展及开发前景[J].天然产物研究与开发, 2018, 30(10):1825-1833;1733.BAO Y F, SHEN X C, WANG F.The research progress and development prospects of biosynthesis, structure activity relationship and biological activity of caffeic acid and its main types of derivatives[J].Natural Product Research and Development, 2018, 30(10):1825-1833;1733.
[31] LI J, ZHAO W T, PAN X, et al.Improvement of antioxidant properties of jujube puree by biotransformation of polyphenols via Streptococcus thermophilus fermentation[J].Food Chemistry:X, 2022, 13:100214.