红曲菌(Monascus spp.)是一种重要的食用性丝状腐生真菌,可产生多种次级代谢产物,主要包括红曲色素(Monascus pigments,MPs)、莫纳可林K(monacolin K,MK)、γ-氨基丁酸(γ-aminobutyric acid)和具有肾毒性的桔霉素(citrinin)[1]。其中MPs主要有红、橙和黄3种颜色,可作为食品着色剂、添加剂,并具有抗菌、抗炎、抗氧化和抗癌等诸多功效[2]。MK可有效抑制胆固醇水平并调节血脂[3],还有望用于降血压、降血糖、抗炎症和抗癌等的治疗[4]。
目前,红曲菌发酵产MPs和MK的形式主要有固态和液态两种。然而,MPs和MK的产量仍有待提高,同时存在成本高[4]、发酵周期长、易受杂菌或桔霉素污染[5]和MPs稳定性低[6]等问题。因此,提升MPs和MK产量、缩短发酵周期、降低污染率成为该行业亟待解决的问题。其中,MPs和MK产量提升的途径主要包括通过诱变或基因工程进行菌株改良和筛选、发酵条件的优化、添加外源添加物、诱导剂及辅因子和非离子表面活性剂等[7-8]。
在固态发酵中常用一些农产品或其废弃物如马铃薯、豆粉、山药等[9]进行红曲菌发酵产MPs和MK,而在液态发酵中常通过添加一些外源添加物如黄酮类物质[10]、乙醇[11]、豆粉[1]等来促进MPs和MK的产生。其中,以大豆作为红曲菌发酵的原料或外源添加物的研究多有报道。相关研究表明,红曲菌液态发酵中大豆水解液是生产色价的最佳氮源[2];黄豆粉产MK的最适添加量为615.3 mg/L[12]。在供试的4种有机氮源(牛肉膏、蛋白胨、黄豆粉和酵母膏)和2种无机氮源(硫酸铵和硝酸钠)中,豆粕是红色红曲菌(Monascus ruber)固态发酵生产MK的最适氮源[3]。类似的现象在烟灰色红曲菌(Monascus fuliginosus MPs -7)和紫色红曲菌(Monascus purpureus)中也得到证实。烟灰色红曲菌的固态发酵中豆粕和豆渣添加量分别为15%时MK产量较高,豆渣保证了一定的MPs产量[13]。在以甘蔗渣为碳源的紫色红曲菌液态深层培养中,以大豆分离蛋白(soybean protein isolate, SPI)为氮源可促进红色MPs的产生[14]。
本课题组前期研究表明,豆粉可促进丛毛红曲菌MS-1液态发酵条件下MK的产生,培养11 d和21 d的最大MK产量分别为390.68和565.64 μg/mL[1]。后续的研究表明,豆粉中显著促进MK产生的成分主要是SPI[15]。然而,SPI促进MK产生的作用机制并不清楚。本研究以丛毛红曲菌(Monascus pilosus)MS-1、YDJ-1、YDJ-2,红色红曲菌(Monascus ruber)MJ-1为实验菌株,在大米固态培养基和液态马铃薯肉汤培养基(potato dextrose broth,PDB)、合成培养基中添加SPI,监测红曲菌的生长及产MPs和MK的情况,探究SPI对不同种属红曲菌产MPs和MK的影响。
1 材料与方法
1.1 材料与试剂
丛毛红曲菌MS-1(CCTCC M 2013295),中国典型培养物保藏中心;红色红曲菌MJ-1、丛毛红曲菌YDJ-1、丛毛红曲菌YDJ-2,市售红曲米分离获得。
大米及土豆为市售;大豆分离蛋白(生物制剂),河南华悦化工产品有限公司;MK标准品(纯度≥98%),阿拉丁公司;琼脂、分析级谷氨酸钠,北京奧博星生物技术有限责任公司;色谱级乙腈、磷酸及其余分析级试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
GI54DS高压蒸汽灭菌锅,致微仪器有限公司;UV1900紫外分光光度计,日本岛津公司;PF-16台式高速离心机,长沙平凡仪器仪表有限公司;HZQ-F16振荡培养箱,哈尔滨市东联电子技术开发有限公司;Blue pard生化培养箱,上海一恒科技有限公司;Agilent 1260高效液相色谱仪,安捷伦科技有限公司;PHS-3C pH计,上海精密科学仪器有限公司。
1.3 实验方法
1.3.1 培养基的配制
马铃薯葡萄糖(potato dextrose agar, PDA)培养基[15]:称取去皮土豆200 g切成1 cm×1 cm×1 cm加蒸馏水煮沸约20 min。纱布过滤,蒸馏水定容至1 000 mL。加入20 g葡萄糖和20 g琼脂粉溶解。pH自然,121 ℃灭菌20 min。
种子液培养基(g/L)[15]:葡萄糖80、蛋白胨10、无水CaCl2 0.1、NH4H2PO4 2、MgSO4·7H2O 0.5,土豆汁定容。pH值为5.5,121 ℃灭菌 20 min。
固态大米培养基[15]:大米(细度20目)55 g于250 mL三角瓶中,分别调整培养基含水量35%(v/w)、冰醋酸含量0.6%(v/w)及MgSO4·7H2O浓度为0.004 mol/kg,混匀,121 ℃灭菌20 min后趁热打散。
PDB培养基:不添加琼脂的PDA培养基。
合成培养基[16](g/L):谷氨酸钠10、MgSO4·7H2O 0.17、K2HPO4 1、KCl 0.5、FeSO4 0.05、蔗糖60。pH值为5.5,121 ℃灭菌20 min。
1.3.2 种子液的制备
将活化后的红曲菌接入PDA培养基中置于30 ℃生化培养箱中培养10 d。在红曲菌PDA斜面上加入无菌水,将红曲菌孢子刮入装有玻璃珠的锥形瓶打散过滤得孢子悬液并调整为106 CFU/mL。将孢子悬液以10%(体积分数)的接种量接种于1.3.1节的种子液培养基中,在30 ℃、120 r/min培养48 h[17]。
1.3.3 红曲菌固态和液态发酵
为考察SPI对红曲菌固态发酵产MPs及MK的影响,以大米培养基为对照,在大米培养基中添加1% SPI,将丛毛红曲菌MS-1、YDJ-1、YDJ-2和红色红曲菌MJ-1种子液分别以13%(v/w)接入发酵培养基中,在30 ℃培养2 d后转入25 ℃继续培养至14 d[15]。分析红曲发酵产物中MPs及MK的含量。
为考察SPI对红曲菌液态发酵产MPs及MK的影响,将丛毛红曲菌MS-1、YDJ-1、YDJ-2和红色红曲菌MJ-1孢子悬液以10%(体积分数)分别接入PDB合成培养基中,在30 ℃、120 r/min培养48 h后转入25 ℃继续培养至14 d[15]。分析4株红曲菌发酵产物中MPs及MK的含量。
1.3.4 红曲菌固态发酵产物中MPs和MK及其同系物种类的检测
红曲菌发酵产物中MPs及MK的测定参考文献[17]的方法。将红曲发酵产物置于55 ℃烘箱烘干12 h后粉碎,称取0.3 g红曲发酵产物(过80目筛)于50 mL离心管,加入10 mL 75%(体积分数,下同)乙醇溶液,充分振荡混匀并超声提取1 h后于8 000 r/min离心10 min。取上清液并用75%乙醇溶液稀释至合适浓度于390 nm(黄色素)、460 nm(橙色素)、505 nm(红色素)波长下测定吸光度值(OD值)并计算色价。色价的计算如公式(1):
(1)
上清液过0.22 μm滤膜后采用HPLC测定红曲发酵产物中MK的含量,根据MK的最大吸收波长和特征吸收峰分析其同系物种类,根据黄色、橙色和红色色素的最大吸收波长和特征吸收峰分析MPs同系物种类。色谱柱为Inertsil ODS-3(4.6 mm×250 mm,5 μm),流动相为V(乙腈)∶V(水)∶V(体积分数0.5%磷酸)=60∶37∶3,流速为1 mL/min,柱温25 ℃,进样量为20 μL,检测波长238 nm。红曲发酵产物中MK含量计算如公式(2)所示:
(2)
1.3.5 红曲菌发酵液pH和生物量的检测
红曲菌液态发酵结束后过滤得滤液,测定发酵液体积,用pH计检测发酵液pH。过滤后的菌丝用无菌水冲洗至水洗液为无色后置于55 ℃烘箱中烘至恒重,生物量用单位体积培养基菌丝干重表示[15]。
1.3.6 红曲菌液态发酵产物中MPs和MK及其同系物种类的检测
红曲菌发酵结束后过滤菌丝,发酵液以8 000 r/min离心10 min,取上清液测定吸光度值并计算色价。上清液过0.22 μm滤膜,采用HPLC分析MK(色谱条件同1.3.4节)。菌丝置55 ℃烘箱中烘至恒重,称取0.3 g菌丝于50 mL离心管,加入10 mL体积分数为75%的乙醇溶液,充分振荡混匀并超声波提取1 h后8 000 r/min离心10 min。上清液于390、460、505 nm波长下测定吸光度并计算色价[15],相关计算如公式(3)~公式(6)所示:
胞外色素/(U/L)=OD值×稀释倍数
(3)
胞内色素![]()
(4)
总色素/(U/L)=
(5)
上清液过0.22 μm滤膜后进行HPLC分析MPs同系物种类、MK含量及其同系物种类(色谱条件同1.3.4节),MK计算如公式(6)~公式(8)所示:
发酵液![]()
(6)
菌丝体![]()
(7)
总![]()
(8)
2 结果与分析
2.1 SPI固态发酵条件下对红曲菌产MPs的影响
如图1所示,与对照相比,在固态培养基中添加1% SPI能显著增加MJ-1红色MPs含量,增加了4.59倍(P<0.05),显著抑制MS-1产红、橙、黄3类MPs(P<0.05)。研究表明,烟灰色红曲霉MPs-7在大米固态培养基中添加豆粕和豆渣抑制MPs的产生,与本研究相符[13]。红曲菌发酵前期产生大量己酸和辛酸等中链脂肪酸供发酵后期合成MPs,而添加1% SPI后可能过高的氮源会阻碍脂肪酸生成或降低了培养基中的C/N比,从而减少MPs的生成[13]。对不同红曲菌添加SPI后效果明显不同,可能与菌种特性关系密切。丛毛红曲菌MS-1可产MPs和MK而不产桔霉素[16, 18],MPs和MK合成途径中共享合成二酮化合物的途径之后再进行分支[13],因此代谢流偏向MK合成时便会导致MPs的合成减少。而MJ-1主要代谢产物为MPs未检测到MK,添加SPI后代谢流会向MPs的方向进而导致MPs含量增加。
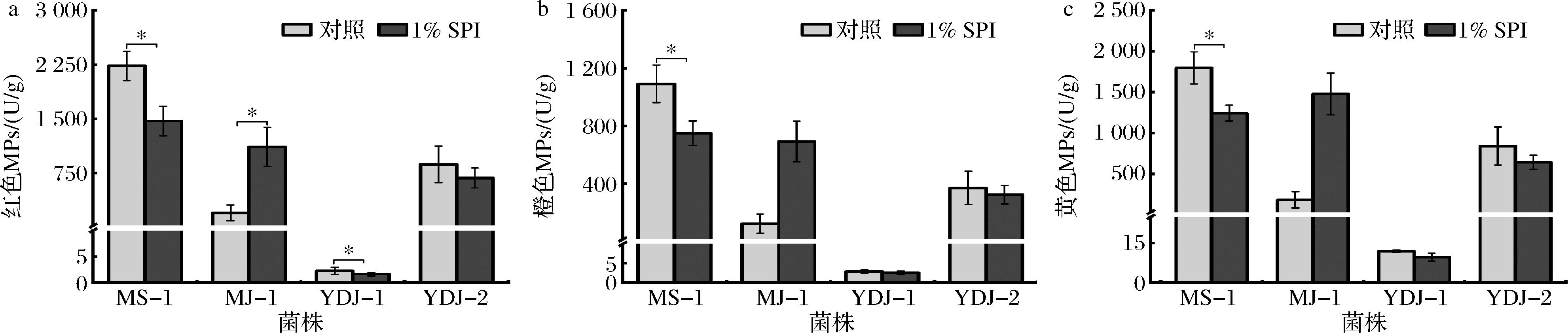
a-红色MPs;b-橙色MPs;c-黄色MPs
图1 SPI对红曲菌固态发酵产MPs的影响
Fig.1 Effects of SPI on MPs production by Monascus spp.in solid-state fermentation
注:**P<0.01,*P<0.05(下同)。
如表1所示,在固态培养基中添加1% SPI可促进MS-1、YDJ-2、MJ-1 3株红曲菌产红色MPs同系物种类和MS-1和MJ-1产黄色MPs同系物种类,而减少3株丛毛红曲菌产橙色MPs同系物种类。综上,1% SPI能促进红曲菌产红色MPs和黄色MPs同系物种类增加,减少丛毛红曲菌橙色MPs同系物种类。
表1 红曲菌固态发酵MPs同系物类型
Table 1 Types of MPs homologs in solid-state fermentation
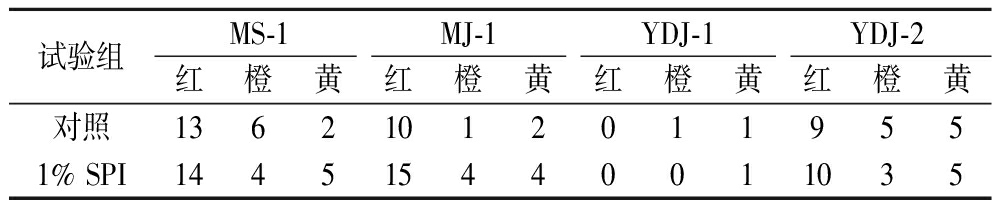
试验组MS-1MJ-1YDJ-1YDJ-2红橙黄红橙黄红橙黄红橙黄对照136210120119551% SPI144515440011035
注:红:红色MPs;橙:橙色MPs;黄:黄色MPs(下同)。
2.2 SPI对红曲菌固态发酵条件下产MK的影响
如图2所示,与对照相比,在固态培养基中添加1% SPI可显著促进丛毛红曲菌MS-1、YDJ-1和YDJ-2产MK(P<0.05),MK产量分别增加0.84、0.80和0.34倍,与已有的研究相符[15]。MJ-1的发酵产物中未检测到MK。在氮源存在的情况下,真菌可通过谷氨酰胺合成酶先将谷氨酸盐代谢合成谷氨酰胺再进行氮代谢[19]。谷氨酸钠相对SPI优先被红曲菌快速利用,促进菌丝生长。而SPI是经低温脱脂豆粕处理后得到的混合蛋白质,富含蛋白质和氮,其复杂的营养成分更利于红曲菌次级代谢产物的长期生物合成[3]。
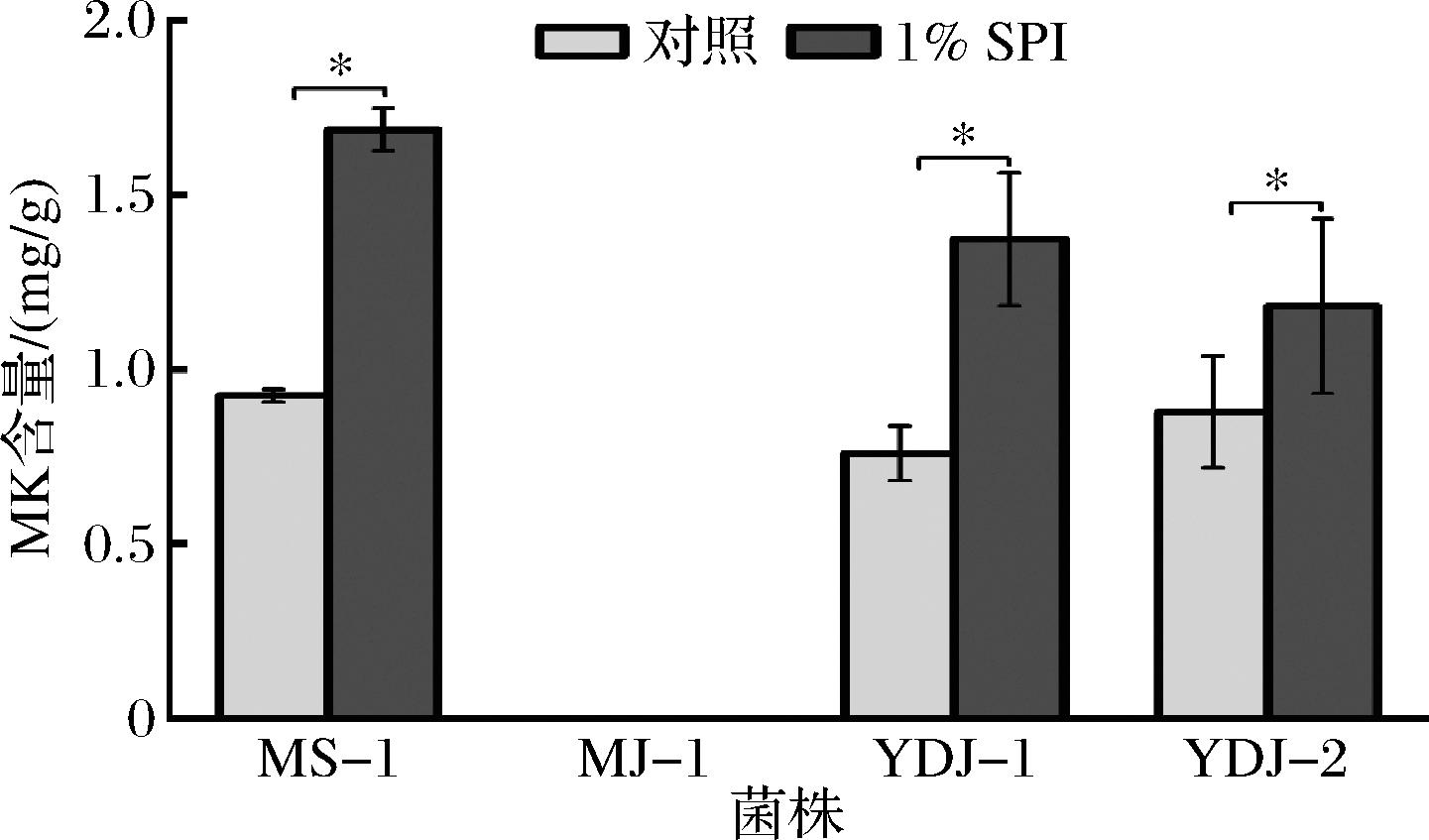
图2 SPI对红曲菌固态发酵产MK的影响
Fig.2 Effects of SPI on MK production by Monascus spp. in solid-state fermentation
另外,培养基中碳源和氮源是影响发酵的主要因素,这些营养素与生物量和代谢产物的形成以及辅因子的生成关系密切,添加1% SPI后培养基的C/N发生变化也可能是MK含量提高的原因之一[13]。结合前期研究,在固态培养基中添加1% SPI促进MK产生的同时会减少MPs的含量。由于MPs和MK的生物合成过程中都通过丙二酰CoA和乙酰CoA缩合得到二酮化合物再进行分支[13],推测SPI通过调控其下游途径并推进此途径下游分支向合成MK,减少MPs合成代谢流。
如表2所示,添加1% SPI可促进红曲菌MK同系物种类的增加,MJ-1的发酵产物中未检测到MK。综上,1% SPI可促进3株丛毛红曲菌产MK并可增加MK同系物种类。
表2 红曲菌固态发酵MK同系物种类
Table 2 Types of MK homologs in solid-state fermentation
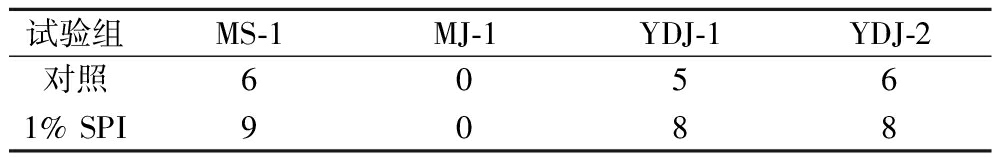
试验组MS-1MJ-1YDJ-1YDJ-2对照60561% SPI9088
2.3 SPI对红曲菌发酵液pH和生物量的影响
如图3-a所示,红曲菌发酵结束后发酵液pH值维持在8.0~9.0。发酵液pH值升高与红曲菌的代谢活动,特别是各种胞外蛋白的产生有关[20]。发酵过程中蛋白质水解产生碱性氨基酸,MPs积累及菌丝体自溶均会导致pH值上升。如图3-b所示,添加1% SPI后4株红曲菌生物量均明显增加,其中MJ-1和YDJ-1合成培养基中增加效果最为显著(P<0.05),说明添加1% SPI能促进红曲菌菌丝体的生长发育,SPI可作为红曲菌合成蛋白质、核酸和其他含氮化合物的原料[21]。
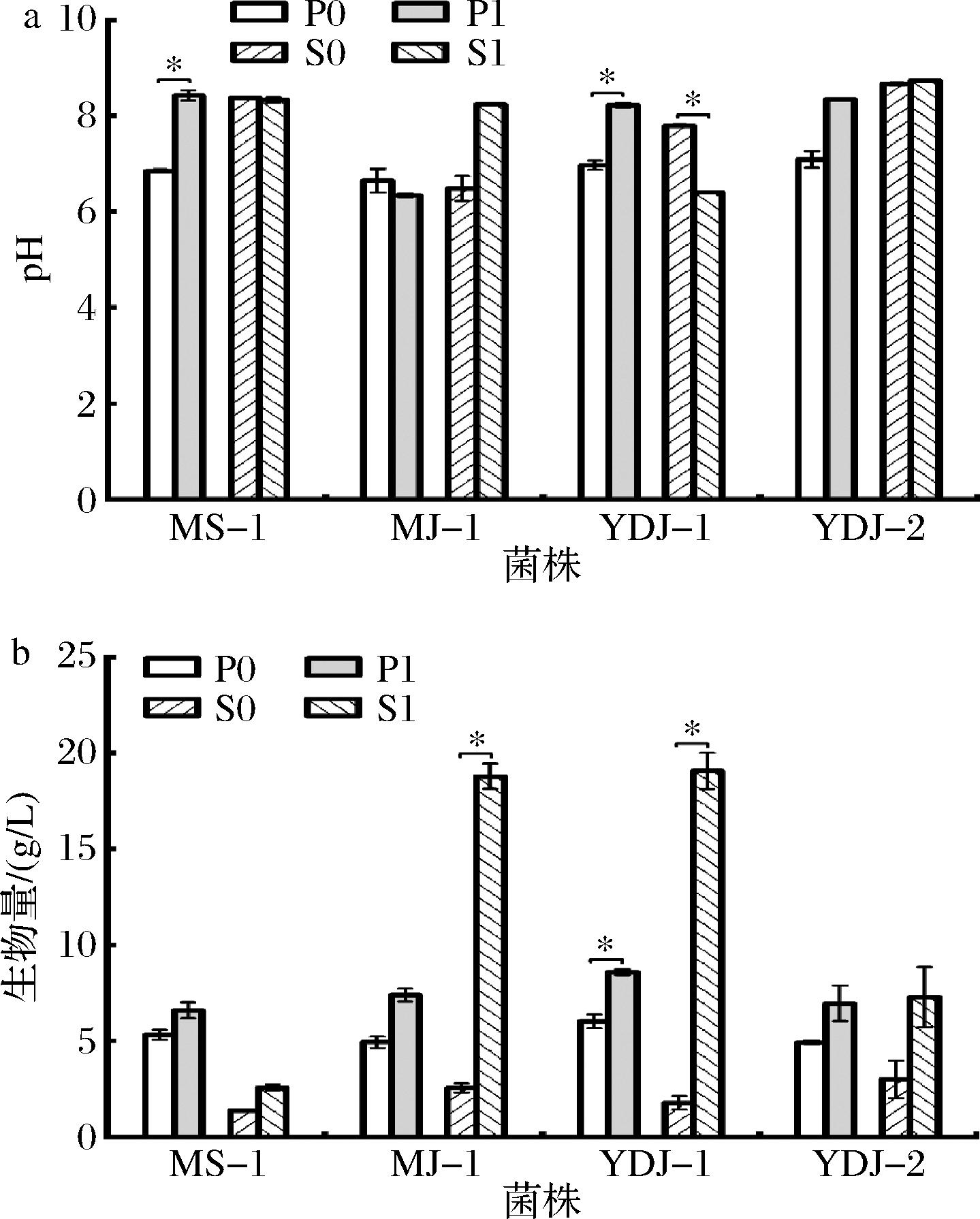
a-发酵液pH;b-生物量
图3 SPI对发酵液pH和生物量的影响
Fig.3 Effect of SPI on the pH of fermentation broth and biomass
注:P:PDB培养基;S:合成培养基;0:对照组;1:1% SPI(下同)。
2.4 SPI对红曲菌液态发酵产MPs的影响
如图4-a~图4-c所示,在PDB培养基中添加1% SPI显著促进MJ-1、YDJ-1和YDJ-2产MPs(P<0.05),增加了0.23~3.87倍。在合成培养基中添加1% SPI能显著促进MJ-1和YDJ-1产MPs,MPs分别增加了1.14~7.36倍,但对MS-1产MPs有显著抑制作用(P<0.05)。SPI对MJ-1产MPs的促进效果最明显(P<0.05),PDB和合成培养基中MJ-1的MPs产量可增加0.67~7.36倍。SPI主要促进4株红曲菌产生黄色MPs,而红色MPs和橙色MPs的含量差别不大,表明SPI可参与调控红曲菌中MPs的组成。
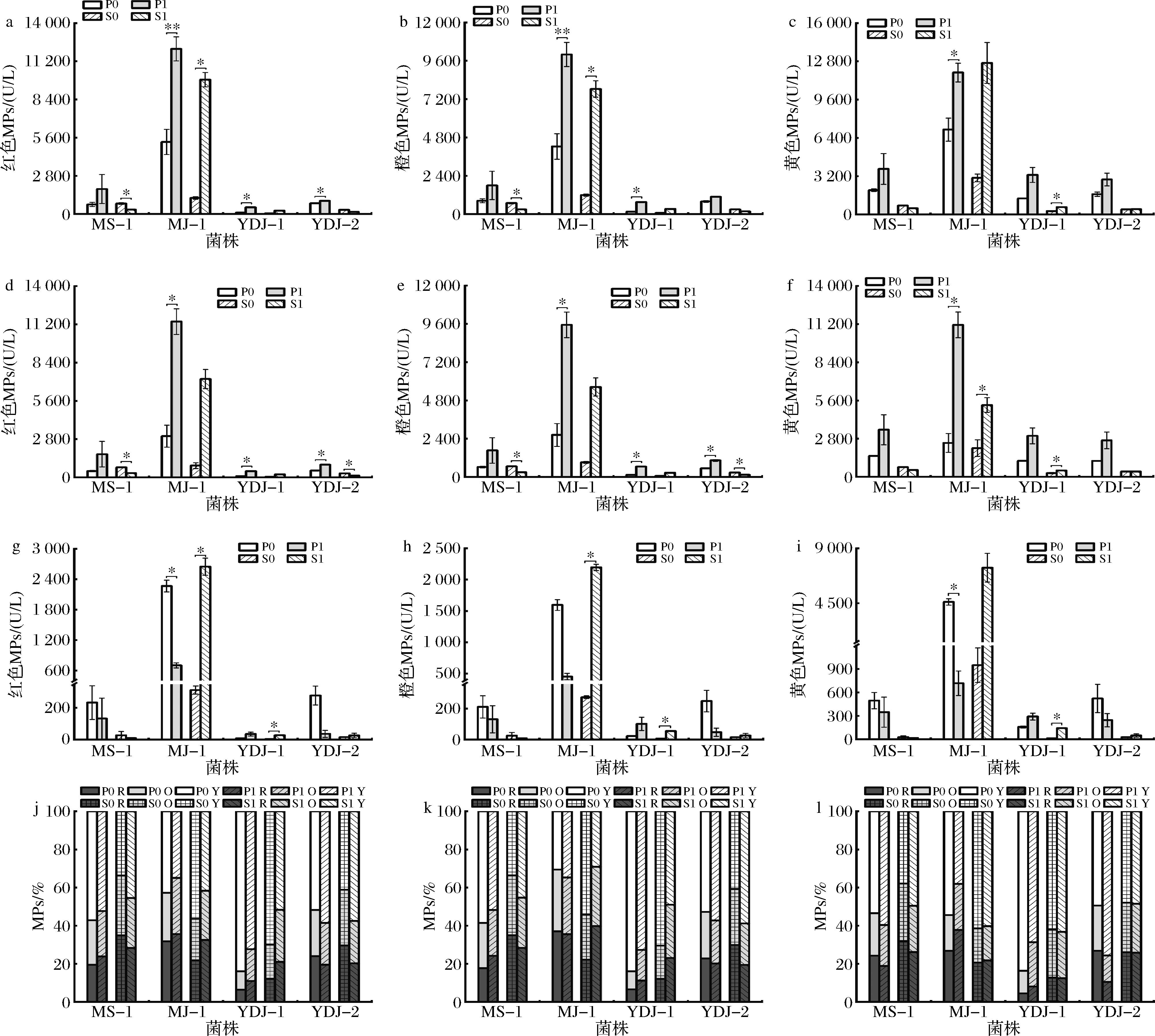
a、b、c-总色素;d、e、f-胞外色素;g、h、i-胞内色素;j、k、l-色素占比
图4 SPI对红曲菌液态发酵产MPs的影响
Fig.4 Effect of SPI on MPs production by Monascus spp.in liquid-state fermentation
注:R-红色素,Y-橙色素,O-黄色素。
在合成培养基中,SPI对MS-1和YDJ-2产MPs表现出抑制作用(图4-a~图4-c)。推测是添加1% SPI造成含氮量过高产生底物抑制现象,限制己酸和辛酸的生成而减少MPs的合成[13],而MJ-1和YDJ-1的生物量增加促使培养基中氮消耗速率快因而底物抑制作用减小促使MPs合成增加。另外,合成培养基中SPI对MS-1产MPs的显著抑制(P<0.05)与固态发酵现象一致(图1),表明在特定的培养条件下SPI可选择性促进红曲菌产MK。
由图4-d~图4-i可知,添加SPI后红曲菌胞外红、橙、黄3种MPs含量均高于胞内。由图4-j~图4-l色素所占比例所示,添加SPI后3种MPs所占比例发生变化,但总体上黄色MPs占比最大。以上结果表明SPI影响MPs的组成和胞内外占比,主要影响胞外MPs的组成和占比。SPI是有机氮源,在高pH条件下主要积累胞外MPs,这与已有的研究结果一致[22]。添加SPI后在高pH条件下黄色MPs成为胞外和胞内的主要MPs,胞内黄色MPs含量高可能是发酵液高pH和胞内氨浓度低综合作用的结果[3],橙色MPs向红色MPs的转化被阻断而更多被还原为黄色MPs,而胞内产生的黄色MPs不断分泌到胞外,促使胞外黄色MPs的含量增加[22]。红色MPs和黄色MPs的生成表现出负相关关系可能是因为这两种MPs都由橙色MPs转化而来,橙色MPs更多转化为红色MPs便减少向黄色MPs的转化[22]。
由表3和表4液态发酵胞内外MPs种类变化可知胞内MPs种类比胞外多。添加1% SPI后4株菌株胞外MPs总体表现出红色MPs和黄色MPs种类减少,而胞内红色MPs和黄色MPs种类减少但橙色MPs种类增加。综上,SPI可引起4株菌株胞内外红色MPs和黄色MPs种类减少,且主要引起胞内MPs种类的变化。
表3 红曲菌液态发酵胞外MPs同系物种类
Table 3 Types of extracellular MPs homologs in liquid-state fermentation

培养基组别MS-1MJ-1YDJ-1YDJ-2红橙黄红橙黄红橙黄红橙黄PDB对照1145002020041% SPI112403011012合成对照6011120021001% SPI021202000000
表4 红曲菌液态发酵胞内MPs同系物种类
Table 4 Types of intracellular MPs homologs in liquid-state fermentation
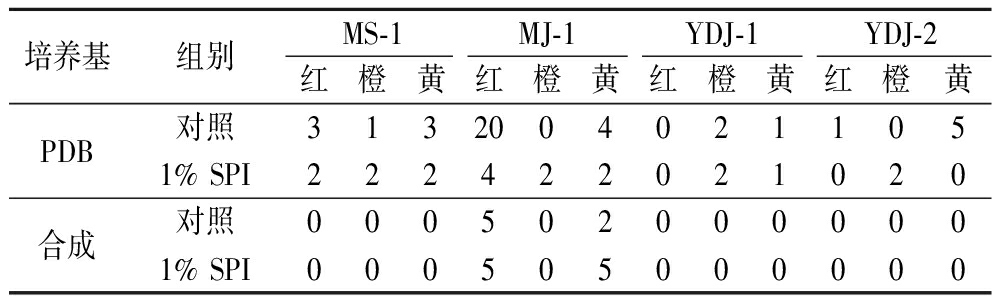
培养基组别MS-1MJ-1YDJ-1YDJ-2红橙黄红橙黄红橙黄红橙黄PDB对照31320040211051% SPI222422021020合成对照0005020000001% SPI000505000000
2.5 大豆分离蛋白对红曲菌液态发酵产MK的影响
如图5-a所示,添加SPI可显著促进丛毛红曲菌产MK(P<0.05)。在PDB培养基中,SPI能促进YDJ-2产MK,含量增加了0.88倍(P<0.05)。在合成培养基中,SPI可显著促进MS-1和YDJ-1产MK,产量分别增加0.95倍和1.15倍(P<0.05)。在4株红曲菌中,YDJ-1在合成培养基实验组MK产量最高(103.43 mg/L),而MJ-1的发酵产物中未检测到MK。
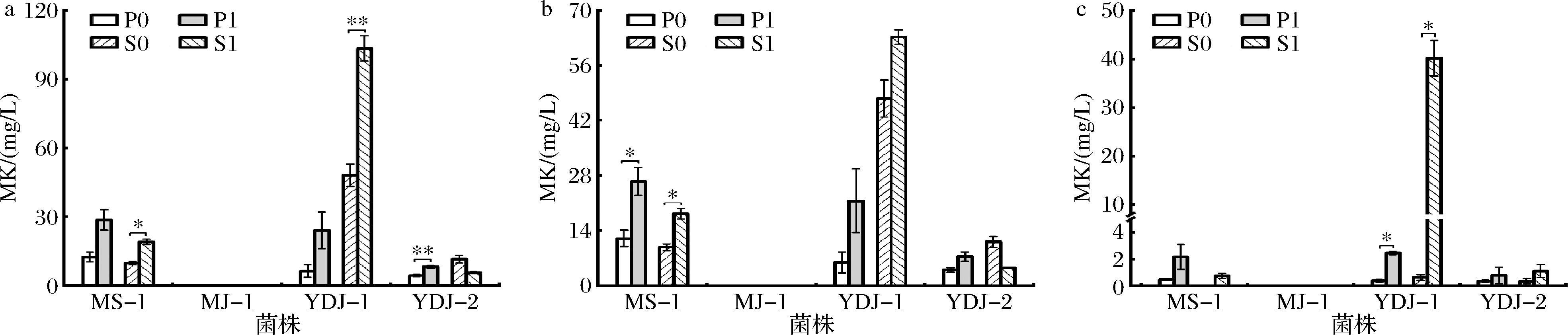
a-总MK含量;b-胞外MK含量;c-胞内MK含量
图5 SPI对红曲菌液态发酵产MK的影响
Fig.5 Effect of SPI on MK production by Monascus spp.in liquid-state fermentation
SPI促进红曲菌产MK可能的原因主要包括:为红曲菌的生长提供充足的营养,SPI水解产生的氨基酸可作为MK合成的前体物,并上调了MK生物合成相关基因的表达。ZHANG等[4, 23]研究表明,谷氨酸能提供代谢能量促进红曲菌菌丝体生长,上调MK合成相关基因的表达,促进MK前体物——乙酰辅酶A的合成,从而促进MK产量的提升。另外,精氨酸也有同样的效果[24]。
由图5-b~图5-c可知,红曲菌产生的胞外MK含量比胞内高,表明SPI能调控红曲菌产MK并促进胞内MK向胞外分泌。ZHANG等[23-24]研究表明,谷氨酸和精氨酸能增加红曲菌细胞膜通透性,促进胞内MK向胞外分泌。由此推测,SPI能促进胞内MK向胞外分泌可能是其分解产生的一些氨基酸在发挥作用。相比于对照,添加SPI后天冬氨酸、谷氨酸、丝氨酸、精氨酸、甘氨酸、苏氨酸、脯氨酸、丙氨酸、缬氨酸、蛋氨酸、半胱氨酸、亮氨酸、苯丙氨酸、组氨酸、赖氨酸和酪氨酸的含量显著增加(P<0.05),在发酵过程中谷氨酸、酪氨酸的利用率最大,另外利用较多的还有丝氨酸、亮氨酸、丙氨酸、脯氨酸、天冬氨酸、缬氨酸、组氨酸、赖氨酸和精氨酸等(数据未显示)。
合成培养基中,SPI促进MS-1产生MK的同时抑制MPs的产生。研究表明,豆粕和豆渣能调控次级代谢流向合成MK的方向从而减少MPs的合成[13],与本研究结果相符,这可能与C/N比发生改变有关,SPI可能调控MK和MPs合成途径的下游分支。另外,研究表明,碳氮源种类会影响MPs和MK的产生,并且MPs和MK的合成存在竞争性,营养物质较低时MPs先合成,而高营养物质条件下MK合成抑制性降低导致其合成速度比MPs的合成速度大[25]。由此推测,添加1% SPI后合成培养基中的氮源种类和碳氮源浓度发生改变,代谢途径走向发生改变,从而导致MS-1中MK产量增加的同时减少MPs的产量。
由表5可知,添加1% SPI后3株丛毛红曲菌胞外的MK同系物种类比胞内多,因此1% SPI可促使MK种类增加且主要促进胞外MK同系物种类。
表5 红曲菌液态发酵MK同系物种类
Table 5 Types of MK homologs in liquid state fermentation
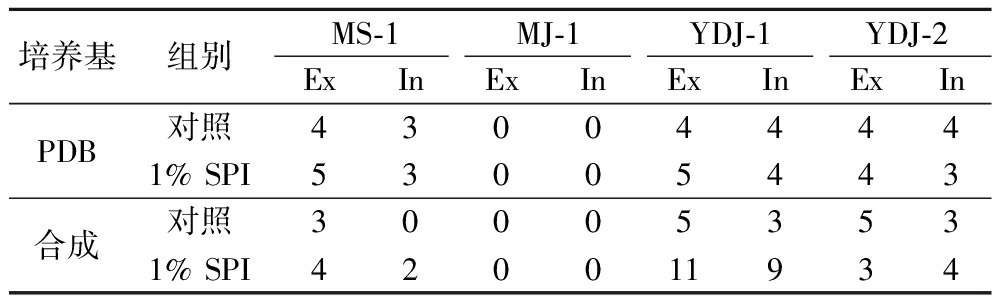
培养基组别MS-1MJ-1YDJ-1YDJ-2ExInExInExInExInPDB对照430044441% SPI53005443合成对照300053531% SPI420011934
注:Ex-胞外;In-胞内。
3 结论
本文通过固态和液态发酵研究了添加1% SPI对3株丛毛红曲菌和1株红色红曲菌生长及产次级代谢物MPs和MK的影响。结果表明,SPI对MJ-1和YDJ-1生物量有显著促进作用(P<0.05)。SPI参与MPs及MK生物合成的调控,影响两者产量。SPI参与MPs组成的调控,主要促进黄色MPs的积累,可引起胞外MPs种类的变化,并主要引起红色MPs和黄色MPs种类的变化。另外,添加SPI可显著促进丛毛红曲菌产MK(P<0.05),促进胞内MK向胞外分泌并影响MK的同系物种类,主要引起胞外MK同系物种类的增加。另外,在固态或合成培养基中添加SPI能调控丛毛红曲菌代谢途径的流向,使得代谢流偏向MK或MPs的方向进行。本研究探讨了SPI用于红曲菌发酵同时产生MK及MPs的可行性,其更深层次的机制研究有望在特定的培养基中调控代谢途径偏向MK或MPs的方向进行,可为红曲菌选择性产生MK及MPs提供理论支持。
[1] FENG Y L, SHAO Y C, ZHOU Y X, et al.Monacolin K production by citrinin-free Monascus pilosusMS-1 and fermentation process monitoring[J].Engineering in Life Sciences, 2014, 14(5):538-545.
[2] 黄艳. 红曲菌液态发酵生产红、橙、黄色素的研究[D].无锡:江南大学, 2014.HUANG Y.The Study on the production of monascus red/orange/yellow pigments in submerged fermentation[D].Wuxi:Jiangnan University, 2014.
[3] ZHANG B B, XING H B, JIANG B J, et al.Using millet as substrate for efficient production of monacolin K by solid-state fermentation of Monascus ruber[J].Journal of Bioscience and Bioengineering, 2018, 125(3):333-338.
[4] ZHANG C, ZHANG N, CHEN M X, et al.Metabolomics analysis of the effect of glutamic acid on monacolin K synthesis in Monascus purpureus[J].Frontiers in Microbiology, 2020, 11:610471.
[5] PATROVSKY M, SINOVSKA K, BRANSKA B, et al.Effect of initial pH, different nitrogen sources, and cultivation time on the production of yellow or orange Monascus purpureus pigments and the mycotoxin citrinin[J].Food Science &Nutrition, 2019, 7(11):3494-3500.
[6] ABDOLLAHI F, JAHADI M, GHAVAMI M.Thermal stability of natural pigments produced by Monascus purpureus in submerged fermentation[J].Food Science &Nutrition, 2021, 9(9):4855-4862.
[7] ZHANG Y R, CHEN Z T, WEN Q Y, et al.An overview on the biosynthesis and metabolic regulation of monacolin K/lovastatin[J].Food &Function, 2020, 11(7):5738-5748.
[8] HE J T, JIA M X, LI W, et al.Toward improvements for enhancement the productivity and color value of Monascus pigments:A critical review with recent updates[J].Critical Reviews in Food Science and Nutrition, 2022, 62(26):7139-7153.
[9] WIDAYANTI V T, ESTIASIH T, ZUBAIDAH E, et al.The role of carbon and nitrogen sources in the production of bioactive compounds in Monascus fermentation products:A mini review[J].IOP Conference Series:Earth and Environmental Science, 2021, 924(1):012083.[10] 欧阳万宝. 黄酮类化合物对紫色红曲菌5046发酵产物的影响及其发酵工厂设计[D].南昌:南昌大学, 2022.OUYANG W B.Study on the effect of flavonoids on the fermented products of Monascus Purpureus 5046 and the design of monascus fenmentation factory[D].Nanchang:Nanchang University, 2022.
[11] QIAN G F, HUANG J, FARHADI A, et al.Ethanol addition elevates cell respiratory activity and causes overproduction of natural yellow pigments in submerged fermentation of Monascus purpureus[J].LWT, 2021, 139:110534.
[12] 陈景智, 王力超, 李亮, 等.红曲霉洛伐他汀的液态发酵及其分离纯化研究[J].食品与发酵工业, 2019, 45(2):31-38.CHEN J Z, WANG L C, LI L, et al.Fermentation conditions and separation of lovastatin for Monascus[J].Food and Fermentation Industries, 2019, 45(2):31-38.
[13] 史成, 王笑, 高嘉欣, 等.两种辅料对固态发酵红曲米莫纳可林K与红曲色素产量的影响[J].食品科学技术学报, 2020, 38(4):119-126.SHI C, WANG X, GAO J X, et al.Effects of two auxiliary substrates on yield of monacolin K and Monascus pigments in solid-state fermentation of red yeast rice[J].Journal of Food Science and Technology, 2020, 38(4):119-126.
[14] SILVEIRA S T, DAROIT D J, SANT’ANNA V, et al.Stability modeling of red pigments produced by Monascus purpureus in submerged cultivations with sugarcane bagasse[J].Food and Bioprocess Technology, 2013, 6(4):1007-1014.
[15] 石佳, 张红梅, 苏子杰, 等.添加葡萄糖及大豆源基质提高红曲monacolin K产量的研究[J].食品与发酵工业, 2021, 47(2):182-187.SHI J, ZHANG H M, SU Z J, et al.Enhancing monacolin K yield of red yeast rice by adding glucose and substrates from soybean[J].Food and Fermentation Industries, 2021, 47(2):182-187.
[16] 赵薇, 姚钰琪, 王爽, 等.甘油影响红曲菌产色素的碳源选择性探究[J].微生物学杂志, 2019, 39(5):28-34.ZHAO W, YAO Y Q, WANG S, et al.Exploration on carbon source selectivity of glycerol affecting pigments production by Monascus spp[J].Journal of Microbiology, 2019, 39(5):28-34.
[17] 李坚华, 徐方, 吴佩芝, 等.富含莫纳可林K燕麦红曲的快速发酵[J].食品与生物技术学报, 2020, 39(6):61-67.LI J H, XU F, WU P Z, et al.Rapid fermentation of red fermented oats rich in monacolin K[J].Journal of Food Science and Biotechnology, 2020, 39(6):61-67.
[18] DAI W H, SHAO Y C, CHEN F S.Production of monacolin K in Monascus pilosus:Comparison between industrial strains and analysis of its gene clusters[J].Microorganisms, 2021, 9(4):747.
[19] 岳倩倩, 倪爱欣, 周礼红.无机氮源对红曲霉调控初探[J].中国酿造, 2016, 35(12):48-52.YUE Q Q, NI A X, ZHOU L H.Effect of inorganic nitrogen source on Monascus regulation[J].China Brewing, 2016, 35(12):48-52.
[20] CHANCHAROONPONG C, HSIEH P C, SHEU S C.Enzyme production and growth of Aspergillus oryzae S.on soybean koji fermentation[J].APCBEE Procedia, 2012, 2:57-61.
[21] 姜冰洁. 红曲菌固态发酵高产Monacolin K的研究[D].无锡:江南大学, 2015.JIANG B J.Study on solid-state fermentation of Monascus with high monacolin K production[D].Wuxi:Jiangnan University, 2015.
[22] 石侃. 红曲色素的pH敏感性及低pH萃取发酵的代谢调控[D].广州:华南理工大学, 2017.SHI K.pH-sensitivity of monascus pigments and metabolic regulation of monascus pigments in extractive fermentation under low pH[D].Guangzhou:South China University of Technology, 2017.
[23] ZHANG C, CHAI S Y, HAO S, et al.Effects of glutamic acid on the production of monacolin K in four high-yield monacolin K strains in Monascus[J].Applied Microbiology and Biotechnology, 2019, 103(13):5301-5310.
[24] ZHANG C, CHEN M X, ZANG Y M, et al.Effect of arginine supplementation on Monacolin K yield of Monascus purpureus[J].Journal of Food Composition and Analysis, 2022, 106:104252.
[25] 李滔滔. 高产洛伐他汀红曲霉菌诱变育种及其在酱油废水中的应用[D].株洲:湖南工业大学, 2013.LI T T.Screening of lovastatin-high-yielding monascus strain and applying in soy sauce waster water[D].Zhuzhou:Hunan University of Technology, 2013.