肉及肉制品富含丰富蛋白质、矿物质和维生素,是人类摄取营养物质的重要来源之一。据统计,全球养猪业生产的猪肉占肉类总消费量的33%,是亚洲和欧洲消费最多的肉类,2019年每个居民食用猪肉的平均屠体当量为20.5 kg[1-2]。金黄色葡萄球菌在自然环境中广泛存在且对严苛环境具有强耐受能力,此外在适宜条件下金黄色葡萄球菌可以形成生物被膜黏附于食品加工设备表面,并以此状态长期存活,对生鲜猪肉及其制品的食用安全造成严重威胁。随着食品行业进入现代化阶段,食品生产线加工工序的复杂性和加工设备的多样化为金黄色葡萄球菌生物被膜的形成提供良好的环境场所,从而大大增加致病菌黏附于设备表面并形成成熟生物被膜的风险[3-5]。成熟生物被膜解离分散,还可能进一步引起食品与加工设备间的交叉污染,因此生产过程中采用栅栏技术对易造成污染的栅栏因子进行关键点控制尤为重要。
边界模型作为概率模型的一类,常用来描述微生物生理状态发生改变的环境限制条件,需要确定微生物生理状态发生改变的概率。1995年RATKOWSKY等[6]提出将逻辑回归方法运用于边界模型的研究中,以此构建不同温度、pH、水分活度与亚硝酸盐浓度下微生物生长/不生长的边界模型。目前相关研究多集中于微生物的生长模型和失活模型以及相关一级模型和二级模型的比较和选择,概率模型作为一类重要的二级模型可用于预测不同环境条件下病原菌(或芽孢)生长/不生长、毒素产生/不产生以及生物被膜形成/不形成的概率[7-10]。将相关概率转化为可用于设定食品安全保质期的值,用于指导栅栏技术、危害分析与关键点控制(hazard analysis critical control point,HACCP)等对食品质量进行控制,是概率模型对食品工业的现实意义之一。
本试验通过逻辑回归的方法建立不同栅栏因子组合环境下,金黄色葡萄球菌黏附与生物被膜形成的边界模型,确定3种因素组合下金黄色葡萄球菌黏附与生物被膜形成的概率,以期为生鲜猪肉及其制品加工、零售过程中金黄色葡萄球菌的风险评估提供理论依据。
1 材料与方法
1.1 菌种
金黄色葡萄球菌(菌株编号为MRSZ96,ST59型),本实验室从生鲜猪肉样品中分离所得,并用甘油保藏。ST型的选取考虑了生鲜猪肉受金黄色葡萄球菌污染较严重的场景。
1.2 试剂与材料
胰酪胨大豆肉汤(trypticase soy broth,TSB)、胰酪胨大豆琼脂(trypticase soy agar,TSA),广州环凯微生物科技有限公司;基础培养基(Baird-Parker,BP),北京陆桥技术股份有限公司;NaCl、浓盐酸、NaOH、塑料离心管、圆底试管,成都浩搏优科技有限公司;细胞培养96孔板,湖南比克曼生物科技有限公司;医用无菌棉签,青岛海氏海诺集团有限公司。
1.3 仪器与设备
PHS-3C pH计,上海万舟科技有限公司;ZHP-160高低温振荡培养箱,常州国字仪器制造有限公司;DNP-9052电热恒温培养箱,上海一恒科学仪器有限公司;BSC1300IIA2生物安全柜,苏州集团苏州安泰空气技术有限公司;Mixcr 4k涡旋混合仪,上海生工生物股份有限公司;RJ-TGL-2000R高速冷冻离心机,上海生析超声仪器有限公司;LDZF-75L-Ⅰ高压灭菌锅,上海申安医疗器械厂;TE412-L精密电子天平,德国赛多利斯公司。
1.4 试验方法
1.4.1 菌株活化及菌悬液制备
将保藏于-80 ℃甘油冻存管中的金黄色葡萄球菌进行活化,使用无菌接种环挑取菌液接种于10 mL的TSB中,于37 ℃恒温培养摇床(160 r/min,24 h)中培养至稳定期。随后用无菌接种环蘸取稳定期菌液划线接种于TSA固体平板上,放置于37 ℃恒温培养箱中培养24 h。挑取TSA固体平板上的单菌落接种于10 mL的TSB液体培养基中,摇床培养至稳定期,然后取10 mL菌悬液用冷冻离心机离心收集菌体(4 ℃,8 000 r/min,5 min)。离心后菌体用10 mL无菌生理盐水重悬,重复3次。最后用无菌生理盐水将金黄色葡萄球菌重悬液稀释至6 lg CFU/mL左右备用。
1.4.2 生物被膜培养
首先使用2 mol/L的HCl和NaOH分别调节TSB的pH值至5.0、6.0、7.0、8.0。经过高温灭菌(121 ℃,20 min)后放入4 ℃冰箱保存备用。在96孔板加入180 μL灭菌后的不同pH值TSB,然后加入20 μL上述菌悬液混匀,分别放置于5、15、25、35 ℃的恒温培养箱中分别培养24、48、72、96 h,试验共64组处理条件,每组处理条件均进行6次独立重复试验。
1.4.3 生物被膜成熟度测定
培养结束后,吸掉每孔中剩余的液体培养基,并用0.85%的无菌生理盐水洗涤3次以去除未黏附的浮游菌体,随后用无菌棉签用力擦拭每孔底部及四周。将棉签移至放有5 mL生理盐水和少许玻璃珠的离心管中,并用涡旋仪涡旋2 min。吸取离心管中的菌液梯度稀释,选取合适的梯度在BP固体平板上进行涂布,置于37 ℃恒温培养箱培养24 h后计数。试验结果以lg CFU/mL表示。每孔中若计数结果≥5 lg CFU/mL,则认定为生物被膜形成;若计数结果在3~5 lg CFU/mL范围内,则视为黏附状态;若计数结果<3 lg CFU/mL,则认定无黏附或生物被膜形成[11]。
1.4.4 黏附与生物被膜形成的边界模型构建
通过逻辑回归的方法,构建金黄色葡萄球菌的黏附与生物被膜形成边界模型。当每组处理条件的计数结果在3~5 lg CFU/mL或≥5 lg CFU/mL时,P值等于1,即形成生物被膜。当计数结果<3 lg CFU/mL时,P值则等于0,即未形成生物被膜。其中逻辑回归模型的表达式如公式(1)所示:
(1)
式中:P,黏附或生物被膜形成的概率;t,培养时间,h;T,培养温度,℃;pH,培养基的pH值。
1.4.5 模型验证及评价
根据分配规则(比例7∶3),将所得的试验结果随机选取14组处理条件进行模型验证。在6次重复试验中,观察到1次阳性结果则判定该处理条件金黄色葡萄球菌可黏附或生物被膜形成,即判定的阈值为0.167(1/6)[12]。随后,将预测的概率值与试验的观测值进行比较。运用混淆矩阵(confusion matrix)与二级指标准确度(accuracy)、精确度(precision)以及均方根误差(root mean square error,RMSE)对构建的边界模型进行精度评价。二级指标的计算如公式(2)~公式(4)所示:
(2)
(3)
(4)
式中:TPR(true positive rate),阳性率;TNR(true negative rate),阴性率;FPR(false positive rate),假阳性率;FNR(false negative rate),假阴性率;P0,黏附或生物被膜形成概率的观测值;Pp,黏附或生物被膜形成概率的预测值;n,观测的个数。
1.4.6 数据处理与统计分析
本研究使用Excel 2021进行数据统计,将金黄色葡萄球菌菌落数“CFU/g”转换为“lg(CFU/g)”。运用Minitab 19.0软件(美国Minitab公司)进行逻辑回归,采用逐步回归的方法保留具有显著性的参数估计项(P<0.05),最终得到金黄色葡萄球菌黏附与生物被膜形成的边界模型,运用Wald检验进行分析,并绘制相应的等值线图和曲面图。
2 结果与分析
2.1 金黄色葡萄球菌黏附/不黏附边界模型
本试验所用金黄色葡萄球菌前期分离鉴定试验结果表明:金黄色葡萄球菌MRSZ96刚果红试验呈阳性,具备形成生物被膜能力;金黄色葡萄球菌MRSZ96多位点序列分型(multilocus sequence typing,MLST)结果为ST59型[13]。ST型的选取考虑了生鲜猪肉受金黄色葡萄球菌污染较严重的场景,根据WU等[14]研究可知,食品中分离出的金黄色葡萄球菌MLST分型最常见为ST59型。
通过逻辑回归的方法,构建金黄色葡萄球菌黏附的边界模型。模型的参数估计值及标准误如表1所示,其黏附概率的等值线图和曲面图如图1所示。对于金黄色葡萄球菌,有线性培养温度T与培养时间t项对其黏附具有显著性影响(P<0.05)。金黄色葡萄球菌黏附/不黏附的边界模型表达式如公式(5)所示:
Logit(Padhesion)=-4.785+0.505×T+0.020×t
(5)
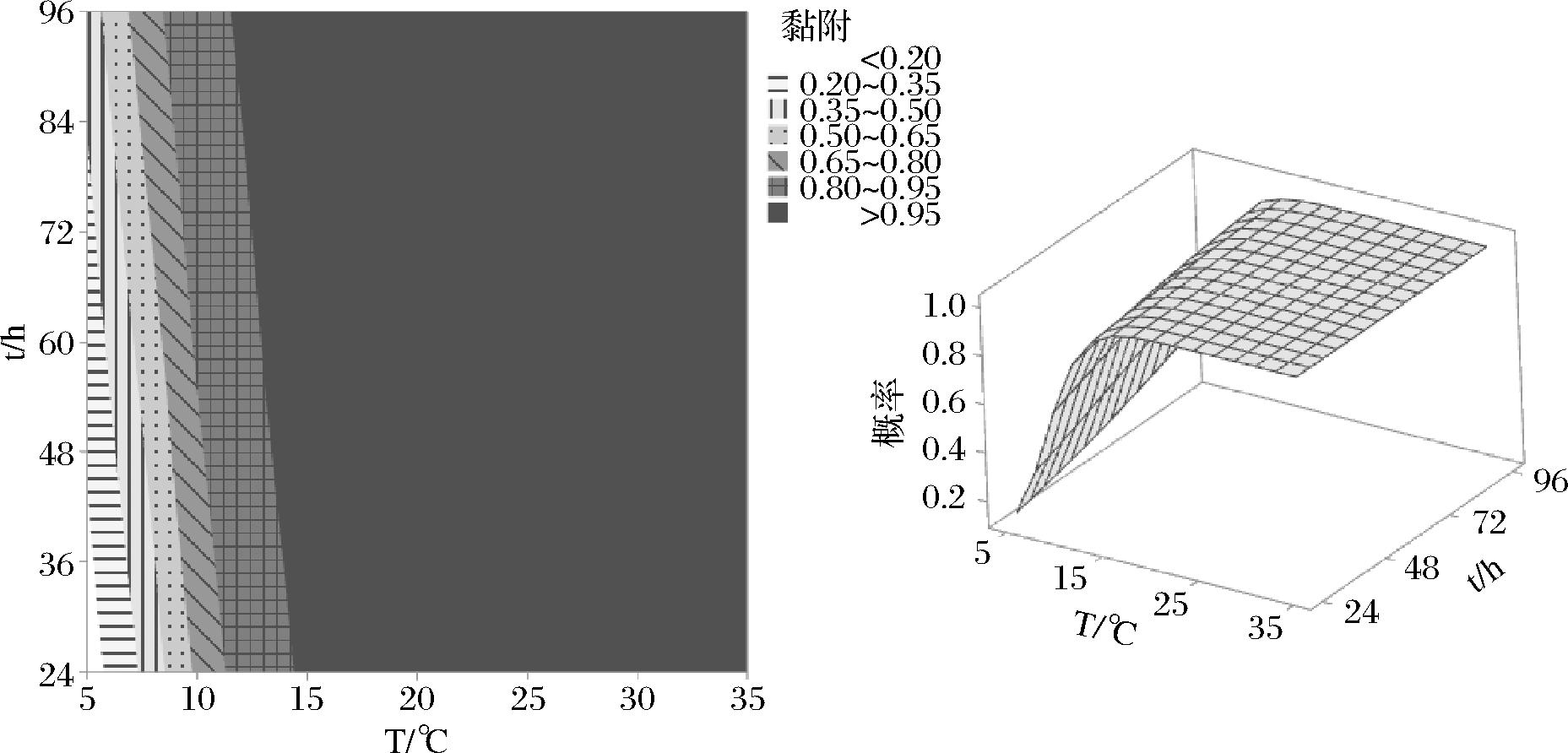
图1 金黄色葡萄球菌黏附概率的等值线图和曲面图
Fig.1 Contour map and surface plot of adhesion probability by S.aureus
表1 金黄色葡萄球菌黏附/不黏附边界回归模型参数
Table 1 Boundary regression model parameters for adhesion/no-adhesion of S.aureus
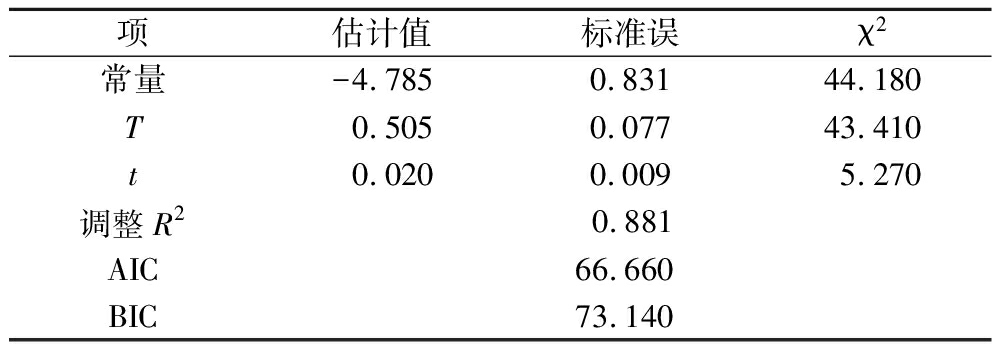
项估计值标准误χ2常量-4.7850.83144.180T0.5050.07743.410t0.0200.0095.270调整R20.881AIC66.660BIC73.140
根据Wald检验,菌株96的T与t的χ2为43.410、5.270,这表明培养温度对金黄色葡萄球菌的黏附起最关键作用,其次是培养时间的影响。此外,pH(5.0~8.0)作为研究因素之一,其对黏附的影响作用不显著,因此黏附边界模型表达式中不存在与pH相关的项。本实验采用调整决定系数(R2)、赤池信息量准则(akaike information criterion,AIC)和贝叶斯信息量准则(bayesian information criterion,BIC)对模型进行内部评价,调整R2越趋近于1代表该模型拟合效果越好,AIC和BIC越小代表该模型拟合精度越高[15]。由表1可知,金黄色葡萄球菌黏附的边界模型的R2为0.881,AIC和BIC分别为66.660、73.140,表明该回归模型拟合效果较好。
肉源金黄色葡萄球菌生物被膜形成过程可分为4个不同的阶段:初始黏附阶段(4~12 h)、指数阶段(12~24 h)、缓慢生长阶段(1~3 d)和稳定期(3~7 d),而温度和pH对于微生物细胞从浮游态到固着形态的表型变化发挥重要作用,以此来影响微生物的黏附程度[16-17]。因此本试验选择培养温度、培养时间和pH作为影响因子构建金黄色葡萄球菌黏附/生物被膜形成的边界模型,金黄色葡萄球菌黏附/不黏附边界模型表明,培养温度和培养时间显著影响金黄色葡萄球菌的黏附,与前人研究一致。
图1为金黄色葡萄球菌在培养温度与培养时间共同影响下黏附的概率。
等值线图中不同颜色代表不同黏附概率,曲面图则直观表现黏附概率的变化情况。从等值线图中可以看出,不同T与t组合下金黄色葡萄球菌对应的黏附概率。在5 ℃下,培养时间低于36 h,黏附发生的概率小于0.20;随着温度升高,相同培养时间黏附发生的概率逐渐增大,15 ℃时培养24 h以上黏附形成概率均大于0.95。结果表明,培养温度是影响该菌株生长繁殖最重要的因素之一,该结果与ELAHI等[18]和MORAES等[19]的研究结果保持一致。ELAHI等[18]利用Logistic回归模型确定金黄色葡萄球菌在摇床或静止培养时不同温度和盐浓度培养条件组合下的生长和产毒边界,发现不同温度和盐浓度条件下金黄色葡萄球菌的菌落数和产毒素量有很大差异。MORAES等[19]则以NaCl浓度、pH和温度作为环境条件变量,构建不同血清型沙门氏菌在不锈钢表面黏附或生物被膜形成的边界模型,结果表明温度对致病菌生物被膜形成具有重要影响作用。
2.2 金黄色葡萄球菌生物被膜形成/不形成边界模型
通过逻辑回归的方法,构建金黄色葡萄球菌黏附的边界模型。模型的参数估计值及标准误如表2所示,其黏附概率的等值线图和曲面图如图2和图3所示。金黄色葡萄球菌有线性培养温度T、pH、培养时间t、pH的平方、pH与t项共同显著性影响(P<0.05)其生物被膜形成。金黄色葡萄球菌形成/不形成的边界模型表达式如公式(6)所示:
Logit(Pbiofilm)=18.600+0.622×T-8.630×pH-0.101×t+0.610×pH2+0.020×pH×t
(6)

a-pH与T;b-t与T;c-t与pH
图2 金黄色葡萄球菌生物被膜形成概率的等值线图和曲面图
Fig.2 Contour map and surface plot of biofilm formation probability by S.aureus

a-pH 5.0;b-pH 6.0;c-pH 7.0;d-pH 8.0
图3 金黄色葡萄球菌生物被膜形成概率的等值线图和曲面图
Fig.3 Contour map and surface plot of biofilm formation probability by S.aureus
表2 不同金黄色葡萄球菌生物被膜形成/不形成边界回归模型参数
Table 2 Boundary regression model parameters for biofilm formation/no-formation of different S.aureus
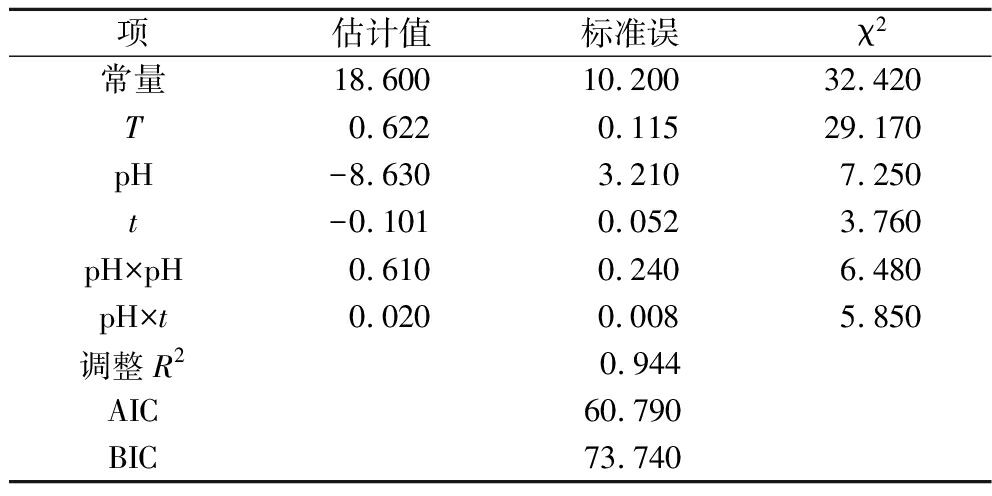
项估计值标准误χ2常量18.60010.20032.420T0.6220.11529.170pH-8.6303.2107.250t-0.1010.0523.760pH×pH0.6100.2406.480pH×t0.0200.0085.850调整R2 0.944AIC60.790BIC73.740
根据Wald检验,菌株各项影响因子最高的χ2为T项所对应的卡方值,其为29.170。结果表明,培养温度对金黄色葡萄球菌生物被膜形成均起最关键作用,其次是pH对该菌株生物被膜形成的影响。如表2所示,金黄色葡萄球菌生物被膜形成/不形成边界模型的R2为0.944,AIC和BIC分别为60.790、73.740。金黄色葡萄球菌生物被膜黏附/生物被膜形成模型的R2>0.800,表明变量T、pH、t对预测结果有效,模型拟合效果较好。由公式(6)可知,pH与pH之间和pH与t之间存在交互作用,与HU等[20]构建的温度、NaCl浓度和pH的组合环境下单增李斯特氏菌的生物被膜形成边界模型相同,所构建的回归方程式同样存在不同环境条件因子间的交互作用情况。
由于生物被膜边界模型表达式中存在平方项,因此图2中的等值线为曲线,生物被膜的形成与培养温度、pH值和培养时间显著相关。恒定值t为60 h时,金黄色葡萄球菌生物被膜形成主要受培养温度影响,T与生物被膜形成概率呈正比,pH对形成概率影响较小;pH值为6.5时,10 ℃以下生物被膜形成概率小于0.1,≥20 ℃时形成概率大于0.7。由此可知培养温度对金黄色葡萄球菌生物被膜形成/不形成起重要作用。
如图3所示,设定pH为恒定不变的值,分别绘制不同温度下金黄色葡萄球菌生物被膜形成等值线图和曲面图。当pH值为5.0时,温度为15 ℃且培养时间为24 h时,生物被膜形成的概率为0.5;而pH值为6.0和7.0时,其他条件相同,生物被膜形成概率降为0.1~0.3;pH值为8.0时,15 ℃培养24 h,生物被膜形成概率提升至0.3~0.5。对比不同pH值条件下的等值线图,发现pH值为8.0时,生物被膜形成概率大于0.9的面积最大,说明该pH值对金黄色葡萄球菌生物被膜形成具有促进作用。TANGO等[21]通过构建数学模型研究不同pH、乙醇浓度和aw范围内金黄色葡萄球菌生物被膜形成表现,结果表明pH和aw接近金黄色葡萄球菌最适生长条件时,生物被膜的形成现象显著增强。结合图2和分析结果表明,生产应用栅栏技术时需注意避开pH值为8.0,预防金黄色葡萄球菌形成生物被膜,防止食品受金黄色葡萄球菌污染影响产品质量。
金黄色葡萄球菌在适宜条件下会大量繁殖并产生肠毒素,且该毒素耐高温、稳定性强。肠毒素作为金黄色葡萄球菌生长繁殖过程中的次级代谢产物,是导致食物中毒的主要原因之一;而生物被膜作为金黄色葡萄球菌生长繁殖过程中的特殊状态,可使金黄色葡萄球菌对不良环境的抵抗性增加、降低其代谢活性和增强对抗生素的耐药性,待生物被膜成熟解离后金黄色葡萄球菌细胞可进行正常繁殖活动,产生大量肠毒素。因此生物被膜对金黄色葡萄球菌生长繁殖及产毒活动具有重要作用。CAI等[22]利用Logistic回归和神经网络(neural network,NN)构建金黄色葡萄球菌在哈萨克干酪生产过程中产/不产肠毒素的预测模型。由此可见,概率模型不仅可用于致病菌生物被膜形成/不形成边界的构建,还能用于产芽孢、产毒素等相关预测。
2.3 模型验证及评价
从所得的试验数据中随机选取19组处理条件下的结果进行模型验证,同时采用混淆矩阵、准确度、精确度及RMSE对边界模型的精度进行评价。金黄色葡萄球菌边界模型的模型预测值与观测值的对比,如表3、表4所示。其中P0指黏附或生物被膜形成的观测概率,Pp指黏附或生物被膜形成的模型预测概率。从表格可以看出,所构建的边界模型其预测值和对应的观测值之间基本一致,表明该模型的预测效果较好。
表3 金黄色葡萄球菌的边界模型验证及基于阈值对黏附/非黏附的分类
Table 3 Validation of boundary model of S.aureus and classification of adhesion/no-adhesion base on threshold
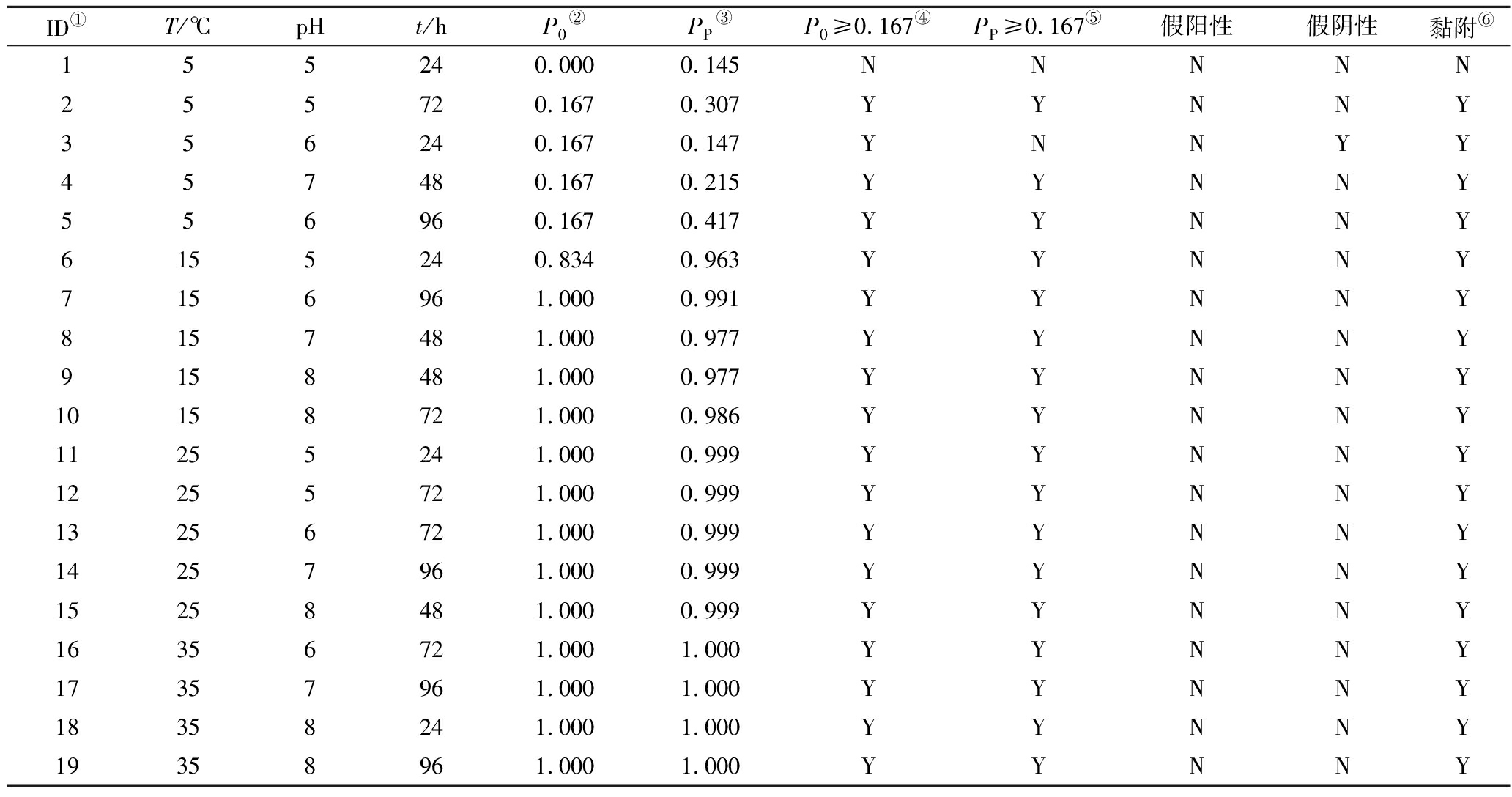
ID①T/℃pHt/hP0②PP③P0≥0.167④PP≥0.167⑤假阳性假阴性黏附⑥155240.0000.145NNNNN255720.1670.307YYNNY356240.1670.147YNNYY457480.1670.215YYNNY556960.1670.417YYNNY6155240.8340.963YYNNY7156961.0000.991YYNNY8157481.0000.977YYNNY9158481.0000.977YYNNY10158721.0000.986YYNNY11255241.0000.999YYNNY12255721.0000.999YYNNY13256721.0000.999YYNNY14257961.0000.999YYNNY15258481.0000.999YYNNY16356721.0001.000YYNNY17357961.0001.000YYNNY18358241.0001.000YYNNY19358961.0001.000YYNNY
注:ID是分组序号(下同);P0为观测的黏附率;Pp是由公式(5)计算出的黏附概率;P0≥0.167是观测的黏附率≥0.167,则定义为“Y”,否则为“N”;Pp≥0.167是预测的黏附率≥0.167,则定义为“Y”,否则为“N”;若观测为黏附,则定义为“Y”,否则为“N”。
表4 金黄色葡萄球菌的边界模型验证及基于阈值生物被膜形成/不形成的分类
Table 4 Validation of boundary model of S.aureus and classification of biofilm formation/no-biofilm formation base on threshold
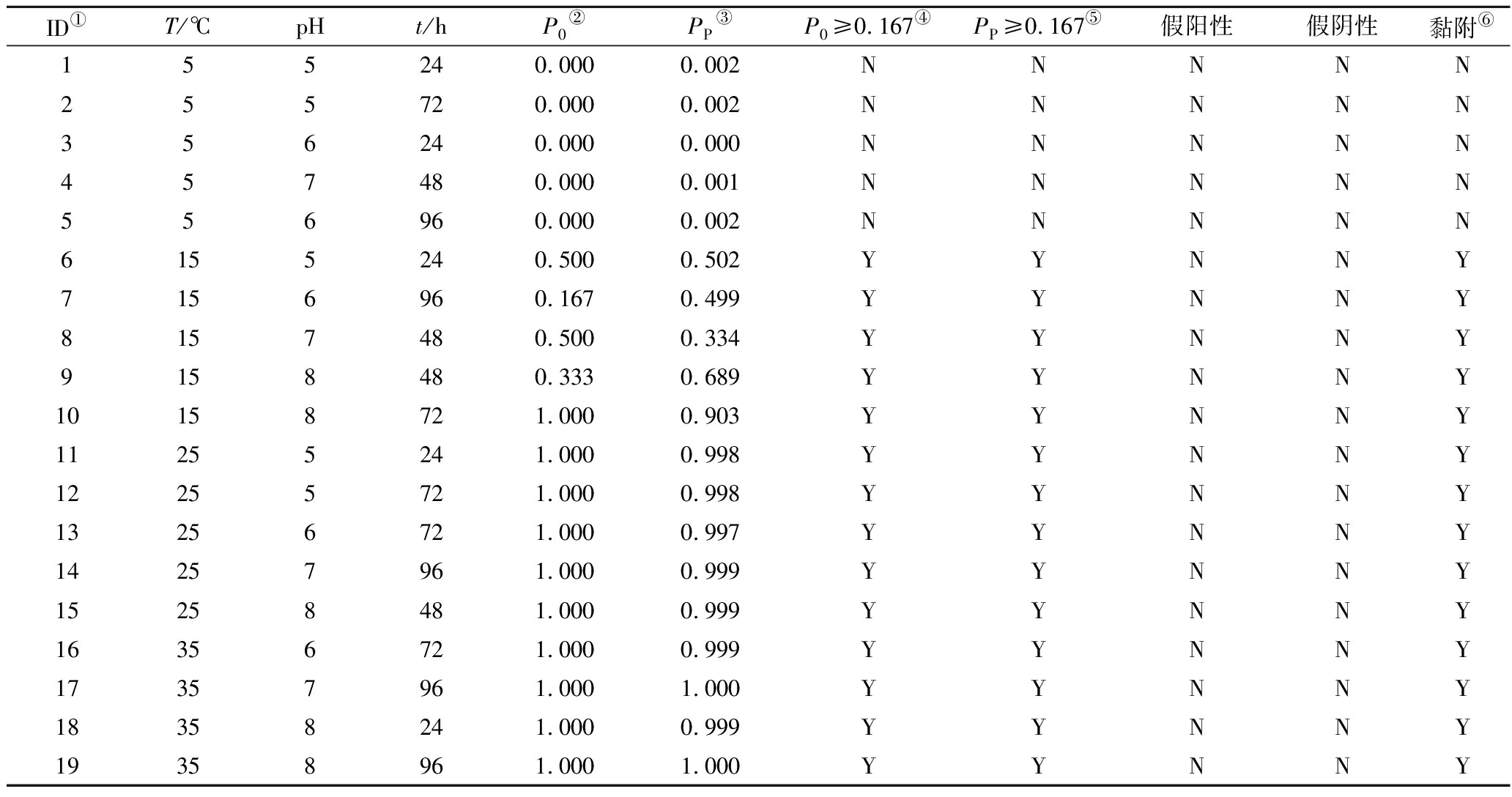
ID①T/℃pHt/hP0②PP③P0≥0.167④PP≥0.167⑤假阳性假阴性黏附⑥155240.0000.002NNNNN255720.0000.002NNNNN356240.0000.000NNNNN457480.0000.001NNNNN556960.0000.002NNNNN6155240.5000.502YYNNY7156960.1670.499YYNNY8157480.5000.334YYNNY9158480.3330.689YYNNY10158721.0000.903YYNNY11255241.0000.998YYNNY12255721.0000.998YYNNY13256721.0000.997YYNNY14257961.0000.999YYNNY15258481.0000.999YYNNY16356721.0000.999YYNNY17357961.0001.000YYNNY18358241.0000.999YYNNY19358961.0001.000YYNNY
注:P0为观测的生物被膜形成率;Pp是由公式(6)计算出的生物被膜形成概率;P0≥0.167是观测的生物被膜形成率≥0.167,则定义为“Y”,否则为“N”;Pp≥0.167是预测的生物被膜形成率≥0.167,则定义为“Y”,否则为“N”;若观测为生物被膜形成,则定义为“Y”,否则为“N”。
表3为金黄色葡萄球菌黏附/不黏附边界模型验证表,如表所示在随机选取的19组数据中,18组试验结果为菌株发生黏附,ID1试验组观测值和预测值均显示未发生黏附,ID3试验组为假阴性。根据混淆矩阵表5,该边界模型RMSE为0.081,预测准确度为0.973,精确度为1.000,阳性率为1.000,阴性率为0.947。金黄色葡萄球菌的生物被膜形成/不形成边界模型验证如表4所示,随机选取的19组试验组中有5组试验组观测值和预测值显示未形成生物被膜,ID为ID1~ID5,无假阳性和假阴性现象发生。混淆矩阵表5显示,生物被膜形成/不形成边界模型的准确度、精确度、阳性率、阴性率都为1.00;生物被膜形成模型的RMSE为0.120。结果表明2个模型均具有较好的预测效果。
表5 验证金黄色葡萄球菌黏附或生物被膜形成的混淆矩阵
Table 5 Confusion matrices for validation of adhesion/
no-adhesion or biofilm formation/no-biofilm formation of S.aureus
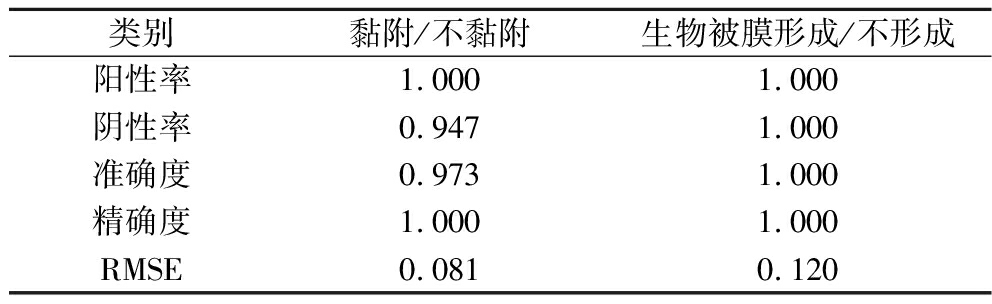
类别黏附/不黏附生物被膜形成/不形成阳性率1.0001.000阴性率0.9471.000准确度0.9731.000精确度1.0001.000RMSE0.0810.120
结合不同评价参数对模型进行内部和外部验证,以此来评价预测模型的拟合效果状况,其中RMSE越小代表该模型拟合精确度越高。WANG等[23]使用准确因子(Af)、精偏差因子(Bf)、RMSE和预测标准误差百分比作为金黄色葡萄球菌在年糕上生长/不生长概率模型的性能和可靠性验证的统计指标。冻梓杰等[24]采用AIC、Af、Bf、均方误差、RMSE以及R2对所建立的生长模型进行评价。
3 结论
本研究采用逻辑回归的方法,建立了不同培养温度、pH与培养时间3种环境因素组合下,生鲜猪肉源ST59型金黄色葡萄球菌的黏附与生物被膜形成边界模型。模型的验证与评价表明,构建模型的预测效果良好。培养温度和培养时间显著影响菌株金黄色葡萄球菌的黏附,而该菌株生物被膜形成则与培养温度、pH和培养时间3种环境因素的交互作用相关。此外,环境温度的升高和培养时间的延长会促进菌体的黏附,而低pH环境会抑制金黄色葡萄球菌的黏附和生物被膜形成。本研究结果有助于确定金黄色葡萄球菌在多种环境因素组合下黏附和生物被膜形成的概率,为生鲜肉类加工环节和销售环节制定生物被膜预防或清除方法、控制生物被膜污染提供理论参考,以保证生鲜猪肉及其肉制品的食品安全。
[1] LEBRET B,  ANDEK-POTOKAR M.Review:Pork quality attributes from farm to fork.Part Ⅰ.Carcass and fresh meat [J].Animal:an International Journal of Animal Bioscience, 2022, 16:100402.
ANDEK-POTOKAR M.Review:Pork quality attributes from farm to fork.Part Ⅰ.Carcass and fresh meat [J].Animal:an International Journal of Animal Bioscience, 2022, 16:100402.
[2] LEBRET B,  ANDEK-POTOKAR M.Review:Pork quality attributes from farm to fork.Part II.Processed pork products[J].Animal:an International Journal of Animal Bioscience, 2022, 16:100383.
ANDEK-POTOKAR M.Review:Pork quality attributes from farm to fork.Part II.Processed pork products[J].Animal:an International Journal of Animal Bioscience, 2022, 16:100383.
[3] WU Y H, LI J, QIAO M F, et al.Characteristic profiles of biofilm, enterotoxins and virulence of Staphylococcus aureus isolates from dairy cows in Xinjiang Province, China[J].Journal of Veterinary Science, 2019, 20(6):e74.
[4] LATORRE A A, PACH P A, GONZ
P A, GONZ LEZ-ROCHA G, et al.On-farm surfaces in contact with milk:The role of Staphylococcus aureus-containing biofilms for udder health and milk quality[J].Foodborne Pathogens and Disease, 2020, 17(1):44-51.
LEZ-ROCHA G, et al.On-farm surfaces in contact with milk:The role of Staphylococcus aureus-containing biofilms for udder health and milk quality[J].Foodborne Pathogens and Disease, 2020, 17(1):44-51.
[5] V ZQUEZ-S
ZQUEZ-S NCHEZ D, GALV
NCHEZ D, GALV O J A, OETTERER M.Contamination sources, biofilm-forming ability and biocide resistance of Staphylococcus aureus in tilapia-processing facilities[J].Food Science and Technology International, 2018, 24(3):209-222.
O J A, OETTERER M.Contamination sources, biofilm-forming ability and biocide resistance of Staphylococcus aureus in tilapia-processing facilities[J].Food Science and Technology International, 2018, 24(3):209-222.
[6] RATKOWSKY D A, ROSS T.Modelling the bacterial growth/no growth interface[J].Letters in Applied Microbiology, 1995, 20(1):29-33.
[7] 张文敏, 董庆利, 刘阳泰, 等.CO2对猪肉中单增李斯特菌抑制模型的优选及建立[J].食品与发酵工业, 2023, 49(24):220-227.ZHANG W M, DONG Q L, LIU Y T, et al.Optimization and establishment of inhibition model of CO2 on Listeria monocytogenes in pork[J].Food and Fermentation Industries, 2023, 49(24):220-227.
[8] 郑婷, 董鹏程, 王仁欢, 等.冷却牛肉中沙门氏菌生长预测模型的建立和验证[J].食品与发酵工业, 2015, 41(7):38-44.ZHENG T, DONG P C, WANG R H, et al.Establishment and validation of predictive model of Salmonella in beef[J].Food and Fermentation Industries, 2015, 41(7):38-44.
[9] SHAO L T, DONG Y, CHEN X J, et al.Modeling the elimination of mature biofilms formed by Staphylococcus aureus and Salmonella spp.Using combined ultrasound and disinfectants[J].Ultrasonics Sonochemistry, 2020, 69:105269.[10] 程慧敏, 赵格, 许育衔, 等.市售小酥肉中沙门菌热失活模型的建立与验证[J].中国食品卫生杂志, 2023, 35(11):1551-1558.CHENG H M, ZHAO G, XU Y X, et al.Establishment and validation of heat inactivation modeling of Salmonella in commercial crispy meat[J].Chinese Journal of Food Hygiene, 2023, 35(11):1551-1558.
[11] MORAES J O, CRUZ E A, PINHEIRO  , et al.An ordinal logistic regression approach to predict the variability on biofilm formation stages by five Salmonella enterica strains on polypropylene and glass surfaces as affected by pH, temperature and NaCl[J].Food Microbiology, 2019, 83:95-103.
, et al.An ordinal logistic regression approach to predict the variability on biofilm formation stages by five Salmonella enterica strains on polypropylene and glass surfaces as affected by pH, temperature and NaCl[J].Food Microbiology, 2019, 83:95-103.
[12] HUANG L H, JIA Z, HWANG C A.Growth and No-Growth boundary of Listeria monocytogenes in beef - A logistic modeling[J].Food Research International, 2022, 152:110919.
[13] 吴任之. 雅安市雨城区猪肉源金黄色葡萄球菌的分离及生物特性分析[D].雅安:四川农业大学, 2022.WU R Z.Isolation and biological characterization of Staphylococcus aureus from pork in Yucheng district, Ya’an City[D].Ya’an:Sichuan Agricultural University, 2022.
[14] WU S, ZHANG F, HUANG J H, et al.Phenotypic and genotypic characterization of PVL-positive Staphylococcus aureus isolated from retail foods in China[J].International Journal of Food Microbiology, 2019, 304:119-126.
[15] 彭亚博, 李晓婷, 方婷, 等.鸡肉中沙门氏菌和背景菌群生长动力学模型[J].食品科学, 2019, 40(9):7-15.PENG Y B, LI X T, FANG T, et al.Modelling growth kinetics of Salmonella and background microorganisms in chicken[J].Food Science, 2019, 40(9):7-15.
[16] CHENG C S, JIANG T, ZHANG D W, et al.Attachment characteristics and kinetics of biofilm formation by Staphylococcus aureus on ready-to-eat cooked beef contact surfaces[J].Journal of Food Science, 2023, 88(6):2595-2610.
[17] KARACA B, AKCELIK N, AKCELIK M.Biofilm-producing abilities of Salmonella strains isolated from Turkey[J].Biologia, 2013, 68(1):1-10.
[18] ELAHI S, FUJIKAWA H.Comprehensive study of the boundaries of enterotoxin A production and growth of Staphylococcus aureus at various temperatures and salt concentrations[J].Journal of Food Science, 2019, 84(1):121-126.
[19] MORAES J O, CRUZ E A, SOUZA E G F, et al.Predicting adhesion and biofilm formation boundaries on stainless steel surfaces by five Salmonella enterica strains belonging to different serovars as a function of pH, temperature and NaCl concentration[J].International Journal of Food Microbiology, 2018, 281:90-100.
[20] HU L L, DONG Q L, LI Z S, et al.Modelling the adhesion and biofilm formation boundary of Listeria monocytogenes ST9[J].Foods, 2022, 11(13):1940.
[21] TANGO C N, AKKERMANS S, HUSSAIN M S, et al.Modeling the effect of pH, water activity, and ethanol concentration on biofilm formation of Staphylococcus aureus[J].Food Microbiology, 2018, 76:287-295.
[22] CAI H X, PEI S J, ZHANG Y, et al.Construction of a dynamic model to predict the growth of Staphylococcus aureus and the formation of enterotoxins during Kazak cheese maturation[J].Food Microbiology, 2023, 112:104234.
[23] WANG J, KOSEKI S, CHUNG M J, et al.A novel approach to predict the growth of Staphylococcus aureus on rice cake[J].Frontiers in Microbiology, 2017, 8:1140.
[24] 冻梓杰, 黄阳阳, 周伟涛, 等.糯米面团中金黄色葡萄球菌生长预测模型的构建[J].食品科学, 2023,44(22):133-138.DONG Z J, HUANG Y Y, ZHOU W T, et al.Predictive growth models for Staphylococcus aureus in glutinous rice dough[J].Food Science, 2023,44(22):133-138.