中国白酒的12种香型,包括浓香型、清香型、酱香型、米香型、豉香型、兼香型、凤香型、药香型、特香型、芝麻香型、老白干香型和馥郁香型,除米香型和豉香型外,其他10种完全或部分采用大曲为糖化剂和发酵剂,其大曲制作通常由整颗粒小麦或大麦直接压制成曲,但特香型大曲的制作较为例外。特香型大曲以面粉和麦麸为主要原料,添加适量比例的酒糟提高大曲的酸度,具有含氮量高、选择性接种环境中耐酸微生物的特点[1-2],这种特殊的制曲方式是特香型白酒风格形成的关键工艺。近年来,对于特香型大曲的研究主要集中在大曲理化指标检测[3]、改变单一因素对大曲品质影响[4]等方面,但对于特香型大曲微生物种类及其数量变化规律的认识仍不清晰。
大曲按照制曲温度可以分为高温大曲(60 ℃以上)、中高温大曲(50~59 ℃)、中温大曲(45~50 ℃)[5],成品曲可分为曲皮、中层及曲心3个层次。大曲不同层次一般具有显著不同的菌群结构,如酱香型高温大曲中曲皮主要为乳杆菌目(Lactobacillales),核心主要为芽孢杆菌目(Bacillales),其中芽孢杆菌目细菌与吡嗪类等风味物质的形成密切相关[2]。浓香型高温大曲不同层次具有不同的微生物结构,如中层富含库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)、扣囊复膜酵母(Saccharomycopsis fibuligera),可产生多种酯类、芳香族、酸类和醇类化合物,对浓香型大曲酒的风格起到重要作用[6]。特香型白酒制曲虽也采用了中高温制曲工艺,但制曲原料较为独特,其成品曲不同层次的微生物菌群结构和风味化合物特征尚未能完全解析。
本研究使用扩增子测序和顶空固相微萃取结合气相色谱质谱技术(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS),从群落结构和风味物质两方面阐述了特香型大曲3个层次微生物和挥发性风味物质的类型及变化规律,同时运用微生物溯源分析对大曲不同层次微生物的来源进行探索。本研究使用的绝对定量方法学、大曲层次分析方法,即细菌和真菌在大曲不同层次间的变化规律,对优化特香型制曲工艺,提升特香型白酒风味品质具有重要参考价值。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
1.1.1.1 大曲样品的采集
大曲样品收集于江西李渡酒业有限公司4个不同曲房的典型性中高温大曲,其入库时间分别为3、6、9、11月,从每个曲房随机抽取3块大曲。选取的大曲均含有典型的3个层次:大曲由外至内约0.5 cm厚区域定义为曲皮(Daqu Surface),曲皮与曲心之间约0.5 cm深色区域定义为中层(Daqu Middle),中层以内约2 cm的曲中心区域定义为曲心(Daqu Core)(图1)。从每块曲分别收集曲皮、中层、曲心3层样品,每层5点取样、粉碎、混合均匀后备用。

图1 成品大曲剖面图
Fig.1 Section drawing of Daqu
1.1.1.2 环境及原料样品的采集
环境样品收集于江西李渡酒业有限公司制曲车间,选择3个曲房。分别从曲房室内地面(ground)和室内屋顶(roof)2个位置收集,混合不同曲房的样品备用。原料样品从原料仓库中随机收集面粉(flour)、麦麸(wheat bran)和酒糟(fermented grains)样品备用。
1.1.2 试剂
DNA提取液、核酸提取液、2-辛醇标准品,北京索莱宝科技有限公司;无水乙醇、氯化钠等,国药集团化学试剂有限公司;磷酸盐缓冲液速溶颗粒,南京诺唯赞生物科技股份有限公司。
1.2 仪器与设备
NanoDrop蛋白核酸测定分光光度计,Thermo FisherScientific公司;高速冷冻离心机,Eppendorf公司;Illumina MiSeq PE300测序平台,Illumina公司。
1.3 实验方法
1.3.1 挥发性化合物测定
采用HS-SPME-GC-MS分析样品中的挥发性风味物质,5 g大曲和10 μL 2-辛醇(31.31 mg/L)混合作为内标,详细测定方法见JI等[7]。
1.3.2 核酸提取、16S rRNA基因扩增子和ITS扩增子测序
所有样品均用0.1 mol/L的PBS处理,30×g离心5 min,重复3次,然后将上清液再次以9 000×g离心3 min,重复3次,使用DNA提取液[V(苯酚)∶V(氯仿)∶V(异戊醇)=25∶24∶1]和核酸提取液[V(氯仿)∶V(异戊醇)=24∶1]提取基因组DNA。分别使用515FmodF(5′-GTGYCAGCMGCCGCGGTAA-3′)、806RmodR(5′-GCATCG-ATGAAGAACGCAGC-3′)和ITS3(5′-GGACTACNVGGGTWTCTAAT-3′)、ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对细菌16S rRNA基因V4区和真菌ITS2区进行PCR扩增。利用Illumina公司的Miseq PE300平台对细菌和真菌序列进行测序分析(上海美吉生物医药科技有限公司)。
1.3.3 细菌总数的绝对定量
在使用PBS处理所有样品前,添加已知数量的丙酮丁醇梭菌营养体细胞,每克大曲和原料样品中添加1.368×108个内标菌,每克环境样品中添加2.28×107个内标菌。
1.4 生物信息学分析
通过美吉生信云内置的QIIME1.9等分析工具处理扩增子测序数据,去除质量较差和含嵌合体的序列,并将相似度大于97%的序列聚类为1个操作分类单元(operational taxonomic unit,OTU)。统计分析采用t-检验,P<0.05为有统计学差异(*),P<0.01为有显著统计学差异(**),P<0.001为有极其显著的统计学差异(***)。Spearman相关系数用于分析微生物和代谢物之间的相关性,使用Gephi(0.9.1)进行关联网络可视化。
2 结果与分析
2.1 特香型成品大曲中不同层次的细菌群落组成与变化规律
在特香型大曲所有样品中共检测到50个细菌目,其中丰度较高的细菌目(平均相对丰度>1%)主要包括乳杆菌目(Lactobacillales,平均值26.58%,分布范围5.55%~86.45%)、假诺卡氏菌目(Pseudonocardiales,平均值26.08%,分布范围0.03%~87.33%)、肠杆菌目(Enterobacterales,平均值26.78%,分布范围0.03%~81.95%)、高温放线菌目(Thermoactinomycetales,平均值5.88%,分布范围0.00%~47.16%)、芽孢杆菌目(Bacillales,平均值5.25%,分布范围0.04%~23.79%)、葡萄球菌目(Staphylococcales,平均值2.66%,分布范围0.11%~10.50%)、立克次氏体目(Rickettsiales,平均值2.26%,分布范围0.03%~19.20%)和微球菌目(Micrococcales,平均值1.65%,分布范围0.00%~9.55%)。
如图2所示,曲皮的优势细菌目分别是乳杆菌目(Lactobacillales)和肠杆菌目(Enterobacterales),其相对比例分别是45.34%(分布范围6.26%~86.81%)和35.61%(分布范围3.20%~67.36%)。随着大曲层次的深入,假诺卡氏菌目(Pseudonocardiales)成为中层中丰度最高的微生物,相对比例为39.20%(分布范围1.85%~87.34%);乳杆菌目(Lactobacillales)和肠杆菌目(Enterobacterales)的相对比例的平均值与曲皮比降低了23.84%和7.93%。而曲心中,相对丰度最高的细菌为假诺卡氏菌目(Pseudonocardiales)、肠杆菌目(Enterobacterales)和高温放线菌目(Thermoactinomycetales),其相对丰度分别为35.63%(分布范围0.39%~70.25%)、17.37%(分布范围0.03%~82.62%)和16.55%(分布范围0.08%~47.17%)。特别值得注意的是,高温放线菌目(Thermoactinomycetales)的相对丰度在曲皮的含量极低,仅约0.03%(分布范围0.00%~0.09%),而在曲心的含量显著增加(P<0.01),相对丰度增加到16.55%(分布范围0.08%~47.17%)。
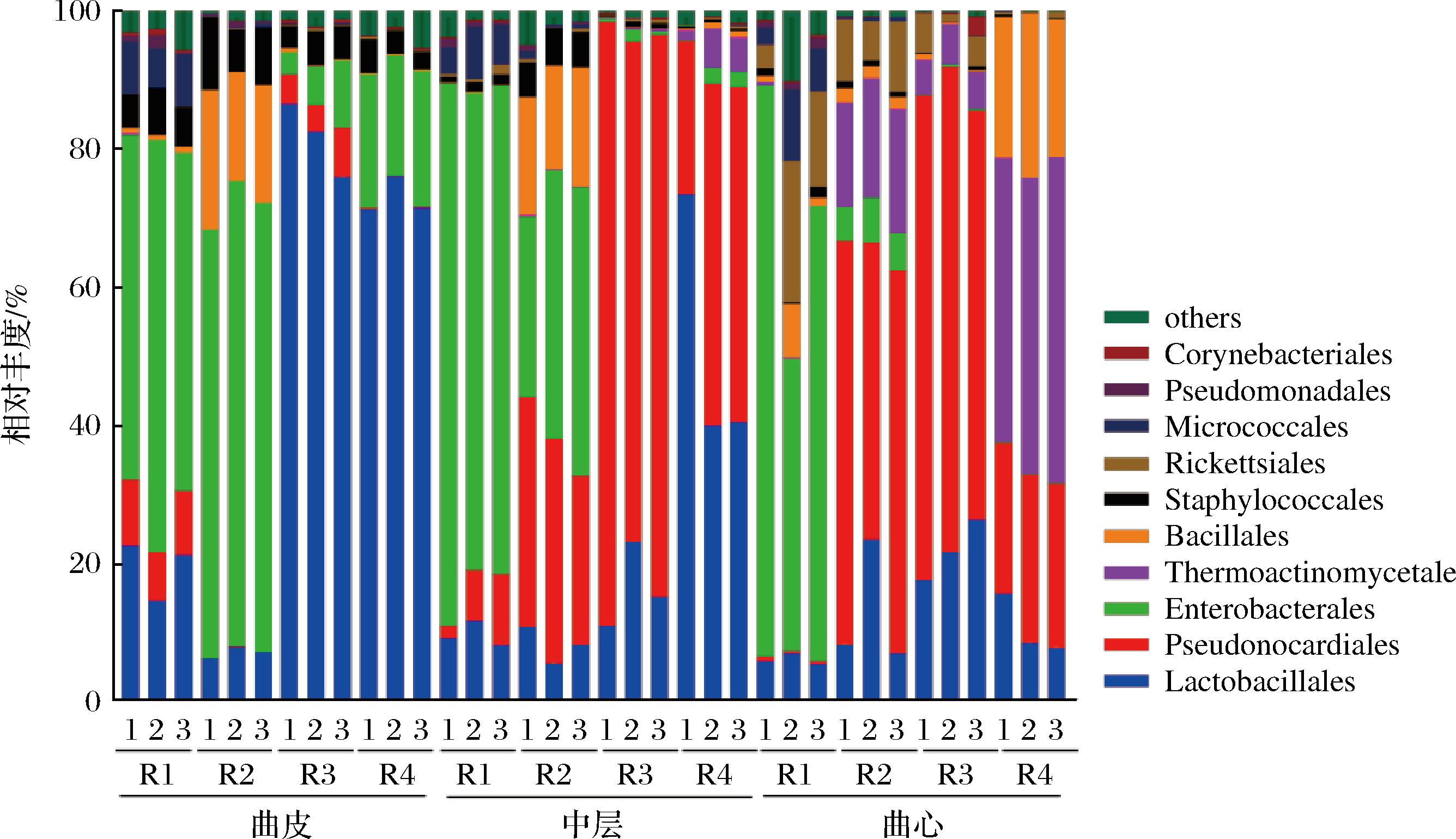
图2 不同层次大曲中细菌组成
Fig.2 The composition of bacteria in different layers of Daqu
注:R1~R4代表4个不同曲房,本图显示分类学水平为目水平。
在所有大曲样品中共检测到103个细菌属,基于已知数量内标菌添加的绝对定量方法来比较大曲3个层次之间的细菌微生物的总生物量(图3-a)。曲皮与中层的平均总生物量分别为(3.69±2.06)×108、(3.84±1.39)×108个/g,无显著差异。而曲心的总生物量[20.3×±8.47)×107个/g]相较于曲皮和中层分别降低了44.98%和47.13%(P<0.05)。在大曲发酵过程中,曲心部分的温度最高[8],推测高温是导致曲心中总生物量低的主要原因之一。
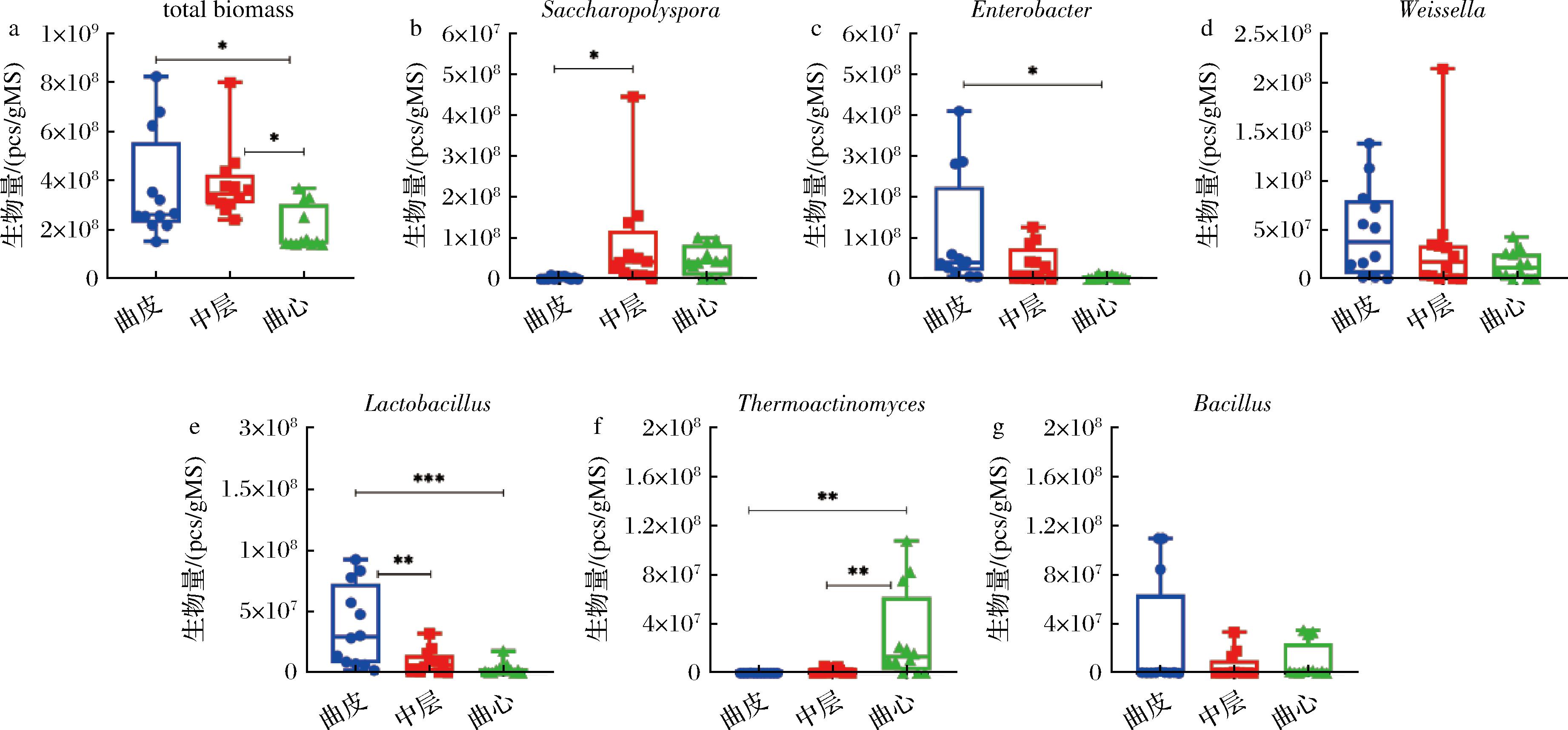
a-大曲不同层次的细菌总生物量;b~g-大曲中主要细菌的生物量变化
图3 成品大曲细菌生物量
Fig.3 Bacterial biomass of mature Daqu at genus level
注:本图显示分类学水平为属水平。
糖多孢菌属(Saccharopolyspora)属于假诺卡氏菌目(Pseudonocardiales),在大曲中层中的生物量显著高于曲皮(图3-b),在中层的含量[(8.37±11.8)×107个/g]为曲皮[(3.47±3.66)×106个/g]的24.14倍。有研究报道,糖多孢菌属(Saccharopolyspora)是小麦曲微生物中占主导地位,可产生酶、维生素、纤维素降解促进因子[9]。魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)和肠杆菌属(Enterobacter)均为产乳酸菌类群,此类菌属在发酵过程中生产的乳酸与乙醇被酯化生成风味物质乳酸乙酯[10]。虽然这三类菌为兼性厌氧菌或耐氧菌,其生长不依赖于氧气的供给,但由图3-c~图3-e可知,这三类菌属均在曲心中测定出的生物量最低。魏斯氏菌属(Weissella)在曲心的含量[(1.48±1.35)×107个/g]为曲皮含量[(4.79±4.40)×107个/g]的30.88%;乳杆菌属(Lactobacillus)在曲心的含量[(3.51±4.74)×106个/g]为曲皮含量[(3.84±3.14)×107个/g]的9.15%;肠杆菌属(Enterobacter)在曲心的含量[(4.08±4.30)×106个/g]为曲皮含量[(1.06±1.32)×108个/g]的3.86%。这表明温度可能为这三类产乳酸细菌生长的限制因素[11]。高温放线菌属(Thermoactinomyces)和芽孢杆菌属(Bacillus)在其他研究中被认为高温[(66±1) ℃]有利于菌株生长[12]。根据绝对定量的结果(图3-f、图3-g),高温放线菌属(Thermoactinomyces)在发酵温度最高的曲心含量[(2.95×±3.56)×107个/g],为中层含量[(1.59×±2.23)×106个/g]的18.49倍,为曲皮含量[(4.23±5.36)×104个/g]的695.96倍。然而,芽孢杆菌属(Bacillus)的生物量却没有观察到从曲皮到曲心的显著梯度变化趋势。这可能与高温放线菌属(Thermoactinomyces)是嗜热微生物有关,最适生长温度在60~80 ℃[13],因其独特的胞外酶结构导致这类微生物趋向在高温中生存[14]。芽孢杆菌属(Bacillus)微生物多为耐高温细菌,可以耐受高温环境但最适生长温度为28~37 ℃,同时芽孢杆菌属(Bacillus)是在有氧条件下生长更为旺盛的兼性厌氧微生物,大曲曲皮的氧含量高于曲心,从另一角度解释了曲皮中芽孢杆菌属(Bacillus)含量最高[(2.59±4.42)×107个/g][15]。
2.2 特香型大曲中不同层次的真菌群落组成与变化规律
在所有大曲样品中共检测到78个真菌属,其中酵母主要包括伊萨酵母属(Issatchenkia,平均值21.10%,分布范围0.06%~97.56%)、丝孢毕赤酵母属(Hyphopichia,平均值3.9%,分布范围0.00%~19.96%)、假丝酵母属(Candida,平均值3.27%,分布范围0.00%~26.20%)等;霉菌主要包括曲霉属(Aspergillus,平均值43.63%,分布范围0.06%~97.56%)、根毛霉属(Rhizomucor,平均值4.00%,分布范围0.00%~30.42%)、横梗霉属(Lichtheimia,平均值2.63%,分布范围0.04%~23.32%)等(图4)。

图4 不同层次大曲中真菌组成
Fig.4 The composition of fungi in different layers of Daqu.R1-R4 represent four bio-replicates at genus level
注:R1~R4代表4个不同曲房,本图显示分类学水平为属水平。
见如表1所示,酵母主要分布在曲皮和中层,曲心的酵母含量相对较低,如Issatchenkia、Hyphopichia、Saccharomycopsis、Pichia、Saturnispora、Wickerhamomyces和Cyberlindnera从曲皮到曲心呈现出降低趋势。伊萨酵母属(Issatchenkia)为曲皮的主要酵母类型,占真菌的40.19%(分布范围6.59%~74.56%)。与丝状真菌的分布情况不同,以伊萨酵母属(Issatchenkia)和丝孢毕赤酵母属(Hyphopichia)为主的酵母在曲皮中总平均丰度为50.11%(分布范围22.94%~74.80%),显著高于中层(平均值21.61%,分布范围0.97%~47.84%,P<0.01)和曲心(平均值3.27%,分布范围0.29%~6.77%,P<0.001)。
表1 成品大曲主要真菌在属水平的相对丰度变化
Table 1 The changes of relative abundance of dominant fungi in mature Daqu at genus level
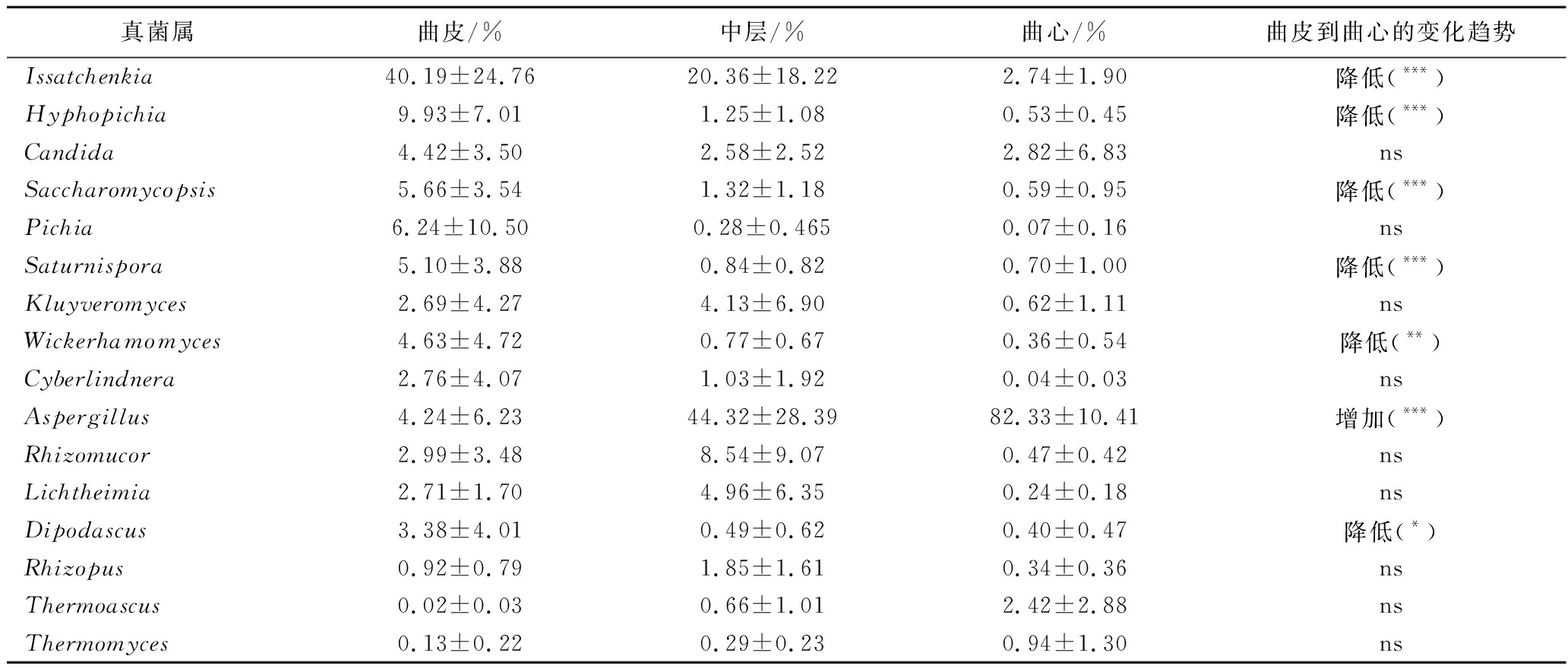
真菌属曲皮/%中层/%曲心/%曲皮到曲心的变化趋势Issatchenkia40.19±24.7620.36±18.222.74±1.90降低(***)Hyphopichia9.93±7.011.25±1.080.53±0.45降低(***)Candida4.42±3.502.58±2.522.82±6.83nsSaccharomycopsis5.66±3.541.32±1.180.59±0.95降低(***)Pichia6.24±10.500.28±0.4650.07±0.16nsSaturnispora5.10±3.880.84±0.820.70±1.00降低(***)Kluyveromyces2.69±4.274.13±6.900.62±1.11nsWickerhamomyces4.63±4.720.77±0.670.36±0.54降低(**)Cyberlindnera2.76±4.071.03±1.920.04±0.03nsAspergillus4.24±6.2344.32±28.3982.33±10.41增加(***)Rhizomucor2.99±3.488.54±9.070.47±0.42nsLichtheimia2.71±1.704.96±6.350.24±0.18nsDipodascus3.38±4.010.49±0.620.40±0.47降低(*)Rhizopus0.92±0.791.85±1.610.34±0.36nsThermoascus0.02±0.030.66±1.012.42±2.88nsThermomyces0.13±0.220.29±0.230.94±1.30ns
注:“ns”代表无数据。
与上述大部分酵母的层次分布不同,多种霉菌的层次分布显现出与酵母相反的变化趋势。曲霉属(Aspergillus)为各层次丰度最高的霉菌,在曲心占比为82.33%(分布范围72.41%~97.48%),为中层(平均占比44.32%,分布范围5.84%~90.22%)和曲皮(平均占比4.24%,分布范围0.06%~18.27%)的1.86倍和19.42倍(P<0.001)。
特香型大曲曲心中曲霉属(Aspergillus)比例高于酵母,可能原因在于曲霉菌丝体更容易在大曲深层基质中进行生长;而酵母的生长受到温度的限制,主要在浅层大曲基质中进行生长繁殖。
2.3 特香型大曲优势微生物的溯源分析
扩增子测序在所有样品(大曲、原料及环境样品)中共检测到220个细菌属和118个真菌属。大曲3个层次样品共检测到103个细菌属和78个真菌属,其中72个细菌属和62个真菌属可在制曲原料或环境样品中能检测到。
为了进一步分析大曲不同层次间微生物群落,本研究将大曲、原料及环境样品中相对丰度>0.5%的属定义为优势细菌属,得到其属水平信息(图5-a)。图5-a显示,所有样品中的细菌主要归属于17个属,且大曲、原料和环境中占据主要比例的细菌几乎均不同。原料中面粉检测到的细菌以魏斯氏菌属(Weissella,平均值47.23%,分布范围41.64%~51.29%)为主;在麦麸中检测到的细菌肠杆菌属(Enterobacter,平均值20.31%,分布范围16.15%~23.43%)的丰度最高;酒糟检测到的细菌属主要为芽孢杆菌属(Bacillus,平均值13.41%,分布范围7.03%~19.96%)。而环境样品中室内地面和室内屋顶中检测到丰度最高的细菌分别是糖多孢菌属(Saccharopolyspora,12.21%)和Inquilinus(38.85%)。而大曲主要细菌属为糖多孢菌属(Saccharopolyspora)、肠杆菌属(Enterobacter)、魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)、高温放线菌属(Thermoactinomyces)等。
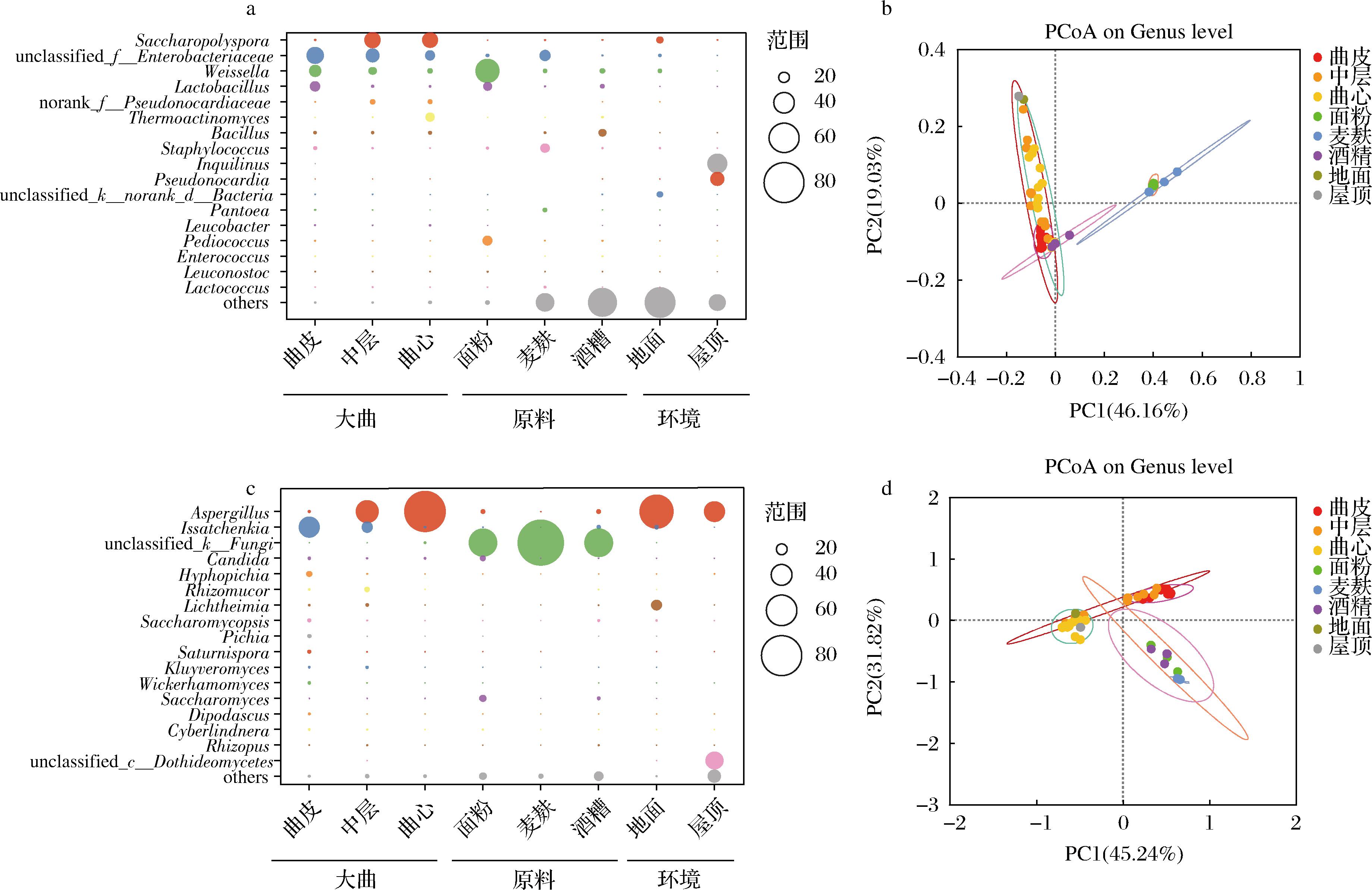
a-属水平大曲优势细菌分布(平均丰度>0.5%);b-基于weighted UniFrac距离的细菌主坐标分析(principal coordinate analysis,PCoA);c-属水平大曲优势真菌分布(平均丰度>0.8%);d-基于weighted UniFrac距离的真菌主坐标分析(PCoA)
图5 大曲、原料及环境样品微生物群落结构
Fig.5 Microbial community structure of Daqu、raw materials and environmental samples
根据上述丰度信息,可以推测大曲中优势细菌属来源:糖多孢菌属(Saccharopolyspora)部分来源于室内地面,肠杆菌属(Enterobacter)和葡萄球菌属(Staphylococcus)主要由麦麸带入,魏斯氏菌属(Weissella)、乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)等乳酸菌主要来源于面粉,芽孢杆菌属(Bacillus)主要来源于酒糟和麦麸,而室内屋顶检测出的细菌并未大量进入大曲制作过程。
在真菌方面,本研究将大曲、原料及环境样品中相对丰度>0.8%的属定义为优势真菌属(图5-c)。由图5-c可知,3种原料样品中的真菌以未鉴定出的真菌(unclassified_k__Fungi)为主,分别占55.40%(分布范围31.79%~81.71%)、92.00%(分布范围89.07%~93.70%)和55.88%(分布范围48.02%~64.90%),表明扩增子测序技术对真菌的判定分辨率较为有限。环境样品中室内地面和室内屋顶中均以曲霉属(Aspergillus)为主,相对丰度分别为67.54%和40.27%。大曲中的曲霉属(Aspergillus)来源于室内环境(包括地面和屋顶),横梗霉属(Lichtheimia)则主要由发酵室内地面提供。伊萨酵母属(Issatchenkia)主要来源于酒糟和室内地面。面粉为制曲过程提供了假丝酵母属(Candida)和酵母属(Saccharomyces)。而麦麸中的主要真菌(unclassified_k__Fungi,未能鉴定到属水平,界水平为fungi)并未在大曲中检出。
为了更直观地说明大曲与原料及环境中微生物的关系,基于weighted UniFrac 距离的主坐标分析(principal coordinate analysis,PCoA)进一步表征它们之间的关系(图5-b和图5-d):曲皮与制曲原料的细菌群落距离较近,中层与制曲环境的细菌群落较近;曲心与制曲环境的真菌群落较近,而制曲原料与其他样品真菌群落距离较远。综上,特香型大曲的细菌主要来源于制曲原料,而真菌主要来源于制曲环境。本研究的结果与DU等[16]、周天慈等[10]对浓香型大曲溯源结果一致,中高温大曲的制造环境是大曲真菌群落的主要来源,而原料则是细菌群落的主要来源。
2.4 特香型大曲不同层次风味物质含量比较分析
运用HS-SPME-GC-MS技术,在特香型大曲中共检测到80种挥发性化合物。将主要化合物分为五类,包括24种醇类、14种醛酮类、9种吡嗪类、10种醚酚类和5种酯类。根据各类化合物的浓度绘制柱状图(图6-a),曲心中醇类、醛酮类、吡嗪类和醚酚类的总含量均大于曲皮和中层(P<0.001),中层中醇类和醛酮类化合物的总含量比曲皮中的有极其显著增加(P<0.001)。曲心的醇类含量(0.65±0.01) μg/g是中层含量(0.54±0.01) μg/g的1.20倍,是曲皮含量(0.43±0.01) μg/g的1.52倍。曲心的醛酮类含量(0.65±0.02) μg/g是中层含量(0.48±0.02) μg/g的1.37倍,是曲皮含量(0.31±0.01) μg/g的2.07倍。曲心的吡嗪类含量(0.22±0.01) μg/g是中层含量(0.16±0.01) μg/g的1.36倍,是曲皮含量(0.16±0.01) μg/g的1.33倍。曲心的醚酚类含量(0.46±0.03) μg/g是中层含量(0.13±0.01) μg/g的3.43倍,是曲皮含量(0.12±0.01) μg/g的3.81倍。而对于吡嗪类和醚酚类风味物质,曲皮和中层的含量差异较小,吡嗪类含量分别为(0.16±0.01)、(0.16±0.01) μg/g,醚酚类含量分别为(0.12±0.01)、(0.13±0.01) μg/g。酯类化合物与其他化合物显示出了不同的分布情况,曲皮中酯类含量(0.07±0.01) μg/g是曲心含量(0.04±0.001) μg/g的1.62倍(P<0.05)。
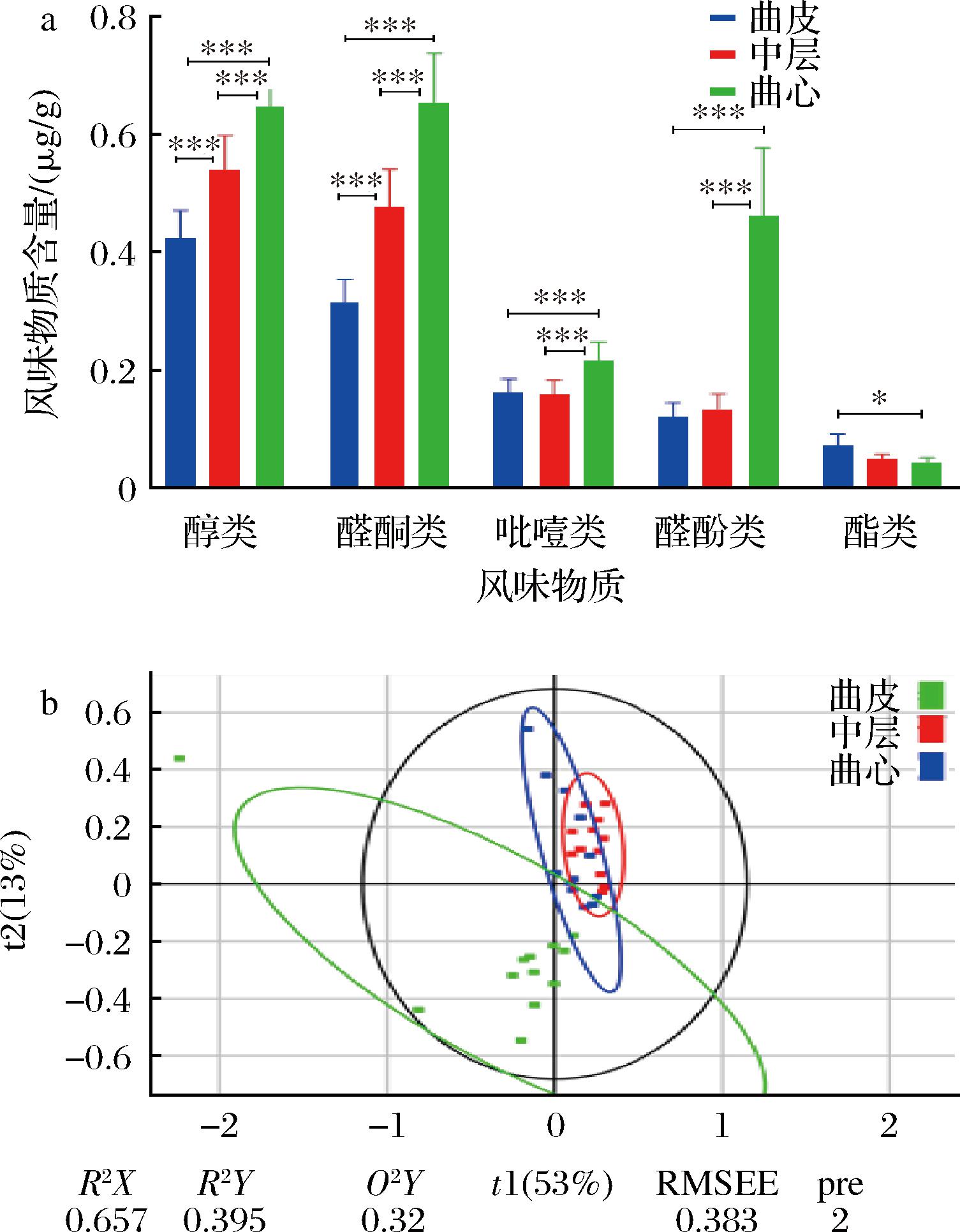
a-大曲中主要风味物质的相对含量;b-风味物质PLS-DA评分图
图6 成品大曲不同层次的风味物质分析
Fig.6 Analysis of flavor substances in different levels of mature Daqu
利用偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)分析特香型大曲3个层次的风味物质组成的相似性,PLS-DA评分图(图6-b)显示,曲心点较为分散,与曲皮和中层点相差较远,这推测是由于曲心风味物质含量差异与曲皮和中层较大导致,而曲皮和中层距离较近,存在部分重叠。风味物质含量和相关性分析表明,曲心的风味物质含量特征显著不同于曲皮和中层,推测曲心的高丰度微生物(如高温放线菌属)对曲心风味物质的形成具有重要作用。
利用Spearman相关系数分析大曲中微生物与主要风味物质间的相互作用(图7)。由图7可知,醇类和吡嗪类物质与高温放线菌属(Thermoactinomyces)和曲霉属(Aspergillus)呈显著正相关,与酵母呈负相关;酯类物质与以伊萨酵母属(Issatchenkia)、丝孢毕赤酵母属(Hyphopichia)和复膜孢酵母属(Saccharomycopsis)为主的酵母呈显著正相关,与高温放线菌属(Thermoactinomyces)和曲霉属(Aspergillus)呈显著负相关。根据之前的研究,高温放线菌属(Thermoactinomyces)可产生多种耐高温酶系[15],包括α-淀粉酶、蛋白酶等,可促进蛋白降解产生多种氨基酸,为美拉德反应提供前体物质,对大曲风味物质的形成可能具有重要作用。此外,高温放线菌形态虽与放线菌纲微生物(Actinomycetia)类似,但在分类学上却属于芽孢杆菌纲(Bacilli),而芽孢杆菌类群是重要的吡嗪合成微生物,是解析高温放线菌对吡嗪产生呈正相关的科学依据。而以伊萨酵母属(Issatchenkia)、丝孢毕赤酵母属(Hyphopichia)为主的酵母被证明与香气化合物,尤其是大多数酯类化合物呈显著正相关[17],也与上述分析结果基本一致。

图7 大曲微生物群落与风味物质的相关性分析
Fig.7 Correlation analysis of microbial community and flavor substances in Daqu
注:实线代表正相关,虚线代表负相关。
3 结论与讨论
本研究采用扩增子测序技术和HS-SPME-GC-MS分别揭示了特香型大曲3个层次的微生物量比关系和挥发性风味物质含量特征。结果表明,曲心的细菌总生物量为曲皮和中层的50%左右。不同层次大曲样品的细菌和真菌群落结构差异均显著不同,魏斯氏菌属、乳杆菌属和肠杆菌属为曲皮的主要细菌类型,高温放线菌属为曲心的绝对优势细菌,而糖多孢菌属在中层和曲心含量远高于曲皮。伊萨酵母属和丝孢毕赤酵母属为曲皮的主要酵母,曲霉属为曲心的优势霉菌。风味物质分析结果表明,曲心的醇类、醛酮类、吡嗪类和醚酚类的总含量均高于曲皮和中层,而曲皮的酯类的总含量高于曲心。微生物溯源分析表明成品曲的细菌主要来源于制曲原料,而真菌主要来源于制曲环境。
特香型大曲与浓香型大曲同为中高温大曲,本研究的特香型大曲曲心和浓香型包包曲均具有较高丰度的高温放线菌属微生物[18]。中高温大曲的曲心微生物组成与酱香型酿造用的高温大曲微生物组成具有一定的相似性,如高温放线菌属微生物起着关键作用[19]。对于真菌而言,本研究与DU等[16]、周天慈等[10]发现制曲环境为真菌的主要来源,环境和制曲工艺(温度、水分)等对中高温大曲的真菌组成具有较大的影响,如张倩等[18]报道浓香型包包曲的曲皮和曲心均含有较高丰度的嗜热子囊菌属,而周天慈等[6]报道平板中高温大曲的主要真菌为曲霉属和根霉属。清香型大曲因制曲温度的原因,曲心的细菌微生物多样性相比特香型大曲曲心的丰富度较低[20],曲皮的优势真菌为复膜孢酵母属,曲心的曲霉属相对比例显著增加[21]。可见,原料、制曲工艺、环境对大曲微生物组成均具有较大影响。
综上,本研究解析了特香型大曲不同层次细菌和真菌及挥发性风味物质随层次的变化规律,结果表明曲心优势微生物(如高温放线菌属)的有效生长对大曲质量可能具有重要的影响,为优化特香型制曲工艺,进而运用生态发酵技术提升大曲品质提供了参考。
[1] 刘婷, 陈可丹, 黄冰静, 等.不同生产环境对特香型大曲的影响[J].中国酿造, 2019, 38(7):80-84.
LIU T, CHEN K D, HUANG B J, et al.Effect of different production environment on Te-flavour Daqu[J].China Brewing, 2019, 38(7):80-84.
[2] JIN Y, LI D Y, AI M, et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Research International, 2019, 121:422-432.
[3] 周斐成, 吴生文, 朱庆圣, 等.特香型大曲发酵过程中曲块不同部位理化指标及主要酶系动态分析[J].中国酿造, 2019, 38(4):58-64.
ZHOU F C, WU S W, ZHU Q S, et al.Physicochemical indexes and dynamic analysis of main enzymes in different layers of Te-flavor Daqu during fermentation process[J].China Brewing, 2019, 38(4):58-64.
[4] 殷海艳, 陆步诗, 李新社, 等.特香型大曲培养条件关键技术优化研究[J].酿酒科技, 2022(9):46-51.
YIN H Y, LU B S, LI X S, et al.Optimization of key technology of the production of texiang Daqu[J].Liquor-Making Science and Technology, 2022(9):46-51.
[5] CAI W C, XUE Y A, WANG Y R, et al.The fungal communities and flavor profiles in different types of high-temperature Daqu as revealed by high-throughput sequencing and electronic senses[J].Frontiers in Microbiology, 2021, 12:784651.
[6] 周天慈, 孙佳, 朱雨婕, 等.中高温大曲制作过程中火圈真菌菌群演替规律及其风味功能[J].微生物学通报, 2021, 48 (11):4178-4189.
ZHOU T C, SUN J, ZHU Y J, et al.Fungal community succession and flavor function in fire cycle during the production of medium-high temperature Daqu[J].Microbiology China, 2021, 48(11):4178-4189.
[7] JI M, DU H, XU Y.Structural and metabolic performance of p-cresol producing microbiota in different carbon sources[J].Food Research International, 2020, 132:109049.
[8] TIAN N, GUO X, WANG M Z, et al.Bacterial community diversity of shilixiang baijiu Daqu based on metagenomics[J].Journal of Food Biochemistry, 2020, e13410(10):e13410.
[9] ZHANG J, LIU S P, SUN H L.Metagenomics-based insights into the microbial community profiling and flavor development potentiality of baijiu Daqu and huangjiu wheat Qu[J].Food Research International, 2022, 152:110707.
[10] 周天慈, 何宏魁, 周庆伍, 等.基于高通量扩增子测序技术解析中高温大曲微生物来源[J].食品与发酵工业, 2021, 47(16):66-71.
ZHOU T C, HE H K, ZHOU Q W, et al.Exploring the source of microbiota in medium-high temperature Daqu based on high-throughput amplicon sequencing[J].Food and Fermentation Industries, 2021, 47(16):66-71.
[11] ZHU C T, CHENG Y X, ZUO Q C, et al.Exploring the impacts of traditional crafts on microbial community succession in Jiang-flavored Daqu[J].Food Research International, 2022, 158:111568.
[12] MEHTA R, SINGHAL P, SINGH H, et al.Insight into thermophiles and their wide-spectrum applications[J].3 Biotech, 2016, 6(1):81.
[13] ESUDER-RODR GUEZ J J, DECASTRO M E, CERD
GUEZ J J, DECASTRO M E, CERD N M E, et al.Cellulases from thermophiles found by metagenomics[J].Microorganisms, 2018, 6(3):66.
N M E, et al.Cellulases from thermophiles found by metagenomics[J].Microorganisms, 2018, 6(3):66.
[14] KANG J M, CHEN X X, HAN B Z, et al.Insights into the bacterial, fungal, and phage communities and volatile profiles in different types of Daqu[J].Food Research International, 2022, 158:111488.
[15] YAO S, LIU Y, ZHANG M J, et al.Thermoactinomyces daqus sp.nov., a thermophilic bacterium isolated from high-temperature Daqu[J].International Journal of Systematic and Evolutionary Microbiology, 2014, 64(Pt1):206-210.
[16] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40.
[17] WANG H Y, XU Y.Effect of temperature on microbial composition of starter culture for Chinese light aroma style liquor fermentation[J].Letters in Applied Microbiology, 2015, 60(1):85-91.
[18] 张倩, 韩保林, 李子健, 等.浓香型白酒包包曲微生物种群多样性及形成机制[J].食品与发酵工业, 2021, 47(18):99-106.
ZHANG Q, HAN B L, LI Z J, et al.Diversity and formation mechanism of the microflora in strong flavor Baijiu Baobaoqu[J].Food and Fermentation Industries, 2021, 47(18):99-106.
[19] 李豆南, 黄魏, 王晓丹, 等.酱香型大曲中高温放线菌的筛选及风味成分分析[J].食品科学, 2018, 39(6):171-176.
LI D N, HUANG W, WANG X D, et al.Identification and flavor profile of a thermoactinomycetaceae strain separated from moutai-flavor Daqu[J].Food Science, 2018, 39(6):171-176.
[20] 刘忠军, 冯廷闯, 刘继明, 等.后火低温大曲曲皮和曲心细菌多样性及基因功能预测[J].食品研究与开发, 2022, 43(21):176-183.
LIU Z J, FENG T C, LIU J M, et al.Bacterial diversity and gene functional prediction in different parts of houhuo low-temperature Daqu[J].Food Research and Development, 2022, 43(21):176-183.
[21] 席啦, 孔祥聪, 倪慧, 等.不同部位后火低温大曲真菌群落结构比较分析[J].食品研究与开发, 2023, 44(2):177-182.
XI L, KONG X C, NI H, et al.Fungal diversity in different parts of Houhuo low-temperature Daqu[J].Food Research and Development, 2023, 44(2):177-182.