金鲳鱼(Trachinotus ovatus)是中国五大海水养殖经济鱼类之一,富含蛋白质等多种营养物质[1]。但是由于金鲳鱼含有较高的水分含量以及自身所含酶类使蛋白质降解成小分子产物,这有助于微生物快速繁殖发生腐败变质,通过杀菌技术可以延缓金鲳鱼品质劣变,延长货架期[2]。目前食品中常见的杀菌技术主要包括热杀菌技术和非热杀菌技术。传统热杀菌技术虽然能够有效杀灭食品中的微生物,但高温也会对食品的感官特性和风味等产生不良影响[3]。
低温等离子体(cold plasma,CP)被称为固态、液态、气态之外的物质第四态,是由活性物质(活性氮和活性氧等)、带电粒子、自由电子等组成的一种电离气体[4]。CP作为新型非热加工技术,具有作用温度低、不含化学物质、环保、操作成本低等优点,在杀灭各类常见微生物、延长食品货架期、替代食品添加剂等方面具有重要作用[5-7]。
目前,CP已广泛应用于食品保鲜,如亚洲鲈鱼、带鱼、南美白对虾以及猪肉等[7-8]。本研究前期发现,CP处理金鲳鱼可以有效抑制腐败微生物的生长,且电压越高,抑菌效果越好,但过高电压会导致肌肉品质劣变。这可能是因为CP体系中含有的活性氮、活性氧等物质使蛋白发生氧化,改变蛋白质结构特性,进而影响食品品质[8]。PÉREZ-ANDRÉS等[9]发现CP处理可以加速鲭鱼中羰基的形成,造成蛋白质不可逆损伤。但也有研究指出,对蛋白质进行适度氧化修饰,可能会改善肉品的加工特性和品质,如提升肉品在人体的消化吸收率、产生特定风味以及提升嫩度和保水性等[10]。
因此,本研究以金鲳鱼为研究对象,探究不同低温等离子体电压(10、20、30 kV)处理对金鲳鱼肌原纤维蛋白(myofibrillar proteins,MP)的Ca2+-ATP酶活性、肌原纤维小片化指数(myofibrillary fragmentation index,MFI)、三氯乙酸(trichloroacetic acid,TCA)溶解肽、总氨基酸含量、二级结构变化(红外光谱)、三级结构变化(表面疏水性、紫外吸收光谱)等的影响,结合SDS-PAGE电泳分析,综合评价CP处理对金鲳鱼肉MP结构特性的影响,以期为金鲳鱼冰鲜产业提供参考。
1 材料与方法
1.1 材料与试剂
金鲳鱼,鲜活,体表无伤,体质量为(500±50) g,湛江市霞山水产品批发市场。
Tris-缓冲液(1 mol/L)、10×磷酸缓冲盐溶液(phosphate buffered saline,PBS)、PM2610蛋白marker,北京酷来搏科技有限公司;溴酚蓝(bromophenol blue,BPB,分析纯),上海麦克林生化科技有限公司;溴化钾(红外光谱测定用),上海安谱实验科技股份有限公司;A070-4 Ca2+-ATP酶测试剂盒,南京建成生物工程研究所;BC1575氨基酸含量检测试剂盒、PC0030 Lowry蛋白浓度测定试剂盒,北京索莱宝科技有限公司;P0006 Bradford蛋白浓度测定试剂盒,上海碧云天生物技术公司;其他试剂均为国产分析纯。
1.2 仪器与设备
CTP-2000S型等离子体处理装置,南京苏曼等离子科技有限公司;T25型高速均质机,德国IKA集团;Varioskan Flash型酶标仪,美国Thermo Fisher公司;3-30KS型高速冷冻离心机,德国Sigma Laborzentrifugen公司;TENSOR 27型傅里叶变换红外光谱仪,德国Bruker公司;Cary 60型紫外分光光度计,美国Agilent公司;GelDoc EZ G型凝胶成像仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1 样品处理
金鲳鱼充氧运输至实验室后冰浴猝死,洁净水洗净,拭干,取背部肌肉,去骨、皮,切成4 cm×3 cm×1 cm块状(大约20 g)。将所有样品随机分为4组,一组为未处理组(0 kV),其余3组在频率9 kHz、极板间距20 mm、处理时间45 s的条件下对鱼肉进行不同CP电压处理(10、20、30 kV)。
1.3.2 肌原纤维蛋白的提取
参考LI等[11]的方法略有修改。向2 g搅碎的鱼肉中加入20 mL 20 mmol/L Tris-缓冲液A(0.05 mol/L KCl,pH 7.0),冰水浴10 000 r/min均质30 s后,在4 ℃下10 000 r/min离心15 min,弃上清液,收集沉淀,重复2次。向得到的沉淀中加入20 mL 20 mmol/L Tris-缓冲液B(0.6 mol/L KCl,pH 7.0),相同条件均质后静置1 h,在4 ℃下10 000 r/min离心15 min后过滤,得到的上清液即为MP,浓度用双缩脲法测定。
1.3.3 Ca2+-ATP酶活性测定
Ca2+-ATP酶活性用测试剂盒测定,ATP酶分解ATP产生ADP和磷,通过测定磷的量来计算Ca2+-ATP酶活性,结果表示为μmol Pi/(mg prot·h)。
1.3.4 肌原纤维小片化指数测定
参考MOTTER等[12]的方法,采用Bradford法将调节MP溶液质量浓度为0.5 mg/mL,在540 nm处测定MP溶液的吸光度。计算如公式(1)所示:
MFI=A540×150
(1)
1.3.5 TCA溶解肽测定
参考SAENGSUK等[13]的方法略有修改。向2 g搅碎的鱼肉中加入18 mL 5%的TCA溶液,冰水浴下12 000 r/min均质1 min,静置1 h后在4 ℃下10 000 r/min离心10 min,测定上清液中酪氨酸(tyrosine,Tyr)的含量,结果表示为μmol Try/g肉。
1.3.6 总氨基酸含量测定
氨基酸含量用试剂盒方法进行测定,氨基酸的α-氨基与水合茚三酮反应产生在570 nm处有特征吸收峰的蓝紫色化合物,通过测定其含量来计算氨基酸含量,结果表示为μmol/g肉。
1.3.7 傅里叶变换红外光谱
参考蓝蔚青等[14]的方法略有修改。将MP溶液冷冻干燥制成冻干粉末。将冻干粉与溴化钾(1∶150,质量比)混合,混匀、研磨、压片,进行傅里叶变换红外光谱扫描。参数为:重复扫描64次,分辨率为4 cm-1,在400~4 000 cm-1进行扫描。
1.3.8 表面疏水性测定
参考WANG等[15]的方法略有修改。向2 g搅碎的鱼肉中加入20 mL 20 mmol/L PBS缓冲液(pH 6.0),冰水浴下12 000 r/min均质1 min,静置1 h,调整蛋白质量浓度至5 mg/mL。取1 mL稀释后的溶液加入200 μL 1 mg/mL BPB,避光混匀10 min后 4 ℃下4 700 r/min离心15 min,取上清液,稀释10倍,于595 nm处测定吸光度,记为A1。同时以PBS溶液代替蛋白溶液重复上述操作,记为A0,结果以BPB结合量表示,计算如公式(2)所示:
BPB结合量![]()
(2)
1.3.9 紫外吸收光谱
调节MP质量浓度为0.5 mg/mL,进行紫外光谱扫描。参数为扫描速度为600 nm/min,间隔为1 nm,在270~350 nm进行扫描。
1.3.10 SDS-PAGE电泳实验
调节MP质量浓度为1 mg/mL,与上样缓冲液(5×)以体积比4∶1混合,沸水浴6 min。冷却后使用15%分离度的胶在非还原条件下进行SDS-PAGE分析,上样量为15 μL,电压120 V。结束后利用考马斯亮蓝 G-250进行染色2 h,再使用脱色液V(醋酸)∶V(乙醇)∶V(水)=2∶3∶5,脱色至条带清晰并进行成像分析。
1.4 数据分析
试验重复3次,试验结果用平均值±标准差表示;用JMP16 pro软件对数据进行单因素方差分析,并用Tukey SD多重评估差异显著性,95%置信区间为P<0.05;采用Origin 2021b软件绘图。
2 结果与分析
2.1 CP对金鲳鱼肉Ca2+-ATP酶活性的影响
Ca2+-ATP酶活性用来评估肌球蛋白分子完整性,从而反映蛋白质变性程度,Ca2+-ATP酶活性越高,蛋白质结构越稳定[16]。由图1可知,未处理组Ca2+-ATP酶活性为0.4 μmol Pi/(mg prot·h),但是随着处理电压的增加,Ca2+-ATP酶活性显著下降(P<0.05),在30 kV时降至0.23 μmol Pi/(mg prot·h),这表明肌球蛋白分子结构发生了破坏。肌球蛋白头部的活性巯基对激活Ca2+-ATP酶的活性具有重要作用,随着CP处理电压的升高,粒子碰撞更为强烈,产生的活性物质如![]() 和H2O2等浓度上升,使其构象发生改变,进而引起Ca2+-ATP酶活性降低[17]。
和H2O2等浓度上升,使其构象发生改变,进而引起Ca2+-ATP酶活性降低[17]。
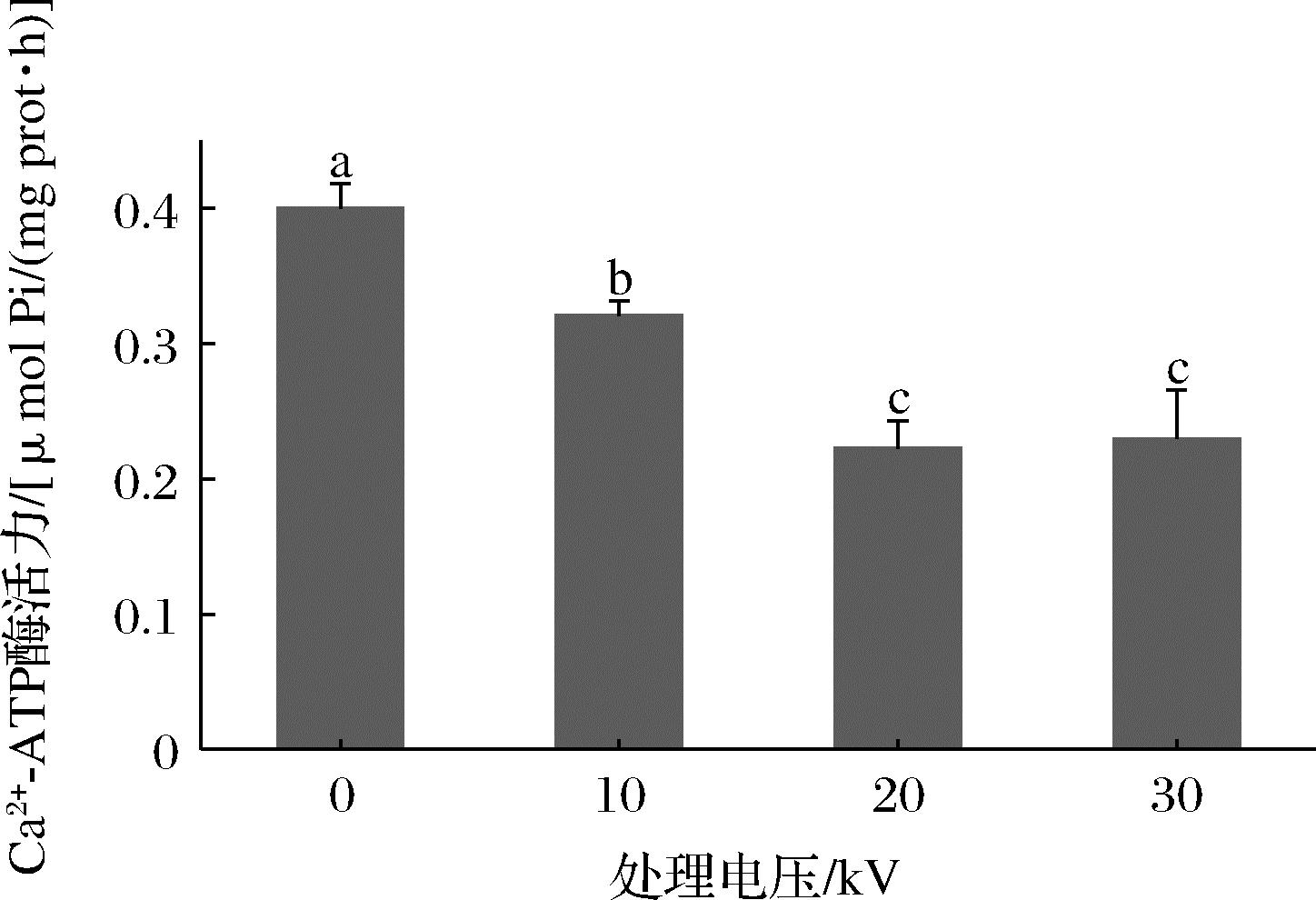
图1 不同低温等离子体电压处理对金鲳鱼Ca2+-ATP酶活性的影响
Fig.1 Effect of different CP voltage treatments on Ca2+-ATP ase activity of golden pompano
注:不同小写字母表示组间显著性差异(P<0.05)(下同)。
2.2 CP对金鲳鱼肉MFI的影响
MFI反映肌原纤维及其骨架蛋白完整度,MFI值越大,则MP内部结构破坏越严重[18]。由图2可知,当CP电压≤ 20 kV时,MFI与未处理组无显著差异,这可能是由于CP在较低电压时产生的活性物质(活性氮和活性氧等)不足以使金鲳鱼肌原纤维及其骨架严重破坏。但当电压为30 kV时,MFI显著升高(P<0.05),是未处理组的1.23倍,这可能是由于CP产生的活性物质(活性氮和活性氧等)以及带电粒子导致肌节中z线破坏,肌原纤维间隙变大,破坏鱼肉蛋白质的完整性,从而增大了MFI[19]。唐玲玲[20]研究了CP处理后凡纳滨对虾的MFI,发现其MFI也随着电压的升高的而增加,这与CP产生活性粒子对MP的轰击有关。同时,MFI也是肉嫩度的一种标志[19],CP处理增加了MP降解的可能性,通过破坏MP紧密结构,提高肌肉嫩度,使肉制品具有更好的口感。
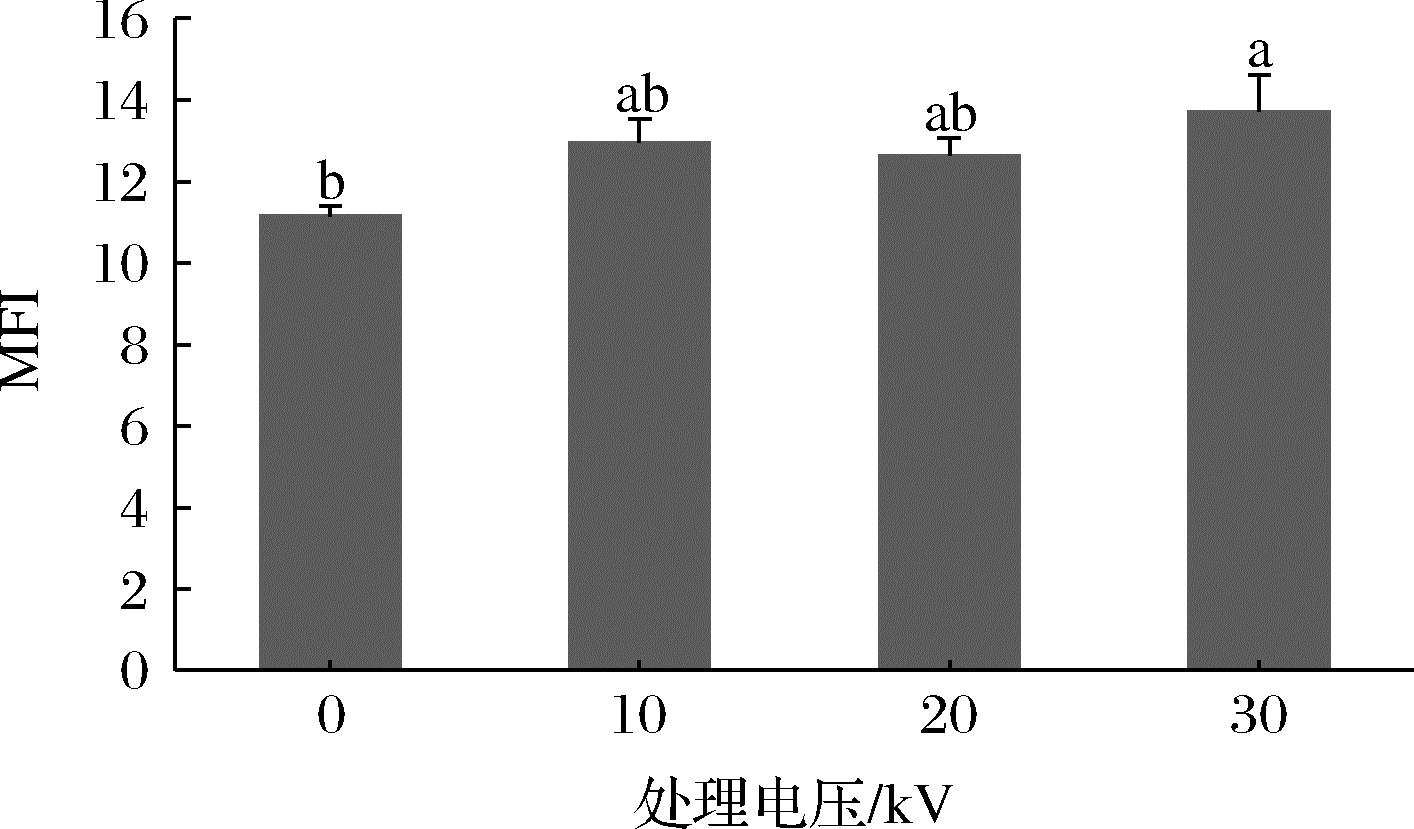
图2 不同低温等离子体电压处理对金鲳鱼肌原纤维小片化指数(MFI)的影响
Fig.2 Effect of different CP voltage treatments on MFI of golden pompano
2.3 CP对金鲳鱼肉TCA溶解肽的影响
TCA溶解肽作为鱼类蛋白质降解的指标,包括小肽、游离氨基酸和其他非蛋白含氮物质(如嘧啶、吡啶和核酸等)[13]。CP处理对金鲳鱼肉TCA溶解肽的影响如图3所示。未处理组TCA溶解肽含量为0.80 μmol Tyr/g肉,随处理电压的上升,TCA溶解肽显著升高(P<0.05),30 kV组比未处理组升高0.37 μmol Tyr/g肉,说明CP处理促使蛋白质发生降解和变性。这与OLATUNDE等[21]的研究相一致,CP处理后鲈鱼片TCA溶解肽含量因蛋白质氧化发生降解而上升,经过不同处理气体的CP(A:90% Ar2和10% O2;B:60% CO2,30% Ar2,10% O2)处理后TCA溶解肽升高0.5~0.7 μmol Tyr/g肉(P<0.05)。这可能是由于CP产生的活性物质(活性氮和活性氧等)以及带电粒子使MP发生氧化和降解,从而导致小肽、游离氨基酸和其他非蛋白含氮物质含量增加[22]。
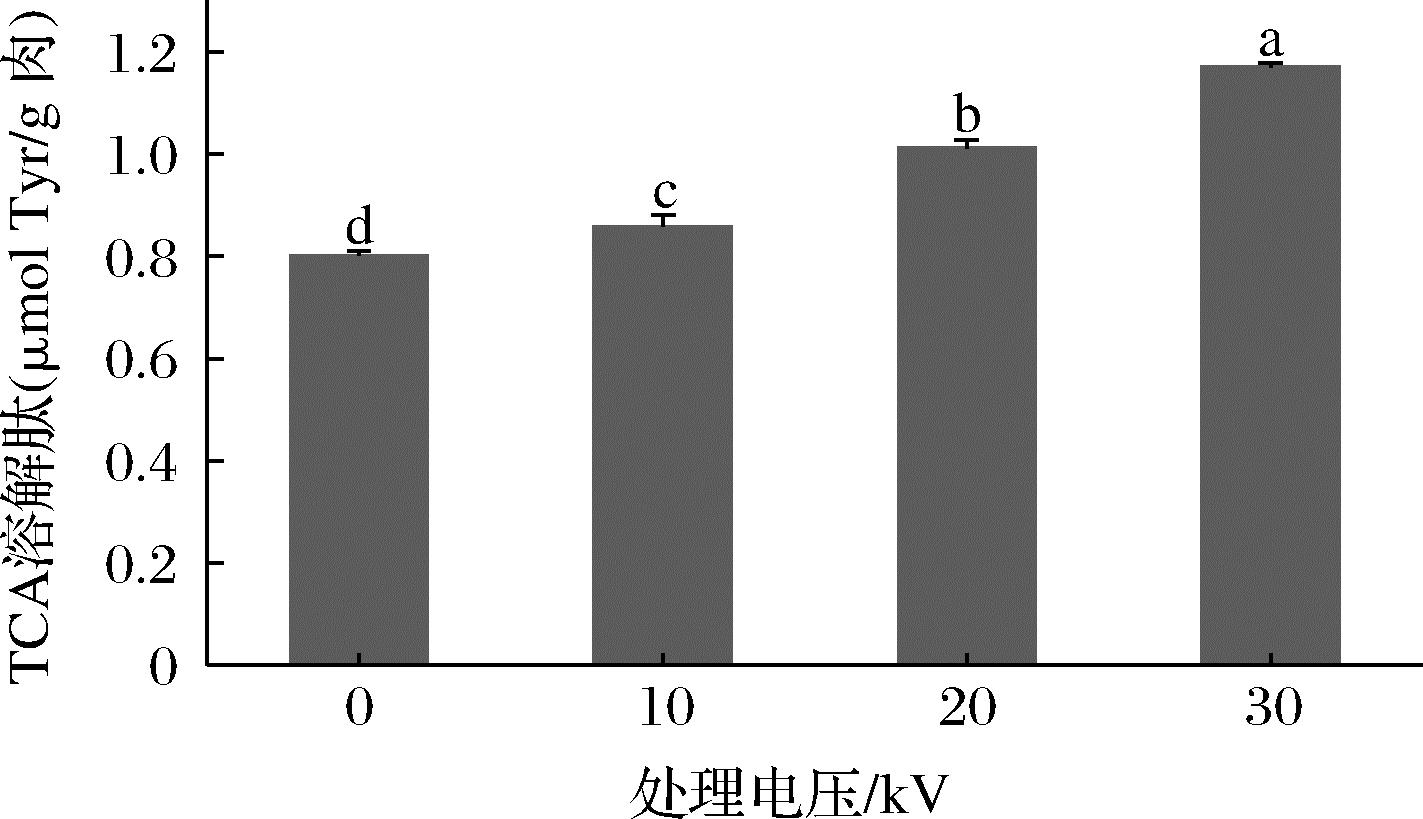
图3 不同低温等离子体电压处理对金鲳鱼TCA溶解肽的影响
Fig.3 Effect of different CP voltage treatments on TCA-soluble peptide of golden pompano
2.4 CP对金鲳鱼肉总氨基酸含量的影响
氨基酸含量的变化一定程度上可以反映蛋白质的变性和降解情况[20]。由图4可知,CP处理促使总氨基酸含量增加。但是当电压低于20 kV时,总氨基酸含量与未处理组差异不显著,而电压达到30 kV时,总氨基酸含量显著增加(P<0.05)。这与LIN等[23]研究相似,他们发现生腌泥螺的总氨基酸含量经CP处理后增加,这可能是由于CP产生的活性粒子与蛋白质或者多肽等作用,使其发生变性。虽然总氨基酸含量增多,证明蛋白质发生一定程度的降解,但是作为食品中的营养元素,氨基酸种类和数量能够影响食品的风味。LIN等[23]发现了CP处理后泥螺的谷氨酸、天冬氨酸、甘氨酸、苏氨酸、丝氨酸等含量显著增加,其中谷氨酸、天冬氨酸作为重要的鲜味来源,有助于泥螺产生特殊风味。综上,CP处理虽然会引起蛋白质氧化,但也有改善金鲳鱼风味的潜在可能性。结合图2和图3,CP处理一定程度上增加了小肽以及游离氨基酸等具有功能特性的物质的含量。虽然,这些较低分子质量的物质不利于贮藏,但是将处理电压控制在合理范围内(≤20 kV),既有改善品质的可能性,又能防止过度氧化带来的品质劣化。

图4 不同低温等离子体电压处理对金鲳鱼氨基酸总量的影响
Fig.4 Effect of different CP voltage treatments on total amino acid content of golden pompano
2.5 CP对金鲳鱼肉蛋白质二级结构的影响
蛋白质的功能特性主要由其二级结构决定,主要包括α-螺旋、β-折叠、β-转角和无规卷曲等。红外光谱特征峰强度可以反映蛋白质的二级结构变化[14]。特征峰主要包括酰胺Ⅰ带(1 600~1 700 cm-1),由N—H弯曲振动和C—N拉伸振动引起;酰胺Ⅱ带(1 500~1 600 cm-1),由羰基C![]() O和双键伸缩振动引起;酰胺Ⅲ带(1 220~1 330 cm-1),由N-H弯曲振动和C—N拉伸振动引起;以及由C—H伸缩振动引起的2 929 cm-1和O—H伸缩振动引起的3 296 cm-1处的单强峰[14,24]。如图5所示,与未处理组相比,CP处理组没有出现新峰,这表明MP中没有出现新的化合物。且随着处理电压的上升,红外光谱中特征峰强度没有明显变化,表明金鲳鱼MP二级结构变化不明显。虽然CP处理产生的活性物质以及带电粒子等会造成一定程度的蛋白质变性,但由于处理时间短,变化极其微小。
O和双键伸缩振动引起;酰胺Ⅲ带(1 220~1 330 cm-1),由N-H弯曲振动和C—N拉伸振动引起;以及由C—H伸缩振动引起的2 929 cm-1和O—H伸缩振动引起的3 296 cm-1处的单强峰[14,24]。如图5所示,与未处理组相比,CP处理组没有出现新峰,这表明MP中没有出现新的化合物。且随着处理电压的上升,红外光谱中特征峰强度没有明显变化,表明金鲳鱼MP二级结构变化不明显。虽然CP处理产生的活性物质以及带电粒子等会造成一定程度的蛋白质变性,但由于处理时间短,变化极其微小。
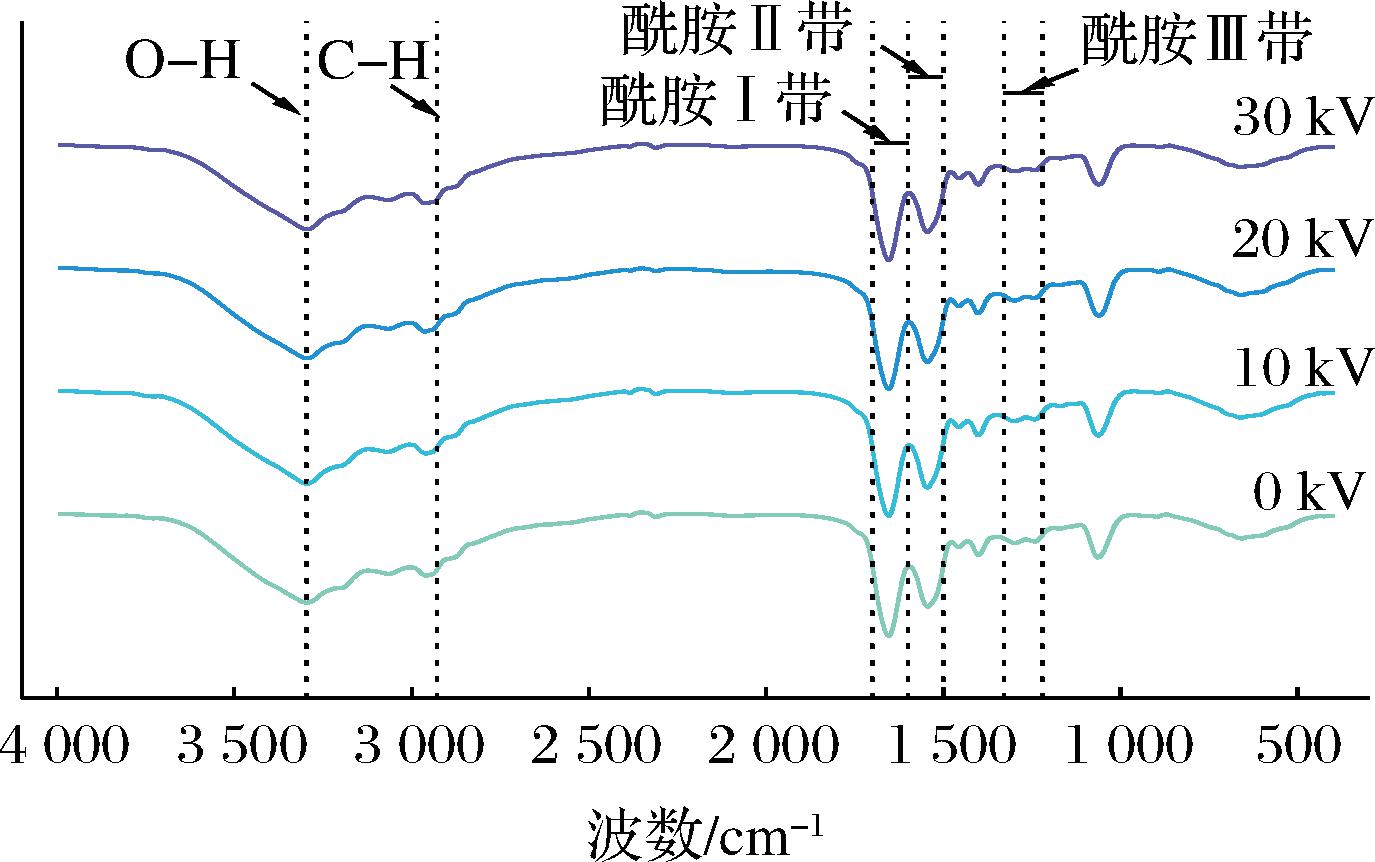
图5 不同低温等离子体电压处理对金鲳鱼红外吸收光谱的影响
Fig.5 Effect of different CP voltage treatments on Fourier transform infrared spectrometer of golden pompano
2.6 CP对金鲳鱼肉表面疏水性的影响
表面疏水性反映了蛋白质的变性程度,蛋白质变性后结构中的疏水性残基暴露,导致表面疏水性升高[15]。如图6所示,随着CP处理电压的升高,样品的表面疏水性先显著增加(电压≤10 kV)(P<0.05),随后趋于平缓,这可能是因为低电压CP处理导致金鲳鱼MP中的疏水性残基基本完全暴露。EKEZIE等[25]同样发现凡纳滨对虾经CP处理30 min后表面疏水性显著升高,这可能是由于CP处理后蛋白质氧化,MP结构展开,苯丙氨酸以及色氨酸等疏水性基团暴露。然而,刘昊天等[10]认为蛋白质的适度氧化,会使其发生去折叠现象,疏水基团的暴露增加了风味物质吸附在蛋白质表面的可能性,有利于挥发性风味的保持。

图6 不同低温等离子体电压处理对金鲳鱼表面疏水性的影响
Fig.6 Effect of different CP voltage treatments on surface hydrophobicity of golden pompano
2.7 CP对金鲳鱼肉紫外吸收光谱的影响
紫外光谱反映了蛋白质发色基团对紫外光的吸收作用,可以表征蛋白质三级结构的稳定性。如图7所示,CP处理后金鲳鱼MP的吸收强度高于未处理组,且随着电压的升高,吸光度越高且略有右移。这可能是由于蛋白质结构随着CP处理电压的升高进一步展开,更多酪氨酸和色氨酸残基等芳香族氨基酸暴露,紫外吸收强度上升[25],这与表面疏水性结果一致,都表明蛋白质经过CP处理后发生一定程度的舒展。QIAN等[24]用CP活化水处理鸡肉MP凝胶后发现CP活化水能够促进疏水基团的暴露,紫外吸收强度上升。同时也有研究表明280 nm处的吸收强度上升可能与氨基酸残基修饰有关,CP产生的活性物质(活性氧和活性氮等)可能可以诱导酪氨酸、色氨酸和苯丙氨酸发生羟基化以及诱导色氨酸和苯丙氨酸硝化[26]。
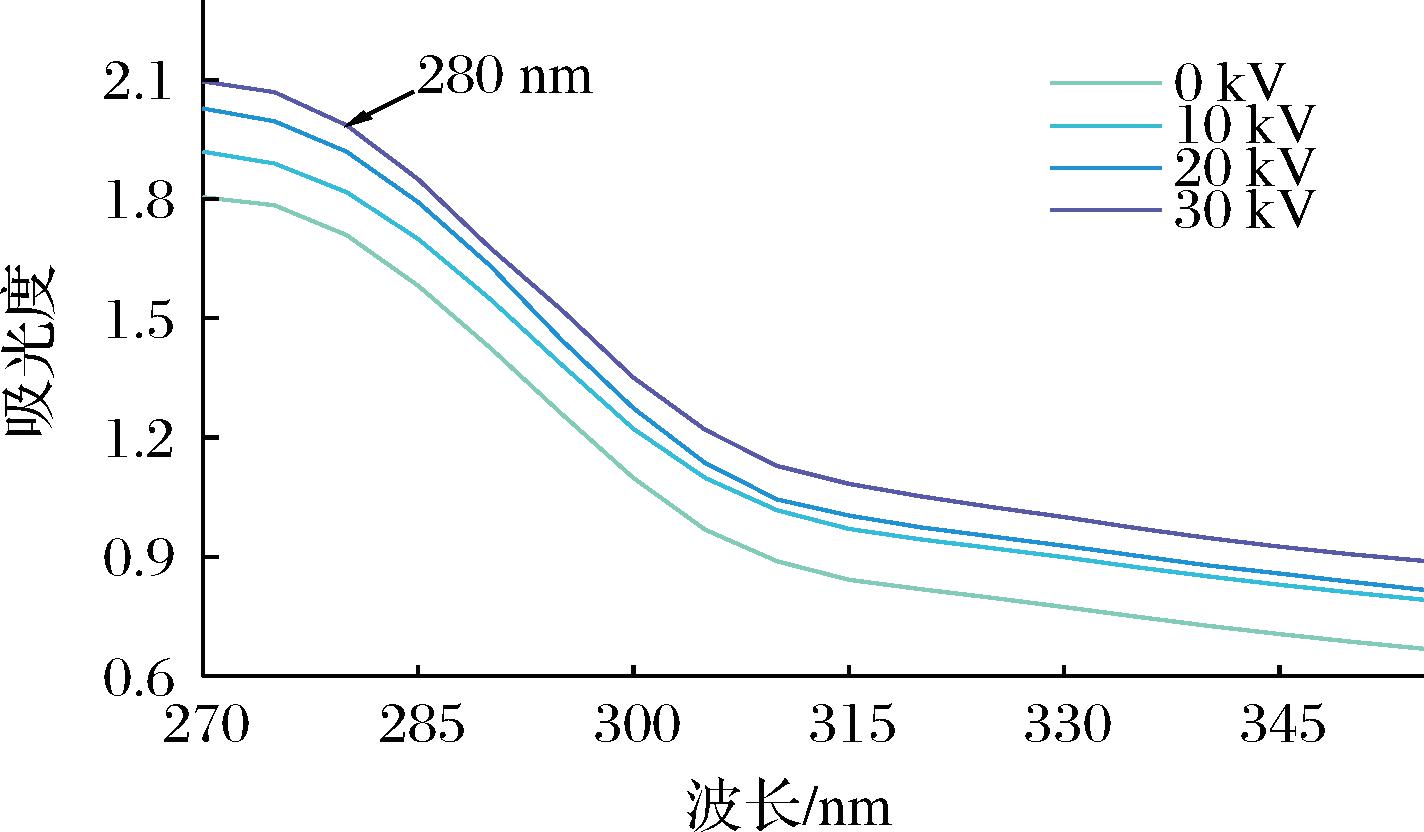
图7 不同低温等离子体电压处理对金鲳鱼紫外光谱的影响
Fig.7 Effect of different CP voltage treatments on UV absorption of golden pompano
2.8 CP对金鲳鱼肉肌原纤维蛋白SDS-PAGE的影响
SDS-PAGE可以表征CP处理后金鲳鱼肉蛋白质结构变化[25]。如图8所示,MP主要集中在10~245 kDa,包括肌球蛋白重链(220 kDa)、肌动蛋白(43 kDa)、原肌球蛋白(35 kDa)等,其中肌球蛋白重链是主要的蛋白质。经CP处理后蛋白质条带数量以及强度未产生明显变化,这说明CP对肽键的影响不显著。实验结果与KODDY等[27]对带鱼肌肉进行50 kV CP处理(<60 s)时相似,他们发现经过带鱼经过CP处理后,蛋白质条带变化轻微。此外EKEZIE等[25]也发现凡纳滨对虾MP经CP射流处理后,电泳条带没有发生明显变化,这可能是CP处理不会改变MP分子量或使MP发生降解。但KODDY等[27]也发现当长时间CP处理时,蛋白质会发生共价键交联以及发生氧化而聚集,从而增强肌球蛋白重链和肌动蛋白条带强度。综合红外光谱(图5)结果,说明CP短时间处理,不足以引起MP一、二级结构的显著变化。
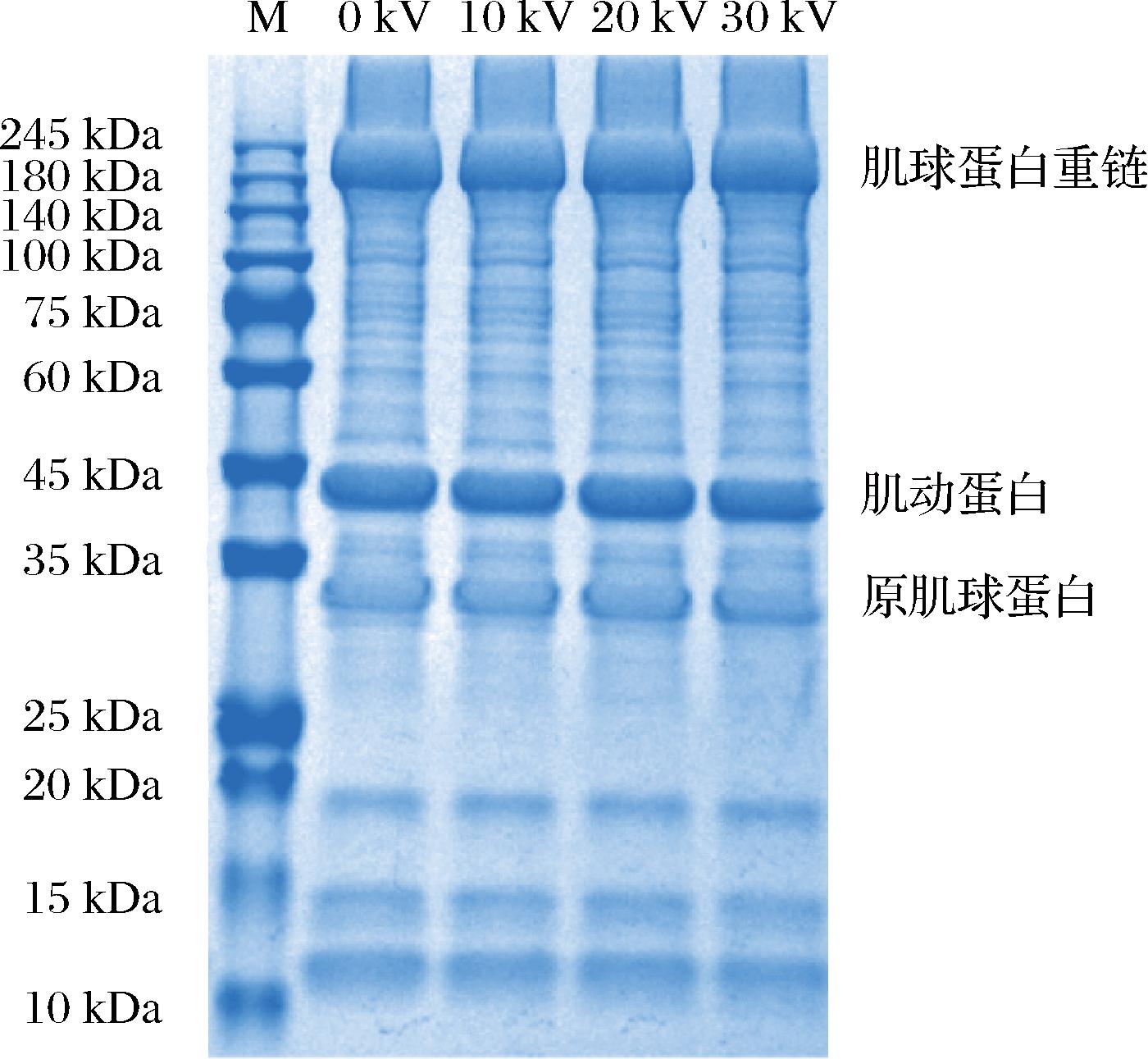
图8 不同低温等离子体电压处理对金鲳鱼SDS-PAGE电泳的影响
Fig.8 Effect of different CP voltage treatments on SDS-PAGE of golden pompano
3 结论
随着CP处理电压的增加,金鲳鱼肉MFI、TCA溶解肽和总氨基酸含量升高,Ca2+-ATP酶活力下降。此外,色氨酸等疏水性基团暴露,表面疏水性和紫外吸收强度增加,这表明蛋白质发生的一定程度舒展。但是金鲳鱼MP的红外光谱和SDS-PAGE说明CP处理后蛋白质一级结构和二级结构未发生明显变化。综上所述,说明CP处理能够促进蛋白质变性,使蛋白质三级结构发生改变,且随着处理电压升高,蛋白质变性越来越严重。因此,在利用CP对水产品进行杀菌时,应控制处理条件,避免过高电压导致的水产品蛋白质的变性,减小其对鱼肉品质不利影响。同时,未来仍需深入了解CP作用机制,选择更加合理的处理条件,以最大程度减少对食品的不良影响;还应该对CP进行安全性评估,使其更加安全可靠地运用于食物保存。
[1] 黄小林, 戴超, 虞为, 等.丁香酚对卵形鲳鲹幼鱼的麻醉效果[J].广东海洋大学学报, 2020, 40(4):124-131.
HUANG X L, DAI C, YU W, et al.Anesthetic effect of eugenol on juvenile Trachinotus ovatus[J].Journal of Guangdong Ocean University, 2020, 40(4):124-131.
[2] 章超桦, 薛长湖.水产食品学[M].第三版.北京:中国农业出版社, 2018.
ZHANG C H, XUE C H.Aquatic Food Science[M].3rd Edition.Beijing:China Agriculture Press, 2018.
[3] 李汴生, 黄雅婷, 阮征.非热杀菌技术在生食水产品中的应用研究进展[J].水产学报, 2021, 45(7):1259-1276.
LI B S, HUANG Y T, RUAN Z.Application of non-thermal sterilization technology in raw ready-to-eat aquatic products[J].Journal of Fisheries of China, 2021, 45(7):1 259-1 276.
[4] 周结倩, 张坤, 徐杰, 等.低温等离子体在水产品保鲜中的应用研究进展[J].食品与发酵工业, 2022, 48(22):328-337.
ZHOU J Q, ZHANG K, XU J, et al.Research progress on application of low temperature plasma in aquatic products preservation[J].Food and Fermentation Industries, 2022, 48(22):328-337.
[5] OLATUNDE O O, BENJAKUL S, VONGKAMJAN K.Dielectric barrier discharge cold atmospheric plasma:Bacterial inactivation mechanism[J].Journal of Food Safety, 2019, 39(6):e12705.
[6] OLATUNDE O O, BENJAKUL S, VONGKAMJAN K.Dielectric barrier discharge high voltage cold atmospheric plasma:An innovative nonthermal technology for extending the shelf-life of Asian sea bass slices[J].Journal of Food Science, 2019, 84(7):1871-1880.
[7] MARCINKOWSKA-LESIAK M, WOJTASIK-KALINOWSKA I, ONOPIUK A, et al.Application of atmospheric pressure cold plasma activated plant protein preparations solutions as an alternative curing method for pork sausages[J].Meat Science, 2022, 187:108751.
[8] OLATUNDE O O, SHIEKH K A, BENJAKUL S.Pros and cons of cold plasma technology as an alternative non-thermal processing technology in seafood industry[J].Trends in Food Science and Technology, 2021, 111:617-627.
[9] PÉREZ-ANDRÉS J M, DE ALBA M, HARRISON S M, et al.Effects of cold atmospheric plasma on mackerel lipid and protein oxidation during storage[J].LWT-Food Science and Technology, 2020, 118:108697.
[10] 刘昊天, 殷小钰, 汪海棠, 等.基于蛋白氧化行为的肉及肉制品品质提升及劣变机制研究进展[J].食品科学, 2020, 41(21):230-237.
LIU H T, YIN X Y, WANG H T, et al.Quality improvement and deterioration of meat and meat products based on the protein oxidation:A review of recent research[J].Food Science, 2020, 41(21):230-237.
[11] LI P Y, MEI J, XIE J.Chitosan-sodium alginate bioactive coatings containing ε-polylysine combined with high CO2 modified atmosphere packaging inhibit myofibril oxidation and degradation of farmed pufferfish (Takifugu obscurus) during cold storage[J].LWT-Food Science and Technology, 2021, 140:110652.
[12] MOTTER M M, CORVA P M, SORIA L A.Expression of calpastatin isoforms in three skeletal muscles of Angus steers and their association with fiber type composition and proteolytic potential[J].Meat Science, 2021, 171:108267.
[13] SAENGSUK N, LAOHAKUNJIT N, SANPORKHA P, et al.Physicochemical characteristics and textural parameters of restructured pork steaks hydrolysed with bromelain[J].Food Chemistry, 2021, 361:130079.
[14] 蓝蔚青, 胡潇予, 阮东娜, 等.傅里叶红外结合拉曼分析卡拉胶寡糖对南美白对虾蛋白结构影响[J].光谱学与光谱分析, 2019, 39(8):2507-2514.
LAN W Q, HU X Y, RUAN D N, et al.Effects of carrageenan oligosaccharides on the protein structure of Litopenaeus Vannamei by fourier transform infrared and micro-raman spectroscopy[J].Spectroscopy and Spectral Analysis, 2019, 39(8):2507-2514.
[15] WANG X J, WANG X W, FENG T T, et al.Saltiness perception enhancement of fish meat treated by microwave:The significance of conformational characteristics, water and sodium mobility[J].Food Chemistry, 2021, 347:129033.
[16] 赵亚, 石启龙, 曹淑敏.南美白对虾贮藏期间Ca2+-ATPase活力变化规律与机制[J].食品科学, 2018, 39(5):258-264.
ZHAO Y, SHI Q L, CAO S M.Variation and underlying mechanisms of Ca2+-atpase activity in Penaeus vannamei during storage[J].Food Science, 2018, 39(5):258-264.
[17] 胡佳慧, 熊光权, 乔宇, 等.微冻贮藏过程中能量代谢酶活性和蛋白质氧化降解对鲈鱼质构特性的影响[J].食品科学, 2018, 39(23):227-234.
HU J H, XIONG G Q, QIAO Y, et al.Effects of energy metabolism-related enzyme activities and protein oxidation on texture properties of perch (Micropterus salmoides) during superchilled storage[J].Food Science, 2018, 39(23):227-234.
[18] 蓝蔚青, 张炳杰, 张溪, 等.微酸性电解水结合复合保鲜剂对凡纳滨对虾冷藏期间蛋白特性影响[J].广东海洋大学学报, 2022, 42(1):98-105.
LAN W Q, ZHANG B J, ZHANG X, et al.Effects of slightly acidic electrolyzed water combined with compound preservative on the protein characteristics of pacific white shrimp (Litopenaeus Vannamei) during refrigerated storage[J].Journal of Guangdong Ocean University, 2022, 42(1):98-105.
[19] DANG D S, BUHLER J F, DAVIS H T, et al.Inhibition of mitochondrial calcium uniporter enhances postmortem proteolysis and tenderness in beef cattle[J].Meat Science, 2020, 162:108039.
[20] 唐玲玲. 低温等离子体对凡纳滨对虾肌肉自溶的控制及机制研究[D].舟山;浙江海洋大学, 2022.
TANG L L.Study on the control and mechanism of atmospheric cold plasma on muscle autolysis of Litopenaeus vannamei[D].Zhoushan:Zhejiang Ocean University, 2022.
[21] OLATUNDE O O, BENJAKUL S, VONGKAMJAN K.Shelf-life of refrigerated Asian sea bass slices treated with cold plasma as affected by gas composition in packaging[J].International Journal of Food Microbiology, 2020, 324:108612.
[22] KETNAWA S, RAWDKUEN S.Application of bromelain extract for muscle foods tenderization[J].Food and Nutrition Sciences, 2011, 2(5):393-401.
[23] LIN H M, ZHANG S, ZHENG R S, et al.Effect of atmospheric cold plasma treatment on ready-to-eat wine-pickled Bullacta exarata[J].LWT-Food Science and Technology, 2020, 120:108953.
[24] QIAN J, WANG Y Y, ZHUANG H, et al.Plasma activated water-induced formation of compact chicken myofibrillar protein gel structures with intrinsically antibacterial activity[J].Food Chemistry, 2021, 351:129278.
[25] EKEZIE F G C, CHENG J H, SUN D W.Effects of atmospheric pressure plasma jet on the conformation and physicochemical properties of myofibrillar proteins from king prawn (Litopenaeus vannamei)[J].Food Chemistry, 2019, 276:147-156.
[26] HAN Y X, CHENG J H, SUN D W.Changes in activity, structure and morphology of horseradish peroxidase induced by cold plasma[J].Food Chemistry, 2019, 301:125240.
[27] KODDY J K, MIAO W H, HATAB S, et al.Understanding the role of atmospheric cold plasma (ACP) in maintaining the quality of hairtail (Trichiurus Lepturus)[J].Food Chemistry, 2021, 343:128418.