花生(Arachis hypogaea L.)又称落花生,地果和香果,属蔷薇目,豆科一年生草本植物。花生是我国重要的经济作物和油料作物,是可食用性植物油脂和植物蛋白质的重要来源[1],据测定,花生中脂肪含量50%左右,较油菜籽、大豆和棉籽高[2]。此外,花生还具有延缓衰老、抗肿瘤等功效,享有“长生果”之美誉[3]。然而,花生的收获季节多是阴雨天气,且刚收获的花生含水率较高,常因花生晾晒不及时而发生霉变,严重影响花生的后续加工,大大降低了花生的利用率。据统计,每年因干燥不及时对花生产业造成的损失量约占花生总产量的13%,损失金额高达10亿元[4-5]。目前,我国花生干燥方式多以自然晾晒为主,干燥周期长,受天气影响较大,且劳动强度大。因此,探求更为高效的带壳鲜花生干燥方法对提高花生综合利用率,促进我国花生产业的健康发展十分重要。
近年来,国内外学者对花生干燥进行了一系列的研究。颜建春等[6]、林子木等[7]、渠琛玲等[8]、王安建等[9]分别采用固定床通风干燥、热风干燥(hot air drying,HAD)、常温通风干燥、热泵干燥的方法对花生的干燥特性进行了研究,并进行了工艺优化。PATIL等[10]对花生籽粒采用160 ℃、10 min热风处理的方法,得出蛋白质性能得到提高的结论。然而在实际生产中,这些干燥方法使花生内部水分难以向外扩散迁移,导致了干燥时间长、营养成分损失大、能量消耗高[11-12]等问题。还有学者将联合干燥的方法用于花生干燥。王招招等[13]、凌铮铮等[14]对花生热风耦合微波干燥特性及工艺优化进行了研究,该方法缩短了干燥时间,然而微波干燥温度的不可控性对花生的品质造成了很大的影响。ZENG等[15]采用叠加及变温的手段,对花生热风干燥进行了改良。红外干燥(infrared drying,IRD)是目前干燥加工的新技术,具有效率高、时间短的特点[16],但干燥效率与产品品质无法同时兼顾[17]。因此,为充分利用热风和红外干燥的优势,对采后花生使用热风-红外分段组合干燥(sequential hot air-infrared drying,HAD-IRD)技术,即前期利用热风干燥去除大部分自由水,后期利用红外干燥去除剩余的少量自由水和结合水的一种新型干燥技术[18],利用红外干燥的热量传递与水分迁移方向相同的优势,促进实现快速去除内部弱结合水,缩短干燥时间,提高产品品质的要求。此外,热风-红外分段组合干燥技术,目前国内学者相关研究较少,鲜见报道。
本文分别对比了热风干燥、红外干燥、热风-红外分段组合干燥对带壳鲜花生干燥特性的影响,及不同干燥条件下热风-红外分段组合干燥带壳鲜花生的干燥特性。并以单一热风干燥及单一红外干燥为对照,研究热风-红外分段组合干燥因素对花生的微观结构、硬度、色泽、脂肪酸组成及花生中蛋白结构的影响,以期为带壳鲜花生干燥向高效节能方向发展提供技术和理论参考。
1 材料与方法
1.1 材料与试剂
试验所用带壳鲜花,购自云南红河。选取大小均匀,颗粒饱满的花生,去除泥沙后,用自封袋密封,并置于冰箱中4 ℃冷藏备用,试验前恢复至室温(20 ℃)后使用。
溴化钾为光谱纯,正己烷、甲醇为色谱纯,氢氧化钾、氢氧化钠、无水硫酸钠等为分析纯。
1.2 仪器与设备
DHG-9140A(2 050 W)电热鼓风干燥箱,上海一恒科学仪器有限公司;XMT-G5000(1 200 W)红外辐射干燥箱,上海聚辰科学仪器有限公司;TM3030 Plus扫描电镜,日立高新技术公司;SMS TA.XT食品物性分析仪,英国Stable Micro Systems公司;X-rite Color 15型色差计,美国爱色丽公司;TSQ9000气相色谱-三重四级杆串联质谱仪,美国赛默飞世尔公司;VERTEX70傅立叶变换中远红外光谱仪,德国BRUKER公司;JY30002电子天平,上海良平仪器有限公司。
1.3 实验方法
1.3.1 带壳鲜花生不同干燥方法对比试验
为探求更合适的干燥方式,参考花生及相关油料作物干燥的相关报道[7,19],对带壳鲜花生采用3种不同的干燥方式进行干燥。根据预试验的较优结果,在同一温度水平下进行带壳鲜花生的干燥,参数设置如表1所示。
表1 干燥方式及参数设置
Table 1 Drying method and parameter setting
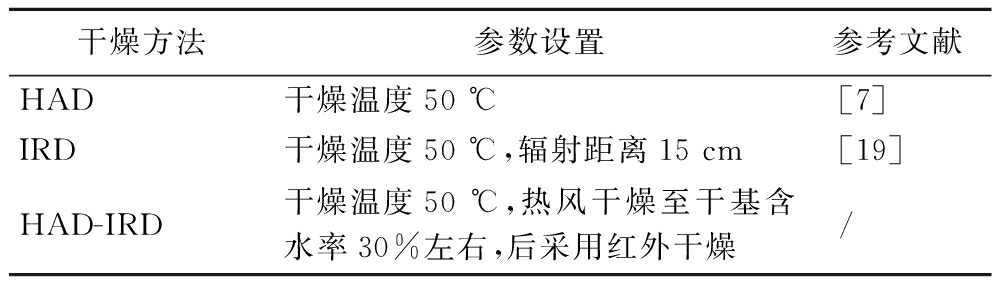
干燥方法参数设置参考文献HAD干燥温度50 ℃[7]IRD干燥温度50 ℃,辐射距离15 cm[19]HAD-IRD干燥温度50 ℃,热风干燥至干基含水率30%左右,后采用红外干燥/
注: / 表示无相关数据。
1.3.2 带壳鲜花生热风-红外分段组合干燥单因素试验
通过预试验及相关报道[20-21]的研究发现,热风-红外分段组合干燥中最重要的工艺参数是确定热风干燥后物料含水率,即2种干燥方法在何时转换(转换含水率)。其次,干燥温度也会影响带壳鲜花生干燥时间和品质[14]。因此选取干燥温度和转换含水率2个因素作为组合试验的单因素。每次试验取花生(130.00±5.00)g,薄层均匀摊开。具体步骤为:a)设置干燥温度为50 ℃,将带壳鲜花生置于热风干燥箱中,分别干燥至不同的干基含水率(15%、20%、25%、30%、35%),然后转用红外干燥;b)将带壳鲜花生置于不同温度(40、50、60、70 ℃)的热风干燥箱中,干燥至干基含水率为30%。然后,转用红外干燥(红外干燥温度与热风干燥温度相同)至目标干基含水率为7%~8%。
1.4 分析测定方法
1.4.1 初始含水率测定
根据GB/T 144891—2008《油料水分及挥发物含量测定》测定带壳鲜花生的初始干基含水率[22]。
1.4.2 含水率测定
干基含水率计算如公式(1)所示:
(1)
式中:Wt为干燥时间t时带壳鲜花生的干基含水率,%;Mt为干燥时间t时带壳鲜花生的质量,g;Mg为带壳鲜花生绝干时的质量,g。
1.4.3 干燥速率的测定
干燥速率计算如公式(2)所示:
(2)
式中:U为干燥时间t时带壳鲜花生的干燥速率,%/h;Δt为2次取样间隔时间,h。
1.4.4 总能耗的计算
总能耗计算如公式(3)所示:
Q=P1t1+P2t2
(3)
式中:Q为带壳鲜花生干燥过程的总能耗,kW·h;P1、P2分别为热风干燥设备、红外干燥设备的功率,kW;t1、t2分别为热风段、红外段的干燥时间,h。
1.4.5 微观结构观察
参照相关研究[23],取干燥后花生仁样品(厚度约1 mm),黏在载物台双面导电胶上,放大200倍观察干燥后花生的微观结构。
1.4.6 硬度特性的测定
由于花生样品具有不规则的特点,因此选择穿刺试验以方便有效地表现其硬度特性。穿刺试验参考卢映洁等[24]的试验方法。参数如下:探头类型P/2 mm,测前速率0.8 mm/s,测试速率0.5 mm/s,测后速率0.8 mm/s,压缩程度40%,触发感应力10 g。
1.4.7 色泽的测定
使用色差计对色度进行测定,结果采用L*值(明/暗)、a*值(红/绿)、b*值(黄/蓝)和色差ΔE值表示。每组样品测定3次,ΔE计算如公式(4)所示:
(4)
式中:L*、 a*和 b*为物料干燥后的色度值;L0、a0和b0为新鲜样品的色度值;ΔE为干燥后物料与干燥前物料之间的色度差异,其值越小表示色泽保留越好。
1.4.8 脂肪酸的测定
采用GC-MS仪对花生中的脂肪酸进行测定。参考陈拾旸等[25]的方法,并作出修改:样品脂肪酸甲酯化修改为:取200 mg油样,移入10 mL具塞试管中,加入0.8 mL、2 mol/L氢氧化钾-甲醇溶液,超声处理10 min,加入4.0 mL正己烷,漩涡振荡2 min后静置片刻,加入0.5 g无水硫酸钠,混匀,静置分层取上层液,过0.22 μm滤膜,准备进样。色谱条件修改为:进样口温度230 ℃;进样量1 μL;分流比100∶1。质谱条件修改为:传输线温度280 ℃;离子源温度240 ℃。
1.4.9 花生蛋白结构的测定
参考严永红等[26]的方法提取花生蛋白,其中提取花生蛋白原料为提油后的花生粕,以料液比1∶10溶于去离子水中,加入NaOH溶液调节pH后,室温40 r/min磁力搅拌2 h。
花生蛋白结构采用傅立叶变换中远红外光谱法(Fourier transform infrared,FT-IR):同李响等[27]的方法。
1.5 数据统计与分析
使用OMNIC 8.2软件及Peakkit 4.0软件对红外谱图进行处理;使用SPSS 25.0对数据进行处理分析,绘图采用Origin 2018软件。
2 结果与分析
2.1 不同干燥方法对带壳鲜花生干燥特性的影响
不同干燥方法处理带壳鲜花生的干燥曲线如图1所示。其中,红外干燥所需时间最短,为5.5 h;热风干燥所需时间最长,为16 h;热风-红外分段组合干燥所需时间介于两者之间,为6 h,较热风干燥时间节约62.5%。图中,热风干燥后期干燥速率迅速减小,致使之后所耗时间约占总干燥时间的一半。这是因为热风干燥热量传递方向与水分迁移方向相反,同时干燥后期花生仁表面产生了硬化结壳现象,堵塞水分迁移孔隙通道,导致水分难以向外扩散迁移[28]。对比热风干燥而言,红外干燥后期无明显的缓慢干燥阶段,是因为红外具有较强的穿透性,利用红外线频率加速物料内部分子振动,使物料内部摩擦产热而使水分蒸发[29]。因此,选择在热风干燥速率明显降低前,转换为红外干燥,可缩短干燥时间。
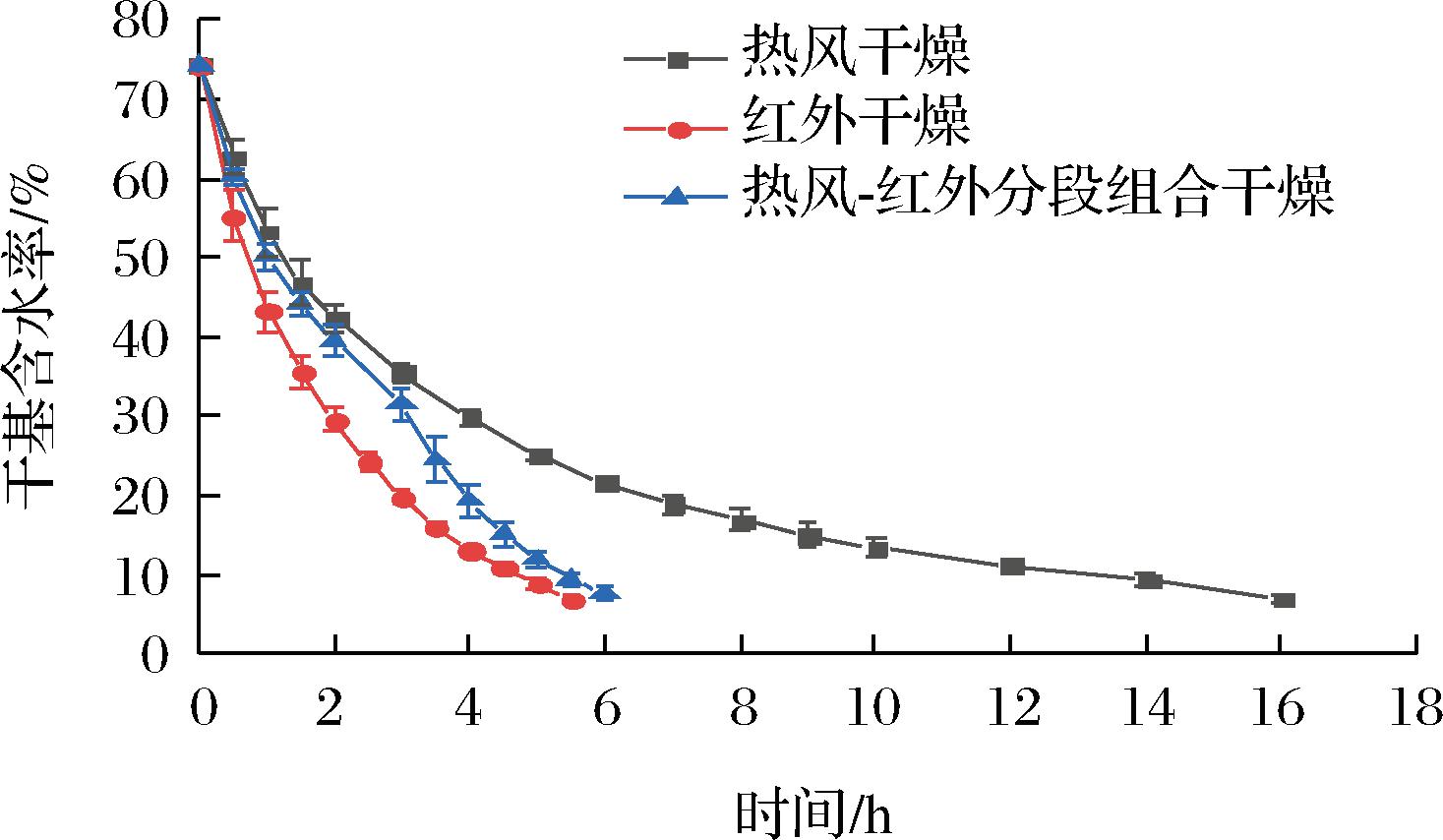
图1 带壳鲜花生在3种干燥方式下的干燥曲线
Fig.1 Drying curves of fresh shelled peanuts by three drying methods
按公式(3)计算不同干燥方法干燥带壳鲜花生的总耗能,如表2所示。
表2 不同干燥方式的总耗能
Table 2 Total energy consumption of different drying methods
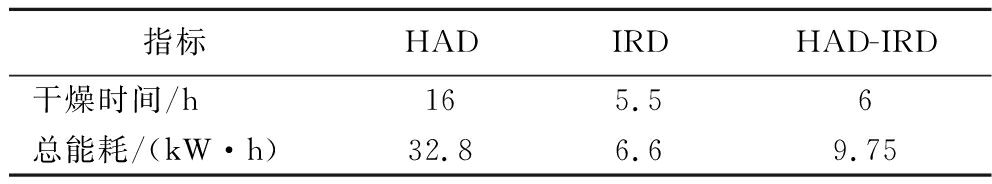
指标HADIRDHAD-IRD干燥时间/h165.56总能耗/(kW·h)32.86.69.75
由表2可知,相同初始含水率、相同干燥温度的条件下,热风干燥总耗能32.8 kW·h,红外干燥总耗能6.6 kW·h,热风-红外分段组合干燥总耗能9.75 kW·h。总耗能方面,热风-红外分段组合干燥较热风干燥节省能源70.27%。在当前全世界能源较为短缺的大背景下,热风-红外分段组合干燥符合资源友好型社会要求。此外,DHG-9140A电热鼓风干燥箱的功率为2 050 W,XMT-G5000红外辐射干燥箱的功率为1 200 W,前者近后者功率的2倍。因此,在一定范围内,缩短热风干燥时间可减少总能耗,节约能源。
2.2 不同热风-红外分段组合干燥条件对带壳鲜花生干燥特性的影响
2.2.1 转换含水率对干燥特性的影响
不同转换含水率下,热风-红外分段组合干燥带壳鲜花生的干燥曲线如图2所示。干燥温度50 ℃,转换含水率为15%、20%、25%、30%、35%条件下干燥花生至目标含水率,分别用时为8、7.5、7、6.5、6 h。图2中显示干燥时间随转换含水率的增加而缩短,转换含水率15%下所用干燥时间比35%的干燥时间延长了33.3%。这是因为热风可迅速带走带壳鲜花生表面的水分,但随着干燥的进行,在热风干燥后期出现硬化结壳现象,从而导致水分难以向外迁移[28];而红外线穿透性强,所产生的辐射作用可加速带壳鲜花生内部分子振动,从而促进水分蒸发[29]。因此提高转换含水率,可缩短干燥时间,比较预试验干燥所得花生品质,选取转换含水率30%而进行后续试验探究。
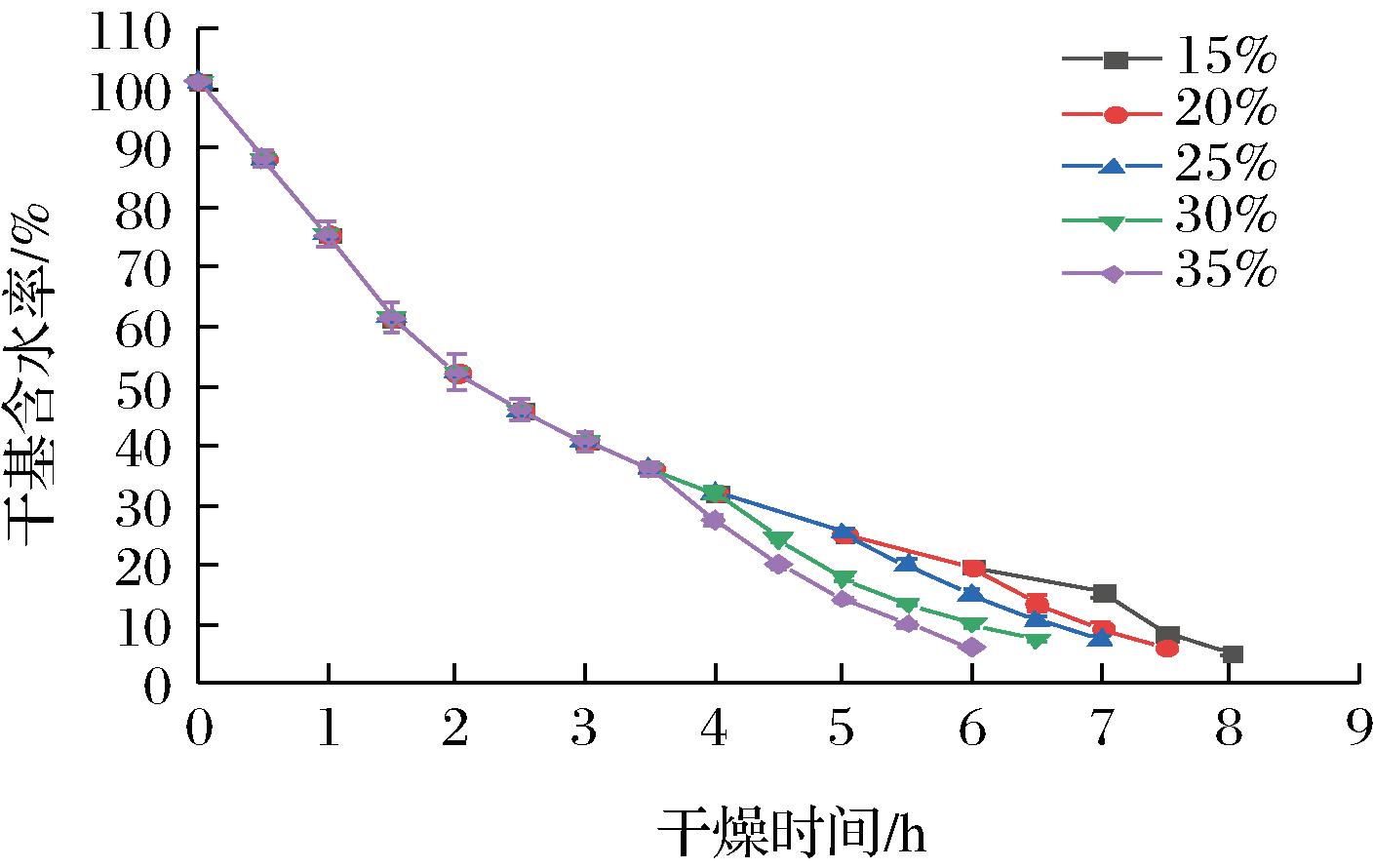
图2 不同转换含水率下的干燥曲线
Fig.2 Drying curves at different conversion moisture content
2.2.2 干燥温度对干燥特性的影响
不同干燥温度下带壳鲜花生的干燥曲线如图3所示。干燥温度为40、50、60、70 ℃,转换含水率为30%的条件下,干燥时间随温度的升高而缩短,干燥至目标含水率,分别用时12、6.5、4.5、4 h。干燥温度70 ℃所用干燥时间比40 ℃缩短了200%。因为热风温度增高,可加速水分子运动,从而加快带壳鲜花生表面水分迁移,缩短热风段干燥时间;红外温度增高,其辐射能力增强,传递给物料的热量越多,传热传质动力增加,水分迁移及蒸发速度越快,有助于减少红外段干燥时间[30]。从图3可以看出,60 ℃与70 ℃干燥总时长相近,结合后续试验结果,通过比较干燥后花生品质,推荐实际生产中,选择干燥温度不超过50 ℃,以减小能耗的同时,保证花生品质。
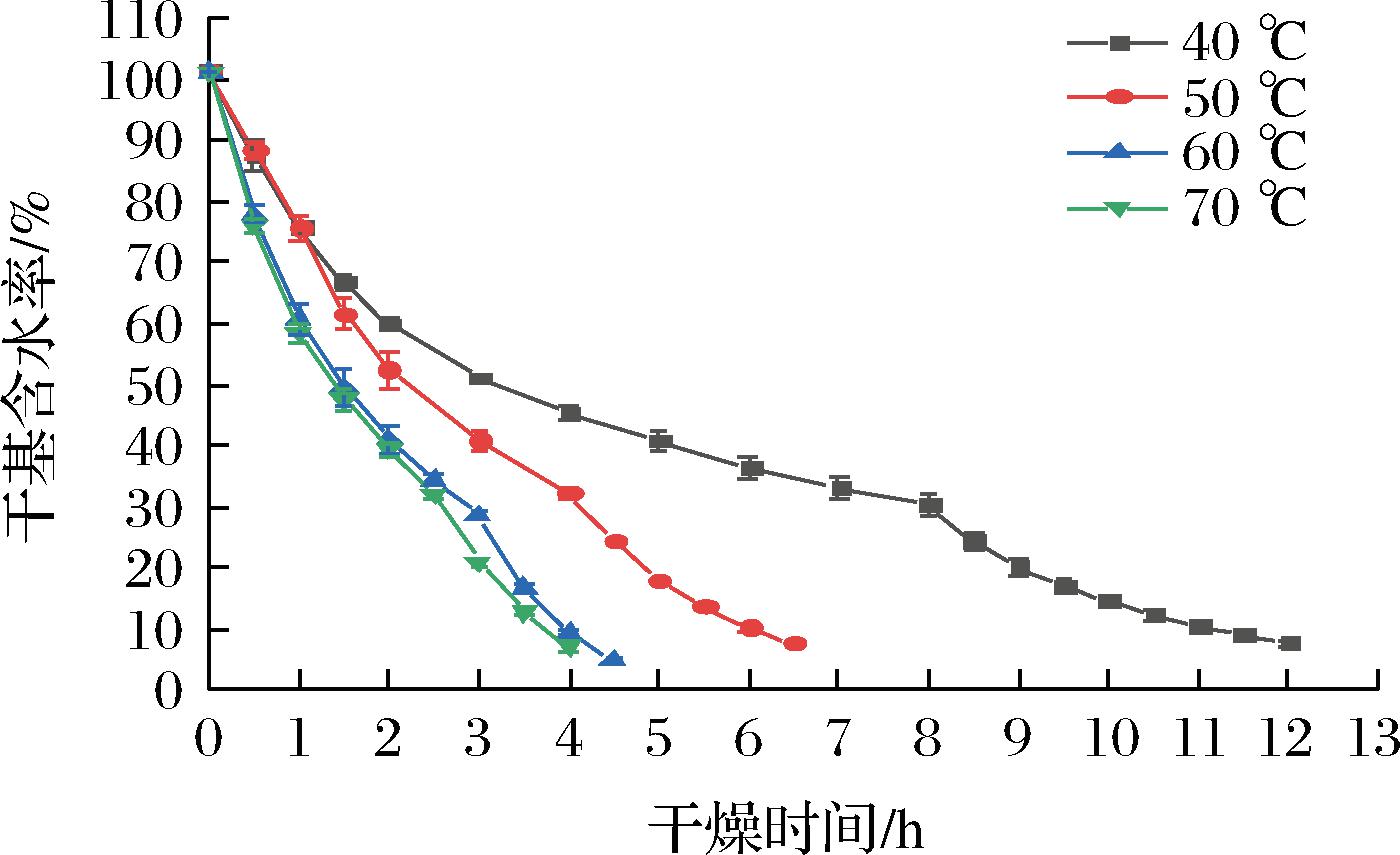
图3 不同温度下的干燥曲线
Fig.3 Drying curves at different temperatures
2.3 不同热风-红外分段组合干燥条件对带壳鲜花生品质的影响
2.3.1 干燥条件对微观结构的影响
不同转换含水率条件下带壳鲜花生的微观结构如图4所示。干燥初期,花生仁的细胞结构饱满且排列较规则,有明显的网状结构,网孔边界清晰。干燥初期,热风干燥使花生内部组织收缩变形,结构紧密,但空腔较浅。随着干燥的进行,物料表面产生硬化现象[28],阻碍水分向外迁移,干燥速率减慢。当干基含水率为15%时,细胞已经开始破裂,表面出现颗粒状结构。干燥后期,红外辐射引起花生内部分子强烈振动,水分蒸发加快,孔隙数增多[29],颗粒状结构增多。因花生是含油率较高的一种油料作物,颗粒状结构为溢出的油脂[24]。不同温度条件下带壳鲜花生的微观结构如图5所示。干燥前期,随着干燥温度升高,干燥至相同含水率所需时间缩短,70 ℃较40 ℃,花生仁的细胞结构更饱满,排列更规则,网孔边界更清晰,更有利于水分迁移,因此70 ℃干燥速率大于40 ℃。干燥后期,干燥温度的升高加剧分子振动,水分蒸发速度增快,花生内部孔隙数量增多,且细胞结构变化加快。同时花生内部孔隙数量增多有利于水分散失,因此干燥后期采用红外干燥代替热风干燥提升快干燥速率。
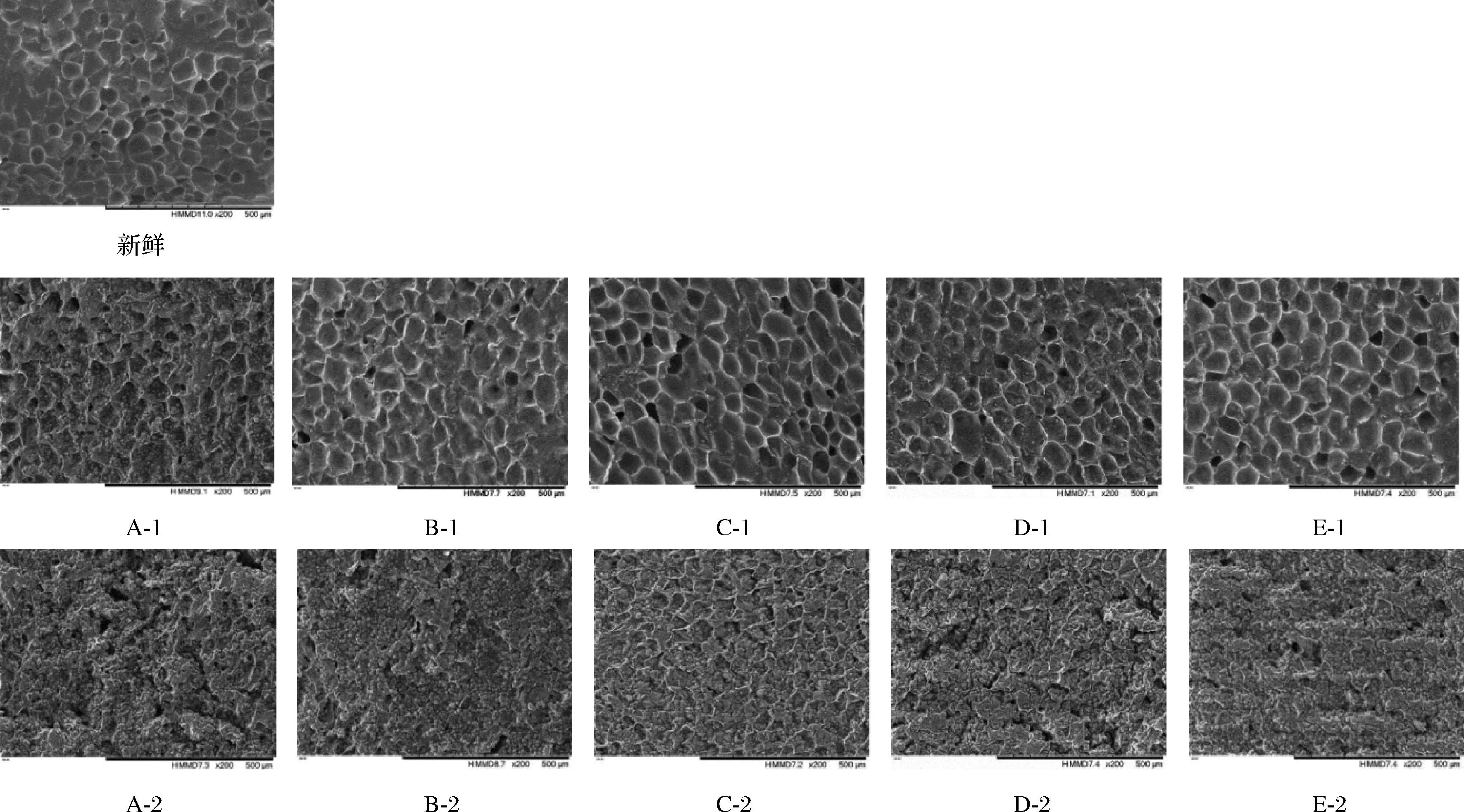
A~E分别为转换含水率15%、20%、25%、30%、35%;1为干燥转换点;2为干燥终点
图4 不同HAD-IRD转换含水率对花生仁微观结构的影响
Fig.4 Effect of different converted moisture content of HAD-IRD on microstructure of peanut kernel
注:A-1:转换含水率为15%时,干燥至转换点时的微观结构图;A-2:转换含水率为15%时,干燥至干燥终点时的微观结构图(B~E同A)。

F~I分别为干燥温度40、50、60、70 ℃;1为干燥转换点;2为干燥终点
图5 不同HAD-IRD干燥温度对花生仁微观结构的影响
Fig.5 Effect of different temperatures of HAD-IRD on microstructure of peanut kernel
注:F-1:干燥温度为40 ℃时,干燥至转换点时的微观结构图;F-2:干燥温度为40 ℃时,干燥至干燥终点时的微观结构图(G~I同F)。
2.3.2 干燥条件对色泽的影响
不同干燥条件对带壳鲜花生色泽的影响如图6所示。与新鲜样品相比,所有干燥后样品的色泽均发生变化;与单一热风干燥及单一红外干燥样品对比,热风-红外分段组合干燥后样品色泽更接近新鲜样品。相较于新鲜样品,转换含水率不同时,a*值无显著性差异(P>0.05),干燥后L*、b*值较新鲜样品有差异,ΔE值有显著性差异(P<0.05)。其中转换含水率30%的色差值ΔE最小,颜色较新鲜样品最为接近。干燥温度不同时,随着温度的升高,L*值先减小后增大,a*及b*值不断增大。L*的先减小后增大可归因于美拉德反应的发生。随着温度升高,美拉德反应加速[31],L*值减小,色泽变暗;同时温度越高,酶促褐变受到的抑制越强,L*值增大。而花生中富含蛋白质及淀粉,在一定条件下,淀粉可转化为还原糖,引起美拉德反应的发生,产生红棕色物质[32],数据上表现为a*值增大。b*值的增大可能是因为氧化反应的发生,随着温度的升高,氧化反应速度增快。其中干燥温度50 ℃的色差值ΔE最小,颜色较新鲜样品最为接近。相较于热风干燥及红外干燥样品,热风-红外分段组合干燥样品的L*、a*及b*值均明显低于二者样品。因为热风干燥时间较长,美拉德反应及氧化反应更完全,而红外干燥形成的高温高湿环境也会使美拉德反应增强,从而导致样品色泽变暗。
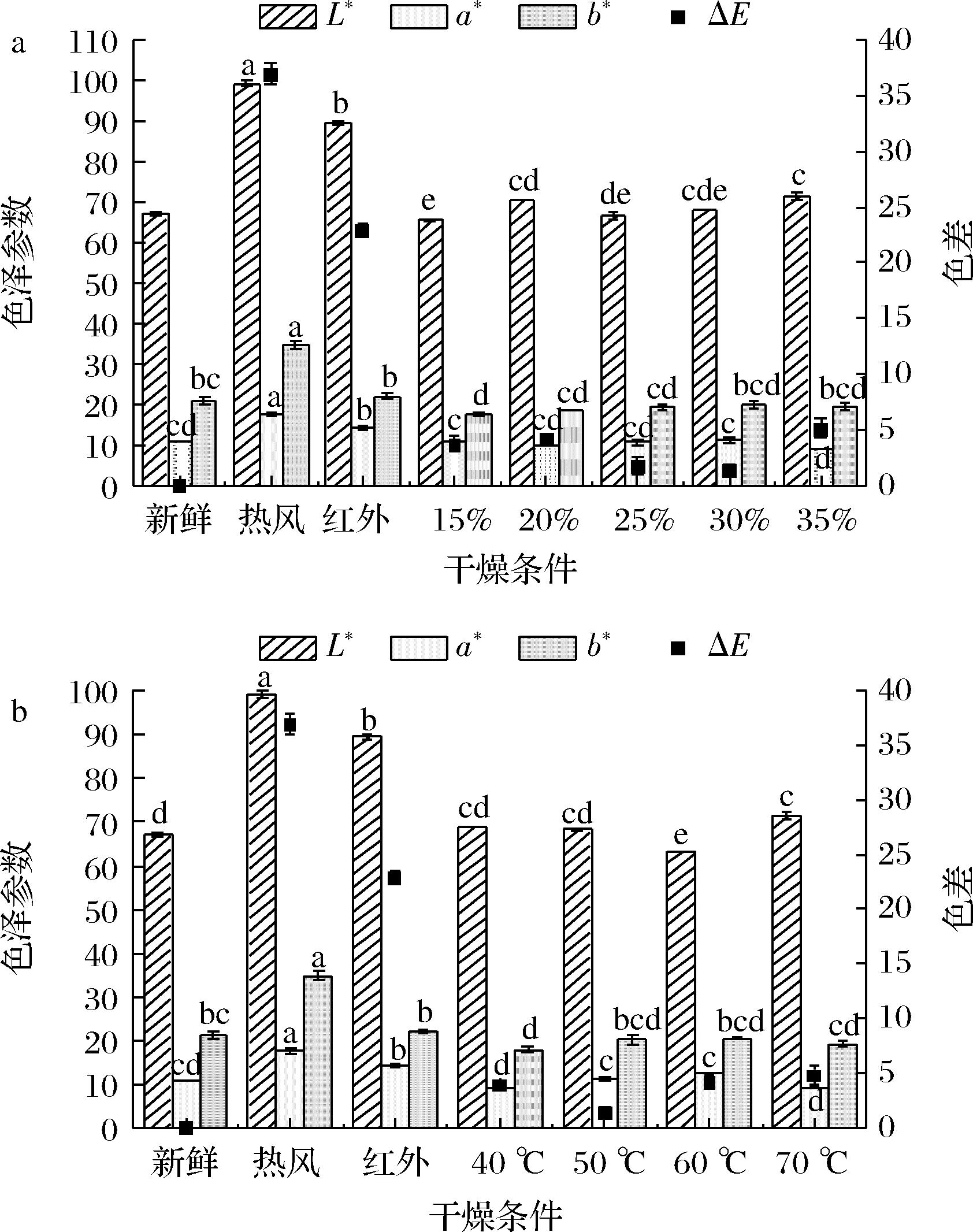
a-转换含水率;b-干燥温度
图6 不同HAD-IRD干燥条件对花生仁色泽的影响
Fig.6 Effect of different HAD-IRD drying conditions on color of peanut kernel
注:图中不同小写字母表示不同处理组间差异显著(P<0.05)(下同)。
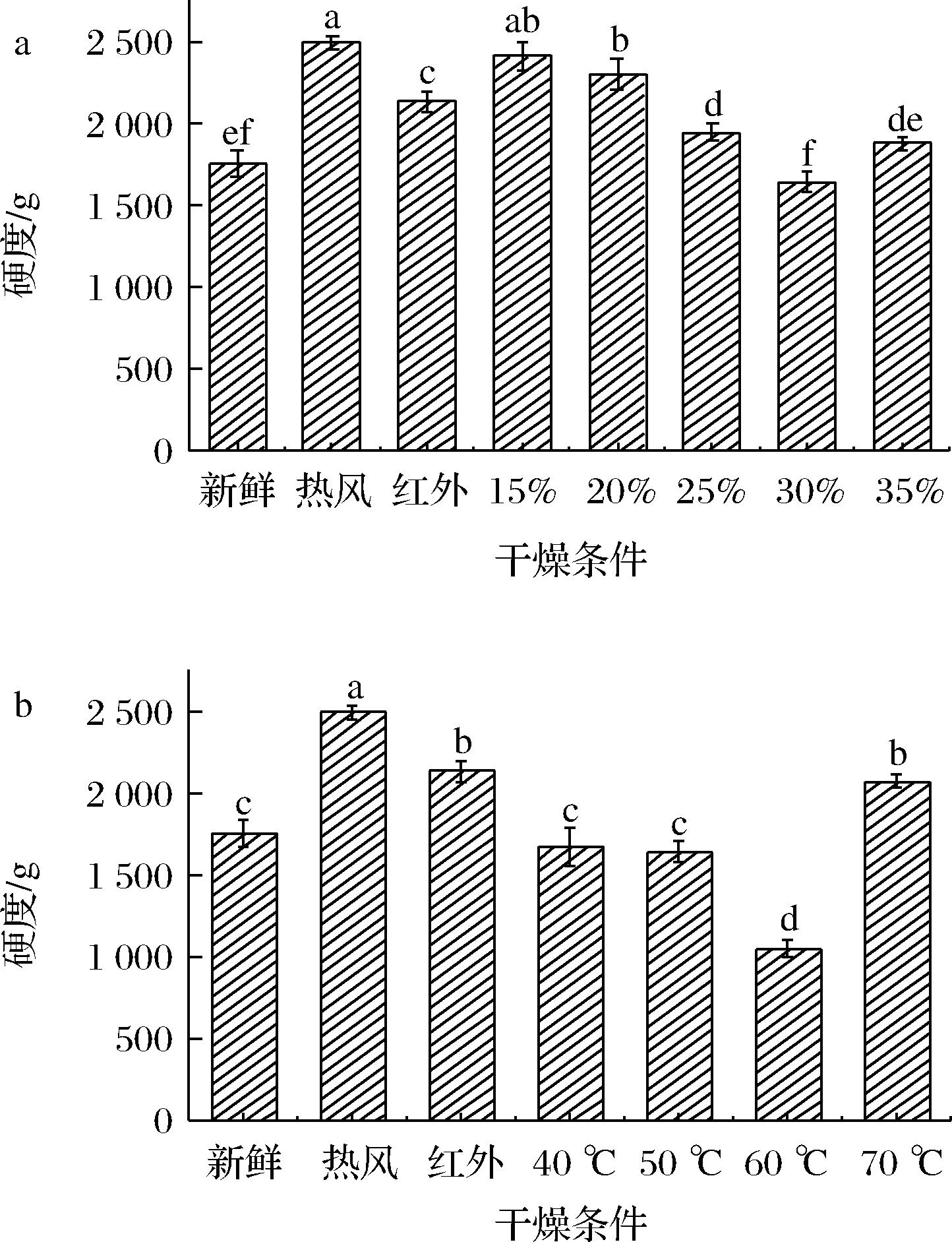
a-转换含水率;b-温度
图7 不同HAD-IRD干燥条件对花生仁硬度的影响
Fig.7 Effect of different HAD-IRD drying conditions on hardness of peanut kernel
综合色泽参数得出,热风-红外分段组合干燥更有利于保护花生色泽,转换含水率及干燥温度对色泽变化有影响,干燥温度低于50 ℃有助于更好地保护花生色泽。
2.3.3 干燥条件对硬度的影响
花生作为重要的油料作物的一种,其硬度大小是影响后期加工的重要因素之一。干燥条件对花生仁硬度的影响如图7所示。花生作为多孔介质物料,干燥过程中多孔介质自然呈现的程度也会影响硬度的大小。热风干燥会产生硬化结壳现象,在花生表面形成干硬膜;红外干燥过程,红外辐射可穿透物料表层,使物料表面及表层的水分迅速蒸发,水分迁移蒸发后易产生孔隙[18],有利于疏松多孔结构的自然呈现,但长时间的红外干燥易造成样品表面的“结壳”现象[33]。随着转换含水率的增大,热风干燥时间缩短,红外干燥时间延长,硬度会逐渐减小。随着干燥温度的升高,水分蒸发速度加快,疏松多孔结构的呈现程度增大,花生硬度降低;但干燥温度过高,会导致花生升温过快而过度失水硬化,硬度增大。由于热风干燥时间过长,其表面结壳现象较红外-热风分段组合干燥更加显著,因此热风干燥所得样品硬度更高。
2.3.4 干燥条件对脂肪酸组成的影响
脂肪酸组成及含量是评价花生营养品质、油料价值及加工价值的重要指标。花生中的脂肪酸以不饱和脂肪酸为主,其中以油酸、亚油酸含量最多[34],具有抗氧化、降低胆固醇、降血脂、预防心脑血管疾病的作用。按照1.4.8节方法,所得结果如表3、表4所示。
表3 不同转换含水率对脂肪酸组成的影响 单位:%
Table 3 Effect of different converted moisture content on fatty acid composition
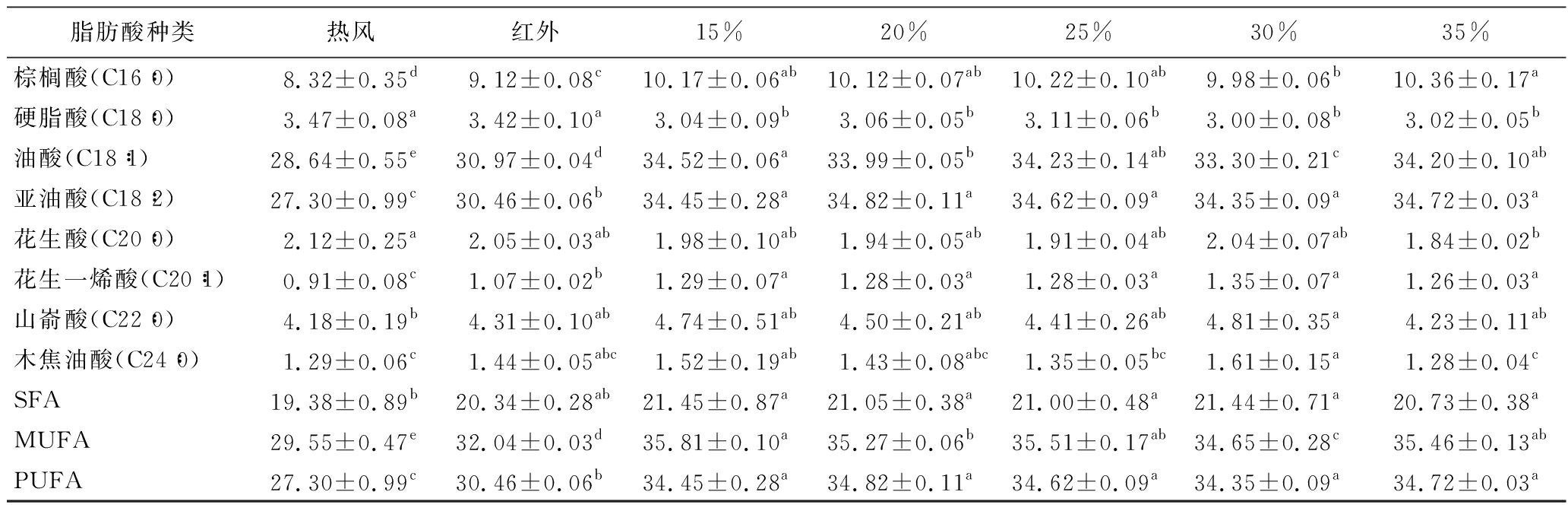
脂肪酸种类热风红外15%20%25%30%35%棕榈酸(C16∶0)8.32±0.35d9.12±0.08c10.17±0.06ab10.12±0.07ab10.22±0.10ab9.98±0.06b10.36±0.17a硬脂酸(C18∶0)3.47±0.08a3.42±0.10a3.04±0.09b3.06±0.05b3.11±0.06b3.00±0.08b3.02±0.05b油酸(C18∶1)28.64±0.55e30.97±0.04d34.52±0.06a33.99±0.05b34.23±0.14ab33.30±0.21c34.20±0.10ab亚油酸(C18∶2)27.30±0.99c30.46±0.06b34.45±0.28a34.82±0.11a34.62±0.09a34.35±0.09a34.72±0.03a花生酸(C20∶0)2.12±0.25a2.05±0.03ab1.98±0.10ab1.94±0.05ab1.91±0.04ab2.04±0.07ab1.84±0.02b花生一烯酸(C20∶1)0.91±0.08c1.07±0.02b1.29±0.07a1.28±0.03a1.28±0.03a1.35±0.07a1.26±0.03a山嵛酸(C22∶0)4.18±0.19b4.31±0.10ab4.74±0.51ab4.50±0.21ab4.41±0.26ab4.81±0.35a4.23±0.11ab木焦油酸(C24∶0)1.29±0.06c1.44±0.05abc1.52±0.19ab1.43±0.08abc1.35±0.05bc1.61±0.15a1.28±0.04cSFA19.38±0.89b20.34±0.28ab21.45±0.87a21.05±0.38a21.00±0.48a21.44±0.71a20.73±0.38aMUFA29.55±0.47e32.04±0.03d35.81±0.10a35.27±0.06b35.51±0.17ab34.65±0.28c35.46±0.13abPUFA27.30±0.99c30.46±0.06b34.45±0.28a34.82±0.11a34.62±0.09a34.35±0.09a34.72±0.03a
注:表中同行肩标小写字母不同表示不同处理组间差异显著(P<0.05)(表4同)。
表4 不同温度对脂肪酸组成的影响 单位:%
Table 4 Effect of different temperatures on fatty acid composition
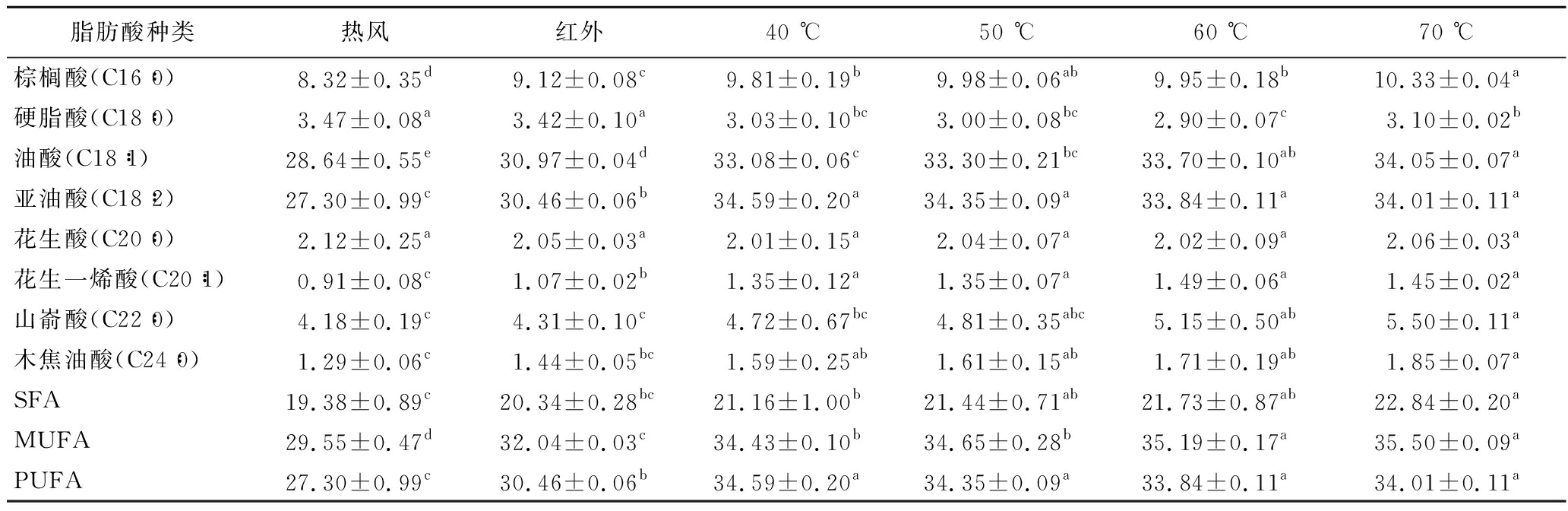
脂肪酸种类热风红外40 ℃50 ℃60 ℃70 ℃棕榈酸(C16∶0)8.32±0.35d9.12±0.08c9.81±0.19b9.98±0.06ab9.95±0.18b10.33±0.04a硬脂酸(C18∶0)3.47±0.08a3.42±0.10a3.03±0.10bc3.00±0.08bc2.90±0.07c3.10±0.02b油酸(C18∶1)28.64±0.55e30.97±0.04d33.08±0.06c33.30±0.21bc33.70±0.10ab34.05±0.07a亚油酸(C18∶2)27.30±0.99c30.46±0.06b34.59±0.20a34.35±0.09a33.84±0.11a34.01±0.11a花生酸(C20∶0)2.12±0.25a2.05±0.03a2.01±0.15a2.04±0.07a2.02±0.09a2.06±0.03a花生一烯酸(C20∶1)0.91±0.08c1.07±0.02b1.35±0.12a1.35±0.07a1.49±0.06a1.45±0.02a山嵛酸(C22∶0)4.18±0.19c4.31±0.10c4.72±0.67bc4.81±0.35abc5.15±0.50ab5.50±0.11a木焦油酸(C24∶0)1.29±0.06c1.44±0.05bc1.59±0.25ab1.61±0.15ab1.71±0.19ab1.85±0.07aSFA19.38±0.89c20.34±0.28bc21.16±1.00b21.44±0.71ab21.73±0.87ab22.84±0.20aMUFA29.55±0.47d32.04±0.03c34.43±0.10b34.65±0.28b35.19±0.17a35.50±0.09aPUFA27.30±0.99c30.46±0.06b34.59±0.20a34.35±0.09a33.84±0.11a34.01±0.11a
由表3、表4可知,花生仁中含量较高的脂肪酸有8种,分别是油酸、亚油酸、棕榈酸、山嵛酸、硬脂酸、花生酸、木焦油酸、花生一烯酸。与单一热风干燥及单一红外干燥相比,使用热风-红外分段组合干燥所得的花生仁脂肪酸含量较高,且差异显著。其中,饱和脂肪酸(saturated fatty acid, SFA)含量变化不大,而单不饱和脂肪酸(monounsaturated fatty acid, MUFA)、多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)含量变化较大,是因为不饱和脂肪酸中含有碳碳双键,其稳定性远远低于饱和脂肪酸[35]。受干燥过程中温度、湿度、氧气等因素的影响,不饱和脂肪酸会发生一定程度的氧化。相较于热风干燥,热风-红外分段组合干燥时间短,不饱和脂肪酸与氧气反应时间短;相较于红外干燥,前期物料快速升温预热,但排湿较慢,形成的高温高湿的环境使不饱和脂肪酸更容易发生氧化[36]。因此热风-红外分段组合干燥所得花生仁的不饱和脂肪酸含量较高。但转换含水率与干燥温度不同时,花生仁脂肪酸含量无较大变化。因此,采用热风-红外分段组合干燥作为花生油生产的前处理方法时,不同干燥条件对不饱和脂肪酸含量的影响可忽略。
2.3.5 干燥条件对蛋白二级结构的影响
花生除了油用价值外,其蛋白质含量也很高,占20%~28%,并且所含必需氨基酸与动物蛋白质非常接近,且不含胆固醇。与其他植物源蛋白相比,花生蛋白的消化性较高,其有效利用率高达98%,易于人体的消化吸收[37],其中赖氨酸有效利用率高达98.8%。与大豆蛋白中赖氨酸的有效利用率78%[38]相比,花生蛋白要高出20%。为探究干燥条件对花生蛋白质二级结构的影响,按照1.4.9节方法提取花生中的蛋白质,并利用FT-IR测定其二级结构相对含量,结果如图8所示。
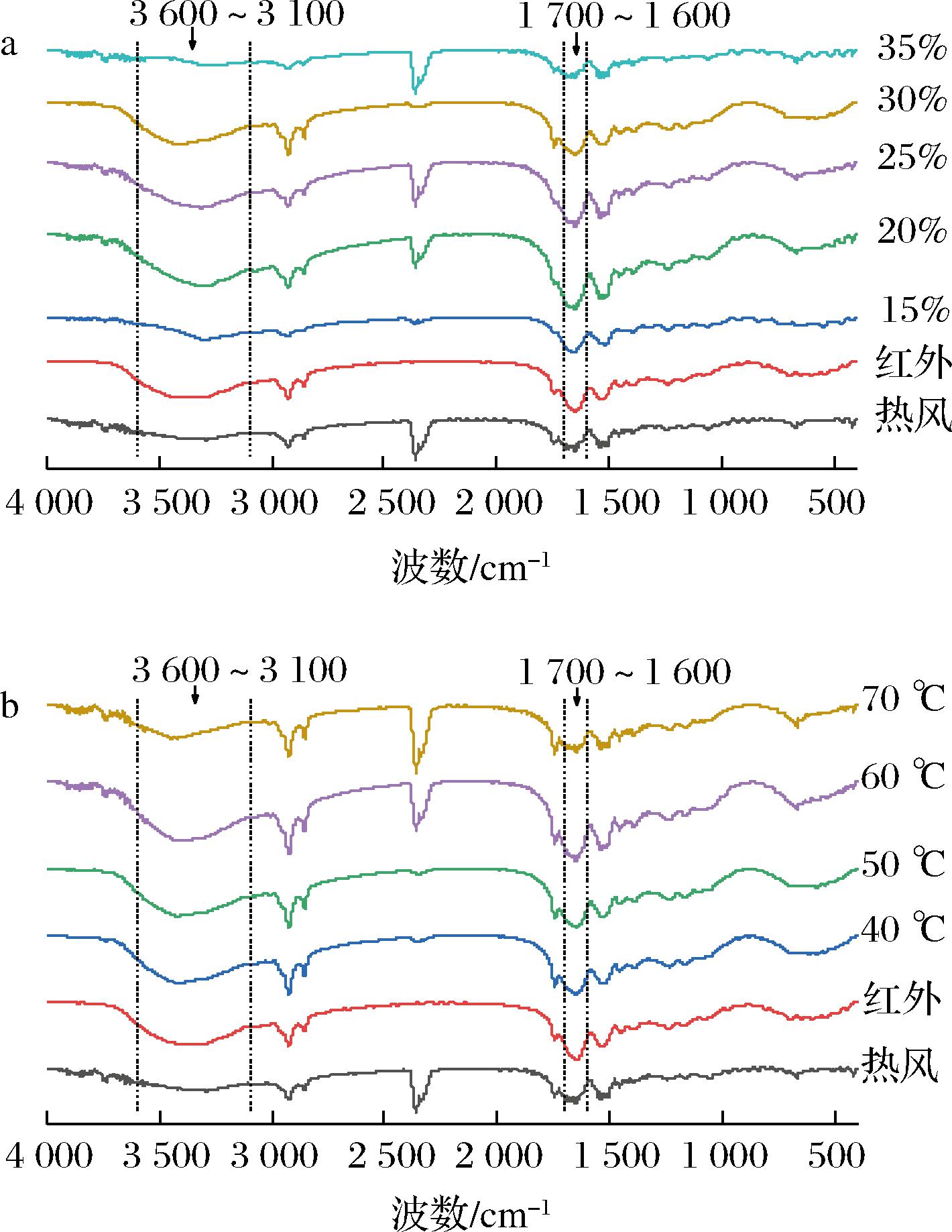
a-转换含水率;b-温度
图8 不同HAD-IRD干燥条件下花生蛋白FT-IR谱图
Fig.8 FT-IR spectra of peanut protein under different HAD-IRD drying conditions
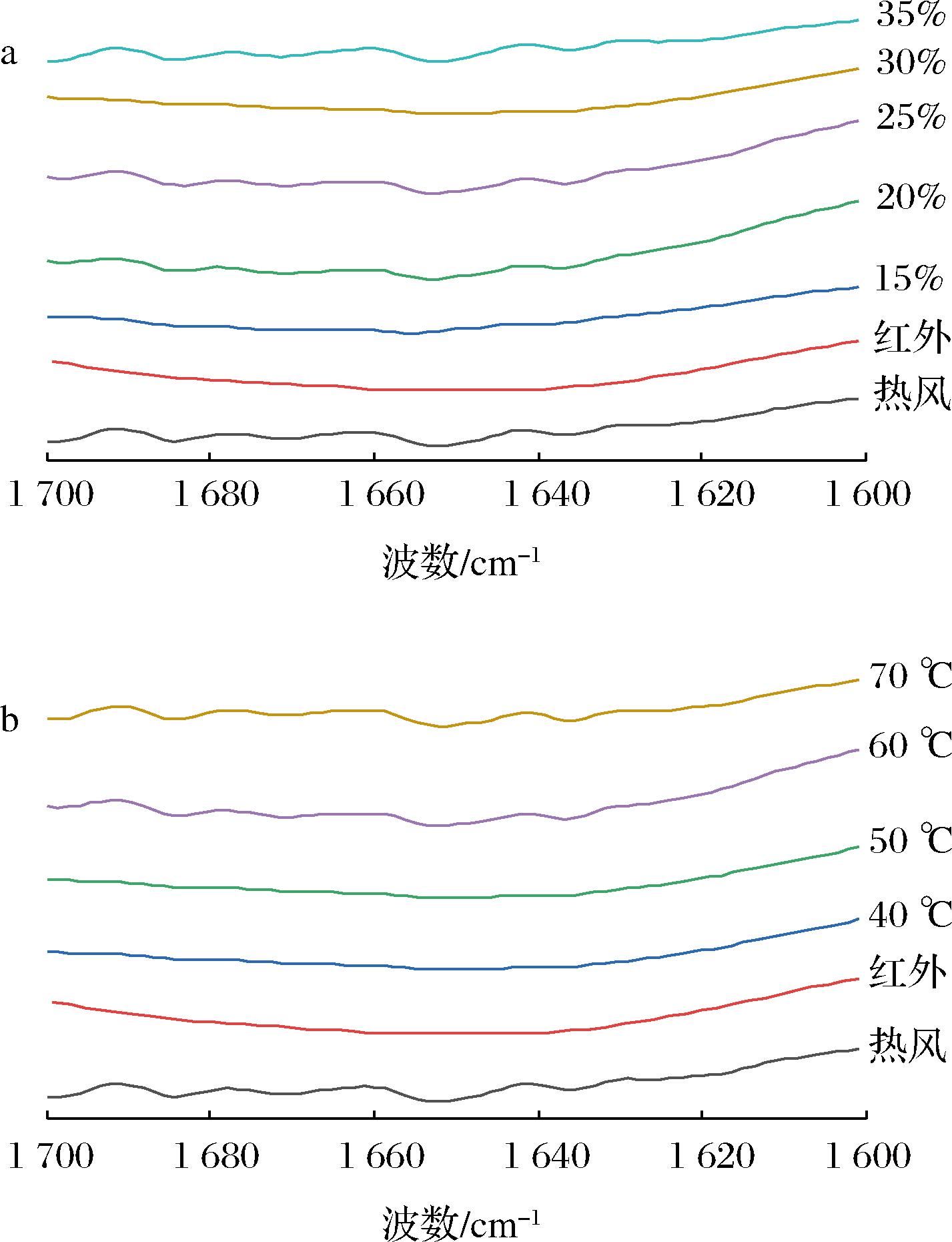
a-转换含水率;b-温度
图9 不同HAD-IRD干燥条件下花生蛋白酰胺 Ⅰ 带FT-IR谱图
Fig.9 FT-IR spectra of amideⅠof peanut protein under different HAD-IRD drying conditions
从图8可以看出,不同干燥条件下,特征吸收峰发生不同程度的蓝移或红移,其中3 600~3 100 cm-1及1 700~1 600 cm-1 2个波段变化最明显。波长3 600~3 100 cm-1段的化学结构表征为O—H伸缩振动、N—H伸缩振动,结合水中O—H基团与氨基酸中C![]() O所形成的分子内和分子间氢键。这表明花生蛋白分子中可能存在大量分子内或分子间氢键。波长1 700~1 600 cm-1段(酰胺Ⅰ带)的化学结构表征为羰基(C
O所形成的分子内和分子间氢键。这表明花生蛋白分子中可能存在大量分子内或分子间氢键。波长1 700~1 600 cm-1段(酰胺Ⅰ带)的化学结构表征为羰基(C![]() O)伸缩振动,能很好地反映蛋白质二级结构的变化。因此对酰胺Ⅰ带谱图(图9)做二阶导数并进行多次拟合,计算出各二级结构的相对含量如表5、表6所示。可以得出,热风-红外分段组合干燥后的花生蛋白二级结构以β-折叠为主,这与王文涛等[39]的研究结果相同。
O)伸缩振动,能很好地反映蛋白质二级结构的变化。因此对酰胺Ⅰ带谱图(图9)做二阶导数并进行多次拟合,计算出各二级结构的相对含量如表5、表6所示。可以得出,热风-红外分段组合干燥后的花生蛋白二级结构以β-折叠为主,这与王文涛等[39]的研究结果相同。
表5 不同转换含水率对蛋白二级结构相对含量的影响
Table 5 Effects of different converted moisture content on relative content of protein secondary structure
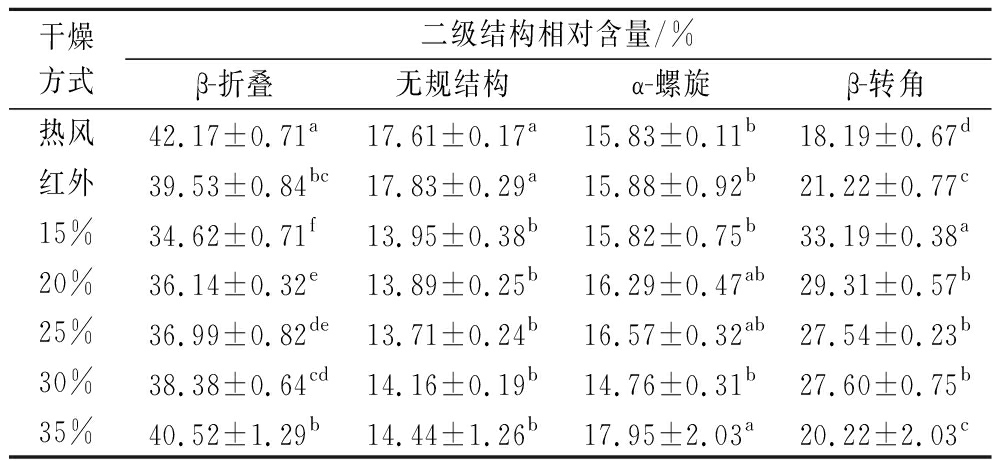
干燥方式二级结构相对含量/%β-折叠无规结构α-螺旋β-转角热风42.17±0.71a17.61±0.17a15.83±0.11b18.19±0.67d红外39.53±0.84bc17.83±0.29a15.88±0.92b21.22±0.77c15%34.62±0.71f13.95±0.38b15.82±0.75b33.19±0.38a20%36.14±0.32e13.89±0.25b16.29±0.47ab29.31±0.57b25%36.99±0.82de13.71±0.24b16.57±0.32ab27.54±0.23b30%38.38±0.64cd14.16±0.19b14.76±0.31b27.60±0.75b35%40.52±1.29b14.44±1.26b17.95±2.03a20.22±2.03c
表6 不同温度对蛋白二级结构相对含量的影响
Table 6 Effects of different temperatures on relative content of protein secondary structure
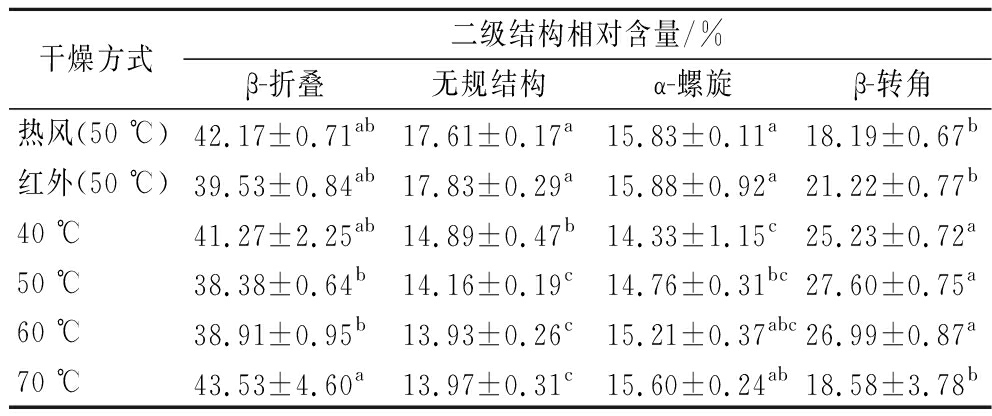
干燥方式二级结构相对含量/%β-折叠无规结构α-螺旋β-转角热风(50 ℃)42.17±0.71ab17.61±0.17a15.83±0.11a18.19±0.67b红外(50 ℃)39.53±0.84ab17.83±0.29a15.88±0.92a21.22±0.77b40 ℃41.27±2.25ab14.89±0.47b14.33±1.15c25.23±0.72a50 ℃38.38±0.64b14.16±0.19c14.76±0.31bc27.60±0.75a60 ℃38.91±0.95b13.93±0.26c15.21±0.37abc26.99±0.87a70 ℃43.53±4.60a13.97±0.31c15.60±0.24ab18.58±3.78b
由表5可知,随着转换含水率的升高,β-折叠相对含量增多,β-转角相对含量减少,而无规结构、α-螺旋相对含量无显著差异。这是由于随着转换含水率的升高,干燥时间缩短,花生蛋白发生变性但未形成聚集体。转换含水率为15%时,干燥时间最长,花生蛋白结构被破坏得最强,导致β-折叠转化为β-转角最多,因此其β-折叠含量最少。与单独热风干燥相比,热风-红外分段组合干燥所得花生蛋白β-折叠、无规结构相对含量明显较低,α-螺旋含量无明显差异、β-转角含量明显较高,这可能与花生干燥时长有关;与单一红外干燥相比,热风-红外分段组合干燥也表现出相同的结果,这与红外线较强的穿透性有关。干燥过程中的高温会破坏花生蛋白的结构,使氢键断裂,分子间作用被破坏,β-折叠向β-转角转化[40],然而过长的干燥时间或高温高湿的环境都会使得疏水性残基和反应基团的暴露,导致聚集反应的发生,从而β-转角结构含量减少,β-折叠结构含量增多。
由表6可知,随着干燥温度的升高,β-折叠相对含量呈现先降低后升高的趋势,β-转角含量呈现先升高后降低的趋势;无规卷曲含量由40 ℃的14.89%降低到70 ℃的13.97%;α-螺旋含量由40 ℃的14.33%升高到70 ℃的15.60%。其原因是:干燥温度升高导致花生蛋白二级结构部分被破坏,氢键断裂,β-折叠转变为β-转角,而蛋白分子变性重新聚集,逐渐形成聚集体[27],β-折叠、α-螺旋含量增加,无规结构、β-转角含量减少。
3 结论
与单一热风干燥及单一红外干燥相比:热风-红外分段组合干燥时间较热风干燥缩短62.5%,干燥能耗减少了70.27%,与红外干燥接近;花生仁色泽及硬度更接近新鲜花生;不饱和脂肪酸含量显著提高(P<0.05);干燥时间及高温导致花生蛋白氢键断裂,蛋白分子变性重新聚集,逐渐形成聚集体,从而导致花生蛋白二级结构相对含量有变化。研究得出热风-红外分段组合干燥方法较单一热风干燥及单一红外干燥更适用于带壳鲜花生的干燥。
采用热风-红外分段组合干燥,相同条件下,转换含水率和干燥温度越高,带壳鲜花生干燥越快。转换含水率和干燥温度对色泽变化有影响,但影响较小。干燥后花生硬度随转换含水率和干燥温度的升高而减小。应用于实际生产中,干燥温度最高不超过50 ℃,可减小能耗,节约资源,且有助于保护花生色泽。干燥条件的变化对脂肪酸含量影响不显著。转换含水率的提高显著提高β-折叠的相对含量,有助于花生蛋白性质的稳定,干燥温度对二级结构相对含量影响不显著(P>0.05)。
[1] 叶梦然. 中国花生产品国际竞争力研究[D].杭州:浙江农林大学, 2014.
YE M R.A research into the international competitiveness of China′s peanut product[D].Hangzhou:Zhejiang A&F University, 2014.
[2] 郝翠翠. 花生转录因子AhWRI1基因的克隆与功能研究[D].青岛:青岛科技大学, 2018.
HAO C C.Cloning and functional analysis of AhWRI1 transcrition factors from peanut[D].Qingdao:Qingdao University of Science &Technology, 2018.
[3] 于丽娜, 张初署, 毕洁, 等.不同花生品种制作花生芽及营养成分分析[J].食品工业科技, 2017, 38(14):304-309.
YU L N, ZHANG C S, BI J, et al.Research of peanut sprout production by different varieties of peanut and its nutrition analysis [J].Science and Technology of Food Industry, 2017, 38(14):304-309.
[4] 杨潇. 新鲜花生热风干燥试验研究[D].北京:中国农业机械化科学研究院, 2017.
YANG X.Experimental study on fresh peanut hot air drying[D].Beijing:Chinese Academy of Agricultural Mechanization Sciences, 2017.
[5] 周巾英, 罗晶, 何家林, 等.我国花生机械化干燥生产现状与发展[J].江西农业学报, 2019, 31(2):66-69.
ZHOU J Y,LUO J,HE J L, et al.Current situation and development of mechanized dry production of peanut in China[J].Acta Agriculture Jiangxi, 2019, 31(2):66-69.
[6] 颜建春, 魏海, 谢焕雄, 等.筒状固定床花生通风干燥性能指标模拟与分析[J].农业工程学报, 2020, 36(1):292-302.
YAN J C, WEI H, XIE H X, et al.Performance index simulation and analysis of peanut ventilation drying in barrel-shaped fixed bed[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(1):292-302.
[7] 林子木, 赵卉, 李玉, 等.花生热风干燥特性及动力学模型的研究[J].农业科技与装备, 2020(2):31-33.
LIN Z M, ZHAO H, LI Y, et al.Study on hot air drying characteristics and kinetic model of peanut[J].Agricultural Science &Technology and Equipment, 2020(2):31-33.
[8] 渠琛玲, 王雪珂, 汪紫薇, 等.花生果常温通风干燥实验研究[J].中国粮油学报, 2020, 35(1):121-125.
QU C L, WANG X K, WANG Z W, et al.Experimental study on peanut drying by ventilation at room temperature[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(1):121-125.
[9] 王安建, 高帅平, 田广瑞, 等.花生热泵干燥特性及动力学模型[J].农产品加工, 2015(5):57-60.
WANG A J, GAO S P, TIAN G R, et al.Heat pump drying characteristics and dynamics model of peanut[J].Farm Products Processing, 2015(5):57-60.
[10] PATIL U G, CHAVAN J K, KADAM S S, et al.Effects of dry heat treatments to peanut kernels on the functional properties of the defatted meal[J].Plant Foods for Human Nutrition, 1993, 43(2):157-162.
[11] DENG L Z, PAN Z L, MUJUMDAR A S, et al.High-humidity hot air impingement blanching (HHAIB) enhances drying quality of apricots by inactivating the enzymes, reducing drying time and altering cellular structure[J].Food Control, 2019, 96:104-111.
[12] DENG L Z, MUJUMDAR A S, ZHANG Q, et al.Chemical and physical pretreatments of fruits and vegetables:Effects on drying characteristics and quality attributes-a comprehensive review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(9):1408-1432.
[13] 王招招, 杨慧, 韩俊豪, 等.花生果微波-热风耦合干燥实验研究[J].中国粮油学报, 2021, 36(1):155-164.
WANG Z Z, YANG H, HAN J H, et al.Experimental study on microwave-hot air coupled drying process for peanut pods[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(1):155-164.
[14] 凌铮铮, 任广跃, 段续, 等.间歇微波-热风耦合干燥花生工艺优化及品质研究[J].食品与机械, 2020, 36(10):183-189;227.
LING Z Z, REN G Y, DUAN X,et al.Research on process optimization and quality of intermittent microwave-hot air coupling drying peanut[J].Food and Machinery, 2020, 36(10):183-189;227.
[15] ZENG S Y, DU Z L, LV W Q, et al.Experimental study on the hygrothermal dynamics of peanut (Arachis hypogaea Linn.) in the process of superposition and variable temperature drying[J].Drying Technology, 2022, 40(7):1463-1477.
[16] 段续, 张萌, 任广跃, 等.玫瑰花瓣红外喷动床干燥模型及品质变化[J].农业工程学报, 2020, 36(8):238-245.
DUAN X, ZHANG M, REN G Y, et al.Drying models and quality changes of rose subjected to infrared assisted spouted bed drying[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(8):238-245.
[17] 曲文娟, 凡威, 马海乐, 等.核桃滚筒催化红外-热风干燥试验及能耗分析[J].食品与机械, 2021, 37(5):163-168;193.
QU W J, FAN W, MA H L, et al.Experiment and energy consumption analysis of walnut drum catalytic infrared-hot air drying [J].Food and Machinery, 2021, 37(5):163-168;193.
[18] 刘德成, 郑霞, 肖红伟, 等.红枣片冷冻-红外分段组合干燥工艺优化[J].农业工程学报, 2021, 37(17):293-302.
LIU D C, ZHENG X, XIAO H W, et al.Optimization of sequential freeze-infrared drying process of jujube slices[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(17):293-302.
[19] 余政毫, 朱文学, 白喜婷, 等.基于低场核磁共振及成像技术的油莎豆远红外干燥过程中水分变化规律[J].食品与发酵工业, 2022, 48(16):131-137.
YU Z H, ZHU W X, BAI X T, et al.Rule of water changes in the far-infrared drying of tiger nut based on low-field NMR and imaging technology[J].Food and Fermentation Industries, 2022, 48(16):131-137.
[20] DUAN X, ZHANG M, MUJUMDAR A S.Study on a combination drying technique of sea cucumber[J].Drying Technology, 2007, 25(12):2011-2019.
[21] WANG H C, ZHANG M, ADHIKARI B.Drying of shiitake mushroom by combining freeze-drying and mid-infrared radiation [J].Food and Bioproducts Processing, 2015, 94:507-517.
[22] 国家粮食储备局无锡科学研究设计院. 油料水分及挥发物含量测定[Z].中华人民共和国国家质量监督检验检疫总局;中国国家标准化管理委员会,2008:12.
Wuxi Scientific Research and Design Institute of State Grain Reserve Administration.Oilseeds—Determination of moisture and volatile matter content[Z].General Administration of Quality Supervision, Inspection and Quarantine of the People′s Republic of China,Standardization Administration of the People′s Republic of China.2008:12.
[23] DAI J W, RAO J Q, WANG D, et al.Process-based drying temperature and humidity integration control enhances drying kinetics of apricot halves[J].Drying Technology, 2015, 33(3):365-376.
[24] 卢映洁, 任广跃, 段续, 等.热风干燥过程中带壳鲜花生水分迁移特性及品质变化[J].食品科学, 2020, 41(7):86-92.
LU Y J, REN G Y, DUAN X, et al.Moisture migration properties and quality changes of fresh in-shell peanuts during hot air drying[J].Food Science, 2020, 41(7):86-92.
[25] 陈拾旸, 刘风英, 陈会民, 等.5株双歧杆菌代谢产物及细胞中脂肪酸构成的气相色谱-质谱分析[J].食品与机械, 2021, 37(4):19-25.
CHEN S Y, LIU F Y, CHEN H M, et al.Analysis of fatty acid profile in metabolites and cells of five Bifidobacterium strains by GC-MS[J].Food and Machinery, 2021, 37(4):19-25.
[26] 严永红, 郑召君, 林叶, 等.臭氧处理对花生蛋白结构性能的影响[J].中国粮油学报, 2021, 36(1):61-67.
YAN Y H, ZHENG S J, LIN Y, et al.Effects of ozone on the structural characteristics of peanut protein[J].Journal of the Chinese Cereals and Oils Association, 2021, 36(1):61-67.
[27] 李响, 张焕丽, 郭世龙, 等.不同改性方法对花生蛋白理化特性影响研究[J].中国粮油学报, 2021, 36(9):101-108.
LI X, ZHANG H L, GUO S L, et al.Effects of different modification methods on physicochemical properties of peanut protein [J].Journal of the Chinese Cereals and Oils Association, 2021, 36(9):101-108.
[28] 段续, 刘文超, 任广跃.热风干燥联合真空降温缓苏提升黄秋葵干制品品质[J].农业工程学报, 2016, 32(18):263-270.
DUAN X, LIU W C, REN G Y.Hot air drying combined vacuum ventilation tempering improving quality of dried okra products [J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(18):263-270.
[29] RASHID M T, MA H L, JATOI M A, et al.Multi-frequency ultrasound and sequential infrared drying on drying kinetics, thermodynamic properties, and quality assessment of sweet potatoes[J].Journal of Food Process Engineering, 2019, 42(5):e13127.
[30] WU X F, ZHANG M, BHANDARI B.A novel infrared freeze drying (IRFD) technology to lower the energy consumption and keep the quality of Cordyceps militaris[J].Innovative Food Science &Emerging Technologies, 2019, 54:34-42.
[31] XIAO H W, YAO X D, LIN H, et al.Effect of SSB (superheated steam blanching) time and drying temperature on hot air impingement drying kinetics and quality attributes of yam slices[J].Journal of Food Process Engineering, 2012, 35(3):370-390.
[32] LI X, ZHENG Y, LIU M, et al.A study on Maillard reaction and its products during processing of red ginseng[J].China Journal of Chinese materia medica, 1997, 24(5):274-278;318.
[33] 彭健, 王蔚婕, 唐道邦, 等.分段式远红外-热泵干燥对龙眼品质的影响[J].食品科学, 2020, 41(19):118-223.
PENG J, WANG W J, TANG D B, et al.Effect of multi-stage far-infrared radiation-assisted heat pump drying on the quality characteristics of Longan[J].Food Science, 2020, 41(19):118-223.
[34] 李鹏飞. 水酶法提取花生油及蛋白质[D].无锡:江南大学, 2017.
LI P F.Enzyme-assisted aqueous extraction of oil and protein from peanut[D].Wuxi:Jiangnan University, 2017.
[35] SHI R, GUO Y, VRIESEKOOP F, et al.Improving oxidative stability of peanut oil under microwave treatment and deep fat frying by stearic acid-surfacant-tea polyphenols complex[J].European Journal of Lipid Science &Technology, 2015, 117(7):1008-1015.
[36] 朱凯阳, 任广跃, 段续, 等.不同干燥方式下带壳鲜花生质构、营养成分及能耗的表征[J].中国食品学报, 2022, 22(4):177-188.
ZHU K Y, REN G Y, DUAN X, et al.Characterization of texture, nutrients and energy consumption of fresh flower with shell under different drying methods[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(4):177-188.
[37] 封小龙. 花生蛋白组分制备、改性及应用研究[D].北京:中国农业科学院, 2014.
FENG X L.Study on the preparation, modification and application of the peanut protein fractions[D].Beijing:Chinese Academy of Agricultural Sciences, 2014.
[38] TOGIAS A, COOPER S F, ACEBAL M L, et al. Addendum guidelines for the prevention of peanut allergy in the United States: Report of the National Institute of Allergy and Infectious Diseases-sponsored expert panel[J]. The Journal of Allergy and Clinical Immunology, 2017, 139(1): 29-44.
[39] 王文涛, 张华, 刘兴丽, 等.等离子体对花生蛋白功能特性和结构的影响[J].中国粮油学报, 2021, 36(2):54-59;66.
WANG W T, ZHANG H, LIU X L, et al.Effects of plasma treatment on functional properties and structure of peanut protein [J].Journal of the Chinese Cereals and Oils Association, 2021, 36(2):54-59;66.
[40] 王晓琳. 花生蛋白二级结构与乳化性关系及其对提高花生饮料稳定性的研究[D].锦州:渤海大学, 2016.
WANG X L.Studies on the peanut protein secondary structure and the emulsifying development of peanut beverage and research [D].Jinzhou:Bohai University, 2016.