木瓜蛋白酶是一种分子质量23.4 kDa,含有212个残基的半胱氨酸内肽酶,在pH 5~8有着较高的酶活性,最佳温度为65 ℃,等电点值为8.75[1]。
木瓜蛋白酶普遍应用于食品、饲料等行业,如肉类嫩化[2]、乳品加工[3]、烘焙[1]、饲料[4]、牙齿美白[5]、治疗烧伤和去除龋齿[6]等。
制作木瓜蛋白酶的传统方法有盐析法、有机溶剂法、超滤法、亲和层析法等。盐析法简单方便,但是最高只有39%的纯度以及无法去除其他杂蛋白使得这种方法无法应用于大规模及高纯度木瓜蛋白酶的制作[7];有机溶剂法能获得纯度较高的木瓜蛋白酶,但酶活性回收率较低[8];超滤法由于浓差极化现象,会影响木瓜蛋白酶的萃取效果,并且无法分离分子质量与木瓜蛋白酶分子质量相近的酶[9];亲和层析法要求前处理液必须经过一定步骤的纯化,且操作复杂,产量较低,不适合大规模生产,优点是纯度较高[10]。
双水相萃取(aqueous two-phase extraction, ATPE)在下游加工中表现出巨大的技术和经济优势,具有巨大的应用潜力。涉及分离、浓缩和纯化的几个阶段可以减少并被ATPE取代,从而使整个回收过程更加节能、成本更低[11]。与传统方法相比,使用ATPE进行分离萃取具有许多优点,包括工艺简单、分离迅速、选择性高、能耗低、成本低等[12],然而很少有研究以中试规模开发连续。多级ATPE使用最多的2种设备是混合沉淀柱和萃取柱,离心分离色谱法和逆流色谱法也被应用于连续或半连续的ATPE[13]。
本课题组通过前期实验,发现聚乙二醇6000(polyethylene glycol 6000,PEG6000)和柠檬酸钠(Na3C6H5O7)组成的双水相体系相比于其他PEG-盐体系在萃取木瓜蛋白酶方面有着更好的表现。本研究通过研究多级PEG6000-Na3C6H5O7双水相体系萃取木瓜蛋白酶获得理论萃取级数并设计出优化的萃取方案。
1 材料与方法
1.1 材料与试剂
柠檬酸钠(Na3C6H5O7),上海麦克林生化科技有限公司;PEG6000,天津光复精细化研究所;木瓜蛋白酶,海口炫铮科技有限公司;L-酪氨酸,上海源叶生物科技有限公司;三氯乙酸、考马斯亮蓝G-250,西陇科学股份有限公司。
1.2 仪器与设备
GL-88B旋转混合器,海门市其林贝尔仪器制造有限公司;Varioskan LUX多功能酶标仪,Thermo Fisher;752 N紫外分光光度计,上海仪电分析仪器有限公司;HH-4恒温水浴锅,常州凯航仪器。
1.3 实验方法
1.3.1 木瓜蛋白酶活性测定
参考张兴灿等[14]方法测定木瓜蛋白酶活性。
1.3.2 萃取级数对木瓜蛋白酶酶活性回收率的影响
参考BABALOLA等[15]方法将双水相相比固定在0.5,分别进行1~7级错流双水相萃取,并与同萃取级数的逆流萃取相对比。每一级双水相体系混合均匀并静置完全分相后,测定每一级上相中的木瓜蛋白酶的酶活性回收率。
1.3.3 木瓜蛋白酶萃取平衡等温线的绘制
参考RZIKI等[16]方法绘制萃取平衡等温线。
1.3.4 多级逆流双水相理论级数的计算
参考LIU等[17]方法和ROSA等[18]方法进行多级逆流双水相理论级数的计算。
1.3.5 PEG6000-Na3C6H5O7多级双水相萃取木瓜蛋白酶
参考刘毅[19]方法分别使用多级错流和多级逆流双水相方法萃取木瓜蛋白酶。
相比Vr计算如公式(1)所示:
(1)
分配系数K计算如公式(2)所示:
(2)
酶活性回收率Ye如公式(3)所示:
(3)
式中:Ct和Cb分别代表目标物质木瓜蛋白酶在双水相体系在上、下相中的不同质量浓度,mg/mL;Vt和Vb分别代表上相和下相的体积,mL;Et为上相酶活性浓度,U/mL;Me为加入系统酶的总活性,U。
2 结果与分析
2.1 相比对木瓜蛋白酶分配行为的影响
如图1所示,随着双水相两相的体积比Vr从0.25增加到1.6,木瓜蛋白酶的酶活性回收率从71.52%增大至87.21%,分配系数从1.21增加至3.17,说明增加相比能显著提高萃取效率。当相比从1.6增加至2.0,分配系数和酶活性回收率均有所下降,这是因为PEG6000的质量分数增加,导致上相浓度增加,空间阻力增加,木瓜蛋白酶的选择性分配效果减弱[20]。
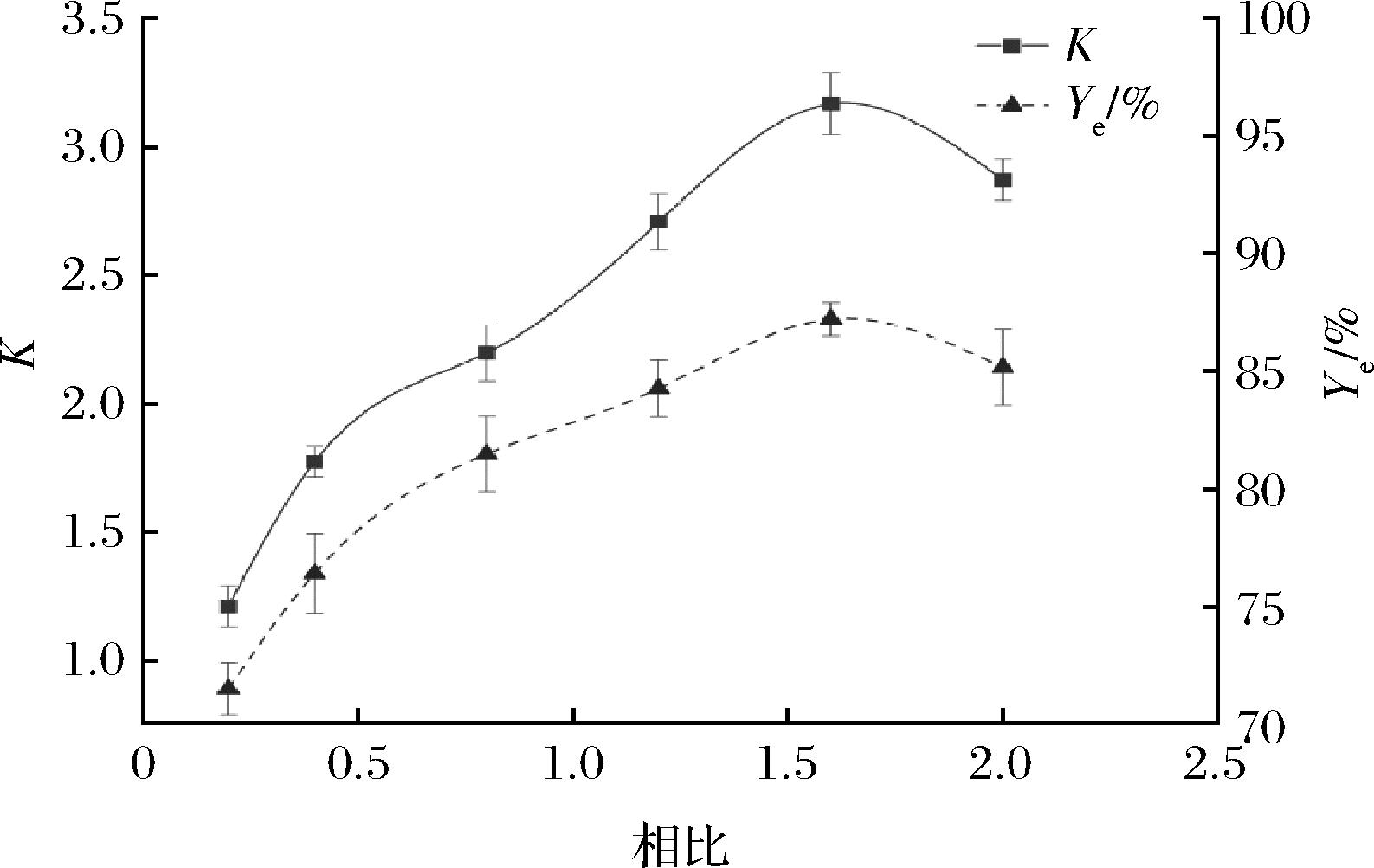
图1 相比对木瓜蛋白酶分配行为的影响
Fig.1 Effect of volume ratio on partitioning behavior of papain
2.2 萃取级数对木瓜蛋白酶酶活性回收率的影响
在多级双水相萃取中,如果在第一级没有富集到很高的回收率是不重要的,因为可以通过增加萃取级数来进行补偿,且相比较高时,会使更多的污染物从下相分配到上相,导致目标物的纯度降低[18],因此,选择0.5的相比进行多级双水相的研究。由图2可以看出,在同相比的条件下,随着萃取级数的增加,多级错流和逆流双水相都能够较为显著地提升木瓜蛋白酶的酶活性回收率。对于多级错流双水相,经过5级错流萃取后,木瓜蛋白酶的酶活性回收率达到了96.63%,6~7级的错流萃取略有下降。由图2可知,在3级双水相错流萃取后,酶活性回收率的增长幅度明显降低,仅增加了1.53%,这说明大部分的木瓜蛋白酶已在前3级完成萃取;多级逆流双水相萃取木瓜蛋白酶的趋势与错流相似,在第5级时达到最大酶活性回收率为97.92%,略高于同级数的错流萃取,且大部分的木瓜蛋白酶已在前3级被萃取出来。
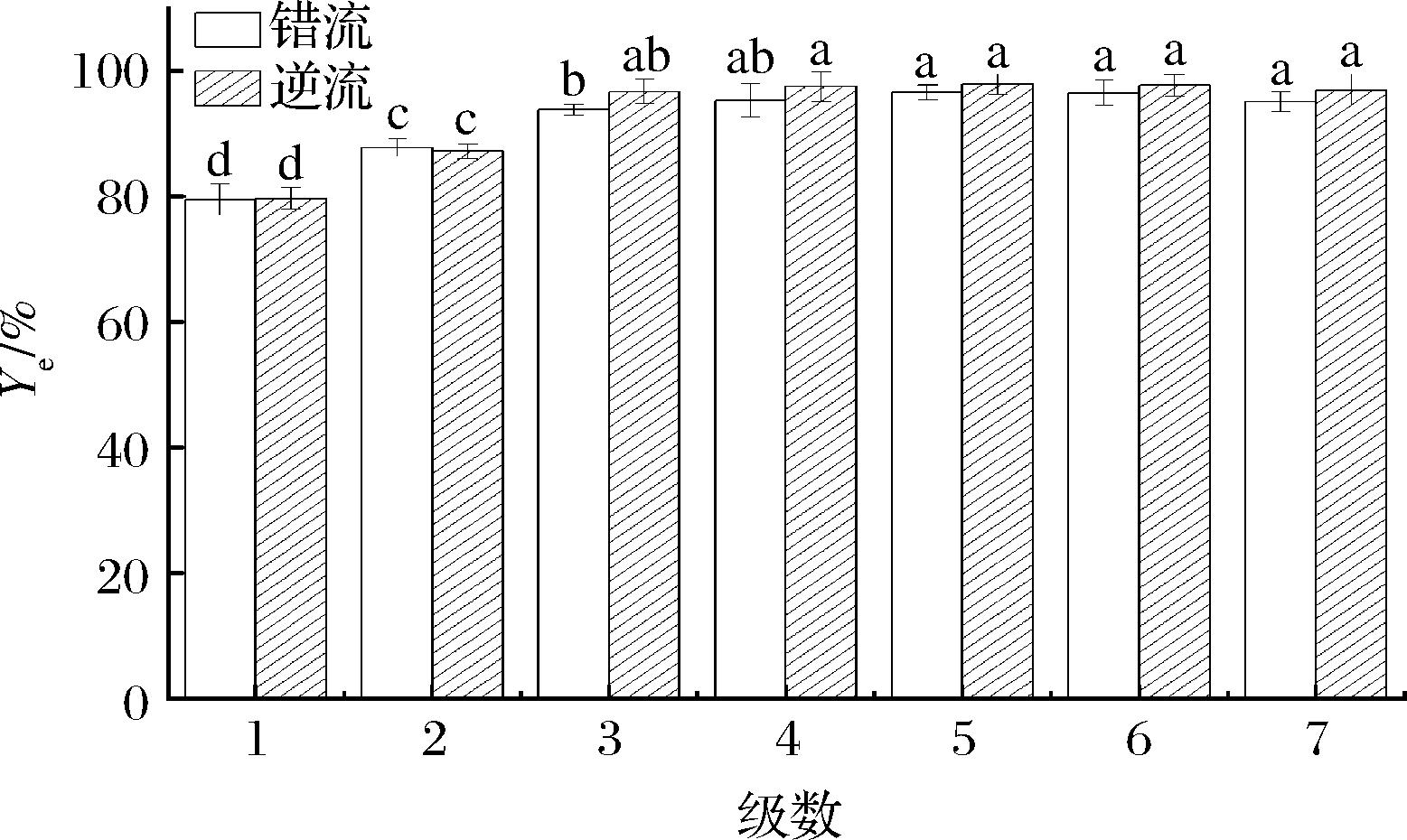
图2 相同相比条件下的多级错流萃取和多级逆流萃取
Fig.2 Multi-stage crosscurrent and countercurrent extraction under the same volume ratio
注:不同小写字母表示差异显著(P<0.05)(下同)。
以上结果说明,在相比为0.5的条件下,通过多级错流或逆流萃取提高木瓜蛋白酶萃取率的方法是切实可行的,经过5级错流双水相萃取,木瓜蛋白酶的酶活性回收率增加了15.57%,经过5级逆流双水相萃取,酶活性回收率增加了18.19%。
2.3 多级错流双水相对比多级逆流双水相
如图3所示,比较了0.3、0.5、0.7相比下五级错流双水相萃取木瓜蛋白酶的差异,并与0.5相比下的5级逆流双水相萃取进行比较,可以发现相比增加和萃取级数增加都能使最终的酶活性回收率得到明显提高。经过五级错流萃取后,分别能达到90.41%、96.32%、95.38%的酶活性回收率,在相比0.5的条件下,5级逆流萃取后,酶活性回收率也达到了97.92%。
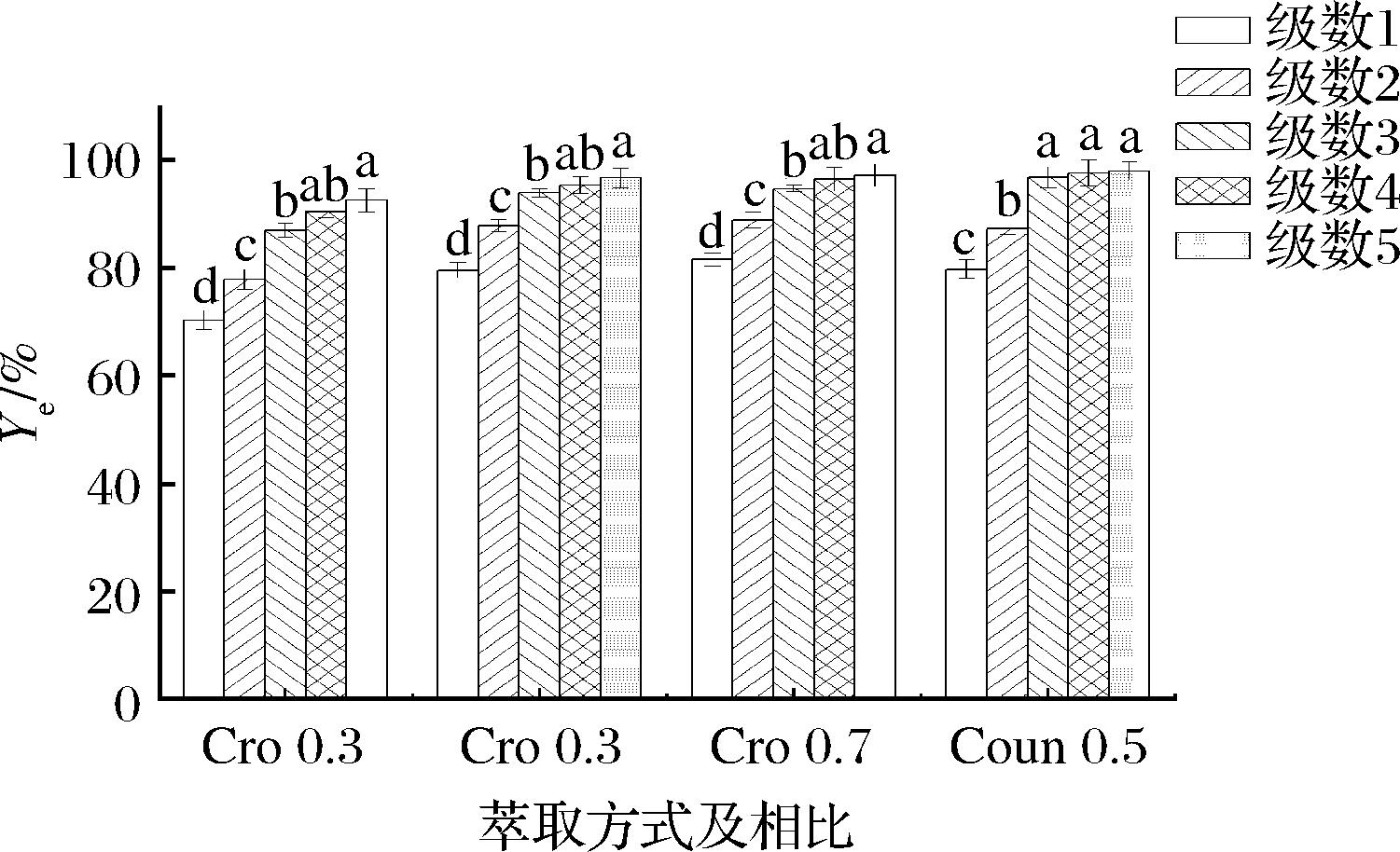
图3 相同相比条件下的多级错流(Cro)萃取和多级逆流(Coun)萃取
Fig.3 Multi-stage crosscurrent extraction and multi-stage countercurrent extraction at the same volume ratio
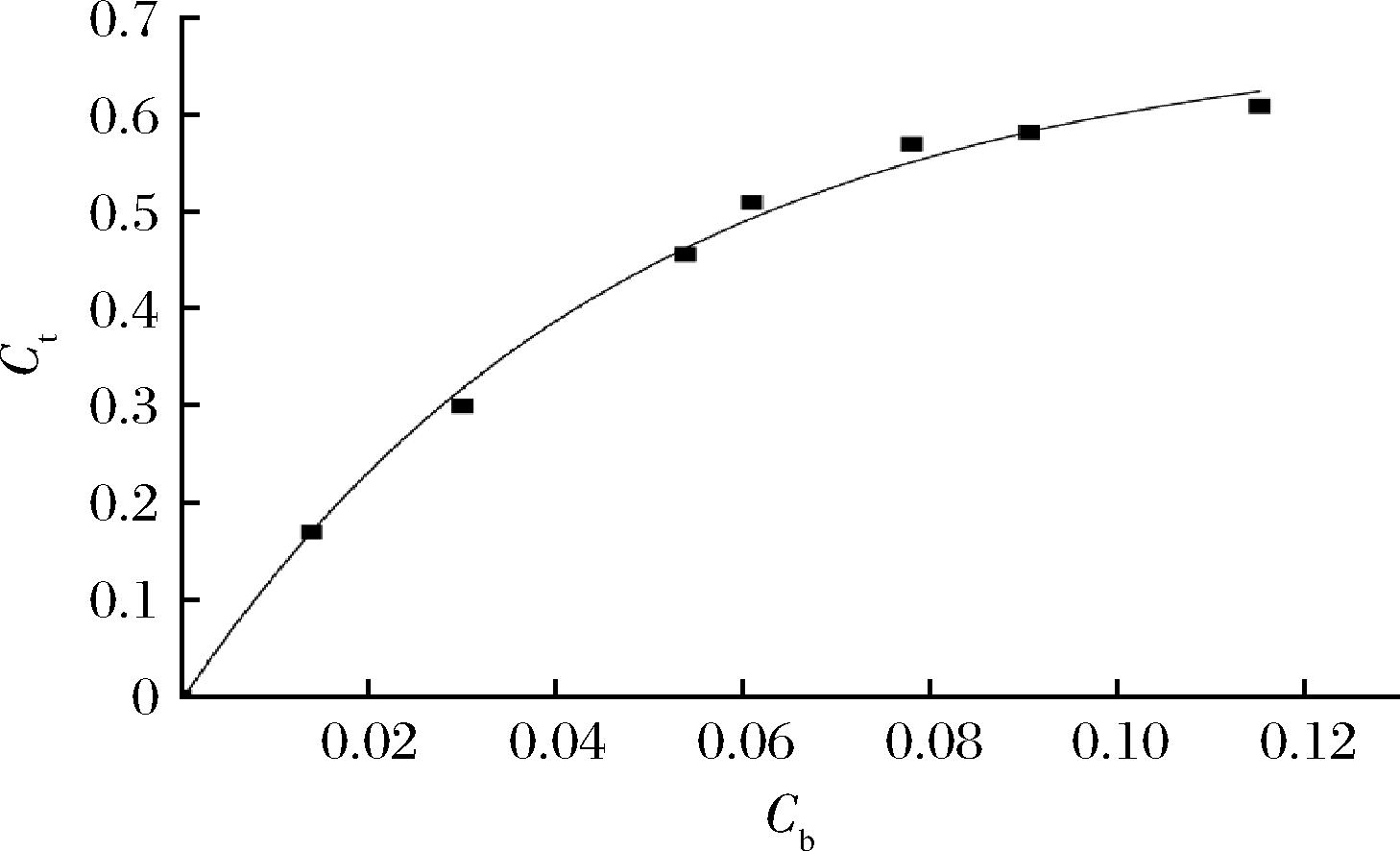
图4 木瓜蛋白酶的萃取平衡等温线
Fig.4 The extraction equilibrium isotherm curve of papain
由于多级错流萃取和多级逆流萃取原理上的差异,为了提高酶活性回收率,多级错流萃取每一级都要加入新的PEG萃取相。因此要想获得同样的酶活性回收率,多级错流萃取需要的PEG萃取剂的量要多于多级逆流萃取[19]。由图2和图3可知,相同相比和萃取级数条件下,多级逆流萃取的酶活性回收率要高于多级错流萃取,因此选择多级逆流萃取进行多级双水相萃取木瓜蛋白酶的研究。
2.4 萃取平衡等温线的绘制
萃取平衡等温线(extraction equilibrium isotherm)是双水相萃取过程中的一个关键的萃取因素,能够很好地反映出目标物在平衡两相之间的分配关系[21],并且可以用于模拟多级萃取的级数及相关规律,最具代表性的就是McCabe Thiele图解法[22]。表1是不同相比条件下,上相中木瓜蛋白酶的浓度(Ct)和下相中木瓜蛋白酶的浓度(Cb)。因为在双水相萃取过程中,上相PEG的质量以及下相柠檬酸钠的质量均为常量,所以可以下相中木瓜蛋白酶浓度Cb为横坐标,上相中木瓜蛋白酶的浓度Ct为纵坐标绘制曲线,即为萃取平衡等温线。得到的拟合曲线方程为Y=0.689 58-0.696 85×exp(-X/0.051 01),其中R2=0.994 2,AdjR2=0.991 9。
表1 不同相比下木瓜蛋白酶双水相在上下相的质量浓度
Table 1 Concentration of papain in top and bottom phase at different volume ratio
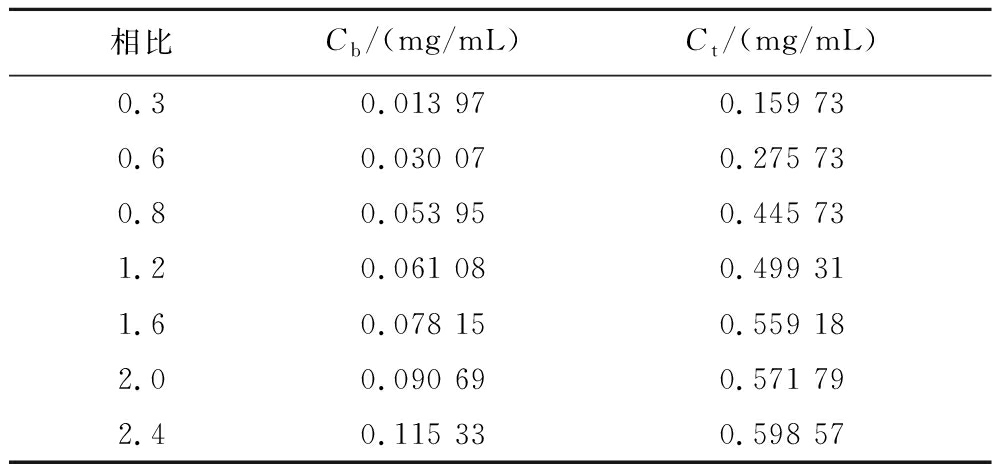
相比Cb/(mg/mL)Ct/(mg/mL)0.30.013 970.159 730.60.030 070.275 730.80.053 950.445 731.20.061 080.499 311.60.078 150.559 182.00.090 690.571 792.40.115 330.598 57
2.5 多级逆流双水相的模拟计算
在这个过程中假设各级加入的PEG用量相同,与下相互溶度很小,且双水相完全分相后只有上相及下相2个部分,萃取过程中没有发生热效应。参考ROSA等[18]方法,对目标物进行物料衡算可得:
VBP×[Solute]BP inlet+VTP×[Solute]TP inlet=VBP×[Solute]BP outlet+VTP×[Solute]TP outlet
(4)
进而可得操作线方程为:
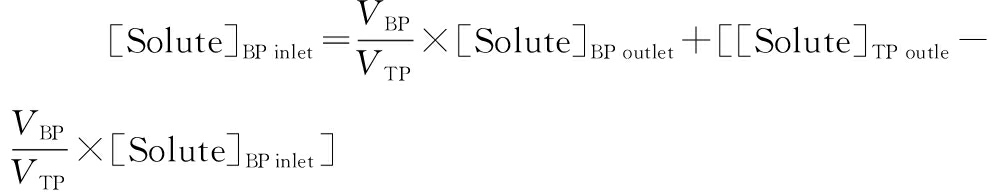
(5)
式中:[Solute]BP inlet和[Solute]BP outlet表示系统中各级双水相上相和下相的木瓜蛋白酶的质量浓度,mg/mL;VBP表示下相的体积,mL;VTP表示上相的体积,mL。
图5采用图解法获得多级逆流双水相的理论级数,由于VBP/VTP为定值,所以操作线是固定斜率的直线,截距为![]() 点(a,b)是流出下相(a)和流入上相(b)中木瓜蛋白酶的浓度,点(c,d)是流入下相(c)和流出上相(d)中木瓜蛋白酶浓度。由于初始PEG上相中不含木瓜蛋白酶,如果回收率为100%,则操作线应穿过点(0,0)。从(c,d)点开始在两者之间多次画阶梯,所画阶梯数即为所需的理论级数N。
点(a,b)是流出下相(a)和流入上相(b)中木瓜蛋白酶的浓度,点(c,d)是流入下相(c)和流出上相(d)中木瓜蛋白酶浓度。由于初始PEG上相中不含木瓜蛋白酶,如果回收率为100%,则操作线应穿过点(0,0)。从(c,d)点开始在两者之间多次画阶梯,所画阶梯数即为所需的理论级数N。
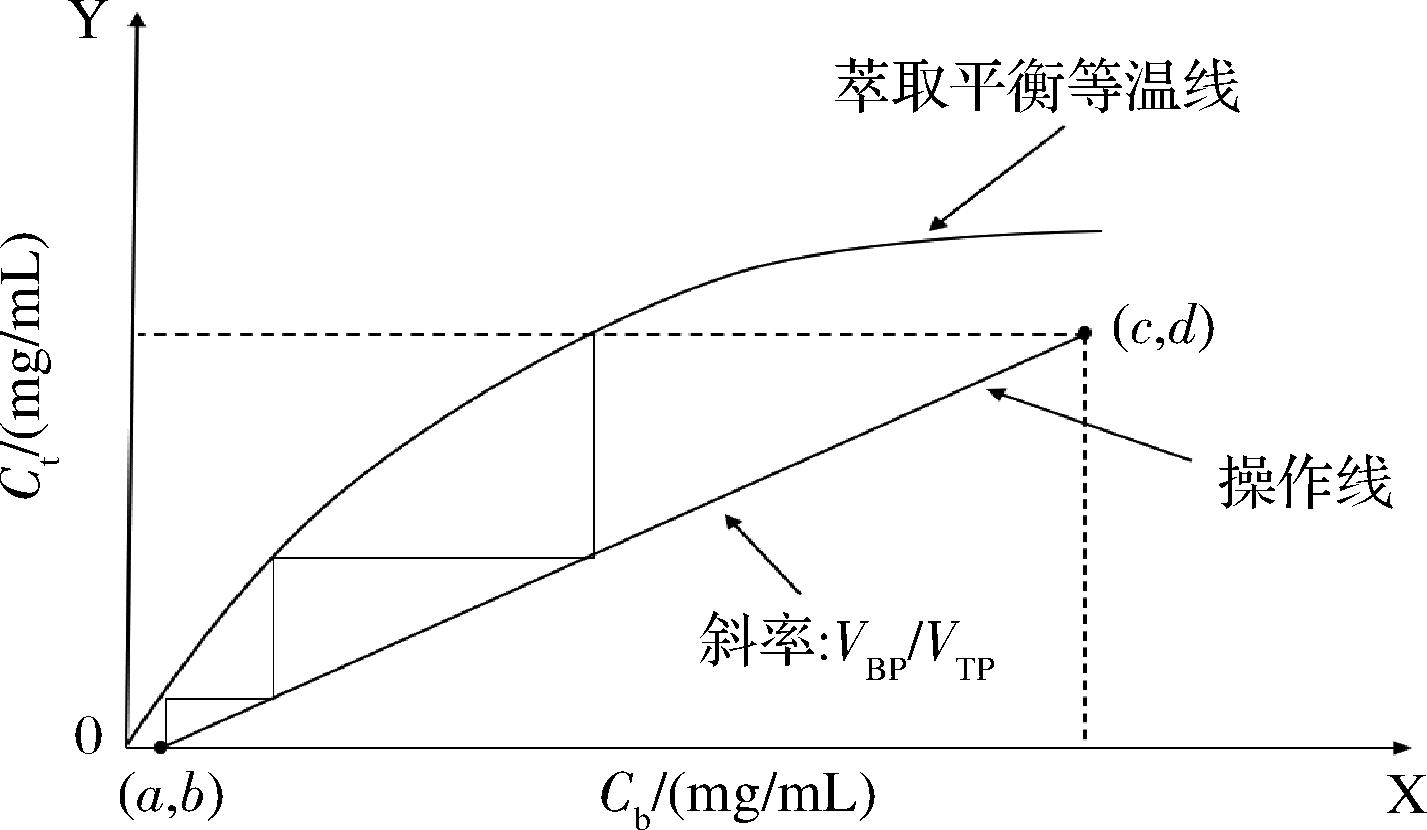
图5 多级逆流萃取在X-Y坐标上图解理论级数
Fig.5 Theoretical stages of the multi-stage countercurrent extraction on the X-Y axis
使用McCabe Thiele图解法可以得到多级逆流双水相萃取木瓜蛋白酶的理论萃取级数。由图6可以看出,在原料液下相的木瓜蛋白酶的初始质量浓度为0.12 mg/mL的情况下,当相比为0.5时,即操作线1,此时多级逆流双水相萃取木瓜蛋白酶的理论级数为3;当相比为0.25时,即操作线2,此时多级逆流双水相萃取木瓜蛋白酶的理论级数为4。
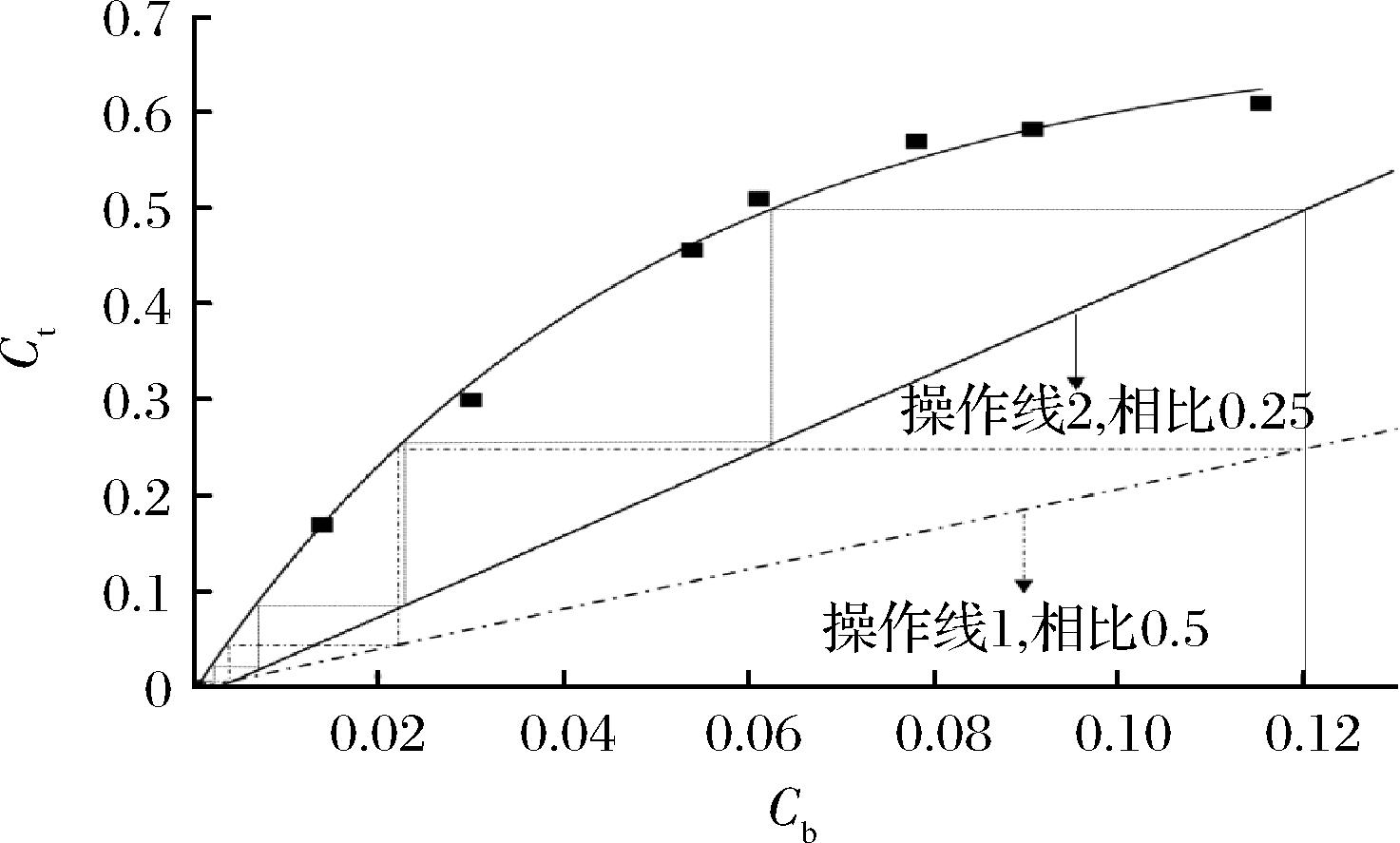
图6 多级逆流双水相萃取木瓜蛋白酶的理论级数
Fig.6 Theoretical stages of multi-stage countercurrent ATPE of papain
注:操作线1:相比为0.5;操作线2:相比为0.25。
2.6 多级双水相萃取工艺设计
将上述理论级数结果进行实验验证,结果如表2所示。经3级逆流双水相萃取后,木瓜蛋白酶的酶活性回收率达到了96.75%。由此可得多级逆流双水相萃取木瓜蛋白酶的预测优化方案,如图7所示。
表2 0.5相比下3级逆流双水相萃取木瓜蛋白酶的酶活性回收率
Table 2 Enzyme activity recovery rate of papain in three-stage countercurrent ATPE at 0.5 volume radio
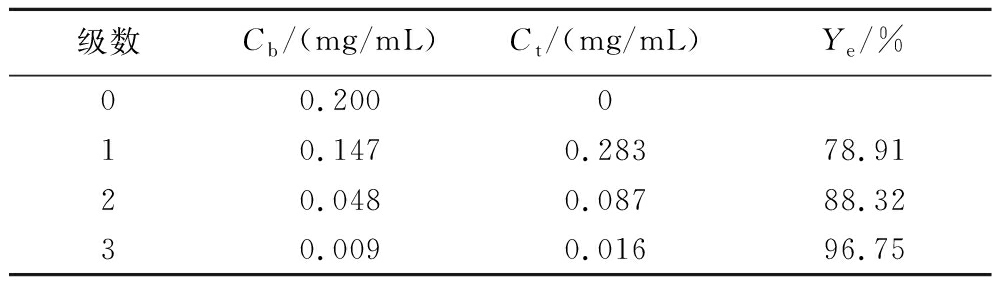
级数Cb/(mg/mL)Ct/(mg/mL)Ye/%00.200010.1470.28378.9120.0480.08788.3230.0090.01696.75
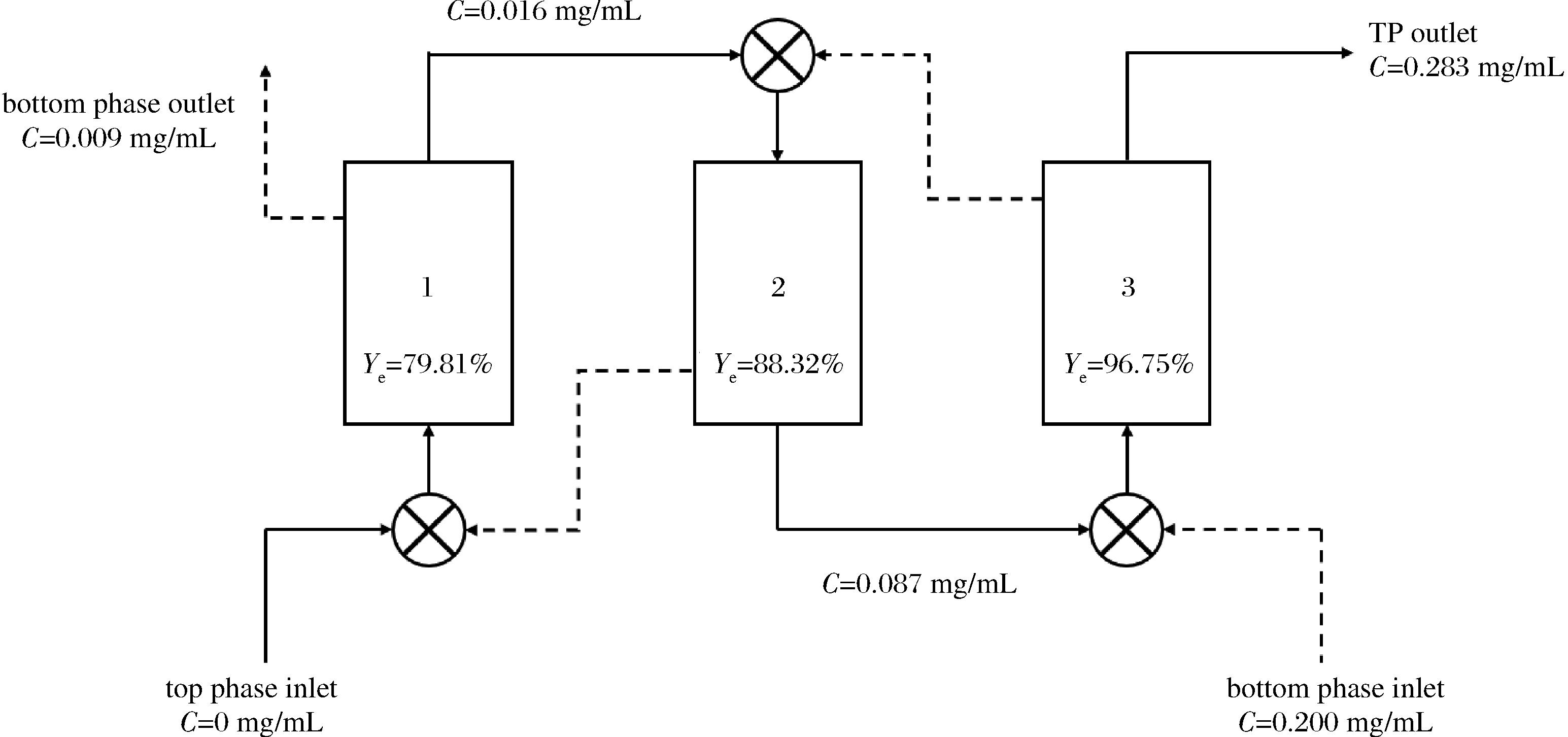
图7 相比0.5条件下的3级逆流双水相萃取木瓜蛋白酶的预测优化方案
Fig.7 Predictive optimization scheme of three-stage countercurrent ATPE of papain at 0.5 volume radio
3 结论
本文探究了多级逆流双水相萃取木瓜蛋白酶的理论级数,结果表明,当相比为0.5,原料液下相的木瓜蛋白酶的初始质量浓度为0.20 mg/mL时,使用3级逆流双水相萃取木瓜蛋白酶的酶活性回收率达到了96.75%,并设计出多级逆流双水相萃取木瓜蛋白酶的优化方案,对多级双水相萃取木瓜蛋白酶的方法在工业上大规模应用具有一定的意义。
[1] POLAINA J, MACCABE A P. Industrial enzymes: Structure, Function and Applications[M]. New York: Springer, 2007.
[2] PIETRASIK Z, SHAND P J.Effects of moisture enhancement, enzyme treatment, and blade tenderization on the processing characteristics and tenderness of beef semimembranosus steaks[J].Meat Science, 2011, 88(1):8-13.
[3] MAHAJAN R T, CHAUDHARI G M.Plant latex as vegetable source for milk clotting enzymes and their use in cheese preparation[J].International Journal of Advanced Research, 2014,2(5):1173-1181.
[4] CHOI W M, LAM C L, MO W Y, et al.Upgrading food wastes by means of bromelain and papain to enhance growth and immunity of grass carp (Ctenopharyngodon idella)[J].Environmental Science and Pollution Research, 2016, 23(8):7186-7194.
[5] MUNCHOW E A, HAMANN H J, CARVAJAL M T, et al.Stain removal effect of novel papain- and bromelain-containing gels applied to enamel[J].Clinical Oral Investigations, 2016, 20(8):2315-2320.
[6] RIBEIRO A P, OLIVEIRA B G, SOARES M F, et al.Effectiveness of 2% and 4% papain gels in the healing of venous ulcers[J].Revista da Escola de Enfermagem da U S P, 2015, 49(3):395-402.
[7] NITSAWANG S, HATTI-KAUL R, KANASAWUD P.Purification of papain from Carica papaya latex:Aqueous two-phase extraction versus two-step salt precipitation[J].Enzyme and Microbial Technology, 2006, 39(5):1103-1107.
[8] 王伟涛. 木瓜蛋白酶的双水相萃取研究[D].海口:海南大学, 2014.
WANG W T.Study on the extraction of papain with aqueous two-phase system[D].Haikou:Hainan University, 2014.
[9] 韦朝英. 木瓜蛋白酶提取及在食品工业中的应用[J].农业与技术, 2018, 38(15):71-72.
WEI C Y.Extraction of papain and its application in food industry[J].Agriculture and Technology, 2018, 38(15):71-72.
[10] 何继芹, 张海德.木瓜蛋白酶的分离方法及其应用进展[J].食品科技, 2006(10):66-69.
HE J Q, ZHANG H D.Development of separation methods and applications of papain[J].Food Science and Technology, 2006(10):66-69.
[11] PHONG W N, LE C F, SHOW P L, et al.Extractive disruption process integration using ultrasonication and an aqueous two-phase system for protein recovery from Chlorella sorokiniana[J].Engineering in Life Sciences, 2017, 17(4):357-369.
[12] ZHAO L, PENG Y L, GAO J M, et al.Bioprocess intensification:An aqueous two-phase process for the purification of C-phycocyanin from dry Spirulina platensis[J].European Food Research and Technology, 2014, 238(3):451-457.
[13] FERREIRA-FARIA D, AIRES-BARROS M R, AZEVEDO A M.Continuous aqueous two-phase extraction:From microfluidics to integrated biomanufacturing[J].Fluid Phase Equilibria, 2020, 508:112438.
[14] 张兴灿, 陈朝银, 李汝荣.木瓜蛋白酶的活力检测标准研究[J].食品工业科技, 2011, 32(10):435-437.
ZHANG X C, CHEN C Y, LI R R.Study on determination standards of papain activity[J].Science and Technology of Food Industry, 2011, 32(10):435-437.
[15] BABALOLA B A, AKINWANDE A I, GBOYEGA A E, et al.Extraction, purification and characterization of papain cysteine-proteases from the leaves of Carica papaya[J].Scientific African, 2023, 19:e01538.
[16] RIZKI Z, JANSSEN A E M, VAN DER PADT A, et al.Design of nanofiltration cascades for fructooligosaccharides using the McCabe-Thiele approach[J].Separation and Purification Technology, 2021, 259:118094.
[17] LIU Y, CHEN L, ZHOU J, et al.Extraction of tetracycline using the ionic liquid-based aqueous two-phase systems:Single-stage versus multi-stage[J].Chemical Industry and Chemical Engineering Quarterly, 2018, 24(4):387-397.
[18] ROSA P A J, AZEVEDO A M, SOMMERFELD S, et al.Application of aqueous two-phase systems to antibody purification:A multi-stage approach[J].Journal of Biotechnology, 2009, 139(4):306-313.
[19] 刘毅. 基于四环素分离/富集的咪唑类离子液体双水相体系的热力学模型及萃取工艺研究[D].广州:华南理工大学, 2020.
LIU Y.Research on the thermodynamic model and extraction technology of imidazole-ionic liquid aqueous two-phase system based on the separation and enrichment of tetracycline[D].Guangzhou:South China University of Technology, 2020.
[20] GRILO A L, RAQUEL AIRES-BARROS M, AZEVEDO A M.Partitioning in aqueous two-phase systems:Fundamentals, applications and trends[J].Separation &Purification Reviews, 2016, 45(1):68-80.
[21] LEJEUNE A, RABILLER-BAUDRY M, RENOUARD T.Design of membrane cascades according to the method of McCabe-Thiele:An organic solvent nanofiltration case study for olefin hydroformylation in toluene[J].Separation and Purification Technology, 2018, 195:339-357.
[22] RAVI R.Transformations for a generalized McCabe-Thiele method:A retrospective and a new perspective[J].International Communications in Heat and Mass Transfer, 2008, 35(7):860-866.