花青素(anthocyanins,ACN)是一种天然食用色素,营养价值高、资源丰富,具有抗衰老、抗氧化、抗炎、抗菌、调节血糖血脂、改善视力、预防癌症和神经退行性疾病等多种生理活性[1-8],在保健食品和食品加工等领域有着广泛的应用。但花青素自身多羟基的1-O(+)苯并吡喃环结构,使其易受内外环境因素影响而发生降解失活,造成生物活性和生物利用度降低,严重限制了其相关应用[9-10],故如何解决花青素的不稳定性已经成为亟待解决的问题。
目前提高花青素稳定性的制剂方法主要是通过载体材料将其制成纳米颗粒、乳液、脂质体、微囊等[11-14],其制备工艺复杂、制备成本高、辅料用量大,易导致给药剂量较大。共无定型复合物(coamorphous complex,CAC)是药物和药物或小分子物质组合形成的均匀单相无定形体系[15],其制备工艺简单,可提高药物的稳定性、溶解度、溶出度,提高药物疗效与生物利用度[16]。杨仲平等[17]将熊果酸与茶氨酸制备成共无定型复合物后,其溶解度增加了2.7倍;施元旦等[18]将姜黄素和茶氨酸联合使用制备成共无定型复合物,与单体姜黄素相比,生物利用度提高了2.08倍;任丽佳等[19]将葛根素与壳寡糖制备成共无定型,有效提高了葛根素的体外溶出度及共无定型药物的稳定性。
烟酰胺(nicotinamide,NCT)是一种水溶性B族维生素,为辅酶Ⅰ和辅酶Ⅱ的组成部分之一,在机体内参与多种氧化还原反应,具有加强DNA修复、预防肿瘤与神经退行性疾病、抗衰老、抗菌等作用[20-23],其结构中含有氢键受体和供体,具备形成共无定形的结构基础,已有研究将烟酰胺与葛根素、喹硫平制备成共无定形[24-25],但还未有花青素方面的相关报道,因此,本研究将花青素与烟酰胺组合制备共无定型复合物,一方面提高花青素稳定性,为增强其稳定性提供一种新的技术手段,另一方面可为保健食品中花青素联合用药提供新的研究思路和研究基础。
1 材料与方法
1.1 材料与试剂
花青素(批号:20200219),大兴安岭林格贝寒带生物科技股份有限公司;矢车菊素-3-O-葡萄糖苷(批号:DST200420-019),德思特生物技术有限公司;烟酰胺(批号:20200110),英博生物科技有限公司;柠檬酸(批号:C11114955),上海麦克林生化有限公司;柠檬酸钠、盐酸、氯化钾(批号:20200311、20180228、20181106),北京化工厂;冰醋酸、无水乙酸钠(批号:15011211、1211231),西陇化工股份有限公司。
1.2 仪器与设备
AR2140型电子天平、DSC3型差示扫描量热仪,梅特勒-托利多仪器有限公司;PHS-3C pH计,上海精科公司;85-2型数显恒温磁力搅拌器,常州市江南实验仪器厂;ZF-6型三用紫外分析仪,上海嘉鹏科技有限公司;UV5100型紫外-可见分光光度计,山东析远仪器有限公司;Epsilon 2-4 Lsplus型真空冷冻干燥机,德国Christ公司;VECTOR-33型傅立叶变换红外光谱仪,德国Bruker公司;XRD-7000型X-射线衍射仪,日本SHIMADZU公司。
1.3 实验方法
1.3.1 花青素-烟酰胺共无定型复合物制备(anthocyanins-nicotinamide coamorphous complex,ACN-NCT CAC)
采用冷冻干燥法[26]制备ACN-NCT CAC:取摩尔比1∶4的花青素和烟酰胺加入适量去离子水,搅拌,冷冻干燥,即得。
1.3.2 响应面优化ACN-NCT CAC制备工艺
在考察了溶剂用量、搅拌速度、搅拌时间等单因素之后,仍以ACN-NCT CAC在紫外条件下8 h后ACN的保存率为响应值,对3个显著因素溶剂用量(A)、搅拌速度(B)和搅拌时间(C)进一步进行Box-Behnken Design响应面设计试验确定最优处方,因素水平表见表1。
表1 Box-Behnken响应面试验因素水平设计表
Table 1 Factors and levels of Box-Behnken design

水平因素A(溶剂用量)/mLB(搅拌速度)/(r/min)C(搅拌时间)/min -12520050354001514560025
1.3.3 保存率的测定
1.3.3.1 ACN含量测定
采用pH示差法[27]测定ACN含量。以矢车菊素-3-O-葡萄糖苷作为参比物,将待测样品溶液分别用pH 1.0的氯化钾缓冲溶液和pH 4.5的乙酸钠缓冲溶液稀释10倍后,以去离子水为空白对照,分别测定其在514 nm和700 nm处的吸光度,按照Fuleki公式[公式(1)、公式(2)]计算出ACN的含量:
ΔA=(A514nm-A700nm)pH1.0-(A514nm-A700nm)pH 4.5
(1)
(2)
式中:ΔA,总吸光度值;A514nm,样品在514 nm处测定的吸光度值;A700nm,样品在700 nm处测定的吸光度值;DF,稀释倍数;M,矢车菊素-3-O-葡萄糖苷的相对分子质量,449.2 g/mol;ε,矢车菊素-3-O-葡萄糖苷的消光系数,26 900 L/(mol·cm);L,光程,1 cm。
1.3.3.2 ACN保存率测定
取ACN-NCT CAC,在相应条件下作用后,分别加入pH 1.0和pH 4.5缓冲溶液稀释,按照1.3.3.1节计算ACN含量,并计算保存率,计算如公式(3)所示:
(3)
式中:R1为ACN保存率,%;w1,ACN-NCT CAC不同条件作用后ACN的含量,mg;w2,ACN-NCT CAC中ACN的初始含量,mg。
1.3.4 ACN-NCT CAC表征分析
1.3.4.1 差示扫描量热分析(differential scanning calorimetry,DSC)
参照陆佳璐等[28]的方法,取5 mg ACN、NCT、物理混合物、ACN-NCT CAC于铝坩中,N2为吹扫气,以50 ℃/min的升温速度,在30~300 ℃温程内进行DSC分析。
1.3.4.2 X射线衍射分析(X-ray diffraction,XRD)
参照刘欢等[29]的方法,取适量ACN、NCT、物理混合物、ACN-NCT CAC,平铺在载玻片,置于X射线衍射仪上进行分析。测定条件为:Cu靶(40 kV,30 mA);扫描范围3°~80° (2θ);扫描速度10°/min;步长0.02°。
1.3.4.3 傅里叶红外光谱分析(Fourier transform infrared spectrometer,FTIR)
参照余丹妮等[30]的方法,取 ACN、NCT、物理混合物、ACN-NCT CAC,加入KBr混合压片,在400~4 000 cm-1波数内扫描谱图。
1.3.5 ACN-NCT CAC稳定性研究
1.3.5.1 pH稳定性
取ACN、ACN-NCT CAC约2 mg,精密称定,置于5 mL量瓶中,用pH 5.0的缓冲液稀释,定容至刻度,每隔1 h,测定吸光度并计算保存率,平行测定3次。
1.3.5.2 温度稳定性
取ACN、ACN-NCT CAC约2 mg,精密称定,置于5 mL量瓶中,用pH 3.0的缓冲液稀释,定容至刻度,置于60 ℃下恒温保存,每隔1 h,测定吸光度并计算保存率,平行测定3次。
1.3.5.3 光照稳定性
取ACN、ACN-NCT CAC约2 mg,精密称定,置于5 mL量瓶中,用pH 3.0的缓冲液稀释,定容至刻度,置于紫外光下,每隔1 h,测定吸光度并计算保存率,平行测定3次。
1.4 数据统计与分析
采用软件Origin 9.8、GraphPad Prism 8.0.2和SPSS 21进行绘图和数据分析,结果用平均值±标准差来表示,每组试验平行3次。
2 结果与分析
2.1 响应面优化实验
响应面试验设计及结果见表2。应用软件Design Expert 12对表2进行拟合分析,结果见表3。分析得到二次回归方程为Y=56.39-1.41A-5.28B-5.26C+0.778 7AB+ 0.831 8AC+4.27BC-8.48A2-6.92B2-6.83C2。该回归模型的P<0.01,失拟项P值>0.05,表明所建模型可靠,拟合效果好,可用于结果分析。其三维响应面和等高线图见图1,其中A、B、C、BC、A2、B2、C2对保存率的影响均显著,交互项AB、AC对保存率的影响不显著,对于保存率的影响显著性顺序为B>C>A。分析后得到最优处方为:溶剂用量为35 mL,搅拌速度为300 r/min,搅拌时间为9 min,模型预测保存率为59.47%。
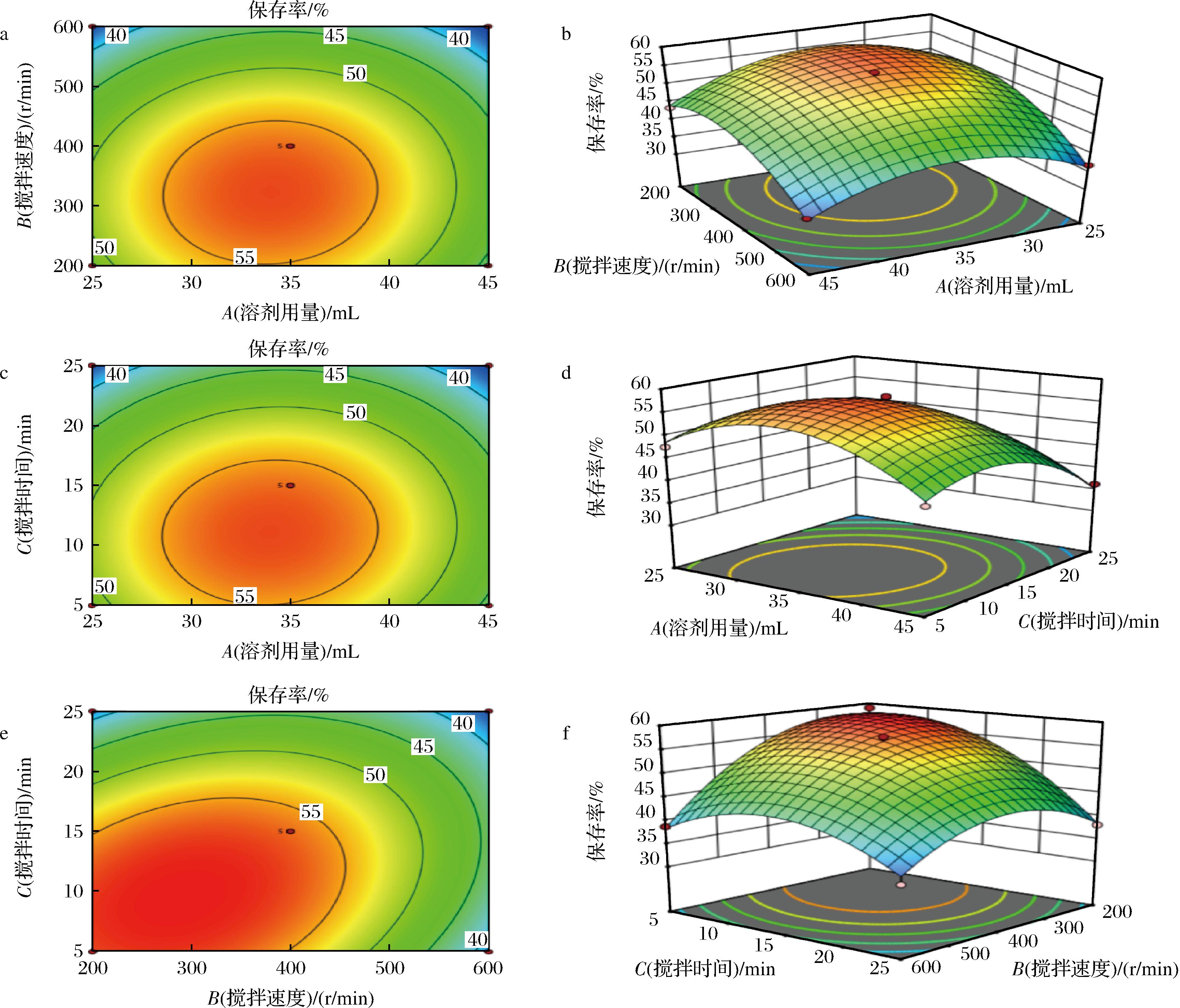
a-溶剂用量-搅拌速度响应面图;b-溶剂用量-搅拌速度等高线图;c-溶剂用量-搅拌时间响应面图;d-溶剂用量-搅拌时间等高线图;e-搅拌速度-搅拌时间响应面图;f-搅拌速度-搅拌时间等高线图
图1 各因素交互对保存率的影响
Fig.1 Effects of interaction of various factors
表2 Box-Behnken试验设计与结果
Table 2 Designs and results of Box-Behnken test

试验号A(溶剂用量)B(搅拌速度)C(搅拌时间)Y(保存率)/%1-10137.38210-143.11301134.7640-1138.0151-1043.46601-138.72711035.688-11036.95900057.2010-1-1047.851110136.241200055.991300055.361400056.06150-1-159.0416-10-147.571700057.34
表3 Box-Behnken设计的方差分析结果
Table 3 Results of variance analysis of Box-Behnken design

来源平方和自由度均方F值P值显著性模型1 320.659146.7474.85<0.000 1**A15.84115.848.080.025 0*B223.251223.25113.88<0.000 1**C221.011221.01112.74<0.000 1**AB2.4312.431.240.302 7AC2.7712.771.410.273 5BC72.76172.7637.120.000 5**A2302.821302.82154.47<0.000 1**B2201.811201.81102.95<0.000 1**C2196.681196.68100.33<0.000 1**残差13.7271.96失拟项10.8433.615.010.076 7纯误差2.8840.720 6总离差1 334.3816
2.2 验证实验
按最优处方制备3批ACN-NCT CAC,测得其保存率分别为59.67%、58.40%、59.46%,平均保存率为(59.18±0.68)%,与模型预测值59.47%偏差较小,表明该模型预测准确,可信度高,优化得到的最佳制备工艺稳定可靠,重复性良好。
2.3 ACN-NCT CAC表征分析
2.3.1 DSC分析
如图2所示,ACN在93.95 ℃有一宽吸热峰,NCT在129.06 ℃有一尖锐吸热峰。ACN和NCT物理混合物在127.45 ℃有一尖锐吸热峰,说明ACN和NCT可能形成了共融物。ACN-NCT CAC中ACN和NCT的熔点特征峰消失,并在73.12 ℃出现一个区别于ACN、NCT及其混合物的宽吸热峰,表明形成了共无定型复合物。
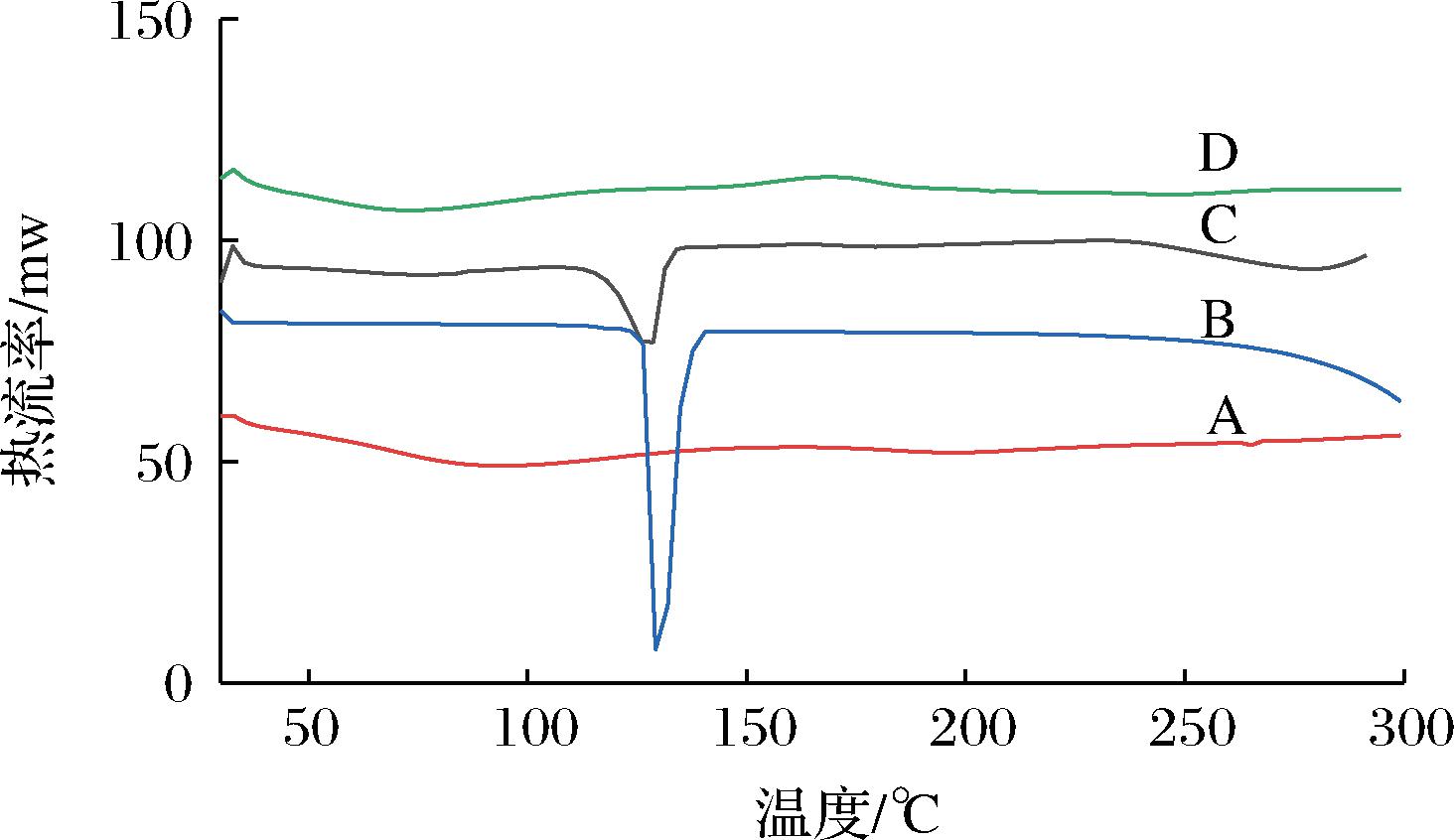
A-ACN;B-NCT;C-ACN和NCT物理混合物;D-ACN-NCT CAC(下同)
图2 ACN、NCT、ACN和NCT物理混合物、ACN-NCT CAC的DSC图
Fig.2 DSC result map of ACN, NCT, physical mixture of ACN and NCT, and ACN-NCT CAC
2.3.2 XRD分析
结果如图3所示,ACN为弥散宽峰,NCT在10°、15°、23°、25°、30°处出现较强的衍射峰,为晶体型态。在二者的物理混合物中虽然部分NCT的衍射峰减弱或消失,但仍可以观察到NCT的晶体衍射峰,表明物理混合物为非共无定型态,而共无定型复合物表现为弥散宽峰,未观察到相应晶体衍射峰,证明为共无定型态,说明形成了ACN-NCT CAC。
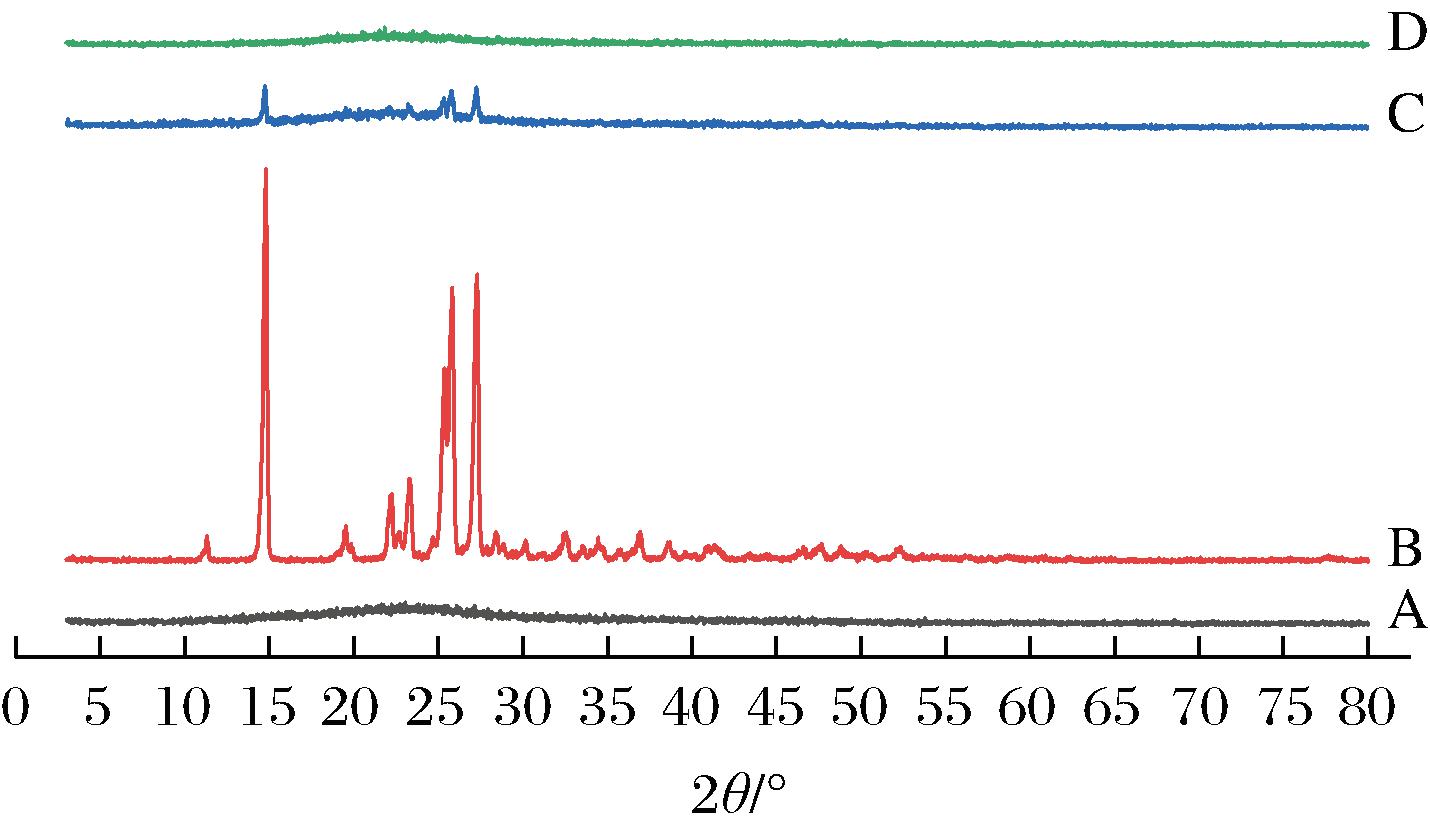
图3 ACN、NCT、ACN和NCT物理混合物、ACN-NCT CAC的XRD图
Fig.3 XRD patterns of ACN, NCT, physical mixture of ACN and NCT, and ACN-NCT CAC
2.3.3 FTIR分析
如图4所示,ACN在3 384 cm-1处有羟基的伸缩振动峰,2 900 cm-1为C—H伸缩振动峰,1 639 cm-1处为苯环(C![]() C)伸缩振动,1 068 cm-1处的特征峰为C—H面内弯曲振动;NCT在3 366、3 159 cm-1处有vN—H的尖锐双峰,在1 600~1 000 cm-1内有吡啶特征双峰。二者的物理混合物中仍有二者的峰特征。在共无定型复合物中,ACN、NCT的一些特征峰消失或减弱,ACN在3 384 cm-1处的羟基特征峰蓝移至3 379 cm-1,NCT在3 366、3 159 cm-1处的vN—H尖锐双峰发生红移,提示ACN与NCT之间可能是通过氢键结合,形成了ACN-NCT CAC。
C)伸缩振动,1 068 cm-1处的特征峰为C—H面内弯曲振动;NCT在3 366、3 159 cm-1处有vN—H的尖锐双峰,在1 600~1 000 cm-1内有吡啶特征双峰。二者的物理混合物中仍有二者的峰特征。在共无定型复合物中,ACN、NCT的一些特征峰消失或减弱,ACN在3 384 cm-1处的羟基特征峰蓝移至3 379 cm-1,NCT在3 366、3 159 cm-1处的vN—H尖锐双峰发生红移,提示ACN与NCT之间可能是通过氢键结合,形成了ACN-NCT CAC。
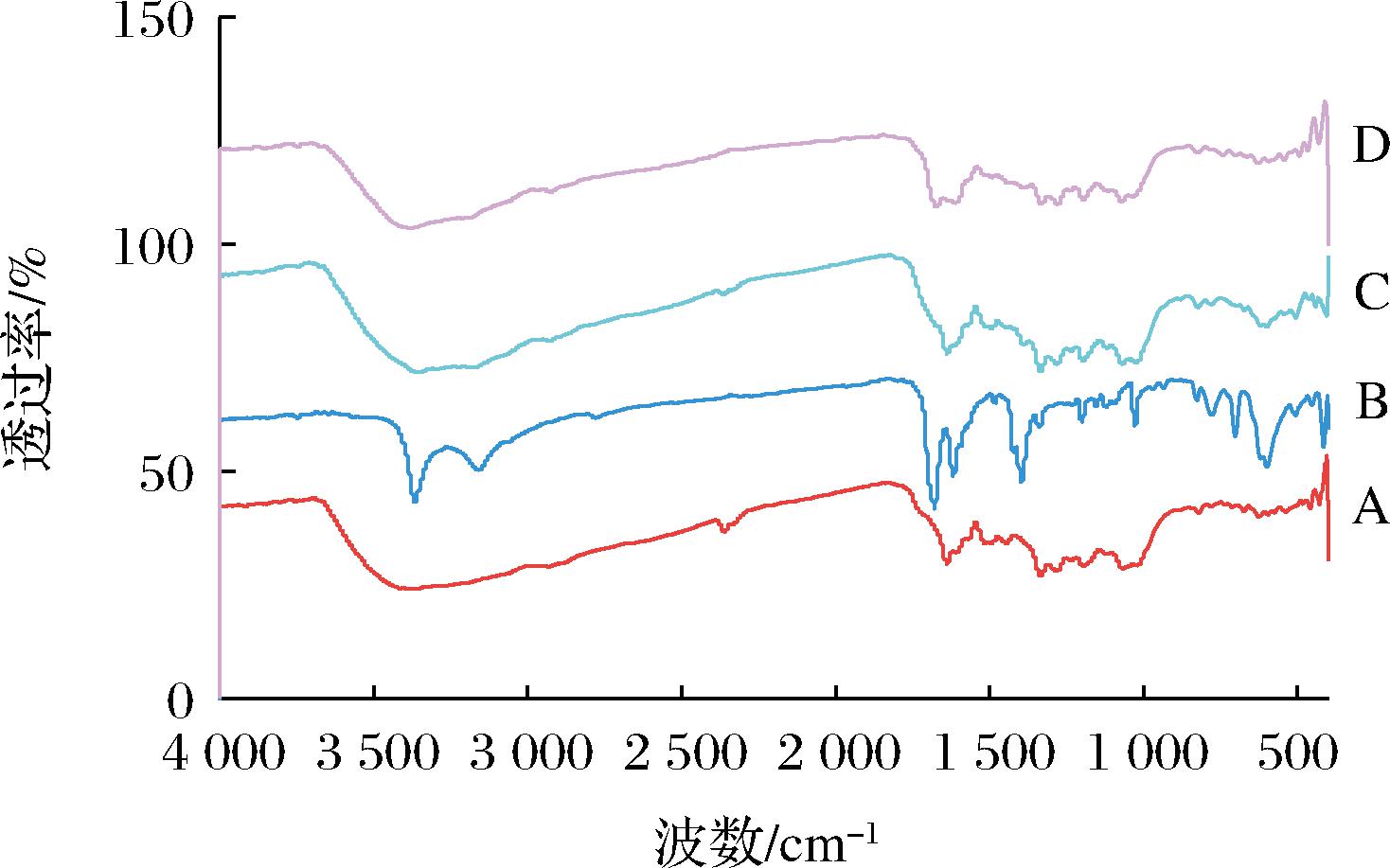
图4 ACN、NCT、ACN和NCT物理混合物、ACN-NCT CAC的FTIR光谱图
Fig.4 FITR spectra of ACN, NCT, physical mixture of ACN and NCT, and ACN-NCT CAC
2.4 ACN-NCT CAC稳定性研究
2.4.1 pH稳定性
结果如图5所示,无论是ACN还是ACN-NCT CAC在一定pH条件下放置时间越长,其保存率越低,但ACN-NCT CAC的保存率显著高于ACN(P<0.01),放置6 h后,ACN-NCT CAC的保存率为75.96%,ACN保存率为69.52%,提高了6.44%,表明将ACN制备成ACN-NCT CAC,可以提高其pH稳定性。
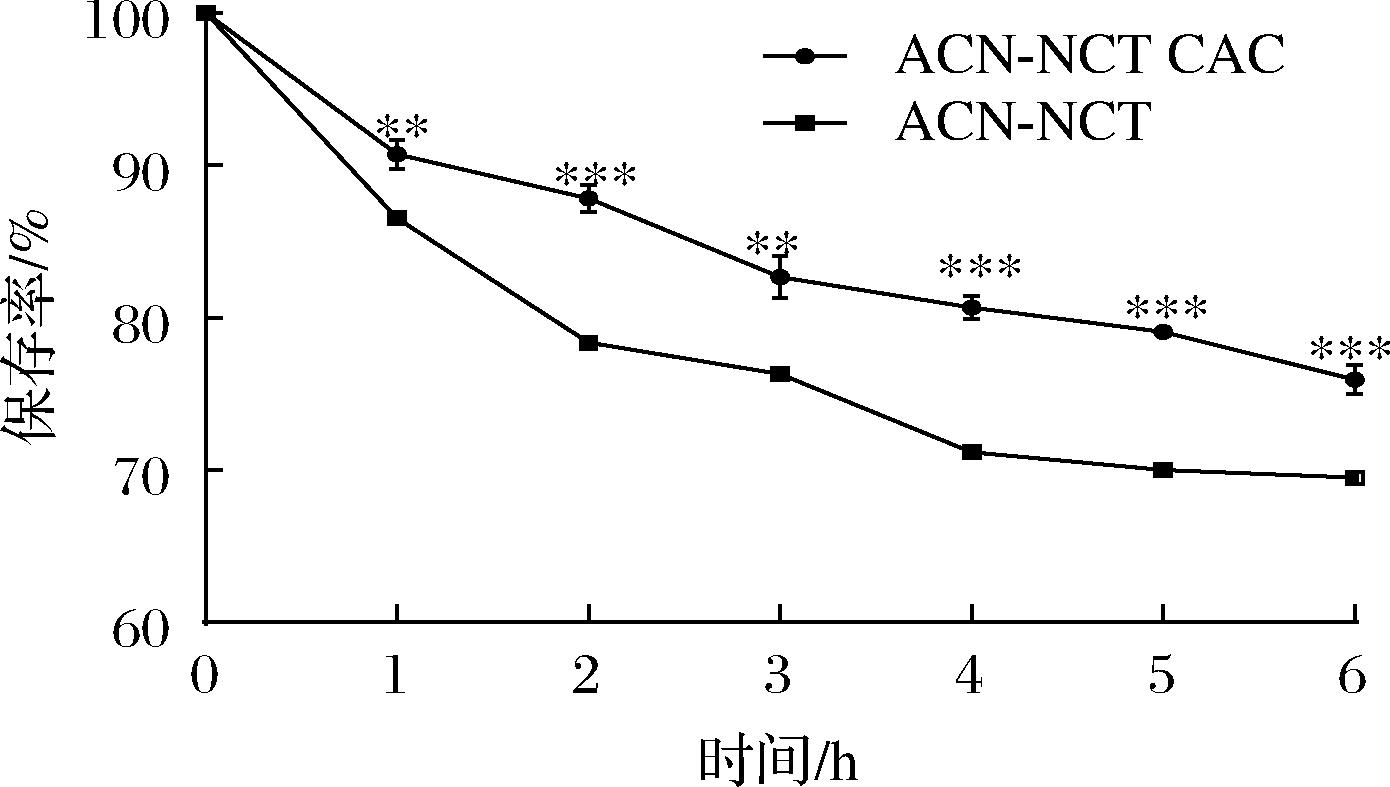
图5 ACN与ACN-NCT CAC在pH 5.0保存率
Fig.5 Retention rates of ACN and ACN-NCT CAC at pH 5.0
注:***表示与ACN组相比有显著性差异(P<0.001);**表示与ACN相比有显著性差异(P<0.01);*表示与ACN相比有显著性差异(P<0.05)(下同)。
2.4.2 热稳定性
温度对ACN的稳定性影响如图6所示,60 ℃下ACN和ACN-NCT CAC的总体变化趋势相同,均一直处于降解状态,但在6 h的加热过程中,ACN-NCT CAC的降解量明显低于ACN,每个取样点的ACN-NCT CAC保存率均高于ACN(P<0.01),6 h后,ACN-NCT CAC的保存率为81.76%,相较ACN原料药,保存率提高了5.22%,表明ACN-NCT CAC可以提高其ACN的热稳定性。

图6 ACN与ACN-NCT CAC在60 ℃保存率
Fig.6 Retention rates of ACN and ACN-NCT CAC at 60 ℃
2.4.3 光照稳定性
结果如图7所示,紫外光照对ACN的影响较大,随着光照时间的延长,ACN降解逐渐增多,降解速率逐渐加快,而在ACN-NCT CAC中,ACN的降解速率呈渐缓趋势,光照6 h后,ACN-NCT CAC的保存率为68.67%,ACN原料药的保存率为44.20%,保存率提高了24.47%(P<0.001),说明共无定型复合物可提高花青素的紫外光稳定性。

图7 ACN与ACN-NCT CAC在紫外光照条件下保存率
Fig.7 Retention rates of ACN and ACN-NCT CAC under UV illumination
3 结论
本研究以花青素保存率为指标,采用响应面法优化了花青素-烟酰胺共无定型复合物的制备工艺,得到最佳工艺参数:溶剂用量35 mL,搅拌速度300 r/min,搅拌时间为9 min,制备的花青素-烟酰胺共无定型复合物保存率为(59.18±0.68)%;差示扫描量热法、X射线衍射证实花青素与烟酰胺确实以共无定型形式存在;傅里叶红外光谱提示二者通过氢键相互作用形成了共无定型复合物。通过测定花青素-烟酰胺共无定型复合物在一定pH、温度、光照下的保存率,证实其减缓了花青素的降解,提高了花青素的稳定性。本研究成功制备了花青素-烟酰胺共无定型复合物,制备工艺简单可行,为花青素在食品加工等方面的进一步相关应用提供了研究基础,也可为保健食品中花青素与相关活性物质的联合应用提供新的研究思路。
[1] GAO J M, WU Y T, HE D J, et al. Anti-aging effects of Ribes meyeri anthocyanins on neural stem cells and aging mice[J]. Aging, 2020, 12(17):17738-17753.
[2] 李煦, 白雪晴, 刘长霞, 等. 天然花青素的抗氧化机制及功能活性研究进展[J]. 食品安全质量检测学报, 2021, 12(20):8163-8171.
LI X, BAI X Q, LIU C X, et al. Research progress on antioxidant mechanism and functional activity of natural anthocyanin[J]. Journal of Food Safety &Quality, 2021, 12(20):8163-8171.
[3] 张晓静. 树莓花青素提取优化及其抗炎作用研究[D]. 新乡: 河南师范大学, 2018.
ZHANG X J. Sutdy on extraction and anti-inflammatory effect of anthocyanin extracted from raspberry[D].Xinxiang: Henan Normal University, 2018.
[4] 董雨荷. 黑果枸杞花青素提取及抑菌、抗氧化机制的研究[D]. 长春: 吉林大学, 2022.
DONG Y H. Study on the extraction of anthocyanin from Lycium barbarum and its antibacterial and antioxidant mechanism[D]. Changchun: Jilin University, 2022.
[5] CHEN Z Q, WANG C, PAN Y X, et al. Hypoglycemic and hypolipidemic effects of anthocyanins extract from black soybean seed coat in high fat diet and streptozotocin-induced diabetic mice[J]. Food &Function, 2018, 9(1):426-439.
[6] NOMI Y, IWASAKI-KURASHIGE K, MATSUMOTO H. Therapeutic effects of anthocyanins for vision and eye health[J]. Molecules, 2019, 24(18):3311.
[7] PARAMANANTHAM A, KIM M J, JUNG E J, et al. Pretreatment of anthocyanin from the fruit of Vitis coignetiae pulliat acts as a potent inhibitor of TNF-α effect by inhibiting NF-κB-regulated genes in human breast cancer cells[J]. Molecules, 2020, 25(10):2396.
[8] 张挺, 李冀宏, 周浩楠, 等. 花青素对神经退行性疾病的作用[J]. 生命的化学, 2022, 42(9):1635-1642.
ZHANG T, LI J H, ZHOU H N, et al. Effect of anthocyanins on neurodegenerative diseases[J]. Chemistry of Life, 2022, 42(9):1635-1642.
[9] 辛宇, 孙敬蒙, 张炜煜. 花青素生物活性及制剂的研究进展[J]. 食品工业科技, 2021, 42(17):413-422.
XIN Y, SUN J M, ZHANG W Y. Research progress of physiological activity and preparations of anthocyanins[J]. Science and Technology of Food Industry, 2021, 42(17):413-422.
[10] 徐青, 王代波, 刘国华, 等. 花青素稳定性影响因素及改善方法研究进展[J]. 食品研究与开发, 2020, 41(7):218-224.
XU Q, WANG D B, LIU G H, et al. Influencing factors and improving methods of anthocyanin stability[J]. Food Research and Development, 2020, 41(7):218-224.
[11] TONG Y Q, DENG H T, KONG Y W, et al. Stability and structural characteristics of amylopectin nanoparticle-binding anthocyanins in Aronia melanocarpa[J]. Food Chemistry, 2020, 311:125687.
[12]![]() M, et al. Freeze-drying of black chokeberry pomace extract-loaded double emulsions to obtain dispersible powders[J]. Journal of Food Science, 2020, 85(3):628-638.
M, et al. Freeze-drying of black chokeberry pomace extract-loaded double emulsions to obtain dispersible powders[J]. Journal of Food Science, 2020, 85(3):628-638.
[13] 王蕾, 陈依, 杨雅其, 等. 蓝莓花青素脂质体的制备及其稳定性研究[J]. 西北农林科技大学学报(自然科学版), 2022, 50(5):85-94.
WANG L, CHEN Y, YANG Y Q, et al. Preparation and stability of blueberry anthocyanin liposomes[J]. Journal of Northwest A &F University (Natural Science Edition), 2022, 50(5):85-94.
[14] 陈程莉, 李丰泉, 刁倩, 等. 黑枸杞花青素微胶囊优化及理化特性分析[J]. 食品与发酵工业, 2020, 46(5):208-214.
CHEN C L, LI F Q, DIAO Q, et al. Optimization and analysis of physical and chemical properties of black Lycium ruthenicum Murr anthocyanin microcapsules[J]. Food and Fermentation Industries, 2020, 46(5):208-214.
[15] 卢山, 邢天嫣, 胡义, 等. 共无定形盐酸鲁拉西酮-莽草酸的稳定性研究[J]. 中国现代应用药学, 2021, 38(20):2505-2511.
LU S, XING T Y, HU Y, et al. Investigation on the stability of coamorphous lurasidone hydrochloride-shikimic acid[J]. Chinese Journal of Modern Applied Pharmacy, 2021, 38(20):2505-2511.
[16] SHI Q, MOINUDDIN S M, CAI T. Advances in coamorphous drug delivery systems[J]. Acta Pharmaceutica Sinica B, 2019, 9(1):19-35.
[17] 杨仲平, 吴琦, 杨雅琴, 等. 熊果酸-茶氨酸共无定型复合物的制备和水溶性测定[J]. 莆田学院学报, 2022, 29(2):45-49.
YANG Z P, WU Q, YANG Y Q, et al. The preparation of ursolic acid and theanine co-amorphous complex and its water solubility[J]. Journal of Putian University, 2022, 29(2):45-49.
[18] 施元旦, 刘玲. 姜黄素-茶氨酸共无定型复合物的制备与生物利用度研究[J]. 现代中药研究与实践, 2019, 33(5):47-53.
SHI Y D, LIU L. Preparation and bioavailability of curcumin-theanine co-amorphous complex[J]. Research and Practice on Chinese Medicines, 2019, 33(5):47-53.
[19] 任丽佳, 李杰, 唐丽娜. 葛根素-壳寡糖共无定型制备与体外溶出度评价[J]. 中国药业, 2022, 31(3):75-80.
REN L J, LI J, TANG L N. Preparation and in vitro evaluation of puerarin-chitosan oligosaccharide co-amorphous[J]. China Pharmaceuticals, 2022, 31(3):75-80.
[20] 杨亚利, 张声源, 潘增烽, 等. 烟酰胺对鼻咽癌CNE-1细胞增殖、凋亡与迁移作用机制研究[J]. 安徽医科大学学报, 2021, 56(3):418-422.
YANG Y L, ZHANG S Y, PAN Z F, et al. Effects and mechanism of nicotinamide on proliferation, apoptosis and migration of nasopharyngeal carcinoma CNE-1 cells[J]. Acta Universitatis Medicinalis Anhui, 2021, 56(3):418-422.
[21] VASIN M V, ILYIN L A, USHAKOV I B. Analysis of the effect of exogenous nicotinamide on bioenergetic processes in the brain during acute hypoxia[J]. Biophysics, 2022, 67(4):637-641.
[22] 董红宇, 吴东颖, 孙海星, 等. 一种用于抗衰老的保健食品及其制备方法: CN112674347A[P]. 2021-04-20.
DONG H Y, WU D Y, SUN H X, et al. The invention discloses a health food for anti-aging and a preparation method thereof: China, CN112674347A[P]. 2021-04-20.
[23] 陈显振, 朱信霖, 姜伟伟, 等. 烟酰胺及联合伊曲康唑体外抗烟曲霉活性研究[J]. 中国真菌学杂志, 2022, 17(2):124-128.
CHEN X Z, ZHU X L, JIANG W W, et al. Study on antifungal activity of nicotinamide and the synergistic effect of nicotinamide to itraconazole against Aspergillus fumigatus in vitro[J]. Chinese Journal of Mycology, 2022, 17(2):124-128.
[24] 吴秀娟, 庞遵霆, 杨思彤, 等. 共无定形技术改善葛根素水溶性及增溶机制研究[J]. 药学学报, 2021, 56(2):585-592.
WU X J, PANG Z T, YANG S T, et al. Mechanistic study on the solubility enhancement of puerarin by coamorphous technology[J]. Acta Pharmaceutica Sinica, 2021, 56(2):585-592.
[25] ALI A M A, AL-REMAWI M M. Freeze dried quetiapine-nicotinamide binary solid dispersions: A new strategy for improving physicochemical properties and ex vivo diffusion[J]. Journal of Pharmaceutics, 2016, 2016:2126056.
[26] ZHU S J, GAO H S, BABU S, et al. Co-amorphous formation of high-dose zwitterionic compounds with amino acids to improve solubility and enable parenteral delivery[J]. Molecular Pharmaceutics, 2018, 15(1):97-107.
[27] 王贝, 侯益明. pH示差法测定花青素含量的方法研究[J]. 山东化工, 2021, 50(21):94-96.
WANG B, HOU Y M. Study on the method of determining anthocyanin content by pH-differential method[J]. Shandong Chemical Industry, 2021, 50(21):94-96.
[28] 陆佳璐, 邓丽娜. 姜黄素-色氨酸共无定型的制备及其在大鼠体内的药动学研究[J]. 中国药房, 2019, 30(17):2348-2354.
LU J L, DENG L N. Preparation of co-amorphous curcumin-tryptophan and its pharmacokinetic study in rats[J]. China Pharmacy, 2019, 30(17):2348-2354.
[29] 刘欢, 赵国巍, 蒋且英, 等. 共无定形技术改善水飞蓟宾的溶出行为及物理稳定性研究[J]. 中国中药杂志, 2022, 47(1):103-110.
LIU H, ZHAO G W, JIANG Q Y, et al. Co-amorphous technology to improve dissolution and physical stability of silybin[J]. China Journal of Chinese Materia Medica, 2022, 47(1):103-110.
[30] 余丹妮, 伍薇, 祁玮玮, 等. 女贞子三萜-胡椒碱共无定型复合物的表征和体外溶出度评价[J]. 中草药, 2018, 49(3):561-568.
YU D N, WU W, QI W W, et al. Characterization of co-amorphous complex with piperine and triterpenoids from Ligustri Lucidi Fructus and dissolution evaluation in vitro[J]. Chinese Traditional and Herbal Drugs, 2018, 49(3):561-568.