咸鸭蛋在我国是最受欢迎的传统蛋制品之一[1],咸蛋清蛋白是一种易被人体消化吸收的优质蛋白,但咸蛋清因盐含量高几乎无法直接利用,将咸蛋清蛋白脱盐酶解可增加其实际应用价值[2]。
铁缺乏会导致缺铁性贫血,可引起人体系统功能紊乱,对人体正常生长发育产生影响。新型铁补充剂多肽-铁螯合物对比传统的铁补充剂更易消化吸收、性质更稳定且对人体无刺激性[3-4],逐渐成为人们理想的铁补充剂。目前,关于多肽-铁螯合物的研究有绿豆多肽-铁螯合物[5]、阿拉斯加鳕皮多肽-铁螯合物[6]、凤尾鱼肌肉蛋白多肽-铁螯合物[7]等。LI等[8]利用动物实验得出DPs-Fe比硫酸亚铁能更有效增强机体铁吸收并减轻铁缺乏的影响。多肽金属螯合物对促进细胞增殖的相关研究有白鲢鱼骨胶原低聚肽螯合钙[9]促进293Ad5+人肾细胞的增殖、EWP-Ca促进 HFOB细胞的增殖[10]。Caco-2细胞对营养素的吸收与利用和人小肠上皮细胞相似[11],利用Caco-2细胞可以较好地反映蛋清多肽-铁螯合物对人体肠道细胞的影响。而关于蛋清多肽-铁螯合物对Caco-2细胞的影响未见相关报道。
本研究以咸蛋清为原料,脱盐后优化酶解条件,从粗肽中分离纯化出铁螯合能力较好的组分,制备蛋清多肽-铁螯合物。利用扫描电镜、能谱、红外光谱和X射线衍射(X-ray diffraction,XRD)分析蛋清多肽-铁螯合物螯合前后的形态结构变化,探究蛋清多肽-铁螯合物的细胞促增殖作用,为蛋清多肽-铁螯合物的开发和应用提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
咸鸭蛋清,菜市场购入;胰蛋白酶,合肥博美生物科技有限责任公司;邻菲啰啉、氯化亚铁、硫酸亚铁,国药试剂有限公司;96孔板(细胞级),康宁公司;菲啰嗪,阿拉丁有限公司;高糖DMEM,Hyclone公司;胎牛血清,Gemini公司;磷酸盐缓冲液、胰蛋白酶、青霉素-链霉素抗体、CCK-8检测试剂盒,碧云天生物技术有限公司;Caco-2结肠腺癌细胞,中国科学院上海细胞库。
1.2 仪器与设备
S-4800扫描电子显微镜,日本日立公司;DA7200傅里叶红外光谱仪,瑞典波通公司;Multiskan FC酶标仪,赛默飞世尔仪器有限公司;DF101B数显集热式磁力搅拌器,常州市金坛大地仪器厂;PHSJ-5雷磁pH计,上海雷磁仪器有限公司;LGJ-10真空冷冻干燥机,松源华兴科技发展有限公司;WJ-80B-Ⅱ恒温培养箱,上海圣科仪器设备有限公司;TG16B离心机,盐城市凯特实验仪器有限公司。
1.3 实验方法
1.3.1 蛋清粉、蛋清多肽-铁螯合物的制备
咸蛋清和超纯水体积比1∶1混合后调节pH为3,60 ℃搅拌5 h后将pH值调节为5.6,离心(5 000 r/min,10 min)后弃上清液,沉淀与超纯水以料液比(g∶mL)1∶2混合均匀重复离心,沉淀冷冻干燥后即为蛋清粉[12](含盐量2 g/100 g)。
4%(质量分数)蛋清多肽溶液中加入维生素C,调节pH值为5.5,加入氯化亚铁后40 ℃水浴螯合反应40 min,加入无水乙醇醇沉后离心(10 000 r/min,10 min)弃去上清液,用无水乙醇反复洗涤沉淀,收集沉淀冷冻干燥得蛋清多肽-铁螯合物[13]。
1.3.2 酶解工艺优化
蛋清粉加入超纯水溶解,加入胰蛋白酶[14]恒温酶解,调节pH,酶解后沸水浴10 min,离心(5 000 r/min,15 min),上清液冻干后得蛋清粗肽。以铁螯合能力和水解度(degree of hydrolysis,DH)为指标,评价底物质量分数(2%、4%、6%、8%,下同)、酶添加量(2%、4%、6%、8%、10%,质量分数,下同)、pH(6.5、7、7.5、8、8.5)、温度(35、40、45、50、55 ℃)、时间(1、2、4、6、8 h)对酶解上清液铁螯合能力和DH的影响。在此条件下,利用正交试验得到最优酶解条件。
1.3.3 DH的测定
采用 pH-Stat法测定DH[15],DH按公式(1)计算:
(1)
式中:B,酶解中加入的 NaOH溶液体积,mL;Nb, NaOH的浓度,mol/L;Mp,底物中蛋白质质量,g;htot=9.143 8(鸭蛋清蛋白);α=[10(pH-pK)]/[1+10(pH-pK)],pH为酶解时pH值,pK=7.0。
1.3.4 铁螯合能力的测定
1 mL待测溶液中加入 4 mL超纯水和0.1 mL氯化亚铁(2 mmol/L)混匀,20 min后加入0.5 mL菲洛嗪(2 mmol/L),反应10 min后在562 nm下测定吸光度[16]。铁螯合能力按公式(2)计算:
铁螯合能力![]()
(2)
式中:A1,样品的吸光度值;A0,纯水代替样品的吸光度值。
1.3.5 超滤分离纯化
蛋清粗肽依次通过50、10、3 kDa的超滤管,收集离心(4 000×g,30 min)后的上液和下液,分别得到分子质量>50 kDa(F1)、50~10 kDa(F2)、10~3 kDa(F3)和<3 kDa(BZ)的4个组分,冷冻干燥,测定各组分的铁螯合能力。
1.3.6 Sephadex G-15分离纯化
将处理好的Sephadex G-15装入层析柱(160 mm×80 cm),超纯水冲洗平衡过夜。BZ组分用超纯水溶解,过 0.22 μm针头滤膜后上样。洗脱液为超纯水,流速0.5 mL/min,检测波长220 nm,分离后得4个组分(BZ-1、BZ-2、BZ-3、BZ-4)收集冻干并测定铁螯合能力。
1.3.7 蛋清多肽-铁螯合物的表征
1.3.7.1 扫描电子显微镜
将BZ-4及蛋清多肽-铁螯合物固定在导电胶上,喷金处理后放入样品室,施加电压获取微观结构图。并对其进行能谱分析[17]。
1.3.7.2 傅里叶红外光谱
参考ZHU等[18]的方法,将BZ-4及蛋清多肽-铁螯合物分别与干燥的 KBr充分研磨混合后压片,在 400~4 000 cm-1进行红外扫描。
1.3.7.3 X射线衍射
取BZ-4及蛋清多肽-铁螯合物分别压片制样,测试条件:管电压 40 kV,速度8 deg/min,扫描角度5°~90°。
1.3.8 细胞实验
1.3.8.1 Caco-2细胞培养
Caco-2细胞培养条件:DMEM高糖培养基[含有10%(体积分数)胎牛血清和1%(体积分数)双抗],置于37 ℃饱和湿度、5%(体积分数)CO2的培养箱,细胞融合至80%~90%后,弃去培养基,用磷酸盐缓冲液清洗2次,加入胰酶消化6 min后收集至离心管,离心(800 r/min,3 min)后弃去上清液,加入培养基吹打均匀进行传代培养,每3 d传代一次。
1.3.8.2 细胞活力的测定
参考钱跃威等[19]方法,细胞培养至对数期,以5×103 个细胞/孔的浓度接种到96孔板中,培养箱孵育24 h后弃去培养基,蛋清多肽-铁螯合物、蛋清多肽和硫酸亚铁用DMEM培养基溶解过0.22 μm针头滤膜,加入不同质量浓度(0.05、0.1、0.5、1、5 mg/mL) 100 μL的上述样品液,培养24 h后,每孔加入10 μL CCK-8溶液,培养箱放置2 h,在450 nm下测定吸光度。
不同刺激时间对细胞活力的影响:加入0.05 mg/mL的样品液100 μL,分别培养24、48、72 h后加入10 μL CCK-8溶液,培养箱放置2 h,在450 nm下测定吸光度。细胞活力按公式(3)计算:
细胞活力![]()
(3)
式中:B1,加样品的吸光度值;B0,不加细胞和样品的吸光度值;B2,加细胞不加样品的吸光度值。
1.4 数据处理
采用SPSS 25.0软件中的ANOVA和Duncan′s进行数据分析比较,实验结果使用Origin 2018软件作图,实验3组平行对照,结果用平均值±标准差表示。
2 结果与分析
2.1 酶解工艺优化实验
胰蛋白酶水解蛋清蛋白制备蛋清多肽的单因素试验结果如图1所示。铁螯合能力随着底物质量分数升高呈现上升趋势,而DH逐渐下降,原因是底物质量分数过低,蛋清多肽含量较少,导致测得铁螯合能力较低;过高则造成蛋白水解不完全。考虑铁螯合能力和DH两个指标,选择4%的底物质量分数进行后续实验(图1-a)。随着酶添加量的增大,铁螯合能力先上升后下降,DH持续增大后逐渐稳定,在8%时达到最大值,此时酶基本与底物完全结合,饱和点后随着酶添加量的增大,部分蛋白完全水解成氨基酸,导致铁螯合能力降低(图1-b)。pH过高或过低都会影响酶的活性,铁螯合能力和DH随着pH的增加先上升后下降,当pH为8时,DH和铁螯合能力达到最高值(图1-c)。酶解过程中随着温度的升高,铁螯合能力和DH先上升后下降,在45 ℃时,铁螯合能力达到最大,原因是不同蛋白酶的最适温度不同,温度过高会导致酶活力下降甚至失活(图1-d)。随着酶解时间的延长,DH和铁螯合能力先上升, 6 h后逐渐平稳(图1-e)。选取4因素,底物质量分数(3%、4%、5%)、酶添加量(6%、8%、10%)、温度(40、45、50 ℃),酶解时间(4、6、8 h),在pH 8条件下进行后续正交试验。

a-底物浓度;b-酶添加量;c-pH;d-酶解温度;e-酶解时间
图1 酶解条件对酶解产物铁螯合能力和DH的影响
Fig.1 Effects of enzymatic hydrolysis conditions on iron-chelating capacity and DH of hydrolysate
正交试验内容及结果如表1,本实验以制备铁螯合肽为主要目的,以铁螯合能力为指标,得最优组合为A2B3C3D3,即底物质量分数4%、酶添加量10%、酶解温度50 ℃、酶解时间8 h,后续验证,所得酶解液铁螯合能力为95.27%。
表1 正交试验设计及结果
Table 1 Orthogonal experimental design and results
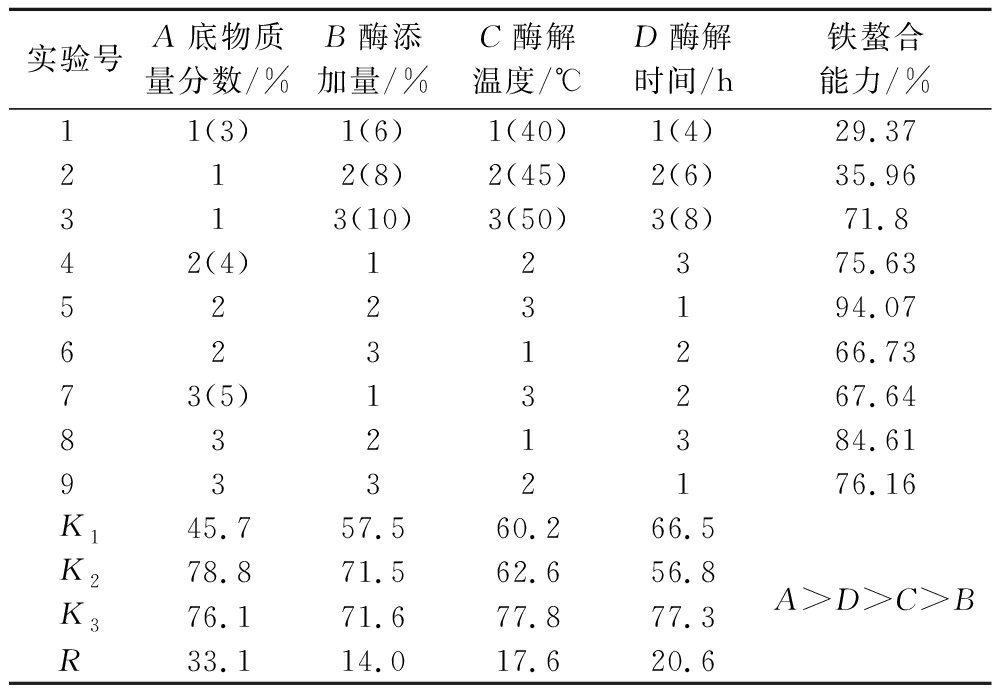
实验号A底物质量分数/%B酶添加量/%C酶解温度/℃D酶解时间/h铁螯合能力/%11(3)1(6)1(40)1(4)29.37212(8)2(45)2(6)35.96313(10)3(50)3(8)71.842(4)12375.635223194.076231266.7373(5)13267.648321384.619332176.16K145.7 57.5 60.2 66.5 K278.8 71.5 62.6 56.8 A>D>C>BK376.1 71.6 77.8 77.3 R33.114.017.620.6
2.2 超滤分级
超滤是一种分离功能性肽的常用方法[20],利用超滤管对2.1节中制备出的蛋清粗肽进行分离,得到4个组分,其中BZ(<3 kDa)的铁螯合能力为(4.13±0.052) mg/g(表2),显著高于其他组分和未分级的粗肽(P<0.05),由此可知分子质量小的蛋清多肽对铁的螯合能力强。本研究结果与JIANG等[21]对蓝圆鲹鱼蛋白酶解物的研究结果相似,因此收集BZ组分进行下一步分离。
表2 超滤分级组分铁螯合能力 (n=3)
Table 2 Iron-chelating capacity of ultrafiltration fractional components (n=3)
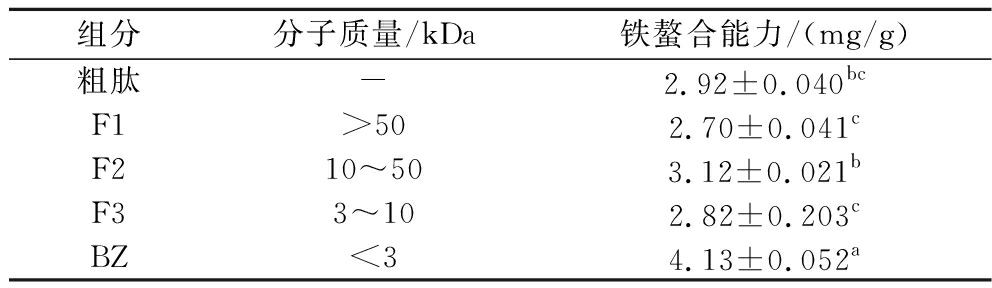
组分分子质量/kDa铁螯合能力/(mg/g)粗肽-2.92±0.040bcF1>502.70±0.041cF210~503.12±0.021bF33~102.82±0.203cBZ<34.13±0.052a
注:列肩标不同字母表示差异显著(P<0.05)(下同)。
2.3 Sephadex G-15分离纯化
凝胶过滤层析的分离原理是大分子多肽无法进入凝胶颗粒的多孔结构中首先被洗脱下来,小分子后被洗脱下来[22]。蛋清多肽BZ组分经 Sephadex G-15分离成4个组分(图2-a),依次为BZ-1、BZ-2、BZ-3、BZ-4。其中BZ-4的铁螯合能力为(31.56±0.503) mg/g,显著高于其他3个组分(P<0.05)(图2-b),比未分离前BZ组分提高了7.64倍。
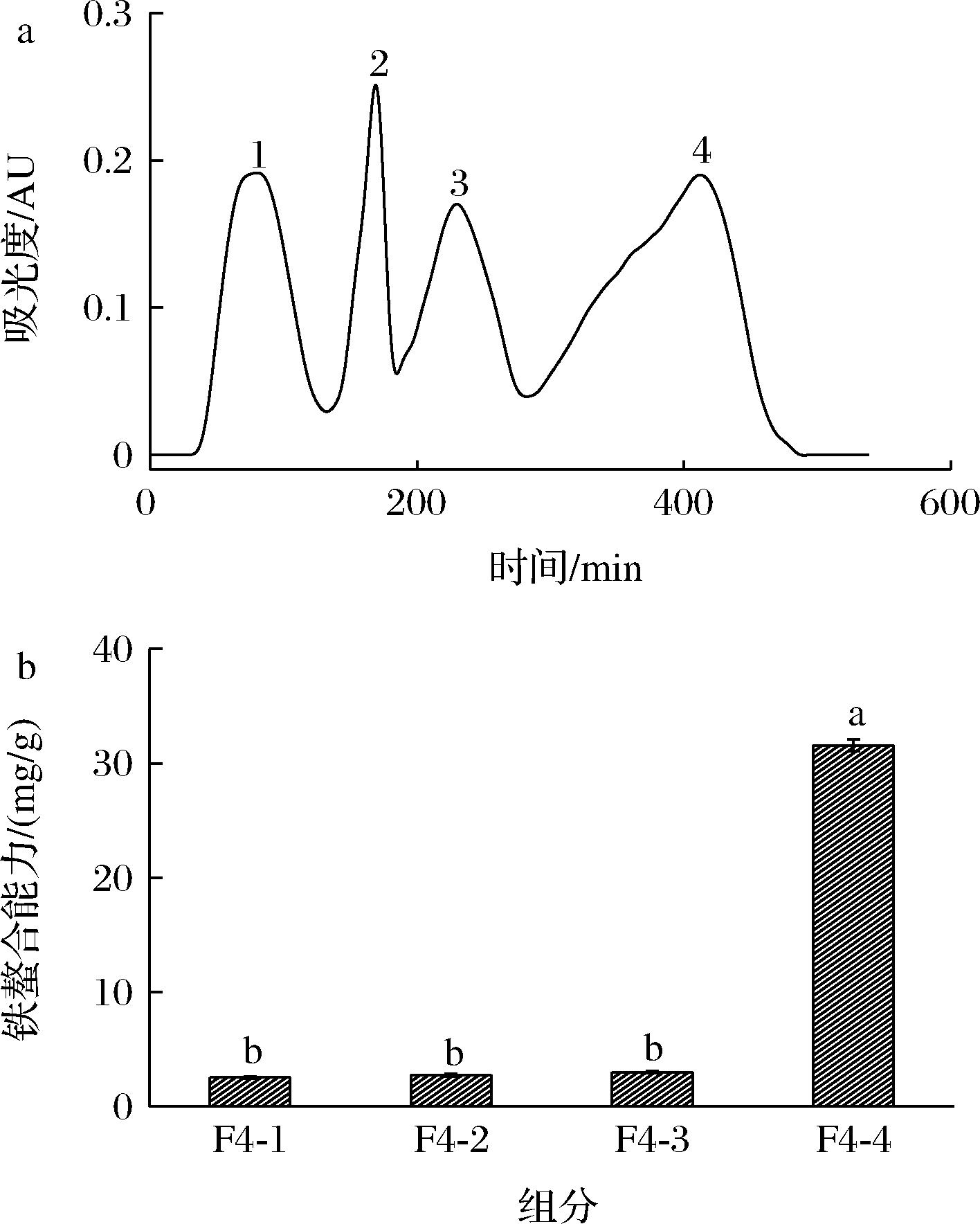
a-Sephadex G-15 凝胶过滤层析色谱图;b-各组分的铁螯合能力
图2 BZ组分的 Sephadex G-15 凝胶过滤层析色谱图和各个组分的铁螯合能力
Fig.2 Sephadex G-15 gel filtration chromatography of BZ and iron-chelating capacity of different components
注:不同小写字母表示差异显著(P<0.05)。
2.4 蛋清多肽-铁螯合物结构表征分析
2.4.1 扫描电镜及能谱分析
BZ-4及蛋清多肽-铁螯合物的扫描电镜中,多肽呈不规则形状(图3-a),表面光滑且疏松多孔。与Fe2+螯合后,表面粗糙不平并形成了团状颗粒聚集体,组织结构更加紧密(图3-b)。这是由于多肽的羧基及氨基与Fe2+发生配位结合,而螯合物表面的颗粒可能是多肽与Fe2+反应后吸附的铁晶体。能谱图中,与BZ-4相比,蛋清多肽-铁螯合物有3个铁元素的峰(图3-c),而多肽图中未出现(图3-d)。综上所述,多肽与Fe2+螯合形成稳定的物质。
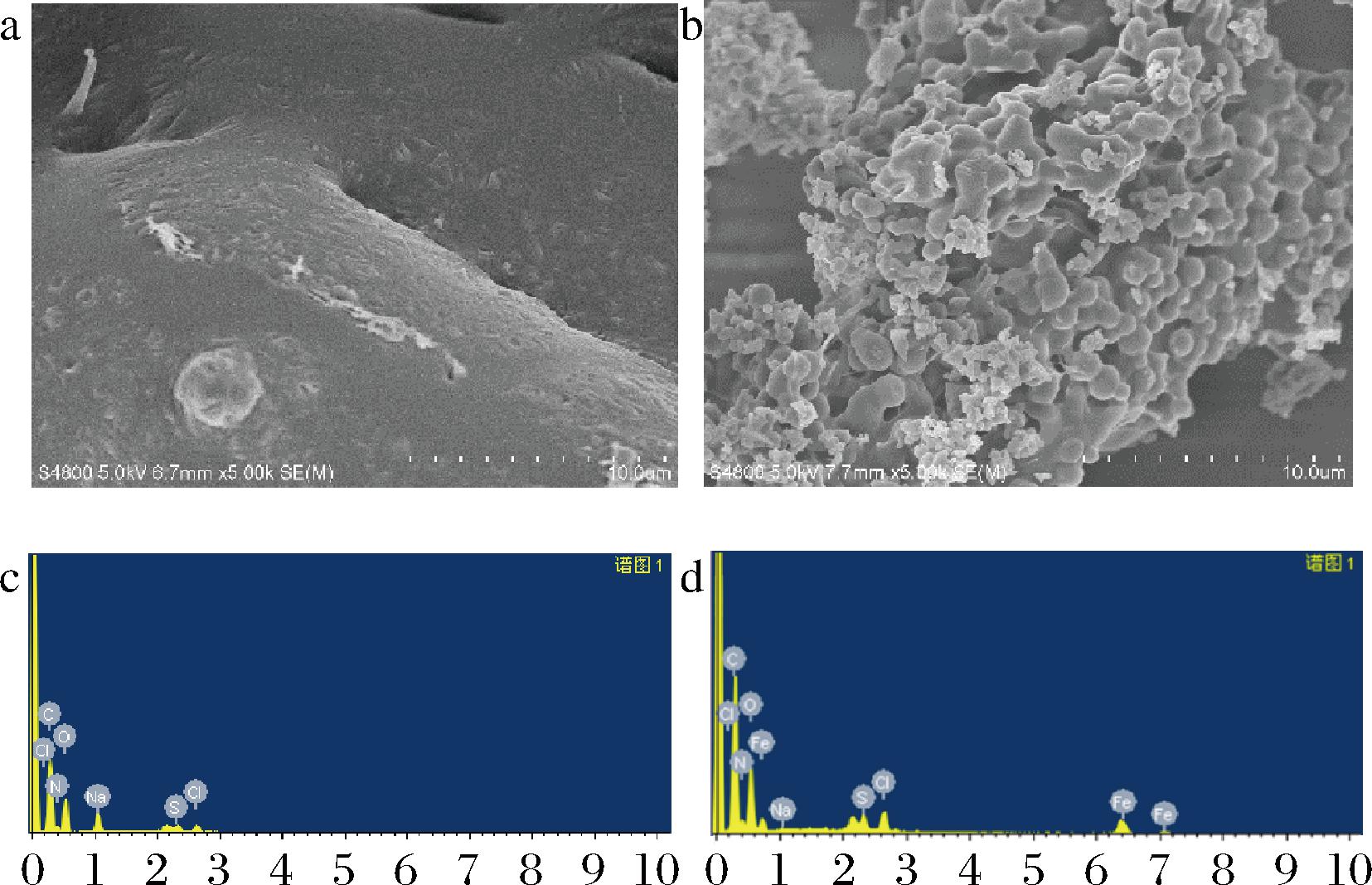
a-BZ-4扫描电镜图;b-蛋清多肽-铁螯合物扫描电镜图;c-BZ-4能谱图;d-蛋清多肽-铁螯合物能谱图
图3 BZ-4和蛋清多肽-铁螯合物的扫描电镜及能谱图
Fig.3 Scanning electron microscopy and energy spectrum analysis of BZ-4 and egg white polypeptide-iron chelate
2.4.2 红外光谱分析
金属离子与多肽螯合时,由于配位键的振动,红外光谱中的吸收峰会发生典型的变化[23]。由图4可知,多肽与Fe2+螯合后其特征吸收峰发生变化,—NH2的伸缩振动带从3 461.69 cm-1移动至3 427.93 cm-1。这说明N端氨基和侧链上的氨基参与了Fe2+螯合,导致N—H键振动频率发生变化;酰胺Ⅰ带,即C![]() O 键的伸缩振动从1 663.22 cm-1移动到1 660.15 cm-1;—COO—的伸缩振动在1 400 cm-1左右,与Fe2+螯合后其特征吸收峰从1 397.44 cm-1移动至1 402.97 cm-1,因此可知多肽中与Fe2+螯合的位点主要是氨基、羧基和酰胺基。此结果与ATHIRA等[24]的研究结果相似。
O 键的伸缩振动从1 663.22 cm-1移动到1 660.15 cm-1;—COO—的伸缩振动在1 400 cm-1左右,与Fe2+螯合后其特征吸收峰从1 397.44 cm-1移动至1 402.97 cm-1,因此可知多肽中与Fe2+螯合的位点主要是氨基、羧基和酰胺基。此结果与ATHIRA等[24]的研究结果相似。
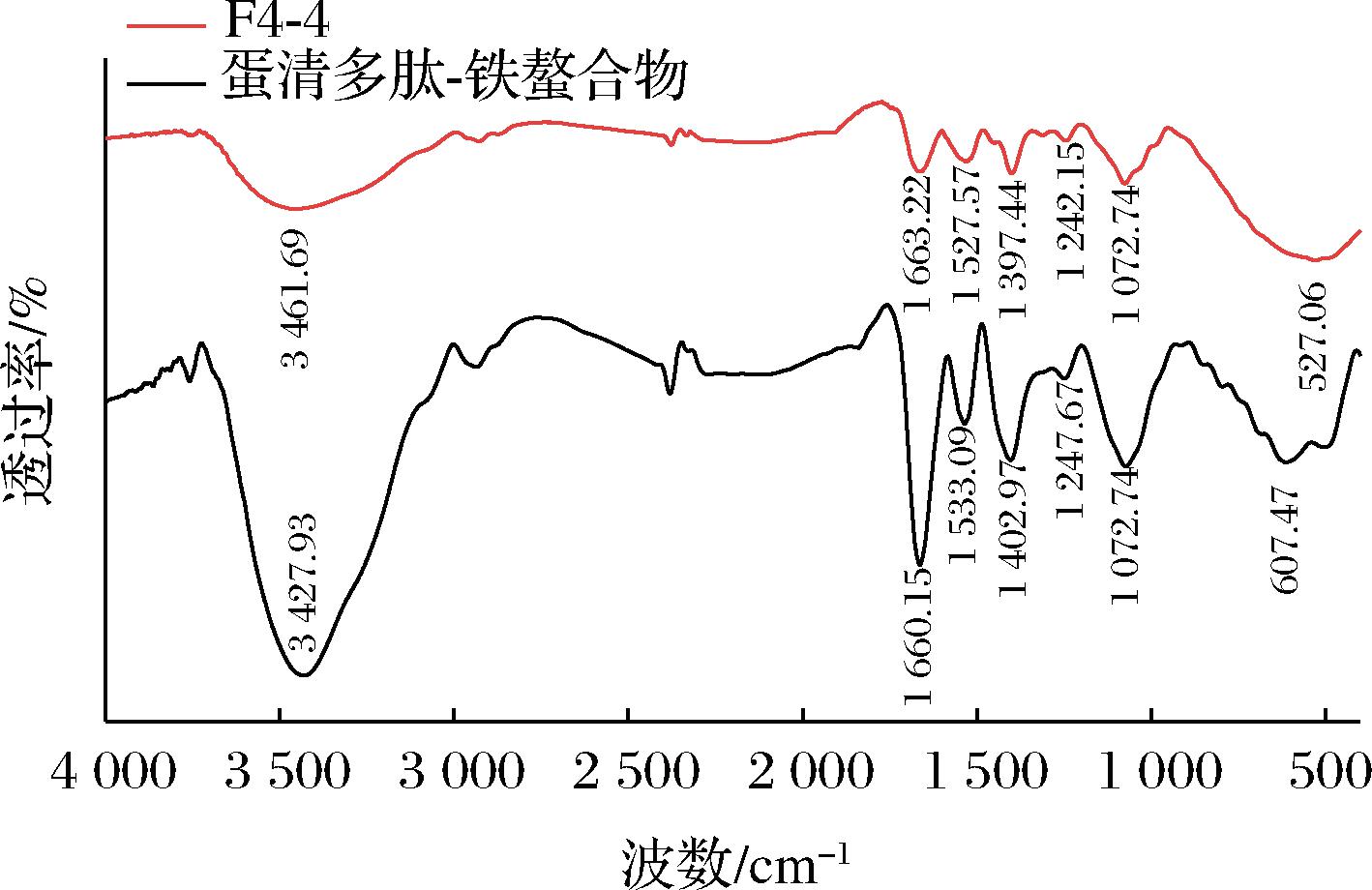
图4 BZ-4和蛋清多肽-铁螯合物的红外光谱图
Fig.4 Infrared spectra of BZ-4 and egg white polypeptide-iron chelate
2.4.3 XRD分析
BZ-4及蛋清多肽-铁螯合物的XRD图中(图5),多肽的特征衍射峰出现在衍射角为20°时,与Fe2+螯合后的衍射峰发生了明显的变化,衍射峰强度下降,衍射角偏移,表明蛋清多肽-铁螯合物中形成了新的相互作用力,具有不同于多肽的非晶型结构。
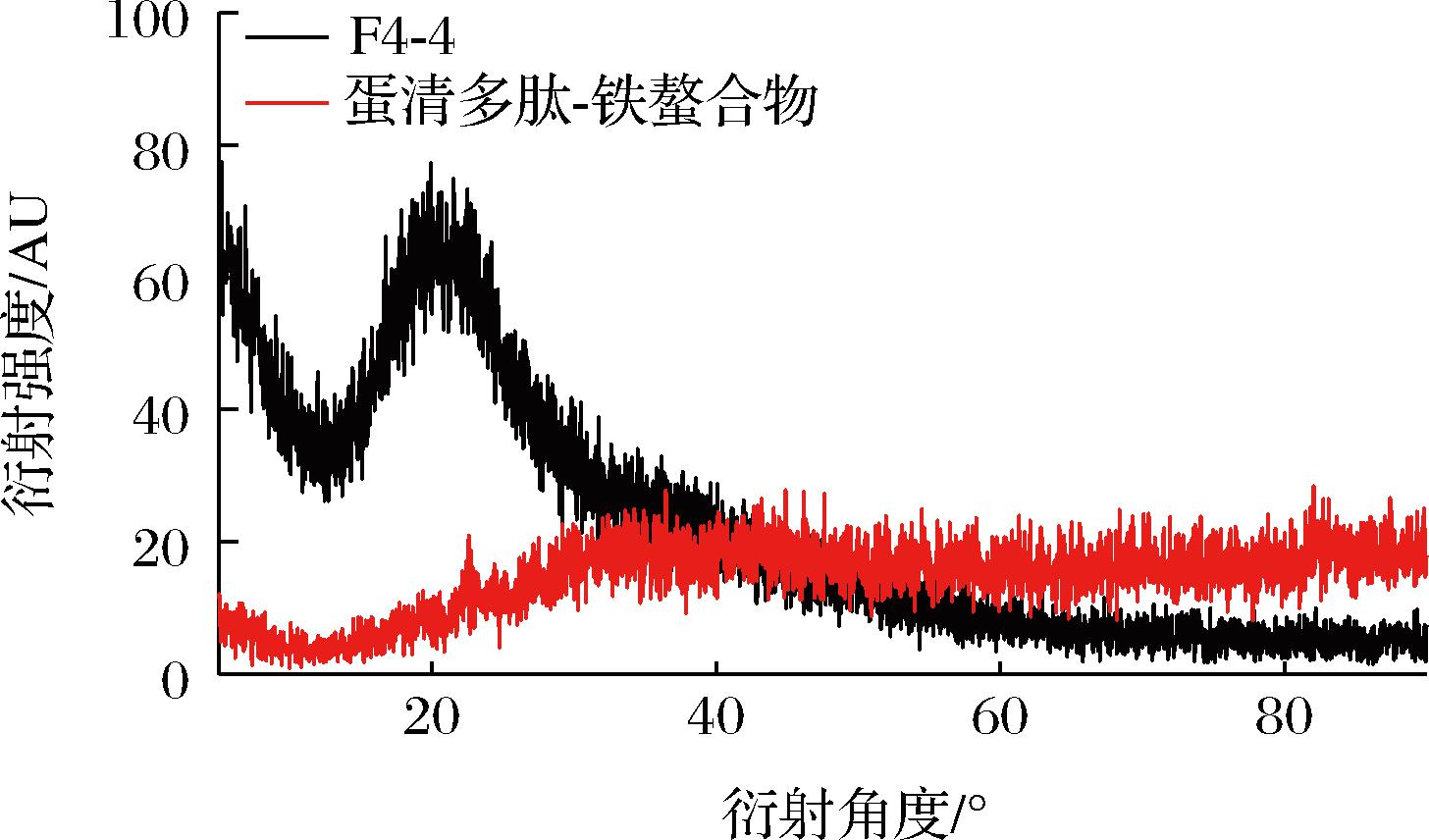
图5 BZ-4和蛋清多肽-铁螯合物的XRD图
Fig.5 XRD of BZ-4 and egg white polypeptide-iron chelate
2.5 细胞实验
细胞毒性实验中(图6-a),在0.05、0.1、0.5、1 mg/mL蛋清多肽-铁螯合物、蛋清多肽和硫酸亚铁的作用下,细胞活力均在80%以上,但当质量浓度为5 mg/mL时,蛋清多肽-铁螯合物处理的细胞活力下降到64.73%,蛋清多肽和硫酸亚铁处理的细胞活力分别仅有33.01%和10.24%,这表明高浓度的蛋清多肽-铁螯合物对细胞的毒性小于同浓度的蛋清多肽和硫酸亚铁。
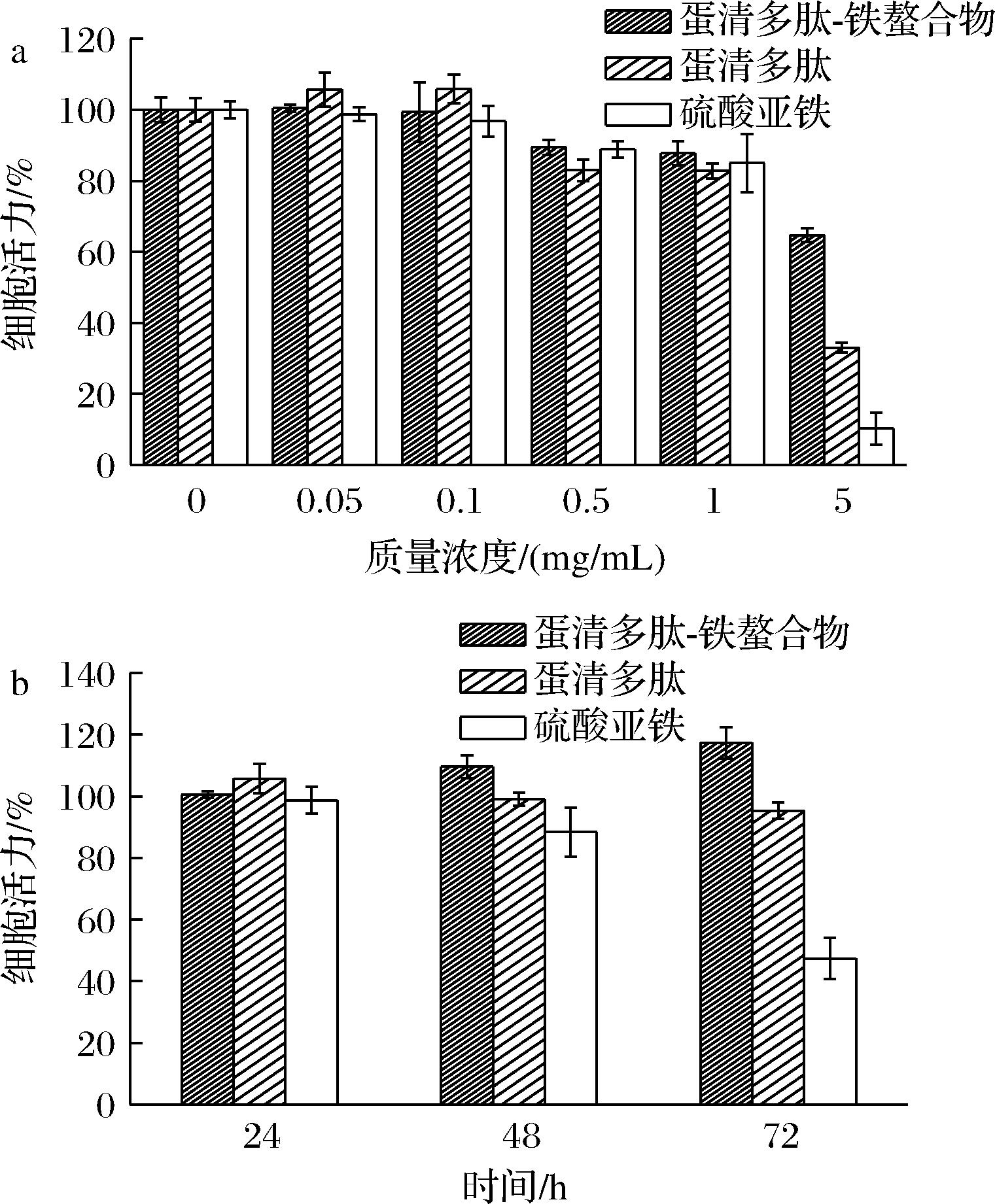
a-不同质量浓度蛋清多肽-铁螯合物、蛋清多肽和硫酸亚铁的细胞活力;b-蛋清多肽-铁螯合物、蛋清多肽和硫酸亚铁不同刺激时间下的细胞活力
图6 蛋清多肽-铁螯合物、蛋清多肽和硫酸亚铁对Caco-2细胞活力的影响
Fig.6 Effects of egg white polypeptide-iron chelate, egg white polypeptide, and ferrous sulfate on the cell activity of Caco-2
为了进一步研究刺激时间对细胞活力的影响,以0.05 mg/mL的蛋清多肽-铁螯合物、蛋清多肽和硫酸亚铁处理细胞(图6-b),随着刺激时间的延长,在蛋清多肽-铁螯合物作用下细胞活力呈上升趋势,说明细胞继续分化和生长。而蛋清多肽对细胞活力无明显影响,硫酸亚铁处理后的细胞活力呈下降趋势,进一步证实了同浓度下蛋清多肽和硫酸亚铁的毒性大于蛋清多肽-铁螯合物。Fe2+毒性可能源于自由基的过度产生,自由基可能改变膜的稳定性和穿透性,并随后引发脂质过氧化和DNA损伤[25]。
3 结论
本研究利用咸蛋清,脱盐后经胰蛋白酶水解,最优工艺为底物浓度4%、酶添加量10%、pH 8、温度50 ℃,酶解8 h,所得产物的铁螯合能力为95.27%。利用超滤和Sephadex G-15分离出铁螯合能力最高的组分为BZ-4,扫描电镜、能谱显示蛋清多肽与Fe2+发生螯合反应,红外表明蛋清多肽与Fe2+结合的位点主要是氨基、羧基和酰胺基。XRD显示多肽与Fe2+螯合后衍射峰偏移,衍射强度变小。这些结果证实了蛋清多肽-铁螯合物的形成。Caco-2细胞实验表明蛋清多肽-铁螯合物与蛋清多肽和硫酸亚铁相比,更加安全且具有促进细胞增殖的作用。
[1] TAN T C, PHATTHANAWIBOON T, MAT EASA A.Quality, textural, and sensory properties of yellow alkaline noodles formulated with salted duck egg white[J].Journal of Food Quality, 2016, 39(4):342-350.
[2] 赵宁宁, 何慧, 胡琪, 等.脱盐咸鸭蛋清促钙吸收肽的制备及脱酰胺修饰[J].食品科学, 2014, 35(9):181-186.
ZHAO N N, HE H, HU Q, et al.Preparation and deamination of calcium absorption-promoting peptides from desalted duck egg white[J]. Food Science, 2014, 35(9):181-186.
[3] 曹丛丛. 阿胶促铁吸收的活性成分及其铁螯合物的补血作用研究[D].无锡:江南大学, 2021.
CAO C C. Study on the active components of Colla corii asini promoting iron absorption and hematopoietic effect of their iron chelates[D].Wuxi: Jiangnan University, 2021.
[4] 黄赛博. 带鱼蛋白多肽亚铁螯合物的制备及生物活性研究[D].舟山:浙江海洋大学, 2016.
HUANG S B. Study on preparation and biological activities of ferrous chelates including hairtail protein hydrolysates[D].Zhoushan: Zhejiang Ocean University, 2016.
[5] ZHANG Y J, DING X J, LI M Q.Preparation, characterization and in vitro stability of iron-chelating peptides from mung beans[J].Food Chemistry, 2021, 349:129101.
[6] GUO L D, HOU H, LI B F, et al.Preparation, isolation and identification of iron-chelating peptides derived from Alaska pollock skin[J].Process Biochemistry, 2013, 48(5-6):988-993.
[7] WU H H, LIU Z Y, ZHAO Y H, et al.Enzymatic preparation and characterization of iron-chelating peptides from anchovy (Engraulis japonicus) muscle protein[J].Food Research International, 2012, 48(2):435-441.
[8] LI B, HE H, SHI W, et al.Effect of duck egg white peptide-ferrous chelate on iron bioavailability in vivo and structure characterization[J].Journal of the Science of Food and Agriculture, 2019, 99(4):1834-1841.
[9] 刘闪, 刘良忠, 陈阳明, 等.白鲢鱼骨胶原低聚肽螯合钙的结构表征及其促细胞增殖作用[J].中国食品学报, 2016, 16(9):185-191.
LIU S, LIU L Z, CHEN Y M, et al.Structural characterization and promoting cell proliferation of collagen oligopeptide chelated calcium from silver carp fish bone[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(9):185-191.
[10] HUANG W, LAN Y Q, LIAO W W, et al.Preparation, characterization and biological activities of egg white peptides-calcium chelate[J].LWT, 2021, 149:112035.
[11] WANG Y H, CAI M, ZENG H, et al.Preparation, characterization and iron absorption by Caco-2 cells of the casein peptides-iron chelate[J].International Journal of Peptide Research and Therapeutics, 2022, 28(4):116.
[12] 崔春, 任娇艳, 赵谋明, 等.一种咸蛋清脱盐制备高起泡性蛋清粉的方法:中国, CN101878924B[P].2012-10-31.
CUI C, REN Y J, ZHAO M M, et al.A method for preparing high foaming egg white powder by desalting salted egg white:China, CN101878924B[P].2012-10-31.
[13] 李博, 侯焘, 陈恩民, 等.脱盐咸鸭蛋清肽-亚铁螯合物的制备及表征[J].食品工业科技, 2017, 38(16):172-177.
LI B, HOU T, CHEN E M, et al.Preparation and characterization of desalted duck egg white peptide-ferrous chelate[J].Science and Technology of Food Industry, 2017, 38(16):172-177.
[14] LIU Y, MA X Y, SI X X, et al.Preparation, characterization, and properties of wampee seed antioxidant peptides-iron chelate[J].Journal of Food Processing and Preservation, 2022, 46(5):e16513.
[15] REN Y, WU H, LI X F, et al.Purification and characterization of high antioxidant peptides from duck egg white protein hydrolysates[J].Biochemical and Biophysical Research Communications, 2014, 452(4):888-894.
[16] 庞忠莉. 牡蛎肽亚铁螯合物的制备及性质研究[D].广州:华南理工大学, 2020.
PANG Z L. Study on preparation and properties of oyster peptide ferrous chelate[D].Guangzhou:South China University of Technology, 2020.
[17] FANG S X, RUAN G R, HAO J, et al.Characterization and antioxidant properties of Manchurian walnut meal hydrolysates after calcium chelation[J].LWT-Food Science and Technology, 2020, 130:109632.
[18] ZHU S Y, ZHENG Y M, HE S, et al.Novel Zn-binding peptide isolated from soy protein hydrolysates:Purification, structure, and digestion[J].Journal of Agricultural and Food Chemistry, 2021, 69(1):483-490.
[19] 钱跃威, 徐瀚麟, 吕奇晏, 等.鳗鱼骨胶原肽钙螯合物的制备及其稳定性和Caco-2吸收特性[J].食品科学, 2020, 41(24):1-8.
QIAN Y W, XU H L, LYU Q Y, et al.Preparation and stability of calcium-chelating peptide and its absorption characteristics in Caco-2 cells[J].Food Science, 2020, 41(24):1-8.
[20] 谢丽平. 具有抗氧化、抗衰老活性的多肽筛选、分离纯化及结构鉴定[D].广州:华南理工大学, 2019.
XIE L P. Screening, separation and purification, structure identification of peptides with antioxidant and anti-aging effects[D]. Guangzhou: South China University of Technology, 2019.
[21] JIANG H, ZHANG W T, CHEN F Y, et al.Purification of an iron-binding peptide from scad (Decapterus maruadsi) processing by-products and its effects on iron absorption by Caco-2 cells[J].Journal of Food Biochemistry, 2019, 43(7):e12876.
[22] 曹玉惠, 张娟娟, 王再扬, 等.牡蛎源类蛋白反应修饰肽的分离纯化及肽锌螯合物的结构表征[J].高等学校化学学报, 2018, 39(3):470-475.
CAO Y H, ZHANG J J, WANG Z Y, et al.Separation and identification of oyster peptide modified by plastein reaction and characterization of peptide-zinc complexes[J].Chemical Journal of Chinese Universities, 2018, 39(3):470-475.
[23] WANG L, DING Y Y, ZHANG X X, et al.Isolation of a novel calcium-binding peptide from wheat germ protein hydrolysates and the prediction for its mechanism of combination[J].Food Chemistry, 2018, 239:416-426.
[24] ATHIRA S, MANN B, SHARMA R, et al.Preparation and characterization of iron-chelating peptides from whey protein:An alternative approach for chemical iron fortification[J].Food Research International, 2021, 141:110133.
[25] HE W L, FENG Y, LI X L, et al.Availability and toxicity of Fe(II) and Fe(III) in Caco-2 cells[J].Journal of Zhejiang University SCIENCE B, 2008, 9(9):707-712.