胶原蛋白作为动物体结缔组织的主要结构蛋白,占动物体蛋白总量的30%[1],是决定人体组织结构强度的主要因素[2]。胶原蛋白与人体组织修复、创口愈合联系密切,凭借良好的生物相容性低免疫原性在食品、药品、医疗产业中广泛应用。
中华鳖(Trionyx sinensis)也称为甲鱼,具有高蛋白、低脂肪等优点,鳖肉不仅味道鲜美,鳖甲、裙边皆有不同的食疗保健作用,是广受消费者好评的滋补品[3]。作为我国淡水养殖的特色产品之一,在近五年的时间里,中华鳖的年养殖量一直保持在30万 t以上,并有着持续上升的趋势[4]。年养殖量的上升将形成大规模、大密度鳖类饲养环境。在这种条件下容易引发中华鳖相互攻击,造成中华鳖的死亡。鳖死亡后,鳖体内的组氨酸会在微生物的作用下迅速产生组胺,食用后会造成组胺中毒,所以死亡后的中华鳖往往被当作废料丢弃,大大降低了中华鳖的经济价值。而在以往对鳖类副产物的研究中发现,背甲[5]、裙边[6]均可作为良好的胶原蛋白提取原料,为这一现状提供了新思路。如果能有效提取死亡中华鳖中胶原蛋白等营养成分,将会对有效减少水产品资源的浪费以及对环境的污染。
本实验在中华鳖副产物研究的基础上,通过柠檬酸和胃蛋白酶、酸性蛋白酶、木瓜蛋白酶、风味蛋白酶的不同提取方式,从中华鳖冻干粉中提取酸溶性胶原(acid-soluble collagen,ASC)和4种酶溶性胶原(enzyme-soluble collagen,ESC)。对5种胶原蛋白的氨基酸组成、微观结构、热稳定性、气味物质进行比较分析,旨在减少中华鳖资源流失的同时扩大鳖源胶原蛋白的应用范围,为中华鳖加工业发展提供实践基础。
1 材料与方法
1.1 材料与试剂
中华鳖由宁波鸣凤养殖场提供,选用雌、雄鳖各500只,质量为670~710 g,去除内脏后,剩余组分低温冷冻研磨成粉,贮存于-80 ℃中;柠檬酸、乙二胺四乙酸(EDTA)、酸性蛋白酶(700 000 U/g)、木瓜蛋白酶(200 000 U/g)、胃蛋白酶(250 000 U/g)、风味蛋白酶(30 000 U/g),上海麦克林股份有限公司;NaCl、异丙醇等均为分析纯,国药化学试剂有限公司。
1.2 仪器与设备
SU5000热场发射扫描电镜,日本日立公司;DSC8500差式扫描量热仪,美国PeekinElmer公司;17-3930小型垂直电泳仪,美国Bio-Rad公司;iS10 傅里叶变换红外光谱仪,美国Thermo Nicolet公司;LA-8080超高速氨基酸自动分析仪,日本日立公司。
1.3 实验方法
1.3.1 中华鳖粉基本成分测定
蛋白质:参考GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》凯氏定氮法;脂肪:参考GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》索氏抽提法;水分:参考GB 5009.3—2016《食品安全国家标准 食品中水分的测定》直接干燥法;灰分:参考GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》高温灼烧法。
1.3.2 中华鳖粉预处理
将研磨后的中华鳖置于真空冷冻干燥机内冻干2 d去除水分,中华鳖冻干粉贮存于玻璃真空干燥皿中备用。
参考文献[7]的方法并略微改动,称取5 g中华鳖冻干粉,提取过程均在4 ℃下。加入150 mL 2.5%(质量分数)NaCl,连续搅拌24 h,去除盐溶性蛋白。离心后弃去上清液,所得沉淀继续添加10%(质量分数)异丙醇,浸泡24 h去除脂肪,离心后向沉淀中加入150 mL 0.1 mol/L EDTA,静置过夜,离心弃去上清液,所得沉淀静置于4 ℃冰箱备用。
1.3.3 胶原蛋白提取
根据LIU等[8]的方法,并在此基础上进行修改。
a)ASC:所有操作均在4 ℃条件下进行。样品中加入175 mL柠檬酸,搅拌提取8 h,所得溶液于12 000 r/min 下离心10 min,弃去沉淀,上清液加入NaCl至浓度达到0.9 mol/L,盐析过夜。离心后所得沉淀加入最小体积的柠檬酸使其溶解,于透析袋中透析2 d,然后进行冷冻干燥得到ASC。
b)ESC:样品加入175 mL去离子水,并使用柠檬酸调节pH值至4种酶的最适pH区间,加入酶,使溶液酶活性达到2 500 U,在4 ℃下搅拌提取12 h,随后处理与ASC相同,透析结束后冷冻干燥的得到ESC。
胶原蛋白得率计算如公式(1)所示:
胶原蛋白含量![]()
(1)
1.3.4 SDS-PAGE
参照LAEMMLI等[9]的方法,将所制胶原蛋白样品20 μL加入至8%(质量分数)分离胶和5%(质量分数)浓缩胶制成的SDS-PAGE预制胶内,120 V电泳60 min。结束后使用考马斯亮蓝R-250快速染色液对预制胶染色30 min,随后脱色。
1.3.5 扫描电子显微镜(scanning electron microscope, SEM)
根据YANG等[10]的方法,将冻干的胶原蛋白样品放置在标准SEM样品台上,并离子喷涂金,以5 kV电压观察蛋白微观结构,比较不同提取方法下胶原蛋白的结构特征与差异。
1.3.6 傅里叶变换红外光谱(Fourier transform infrared spectrometer,FT-IR)
根据文献[11]的方法并进行一定的修改,光谱扫描范围为4 000~500 cm-1,分辨率为4 cm-1,得到5种胶原蛋白吸收峰的变化曲线。
1.3.7 差式量热扫描仪(differential scanning calorimetry, DSC)
参考张强等[6]的测量方法,称取0.1 g冻干粉加入4 mL乙酸,准确称取10 mg液体于坩埚中,扫描温度20~70 ℃,以5 ℃/min的速率进行升温,以空白坩埚作为对照。
1.3.8 GC-MS
参考CHEN等[12]的方法并进行一定的修改,将色谱柱温度编程设置在40 ℃下5 min,然后以3 ℃/min的速率升降到220 ℃并保持5 min。质谱仪的电子电离电压和离子源温度分别为70 eV和230 ℃。质谱仪的扫描范围设置为40~400 m/z。通过将其质谱数据与其标准和质谱数据库(NIST-14)进行比较来识别气味剂,计算每种化合物的保留指数(retention index,RI),并与其标准进行比较。通过GC-MS探究不同方法所得到的鳖源胶原蛋白的气味。
1.3.9 氨基酸成分分析
参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》。称取胶原蛋白冻干10 mg,加入6 mol/L盐酸,水解22 h,冷却至室温后定容。准确吸取0.5 mL样液于干燥皿中,减压干燥,干燥残留物用0.5 mL水解直至蒸干。蒸干后加入2 mL柠檬酸钠缓冲溶液,通过0.22 μm滤膜后转移至进样瓶备用。
1.4 数据统计与分析
采用SPSS 27和Origin 2017进行统计与数据分析。
2 结果与分析
2.1 中华鳖粉基本成分分析
由图1可知,中华鳖粉粗蛋白含量占总组分的18.22%,虽低于鳖裙边粗蛋白[6],但水分、粗脂肪含量较低,原料量大,易于获取等优点,依旧可以视为较好的胶原蛋白来源。
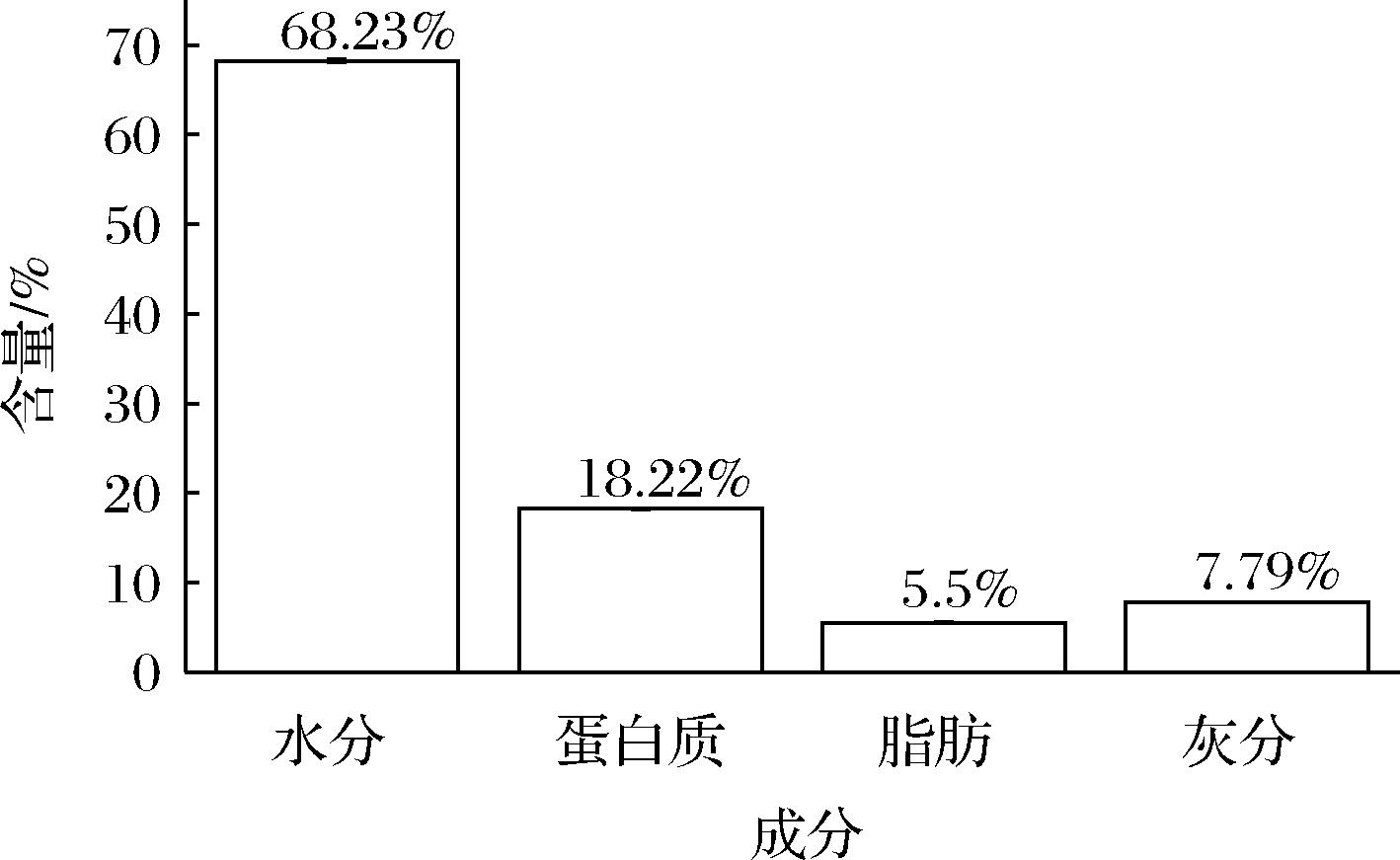
图1 中华鳖粉基本成分
Fig.1 Basic ingredients of Chinese soft-shelled turtle powder
2.2 中华鳖粉胶原蛋白得率
由图2可知,由于胶原蛋白末端肽链在酸性条件下的溶解度较低,酶裂解后,能够提高胶原蛋白肽链在酸性溶液中的溶解度,进而提高胶原蛋白的提取效率,所以酸法较酶法提取率偏低。在不同酶提取率比较中,胃蛋白酶与酸性蛋白酶显著高于风味与木瓜蛋白酶(P<0.05)。这是因为蛋白质内部结构域在酸性条件下更易受到裂解[12],所以pH在酸性或弱酸性时,鳖粉胶原蛋白提取效率更高。
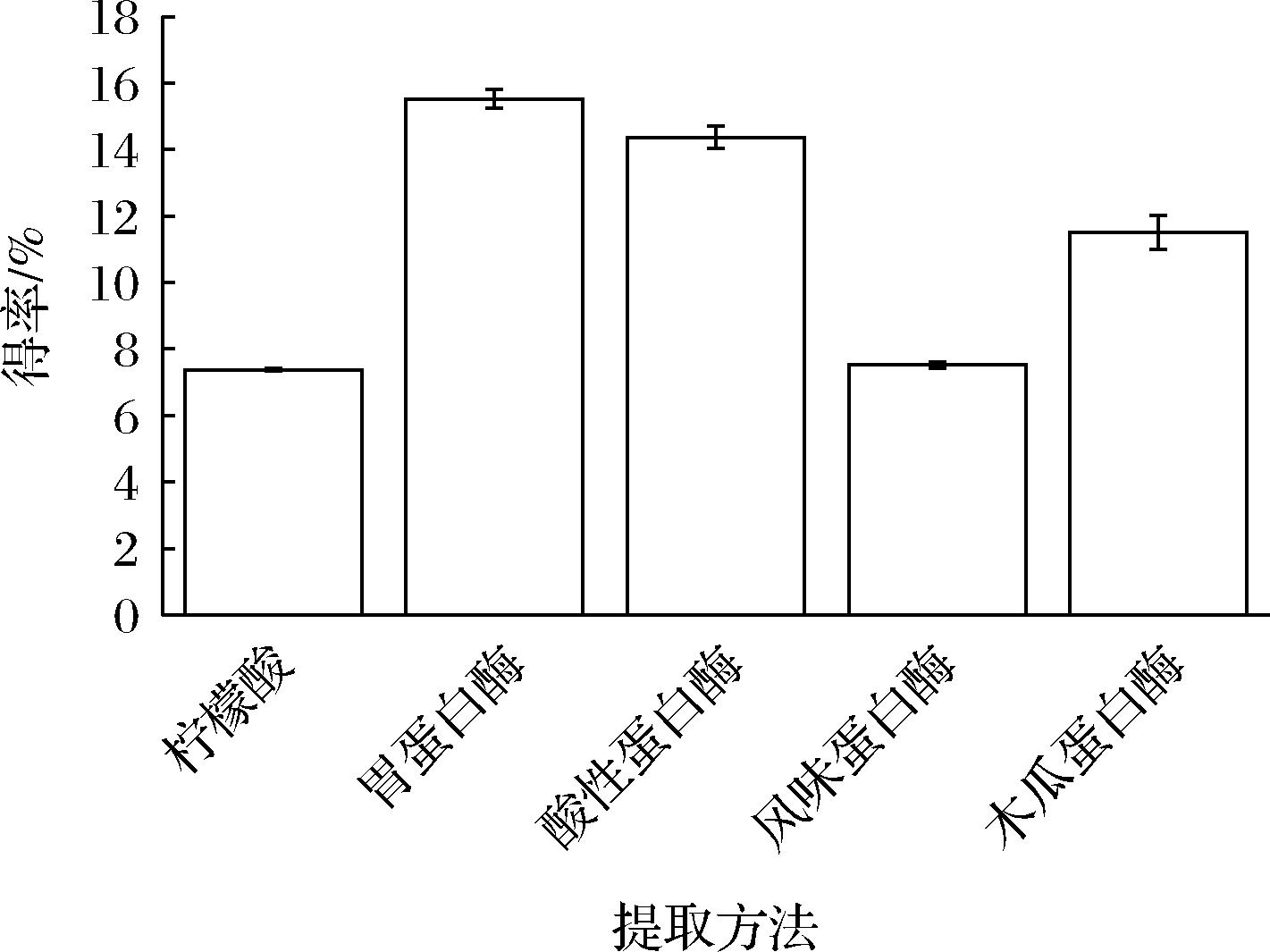
图2 中华鳖粉胶原蛋白提取率
Fig.2 Chinese soft-shelled turtle powder collagen extraction rate
2.3 中华鳖粉胶原蛋白SDS-PAGE凝胶电泳分析
图3中的1~5条带分别对应柠檬酸、酸性蛋白酶、胃蛋白酶、风味蛋白酶和木瓜蛋白酶的电泳条带。从上到下可以依次看见γ、β、α1、α2链,其中α1、α2链分子质量为135~180 kDa,确定了γ链(300 kDa)与β链(250 kDa)的条带,进一步证明中华鳖粉中存在Ⅰ型胶原蛋白。ASC与ESC的α2链下还存在其他条带,说明均有小分子肽的存在。
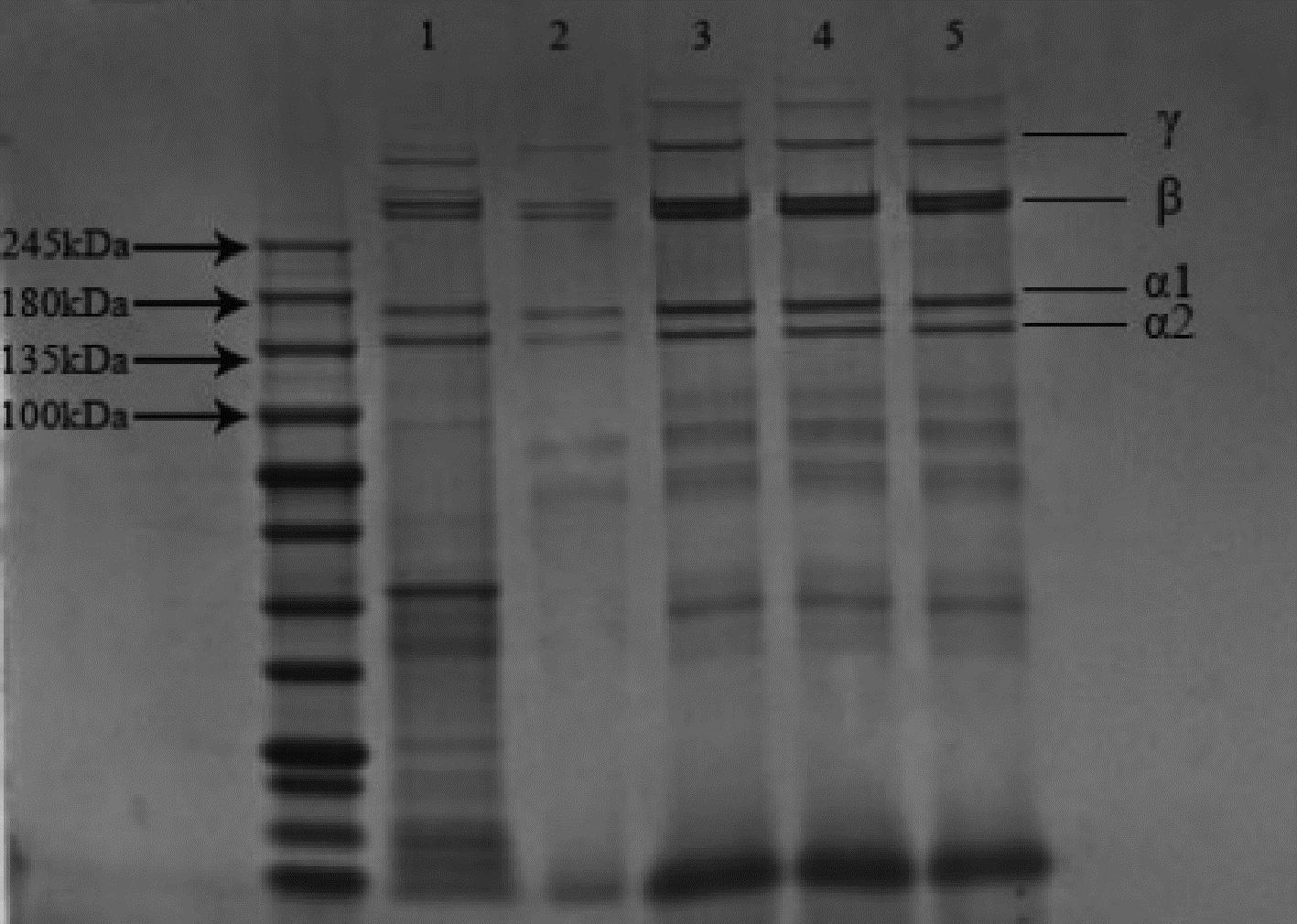
1-柠檬酸;2-酸性蛋白酶;3-胃蛋白酶;4-风味蛋白酶;5-木瓜蛋白酶
图3 中华鳖粉ASC与ESC SDS-PAGE电泳图
Fig.3 SDS-PAGE electrophoresis of ASC and ESC of Chinese soft-shelled turtle powder
2.4 中华鳖粉胶原蛋白SEM分析
图4是在1 mm、500 μm、100 μm 3种放大倍数下对5种胶原蛋白的微观结构进行观察,图中显示,2种中性酶(风味、木瓜)提取的胶原蛋白交联程度低,多为片状,且较为松散(图4-d-1~图4-d-3,图4-e-1~图4-e-3)。猜测因为鳖粉中同时存在裙边以及背甲组织,导致柠檬酸与胃蛋白酶法提取的胶原蛋白存在少量海绵组织与多孔交联组织的混合结构(图4-a-1~图4-a-3,图4-b-1~图4-b-3),酸性蛋白酶法得到的胶原蛋白呈多层片状结构,紧密程度高于风味、木瓜蛋白酶法,但交联程度低于胃蛋白酶与柠檬酸法。由此可得,不同提取方式会对胶原蛋白微观结构造成影响。
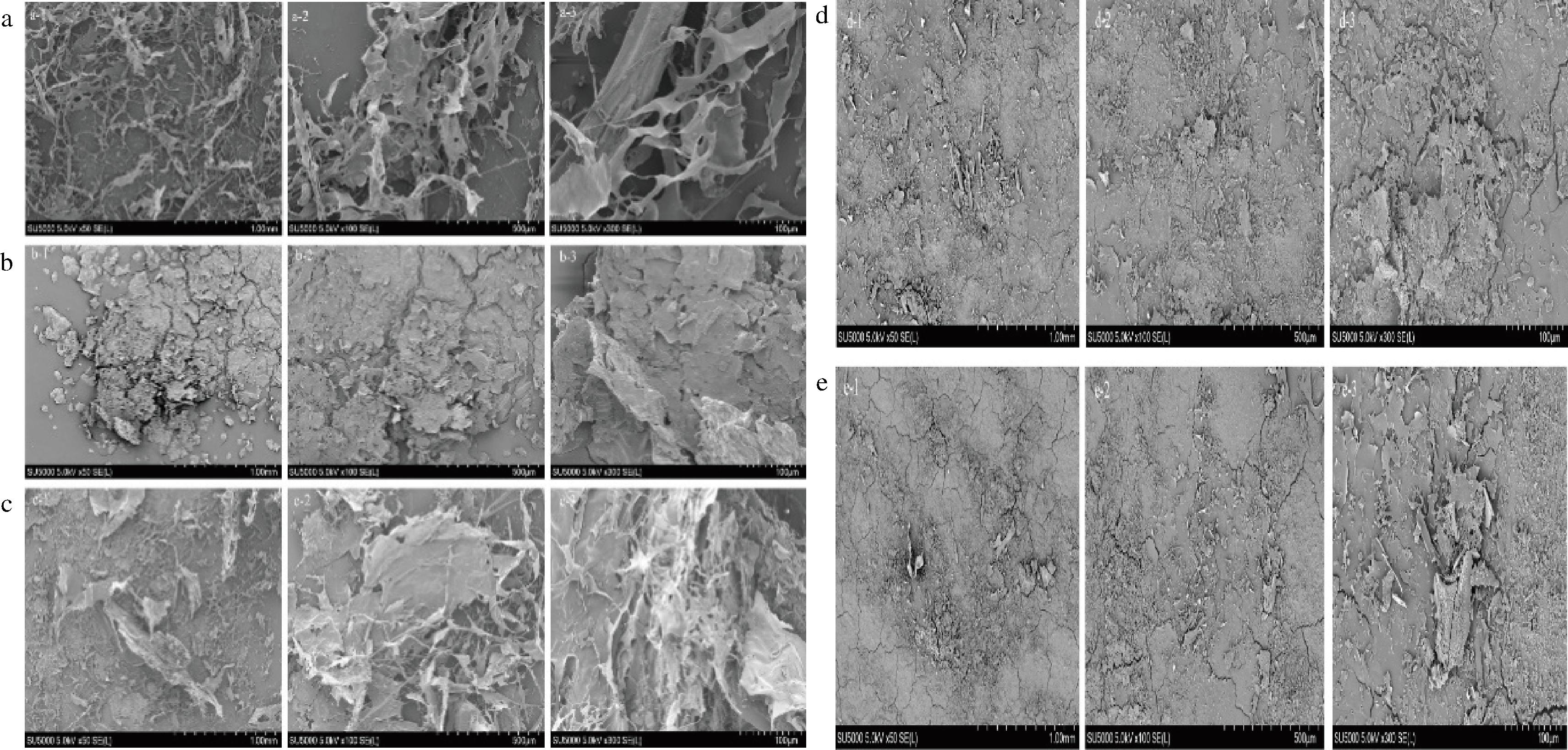
a-柠檬酸;b-酸性蛋白酶;c-胃蛋白酶;d-风味蛋白酶;e-木瓜蛋白酶
图4 中华鳖粉酸溶性胶原ASC与酶溶性胶原ESC扫描电镜图
Fig.4 SEM of ASC and ESC of Chinese turtle powder
2.5 中华鳖粉胶原蛋白FT-IR分析
图5为5种提取工艺下中华鳖粉胶原蛋白在4 000~500 cm-1红外吸收光谱图。图5-a显示,不同工艺提取的胶原蛋白峰形存在差异。图5-b、图5-c中酰胺A带处于3 273.23、3 231.28 cm-1附近,均小于N—H的拉伸振动范围(3 400~3 440 cm-1),说明鳖粉胶原蛋白的稳定性由氢键主导[13]。5种胶原蛋白的酰胺B带出现在2 971.41 cm-1和2 970.45 cm-1附近,说明是由C—H的不对称伸展和伸缩振动引起的特征吸收峰[14]。在对酰胺Ⅱ带的分析中发现,由于甘氨酸和脯氨酸侧链的—CH2与蛋白质C—N、N—H基团的收缩、弯曲振动发生了耦合,导致酸性、风味、木瓜蛋白酶法吸收峰位于1 400~1 500 cm-1[15],而胃蛋白酶与柠檬酸法所得胶原蛋白的酰胺Ⅰ、Ⅱ、Ⅲ带分别位于1 633.48、1 557.30、1 241.02 cm-1,仅与双键基团的拉伸振动有关,耦合程度较小[16]。红外光谱表明5种胶原蛋白二级结构保留完整,与ZOU等[14]对龟甲,SUN等[17]对罗非鱼皮的研究结果一致,酶法与酸法均保留了较好的胶原蛋白三螺旋结构。
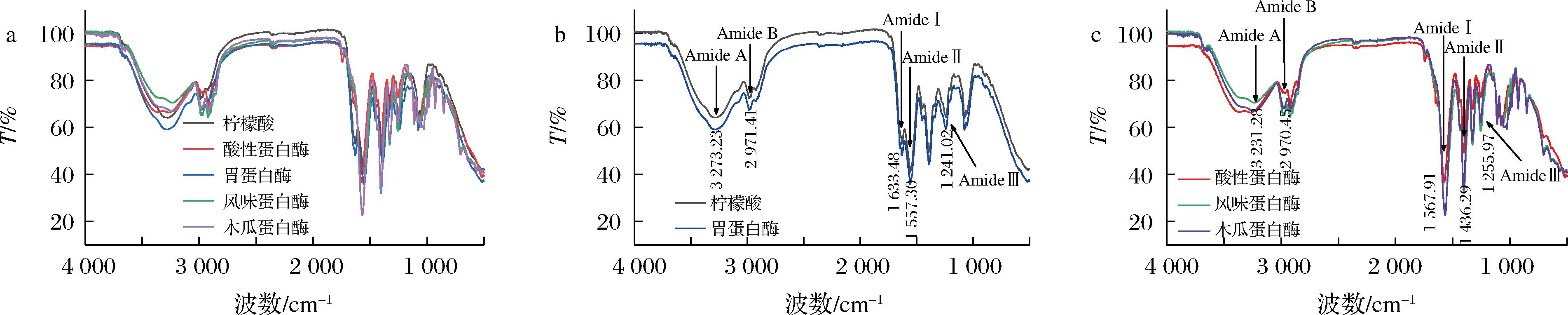
图5 中华鳖粉ASC与ESC傅里叶红外光谱图
Fig.5 Fourier infrared spectra of ASC and ESC collagen from Chinese turtle powder
注:Amide A:酰胺A带;Amide B:酰胺B带;Amide Ⅰ:酰胺Ⅰ带;Amide Ⅱ:酰胺Ⅱ带;Amide Ⅲ:酰胺Ⅲ带。
2.6 中华鳖粉胶原蛋白热稳定性分析
图6显示了中华鳖粉ASC与ESC的热变性温度曲线。ASC热变性温度略低于ESC,但无显著差异(P>0.05)。研究显示,鱼皮胶原蛋白的热变性温度在35 ℃以下[18],并且软壳龟皮肤胶原蛋白[19]与软壳龟裙边胶原蛋白[10]的热变性温度分别为36 ℃和35.1 ℃,这表明鳖粉胶原蛋白热稳定性要优于鱼皮和软壳龟皮肤、裙边组分。ZOU等[14]的研究表明,超声波等物理处理方式能够有效提高胶原蛋白热稳定性,在本研究中,胃蛋白酶法提取的胶原热稳定性最好,下一步可以采取超声波处理等方式进一步提高鳖粉胶原蛋白的热稳定性,为鳖源胶原蛋白的应用提供更丰富的实践基础。
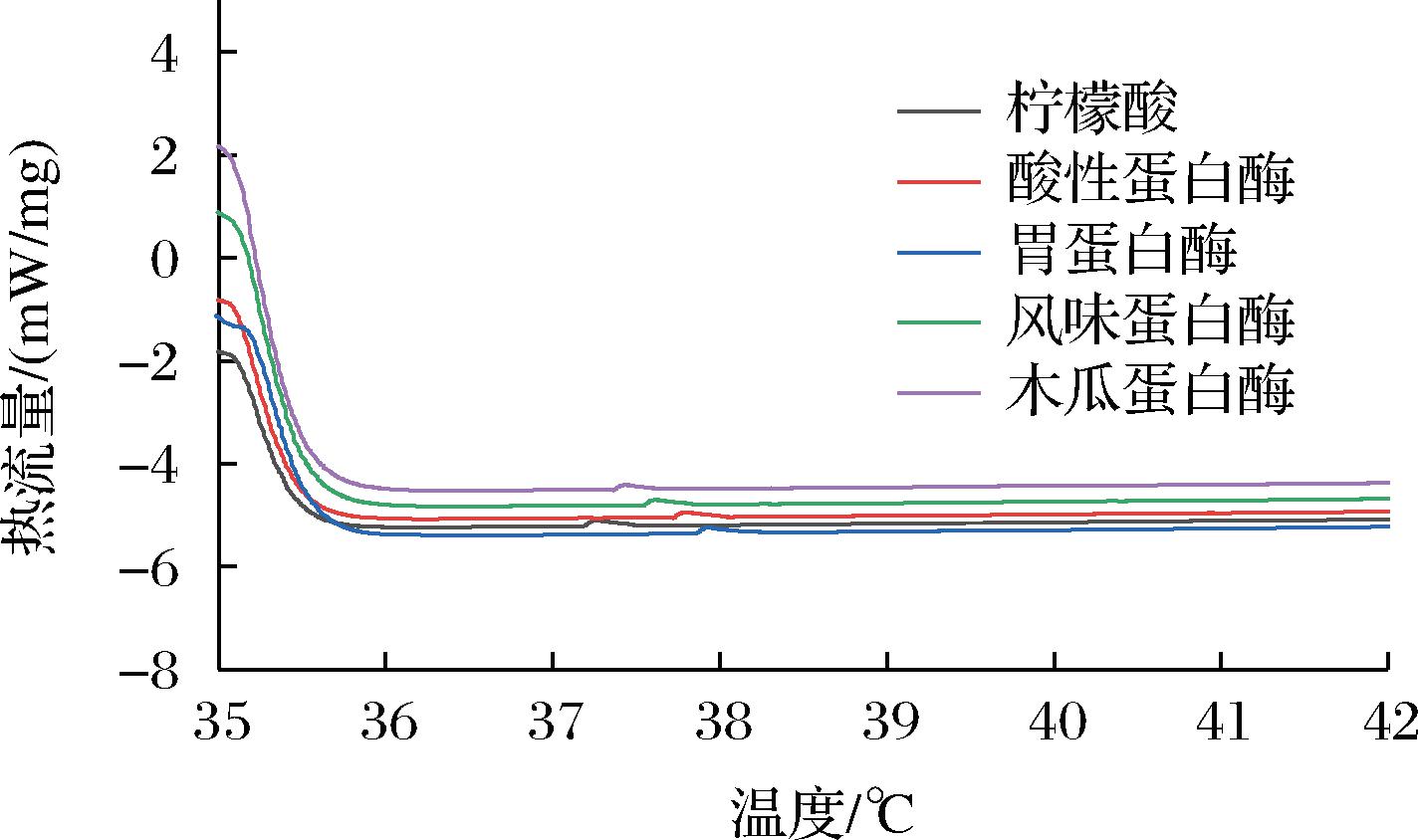
图6 中华鳖粉ASC与ESC胶原热变性温度曲线
Fig.6 Thermal denaturation temperature profile of ASC and ESC from Chinese turtle powder
2.7 中华鳖粉在不同提取方法下的气味特征分析(GC-MS)
如表1所示,通过质谱与RI值定性分析,分别从5种方法中检测出12种(柠檬酸)、10种(酸性蛋白酶)、4种(胃蛋白酶)、9种(风味蛋白酶)、14种(木瓜蛋白酶)挥发性气味物质。5种胶原蛋白的主要气味为苯环、乙酸乙酯(芳香类)和酮、醇(果香类)化合物,同时,不同提取方法会使胶原混有其他气味成分(来源于非胶原蛋白杂质),这两者共同决定了所提胶原的气味构成,间接影响鳖粉胶原蛋白在各领域中的应用。柠檬酸法中检测出使水产品产生强烈刺激性气味的异戊醇(主要存在于淡水鱼皮肤[20]),而酶法并未检出。
表1 中华鳖粉在不同提取方法下的气味物质成分
Table 1 Odor composition of Chinese soft-shelled turtle powder under different extraction methods
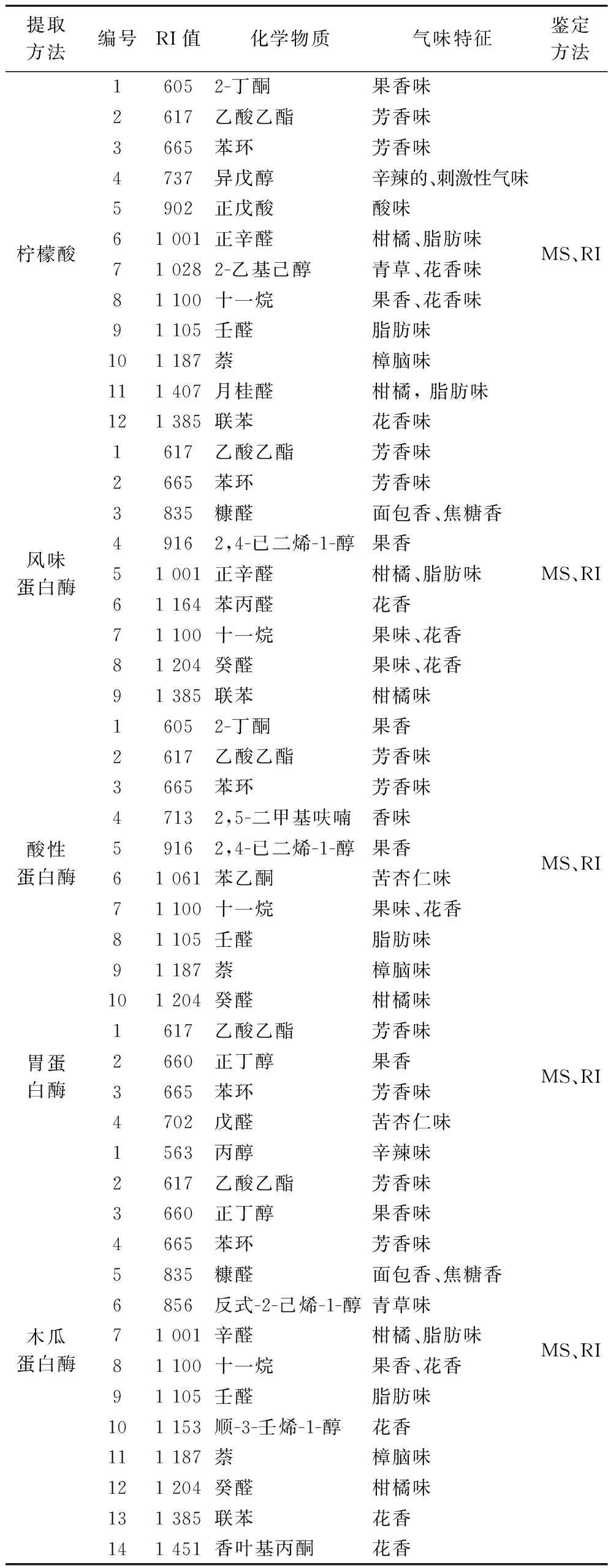
提取方法编号RI值化学物质气味特征鉴定方法柠檬酸16052-丁酮果香味2617乙酸乙酯芳香味3665苯环芳香味4737异戊醇辛辣的、刺激性气味5902正戊酸酸味61 001正辛醛柑橘、脂肪味71 0282-乙基己醇青草、花香味81 100十一烷果香、花香味91 105壬醛脂肪味101 187萘樟脑味111 407月桂醛柑橘, 脂肪味121 385联苯花香味MS、RI风味蛋白酶1617乙酸乙酯芳香味2665苯环芳香味3835糠醛面包香、焦糖香49162,4-已二烯-1-醇果香51 001正辛醛柑橘、脂肪味61 164苯丙醛花香71 100十一烷果味、花香81 204癸醛果味、花香91 385联苯柑橘味MS、RI酸性蛋白酶16052-丁酮果香2617乙酸乙酯芳香味3665苯环芳香味47132,5-二甲基呋喃香味59162,4-已二烯-1-醇果香61 061苯乙酮苦杏仁味71 100十一烷果味、花香81 105壬醛脂肪味91 187萘樟脑味101 204癸醛柑橘味MS、RI胃蛋白酶1617乙酸乙酯芳香味2660正丁醇果香3665苯环芳香味4702戊醛苦杏仁味MS、RI木瓜蛋白酶1563丙醇辛辣味2617乙酸乙酯芳香味3660正丁醇果香味4665苯环芳香味5835糠醛面包香、焦糖香6856反式-2-己烯-1-醇青草味71 001辛醛柑橘、脂肪味81 100十一烷果香、花香91 105壬醛脂肪味101 153顺-3-壬烯-1-醇花香111 187萘樟脑味121 204癸醛柑橘味131 385联苯花香141 451香叶基丙酮花香MS、RI
注:MS表示质谱。
说明酶法能一定程度上避免水产品原料中的刺激性气味进入提取成分中;除此之外,柠檬酸、酸性蛋白酶、木瓜蛋白酶提取出的萘(樟脑味),对胶原蛋白后续应用存在不利影响;风味蛋白酶提取出的糠醛成分(面包、焦糖味)能提升酶溶性胶原蛋白在功能性食品上的应用潜力;同时胃蛋白酶法提取出的挥发性气味物质最少,更适用于生物医药产品的研发。
2.8 中华鳖粉胶原蛋白氨基酸分析
表2、表3显示了中华鳖粉胶原蛋白的氨基酸组成。中华鳖粉胶原蛋白中必需氨基酸占比优于中华鳖裙边[6],说明中华鳖粉胶原蛋白具备较高的营养价值。其中胃蛋白酶溶性胶原蛋白氨基酸总量最高,而呈味氨基酸含量较少,与前文GC-MS研究结果一致。
表2 中华鳖粉ASC与ESC氨基酸组成
Table 2 Amino acid composition of ASC and ESC of Chinese turtle powder

氨基酸分类氨基酸种类提取方法及含量/(g/100 g)柠檬酸酸性蛋白酶胃蛋白酶风味蛋白酶木瓜蛋白酶呈味氨基酸TDAA甘氨酸(Gly)37.11±0.3043.0±3.0045.68±0.0728.3±0.1049.1±0.90谷氨酸(Glu)5.74±0.054.86±0.008.27±0.015.60±0.013.09±0.02丙氨酸(Ala)/0.007 1±0.001 5/0.007 4±0.004 3/天冬氨酸(Asp)4.37±0.023.34±0.014.55±0.014.20±0.022.27±0.01必需氨基酸TEAA赖氨酸(Lys)2.60±0.051.44±0.105.40±0.032.02±0.071.33±0.04亮氨酸(Leu)7.41±0.032.17±0.0722.2±0.015.97±0.073.90±0.07苏氨酸(Thr)1.62±0.001.32±0.012.18±0.011.53±0.020.79±0.01缬氨酸(Val)0.55±0.110.48±0.030.75±0.050.42±0.110.33±0.08苯丙氨酸(Phe)/////异亮氨酸(Ile)2.87±0.0110.58±0.0414.89±0.104.53±0.068.24±0.04蛋氨酸(Met)1.04±0.030.88±0.134.62±0.031.64±0.090.87±0.06非需氨基酸TNEAA半胱氨酸(Cys)1.14±0.011.05±0.041.50±0.041.36±0.090.73±0.08精氨酸(Arg)3.35±0.172.25±0.176.02±0.023.09±0.032.18±0.09丝氨酸(Ser)2.47±0.021.46±0.013.42±0.011.92±0.021.11±0.01组氨酸(His)0.81±0.010.47±0.005.05±0.0043.00±0.1034.90±0.40亚氨基酸脯氨酸(Pro)2.75±0.081.65±0.138.81±0.152.57±0.302.85±0.09羟脯氨酸(Hyp)0.63±0.291.31±0.392.34±0.250.59±0.301.28±0.36TAA74.46±1.18 76.26±4.14 135.68±0.88 106.75±1.42 112.97±2.26
注:/表示无法检出,TAA(total amino acid)-氨基酸总量,TDAA(total delicious amino acid)-呈味氨基酸,TEAA(total essential amino acids)-必需氨基酸,TNEAA(total non essential amino acid)-非必需氨基酸。
表3 中华鳖粉ASC与ESC氨基酸占比 单位:%
Table 3 Percentage of amino acids in ASC and ESC of Chinese turtle powder
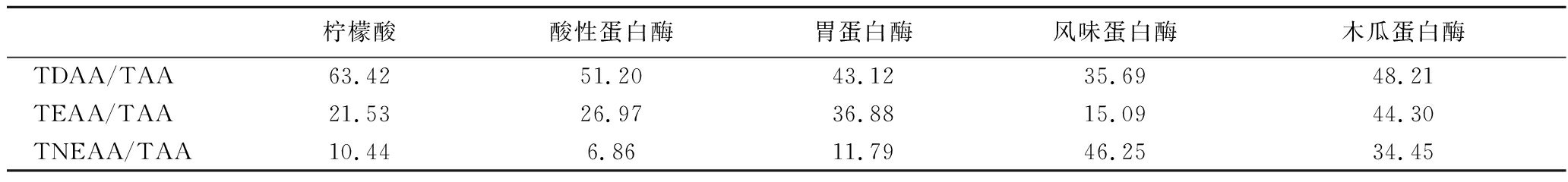
柠檬酸酸性蛋白酶胃蛋白酶风味蛋白酶木瓜蛋白酶TDAA/TAA63.4251.2043.1235.6948.21TEAA/TAA21.5326.9736.8815.0944.30TNEAA/TAA10.446.8611.7946.2534.45
胶原蛋白的分子结构主要通过Pro和Hyp的吡咯烷环对多肽链二级结构变化的限制来维持,并且部分由Hyp的羟基的氢键能力维持[21]。亚氨基酸含量越高,螺旋的稳定性和胶原蛋白的热稳定性就越大[22]。本研究中,胃蛋白酶溶性胶原蛋白亚氨基酸含量较高,具有较高的热变性温度,与DSC测定结果相同。
3 结论
本文采用5种不同提取方法,从中华鳖粉中提取到ASC和4种ESC,对所提胶原蛋白进行理化指标的测定与分析。
不同提取方法对胶原蛋白二级结构、氨基酸组成、气味组成、微观形态均存在影响。对比不同提取方式,ESC提取率显著高于ASC,其中最适pH<5的酶类能够有效提高鳖粉胶原蛋白产率。傅里叶红外光谱结果显示5种提取方法均能得到完整胶原蛋白结构,其中胃蛋白酶溶性胶原蛋白基团耦合程度较小,三螺旋结构最为稳定。对比不同方法的氨基酸组成与热稳定性(DSC),推测胶原蛋白热稳定性与亚氨基酸含量呈正相关。根据气相-质谱联用仪测定的数据,胃蛋白酶溶性胶原中,杂质气味较少,无刺激性气味组分,仅以芳香、果香为主,结合其微观结构(SEM),胃蛋白酶溶性胶原交联程度高、延展性强,具有更好的食品、医药利用价值。
根据SDS-PAGE凝胶电泳图谱中的条带与分子质量判断,鳖粉胶原具备I型胶原的主要特征,说明鳖粉胶原蛋白具备一定的纯度,但酶法提取的α2链下方存在明显条带,说明部分胶原蛋白在酶的持续作用下降解为小分子肽,对胶原的纯度造成了部分影响,但结合本研究其余数据发现:鳖粉胶原蛋白的主要性质并未被影响,依旧能保持I型胶原的主要特征。若想采取进一步的研发,则需进行更精密的纯化操作,以隔绝小分子肽的干扰。
综上,5种提取方法对鳖粉胶原蛋白的产量、氨基酸含量、微观结构、热稳定性等方面均存在影响。通过比较,胃蛋白酶提取的鳖粉胶原蛋白具有气味小、交联程度高、热稳定性好等优势,具备进一步纯化、开发利用的潜力。
[1] SRINIVASAN S, DURAIRAJ B. Collagen isolation and characterization from Sardinella longiceps[J]. Journal of Advanced Veterinary and Animal Research, 2021, 8(4):679-686.
[2] 蒋挺大.胶原与胶原蛋白[M]. 北京: 化学工业出版社, 2006.
JIANG T D. Collagen and Collagen [M]. Beijing: Beijing Chemical Industry Press, 2006.
[3] 曾漪青. 甲鱼的保健功能和加工技术[J]. 科学养鱼, 2003(2):55-56.
ZENG Y Q. Health care function and processing technology of soft-shelled turtle[J]. Scientific Fish Farming, 2003(2):55-56.
[4] 黄可承, 宫萱, 唐嘉诚, 等. 水产品副产物胶原蛋白制备方法及应用[J]. 精细化工, 2022, 39(9):1757-1766.
HUANG K C, GONG X, TANG J C, et al. Preparation and application of collagen from aquatic by-products[J]. Fine Chemicals, 2022, 39(9):1757-1766.
[5] 赵琼瑜, 胡鉴, 李彩燕, 等. 超声波辅助鳖甲脱钙工艺优化及其对胶原蛋白生化特征的影响[J]. 食品工业科技, 2022, 43(22):39-51.
ZHAO Q Y, HU J, LI C Y, et al. Ultrasound-assisted decalcification process optimization of carapace of Chinese soft-shelled turtle and biochemical characterization of collagen[J]. Science and Technology of Food Industry, 2022, 43(22):39-51.
[6] 张强, 黄鑫, 符安卫, 等. 中华鳖裙边胶原蛋白的提取、鉴定及其理化性质[J]. 食品与发酵工业, 2019, 45(12):176-182.
ZHANG Q, HUANG X, FU A W, et al. Extraction and characterization of collagens in Chinese sturgeon calipash[J]. Food and Fermentation Industries, 2019, 45(12):176-182.
[7] 陆剑锋, 万全, 殷章敏, 等. 中华鳖裙边胶原蛋白的提取及其特征[J]. 水产学报, 2010, 34(6):981-988.
LU J F, WAN Q, YIN Z M, et al. Extraction and characterization of collagen from calipash of Chinese soft-shelled turtle (Pelodiscus sinensis)[J]. Journal of Fisheries of China, 2010, 34(6):981-988.
[8] LIU H Y, LI D, GUO S D. Studies on collagen from the skin of channel catfish (Ictalurus punctaus)[J]. Food Chemistry, 2007, 101(2):621-625.
[9] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227:680-685.
[10] YANG Y N, LI C Y, SONG W, et al. Purification, optimization and physicochemical properties of collagen from soft-shelled turtle calipash[J]. International Journal of Biological Macromolecules, 2016, 89:344-352.
[11] FU Z R, AKULA S, THORPE M, et al. Marked difference in efficiency of the digestive enzymes pepsin, trypsin, chymotrypsin, and pancreatic elastase to cleave tightly folded proteins[J]. Biological Chemistry, 2021, 402(7):861-867.
[12] FU Z R, AKULA S, THORPE M, et al. Marked difference in efficiency of the digestive enzymes pepsin, trypsin, chymotrypsin, and pancreatic elastase to cleave tightly folded proteins[J]. Biological Chemistry, 2021, 402(7):861-867.
[13] KITTIPHATTANABAWON P, BENJAKUL S, VISESSANGUAN W, et al. Isolation and characterization of collagen from the cartilages of brownbanded bamboo shark (Chiloscyllium punctatum) and blacktip shark (Carcharhinus limbatus)[J]. LWT-Food Science and Technology, 2010, 43(5):792-800.
[14] ZOU Y, WANG L, CAI P P, et al. Effect of ultrasound assisted extraction on the physicochemical and functional properties of collagen from soft-shelled turtle calipash[J]. International Journal of Biological Macromolecules, 2017, 105:1602-1610.
[15] 吴婷. 牦牛骨胶原蛋白提取纯化及结构解析[D]. 兰州: 甘肃农业大学, 2017.
WU T. Extraction and purification of yak bone collagen and structural analysis[D]. Lanzhou: Gansu Agricultural University, 2017.
[16] CHUAYCHAN S, BENJAKUL S, KISHIMURA H. Characteristics of acid- and pepsin-soluble collagens from scale of seabass (Lates calcarifer)[J]. LWT-Food Science and Technology, 2015, 63(1):71-76.
[17] SUN L L, HOU H, LI B F, et al. Characterization of acid- and pepsin-soluble collagen extracted from the skin of Nile tilapia (Oreochromis niloticus)[J]. International Journal of Biological Macromolecules, 2017, 99:8-14.
[18] JONGJAREONRAK A, BENJAKUL S, VISESSANGUAN W, et al. Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper (Lutjanus vitta)[J]. Food Chemistry, 2005, 93(3):475-484.
[19] NAGAI N, KOBAYASHI H, KATAYAMA S, et al. Preparation and characterization of collagen from soft-shelled turtle (Pelodiscus sinensis) skin for biomaterial applications[J]. Journal of Biomaterials Science. Polymer Edition, 2009, 20(5-6):567-576.
[20] YUAN J F, MISHRA P, CHING C B. Engineering the leucine biosynthetic pathway for isoamyl alcohol overproduction in Saccharomyces cerevisiae[J]. Journal of Industrial Microbiology &Biotechnology, 2017, 44(1):107-117.
[21] LI Z R, WANG B, CHI C F, et al. Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel (Scomberomorous niphonius)[J]. Food Hydrocolloids, 2013, 31(1):103-113.
[22] YOUSEFI M, ARIFFIN F, HUDA N. An alternative source of type I collagen based on by-product with higher thermal stability[J]. Food Hydrocolloids, 2017, 63:372-382.