近年来,植物基食品已成为食品领域发展的热点之一,越来越多的研究表明,植物基食品可在结构或者味道上取代动物制品,并且具有营养健康、绿色环保、安全可靠等优点[1]。而凝胶素食产品作为植物基食品的主力军,近年来已被开发为素鸡肉、素毛肚、素虾仁、素牛肉[2-3]等产品。食品色泽是影响食品销售和感官的关键因素,而凝胶素食普遍存在着色难、保色难等问题。研制色泽良好、鲜艳稳定、色素保留率高的产品是现今凝胶素食研究的重点。
魔芋葡甘聚糖(konjac glucomannan,KGM)是一种天然高分子多糖,是制备凝胶素食最常用的基材之一,在适宜的碱性条件下加热会发生脱乙酰作用,分子链蜷曲,通过疏水相互作用互相交联形成空间网络结构[2,4],已有研究表明魔芋葡甘聚糖经脱乙酰后可以包埋姜黄素、植物精油等脂溶性小分子[5-6]。玉米黄质(zeaxanthin,ZEA)是凝胶素食领域常见的脂溶性色素之一,来源于玉米、橙辣椒、蛋黄、芒果等食物,作为一种天然的食品着色剂,因其优质的着色效果而广泛应用于胶基糖果、饮料等食品中,与其他人工合成的黄色色素制成的食品相比,更加绿色安全,且“黄色食品”更容易吸引消费者;其次,ZEA相比于其他类胡萝卜素,抗氧化性更强,故可以减少食品中营养物质的损失、维持食品风味、延长食品货架期[7];同时,在酸、碱、还原性以及其他离子存在的条件下也更加稳定[8]。目前,已有研究通过在魔芋凝胶体系中加入大豆分离蛋白构成三元体系来包裹脂溶性色素小分子[9],也有研究通过固体脂质颗粒、乳液和植物多糖来包裹ZEA提高其色素保留率以及稳定性[10-12],而使用魔芋葡甘聚糖单一体系来包裹ZEA色素小分子的报道尚不多见。
基于此,为解决魔芋凝胶的赋色问题,同时在赋色的基础上制备色素保留率更高,色泽更稳定,凝胶性能更加良好的KGM/ZEA复合有色凝胶,本研究拟通过对比未添加色素的KGM凝胶与赋色后KGM/ZEA复合有色凝胶的色素保留率、色差、持水性、质构性能、热稳定性以及结晶性差异,利用傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)、扫描电镜(scanning election microscopy, SEM)以及荧光显微镜等技术手段对未添加色素的KGM凝胶和赋色后KGM/ZEA复合有色凝胶的微观结构进行分析,探究KGM和ZEA稳定的结合方式,拓展ZEA在凝胶素食领域中的应用前景,以期为“黄色凝胶素食产品”的开发提供理论和技术指导。
1 材料与方法
1.1 材料与试剂
魔芋精粉(食品级,魔芋葡甘聚糖含量≥93%),济南品康生物技术有限公司;玉米黄质(食品级,纯度≥60%),西安凯康生物科技有限公司;玉米黄质标准品(纯度≥85%),上海麦克林生化有限公司;碳酸钠(分析纯),上海源叶生物科技有限公司;丙酮(色谱纯),重庆川东化工公司;乙腈(色谱纯),成都科隆化学品有限公司;甲醇(色谱纯),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
FA1004A电子分析天平,上海精天电子仪器有限公司;JJ-1型精密增力电动搅拌器,金坛市城东新瑞仪器厂;HZ-ZK8型数显恒温水浴锅,巩义市予华仪器有限责任公司;TGL-18MS高速冷冻离心机,上海卢湘仪仪器有限公司;TA.XT Plus质构仪,英国Stable Micro System公司;CM-5色差仪,柯尼卡美能达公司;SCIENTZ-10 ND型真空冷冻干燥机,宁波新芝生物科技股份有限公司;DSC25差示扫描量热仪,美国TA公司;Spectrum 100傅里叶红外光谱仪,美国Perkin Elmer公司;LC-20A高效液相色谱仪,日本岛津公司;Phenom Pro扫描电子显微镜,荷兰Phenom World公司;BX53荧光正置显微镜,日本OLYMPUS公司;XRD-7000射线衍射仪,日本SHIMADZU公司。
1.3 实验方法
1.3.1 KGM/ZEA复合有色凝胶的制备
将一定量的ZEA和Na2CO3混合并溶解加入水中,缓慢加入称量好的KGM,充分搅拌使KGM与ZEA混合均匀,充分溶胀反应4 h,平整表面,经热诱导形成凝胶后立即冷却到室温并存放于4 ℃过夜待测。未加ZEA的魔芋凝胶命名为对照组,添加ZEA的魔芋凝胶命名为KGM/ZEA-1,添加ZEA后经预实验制得凝胶性能最好的魔芋凝胶命名为KGM/ZEA-2,最佳制备条件:ZEA、Na2CO3、KGM质量分数分别为0.30%、0.22%、6.30%,90 ℃恒温水浴20 min。
1.3.2 KGM/ZEA复合有色凝胶色素保留率的测定
准确称取0.10 g试样于10 mL具塞试管中,加入10 mL丙酮,室温下超声处理至试样无色。溶液过0.22 μm滤膜,滤液取20 μL上机待测。色谱条件参考孟繁磊等[13]的方法并做部分修改:色谱柱:Zorbax SB-C18(4.6 mm×250 mm,5 μm);流动相为V(乙腈)∶V(甲醇)=90∶10;进样量20 μL;流速0.5 mL/min;紫外检测波长445 nm;柱温箱温度35 ℃。同此色谱条件进行标准曲线测定,绘制标准曲线如图1所示,标准曲线方程见公式(1),根据公式(2)计算复合有色凝胶的色素保留率:
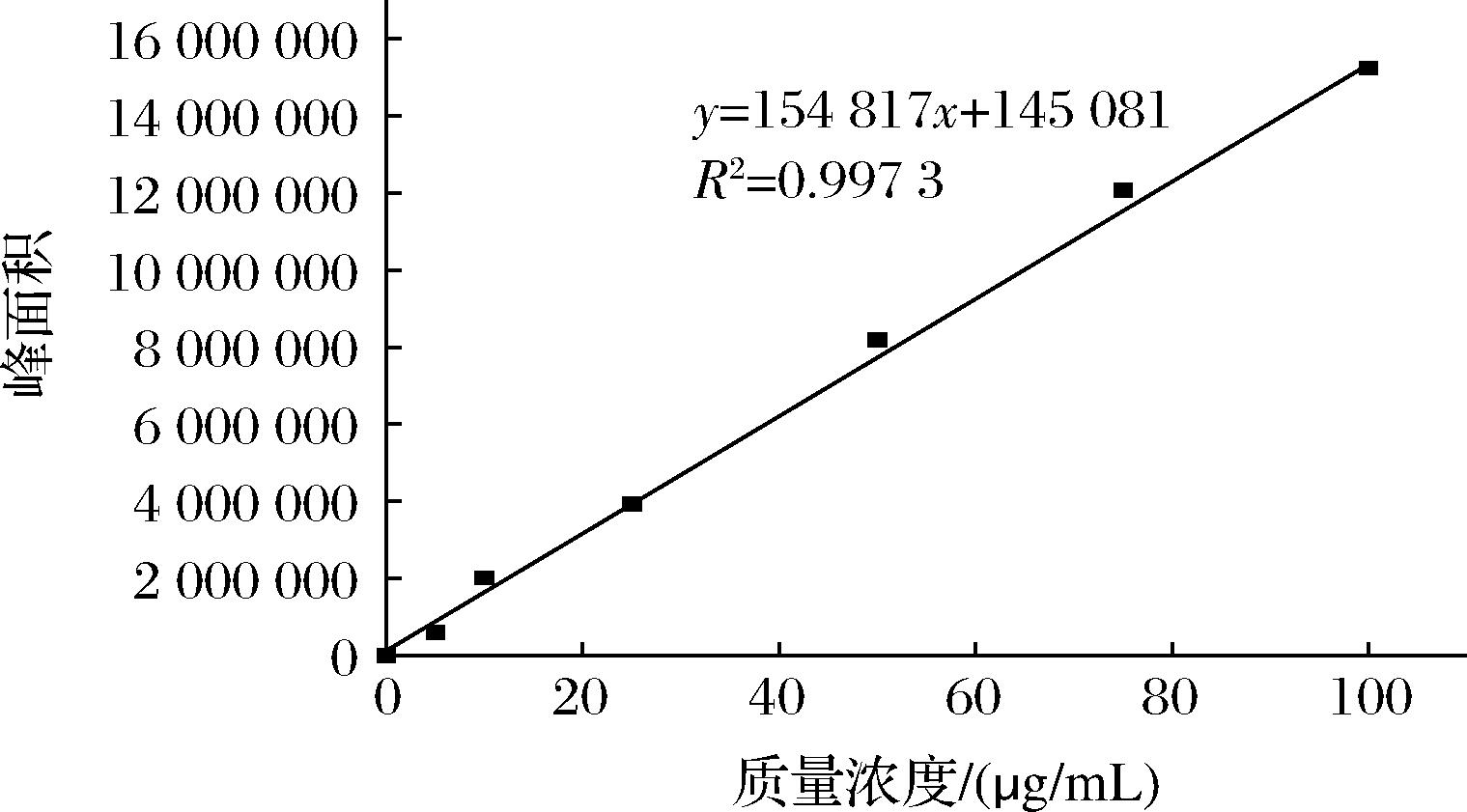
图1 ZEA标准曲线
Fig.1 Standard curve of zeaxanthin
y=154 817x+145 081(R2=0.997 3)
(1)
(2)
式中:Y1,KGM/ZEA复合有色凝胶的色素保留率,%;x1,标曲中复合有色凝胶的ZEA含量,%;x2,复合有色凝胶中加入的ZEA含量,%。
1.3.3 KGM/ZEA复合有色凝胶色泽的测定
将制备好的凝胶切成3 cm×3 cm×3 cm的小块,色度仪经校正后,测定复合有色凝胶的白度指数L*及彩色指数a*值、b*值。重复测定10次,取平均值[14]。
1.3.4 KGM/ZEA复合有色凝胶持水性的测定
将制备好的凝胶以10 000 r/min的速度离心15 min,除去凝胶表面水分,根据公式(3)计算复合有色凝胶的持水性[15]:
(3)
式中:Y2,复合有色凝胶的持水性,%;m1,离心后的凝胶质量,g;m2,离心前的凝胶质量,g。
1.3.5 KGM/ZEA复合有色凝胶质构特性的测定
参考朱坤等[9]的方法测定复合有色凝胶的质构特性。将制备好的凝胶均匀切片(直径3 cm,厚1 cm)。质构测试条件为压缩模式,探头:P/0.5,测前速率:2.0 mm/s,测试速率:1.0 mm/s,测后速率:5.0 mm/s,形变量:60%,触发力:0.05 N,数据采集速率:200 pps。每个试样重复测定6次。
1.3.6 KGM/ZEA复合有色凝胶FTIR的测定
将制备好的凝胶预冷冻24 h,放入真空冷冻干燥机冷冻干燥48 h,在玛瑙研钵中研碎为粉末,用傅里叶红外光谱仪以4 cm-1的速率在4 000~600 cm-1光谱范围内扫描测定[16]。
1.3.7 KGM/ZEA复合有色凝胶差示扫描量热分析(differential scanning calorimetry,DSC)的测定
取5 mg左右凝胶粉末样品,置于坩埚内压片密封。在流速为250 mL/min的氮气保护下,将坩埚放置于DSC分析仪中进行测定。测定条件为:起始温度为50 ℃;终止温度为240 ℃;升温速率为10 ℃/min[17]。
1.3.8 KGM/ZEA复合有色凝胶X射线衍射(X-ray diffraction,XRD)的测定
将凝胶粉末样品置于X射线衍射仪的样品台上进行测试(CuKa辐射)。测试参数:室温,X射线波长A=0.154 nm,采用Cu靶、石墨单色器,管压40 kV,电流30 mA,扫描范围4°~40°,扫描速度2 °/min[17]。
1.3.9 KGM/ZEA复合有色凝胶SEM的测定
将冻干后的凝胶样品切成边长为1 cm的正方形薄片,用固定胶粘于样品铜台,在真空度10-2~10-3Pa,溅射电压1.1~1.2 kV,镀膜时间2~3 min条件下镀金,放置10 min,送入电镜观察,选择有代表性的区域拍摄[18]。
1.3.10 KGM/ZEA复合有色凝胶的荧光显微镜观察
取凝胶样品采用尼罗红染料(1 mg/mL乙醇)进行染色,在4 ℃下保存过夜,然后将凝胶样品置于荧光显微镜下进行观察,其激发波长为543 nm[19]。
1.4 数据统计与分析
采用Excel处理数据,每组试验最少重复3次,结果以“平均值±标准差”来表示,采用SPSS 26.0 软件对试验数据进行统计分析,不同小写字母表示样品间存在显著性(P<0.05),采用Origin 2021软件作图。
2 结果与分析
2.1 KGM凝胶和KGM/ZEA复合有色凝胶的色素保留率以及色泽分析
KGM凝胶和赋色后的KGM/ZEA复合有色凝胶的色泽如图2所示。L*值指明暗程度,L*越大表示白度越大;a*值指红绿程度,a*越大表示偏向红色,a*越小表示偏向绿色;b*值指黄蓝程度,b*越大表示偏向黄色,b*越小表示偏向蓝色[20]。与对照组相比,KGM/ZEA-2复合有色凝胶的L*、a*、b*值分别提高了9.78%、4.34%和5.63%,说明ZEA赋予KGM凝胶良好的色泽,颜色呈橙黄色。同时相比于KGM/ZEA-1,KGM/ZEA-2复合有色凝胶的L*、a*、b*值分别提高了2.55%、1.09%、2.14%,而KGM/ZEA-1与KGM/ZEA-2复合有色凝胶的色素保留率分别为57.49%和73.82%,即L*、a*、b*值的上升与色素保留率升高一致,表明在最佳制备的条件下,KGM/ZEA复合有色凝胶中截留了更多的色素小分子,色素保留率更高,颜色更加偏向橙黄,色泽更加鲜艳明亮,提高了消费者的食欲和购买欲望。
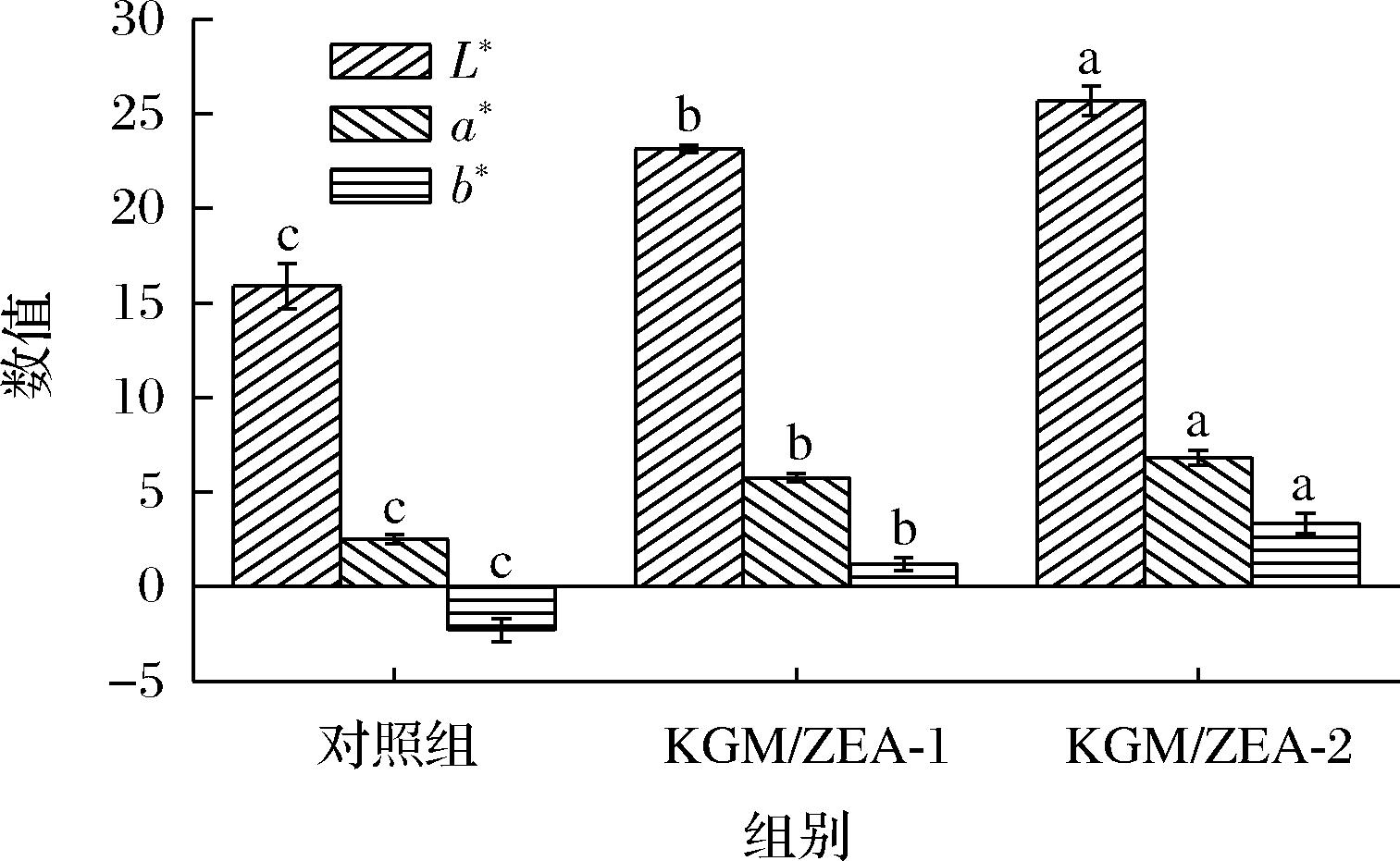
图2 KGM凝胶和KGM/ZEA复合有色凝胶的色泽
Fig.2 Color of KGM gel and KGM/ZEA composite coloring gel
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 KGM凝胶和KGM/ZEA复合有色凝胶的持水性分析
KGM凝胶和赋色后的KGM/ZEA复合有色凝胶的持水性如图3所示。对照组和赋色后复合有色凝胶的持水性都达到了95%以上,其中KGM/ZEA-2复合有色凝胶的持水性最高,可达97.82%,均表现出良好的持水性,是因为KGM本身就具有良好的吸水性,可通过氢键与水分子结合,且魔芋凝胶自身形成的网络结构能够锁住水分子防止其流失[21]。
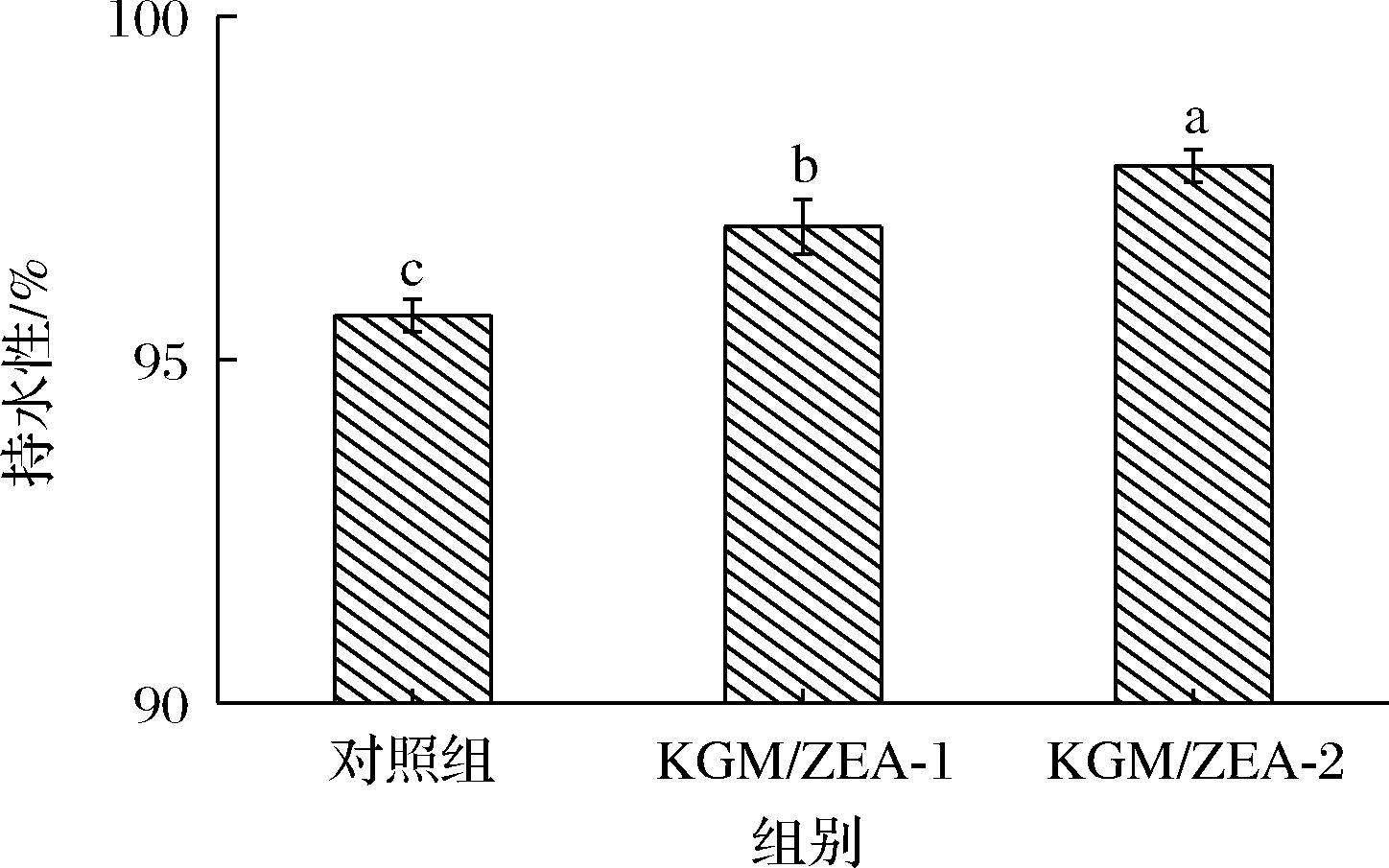
图3 KGM凝胶和KGM/ZEA复合有色凝胶的持水性
Fig.3 Water holding capacity of KGM gel and KGM/ZEA composite coloring gel
KGM/ZEA-2复合有色凝胶与对照组和KGM/ZEA-1相比,持水性呈上升的趋势,分别上升了2.18%和0.88%,此结果与周绪霞等[22]的研究结果基本一致。复合有色凝胶的持水性升高与氢键的形成有关,已有研究表明水分子之间会形成氢键以促进“水化层”的形成,水化层是指体系中不易流动的水会沿一定方向包裹聚合物并附着在聚合物外部的一种现象[23]。随着脂溶性色素小分子的加入,水分子与脂溶性物质也会产生部分氢键以促进这种结构的形成,阻止了凝胶中水分子的迁移和损失[22]。在最佳制备条件下,体系中截留了更多的色素小分子,使更多的水分子禁锢在凝胶体系中,持水性增加。
2.3 KGM凝胶和KGM/ZEA复合有色凝胶的质构分析
KGM凝胶和赋色后的KGM/ZEA复合有色凝胶的质构性能如表1所示。对照组和赋色后复合有色凝胶的凝胶强度、硬度、咀嚼性差异显著(P<0.05)。KGM/ZEA-2复合有色凝胶相比于对照组和KGM/ZEA-1,凝胶强度、硬度、咀嚼性分别提高了91.01%、54.09%、50.70%和75.40%、45.48%、42.23%,均显著高于对照组和KGM/ZEA-1(P<0.05),该结果与朱坤等[9]的研究结果相类似。添加ZEA后,可能是因为ZEA在KGM网络结构中充当填充剂,限制了凝胶网络结构中KGM分子链的移动,有利于KGM致密的网络结构保持,增强了其质构性能[22,24-25]。在最佳制备条件下,复合有色凝胶中截留了更多的色素小分子,其在KGM的孔隙中的填充以及分布更加均匀。当体系内色素小分子增加时,有更多的KGM分子参与该凝胶结构的形成,二者产生一定的协同作用,暴露出更多的疏水基团[22],KGM分子链之间的相互作用增强,使得KGM的网络结构也更加致密紧实,质构性能进一步得到改善,具有更好的凝胶强度、硬度和咀嚼性[26]。但也有研究指出脂溶性小分子添加量达到一定值时,凝胶体系中的脂溶性小分子不能被完全包裹而流出,造成凝胶体系的凝胶强度不再增加[22],故控制ZEA的使用量可保证该复合有色凝胶的性能。
表1 KGM凝胶和KGM/ZEA复合有色凝胶的质构性能
Table 1 Texture properties of KGM gel and KGM/ZEA composite coloring gel
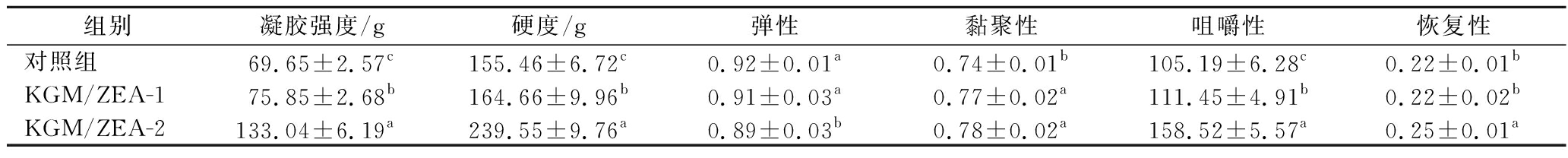
组别凝胶强度/g硬度/g弹性黏聚性咀嚼性恢复性对照组69.65±2.57c155.46±6.72c0.92±0.01a0.74±0.01b105.19±6.28c0.22±0.01bKGM/ZEA-175.85±2.68b164.66±9.96b0.91±0.03a0.77±0.02a111.45±4.91b0.22±0.02bKGM/ZEA-2133.04±6.19a239.55±9.76a0.89±0.03b0.78±0.02a158.52±5.57a0.25±0.01a
注:不同小写字母表示差异显著(P<0.05)。
2.4 KGM凝胶和KGM/ZEA复合有色凝胶的FTIR分析
KGM凝胶和赋色后的KGM/ZEA复合有色凝胶的红外光谱如图4所示,样品吸收峰大致相似。与对照组相比,添加ZEA的复合有色凝胶在2 920 cm-1和1 749 cm-1出现新的吸收峰,分别对应ZEA中亚甲基的伸缩振动和C![]() O双键的伸缩振动[10-11];—OH的伸缩振动峰出现于3 200~3 650 cm-1,对照组和赋色后复合有色凝胶中—OH的特征峰均出现在3 327 cm-1;在1 650~1 900 cm-1表明分子间存在C
O双键的伸缩振动[10-11];—OH的伸缩振动峰出现于3 200~3 650 cm-1,对照组和赋色后复合有色凝胶中—OH的特征峰均出现在3 327 cm-1;在1 650~1 900 cm-1表明分子间存在C![]() O双键的伸缩振动,在1 710 cm-1附近属于乙酰基上C
O双键的伸缩振动,在1 710 cm-1附近属于乙酰基上C![]() O的伸缩振动峰;1 640 cm-1附近是氢键的吸收峰[9],对照组和赋色后的复合有色凝胶在1 643 cm-1出现吸收峰,证明复合有色凝胶中分子内存在氢键作用;在1 000~1 250 cm-1范围内代表C—O单键的伸缩振动;在869 cm-1和802 cm-1附近处是KGM中魔芋葡甘露聚糖的吸收峰[27]。
O的伸缩振动峰;1 640 cm-1附近是氢键的吸收峰[9],对照组和赋色后的复合有色凝胶在1 643 cm-1出现吸收峰,证明复合有色凝胶中分子内存在氢键作用;在1 000~1 250 cm-1范围内代表C—O单键的伸缩振动;在869 cm-1和802 cm-1附近处是KGM中魔芋葡甘露聚糖的吸收峰[27]。
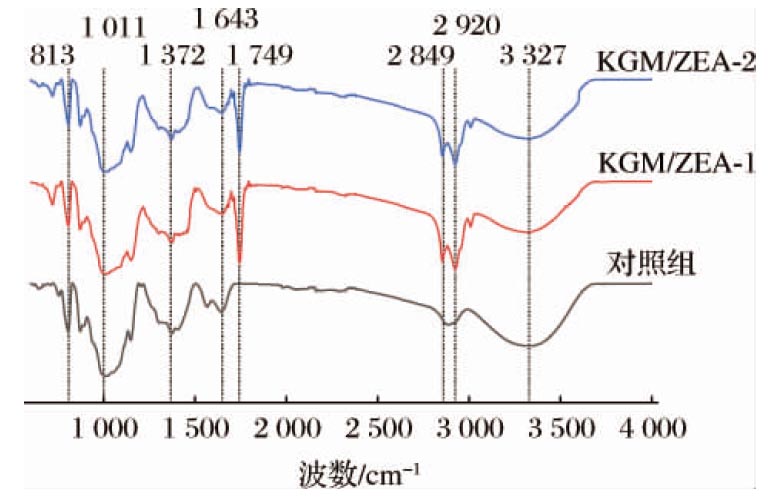
图4 KGM凝胶和KGM/ZEA复合有色凝胶的FTIR图
Fig.4 FTIR spectra of KGM gel and KGM/ZEA composite coloring gel
对比KGM凝胶和赋色后的KGM/ZEA复合有色凝胶这一系列特征峰的伸缩振动,并未发现新的功能基团,表明ZEA与KGM仅仅是物理结合,并未与其他基团发生化学反应。但是,在添加ZEA后,相比于KGM/ZEA-1,KGM/ZEA-2复合有色凝胶乙酰基上C![]() O的伸缩振动峰透射率增加了7.77%,氢键的伸缩振动峰减少了1.04%,说明KGM/ZEA-2的凝胶体系中乙酰基数量减少,氢键数量增加[28],氢键数量增加与持水性的分析相一致。目前已有研究表明凝胶体系中KGM分子链之间的距离由于脱除乙酰基而变短,各分子链积累,有利于疏水相互作用形成牢固的网络结构,随着脱乙酰程度的增加,疏水相互作用增强,是脱乙酰KGM凝胶化的主要驱动力[29-30]。由此推测KGM/ZEA-2的复合有色凝胶乙酰基数量减少,即脱乙酰的KGM分子链数量增加,在疏水相互作用的驱动下包埋了更多的ZEA小分子,提高凝胶的质构性能,与色泽以及质构的研究结果相一致。
O的伸缩振动峰透射率增加了7.77%,氢键的伸缩振动峰减少了1.04%,说明KGM/ZEA-2的凝胶体系中乙酰基数量减少,氢键数量增加[28],氢键数量增加与持水性的分析相一致。目前已有研究表明凝胶体系中KGM分子链之间的距离由于脱除乙酰基而变短,各分子链积累,有利于疏水相互作用形成牢固的网络结构,随着脱乙酰程度的增加,疏水相互作用增强,是脱乙酰KGM凝胶化的主要驱动力[29-30]。由此推测KGM/ZEA-2的复合有色凝胶乙酰基数量减少,即脱乙酰的KGM分子链数量增加,在疏水相互作用的驱动下包埋了更多的ZEA小分子,提高凝胶的质构性能,与色泽以及质构的研究结果相一致。
2.5 KGM/ZEA复合有色凝胶的DSC分析
KGM凝胶和赋色后的KGM/ZEA复合有色凝胶的DSC谱图如图5所示。对照组和赋色后复合有色凝胶的DSC曲线相似,在180 ℃附近出现了明显的吸热峰,3组样品熔融吸收峰的峰值温度分别出现在177.50、184.07、186.59 ℃,呈上升的趋势,3组样品的热焓值(ΔH)也呈现相同的趋势,分别为97.82、137.24、143.46 J/g,表明凝胶体系在熔融过程中能量发生变化。熔融吸收峰的峰值温度和热焓值的持续上升说明该凝胶体系在添加ZEA后热稳定性增强,且在最佳制备条件下热稳定性进一步增强。产生该现象的原因可能是,ZEA的添加增强了凝胶体系中KGM分子链间形成的作用力,KGM分子链之间聚拢,互相缠结;在最佳制备条件下,由于凝胶体系内疏水相互作用的增强,赋予了KGM更加紧实的网络结构,使得熔融过程需要更多的能量,从而提高了KGM/ZEA复合有色凝胶的热稳定性[31],与FTIR分析结果相对应。
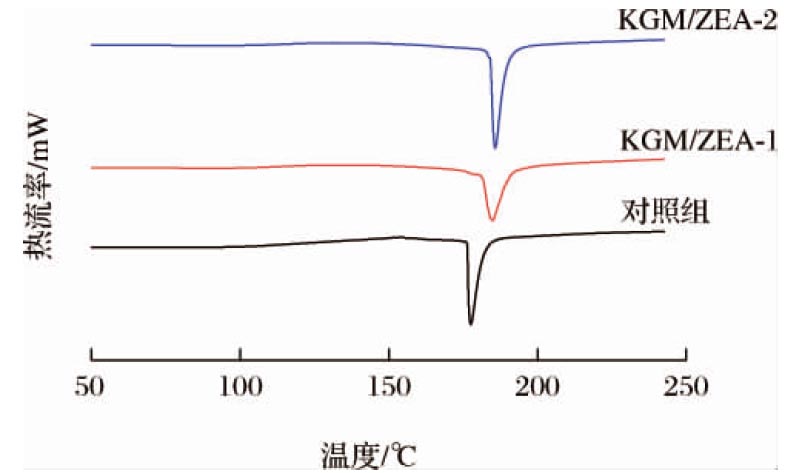
图5 KGM凝胶和KGM/ZEA复合有色凝胶的DSC图
Fig.5 DSC spectra of KGM gel and KGM/ZEA composite coloring gel
2.6 KGM凝胶和KGM/ZEA复合有色凝胶的XRD分析
KGM凝胶和赋色后的KGM/ZEA复合有色凝胶的XRD谱图如图6所示。通过XRD分析,对照组与赋色后复合有色凝胶未出现明显的结晶峰,均在20°左右出现一个较大的无定形态的非结晶峰,且加入ZEA后未有新的结晶峰出现,说明ZEA的加入并未改变该复合有色凝胶的非结晶结构,无明显的结构差异。对照组、KGM/ZEA-1和KGM/ZEA-2复合有色凝胶的结晶度分别为20.62%、24.92%和33.27%,相比于对照组和KGM/ZEA-1,KGM/ZEA-2复合有色凝胶的结晶度显著上升了12.65%和8.35%(P<0.05)。对照组结晶程度较低可能是因为KGM分子之间形成的空间网状结构排列混乱,导致形成的网状结构缺乏规整性[32]。加入ZEA后该复合有色凝胶结晶度的升高说明KGM与ZEA具有良好的相容性,产生了一定的协同作用,利于网络结构的形成[17]。而KGM/ZEA-2较于KGM/ZEA-1结晶度有所提高,是因为在适宜配比下,该凝胶体系中的KGM分子之间发生蔟集,相互作用改变,作用力增强,网络结构进一步得到改善,该结论与此前质构以及持水性的结论相一致。
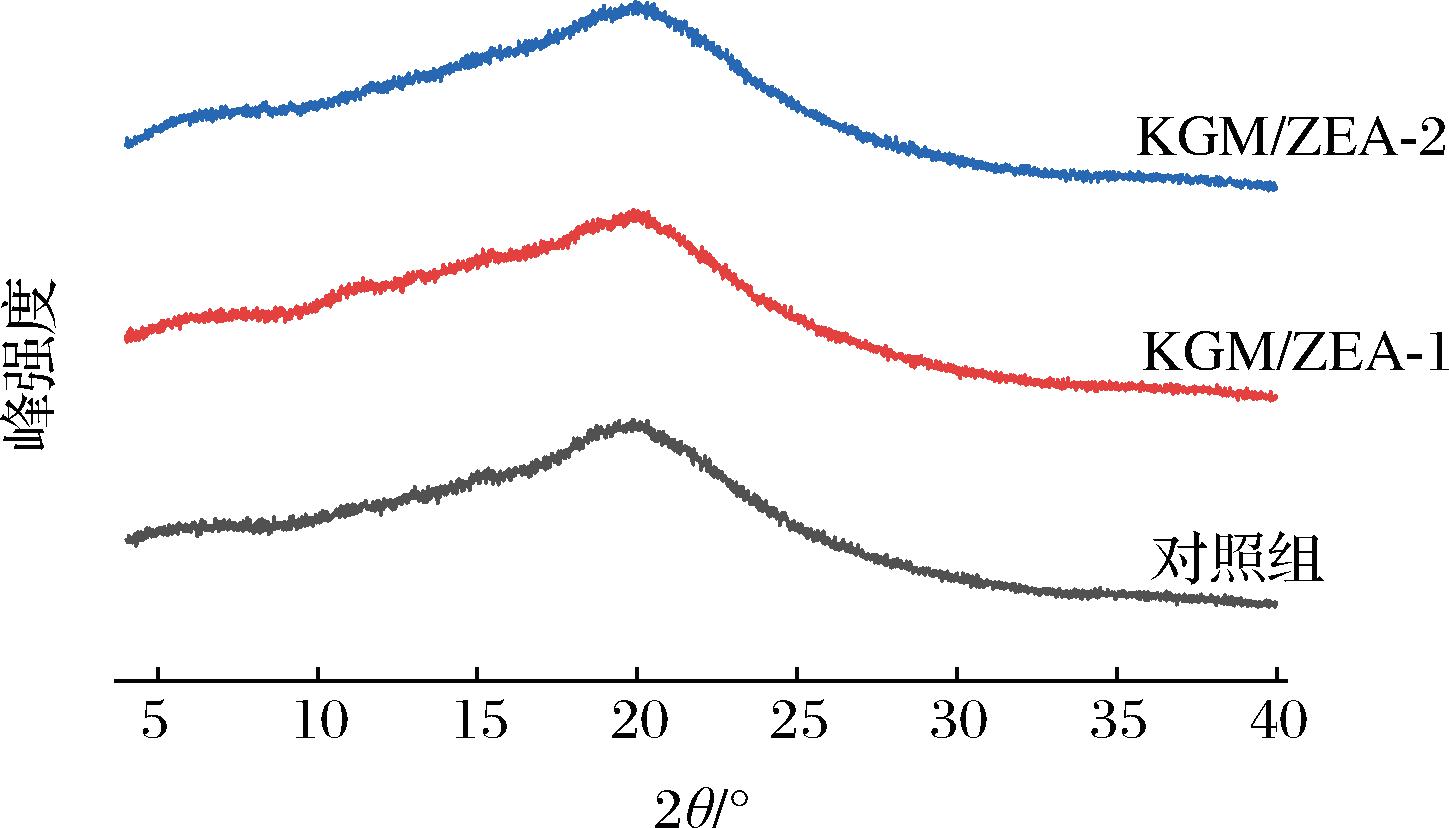
图6 KGM凝胶和KGM/ZEA复合有色凝胶的XRD图
Fig.6 XRD spectra of KGM gel and KGM/ZEA composite coloring gel
2.7 KGM凝胶和KGM/ZEA复合有色凝胶的SEM分析
KGM凝胶和赋色后的KGM/ZEA复合有色凝胶的扫描电镜照片如图7所示。可以明显观察到对照组与赋色后复合有色凝胶的微观结构差异较大。如对照组如图7-a所示,其孔径较大,结构松散,分布不均匀,结构断裂现象严重;添加ZEA后,KGM/ZEA-1复合有色凝胶如图7-b所示,相比于对照组,可以观察到其孔径略微变小,但是分布仍然不均匀,不连续,存在断裂现象;而KGM/ZEA-2复合有色凝胶如图7-c所示,其孔径明显变小,分布更加均匀,结构连续且更加致密,呈堆叠状,呈现出一个多孔的网络结构,该结论类似于刘子奇等[31]的研究结果。造成该现象的原因是复合有色凝胶的网络结构是以KGM为主形成的网络结构,在添加ZEA并在最佳制备条件下,KGM内部分子链相互纠缠,相互作用增强,稳定性进一步提高,使其内部形成的网络结构更加致密[9,22]。因此KGM/ZEA-2复合有色凝胶具有更高的色素保留率,更好的质构性能,与此前的分析结果一致。

a-对照组;b-KGM/ZEA-1;c- KGM/ZEA-2
图7 KGM凝胶和KGM/ZEA复合有色凝胶的扫描电镜图片(×200)
Fig.7 SEM photographs of KGM gel and KGM/ZEA composite coloring gel (×200)
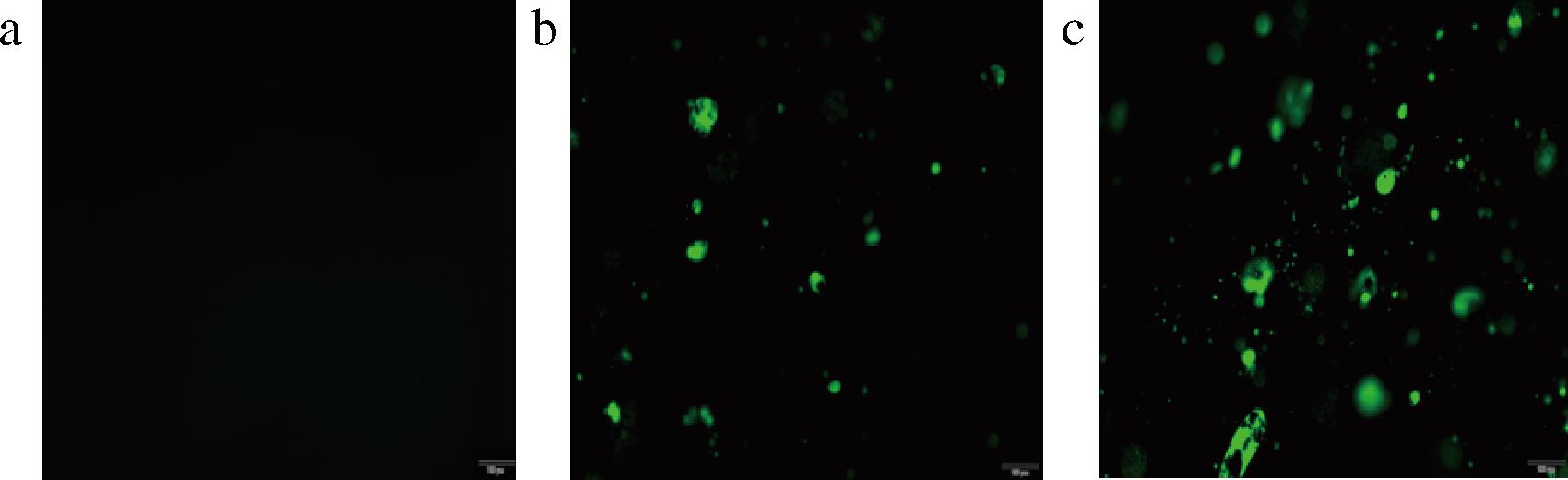
2.8 KGM凝胶和KGM/ZEA复合有色凝胶的荧光显微镜分析
KGM凝胶和赋色后的KGM/ZEA复合有色凝胶的荧光显微镜照片如图8所示。经荧光染色后,可对ZEA进行标记,在荧光显微镜下可观察到脂溶性色素-ZEA在复合有色凝胶中的分布状态[33]。通过对比图8-a~图8-c,可以明显观察到ZEA在对照组及赋色后复合有色凝胶中的分布差异。对照组无荧光,KGM/ZEA-2复合有色凝胶中的荧光分布更多,分布更均匀,即KGM/ZEA-2复合有色凝胶中截留了更多的色素小分子,该研究结果与此前KGM/ZEA-2复合有色凝胶色素保留率升高一致。即在最佳制备条件下凝胶内KGM分子链互相缠结,凝胶网络孔隙之间的距离变小,孔隙分布均匀且连续,形成了更加致密的网络结构,有利于ZEA小分子的捕获和均匀分布[9],该荧光显微镜图片与此前复合有色凝胶的SEM图片密切相关。
a-对照组;b-KGM/ZEA-1;c-KGM/ZEA-2
图8 KGM凝胶和KGM/ZEA复合有色凝胶的荧光显微镜图片(×10)
Fig.8 Fluorescence microscope photographs of KGM gel and KGM/ZEA composite coloring gel (×10)
3 结论
玉米黄质可以赋予魔芋凝胶良好的色泽,且KGM/ZEA-2复合有色凝胶色素保留率得到了提高,色泽更加鲜艳,持水性、质构性能与热稳定性得到了进一步的提高,KGM/ZEA-2复合有色凝胶可以形成一个分布均匀、结构连续致密的多孔网络结构。玉米黄质可以作为一种天然色素应用于以KGM为主的植物基新型食品,改善魔芋凝胶素食难以赋色的现状,用于食品行业中“彩色凝胶素食产品”的生产,拓展多彩凝胶素食领域的发展。后续可通过分子模拟、分子对接等技术手段模拟观察KGM的网络结构变化、KGM与ZEA的具体结合位点,进一步探究魔芋多糖体系与色素小分子的互作机制。
[1] YULIARTI O, KIAT KOVIS T J, YI N J.Structuring the meat analogue by using plant-based derived composites[J].Journal of Food Engineering, 2021, 288:110138.
[2] SOLO-DE-ZALD VAR B, TOVAR C A, BORDER
VAR B, TOVAR C A, BORDER AS A J, et al.Effect of deacetylation on the glucomannan gelation process for making restructured seafood products[J].Food Hydrocolloids, 2014, 35:59-68.
AS A J, et al.Effect of deacetylation on the glucomannan gelation process for making restructured seafood products[J].Food Hydrocolloids, 2014, 35:59-68.
[3] SOLO-DE-ZALD VAR B, TOVAR C A, BORDER
VAR B, TOVAR C A, BORDER AS A J, et al.Pasteurization and chilled storage of restructured fish muscle products based on glucomannan gelation[J].Food Hydrocolloids, 2015, 43:418-426.
AS A J, et al.Pasteurization and chilled storage of restructured fish muscle products based on glucomannan gelation[J].Food Hydrocolloids, 2015, 43:418-426.
[4] WANG L X, DAO L P, GUO Q Y, et al.Investigation on the influence of AC electric filed and KCl on the structure and gel properties of Konjac glucomannan[J].Food Chemistry, 2022, 386:132755.
[5] YANG J, XIAO J X, DING L Z.An investigation into the application of konjac glucomannan as a flavor encapsulant[J].European Food Research and Technology, 2009, 229(3):467-474.
[6] WANG J, LIU C H, SHUAI Y, et al.Controlled release of anticancer drug using graphene oxide as a drug-binding effector in konjac glucomannan/sodium alginate hydrogels[J].Colloids and Surfaces B:Biointerfaces, 2014, 113:223-229.
[7] 向智男, 宁正祥.功能性色素:玉米黄质的特性、提取及其研究应用[J].食品与机械, 2005,21(1):74-77.
XIANG Z N, NING Z X.Properties, extraction and application of functional pigment-zeaxanthin[J].Food and Machinery, 2005,21(1):74-77.
[8] 刘辉. 玉米黄色素的提取及应用研究进展[J].现代食品, 2016(9):41-42.
LIU H.Research progress on extraction and application of corn yellow pigment[J].Modern Food, 2016(9):41-42.
[9] 朱坤, 刘缘勤, 范盛玉, 等.魔芋葡甘聚糖-大豆分离蛋白-辣椒红色素复合有色凝胶的制备及其性能研究[J].食品与发酵工业, 2021,47(15):213-219.
ZHU K, LIU Y Q, FAN S Y, et al.Preparation and characteristics of konjac glucomannan-soybean protein isolate-capsanthin coloring composite gel[J].Food and Fermentation Industries, 2021, 47(15):213-219.
[10] OSANLOU R, EMTYAZJOO M, BANAEI A, et al.Preparation of solid lipid nanoparticles and nanostructured lipid carriers containing zeaxanthin and evaluation of physicochemical properties[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2022, 641:128588.
[11] DE CAMPO C, DICK M, PEREIRA DOS SANTOS P, et al.Zeaxanthin nanoencapsulation with Opuntia monacantha mucilage as structuring material:Characterization and stability evaluation under different temperatures[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2018, 558:410-421.
[12] LIU Y, ZHANG C Y, CUI B Z, et al.Effect of emulsifier composition on oil-in-water nano-emulsions:Fabrication, structural characterization and delivery of zeaxanthin dipalmitate from Lycium barbarum L.[J].LWT, 2022, 161:113353.
[13] 孟繁磊, 宋志峰, 谭莉, 等.UPLC法测定黄玉米中玉米黄质[J].中国食品添加剂, 2018(11):188-192.
MENG F L, SONG Z F, TAN L, et al.Determination of zeaxanthin in yellow corn by UPLC [J].China Food Additives, 2018(11):188-192.
[14] 杨悦, 任元元, 邓利玲,等.基于碱性电解水形成的魔芋热不可逆凝胶性质研究[J].食品与发酵工业, 2022, 48(18):149-154.
YANG Y, REN Y Y, DENG L L, et al.Study on properties of thermal irreversible konjac gel formed by alkaline electrolyzed water[J].Food and Fermentation Industries, 2022, 48(18):149-154.
[15] HERRANZ B, TOVAR C A, SOLO-DE-ZALD VAR B, et al.Influence of alkali and temperature on glucomannan gels at high concentration[J].LWT-Food Science and Technology, 2013, 51(2):500-506.
VAR B, et al.Influence of alkali and temperature on glucomannan gels at high concentration[J].LWT-Food Science and Technology, 2013, 51(2):500-506.
[16] WU C H, PENG S H, WEN C R, et al.Structural characterization and properties of konjac glucomannan/curdlan blend films[J].Carbohydrate Polymers, 2012, 89(2):497-503.
[17] WANG L, XIAO M, DAI S H, et al.Interactions between carboxymethyl konjac glucomannan and soy protein isolate in blended films[J].Carbohydrate Polymers, 2014, 101:136-145.
[18] LIU X B, GAN J, NIRASAWA S, et al.Effects of sodium carbonate and potassium carbonate on colloidal properties and molecular characteristics of konjac glucomannan hydrogels[J].International Journal of Biological Macromolecules, 2018, 117:863-869.
[19] ZHANG Z P, ZHANG R J, MCCLEMENTS D J.Encapsulation of β-carotene in alginate-based hydrogel beads:Impact on physicochemical stability and bioaccessibility[J].Food Hydrocolloids, 2016, 61:1-10.
[20] ZHANG T, XUE Y, LI Z J, et al.Effects of deacetylation of konjac glucomannan on Alaska Pollock surimi gels subjected to high-temperature (120 ℃) treatment[J].Food Hydrocolloids, 2015, 43:125-131.
[21] GUO L P, YOKOYAMA W, CHEN L, et al.Characterization and physicochemical properties analysis of konjac glucomannan:Implications for structure-properties relationships[J].Food Hydrocolloids, 2021, 120:106818.
[22] 周绪霞, 姜珊, 顾赛麒, 等.油茶籽油对鱼糜凝胶特性及凝胶结构的影响[J].食品科学, 2017, 38(9):27-33.
ZHOU X X, JIANG S, GU S Q, et al.Effect of Camellia tea oil on properties and structure of surimi gels[J].Food Science, 2017, 38(9):27-33.
[23] LUE S J, SHIEH S J.Modeling water states in polyvinyl alcohol-fumed silica nano-composites[J].Polymer, 2009, 50(2):654-661.
[24] ZHAO X Y, WANG X F, ZENG L J, et al.Effects of oil-modified crosslinked/acetylated starches on silver carp surimi gel:Texture properties, water mobility, microstructure, and related mechanisms[J].Food Research International, 2022, 158:111521.
[25] ZHOU X X, CHEN H, LYU F, et al.Physicochemical properties and microstructure of fish myofibrillar protein-lipid composite gels:Effects of fat type and concentration[J].Food Hydrocolloids, 2019, 90:433-442.
[26] 韩柯颖, 冯潇, 杨玉玲, 等.添加山茶油对肌原纤维蛋白凝胶特性的影响[J].中国农业科学, 2021, 54(20):4446-4455.
HAN K Y, FENG X, YANG Y L, et al.Effects of camellia oil on the properties of myofibrillar protein gel[J].Scientia Agricultura Sinica, 2021, 54(20):4446-4455.
[27] CHEN Z J, WANG S S, SHANG L C, et al.An efficient and simple approach for the controlled preparation of partially degraded konjac glucomannan[J].Food Hydrocolloids, 2020, 108:106017.
[28] 范盛玉, 严竟, 朱坤,等.辣椒红色素对魔芋葡甘聚糖-大豆分离蛋白复合凝胶性质的影响[J].食品与发酵工业, 2023, 49(8):216-222.
FAN S Y, YAN J, ZHU K, et al.Effects of capsanthin on the properties of KGM-SPI composite gel[J].Food and Fermentation Industries, 2023, 49(8):216-222.
[29] RAN X, YANG H.Promoted strain-hardening and crystallinity of a soy protein-konjac glucomannan complex gel by konjac glucomannan[J].Food Hydrocolloids, 2022, 133:107959.
[30] XIN C, CHEN J, LIANG H S, et al.Confirmation and measurement of hydrophobic interaction in sol-gel system of konjac glucomannan with different degree of deacetylation[J].Carbohydrate Polymers, 2017, 174:337-342.
[31] 刘子奇, 王林, 王维海, 等.a-纤维素/魔芋葡甘聚糖复合水凝胶的制备及其性能[J].精细化工, 2018, 35(7):1131-1135;1143.
LIU Z Q, WANG L, WANG W H, et al.Preparation and properties of a-cellulose/konjac glucomannan composite hydrogels[J].Fine Chemical, 2018, 35(7):1131-1135;1143.
[32] ZHANG F S, FANG M O, FANG Q, et al.Effect of high hydrostatic pressure processing on the structure and property of konjac glucomannan-casein mixture[J].Chinese Journal of Structural Chemistry, 2018, 37(1):55-64.
[33] WEI Y, YU Z P, LIN K S, et al.Fabrication and characterization of resveratrol loaded zein-propylene glycol alginate-rhamnolipid composite nanoparticles:Physicochemical stability, formation mechanism and in vitro digestion[J].Food Hydrocolloids, 2019, 95:336-348.