作为酱香型白酒酿造过程中所必须的糖化发酵剂和生香剂,高温大曲不仅为发酵体系提供了丰富的酶系和菌系,亦赋予了酒体丰富的风味物质及其他前体成分[1]。高温大曲中风味代谢物的形成需要经过复杂的发酵过程,主要依赖于内源酶和微生物之间的相互作用,其中微生物群落的组成和丰度显著影响了大曲中风味代谢物的形成[2]。SHI等[3]通过探究黑、白和黄3种高温大曲的微生物群落和挥发性代谢产物发现,Thermomyces(嗜热真菌属)是所有大曲中共有的优势真菌属,且Thermoascus(嗜热子囊菌属)和Aspergillus(曲霉属)与大曲中绝大多数含量丰富的挥发性代谢物呈正相关。沈世明等[4]通过对高温大曲微生物群落结构以及曲香风味物质进行分析发现,Byssochlamys(丝衣霉菌属)和Pichia(毕赤酵母属)随着贮存时间的延长逐渐变为大曲中的优势真菌属,且Pichia等酵母属与酯类物质存在正相关。由此表明,以霉菌和酵母菌为主的真菌群落结构对大曲风味品质的形成具有不可忽视的作用[5],因此探究高温大曲中真菌微生物群落及其与风味代谢物之间的相关性是很有必要的。
随着现代分子生物学技术的发展,基于免培养的高通量测序技术(high-throughput sequencing,HTS)在食品领域的应用逐渐深入,研究人员可以借助该技术对高温大曲中大部分微生物群落结构进行解析[6]。JIANG等[7]通过揭示高温大曲生产过程中微生物群落结构和演替规律发现,异常威克汉姆酵母属(Wickerhamomyces)为大曲生产初期的优势真菌属,随着大曲发酵温度升高,Wickerhamomyces逐渐消失,扣囊覆膜酵母属(Saccharomycopsis)和Thermoascus的丰度逐渐升高,大曲发酵结束期间,Thermomyces和Thermoascus成为大曲中的优势真菌属。ZUO等[8]对2种制曲方式下高温大曲的细菌组成进行研究发现,机制大曲的细菌多样性和Bacillus相对丰度均高于手工大曲。电子鼻技术具有操作简单、客观可靠且重现性良好的优势,可以有效反映样品中特征挥发性物质及其风味品质。CAI等[9]对不同类型低温大曲风味品质进行分析发现,红心大曲中芳香类物质丰度较高,清茬大曲和后火大曲的风味较为相似。张春林[10]通过对泸州老窖大曲进行分析表明,电子鼻分析可以有效区分高温优级大曲与中温优级大曲、中温普级大曲和高温普级大曲之间的气味差异。综上表明,高温大曲中微生物群落结构受到发酵温度、生产周期和制曲方式等多种因素的影响,因此,利用HTS和电子鼻联用技术对高温大曲中真菌类群与其风味品质的关联性进行分析是可行的。
山东省临沂市兰陵县地处我国白酒黄淮流域超级产区,四季分明且雨热同期,属于温带季风气候,适合于大多数微生物的生长繁殖。本研究首先利用MiSeq高通量测序技术对兰陵高温大曲中真菌多样性进行解析,再结合电子鼻对其风味品质进行评价,并进一步探究真菌属与风味品质之间的关联性,以期为高温大曲风味品质及真菌类群的解析提供数据支撑。
1 材料与方法
1.1 材料与试剂
高温大曲样品,采集自山东省临沂市兰陵县某酒厂制曲车间;马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA),青岛海博生物技术有限公司;QIAGEN DNeasymericon Food Kit试剂盒,德国QIAGEN公司;引物ITS3F/ITS4R,武汉天一辉远生物科技有限公司;5×TransStartTM FastPfu Buffer、dNTPs、FastPfu Fly DNA Polymerase、牛血清白蛋白(bovine serum albumin,BSA)、2×PCR Buffer、rTaq酶、PMD 18-T载体,北京全式金生物技术有限公司;Axygen PCR清洁试剂盒,成都康迪生物技术有限公司。
1.2 仪器与设备
AF-08A新型密封式粉碎机,北京中科浩宇科技发展有限公司;霉菌培养箱,上海一恒科学仪器有限公司;UVPCDS8000凝胶成像分析系统,美国ProteinSimple公司;NanoDrop ND-2000C微量紫外-可见光分光光度计,美国Nano Drop公司;DYCP-31DN琼脂糖水平电泳仪,北京六一生物科技有限公司;vetiri96 ProFlex梯度基因扩增仪,美国Applied Biosystems公司;PE300型高通量测序平台,美国Illumina公司;R920型机架式服务器,美国DELL公司;PEN3电子鼻,德国AIRSENSE公司。
1.3 试验方法
1.3.1 样品采集与预处理
本研究使用的高温大曲由山东省临沂市兰陵县某白酒酿造厂提供(117°41″~118°18″E,34°37′~35°06″N),共随机采集了15份同一批次黄色高温大曲样品,依次编号为LL1~LL15。
1.3.2 高温大曲中霉菌和酵母菌落计数
参照GB 4789.15—2016《食品安全国家标准 食品微生物学检验 霉菌和酵母计数》对高温大曲中霉菌和酵母进行活菌计数,即:称取25 g大曲样品,加入到225 mL无菌生理盐水中进行倍比稀释,准确吸取1 mL适宜稀释度的样品匀液于无菌培养皿中,采用倾注法注入适量的PDA固体培养基,并在28 ℃培养箱中正置培养5 d,每个梯度设置3个平行。
1.3.3 基于高通量测序技术解析大曲真菌多样性
DNA提取:根据制造商的使用指南,利用QIAGEN DNeasymericon Food Kit试剂盒从2 g大曲样品中提取总基因组DNA。DNA的提取质量及浓度和纯度分别通过0.8%琼脂糖凝胶电泳和微量紫外-可见光分光光度计进行检测与分析[11],检测合格的DNA样品进行后续分析。
PCR扩增:使用引物ITS3F和ITS4R对真菌的内部转录间隔区(ITS1)进行PCR扩增[12]。扩增体系:4 μL的5×PCR缓冲液,4 μL的dNTPs(2.5 mmol/L),0.8 μL的ITS3F(5 μmol/L),0.8 μL的ITS4R(5 μmol/L),0.4 μL的DNA聚合酶(5 U/μL),0.2 μL的BSA和10 ng的DNA模板,并用ddH2O补充至20 μL。扩增参数:95 ℃预加热3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃复性45 s,循环35次;72 ℃保持10 min。PCR的扩增质量通过2%的琼脂糖凝胶电泳进行检测[13],并利用Axygen PCR清洁试剂盒对检测合格的PCR产物进行纯化。
高通量测序:待测样品寄往上海美吉生物医药科技有限公司,使用PE300型高通量测序平台将扩增合格的PCR清洁产物进行测序。
1.3.4 序列质控和生物信息学分析
使用QIIME平台(v1.9.0)对样品中真菌群落的扩增子序列进行分析。首先参考LI等[14]的方法对原始序列进行质量控制,通过UCLUST两步法将有效序列按照100%和97%相似度建立分类操作单元(operational taxonomic units,OTU)[15],使用UCHIME算法去除含嵌合体序列OTU[16],选取代表性序列与UNITE数据库进行同源性比对并确定物种分类学地位[17],并基于真菌门和属水平对微生物丰度进行统计,计算样品中真菌群落α和β多样性指数。
1.3.5 基于电子鼻技术分析大曲风味品质
取10 g待测大曲样品于电子鼻顶空进样瓶中,样品体积约占样品瓶的1/3,并用带聚四氟乙烯(polytetrafluoroethylene,PTFE)硅胶垫片的顶空瓶盖密封。每份样品设置3个平行,并在室温下平衡30 min后进行顶空进样。进样条件[18]:首先传感器置于干燥空气中平衡120 s,检测时间90 s;样品测试时间60 s,取样间隔1 s,清洗时间110 s,归零时间5 s;测量时间、预采样时间和注射流量分别为90 s、5 s和300 mL/min。选取传感器信号较为稳定的49~51 s为信号采集时间,并将传感器响应值的平均值用于后续实验分析。
1.3.6 统计分析
数据处理及可视化分析主要在Excel 2016、Origin 2021、R4.1.0和GraphPad Prism 9中进行与实现。当2组方差不均匀时,采用曼-惠特尼(Mann-Whitney)检验法对2个聚类之间进行显著性分析。
2 结果与分析
2.1 兰陵地区高温大曲中真菌类群OTU分布和β多样性分析
采用MiSeq高通量测序技术,本研究从15份兰陵高温大曲中共获得923 724条序列,经过质量控制、去除嵌合体并按照97%相似度被划分为6 778个OTU。若某一个OTU存在于15个高温大曲中,则将其定义为核心OTU。本研究首先统计了高温大曲中OTU的分布情况,并进行了基于加权UniFrac距离的层次聚类分析(hierarchical cluster analysis,HCA),结果见图1。
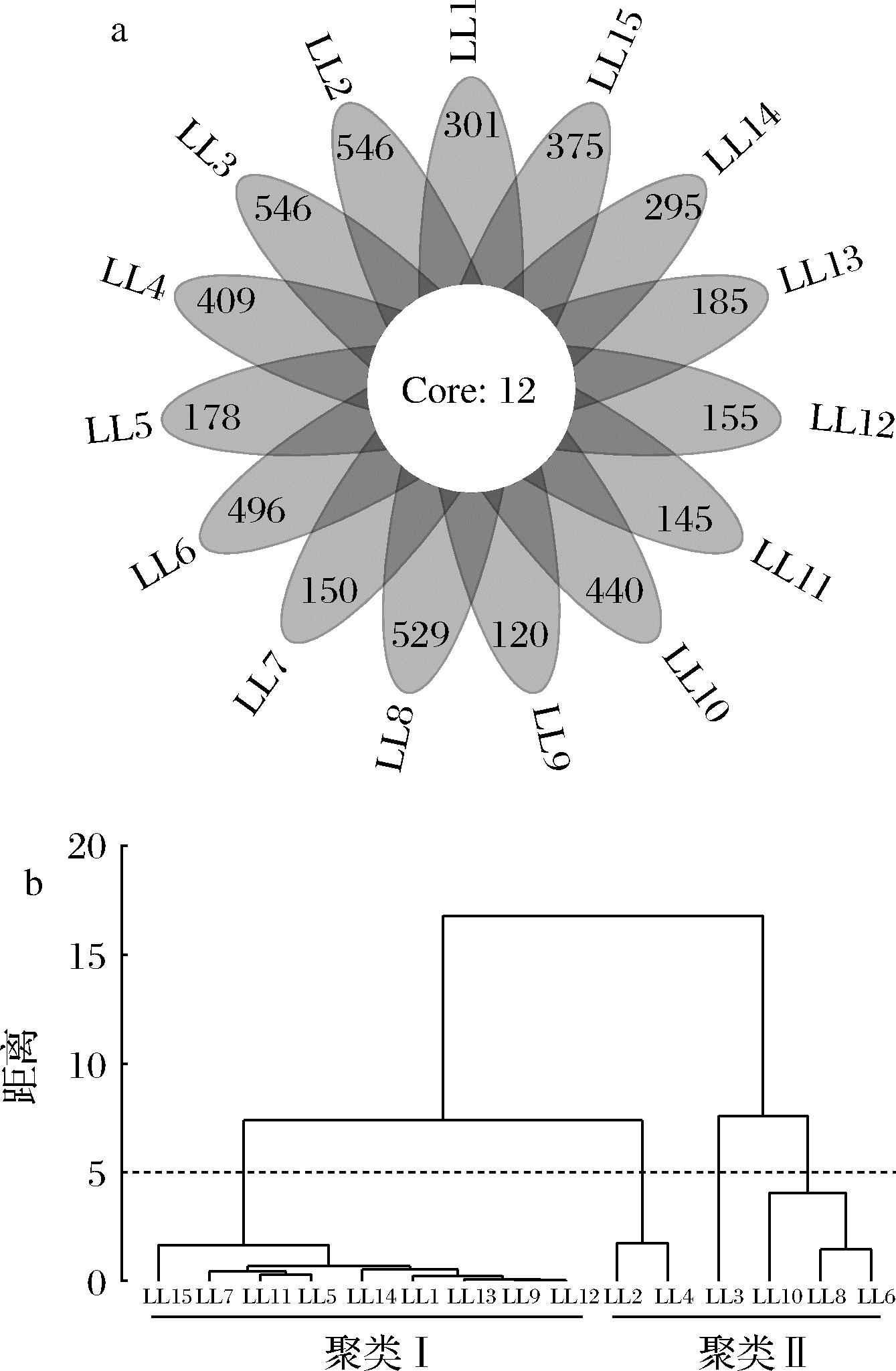
a-OTU花瓣图;b-层次聚类分析
图1 高温大曲真菌类群的OTU花瓣图和基于加权UniFrac距离的层次聚类分析
Fig.1 OTU petal map and based on weighted UniFrac distance of hierarchical cluster analysis in fungal groups of high-temperature Daqu
由图1-a可知,15份高温大曲真菌类群共有12个核心OTU,包含793 381条序列,占有效序列的86.37%。除核心OTU外,不同高温大曲中亦含有133~534个OTU,包含165~54 035条序列,占有效序列的0.02%~5.88%。由此可见,作为同一批次的高温大曲,虽然共有大量核心真菌类群,但不同高温大曲之间真菌群落结构亦存在一定差异。由图1-b可知,当加权UniFrac距离为5时,除高温大曲LL2、LL3、LL4、LL6、LL8和LL10外,其余9份高温大曲明显聚为一类。因此,本研究将高温大曲LL1、LL5、LL7、LL9、LL11、LL12、LL13、LL14和LL15定义为聚类I,将高温大曲LL2、LL3、LL4、LL6、LL8和LL10定义为聚类II。
2.2 兰陵地区高温大曲中霉菌和酵母菌落计数及真菌类群α多样性分析
为了更直观比较2个聚类中真菌类群结构的差异,本研究采用纯培养技术对2个聚类中可培养霉菌和酵母进行了菌落计数分析,并计算了2个聚类真菌类群发现物种数和香农指数,发现物种数可以有效评估样品中物种丰富度,香农指数则用于评估物种多样性[11]。结果如图2所示。
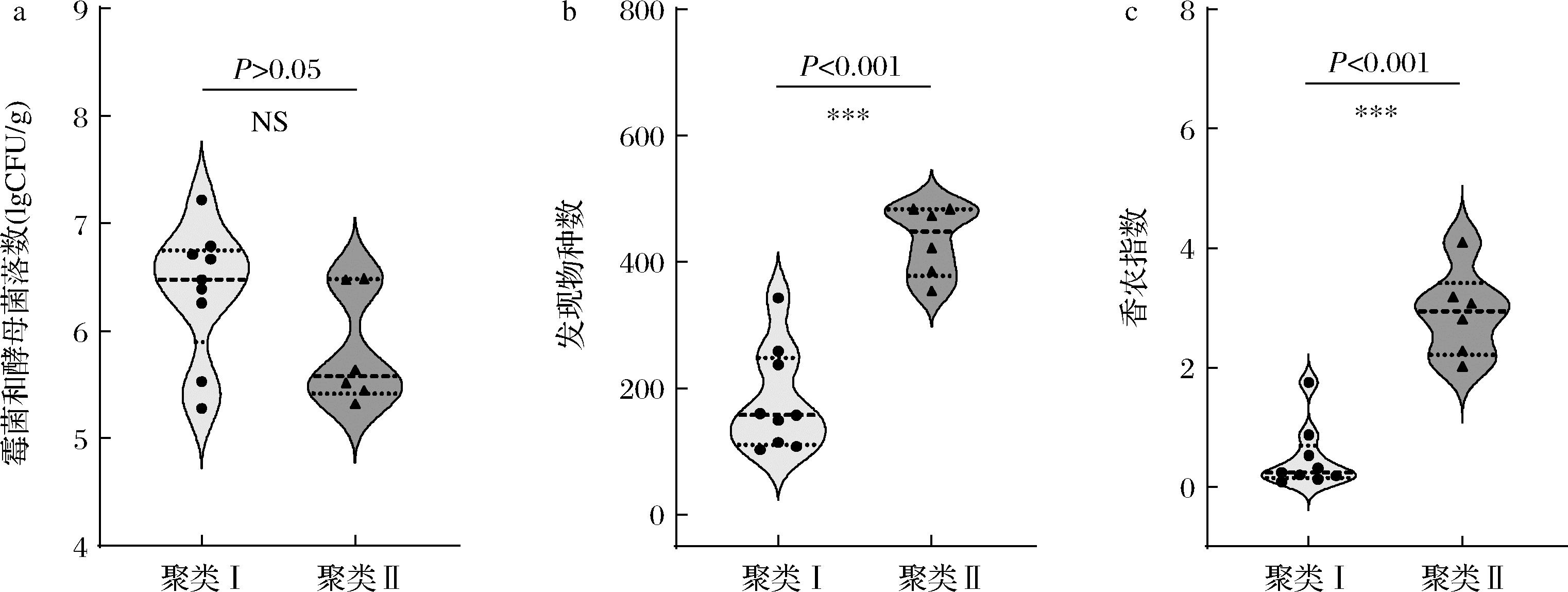
a-霉菌和酵母菌落数;b-发现物种数;c-香农指数
图2 两个聚类中霉菌和酵母菌落数、发现物种数和香农指数
Fig.2 The number of mold and yeast colonies, observed species and Shannon index in the two clusters
注:发现物种数和香农指数均是在测序深度为45 010条序列时进行计算;“NS”代表不显著(P>0.05);“*”代表显著(P<0.05);“**”代表非常显著(P<0.01);“***”代表极显著(P<0.001)(下同)。
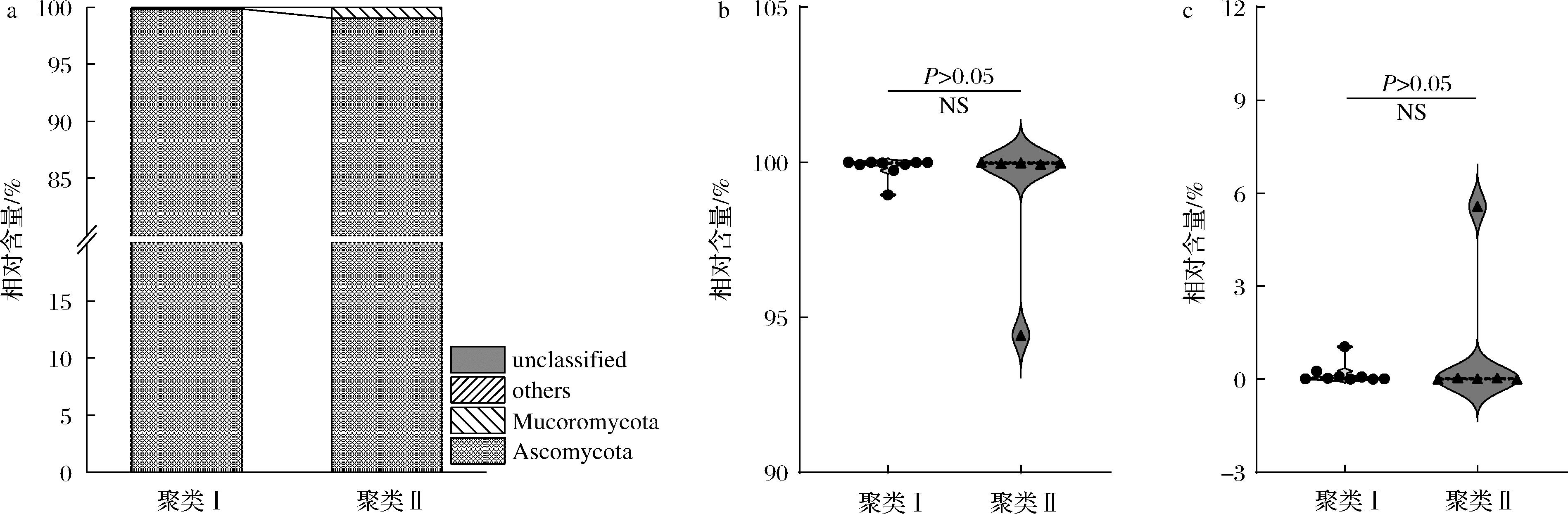
a-优势真菌门;b-子囊菌门;c-毛霉门
图3 两个聚类中平相对含量>0.5%的真菌门及物种比较分析
Fig.3 Fungal phylum with average relative content>0.5% in two clusters and their comparative analysis

a-优势真菌属;b-嗜热真菌属;c-曲霉属;d-嗜热子囊菌属;e-嗜热毛霉属;f-嗜热真菌属和曲霉属的拟合曲线
图4 两个聚类中平相对含量>0.5%的真菌属及物种比较分析
Fig.4 Fungal genera with average relative content>0.5% in two clusters and their comparative analysis
由图2可知,聚类I和聚类II的平均霉菌和酵母菌落数分别为6.37 lgCFU/g和5.82 lgCFU/g,平均发现物种数分别为182和434,平均香农指数分别为0.48和2.92。经过Mann-Whitney检验发现,2个聚类高温大曲中霉菌和酵母菌落数差异不显著(P>0.05),而发现物种数和香农指数差异极显著(P<0.001),表明隶属于聚类I的高温大曲真菌类群的丰富度和多样性均显著偏低。
2.3 兰陵地区高温大曲中真菌类群分析
为进一步探究2个聚类高温大曲在真菌群落结构上的差异,本研究选取代表性序列与数据库进行同源性比对,共鉴定到4个真菌门和32个真菌属,并对2个聚类中平均相对含量>0.5%的真菌门和属进行了可视化统计分析。2个聚类中平均相对含量>0.5%的真菌门分布情况及差异分析见图3。
由图3可知,高温大曲中真菌主要隶属于2个门,分别为Ascomycota(子囊菌门)和Mucoromycota(毛霉门),其在聚类I和聚类II中的平均相对含量分别为99.83%和0.17%以及99.05%和0.94%。经过Mann-Whitney检验表明,2个聚类中Ascomycota和Mucoromycota相对含量差异均不显著(P>0.05)。2个聚类中平均相对含量>0.5%的真菌属分布情况及差异分析见图4。
由图4可知,高温大曲中真菌主要隶属于4个属,分别为隶属于Ascomycota的Thermomyces、Aspergillus和Thermoascus以及隶属于Mucoromycota的Thermomucor(嗜热毛霉属),其在聚类I和聚类II中的平均相对含量分别为96.44%、1.47%、1.34%和0.13%以及46.60%、37.89%、13.03%和0.93%。经过Mann-Whitney检验发现,较之聚类II,聚类I高温大曲中Thermomyces相对含量极显著偏高(P<0.001),而Aspergillus相对含量极显著偏低(P<0.001)。由图4-f可知,所有兰陵高温大曲中Thermomyces和Aspergillus相对含量呈现极显著负相关性(P<0.001)。
PANG等[19]对中国北方地区高温大曲微生物类群进行分析发现,Thermomyces、Thermoascus、Byssochlamys(丝衣霉属)和Aspergillus是黑色、白色和黄色大曲中的优势真菌属,且嗜热菌Thermomyces和Thermoascus可以编码与糖化和乙醇发酵相关的酶。邓灿等[20]对湖北某酒厂高温大曲真菌群落进行解析发现,Thermomyces、Thermoascus和Aspergillus是构成大曲微生物群落的3个真菌属,且优级曲中嗜热菌Thermomyces和Thermoascus占比98.89%,Aspergillus仅占比0.57%,这与本研究中聚类I高温大曲分析结果相似。通过文献调研,ZHANG等[21]指出Thermomyces、Thermoascus和Aspergillus是高温大曲中主要的真菌类群,这与本研究所得结论一致。
2.4 兰陵地区高温大曲风味品质分析
PEN3电子鼻含有对特定挥发性气体具有较高灵敏度的金属传感器,可以快速且客观的对样品进行检测分析[22]。本研究基于电子鼻技术对大曲样品的风味品质进行评价,电子鼻传感器的响应值与风味物质的浓度呈现正相关,通过Mann-Whitney检验对两个聚类的各传感器响应值进行了比较分析,结果见表1。
表1 两个聚类高温大曲风味品质的比较分析(n=15)
Table 1 Comparative analysis of flavor quality of two clusters of high-temperature Daqu (n=15)

金属传感器性能描述聚类I聚类IIP值差异性W1C对芳香类物质灵敏0.23(0.23,0.23~0.25)0.23(0.23,0.21~0.24)0.172NSW3C对氨气、芳香类物质灵敏0.29(0.29,0.28~0.29)0.28(0.28,0.27~0.29)0.257NSW5C对烷烃、芳香类物质灵敏0.28(0.28,0.27~0.29)0.28(0.28,0.27~0.30)0.797NSW1W对有机硫化物、萜类物质灵敏46.57(46.67,40.23~49.27)47.88(48.23,40.23~57.35)0.388NSW2S对乙醇灵敏7.03(6.91,6.47~8.04)7.58(7.09,6.47~9.56)0.145NSW2W对有机硫化物灵敏1.32(1.32,1.30~1.33)1.33(1.33,1.30~1.35)0.046*W3S对烷烃灵敏1.06(1.05,1.02~1.10)1.08(1.07,1.02~1.13)0.153NS
注:“0.23(0.23,0.23~0.25)”代表“平均值(中位数,最小值~最大值)”,“*”代表显著(P<0.05);“NS”代表不显著(P>0.05)。
由表1可知,传感器W1C对聚类I高温大曲的响应值比聚类II高,而传感器W1 W、W2S、W2 W和W3S对聚类I高温大曲的响应值比聚类II低,且除了传感器W2 W的响应值在2个聚类之间差异显著(P<0.05)之外,其余6个传感器的响应值在2个聚类之间差异均不显著(P>0.05)。由此表明,较之聚类II,聚类I高温大曲中有机硫化物含量显著偏低(P<0.05)。已有报道显示,芳香类物质是对白酒风味贡献最大的骨架风味化合物之一[23],而大多数含硫化合物则具有令人不愉悦的气味,如具有臭鸡蛋味的硫化氢、具有豆腥味的二甲基三硫以及具有洋葱味的二乙基硫、二甲基二硫和二乙基二硫等[24]。由此可见,聚类I高温大曲风味品质可能更佳,与上述真菌类群分析推测一致。
2.5 兰陵地区高温大曲真菌属与风味品质的多元统计学分析
本研究基于主成分分析(principal components analysis,PCA)和普式分析(procrustes analysis),进一步对两个聚类高温大曲中平均相对含量>0.5%的真菌属与风味品质评价指标进行了空间排布和形状映射,结果见图5。
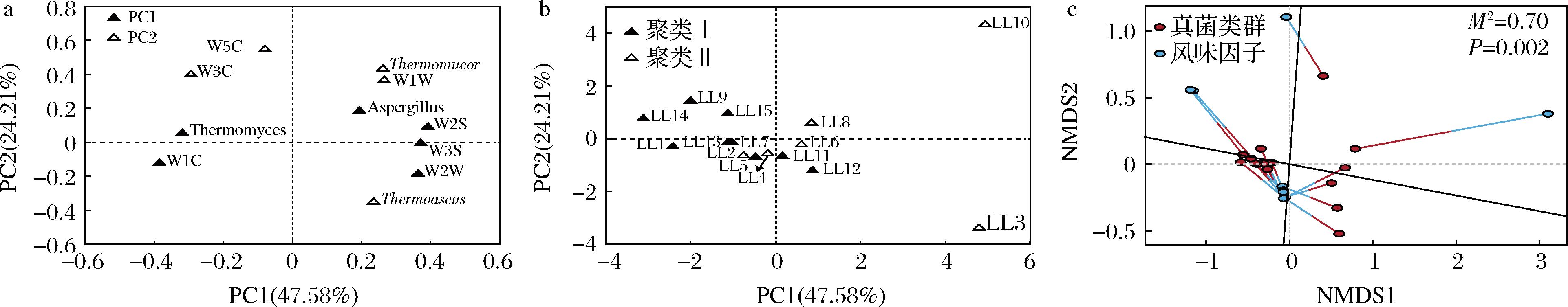
a-因子得分图;b-因子载荷图;b-普式分析
图5 基于高温大曲真菌属与风味指标的主成分分析和普式分析
Fig.5 Principal component analysis and procrustes analysis based on high-temperature Daqu fungal genus and flavor index
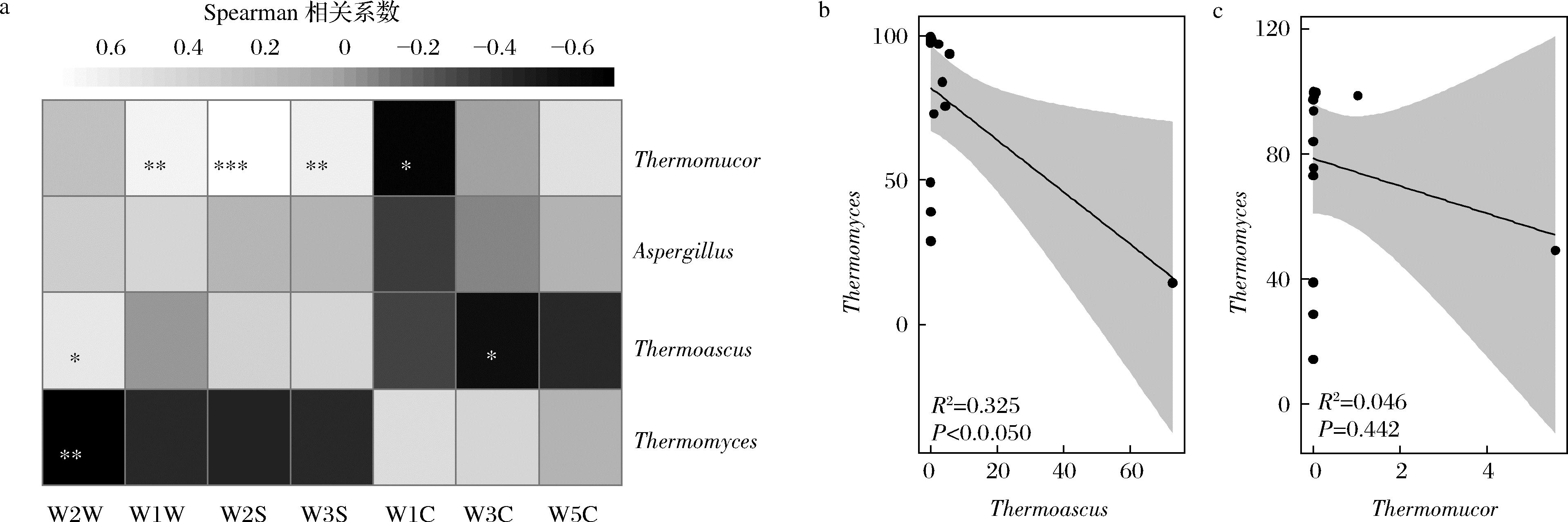
a-相关性热图;b-嗜热真菌属与嗜热子囊菌属的拟合曲线;c-嗜热真菌属与曲霉属的拟合曲线
图6 高温大曲真菌属与风味品质的相关性分析
Fig.6 Correlation analysis fungal genera and flavor quality in high-temperature Daqu
由图5-a可知,第一主成分包括Thermomyces、Aspergillus、W1C(对芳香类物质灵敏)、W2S(对乙醇灵敏)、W2W(对有机硫化物灵敏)和W3S(对烷烃灵敏)共6个指标,第二主成分包括Thermoascus、Thermomucor、W3C(对氨气、芳香类物质灵敏)、W5C(对烷烃、芳香类物质灵敏)和W1W(对有机硫化物、萜类物质灵敏)共5个指标,累计贡献率为71.79%。此外,Thermomyces以及传感器W1C、W3C和W5C敏感的物质均分布于Y轴左侧,Thermoascus、Aspergillus和Thermomucor以及传感器W2S、W3S、W1W和W2W敏感的物质均分布于Y轴右侧。由图5-b可知,隶属于聚类I的高温大曲主要集中分布于Y轴左侧和第四象限,隶属于聚类II的高温大曲则主要分布于Y轴右侧和第三象限且空间排布分散。由此表明,隶属于聚类I的高温大曲Thermomyces丰度较高且芳香类物质含量丰富,隶属于聚类II的高温大曲Thermoascus、Aspergillus和Thermomucor以及有机硫化物等物质含量较高。
由图5-c可知,通过对高温大曲中菌群丰度和风味强度的数据进行降维,纳入本研究的样品在一个低维空间内产生了形状映射,本研究在此基础上进行了点坐标之间偏差平方和(M2值)计算和显著性检验(P值),结果表明高温大曲中平均相对含量>0.5%的真菌属与风味因子之间具有非常显著的相关性(P<0.01)。由此可知,高温大曲在赋予发酵体系酶系和菌系的同时,对其风味品质亦产生了影响。基于Spearman相关性分析技术,本研究进一步探究了真菌属与风味指标之间的关联性,如图6所示。
由图6-a可知,Thermomyces与传感器W2W的响应值呈非常显著负相关(P<0.01),Thermoascus与传感器W2W的响应值呈显著正相关(P<0.05),与传感器W3C的响应值呈显著负相关(P<0.05),Thermomucor与传感器W1W的响应值呈非常显著正相关(P<0.01),与传感器WIC的响应值呈显著负相关(P<0.05)。由此表明,高温大曲中Thermomyces与有机硫化物存在显著负相关,而Thermoascus和Thermomucor与有机硫化物存在显著正相关,与芳香类物质存在显著负相关。由图6-b和图6-c可知,与高温大曲风味品质具有显著相关性的真菌属之间亦存在一定的关联性,且Thermomyces和Thermoascus之间呈现显著负相关(P<0.05)。综合上述分析可知,隶属于聚类I的高温大曲Thermomyces和芳香类物质含量丰富,且与Thermoascus和Thermomucor之间存在一定的负相关性,这表明Thermomyces对高温大曲风味品质形成可能具有积极贡献。
3 结论
本研究将15份兰陵地区高温大曲划分为两个聚类,研究发现,对两个聚类高温大曲的划分具有重要影响的真菌类群主要为Thermomyces、Aspergillus、Thermoascus和Thermomucor。其中,Thermomyces相对含量丰富的聚类I高温大曲中芳香类物质含量明显偏高,Aspergillus、Thermoascus和Thermomucor相对含量较高的聚类II高温大曲中有机硫化物含量明显偏高。由此可见,Thermomyces对高温大曲风味品质形成可能具有积极贡献。
[1] CHEN B, WU Q, XU Y.Filamentous fungal diversity and community structure associated with the solid state fermentation of Chinese Maotai -flavor liquor[J].International Journal of Food Microbiology, 2014, 179:80-84.
[2] LIU Y B, LI H D, DONG S M, et al.Dynamic changes and correlations of microbial communities, physicochemical properties, and volatile metabolites during Daqu fermentation of Taorong-type Baijiu[J].LWT, 2023, 173:114290.
[3] SHI W, CHAI L J, FANG G Y, et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Research International, 2022, 156:111298.
[4] 沈世明, 何猛超, 刘桂珍, 等.酱香型大曲贮存初期微生物及风味物质变化的分析研究[J].酿酒科技, 2023, 344(2):128-135.
SHEN S M, HE M C, LIU G Z, et al.Analysis and study on the changes of microorganisms and flavor substances in Maotai-flavor Daqu at the initial stage of storage[J].Liquor-Making Science &Technology, 2023, 344(2):128-135.
[5] 周天慈. 基于高通量测序技术定量解析大曲核心真菌群落的形成机制[D].无锡:江南大学, 2021.
ZHOU T C.Analyzing quantitatively the formation mechanism of Daqu core fungal community based on high-throughput sequencing technology[D].Wuxi:Jiangnan University, 2021.
[6] 陈玲, 袁玉菊, 曾丽云, 等.16S rDNA克隆文库法与高通量测序法在浓香型大曲微生物群落结构分析中的对比研究[J].酿酒科技, 2015, 258(12):33-36;40.
CHEN L, YUAN Y J, ZENG L Y, et al.16S rDNA clone library vs.high-throughput sequencing method in the analysis of the microbial communities in Nongxiang Daqu[J].Liquor-Making Science &Technology, 2015, 258(12):33-36;40.
[7] JIANG Q E, WU X Y, XU Y Q, et al.Microbial composition and dynamic succession during the Daqu production process of northern Jiang-flavored liquor in China[J].3 Biotech, 2021, 11(5):1-15.
[8] ZUO Q C, HUANG Y G, GUO M.Evaluation of bacterial diversity during fermentation process:A comparison between handmade and machine-made high-temperature Daqu of Maotai-flavor liquor[J].Annals of Microbiology, 2020, 70(1):14-23.
[9] CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions, and flavor in different types of low-temperature Daqu[J].Food Research International, 2021, 150(12):110734.
[10] 张春林. 泸州老窖大曲的质量、微生物与香气成分关系[D].无锡:江南大学, 2012.
ZAHNG C L.The relationship between quality, microorganisms and flavour components of Luzhou Laojiao Daqu[D].Wuxi:Jiangnan University, 2012.
[11] HUANG Y Y, LIANG Z C, LIN X Z, et al.Fungal community diversity and fermentation characteristics in regional varieties of traditional fermentation starters for Hong Qu glutinous rice wine[J].Food Research International, 2021, 141:110146.
[12] ZHANG Y J, SKAAR I, SULYOK M, et al.The microbiome and metabolites in fermented Pu-erh Tea as revealed by high-throughput sequencing and quantitative multiplex metabolite analysis[J].PLoS One, 2016, 11(6):e0157847.
[13] XU D D, WANG P, ZHANG X, et al.High-throughput sequencing approach to characterize dynamic changes of the fungal and bacterial communities during the production of sufu, a traditional Chinese fermented soybean food[J].Food Microbiology, 2020, 86:103340.
[14] LI J, HU W Z, HUANG X J, et al.Investigation of yeast population diversity and dynamics in spontaneous fermentation of Vidal blanc icewine by traditional culture-dependent and high-throughput sequencing methods[J].Food Research International, 2018, 112(8):66-77.
[15] LI Y L, LIU S P, ZHANG S Y, et al.Spatiotemporal distribution of environmental microbiota in spontaneous fermentation workshop:The case of Chinese Baijiu[J].Food Research International, 2022, 156(6):111126.
[16] XIAO R, CHEN S Q, WANG X Q, et al.Microbial community starters affect the profiles of volatile compounds in traditional Chinese Xiaoqu rice wine:Assement via high-throughput sequencing and gas chromatography-ion mobility spectrometry[J].LWT, 2022, 170(12):114000.
[17] CHEN T Y, WANG H Y, SU W, et al.Analysis of the formation mechanism of volatile and non-volatile flavor substances in corn wine fermentation based on high-throughput sequencing and metabolomics[J].Food Research International, 2023, 165:112350.
[18] SONG F H, XIANG H, LI Z F, et al.Monitoring the baking quality of Tieguanyin via electronic nose combined with GC-MS[J].Food Research International, 2023, 165(3):112513.
[19] PANG Z M, LI W W, HAO J, et al.Correlational analysis of the physicochemical indexes, volatile flavor components, and microbial communities of high-temperature Daqu in the northern region of China[J].Foods (Basel, Switzerland), 2023, 12(2):326.
[20] 邓灿, 高瑞杰, 赵永威, 等.高温大曲感官指标与理化指标、微生物群落和挥发性物质的关联[J].食品与发酵工业, 2022, 48(23):78-85.
DENG C, GAO R J, ZHAO Y W, et al.Correlation between sensory indexes, physical and chemical indexes, microbial community and volatile substances of high-temperature Daqu[J].Food and Fermentation Industries, 2022, 48(23):78-85.
[21] ZHANG H X, WANG L, TAN Y W, et al.Effect of Pichia on shaping the fermentation microbial community of sauce-flavor Baijiu[J].International Journal of Food Microbiology, 2021, 336(1):108898.
[22] DI GILIO A, PALMISANI J, PETRACCONE S, et al.An integrated high temporal resolution approach to monitor VOCs concentrations and odour annoyance near a petroleum plant[J].Environmental Engineering and Management Journal, 2018, 17(10):2373-2378.
[23] HE G Q, HUANG J, WU C D, et al.Bioturbation effect of fortified Daqu on microbial community and flavor metabolite in Chinese strong-flavor liquor brewing microecosystem[J].Food Research International, 2020, 129:108851.
[24] 沙莎. 白酒中挥发性含硫化合物及其风味贡献研究[D].无锡:江南大学, 2017.
SHA S.Characterization and flavor impact of volatile sulfur compounds in Chinese liquors[D].Wuxi:Jiangnan University, 2017.