大豆分离蛋白(soybean protein isolate, SPI)因其具有低成本、高营养价值和良好功能特性的独特优势,在食品工业中可作壁材应用于油脂包埋[1]。然而SPI在食品加工中易受溶液环境、加工条件等影响导致沉淀、聚集甚至变性,在一定程度上限制了SPI的应用。美拉德反应因其不需要额外添加化学物质且安全性高,是一种温和绿色的蛋白质改性方法[2]。研究表明,分子质量较大的碳水化合物能与蛋白质形成具有更好乳化性和稳定性的美拉德反应产物,在此情况下,多糖被广泛应用于美拉德反应以改善SPI的功能特性[3]。
魔芋葡甘聚糖(konjac glucomannan, KGM)作为一种天然中性多糖,具有良好的生物降解性、成膜性和稳定性[4],可用于美拉德反应改善蛋白的功能性质。KGM与花生分离蛋白发生美拉德反应后,溶解性和乳化性显著提高[5]。CUI等[6]研究发现KGM与SPI形成的美拉德反应产物可以负载血管紧张素转换酶并增强其稳定性。刘柳等[7]研究发现KGM与大米蛋白在最佳条件下发生美拉德反应,接枝度仅为14.94%。这可能是由于天然KGM分子溶解度较低,即使在低浓度下仍表现出极高的黏度和较差的分散性[8],在一定程度上限制了其应用于美拉德反应改性蛋白。研究表明,KGM含有丰富的羟基,可被化学氧化为氧化魔芋葡甘聚糖(oxidized konjac glucomannan, OKGM),使KGM黏度降低、溶解度增大[9],有望促进其与SPI的美拉德反应。但是,有关OKGM与SPI发生美拉德反应的研究尚未见报道。此外,OKGM的氧化度对美拉德反应及其产物的性质的影响还未清楚。
因此,本文以KGM为原料,通过高碘酸钠氧化制备不同氧化度的OKGM,经红外光谱(Fourier transform infrared spectrometer,FTIR)分析KGM的结构变化。然后通过湿法美拉德反应制备SPI-OKGM,探究OKGM氧化度和SPI与OKGM质量比对SPI-OKGM接枝度、褐变强度以及结构特性的影响,并借助乳化活性和乳化稳定性以及DPPH自由基清除率、还原力和抗脂质氧化能力表征美拉德反应产物的乳化能力和抗氧化能力,以期为拓展OKGM在美拉德反应改性蛋白等方面的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
大豆分离蛋白,合肥博美生物科技有限公司;魔芋葡甘聚糖,湖北十堰花仙子有限公司;金龙鱼大豆油,益海嘉里食品工业有限公司;溴化钾(光谱级),天津光孚精细化工研究所;其他化学试剂均为分析纯。
1.2 仪器与设备
JY98-ⅢDN型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;TGL-16G台式离心机,上海安亭科学仪器厂;H4-20KR台式高速冷冻离心机,湖南可成仪器设备有限公司;FD-1A-50型冷冻干燥机,北京博医康实验仪器有限公司;T6新世纪紫外分光光度计,北京普析通用仪器有限责任公司;Spectrum Two型傅里叶红外变换光谱仪,美国PerkinElmer公司;TM 4000 Plus 10101型扫描电镜,日本日立高新公司;T18 ULTRA-TURRAX型高速均质机,德国IKA公司。
1.3 实验方法
1.3.1 OKGM的制备
将120 g/L高碘酸钠溶液分别与800 mL 10 g/L KGM溶液按照质量比0.4∶1、0.7∶1和1.1∶1混合,并使用蒸馏水定容至900 mL。避光条件下连续搅拌12 h,然后逐滴加入乙二醇并持续搅拌2 h以终止反应。将得到的反应混合液转移至3.5 kDa透析袋中,室温下连续透析24 h,离心后收集上清液,冻干备用。
1.3.2 OKGM的红外表征和氧化度测定
使用Spectrum Two型傅里叶红外变换光谱仪对KGM和OKGM进行分析。仪器设定波数范围为4 000~500 cm-1,分辨率为4 cm-1,扫描次数为8次。
将0.1 g OKGM样品添加至25 mL 0.25 mol/L的盐酸羟胺水溶液(pH 4.0,含3 mL 0.05%的甲基橙)中,室温下搅拌5 h后,用0.1 mol/L标准氢氧化钠(NaOH)溶液滴定,以KGM作为空白对照,并按照公式(1)计算氧化度:
氧化度![]()
(1)
式中:V1为样品液消耗NaOH的体积,mL;V0为空白液消耗NaOH的体积,mL;CNaOH为NaOH溶液的摩尔浓度,mol/L;Mw为KGM中葡萄糖单元的摩尔质量,162 g/mol;W为OKGM的质量,g。
1.3.3 美拉德产物的制备
参考ZHAO等[10]方法并略作修改。用磷酸钠缓冲液(0.01 mol/L,pH 7.4)配制质量浓度为60 g/L的SPI溶液和OKGM溶液。将SPI溶液在204 W下超声5 min后与OKGM溶液按照不同质量比(4∶1、2∶1、1∶1、1∶2和1∶4)混合均匀,恒温水浴振荡(60 ℃,200 r/min)30 h后置于冰水浴中冷却至室温以终止反应。将反应混合液置于去离子中透析24 h后冷冻干燥。其中,以氧化度为26.80%、42.98%和59.66%的OKGM制备的美拉德产物分别命名为SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66。
1.3.4 美拉德产物的表征
1.3.4.1 接枝度
参考PENG等[11]的方法,采用邻苯二甲醛(o-phthalaldehyde,OPA)试剂法测定接枝度。将4 mL OPA试剂加入至200 μL 2 mg/mL样品溶液中,充分涡旋混匀,35 ℃水浴2 min,在340 nm测定其吸光值,将4 mL OPA试剂加入至200 μL去离子水中作为空白对照,并根据公式(2)计算接枝度:
接枝度![]()
(2)
式中:A0为对照组,是相同培养条件下SPI在340 nm处的吸光度;A1为美拉德反应产物在340 nm处的吸光度。
1.3.4.2 褐变强度
参考PENG等[11]的方法,配制质量浓度为2.0 mg/mL 的样品溶液,在420 nm处测量其吸光度(A420),以去离子水作为空白。
1.3.4.3 红外光谱
使用溴化钾压片法测定样品的FTIR光谱。分别将2 mg的SPI、SPI+OKGM共混物以及SPI-OKGM与溴化钾以质量比1∶100混合研磨,压制成薄片,试验条件详见1.3.2节。
1.3.4.4 表面形貌
采用扫描电子显微镜观察SPI、SPI+OKGM共混物以及SPI-OKGM美拉德反应产物的形貌。将样品分散于有双面胶的样品台,吹掉浮粉并喷金,进行扫描观察,放大倍数为300和1 000倍,加速电压为15 kV。
1.3.5 美拉德产物的乳化性
参照ZHANG等[12]的方法并稍作修改。将30 mL 1 mg/mL样品溶液与10 mL大豆油混合,利用均质机进行均质(10 000 r/min,1 min),使两者充分混匀。从底部取出50 μL乳液并加入至5 mL 1 mg/mL十二烷基硫酸钠溶液中,以1 mg/mL的十二烷基硫酸钠溶液为空白对照,于500 nm波长下测定吸光度,根据公式(3)和公式(4)计算SPI、SPI+OKGM共混物以及SPI-OKGM的乳化活性和乳化稳定性:
乳化活性![]()
(3)
乳化稳定性![]()
(4)
式中:N为稀释倍数;c为样品浓度,g/mL;φ为乳状液中油相体积分数,25%;θ为比色池光径,cm;A0为0 min吸光值;A10为10 min吸光值;t为10 min。
1.3.6 美拉德产物的抗氧化能力
1.3.6.1 DPPH自由基清除率
参考YU等[13]的方法,并略作修改。将2 mg/mL样品溶液与0.1 mmol/L DPPH乙醇溶液等体积混合,避光反应30 min,在517 nm下测定其吸光值。相同条件下,用去离子水替代样品溶液作为对照组,以无水乙醇替代DPPH乙醇溶液作为空白组。DPPH自由基清除率按公式(5)计算:
DPPH自由基清除率![]()
(5)
式中:At为样品溶液组的吸光值;A0为样品对照的吸光值;Ac为DPPH空白对照的吸光值。
1.3.6.2 还原力
参考ZHAO等[14]的方法,并略作修改。将1 mL 5 mg/mL样品溶液和等体积的10 g/L铁氰化钾溶液和磷酸钠缓冲溶液(0.2 mol/L,pH 6.6)混合。将混合溶液在50 ℃下保温20 min,冰水浴冷却后加入1 mL 100 g/L三氯乙酸(trichloroacetic acid, TCA)溶液,随后离心(8 000 r/min,10 min),收集1 mL上清液,并与1 mL去离子水和200 μL 1 g/L的氯化铁溶液涡旋混合,室温静置10 min后测定700 nm处的吸光度。使用等量的去离子水代替样品作为空白对照。
1.3.6.3 抗脂质氧化能力
参考ZHANG等[15]的方法。将卵磷脂溶于磷酸钠缓冲溶液(0.01 mol/L,pH 7.4)配制10 mg/mL的溶液并标记为LLS。将15 g TCA、0.37 g硫代巴比妥酸(thiobarbituric acid,TBA)和2 mL浓盐酸加入去离子水中并定容至100 mL,将该溶液标记为TCA/TBA/HCl。分别取1 mL样品溶液与等体积的LLS和400 μmol/L FeCl3混合均匀,于37 ℃水浴60 min,加入2 mL TCA/TBA/HCl,沸水浴15 min后,取出冰水冷却。最后将冷却后的溶液离心(8 000 r/min,10 min),取上清液测定532 nm下的吸光度值A1。空白组用去离子水代替样品,测定其吸光度A0。抗脂质氧化能力按公式(6)计算:
抗脂质氧化能力![]()
(6)
1.4 数据处理
所有实验重复3次,结果以平均值±标准偏差表示。用统计软件SPSS(Trial version 18.0, SPSS Inc., Chicago, IL, USA)进行单因素方差分析(P<0.05时表示组间差异显著)。
2 结果与分析
2.1 OKGM的制备与表征
通过控制高碘酸钠用量,制得3种不同氧化度的OKGM,分别为26.80%、42.98%和59.66%(图1-A)。由图1-B可知,在KGM光谱中,3 418、1 731、809 cm-1处的特征峰分别与葡萄糖单元的O—H伸缩振动、乙酰基的C![]() O伸缩振动和甘露糖单元有关。但在OKGM光谱中,3 418 cm-1处的特征峰蓝移至3 434~3 435 cm-1处,同时1 731 cm-1处特征峰红移至1 726 cm-1 处,这可能是因为KGM中的部分羟基被氧化为醛基[16]。此外,OKGM在892~895 cm-1处产生了新的特征峰,该峰的出现是由于醛基和邻近羟基之间形成半缩醛结构[17]。
O伸缩振动和甘露糖单元有关。但在OKGM光谱中,3 418 cm-1处的特征峰蓝移至3 434~3 435 cm-1处,同时1 731 cm-1处特征峰红移至1 726 cm-1 处,这可能是因为KGM中的部分羟基被氧化为醛基[16]。此外,OKGM在892~895 cm-1处产生了新的特征峰,该峰的出现是由于醛基和邻近羟基之间形成半缩醛结构[17]。
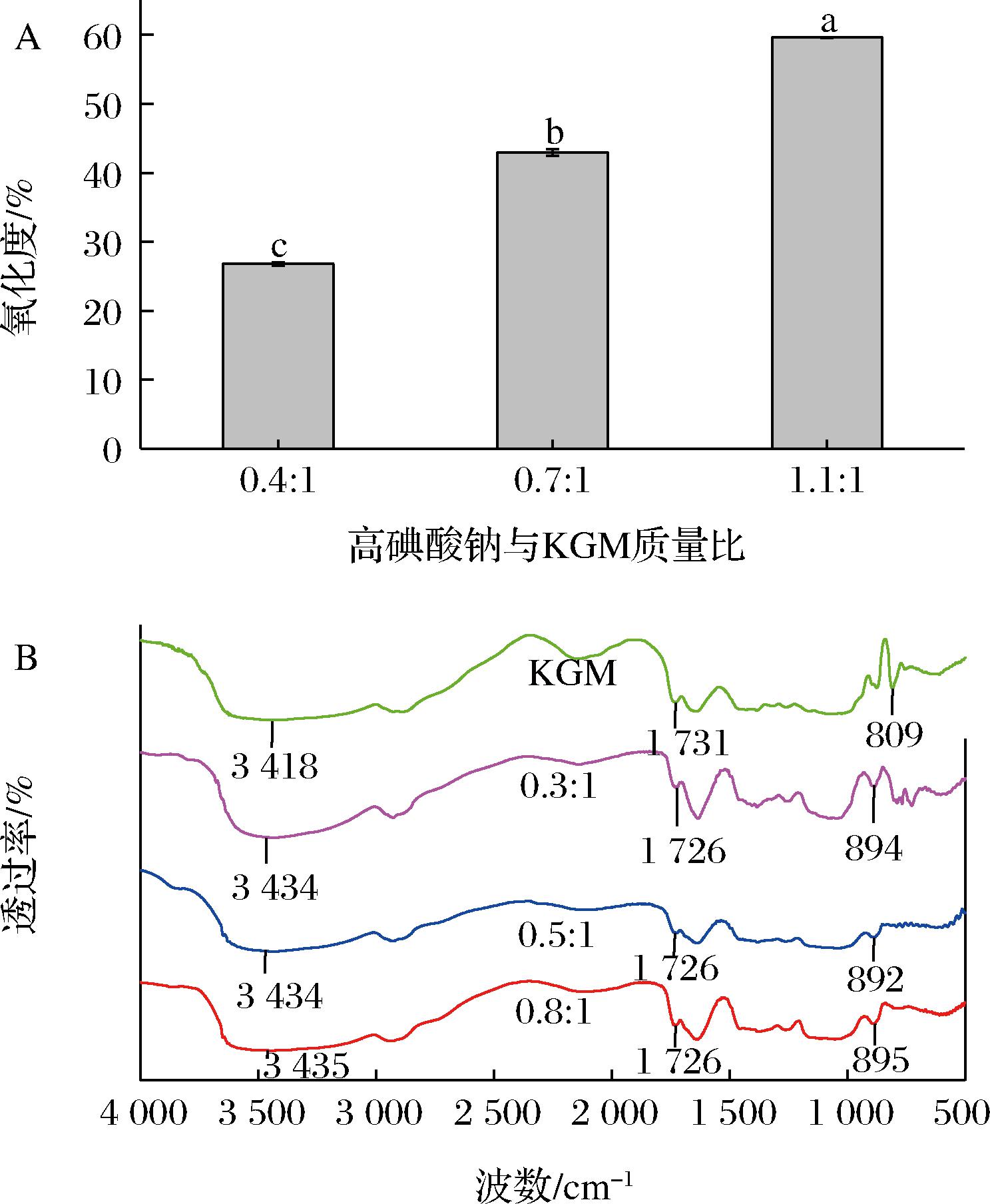
A-氧化度;B-红外光谱
图1 氧化魔芋葡甘聚糖的氧化度与红外光谱
Fig.1 Oxidation degree and Fourier infrared spectrum of oxidized konjac glucomannan
注:不同小写字母表示差异显著(P<0.05)。
2.2 OKGM氧化度和SPI与OKGM的质量比对SPI美拉德反应进程的影响
2.2.1 接枝度
接枝度可直接反映蛋白质的美拉德反应程度,是美拉德反应产物最重要的理化性质之一[18]。图2为SPI与3种氧化度的OKGM在不同质量比下制备的美拉德反应产物的接枝度。当SPI与OKGM质量比为2∶1和1∶1时,SPI-OKGM的接枝度随OKGM氧化度的增大而增加,表明在特定的SPI与OKGM质量比下,高氧化度的OKGM具有更强的反应活性。随SPI与OKGM的质量比由4∶1降低至1∶4时,SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的接枝度均呈现先增大后减小的趋势,并分别在1∶2、1∶1和1∶1时达到最大,为35.15%、38.38%和40.62%,说明与较低氧化度的OKGM相比,较高氧化度的OKGM能在更少质量参与反应的情况下即可达到最大接枝度。
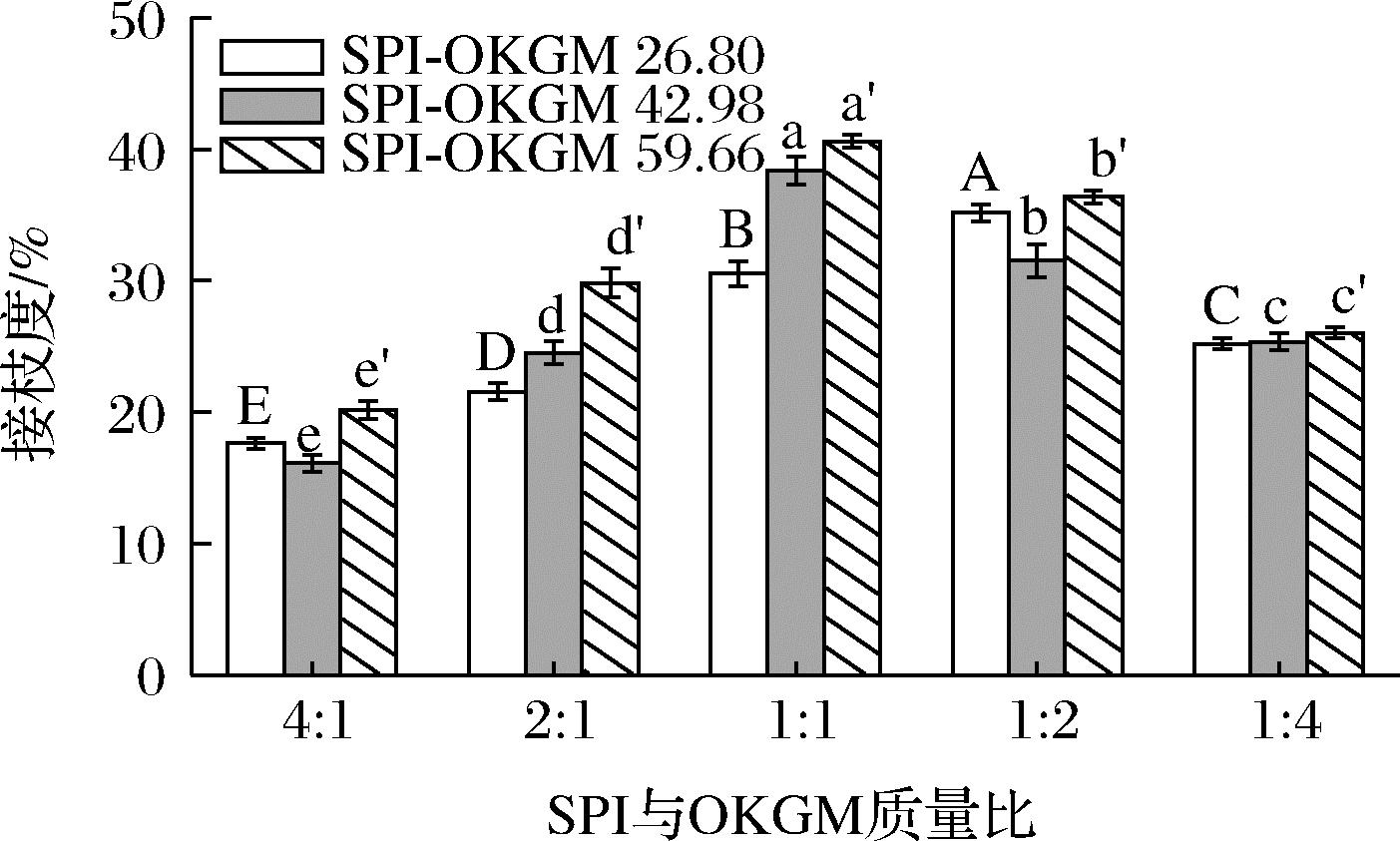
图2 SPI与OKGM质量比对SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的接枝度的影响
Fig.2 Effect of mass ratio of SPI to OKGM on degree of grafting of SPI-OKGM 26.80, SPI-OKGM 42.98, and SPI-OKGM 59.66
注:同种柱形图上方的不同字母表示组间差异显著(P<0.05)(下同)。
2.2.2 褐变强度
褐变引起吸光值的增加可以在一定程度上评估美拉德反应程度[19]。图3为SPI与OKGM质量比和OKGM氧化度对SPI-OKGM褐变强度的影响。当SPI与OKGM质量比为1∶1时,SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的褐变强度相比于SPI+OKGM共混物(SPI与OKGM质量比为1∶1)的褐变强度分别显著提高了0.16、0.30和0.34。SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66褐变强度随SPI与OKGM质量比的变化趋势与接枝度随质量比的变化趋势(图2)相似。此外,在所有质量比下(4∶1~1∶4),SPI-OKGM美拉德反应产物的褐变强度随OKGM氧化度的增大而增加,表明OKGM氧化度越大,其与SPI形成的棕色聚合物越多,接枝产物颜色越深。
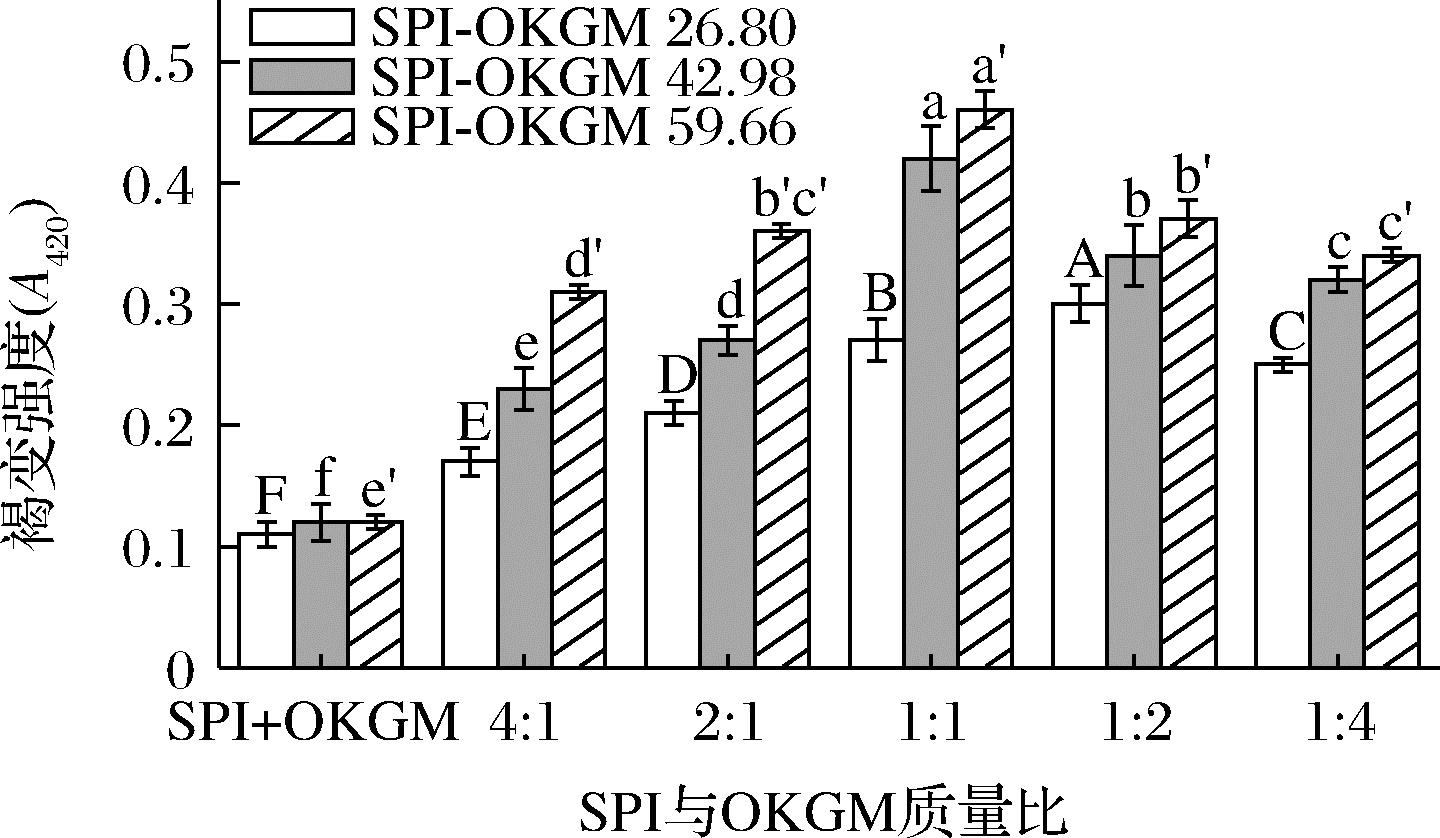
图3 SPI与OKGM质量比对SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的褐变强度的影响
Fig.3 Effect of mass ratio of SPI to OKGM on browning intensity of SPI-OKGM 26.80, SPI-OKGM 42.98, and SPI-OKGM 59.66
2.3 OKGM对SPI结构的影响
2.3.1 红外光谱分析
图4显示不同SPI与OKGM质量比下OKGM氧化度对SPI-OKGM红外光谱的影响。SPI在1 648、1 533 cm-1处的特征峰分别与C![]() O和C—N的拉伸振动(酰胺I带)以及N—H弯曲振动和C—N拉伸振动(酰胺Ⅱ带)有关[20]。与SPI相比,不同SPI与OKGM质量比下的SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66在1 648、1 533 cm-1处均发生了不同程度的蓝移,这归因于SPI的游离氨基和OKGM的羰基之间发生了共价结合,同时反应生成了Amadori化合物(C
O和C—N的拉伸振动(酰胺I带)以及N—H弯曲振动和C—N拉伸振动(酰胺Ⅱ带)有关[20]。与SPI相比,不同SPI与OKGM质量比下的SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66在1 648、1 533 cm-1处均发生了不同程度的蓝移,这归因于SPI的游离氨基和OKGM的羰基之间发生了共价结合,同时反应生成了Amadori化合物(C![]() O)和Schiff碱(C
O)和Schiff碱(C![]() N)等物质[21]。此外,SPI与OKGM发生美拉德反应后,其在3 398 cm-1处的特征峰变宽且也发生了不同程度的蓝移,这与QU等[22]的研究结果一致,表明OKGM的共价接入使体系中羟基和氢键数目增加。
N)等物质[21]。此外,SPI与OKGM发生美拉德反应后,其在3 398 cm-1处的特征峰变宽且也发生了不同程度的蓝移,这与QU等[22]的研究结果一致,表明OKGM的共价接入使体系中羟基和氢键数目增加。
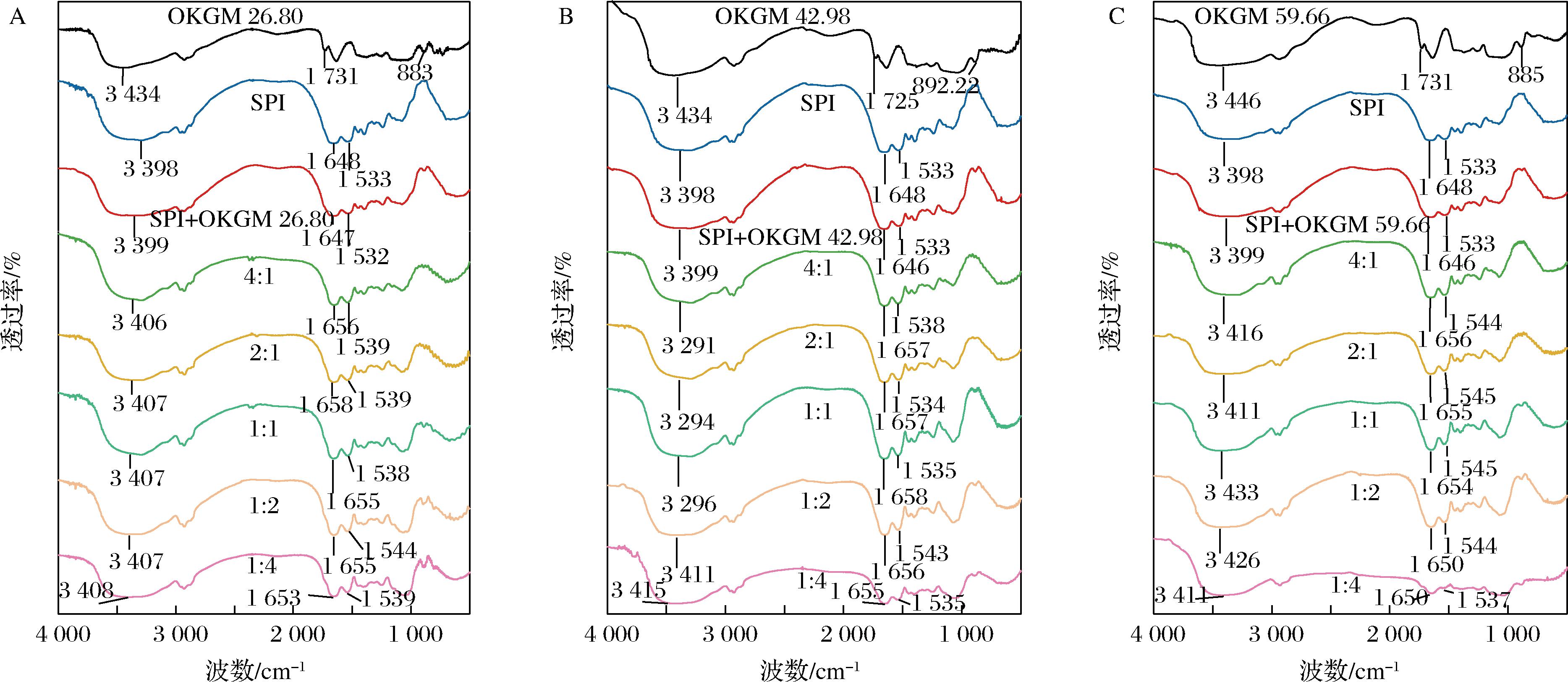
A-SPI-OKGM 26.80;B-SPI-OKGM 42.98;C-SPI-OKGM 59.66
图4 SPI与OKGM的质量比对SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66红外光谱的影响
Fig.4 Effect of mass ratio of SPI to OKGM on Fourier infrared spectrum of SPI-OKGM 26.80, SPI-OKGM 42.98, and SPI-OKGM 59.66

A-SPI;B-SPI+OKGM 26.80共混物;C-SPI+OKGM 42.98共混物;D-SPI+OKGM 59.66共混物;E-SPI-OKGM 26.80;F-SPI-OKGM 42.98;G-SPI-OKGM 59.66
图5 SPI、SPI+OKGM共混物以及SPI-OKGM的扫描电镜图
Fig.5 Scanning electron micrograph of SPI, SPI+OKGM mixture, and SPI-OKGM
注:放大倍数分别为300和1 000倍。
2.3.2 扫描电镜分析
图5为SPI、SPI+OKGM共混物以及SPI-OKGM的扫描电镜图。SPI呈现出紧凑的不规则片状结构,表面光滑(图5-A);SPI和3种不同氧化度的OKGM的共混物呈现片状堆叠的结构,并呈现黑白分明的2种颜色(图5-B~图5-D),表明SPI和OKGM仅是简单的混合,存在不均匀现象。与单一的蛋白相比,SPI与OKGM的美拉德反应产物呈现出相对松散的薄片状(图5-E~图5-G),说明美拉德反应使SPI空间结构延伸,OKGM进入并覆盖其表面,导致蛋白质之间的聚集程度显著降低[22-23]。
2.4 OKGM氧化度和SPI与OKGM的质量比对SPI乳化能力的影响
图6反映了SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66在不同SPI与OKGM质量比下的乳化活性(图6-A)和乳化稳定性(图6-B)。由图6-A可知,随着OKGM质量占比的增加,SPI-OKGM的乳化活性呈现先增大后减小的趋势。当SPI与OKGM质量比为1∶2、1∶1和1∶1时,SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的乳化活性增大至最大,分别为103.05、106.55、113.25 m2/g,这是因为SPI和OKGM结合,在油-水界面,增加空间位阻,利于形成亲-疏水平衡,接枝产物吸附在油水界面形成紧密的保护层,从而阻止了油滴的聚集[24]。随着OKGM质量占比继续增加,SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的乳化活性反而分别降低了33.81、13.83、5.93 m2/g,但始终高于单一SPI(36.39 m2/g)。同时,乳化稳定性结果与乳化活性结果有着相似的趋势(图6-B)。
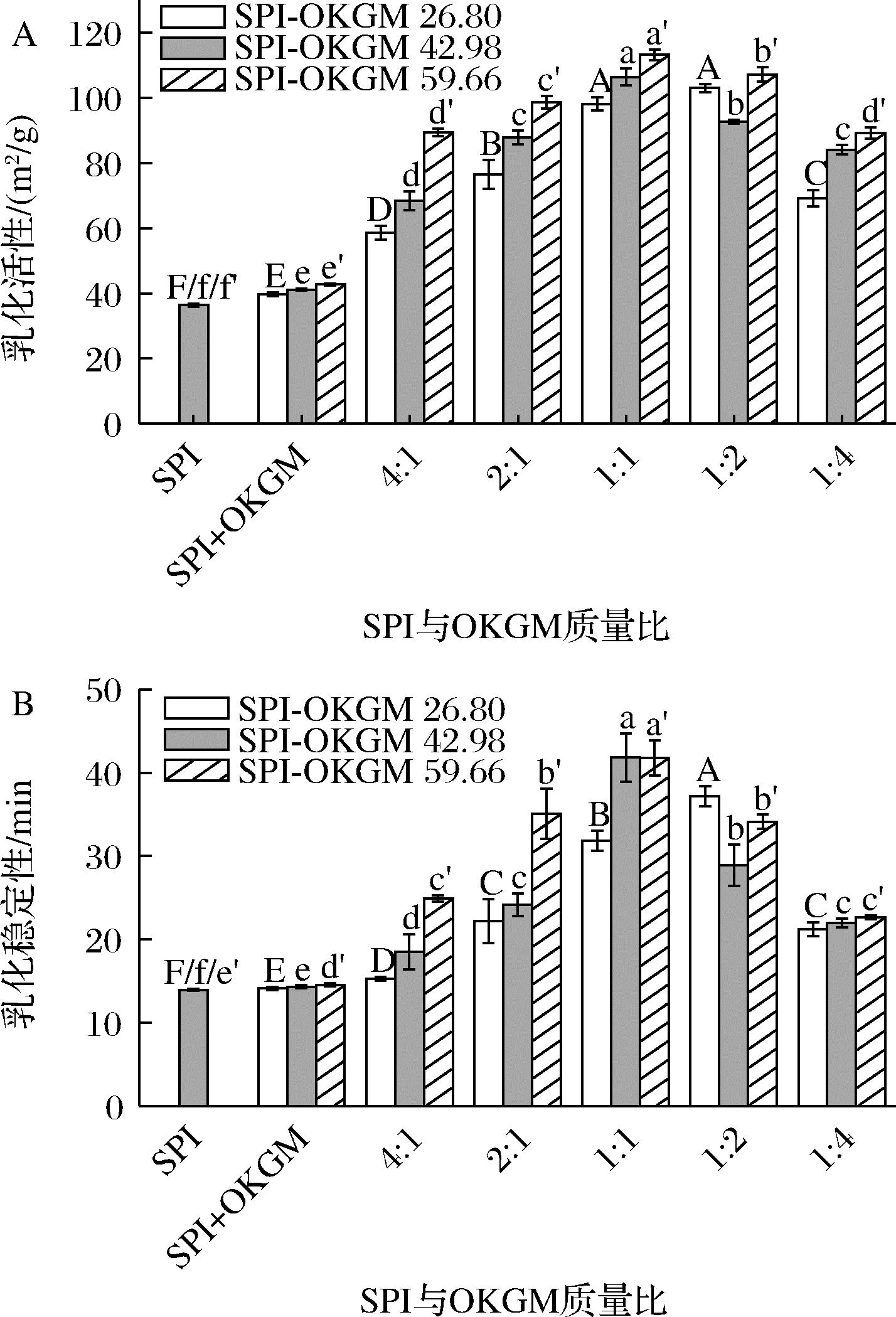
A-乳化活性;B-乳化稳定性
图6 OKGM氧化度和SPI与OKGM质量比对SPI-OKGM乳化活性及乳化稳定性的影响
Fig.6 Effect of oxidation degree of OKGM and mass ratio of SPI to OKGM on emulsifying activity and emulsifying stability of SPI-OKGM
2.5 OKGM氧化度和SPI与OKGM质量比对SPI抗氧化能力的影响
DPPH自由基清除率、还原力和抗脂质氧化能力均是评价物质抗氧化性能的重要指标。不同SPI与OKGM质量比下OKGM氧化度对SPI-OKGM的DPPH自由基清除率和还原力的影响如图7-A和图7-B所示。SPI与OKGM物理共混以及发生美拉德反应后,DPPH自由基清除率和还原力均增强,且与SPI+OKGM共混物(SPI与OKGM质量比为1∶1)相比,相同质量比下的SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的DPPH自由基清除率分别增加了42.98%、45.78%和47.91%;还原力分别增加了0.45、0.44和0.48,这是因为SPI与OKGM发生美拉德反应形成了具有抗氧化能力的中间体和类黑精等棕色聚合物[13],表明通过美拉德反应对SPI改性是提高SPI的抗氧化能力的有效途径。此外,SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的DPPH自由基清除率和还原力均随OKGM质量占比的增加呈现先增大后减小的趋势,与接枝度随质量比的变化趋势相似(图2)。
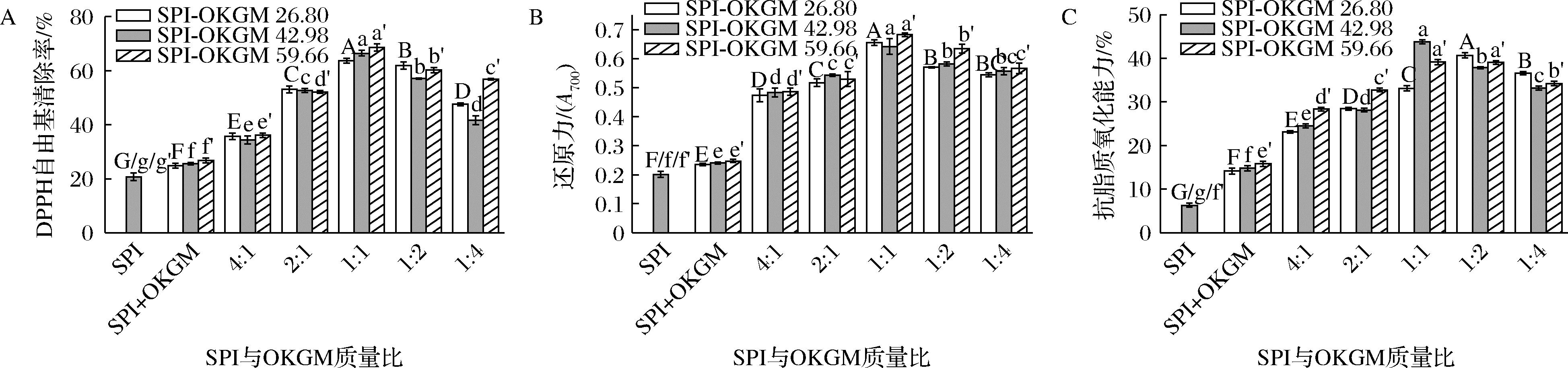
A-DPPH自由基清除率;B-还原力;C-抗脂质氧化能力
图7 OKGM氧化度和SPI与OKGM质量比对SPI-OKGM抗氧化能力的影响
Fig.7 Effect of oxidation degree of OKGM and mass ratio of SPI to OKGM on antioxidant activities of SPI-OKGM
图7-C显示了不同SPI与OKGM质量比下SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的抗脂质氧化能力。SPI与不同氧化度的OKGM以质量比1∶1物理共混后,抗脂质氧化能力显著提升,但低于相同质量比下SPI-OKGM的。随着SPI与OKGM从4∶1到1∶4,SPI-OKGM的抗脂质氧化能力呈现先增大后减小的趋势。SPI-OKGM 26.80、SPI-OKGM 42.98和SPI-OKGM 59.66的抗脂质氧化能力分别在SPI与OKGM质量比为1∶2、1∶1和1∶1时升高至最大,为40.68%、43.76%和39.16%。此外,除SPI与OKGM质量比为1∶2和1∶4时,SPI-OKGM 42.98和SPI-OKGM 59.66的抗脂质氧化能力均高于SPI-OKGM 26.80。
3 结论
本文研究了3种不同氧化度的OKGM在不同质量比下和SPI的美拉德反应。接枝度和褐变强度结果表明SPI-OKGM 59.66的美拉德反应程度更深,褐变更强。相比于SPI和SPI+OKGM共混物,SPI与OKGM在不同质量比下形成的美拉德反应产物的乳化性能和抗氧化性能明显提升。其中,当SPI与OKGM质量比为1∶1时,SPI-OKGM 59.66的乳化活性和乳化稳定性分别为113.25 m2/g和41.81 min,DPPH自由基清除率和还原力分别为68.57%和0.68,表现最佳的乳化性能和抗氧化性能。本结果为OKGM应用于SPI的美拉德反应改性提供了理论依据,为拓展SPI-OKGM美拉德反应产物在食品领域应用提供一定技术积累。
[1] SRIDHAR K, BOUHALLAB S, CROGUENNEC T, et al.Application of high-pressure and ultrasound technologies for legume proteins as wall material in microencapsulation:New insights and advances[J].Trends in Food Science &Technology, 2022, 127:49-62.
[2] 柳倩. 乳清分离蛋白的分子修饰构建低环境敏感型风味载体[D].无锡:江南大学, 2022.
LIU Q.Construction of low environment-sensitive flavor carriers via molecular modification of whey protein isolate Wuxi:Jiangnan University, 2022.
[3] MA X B, CHI C D, PU Y F, et al.Conjugation of soy protein isolate (SPI) with pectin:Effects of structural modification of the grafting polysaccharide[J].Food Chemistry, 2022, 387:132876.
[4] ZHANG C, CHEN J D, YANG F Q.Konjac glucomannan, a promising polysaccharide for OCDDS[J].Carbohydrate Polymers, 2014, 104:175-181.
[5] LI C, HUANG X J, PENG Q, et al.Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J].Ultrasonics Sonochemistry, 2014, 21(5):1722-1727.
[6] CUI T T, JIA A R, SHI Y P, et al.Improved stability and transshipment of enzymatic hydrolysate with ACE inhibitory activity-loaded nanogels based on glycosylated soybean protein isolate via the Maillard reaction[J].International Journal of Food Science &Technology, 2021, 56(9):4417-4427.
[7] 刘柳, 袁江兰, 靳艳, 等.魔芋多糖对大米蛋白的接枝改性[J].食品研究与开发, 2013, 34(6):14-17.
LIU L, YUAN J L, JIN Y, et al.Graft modification of rice protein by konjac polysaccharide[J].Food Research and Development, 2013, 34(6):14-17.
[8] CHEN Y Y, ZHAO H Y, LIU X W, et al.TEMPO-oxidized Konjac glucomannan as appliance for the preparation of hard capsules[J].Carbohydrate Polymers, 2016, 143:262-269.
[9] ZHU F.Modifications of konjac glucomannan for diverse applications[J].Food Chemistry, 2018, 256:419-426.
[10] ZHAO C B, YIN H H, YAN J N, et al.Structure and acid-induced gelation properties of soy protein isolate-maltodextrin glycation conjugates with ultrasonic pretreatment[J].Food Hydrocolloids, 2021, 112:106278.
[11] PENG X Q, XU Y T, LIU T X, et al.Molecular mechanism for improving emulsification efficiency of soy glycinin by glycation with soy soluble polysaccharide[J].Journal of Agricultural and Food Chemistry, 2018, 66(46):12316-12326.
[12] ZHANG Q Y, LONG X, XIE J, et al.Effect of D-galactose on physicochemical and functional properties of soy protein isolate during Maillard reaction[J].Food Hydrocolloids, 2022, 133:107914.
[13] YU M, HE S D, TANG M M, et al.Antioxidant activity and sensory characteristics of Maillard reaction products derived from different peptide fractions of soybean meal hydrolysate[J].Food Chemistry, 2018, 243:249-257.
[14] ZHAO S L, HUANG Y, MCCLEMENTS D J, et al.Improving pea protein functionality by combining high-pressure homogenization with an ultrasound-assisted Maillard reaction[J].Food Hydrocolloids, 2022, 126:107441.
[15] ZHANG Y T, TAN C, ZHANG X M, et al.Effects of maltodextrin glycosylation following limited enzymatic hydrolysis on the functional and conformational properties of soybean protein isolate[J].European Food Research and Technology, 2014, 238(6):957-968.
[16] WANG L, LIN L Z, GUO Y Y, et al.Enhanced functional properties of nanocomposite film incorporated with EGCG-loaded dialdehyde glucomannan/gelatin matrix for food packaging[J].Food Hydrocolloids, 2020, 108:105863.
[17] KORKIATITHAWEECHAI S, UMSARIKA P, PRAPHAIRAKSIT N, et al.Controlled release of diclofenac from matrix polymer of chitosan and oxidized konjac glucomannan[J].Marine Drugs, 2011, 9(9):1649-1663.
[18] MAO L K, PAN Q Y, HOU Z Q, et al.Development of soy protein isolate-carrageenan conjugates through Maillard reaction for the microencapsulation of Bifidobacterium longum[J].Food Hydrocolloids, 2018, 84:489-497.
[19] HE W Y, TIAN L, ZHANG S S, et al.A novel method to prepare protein-polysaccharide conjugates with high grafting and low browning:Application in encapsulating curcumin[J].LWT, 2021, 145:111349.
[20] DAI S C, LIAN Z T, QI W J, et al.Non-covalent interaction of soy protein isolate and catechin:Mechanism and effects on protein conformation[J].Food Chemistry, 2022, 384:132507.
[21] WANG X, WANG S J, XU D X, et al.The effect of glycosylated soy protein isolate on the stability of lutein and their interaction characteristics[J].Frontiers in Nutrition, 2022, 9:887064.
[22] QU W J, ZHANG X X, HAN X, et al.Structure and functional characteristics of rapeseed protein isolate-dextran conjugates[J].Food Hydrocolloids, 2018, 82:329-337.
[23] WANG Y Y, ZHANG A Q, WANG X B, et al.The radiation assisted-Maillard reaction comprehensively improves the freeze-thaw stability of soy protein-stabilized oil-in-water emulsions[J].Food Hydrocolloids, 2020, 103:105684.
[24] MA X B, CHEN W J, YAN T Y, et al.Comparison of citrus pectin and apple pectin in conjugation with soy protein isolate (SPI) under controlled dry-heating conditions[J].Food Chemistry, 2020, 309:125501.