小麦面筋蛋白,俗称谷朊粉或活性小麦面筋[1],是小麦粉的重要组成部分,约占小麦粉的13%。面筋蛋白具有优良的黏弹性、吸水性、延展性和薄膜成型性等[2],凭借这些物理特性,面筋蛋白被广泛应用于食品和饲料工业中。以食品行业为例,在我国古代就有食用面筋蛋白制成的食品的惯例,如素鸡、香肠、肉冻等,随着现代科技发展,人们对面筋蛋白也有了更加充分的认知,于是面筋蛋白作为食品添加剂被广泛应用于各类食品制造中。有研究证明,在制作面条时加入面筋蛋白可以有效地改善其蒸煮品质,且可以提升其抗拉强度与韧性[3]。除此之外,人造肉作为一个新兴领域,面筋蛋白也在其中起到相当的作用,MASTROMATTEO等[4]发现面筋蛋白独特的形成网络的能力可以促进人造肉所用蛋白的组织化,张丙虎[5]通过实验发现面筋蛋白可以改善人造肉的质构特性。
小麦制粉工艺中将小麦胚乳粉碎后进行重组,分为前路粉、中路粉和后路粉,前路粉主要来自于小麦胚乳芯部的物料,后路粉主要来自小麦胚乳外部的物料。国内外已有不少对前中后路粉的相关研究,贾祥祥等[6]发现,前路粉的水分、灰分、降落数值等显著高于后路粉,而灰分和蛋白质含量则是后路粉显著高于前路粉;李巍[7]发现从前路粉到后路粉的白度呈下降趋势,吸水率则是呈上升趋势。出于经济因素考虑,我国目前小麦谷朊粉的生产主要采用中后路粉,面条、馒头等蒸煮类面食食品主要采用前路和中路的小麦粉。本文通过对小麦生产线前、中、后路不同出粉部位的小麦粉分离出的面筋蛋白进行特性测定与差异化分析,明确小麦前中后路粉的面筋蛋白差异规律性,为工业中谷朊粉生产的原料选择提供依据。
1 材料与方法
1.1 材料与试剂
某面粉厂生产线基础粉:AF1、AF2、AF3、ABZ(AF1为前路粉,AF2为中路粉,AF3、ABZ为后路粉);Tris、甘氨酸、EDTA二钠、5,5′-二硫代双(2-硝基苯甲酸)[5,5′-dithiobis-(2-nitrobenzoic acid),DTNB]、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、磷酸缓冲液(pH=7)、溴酚蓝,以上试剂均为分析纯级。
1.2 仪器与设备
JHMZ型针式和面机,北京东方孚德科技发展中心;冷冻干燥机,北京亚星仪科科技发展有限公司;马弗炉,上海跃进医疗器械厂;FossKjeltec8400全自动凯氏定氮仪,福斯分析仪器公司;恒温水浴振荡器,金坛市华峰仪器有限公司;DL-5-B离心机,上海跃进医疗器械厂;紫外分光光度计,上海奥析科学仪器有限公司;哈克RS6000流变仪,德国Haake公司。
1.3 实验方法
1.3.1 制样
面筋蛋白的制备参考徐小青等[8]的方法并稍加修改,取30 g面粉与15 mL蒸馏水放置和面机中和面3 min,和面完成后置于室温醒发25 min,醒发完成后用足量蒸馏水揉洗面团,并将蒸馏水中的面团碎片收集重新加入面团,如此反复直至揉洗后的蒸馏水清澈无浑浊且加入碘液后碘液不变蓝。将洗出的湿面筋置于冰柜冷冻10 h后在放入冷冻干燥机里干燥36 h,再将干燥完成的面筋用研磨磨成粉过100目筛即得样品,样品放于5 ℃环境下保存。
1.3.2 基本理化指标
水分的测定参考GB 5009.3—2016方法;灰分的测定参考GB 5009.4—2016方法;蛋白质的测定参考GB 5009.5—2016方法;吸水率的测定参考GB/T 21924—2008方法;面筋指数的测定参考LS/T 6102—1995方法。
1.3.3 游离巯基
参考LUO等[9]的方法并稍加修改。先制备Tris-Gly缓冲液(取5.214 g Tris、3.378 g甘氨酸与0.744 5 g EDTA二钠溶于一定量蒸馏水再定容至500 mL),取50 mL Tris-Gly缓冲液加入0.2 g DTNB混匀制得DTNB溶液,再称量2.5 g SDS溶于100 mL Tris-Gly缓冲液得到SDS-Tris-Gly缓冲液。取50 mg面筋蛋白溶于6 mL SDS-Tris-Gly缓冲液中于水浴振荡器反应70 min(反应期间每10 min取出样品并涡旋振荡30 s),再于2 000×g的条件下离心15 min,取1 mL离心后上清液加入50 μL DTNB,反应30 min后,在412 nm处测定吸光度(空白组设为蒸馏水)。游离巯基含量计算如公式(1)所示:
游离疏基量![]()
(1)
式中:A412为空白组在412 nm处测得的吸光度;C取8 mg/mL,代表蛋白质质量浓度。
1.3.4 表面疏水性
参考CHELHI等[10]的方法并稍加修改,取15 mg面筋蛋白置于1.5 mL 20 mmol/L磷酸盐缓冲液中(pH 7.0)中充分混匀,再加入300 μL 1 mg/mL溴酚蓝指示剂于涡旋振荡器上振荡2 min,之后于4 000×g的条件下离心10 min,取上清液再稀释至10 mL,用酶标仪在595 nm下测其吸光度(空白组设为蒸馏水)。溴酚蓝结合量计算如公式(2)所示:
溴酚蓝结合量![]()
(2)
式中:A空为空白组在595 nm处测得的吸光度,A样为样品在595 nm处测得的吸光度。
1.3.5 麦谷蛋白大聚体(glutenin macropolymer,GMP)
参考任佳影等[11]的方法并加以修改,取0.5 g面筋蛋白溶于10 mL 1.5 g/100 mL SDS提取液,于室温条件下置于水浴振荡器振荡1 h,在9 000×g条件下离心15 min,弃去上清液,重复上述步骤一次。得到的沉淀使用自动凯氏定氮仪测定蛋白质含量。
1.3.6 流变学特性
按照1.3.1节的方法制取湿面筋,再将湿面筋放置于哈克流变仪2个35 mm平行板之间,板间间隙设置为1 mm。湿面筋安置好后挂掉溢出的湿面筋,再用矿物油封存间隙四周,静置5 min后开始频率扫描与蠕变回复。频率扫描参数设置为温度(25±0.1) ℃;固定应力15 Pa;频率范围0.1~10 Hz,蠕变回复参数设置为温度(25±0.1) ℃;固定应力15 Pa;蠕变时间300 s;恢复时间600 s。
1.4 数据处理与分析
将实验数据汇总于Excel 2021进行整理,使用Origin2022 64bit进行绘图,IBM SPSS20进行数据分析。
2 结果与分析
2.1 小麦前中后路粉面筋蛋白基本理化指标分析
表1是小麦前中后路粉的基础理化指标。由表1可知,前中后路粉面筋蛋白的灰分与蛋白含量呈现上升趋势,吸水率、白度与面筋指数总体呈现下降趋势。这可能是因为灰分物质主要集中在小麦麸皮处,而前路粉主要是由小麦胚乳部分研磨而成,灰分物质在小麦粉分离面筋蛋白时不溶于水,故后路粉面筋蛋白灰分含量显著高于前路粉面筋蛋白。前中后路粉面筋蛋白的蛋白含量呈现上升趋势,这是因为小麦粉的蛋白质主要集中在小麦颗粒的胚乳与糊粉层中,其胚乳蛋白含量由内到外逐步增加,蛋白品质逐步下降[12],且后路粉研磨过程中会掺有表皮等杂质导致后路粉面筋蛋白含量显著高于前路粉面筋蛋白。面筋蛋白的面筋强度是指小麦粉湿面筋在离心力的作用下通过一定孔径筛板后筛下物与原湿面筋质量之比,它体现了该面筋蛋白的强度,在制粉过程中,后路粉经过多次研磨,其面筋网络结构可能遭到破坏,因此面筋指数低于前路粉。
表1 小麦前中后路粉面筋蛋白基本理化指标 单位:%
Table 1 Basic physicochemical indexes of wheat flour gluten protein in anterior, middle, and posterior routes
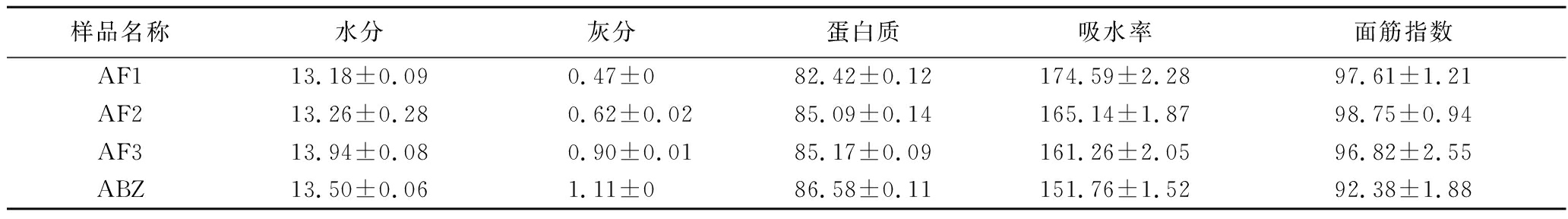
样品名称水分灰分蛋白质吸水率面筋指数AF113.18±0.090.47±082.42±0.12174.59±2.2897.61±1.21AF213.26±0.280.62±0.0285.09±0.14165.14±1.8798.75±0.94AF313.94±0.080.90±0.0185.17±0.09161.26±2.0596.82±2.55ABZ13.50±0.061.11±086.58±0.11151.76±1.5292.38±1.88
2.2 小麦前中后路粉面筋蛋白游离巯基含量分析
小麦面筋蛋白中的麦谷蛋白和麦醇溶蛋白主要依靠二硫键来维持结构[13-14],而蛋白质中二硫键与游离巯基是相互转换的关系,游离巯基含量增多说明二硫键发生了断裂,蛋白质三级结构遭到破坏,蛋白质空间稳定性下降,所以游离巯基可以作为观测蛋白质结构稳定性的一个重要指标[15]。不同出粉点对小麦面筋蛋白的游离巯基含量影响如图1所示,图中的a、b、c、d标注代表了前中后路粉的游离巯基含量依次显著性增加(P=0.014<0.05)。这说明在出粉点靠前的条件下,面筋蛋白更容易聚集,二硫键数量增多,空间结构更加稳定,而经过多次筛选聚集研磨的后路粉蛋白质品质没有前路粉蛋白质品质高,且后路粉中的麦谷蛋白含量没有前路粉高[16],故游离巯基含量增多,这也与SUTTON等[17]的研究结果相符合。
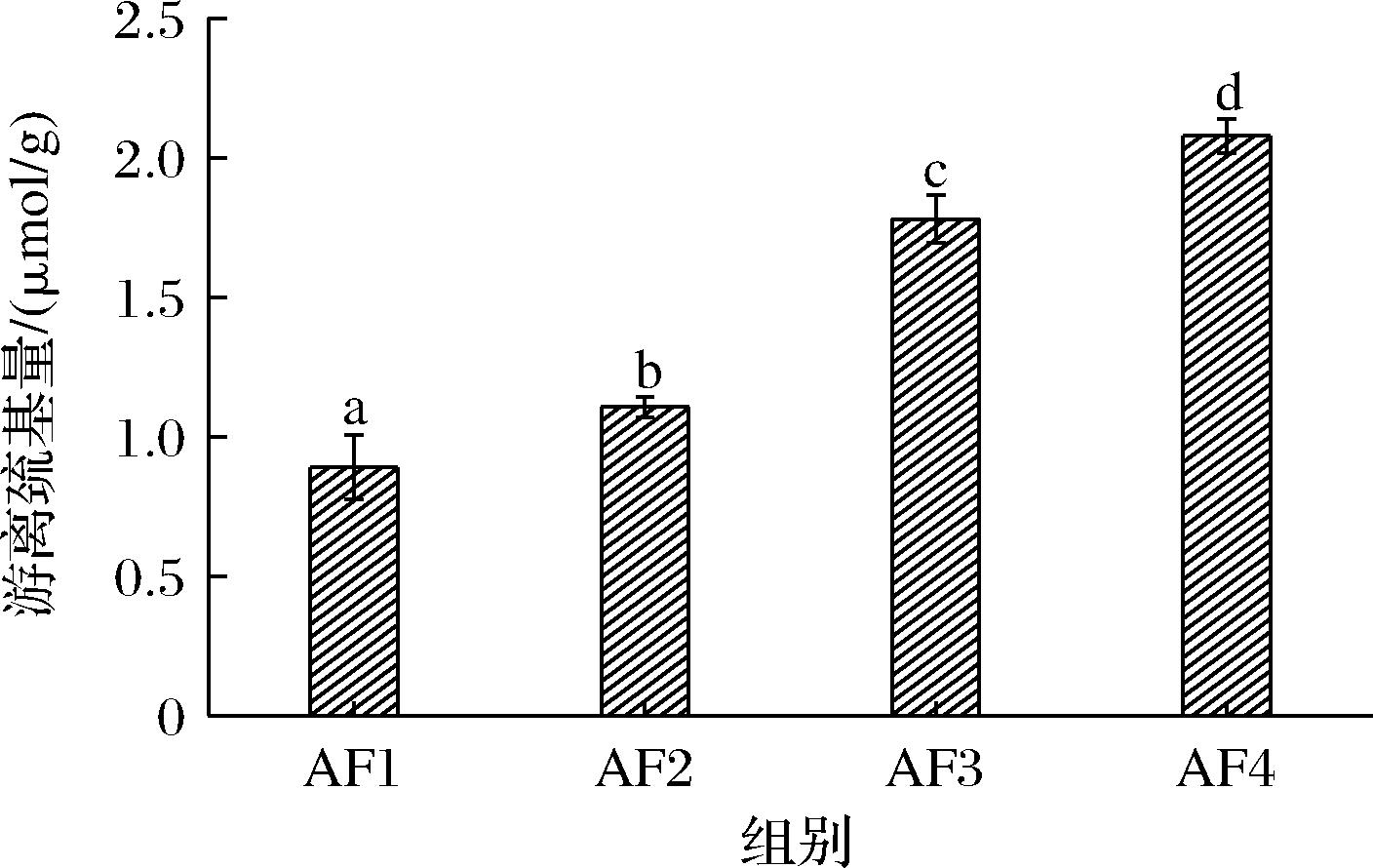
图1 小麦前中后路粉面筋蛋白游离巯基含量
Fig.1 Content of free sulfhydryl groups in wheat gluten in anterior, middle, and posterior routes
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.3 小麦前中后路粉面筋蛋白表面疏水性分析
蛋白质的表面疏水性是指暴露在蛋白质分子表面且可以键合疏水键团的数量[18],其与蛋白质理化性质、结构特性、加工方法以及条件有关。表面疏水性可以体现出蛋白质空间构象的稳定性,反映出分子间相互作用的强度,一般来说,表面疏水性越强蛋白质空间稳定性越差。此外,表面疏水性还可以体现出蛋白质的变性程度[19]。本次实验采用更适合溶解度低的溴酚蓝法,溴酚蓝结合量越多,代表面筋蛋白的表面疏水性越强。前中后路粉的表面疏水性差异如图2所示,图中a、b、c、d标注说明了4种面粉面筋蛋白的表面疏水性依次增加且样品间均存在极显著性差异(P=0.00<0.01),AF1粉面筋蛋白表面疏水性最弱,表明了其蛋白表面疏水基团数量最少,空间结构最稳定,这是因为前路粉面筋蛋白纯度高杂质少,而ABZ粉面筋蛋白表面疏水性最强是因为与后路粉相比,前路粉会经过多次研磨,机械运动破坏了蛋白质空间结构,使得蛋白质之间的疏水相对作用下降,蛋白质分子链展开,疏水基团暴露出来,并且后路粉面筋蛋白中还可能存在其他诸如麸皮等杂质影响了其表面疏水性。
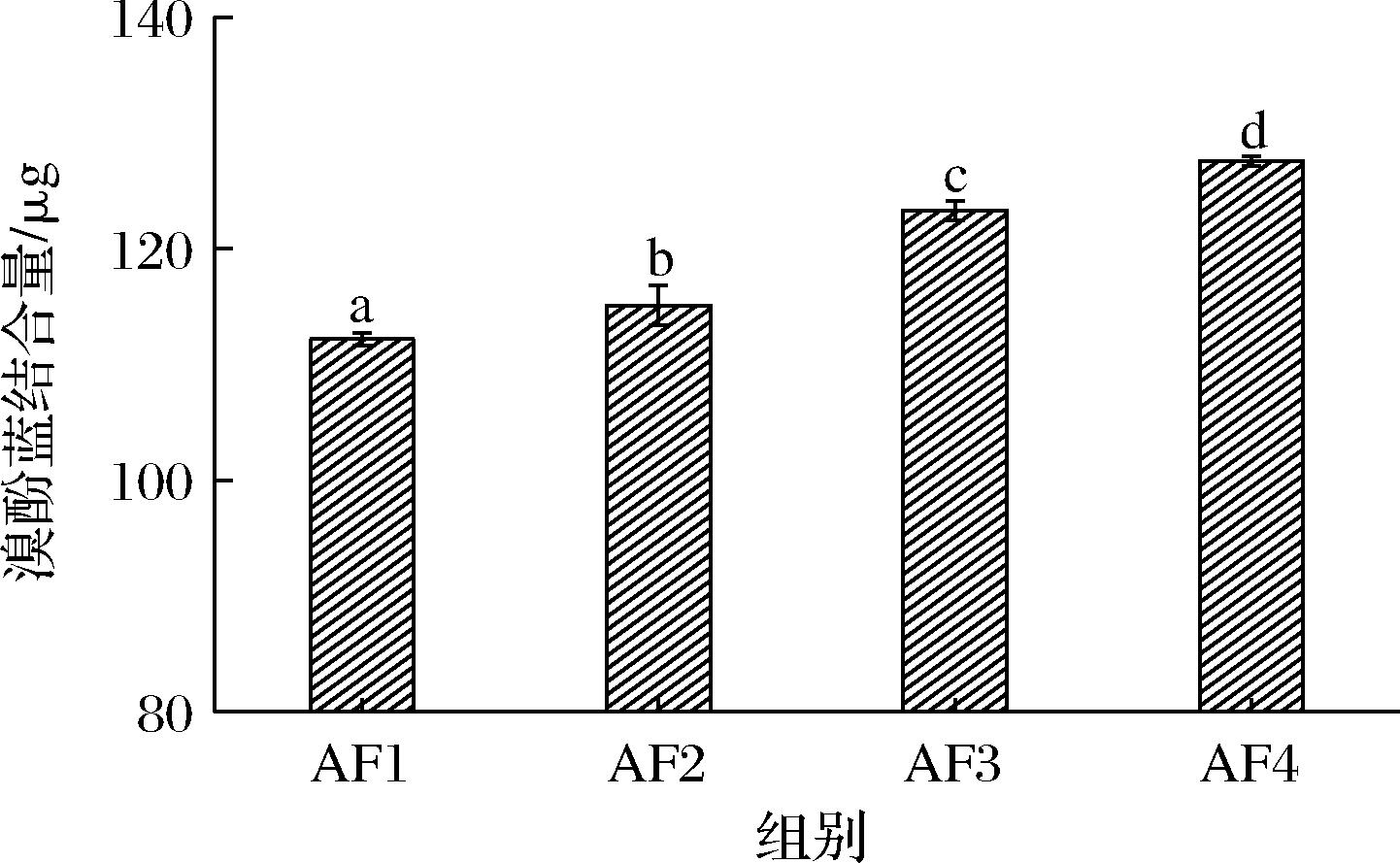
图2 小麦前中后路粉面筋蛋白表面疏水性差异
Fig.2 Surface hydrophobicity difference of wheat flour gluten protein in anterior, middle, and posterior routes
2.4 小麦前中后路粉面筋蛋白GMP分析
麦谷蛋白可以根据分子质量分为高分子质量亚基和低分子质量亚基,麦谷蛋白亚基通过二硫键相互作用集聚而成的聚合体被称为GMP[20],它是面筋蛋白物理特性的主要决定因素,其数量和特性与蛋白质的流变特性密切相关。前中后路粉面筋蛋白GMP含量如图3所示,前中后路粉GMP含量呈下降趋势,其中AF1粉与AF2粉虽符合下降趋势但是趋势不明显,AF3粉与ABZ粉下降趋势极显著,这是因为出粉点靠前的面粉中的蛋白质虽然含量较少,但是蛋白纯度高质量好,麦谷蛋白聚合程度高,而出粉点靠后的面粉由于多次磨粉机械运动,GMP发生解聚导致GMP含量下降,此外GMP含量可以侧面说明该蛋白质二硫键数量与游离巯基含量变化,当GMP含量下降时反映了该蛋白二硫键数量下降,游离巯基含量增多,这与游离巯基实验结果相吻合。
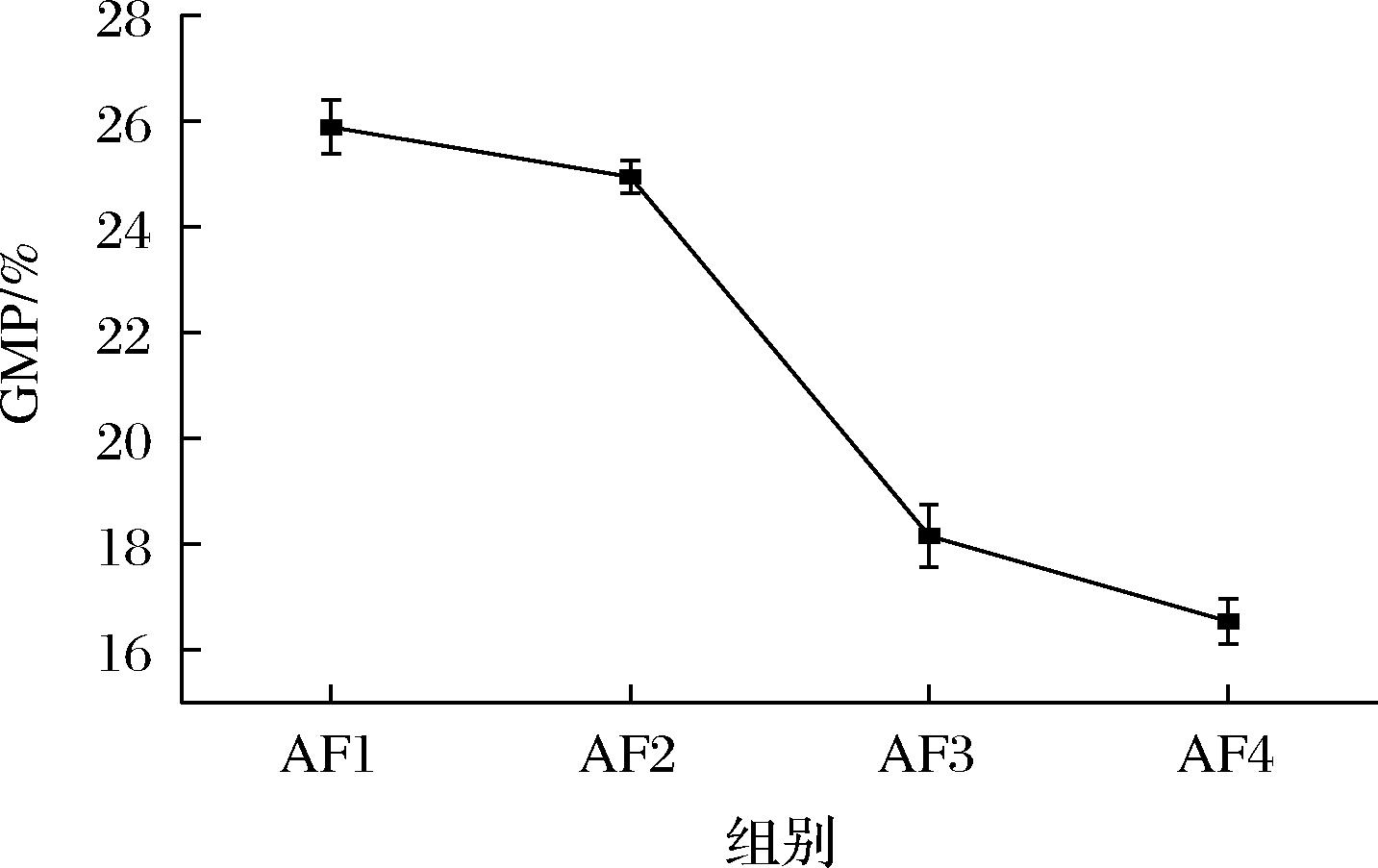
图3 小麦前中后路粉面筋蛋白GMP含量
Fig.3 GMP content of wheat flour gluten protein in anterior, middle, and posterior routes
2.5 小麦前中后路粉面筋蛋白流变学特性分析
2.5.1 小麦前中后路粉面筋蛋白频率扫描分析
在流变学实验中,G′代表储能模量,它可以反映该物质的弹性,G″代表损耗模量,它可以反映该物质的黏性。小麦前中后路粉面筋蛋白流变学特性差异如图4-a和图4-b所示,随着频率的上升,无论是储能模量还是损耗模量,前中后路粉面筋蛋白均呈现上升趋势,其中AF1粉面筋蛋白的储能模量和损耗模量最大,AF2、AF3、ABZ三种粉面筋蛋白依次降低,这说明了4种面筋蛋白里AF1的黏弹性最大,ABZ的黏弹性最小,间接说明了AF1粉的面筋蛋白麦谷蛋白与麦醇溶蛋白含量高质量好,面筋网络结构更加稳定,ABZ粉面筋蛋白面筋质量最差。损耗正切角tanδ是损耗模量与储能模量的比值,它可以反映该物质的流动性,tanδ越小,说明该物质流动性越差,物质组分中的高聚物占比越大[21],从图4-c可以看出AF1~ABZ粉面筋蛋白的损耗正切角随着频率上升基本呈现上升趋势,其中ABZ最大,AF1最小,4种面筋蛋白均小于1,说明了4种面筋蛋白均弹性大于黏性,且AF1面筋蛋白流动性最差,高聚物GMP含量最高,ABZ面筋蛋白流动性最好,高聚物GMP含量最低,这也与GMP测定实验结果相吻合。
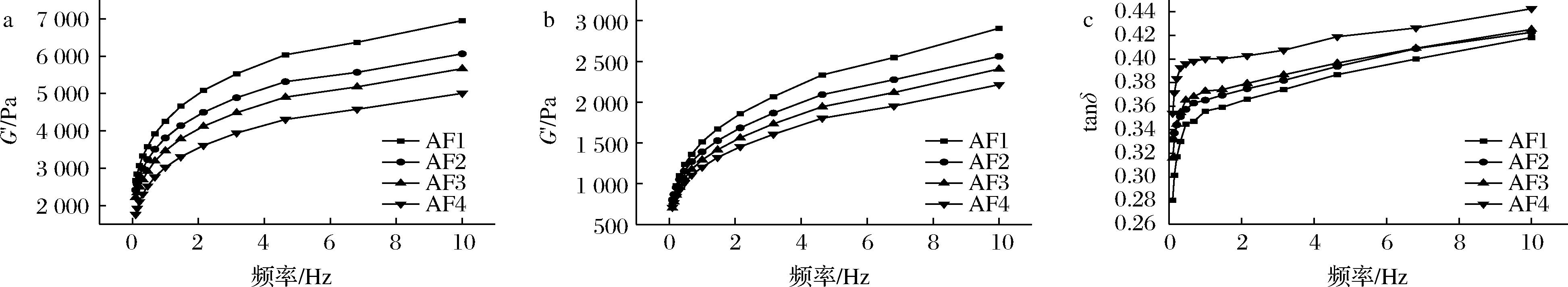
a-储能模量;b-损耗模量;c-损耗正切角
图4 小麦前中后路粉面筋蛋白储能模量、损耗模量与损耗正切角随频率变化曲线图
Fig.4 The energy storage modulus, loss modulus, and loss tangent angle of wheat gluten protein in anterior, middle, and posterior routes as a function of frequency
2.5.2 小麦前中后路粉面筋蛋白蠕变恢复分析
小麦面筋蛋白的蠕变恢复分为2个阶段,第一阶段是面筋蛋白受作用于它的外力影响发生一定形变,这一阶段被称为蠕变阶段,第二阶段是是外力撤销后面筋蛋白形变量随时间变化,这一阶段被称为恢复阶段。面筋蛋白的蠕变回复特性可以体现出其黏弹特性,在该实验中,样品的弹性越大,其越不容易发生形变且越容易恢复到最小形变量,即样品的弹性与它的最大形变量呈反比[22]。4种面筋蛋白的蠕变回复曲线如图5所示,AF1粉面筋蛋白的最大形变量与不可恢复形变量明显低于ABZ粉面筋蛋白,由此可知,前路粉面筋蛋白的弹性最好,后路粉面筋蛋白弹性最差,这也与频率扫描结果相吻合。
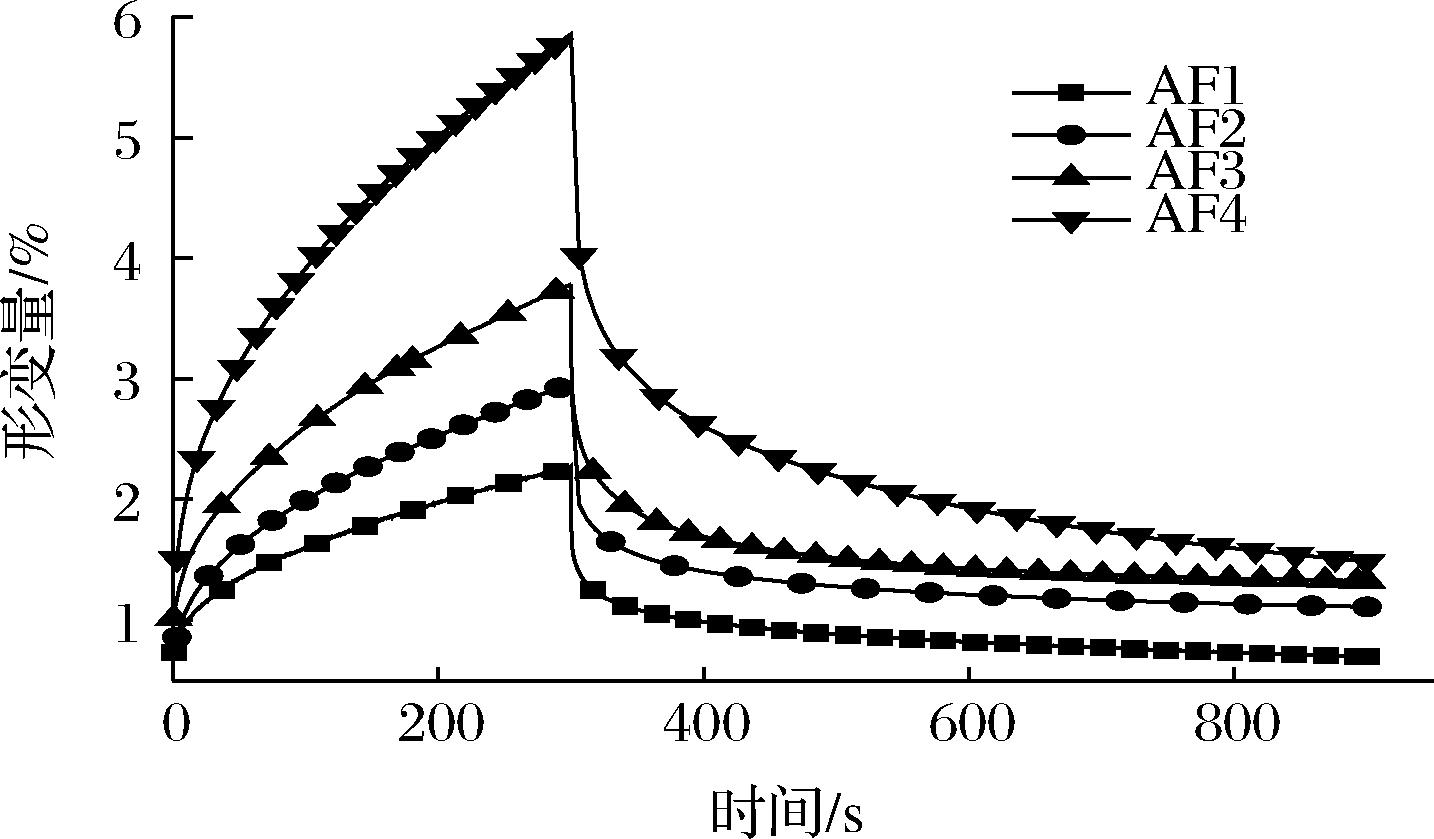
图5 小麦前中后路粉面筋蛋白蠕变恢复曲线
Fig.5 Creep recovery curve of wheat flour gluten protein in anterior, middle, and posterior routes
3 结论与展望
本实验通过对同种小麦不同出粉点面粉的面筋蛋白进行基本理化指标测定,同时对其结构特性与流变学特性进行评测,发现不同粉路面粉的面筋蛋白的组分分布以及空间结构特性存在一定规律性显著差异,前中后路粉面筋蛋白的灰分与蛋白含量呈现上升趋势,而吸水率与面筋指数呈现下降趋势,4种面筋蛋白游离巯基数量与表面疏水性由前路到后路依次增加,而GMP含量则是后路粉面筋蛋白显著低于前路粉面筋蛋白。在流变学实验中,前路粉面筋蛋白的储能模量与损失模量均显著高于后路粉面筋蛋白,在蠕变回复阶段后路粉面筋蛋白最大形变量与不可恢复形变量显著高于前路粉面筋蛋白。
目前国内外对系统粉的研究主要集中在不同粉路制品的差异性分析中,而对不同粉路面筋蛋白的研究较少,小麦前路粉蛋白质主要集中在其胚乳部分,而小麦后路粉蛋白质主要集中在小麦籽粒的糊粉层中,故在制作小麦面制品时,选用前路粉制作的面制品其蛋白品质要优于原料为后路粉的制品但经济性并无优势。因此在实际生产加工过程中,可以依据前中后路粉的面筋蛋白差异性,在满足质量与经济需求的前提下为最终制品选用较为适合的原料粉。
[1] 章旭. 小麦面筋蛋白的复合改性研究[D].无锡:江南大学,2011.
ZHANG X.Study on compound modification of wheat gluten protein[D].Wuxi:Jiangnan University,2011.
[2] 张令文,李欣欣,王雪菲,等.不同品种小麦面筋蛋白的功能性质[J].食品工业科技,2022,43(12):77-83.
ZHANG L W, LI X X, WANG X F, et al.Functional properties of gluten from different wheat cultivars[J].Science and Technology of Food Industry, 2022, 43(12):77-83.
[3] 李翠翠,刘晓静,李永丽.面筋蛋白在面条领域的影响研究进展[J].食品工业,2021,42(3):239-242.
LI C C, LIU X J, LI Y L.Progress in the effect of gluten protein in the noodle field[J].The Food Industry,2021,42(3):239-242.
[4] MASTROMATTEO M, CHILLO S, BUONOCORE G G, et al.Effects of spelt and wheat bran on the performances of wheat gluten films[J].Journal of Food Engineering, 2008, 88(2):202-212.
[5] 张丙虎.小麦谷朊粉挤压组织化特性研究[D].北京:中国农业科学院,2010.
ZHANG B H.Extrusion texturization properties of vital wheat gluten[D].Beijing:Chinese Academy of Agricultural Scienc-es, 2010.
[6] 贾祥祥,田红玉,张涛,等.制粉车间不同出粉点小麦粉品质特性研究[J].粮食与饲料工业,2017(11):9-12;16.
JIA X X, TIAN H Y, ZHANG T, et al.Quality characteristics of wheat flour in different meal outlet in flour milling workshop[J].Cereal & Feed Industry,2017(11):9-12;16.
[7] 李巍. 制粉工艺中不同出粉点的品质特性分析[J]. 面粉通讯, 2005, 19(3): 12-16.
LI W. Analysis of quality characteristics of different milling points in milling process[J]. Flourmilling, 2005, 19(3): 12-16.
[8] 徐小青,郭祯祥,郭嘉.麦醇溶蛋白与麦谷蛋白比值对面团特性的影响[J].河南工业大学学报(自然科学版),2020,41(2):27-33.
XU X Q, GUO Z X, GUO J.Effect of the ratio of gliadin to glutenin on dough characteristics[J].Journal of Henan University of Technology (Natural Science Edition),2020,41(2):27-33.
[9] LUO Y, LI M, ZHU K X, et al.Heat-induced interaction between egg white protein and wheat gluten[J].Food Chemistry, 2016, 197(Pt A):699-708.
[10] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4):681-683.
[11] 任佳影,陈洁,张九魁.碱面团在和面过程中面筋网络结构变化的影响[J].食品工业,2019,40(8):155-158.
REN J Y, CHEN J, ZHANG J K.Effect of alkali dough on the structure change of gluten in the process of smoothing[J].The Food Industry,2019,40(8):155-158.
[12] 王爱华,郑学玲.小麦制粉过程前、中、后路粉品质及流变学特性差异分析[J].河南工业大学学报(自然科学版),2021,42(1):8-14.
WANG A H, ZHENG X L.Analysis on the difference of flour quality and rheological characteristics before, during and after wheat milling process[J].Journal of Henan University of Technology (Natural Science Edition),2021,42(1):8-14.
[13] STANCIUC N, BANU I, BOLEA C, et al. Structural and antigenic properties of thermally treated gluten proteins[J]. Food Chemistry, 2017, 267(30): 43-51.
[14] WANG K Q, LUO S Z, ZHONG X Y, ET AL. Changes in chemical interactions and protein conformation during heat-induced wheat gluten gel formation[J]. Food Chemistry, 2017, 214: 393-399.
[15] WANG P, CHEN H Y, MOHANAD B, et al.Effect of frozen storage on physico-chemistry of wheat gluten proteins:Studies on gluten-, glutenin- and gliadin-rich fractions[J].Food Hydrocolloids, 2014, 39:187-194.
[16] 谷玉娟,林江涛,陈婷婷,等.制粉流程中各系统粉蛋白品质特性分析[J].现代面粉工业,2017,31(6):5-9.
GU Y J, LIN J T, CHEN T T, et al.Analysis on the quality characteristics of flour protein in each system in milling process [J].Modern Flour Milling Industry, 2017,31(6):5-9.
[17] SUTTON K H, SIMMONS L D.Molecular level protein composition of flour mill streams from a pilot-scale flour mill and its relationship to product quality[J].Cereal Chemistry,2006,83(1):52-56.
[18] 殷春燕,昝立峰,邢浩春,等.超声辅助提取对蛋白质的功能性质和结构影响的研究进展[J].食品科技,2022,47(1):246-253.
YIN C Y, ZAN L F, XING H C, et al. Recent advances on the effect of ultrasound-assisted extraction on the structure and functional properties of protein[J].Food Science and Technology, 2022,47(1):246-253.
[19] 王博,伊东,谢梦颖,等.糖基化大豆分离蛋白对肌原纤维蛋白功能特性的影响[J].食品科学,2017, 38(7):63-69.
WANG B, YI D, XIE M Y, et al.Effect of glycosylated soybean protein isolate on functional properties of myofibrillar protein[J].Food Science,2017, 38(7):63-69.
[20] 柳甜甜. 酸面团发酵过程中麦谷蛋白大聚体的降解[D].郑州:河南工业大学,2017.
LIU T T.Degradation of glutenin macropolymer during sourdough fermentation[D].Zhengzhou:Henan University of Technology,2017.
[21] 安兆鹏,王然,赵文哲,等.小麦麸皮对面团及面筋蛋白特性的影响[J].食品研究与开发,2018,39(9):11-17.
AN Z P, WANG R, ZHAO W Z, et al.Effects of wheat bran on dough and gluten characteristics[J].Food Research and Development,2018,39(9):11-17.
[22] 王爱华.小麦前路粉和后路粉分离淀粉与谷朊粉特性差异性分析[D].郑州:河南工业大学,2021.
WANG A H.Analysis of the difference in the characteristics of starch and gluten powder separated from the front road a-nd rear road flour of wheat flour[D].Zhengzhou:Henan university of technology, 2021.