D-阿洛酮糖(D-allulose)是D-果糖C3位置的差向异构体[1],具有与蔗糖相似的口感,但代谢产生的能量只有蔗糖的0.3%,还具有改善胰岛素抵抗和预防糖尿病的功能[2-3],还可以提升啮齿动物的抗肥胖作用,防止2型糖尿病的发展,并改善大鼠血脂异常[4-5]。糖尿病和肥胖症是全球日益严重的健康问题,具有低热量和预防糖尿病等功能的天然甜味剂D-阿洛酮糖受到广泛关注[6],作为蔗糖的替代品具有重要的研究和应用价值[7]。
D-阿洛酮糖在自然界中的含量很低,提取成本极高,直接提取法很难满足市场需求;此外,化学合成法反应条件苛刻,污染环境,副产物分离困难,难以实现产业化[8]。生物合成法则有周期短、成本低、对环境影响较小等优势,目前,已成为生产D-阿洛酮糖的主要方法。GU等[9]在培养大肠杆菌中进行了培养基优化并对诱导条件进行研究,还研究了摇瓶培养中提高大肠杆菌分泌DAE的策略,使活性达3.5 U/mL。李秋凤等[10]对大肠杆菌的培养条件进行了优化,优化后DAE的酶活可达10.11 U/g,以120 g/L的D-果糖为底物全细胞催化0.5 h后,D-阿洛酮糖产量为11.47 g/L。
本文以实验室构建表达D-阿洛酮糖3-差向异构酶(D-allulose 3-epimerase, DAE)的重组大肠杆菌为发酵菌株,研究发酵培养基及发酵条件对重组菌株生长和酶活的影响。通过优化重组大肠杆菌培养基碳源、氮源以及金属离子的组成和浓度,提高了菌体密度和单位体积酶活;在此基础上,对接种量、装液量、诱导时间等培养条件进行优化,使得单位体积酶活进一步提高;最终在5 L发酵罐中进行批式发酵,实现了重组大肠杆菌的高密度培养,大大提高了DAE酶活,对D-阿洛酮糖3-差向异构酶的发酵生产具有重要的参考价值。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
实验菌株为本研究室构建的大肠杆菌BL21-pET22b-CbDAE菌株,所表达DAE来自Clostridium bolteae,Genbank登录号:EDP19602.1。
1.1.2 培养基
LB培养基(g/L):胰蛋白胨10、酵母浸粉5、氯化钠10,pH自然。
LBA培养基:在LB培养基的基础上加入氨苄青霉素,终质量浓度为100 mg/L。
初始发酵培养基(g/L):基于SUN等[11]方法改进,葡萄糖30、酵母浸粉8、蛋白胨4、(NH4)2SO4 3、KH2PO4 3、MgSO4 0.5,pH 7。
以上培养基灭菌条件为121 ℃,20 min。
1.2 仪器与设备
Agilent 8453紫外分光光度计、Agilent 1200高效液相色谱仪,安捷伦科技有限公司;5 L自动控制发酵罐,上海百伦生物科技有限公司;Sugar-Pak I Column色谱柱,Waters;LS-B50 L立式蒸汽压力锅,上海华线医用核子仪器有限公司。
1.3 实验方法
1.3.1 菌株培养方法
1.3.1.1 活化
将保藏于-80 ℃的重组大肠杆菌划线接种于LBA液体培养基中,37 ℃培养12 h后转接于LBA固体平板,37 ℃静置培养12 h。
1.3.1.2 种子培养
将平板活化后的重组大肠杆菌挑取单菌落,接种于LBA培养基中,37 ℃、200 r/min过夜培养。
1.3.1.3 蛋白表达
将种子液以5%(体积分数)的接种量接种于发酵培养基中,37 ℃、200 r/min培养至OD600=0.6~0.8时加入异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactopyranoside,IPTG)诱导重组大肠杆菌合成目的蛋白,30 ℃、200 r/min培养8 h后结束发酵。
1.3.2 实验方法
1.3.2.1 培养基优化
(1)通过单因素试验进行碳源选择及添加量优化:以初始发酵培养基为对照,在初始发酵培养基的基础上,使用不同碳源(葡萄糖、果糖、乳糖、蔗糖、甘油)替换初始发酵培养基中的碳源,确定最佳碳源。在最佳碳源种类的基础上,进行碳源添加量(5、10、15、20、25、30、35 g/L)的优化。
(2)通过单因素试验进行氮源选择及添加量优化:以初始发酵培养基为对照,使用不同氮源及不同配比(酵母浸粉、胰蛋白胨、牛肉膏、大豆蛋白胨、酵母浸粉+胰蛋白胨、酵母浸粉+牛肉膏、酵母浸粉+大豆蛋白胨)替换初始发酵培养基中的氮源。在最佳氮源种类的基础上进行氮源添加量(5、10、15、20、25、30 g/L)的优化。
(3)通过单因素试验进行金属离子选择及添加量优化:以初始发酵培养基为基础,考察不同金属离子(Fe2+、Cu2+、Co2+、Mn2+、Zn2+)对发酵酶活性的影响。在最佳金属离子种类的基础上进行金属离子添加量(0.01、0.025、0.05、0.075、0.1 mmol/L)的优化。
1.3.2.2 摇瓶水平发酵条件优化
(1)接种量:利用优化后的发酵培养基,分别按1%、3%、5%、7%、10%(体积分数)的种子液接入发酵培养基,37 ℃、200 r/min培养至OD600=0.6~0.8时加入IPTG诱导大肠杆菌合成目的蛋白,30 ℃、200 r/min培养8 h后结束发酵。
(2)装液量:利用优化后的发酵培养基,在250 mL锥形瓶培养大肠杆菌,将种子液以5%接入量接到发酵培养基中,装液量分别为10%、20%、30%、40%、50%(体积分数),培养及诱导条件同上。
(3)发酵时间:利用优化后的发酵培养基,将种子液以5%的接种量进行接种,培养条件同上,30 ℃、200 r/min分别培养8、10、12、14、16 h。
(4)IPTG添加量:将种子液以5%的接种量进行接种,当OD600在0.6~0.8时加入IPTG进行诱导,IPTG添加量分别为0.1、0.2、0.4、0.7、1 mmol/L,培养及诱导条件同上。发酵结束收集菌体,离心并用PBS缓冲液洗涤2次,将定容后的菌液进行果糖催化反应。
1.3.2.3 5 L发酵罐放大验证
利用5 L发酵罐进行发酵,装液量为3 L,pH控制为7,溶氧控制为30%,在诱导发酵过程中,每隔2 h取样一次,收集菌体,离心,用PBS缓冲液进行洗涤2次,将定容后的菌液进行果糖催化反应。
1.3.2.4 不同细胞添加量对酶促反应的影响
在催化体系中分别加入不同量的细胞,分别为0.014、0.007、0.002 8、0.001 4 g DCW/L,反应20 min、40 min、1 h、2 h、4 h、8 h、12 h,取样测定。
1.3.3 指标检测方法
菌体测量方法:发酵过程中取样测定,稀释一定倍数之后,在波长600 nm测定吸光度值。
酶活性测定:将发酵液进行离心(6 000 r/min,10 min,4 ℃),收集菌体,用PBS缓冲液(pH=7,50 mmol/L)洗涤2次。将收集的菌体利用PBS缓冲液重悬并定容后进行酶促反应。
酶促反应体系:果糖终质量浓度500 g/L,加入PBS(pH=7)缓冲液并加水稀释至体系终浓度为50 mmol/L。50 ℃预热反应体系,将适量的细胞加入到预热后的酶促反应体系中,50 ℃反应20 min,沸水浴10 min终止反应。反应液低温离心(4 ℃,10 000 r/min,10 min)后取上清液,稀释20倍后进行HPLC检测。
高效液相色谱测定条件:柱温温度80 ℃,流动相为超纯水,流速0.6 mL/min;检测器为示差折光检测器。
1.3.4 酶活性的定义
酶活性定义:在50 ℃反应条件下,1 min内酶催化D-果糖产生1 μmol的D-阿洛酮糖所需要的酶量定义为1个酶活单位。
1.4 数据处理与统计分析
所有实验均重复进行3次,数据以平均值±标准偏差(standard deviation,SD)表示。使用SPSS中Duncan方法,对数据进行方差分析和多重测试分析。在P<0.05时表示处理的结果存在差异性显著。
2 结果与分析
2.1 发酵培养基优化单因素试验
2.1.1 碳源种类及添加量对酶活性和菌体量的影响
在初始培养基的基础上,利用不同碳源(果糖、乳糖、蔗糖、甘油)替换初始发酵培养基中的葡萄糖,确定最佳碳源,结果如图1-a所示。当碳源为蔗糖时,D-阿洛酮糖-3-差向异构酶的比酶活最高,为9.81 U/mL,是对照组的2.22倍;其次为甘油、乳糖和果糖。不同碳源不仅导致单位体积酶活的差异,同时也对菌体量有影响,在以甘油为唯一碳源时,菌体密度最高,OD600为5.69。当使用蔗糖作为碳源时,OD值增加了27.35%,但单位体积酶活性增加了112.4%,说明蔗糖为碳源有利于重组大肠杆菌对重组蛋白的合成。
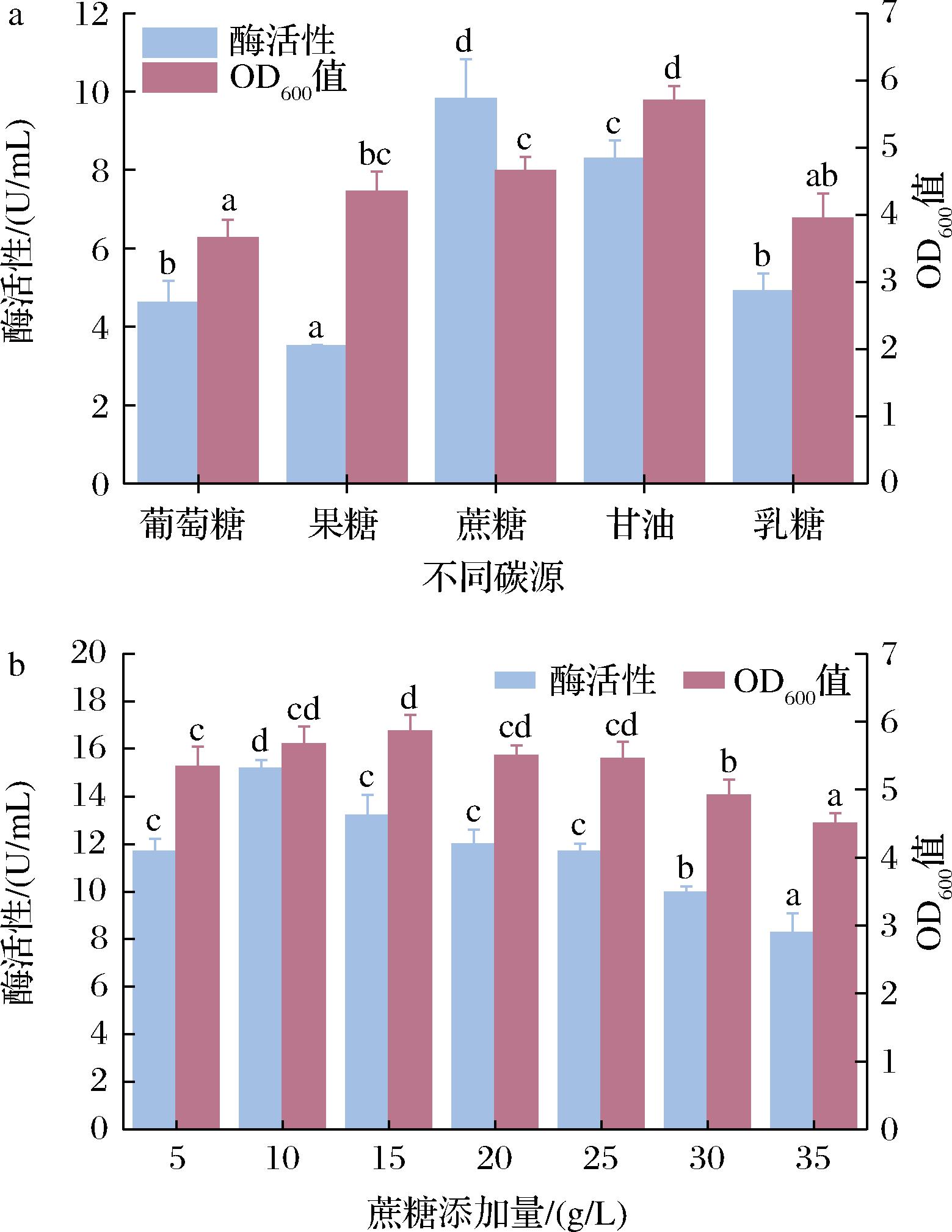
a-不同碳源;b-蔗糖添加量
图1 不同碳源的添加以及蔗糖添加量对酶活性及OD600的影响
Fig.1 Effect of different carbon source additions and sucrose additions on enzyme activity and OD600
注:不同字母表示不同条件之间的显著性差异(P<0.05)(下同)。
以蔗糖作为碳源,进行添加量(5、10、15、20、25、30、35 g/L)的优化,对菌体OD值和酶活性的影响如图1-b所示。随着蔗糖添加量的增加,DAE的酶活性呈现先增加后减少的趋势。当蔗糖添加量为10 g/L时,单位体积的酶活性最高,为15.16 U/mL。蔗糖添加量过高不仅会导致DAE的酶活降低,也导致菌体量降低。说明过高浓度的蔗糖对微生物的生长有一定的抑制作用[12]。因此,确定最优蔗糖添加量为10 g/L。
2.1.2 氮源种类及添加量对酶活性和菌体量的影响
以初始发酵培养基为对照,使用不同氮源(酵母浸粉、胰蛋白胨、牛肉膏、大豆蛋白胨、酵母浸粉+牛肉膏、酵母浸粉+大豆蛋白胨)替换初始发酵培养基中的酵母浸粉+胰蛋白胨,对菌株生长以及酶活性的影响如图2-a所示。不同氮源对单位体积的酶活性有较大影响,当氮源为大豆蛋白胨时,DAE的酶活性最高,为11.16 U/mL,比对照组提高47.71%,且显著高于其他氮源。当胰蛋白胨为唯一氮源时,OD600值最高,达到4.43,但酶活性却仅为大豆蛋白胨为碳源时的51.05%,因此,确定最优氮源为大豆蛋白胨。对大豆蛋白胨进行氮源添加量(5、10、15、20、25、30 g/L)的优化,结果如图2-b所示。大豆蛋白胨添加量对单位体积的酶活性影响显著,随着大豆蛋白胨添加量的升高,单位体积酶活性呈现先增加后减少的趋势,当大豆蛋白胨添加量为15 g/L时,单位体积酶活性最高,为11.59 U/mL。因此,确定大豆蛋白胨最优添加量为15 g/L。
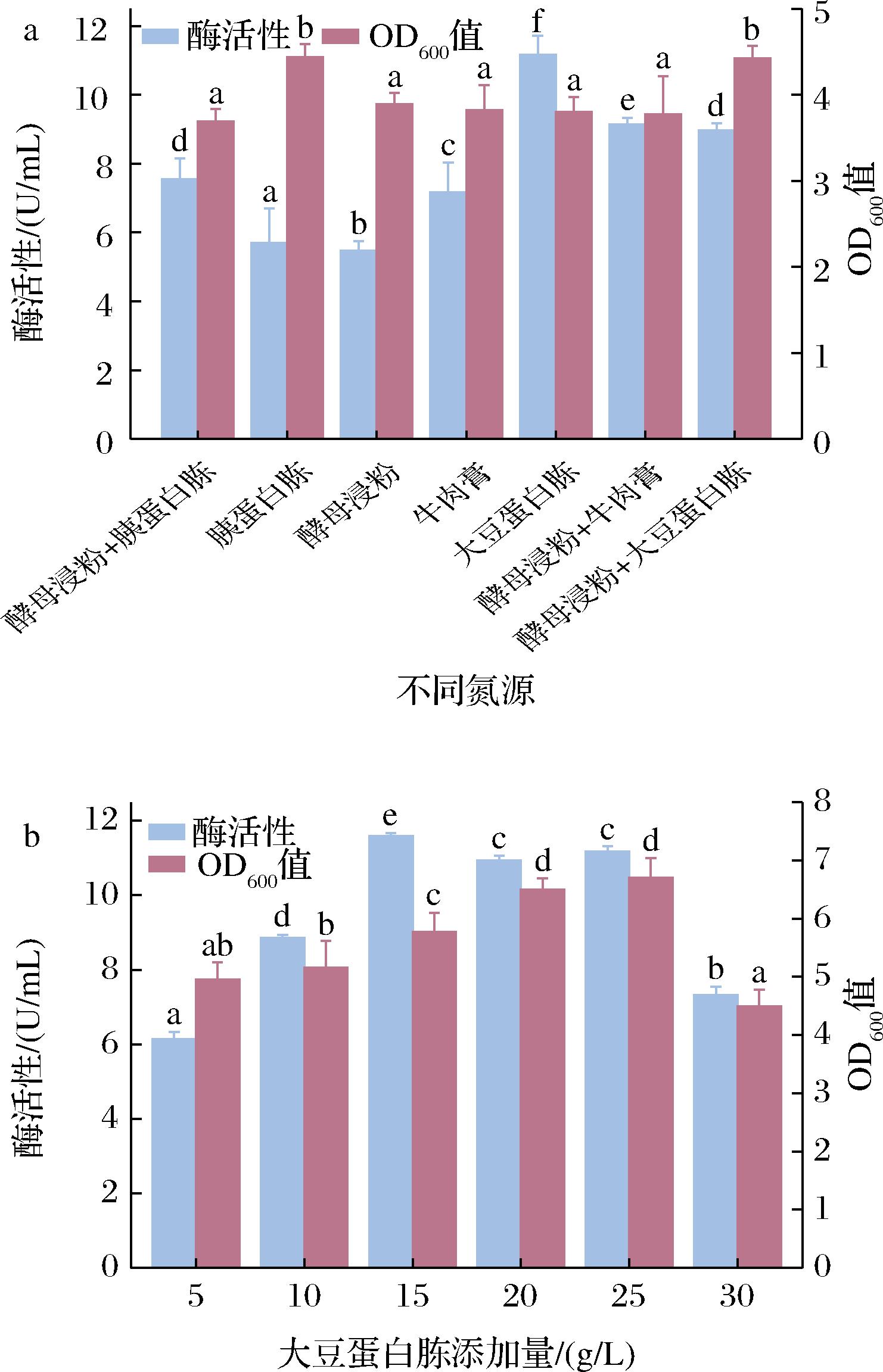
a-不同氮源;b-大豆蛋白胨添加量
图2 不同氮源的添加以及大豆蛋白胨添加量对酶活性及OD600的影响
Fig.2 Effect of different nitrogen sources and soy peptone additions on enzyme activity and OD600
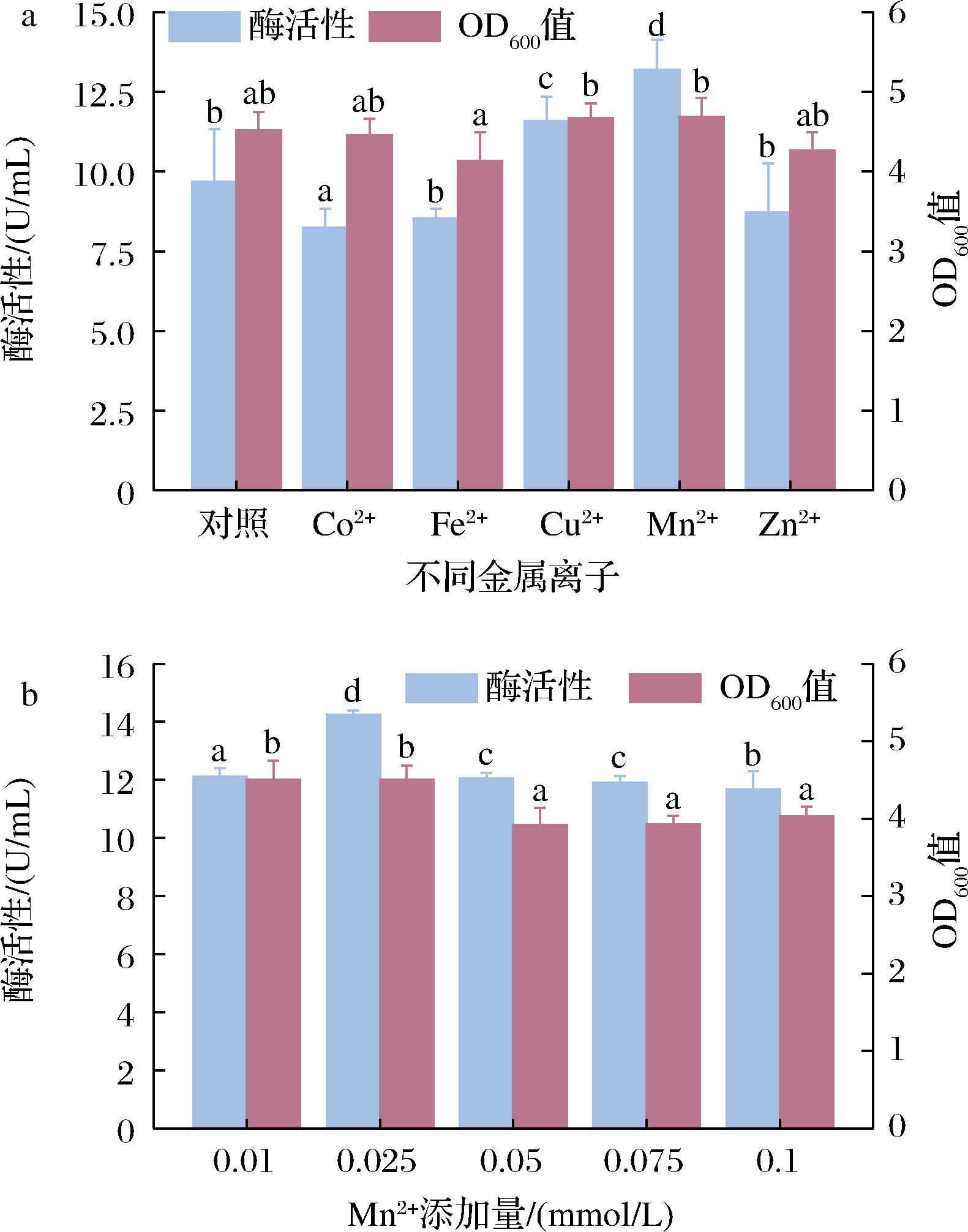
a-不同金属离子;b-Mn2+添加量
图3 不同金属离子的添加以及Mn2+添加量对
酶活性及OD600的影响
Fig.3 Effect of different metal ion addition and Mn2+ addition on enzyme activity and OD600
2.1.3 金属离子种类及添加量对酶活性和菌体量的影响
蛋白质的多肽链通常与金属离子配位,具有官能团的侧链可以作为金属的附加结合位点,包括组氨酸的咪唑基团、天冬氨酸和谷氨酸的羧基、酪氨酸的酚环以及赖氨酸和精氨酸侧链的氮[13]。氢键、静电和疏水键以及范德华相互作用对金属-蛋白质相互作用具有重要意义,对蛋白质结构的稳定有相当大的影响。影响金属与蛋白质结合的因素包括金属性质,例如价态、离子半径、电荷接受能力和各自生物区室中的游离金属浓度[14]。以初始发酵培养基为基础,考察不同金属离子(Fe2+、Cu2+、Co2+、Mn2+、Zn2+)对DAE酶活性和菌体生长的的影响,结果如图3-a所示。不同金属离子对单位体积酶活性有较大影响,当金属离子为锰离子时,酶活性最高,为13.19 U/mL,相比于对照组提高36.39%。添加不同离子对酶活性有很大影响,但对OD600值却影响不大,说明金属离子对菌体的生长影响不显著。在此基础上,研究了不同的Mn2+添加量(0.01、0.025、0.05、0.075、0.1 mmol/L)对菌体生长和酶活性的影响,结果如图3-b所示。随着Mn2+添加量的升高,单位体积酶活性呈现先增加后减少的趋势。当锰离子添加量为0.025 mmol/L时,单位酶活性可高达14.25 U/mL。不同金属离子浓度对OD600值的影响不大。
2.2 单因素发酵条件优化
2.2.1 接种量对DAE酶活性和菌体量的影响
除培养基外,接种量对微生物的发酵也有较大影响。提高接种量,可以促进微生物的生长,且有利于缩短菌体生长的延滞期;而接种量过大,代谢会向生物量转变,减少酶的合成[15]。因此,合适的接种量对于发酵生产有着重要的意义。分别按1%、3%、5%、7%、10%(体积分数)的接种量研究其对微生物生长及酶活性的影响,结果如图4所示。随着接种量的增大,单位体积酶活性呈现先升高后降低的趋势。当接种量为3%时,单位体积酶活性最高,为14.94 U/mL。虽然不同接种量对酶活性有较大影响,但对于发酵菌体的最终密度影响并不大。因此,确定了最佳接种量为3%。
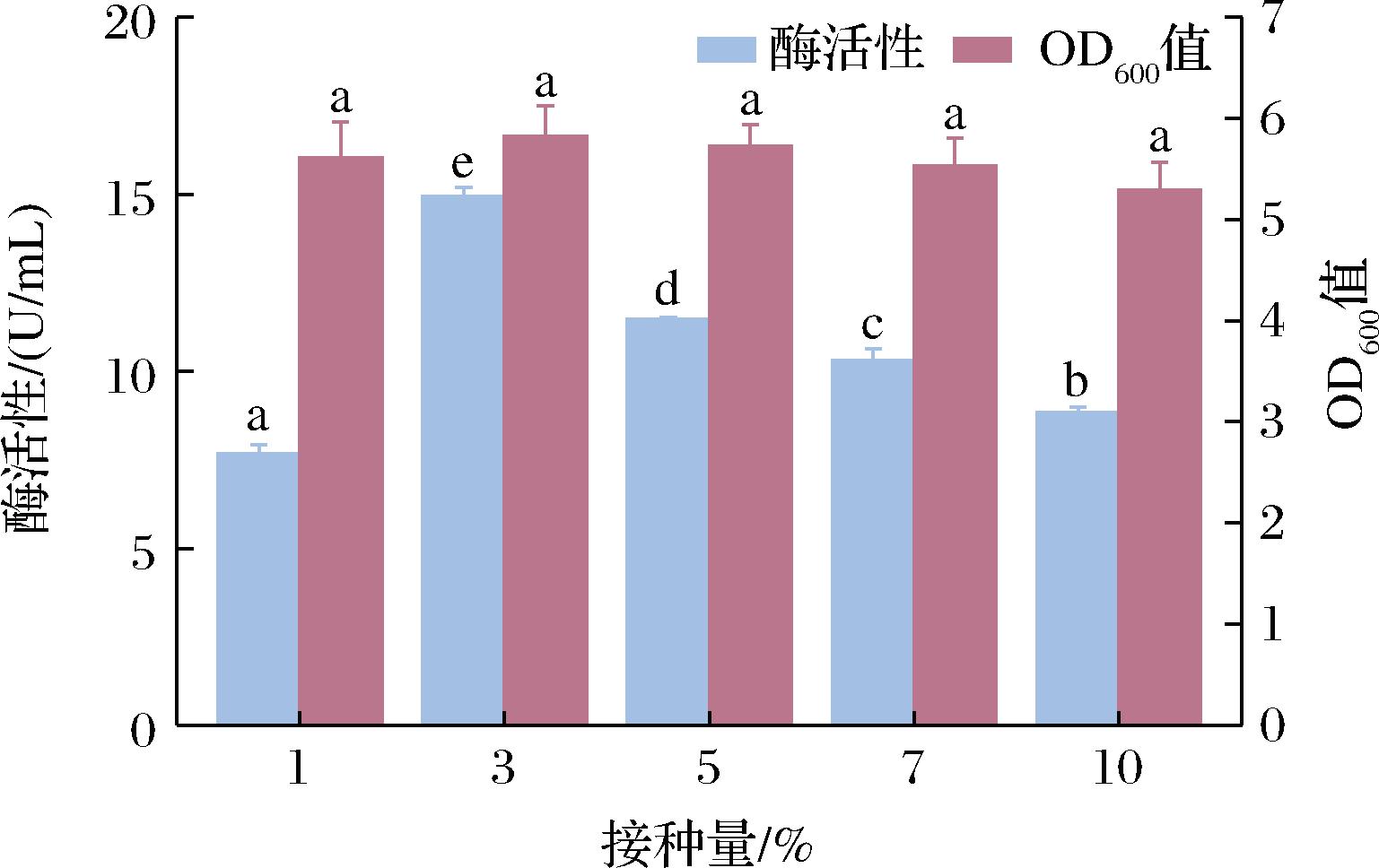
图4 接种量对酶活性及OD600的影响
Fig.4 Effect of inoculum amount on enzyme activity and OD600
2.2.2 培养基装液量对DAE酶活性及菌体量的影响
由于大肠杆菌是一种兼性厌氧菌,发酵液中的溶氧量对大肠杆菌的生长起着重要作用,菌体生长快慢对重组蛋白的合成同样产生影响。在摇瓶培养中,溶氧量的多少直接受到摇瓶装液量的影响。因此,摇瓶内适量的培养基有利于菌种的生长和重组蛋白的表达。分别按10%、20%、30%、40%、50%的装液量研究其对菌体生长与酶活性的影响,结果如图5所示。随着装液量的增加,单位体积酶活性呈现先增加后减少的趋势。当接种量为30%时,单位体积酶活性最高,为13.41 U/mL。不同装液量对单位体积酶活性影响较大,但对菌体影响较小。因此,确定了最佳装液量为30%。
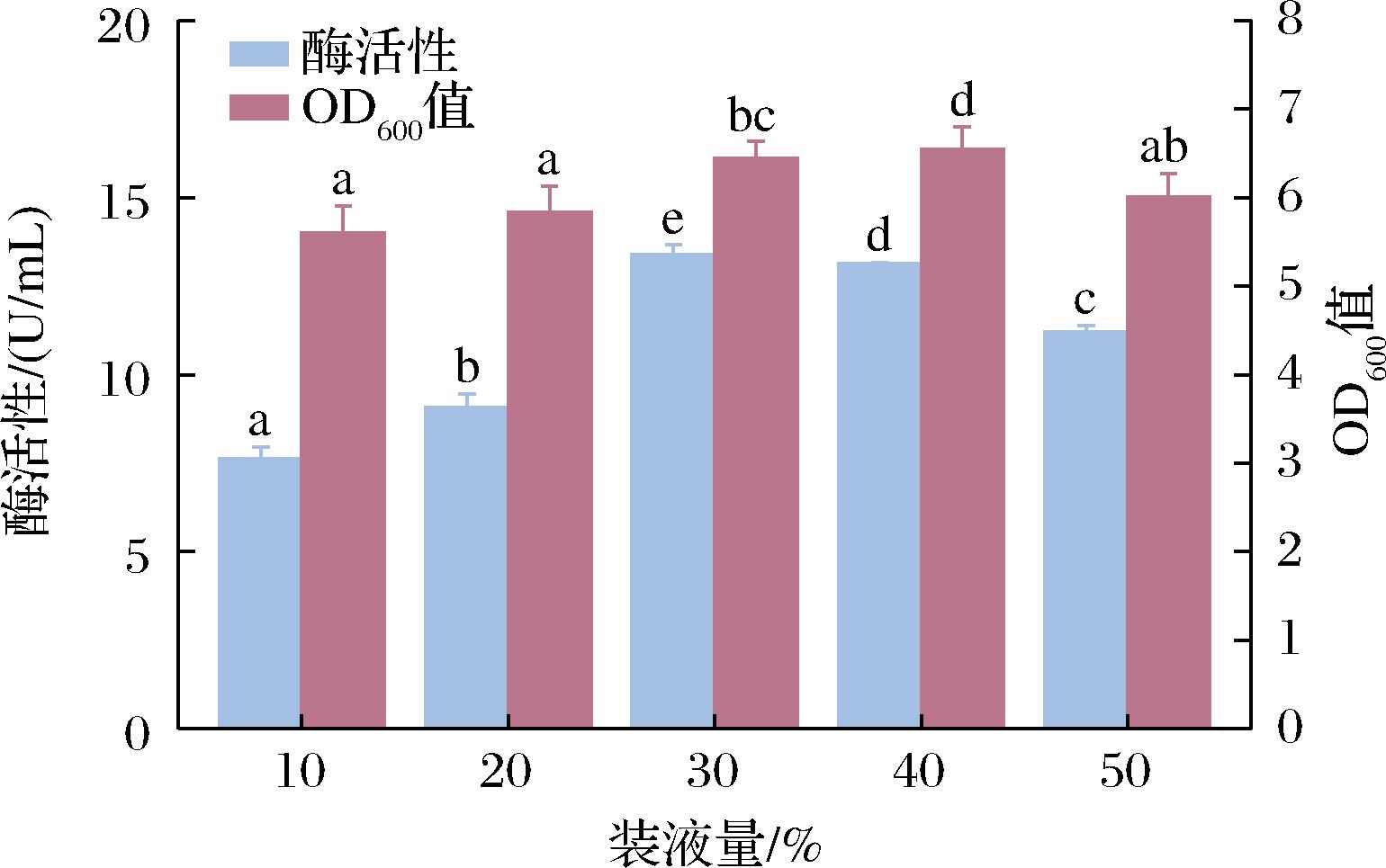
图5 装液量对酶活性及OD600的影响
Fig.5 Effect of loading volume on enzyme activity and OD600
2.2.3 诱导时间对DAE酶活性和菌体量的影响
诱导时间与蛋白产量和酶活性密切相关,受到氮源、碳源等能源物质的限制和已表达蛋白的抑制作用的影响,重组蛋白产量不会一直持续增长。分别诱导8、10、12、14、16 h,研究不同诱导时间对菌体密度和单位体积酶活性的影响,结果如图6所示。随着发酵时间的延长,单位体积酶活性呈现先升高后降低的趋势。当发酵10 h时,单位体积的酶活性最高,为20.23 U/mL。当诱导时间达到或超过12 h时,菌株OD持续增加,但酶活性显著降低。因此,最佳诱导时间为10 h。
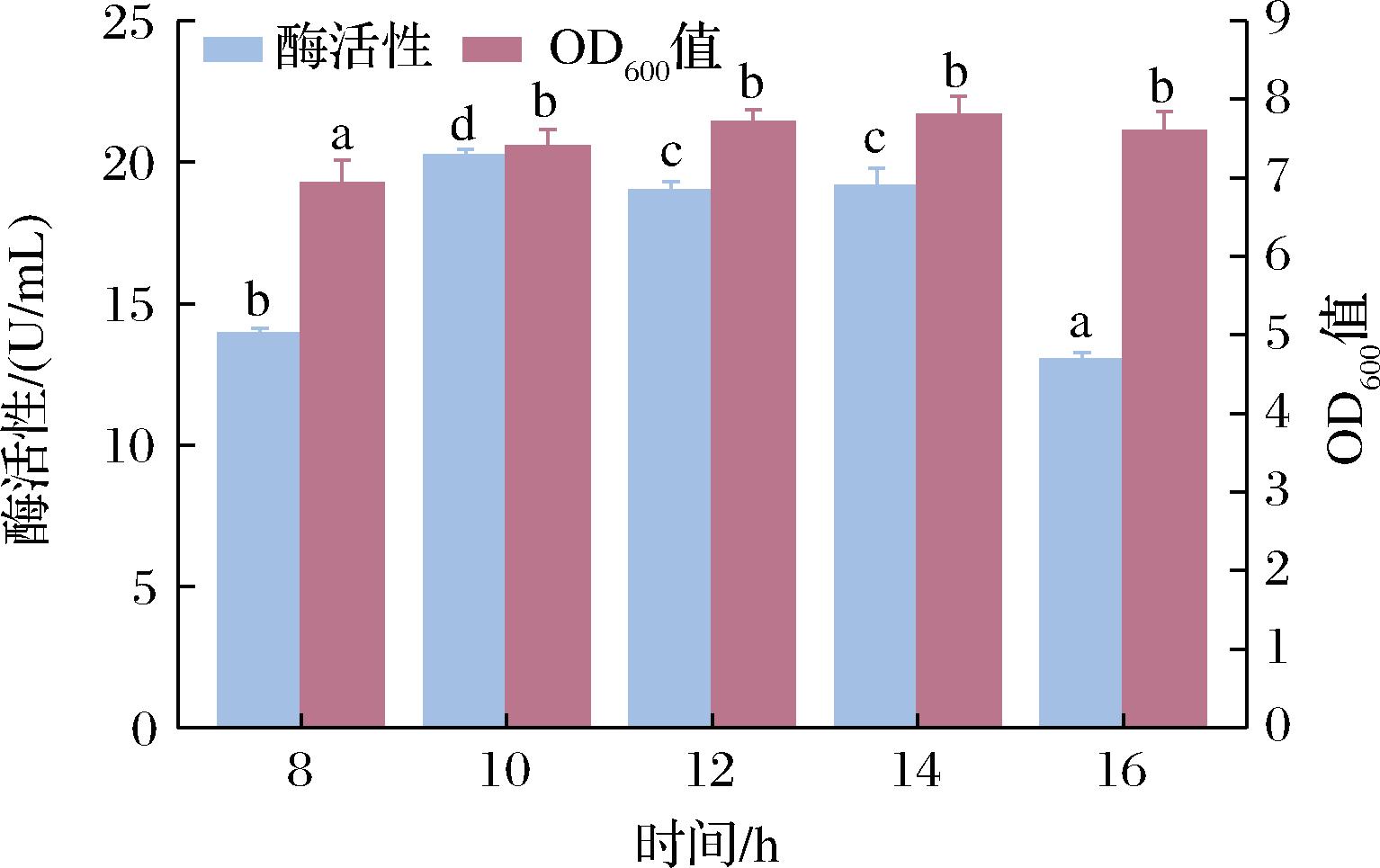
图6 诱导时间对酶活性及OD600的影响
Fig.6 Effect of induction time on enzyme activity and OD600
2.2.4 诱导剂添加量对DAE酶活性和菌体量的影响
本研究中使用的是重组大肠杆菌,其DAE启动子为诱导型启动子,只有加入诱导剂(IPTG)才会开始表达蛋白。诱导剂浓度是影响诱导型启动子表达重组蛋白的重要因素,浓度过低可能导致诱导剂的量不足以与阻遏蛋白结合,从而降低表达水平;当诱导剂的浓度太高又可能会使菌体的生长受限,重组蛋白的表达太快会产生包涵体[16]。本研究中以不同的诱导剂浓度(0.1、0.2、0.4、0.7、1 mmol/L)诱导蛋白表达,结果如图7所示。随着诱导剂浓度的升高,单位体积酶活性不断增大。当诱导剂添加量为1 mmol/L时,单位体积酶活性最高,为14.22 U/mL,是诱导剂添加量0.1 mmol/L时单位体积酶活性的1.85倍。随着IPTG浓度的增加,菌体密度逐渐降低,说明高浓度IPTG对菌株的生长不利。考虑到IPTG对酶活性的影响及经济问题,确定最佳诱导剂添加量为1 mmol/L。
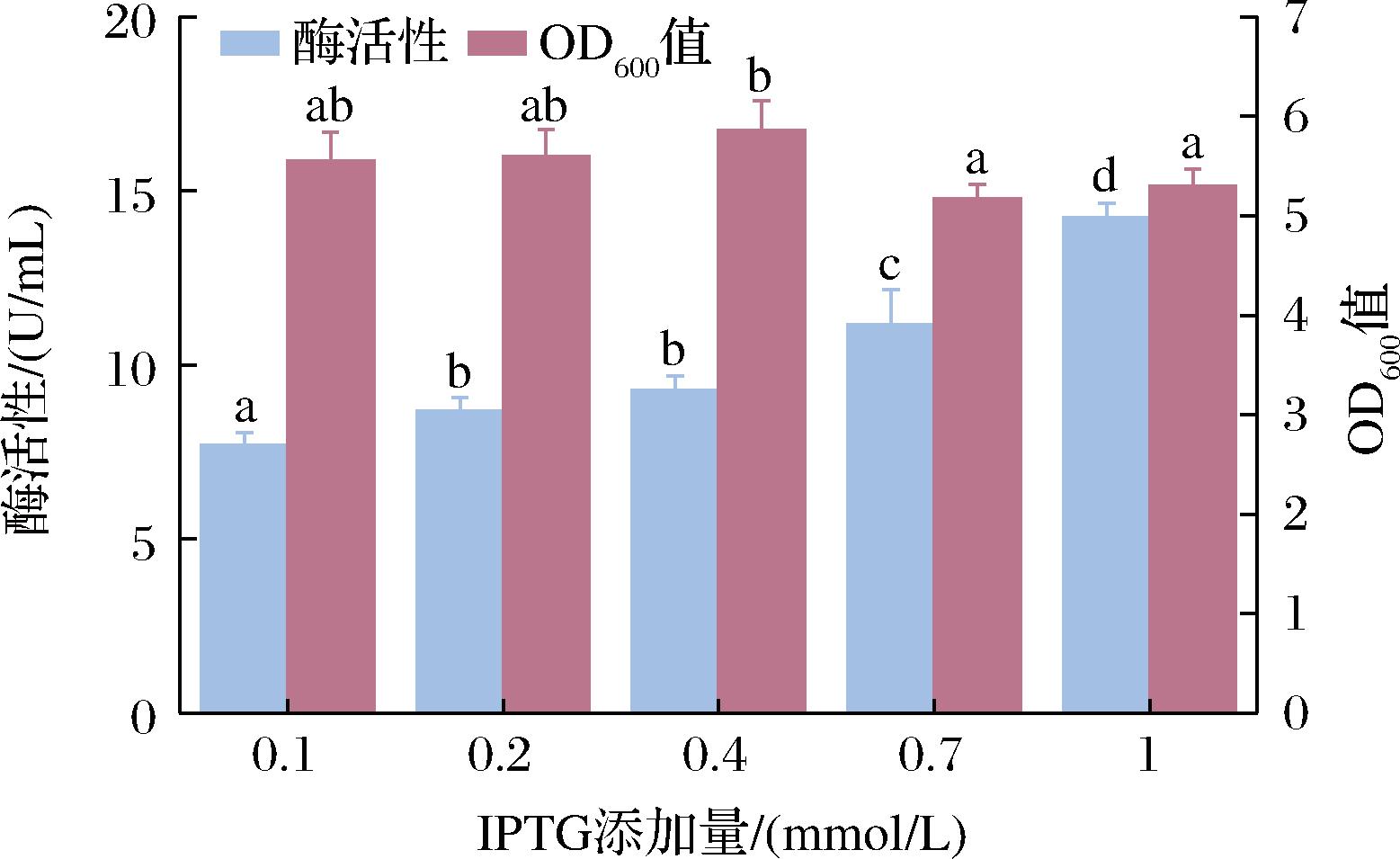
图7 IPTG添加量对酶活性及OD600的影响
Fig.7 Effect of IPTG addition on enzyme activity and OD600
2.3 培养基及培养条件优化前后对酶活性和菌体量的对比
采用单因素对培养基及培养条件进行优化,重组大肠杆菌的菌体密度和单位体积酶活性变化如图8所示。优化后,重组大肠杆菌单位体积酶活性有了大幅提升,达到优化前的2.57倍;菌体密度也有所提高,达到优化前的1.46倍,说明培养基以及培养条件优化在提高菌体密度的同时,大幅度提高了目的蛋白的活性表达。
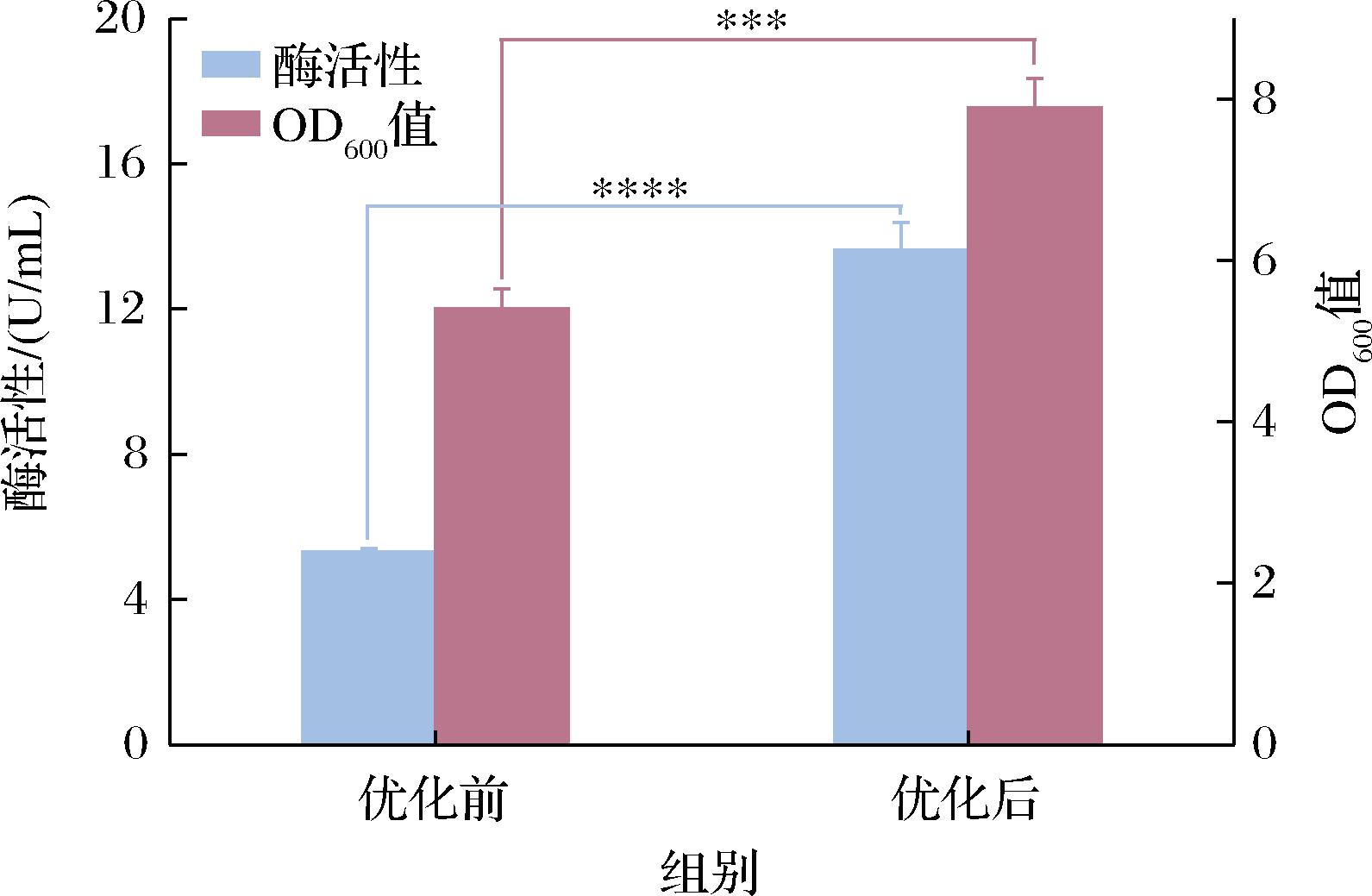
图8 优化前后酶活性及OD600的对比
Fig.8 Effect on enzyme activity and OD600 before and after optimization
注:*表示显著性差异(***P<0.001;****P<0.000 1)。
2.4 发酵罐高密度发酵研究
相比于摇瓶培养,发酵罐培养不但能够更好地控制发酵条件,从而有利于微生物的生长和目的蛋白的稳定表达,而且发酵罐也更接近实际生产条件,具有现实意义。
本研究在前期培养基和培养条件优化的基础上,利用5 L发酵罐研究重组大肠杆菌的生长和目的蛋白表达特性,在诱导10 h后开始进行补充葡萄糖溶液,参考李澜潇等[17]补料方式,结果如图9-a所示。随着培养时间的延长,重组大肠杆菌菌体密度逐渐增加并逐渐趋于平衡,OD600最高可达51.8,菌体干重最高可达21.5 g/L;单位体积酶活性呈现先升高后降低的趋势,当诱导时间为18 h时,单位体积酶活性最高为103.8 U/mL。
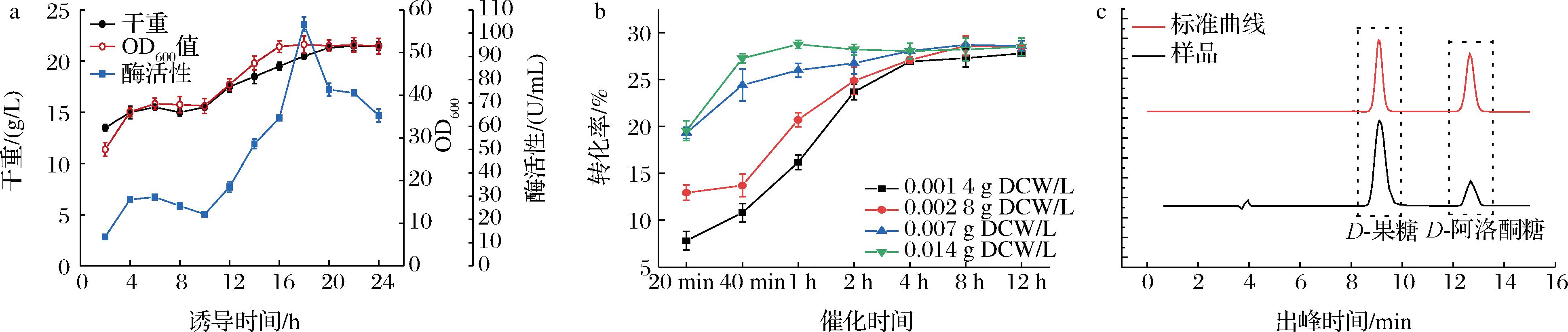
a-不同诱导时间对大肠杆菌的干重、OD600及酶活性的影响;b-不同细胞添加量、不同催化时间对转化率的影响;c-产物液相检测图
图9 诱导时间对大肠杆菌的干重、OD600、酶活性不同影响以及不同细胞添加量对转化率的影响
Fig.9 Different effects of induction time on dry weight, OD600 and enzyme activity of Escherichia coli and the effect of different cell addition on transformation rate
取不同诱导时间的重组大肠杆菌细胞进行D-果糖到D-阿洛酮糖的全细胞转化反应,当诱导时间为18 h时,D-阿洛酮糖产量最高,达到90.47 g/L;转化率达到18.26%。考虑到不同细胞添加量对催化速率的影响,在反应体系中加入不同细胞量在不同反应时间取样测定,结果如图9-b所示。细胞添加量越多,在初始反应时催化速度越快,当细胞添加量为0.014 g DCW/L时,催化1 h即可达到最大反应平衡点28.76%,D-阿洛酮糖产量可达149.74 g/L。
3 结论与讨论
在重组大肠杆菌发酵D-阿洛酮糖3-差向异构酶的研究中,获得高水平的单位体积酶活性是实际生产中的本质要求,这与菌株的生长代谢关系密切。本实验通过优化培养基与发酵条件,确定了重组大肠杆菌在发酵过程中的最适碳氮源以及金属离子浓度,也确定了培养基的成分以及最佳培养条件。其中,最佳培养基的组成为:蔗糖10 g/L、大豆蛋白胨15 g/L、(NH4)2SO4 3 g/L、KH2PO4 3 g/L、MgSO4 0.5 g/L、MnSO4 0.025 mmol/L。通过发酵条件的单因素优化研究确定了大肠杆菌在发酵过程中的最佳诱导时间为10 h,接种量为3%,摇瓶装液量为30%,IPTG添加浓度为1 mmol/L。通过本研究的优化,摇瓶单位体积酶活性达到优化前的2.57倍,菌体密度达到优化前的1.46倍。
周雪[15]在优化培养基以及培养条件后,以36 g/L果糖为底物,反应5 h生成D-阿洛酮糖为12.07 g/L。胡梦莹[18]在45% D-果糖为底物,55 ℃,反应30 min时DAE的转化率为12.5%左右。本实验在优化培养基以及培养条件后,以500 g/L的D-果糖为底物,pH为7,50 ℃反应20 min转化率为20.43%,D-阿洛酮糖生成量为102.33 g/L。在不同细胞添加量时,当细胞添加量为0.014 g DCW/L时反应1 h最高转化率为28.76%,D-阿洛酮糖最高生成量可为149.74 g/L。最后,利用5 L发酵罐进行放大实验,菌体密度(OD600)最高可达51.8,菌体干重最高可达21.5 g/L;诱导18 h时单位体积酶活性最高,可达103.8 U/mL。CHEN等[19]在7.5 L发酵罐中补料培养枯草芽孢杆菌产DAE,需要84 h获得酶活性为95 U/mL。FU等[20]利用枯草芽孢杆菌在7.5 L发酵罐中发酵72 h酶活性为74 U/mL。因此,本研究对于D-阿洛酮糖3-差向异构酶的发酵生产具有重要的参考价值。
[1] PATEL S N, SHARMA M, LATA K, et al.Improved operational stability of d-psicose 3-epimerase by a novel protein engineering strategy, and d-psicose production from fruit and vegetable residues[J].Bioresource Technology, 2016, 216:121-127.
[2] CHEN J C, HE P, BAI H M, et al.Poly(β-cyclodextrin)/carbon quantum dots modified glassy carbon electrode:Preparation, characterization and simultaneous electrochemical determination of dopamine, uric acid and tryptophan[J].Sensors &Actuators B:Chemical, 2017, 252:9-16.
[3] SHINTANI T, YAMADA T, HAYASHI N, et al.Rare sugar syrup containing d-allulose but not high-fructose cornsyrup maintains glucose tolerance and insulin sensitivity partly via hepatic glucokinase translocation in wistar rats[J].Journal of Agricultural and Food Chemistry, 2017, 65(13):2888-2894.
[4] NAGATA Y, KANASAKI A, TAMARU S, et al.D-psicose, an epimer of D-fructose, favorably alters lipid metabolism in sprague-dawley rats[J].Journal of Agricultural and Food Chemistry, 2015, 63(12):3168-3176.
[5] HOSSAIN A, YAMAGUCHI F, MATSUO T, et al.Rare sugar d-allulose:Potential role and therapeutic monitoring in maintaining obesity and type 2 diabetes mellitus[J].Pharmacology &Therapeutics, 2015, 155:49-59.
[6] RAN G Q, TAN D, ZHAO J P, et al.Functionalized polyhydroxyalkanoate nano-beads as a stable biocatalyst for cost-effective production of the rare sugar d-allulose[J].Bioresource Technology, 2019, 289:121673.
[7] JIANG S W, XIAO W, ZHU X X, et al.Review on d-allulose:In vivo metabolism, catalytic mechanism, engineering strain construction, bio-production technology[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:26.
[8] TANG S W, CHO D J, XU H, et al.Second-harmonic generations in fishet metamaterials[C].2012 International Workshop on Metamaterials (Meta):IEEE, 2013:1-2.
[9] GU L, ZHANG J, LIU B H, et al.High-level extracellular production of d-psicose-3-epimerase with recombinant Escherichia coli by a two-stage glycerol feeding approach[J].Bioprocess and Biosystems Engineering, 2013, 36(11):1767-1777.
[10] 李秋凤, 陈静, 赵婧邑, 等.D-阿洛酮糖3-差向异构酶在大肠杆菌内的高效可溶性表达及发酵条件研究[J].食品工业科技, 2022, 43(22):136-143.
LI Q F, CHEN J, ZHAO J Y, et al.Efficient soluble expression and fermentation conditions of D-allulose 3-epimerase in Escherichia coli[J] Science and Technology of Food Industry, 2022, 43(22):136-143.
[11] SUN P J, LI C G, GONG Y, et al.Process study of ceramic membrane-coupled mixed-cell fermentation for the production of adenine[J].Frontiers in Bioengineering and Biotechnology, 2022, 10:969668.
[12] 温宇威. D-阿洛酮糖3-差向异构酶的异源表达及发酵优化[D].无锡:江南大学, 2016.
WEN Y W.Heterologous expression and fermentation optimization of D-psicose 3-epimerase[D].Wuxi:Jiangnan University, 2016.
[13] YAMAUCHI O, ODANI A, TAKANI M.Metal-Amino acid chemistry.Weak interactions and related functions of side chain groups[J].Journal of the Chemical Society,Dalton Transactions, 2002(18):3411-3421.
[14] DUDEV T, LIM C.Competition among metal ions for protein binding sites:Determinants of metal ion selectivity in proteins[J].Chemical Reviews, 2014, 114(1):538-556.
[15] 周雪. D-阿洛酮糖3-差向异构酶的外源表达、纯化及其发酵条件的优化[D].大连:大连工业大学, 2019.
ZHOU X.The Expression purification and its fermentation of D-psicose 3-epimerase[D].Dalian:Dalian Polytechnic University, 2019.
[16] 名晓东. 卤代烷脱卤酶的发酵工艺优化及固定化[D].无锡:江南大学, 2022.
MING X D.Fermentation process optimization and immobilization on haloalkane dehalogenase[D].Wuxi:Jiangnan University, 2022.
[17] 李澜潇, 王硕, 徐庆阳, 等.金属离子及生长因子对核黄素发酵影响的研究[J].食品与发酵工业, 2023, 49(10):177-184.
LI L X, WANG S, XU Q Y, et al.Effects of metal ions and growth factors on riboflavin fermentation[J].Food and Fermentation Industries, 2023, 49(10):177-184.
[18] 胡梦莹. D-阿洛酮糖3-差向异构酶在枯草芽孢杆菌中的表达[D].无锡:江南大学, 2022.
HU M Y.Expression of D-psicose 3-epimerase in Bacillus subtilis[D].Wuxi:Jiangnan University, 2022.
[19] CHEN J Q, ZHU Y M, FU G, et al.High-level intra- and extra-cellular production of d-psicose 3-epimerase via amodified xylose-inducible expression system in Bacillus subtilis[J].Journal of Industrial Microbiology and Biotechnology, 2016, 43(11):1577-1591.
[20] FU G, ZHANG S B, DONG H N, et al.Enhanced production of d-psicose 3-epimerase in Bacillus subtilis by regulation of segmented fermentation[J].Biotechnology and Applied Biochemistry, 2020, 67(5):812-818.